Method Article
Culture, Manipulation et Transplantation orthotopique d'organoïdes tumoraux de la vessie de souris
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Ce protocole fournit des étapes expérimentales détaillées pour établir une culture in vitro tridimensionnelle des organoïdes de tumeur de réservoir souple dérivés du cancer de réservoir souple cancérogène-induit. Des méthodes de culture comprenant le passage, le génie génétique, et la transplantation orthotopic des organoïdes de tumeur sont décrites.
Résumé
Le développement de modèles de tumeur avancés a longtemps été encouragé parce que les modèles actuels de cancer ont montré des limitations telles que l'absence de l'architecture tridimensionnelle (3D) de tumeur et la faible pertinence au cancer humain. Les chercheurs ont récemment développé un modèle de cancer in vitro 3D désigné sous le titre d'organoïdes tumoraux qui peuvent imiter les caractéristiques d'une tumeur indigène dans un plat de culture. Ici, des procédures expérimentales sont décrites en détail pour l'établissement des organoïdes de tumeur de réservoir souple d'une tumeur de réservoir murine cancérogène-induite, y compris la culture, le passage, et le maintien des organoïdes 3D de tumeur résultants in vitro. En outre, des protocoles pour manipuler les lignes organoïdes de tumeur de réservoir souple établies pour le génie génétique utilisant la transduction lentivirus-négociée sont décrits, y compris des conditions optimisées pour l'introduction efficace de nouveaux éléments génétiques dans la tumeur organoïdes. Enfin, la procédure pour la transplantation orthotopic des organoïdes de tumeur de réservoir souple dans la paroi de la vessie murine pour une analyse plus approfondie est prévue. Les méthodes décrites dans cet article peuvent faciliter l'établissement d'un modèle in vitro pour le cancer de la vessie pour le développement de meilleures options thérapeutiques.
Introduction
Le cancer de la vessie est le cancer des voies urinaires le plus répandu, avec environ 165 000 patients qui meurent chaque année1. Parmi les différents types de cancer de la vessie, le carcinome urothélial invasif musculaire présente un phénotype agressif, et son taux de survie à 5 ans est inférieur à 50%2. De nouvelles options thérapeutiques pour les tumeurs urothéliales invasives n'ont pas été élargies au cours des dernières décennies1.
Les lignées cellulaires cancéreuses ont été largement utilisées pour le dépistage des médicaments3. Bien que des résultats favorables aient été observés chez de nombreux candidats-médicaments dans les lignées de cellules cancéreuses, de mauvais résultats sont rapportés dans les essais cliniques4. Suite à l'adaptation accrue aux environnements de culture bidimensionnels (2D) in vitro, il est devenu de plus en plus difficile de récapituler les tumeurs indigènes dans les lignées cellulaires. Les modèles de cancer des animaux ou les xénogreffes tumorales dérivées du patient peuvent être utilisés pour remédier aux limitations observées dans les lignées de cellules cancéreuses de la vessie. Cependant, les modèles de cancer des animaux sont exigeants en temps et en ressources. Par conséquent, l'amélioration des modèles de maladies ont été à la demande pendant des années et un nouveau système de modèles, organoïdes, a été développé pour surmonter les lacunes des modèles existants5.
Un organoïde est une construction 3D multicellulaire qui peut récapituler in vitro les caractéristiques physiologiques de son organe in vivo correspondant. Les organoïdes normaux et tumoraux peuvent être dérivés de cellules souches pluripotentes ou adultes, et de cellules tumorales primaires, respectivement5,6. Au cours des dernières années, organoïdes tumoraux ont été établis à partir d'un grand nombre de tissus tumoraux divers7, y compris le côlon8,9, vessie10, pancréas11,12, prostate13, foie14, et le sein15 tissus tumoraux. De tels organoïdes de tumeur imitent leurs tumeurs originales phénotypiquement et génétiquement. En raison de leur similitude avec les tissus tumoraux in vivo et de leurs nombreuses applications pratiques, les chercheurs les ont adoptés comme nouveaux modèles de maladie dans l'étude de la pathogénie cancéreuse.
Ici, les procédures pour l'établissement des organoïdes de tumeur d'une tumeur invasive insoncérogène de carcinogen-induite16 sont disposées. N-butyl-N-(4-hydroxybutyl) nitrosamine (BBN) est utilisé comme cancérogène pour induire le carcinome urothélial invasif chez les souris17 et les organoïdes tumoraux, qui présentent les caractéristiques pathologiques des tumeurs de la vessie invasives musculaires de souris, sont établis à partir du cancer de la vessie murine induit par BBN16. La méthode de manipulation génétique des organoïdes tumoraux est illustrée à l'aide d'une transduction médiée par lentivirus pour développer un système modèle d'étude de la base moléculaire du développement du cancer de la vessie. En outre, une méthode pour transplanter des organoïdes orthotopiquement dans une vessie pour étudier le rôle de l'environnement indigène de réservoir souple dans le cancer de réservoir souple est décrite.
Protocole
Toutes les procédures ont été approuvées et menées selon les directives du Comité institutionnel de soins et d'utilisation des animaux de l'ACCE (numéro DE l'IACUC : POSTECH-2019-0055).
1. In Vitro Culture of Bladder Tumor Organoids
- Établir des organoïdes de tumeur de réservoir souple de la tumeur de réservoir murine (Figure 1Un).
REMARQUE : La procédure pour produire des tumeurs de réservoir souple de souris BBN-induites est décrite dans Shin et autres.17.- Fournir 0,1 % d'eau contenant du BBN dans une bouteille foncée à la souris ad libitum pendant 6 mois. Changer l'eau contenant du BBN 2 fois par semaine.
REMARQUE : Une souris mâle C57BL/6 avec un poids corporel d'environ 25 g à 8-10 semaines d'âge a été employée. L'eau contenant du BBN peut être administrée à jusqu'à cinq souris dans une seule cage. - Après 6 mois, euthanasiez la souris en utilisant l'inhalation de dioxyde de carbone et isolez la tumeur entière de réservoir souple. Transférer dans un plat Petri de 90 mm.
- Enlever les parties non cancéreuses et les régions nécrotiques à l'aide de ciseaux chirurgicaux stériles et laver les fragments de tumeur de la vessie 2 à 3 fois avec le froid 1x Dulbecco phosphate tamponné saline (DPBS). Recueillir les fragments et les transférer dans un nouveau plat Petri de 90 mm.
- Ajouter 1 mL de milieu essentiel minimum modifié (DMEM) de Dulbecco avec 10 mM 4-(2-hydroxyethyl)-1-piperazineethanesulfonic acide (HEPES).
- Émincer le tissu tumoral en morceaux aussi petits que possible (0,5 à 1 mm3) à l'aide d'une lame de rasoir stérilisée.
- Ajouter 9 ml de DMEM avec 10 mM HEPES, 250 'g/mL de collagène de type I, 250 'g/mL de collagène de type II, et 250 U/mL de thermolysine. Incuber le tissu tumoral haché pendant 1,5 à 2 h sur un shaker orbital dans un incubateur (37 oC, 5 % de CO2) pour dissocier les fragments dans la suspension cellulaire. Transférer la suspension cellulaire dans un tube de 50 ml.
REMARQUE: Si la taille de la tumeur récoltée à partir de la souris est supérieure à 1 cm3, le traiter avec 2x la quantité de thermolysine ou augmenter le temps d'incubation. - Centrifuger le tube à 400 x g pendant 5 min à 4 oC et aspirer le supernatant.
- Resuspendre la pastille à l'aide de 5 ml d'ammonium-chlorure-potassium (ACK) lysing tampon pour lyser les globules rouges. Incuber le tube pendant 3 à 5 minutes à température ambiante (RT) jusqu'à la lyse complète des globules rouges.
REMARQUE : Si les globules rouges ne sont pas observés, omettez le processus de lysing. - Ajouter 20 ml de DMEM dans le tube. Centrifuger le tube à 400 x g pendant 5 min à 4 oC et aspirer le supernatant.
- Resuspendre la pastille avec 1 ml de 0,25% Trypsin-EDTA et 10 'M Y-27632 dihydrochlorure (Y-27632) pour dissocier la pastille en cellules simples. Incuber le tube pendant 5 min dans un bain d'eau de 37 oC.
REMARQUE : Observez la tumeur sous un microscope pour confirmer la dissociation complète en cellules simples. Si des morceaux de cellules persistent, pipette la suspension plus loin. - Neutraliser la trypsine à l'aide de 10 mL de DMEM avec 10% de sérum bovin fœtal (FBS). Filtrer la suspension cellulaire à travers une passoire cellulaire de 100 m sur un nouveau tube de 50 ml pour enlever les débris non digérés.
- Centrifuger le tube à 400 x g pendant 5 min à 4 oC et aspirer le supernatant.
- Enrober un puits dans une plaque de 24 puits à l'aide de 150 l de facteur de croissance à froid réduit matrice membranaire du sous-sol (Tableau des matériaux) et placez la plaque de 24 puits dans un incubateur (37 oC, 5 % CO2) pendant 30 min pour solidifier la matrice membranaire du sous-sol.
REMARQUE : Décongeler et maintenir la matrice de membrane du sous-sol à 4 oC afin d'éviter la solidification avant utilisation. - Resuspendre la pastille à l'aide de 1 ml de DMEM et compter les cellules à l'aide d'un hémocytomètre. Transférer 3 x 4 x 104 cellules tumorales dans un microtube de 1,5 ml sur la glace.
- Centrifuger le microtube à 400 x g pendant 3 min à 4 oC et jeter soigneusement le supernatant.
- Resuspendre les cellules avec 500 l de milieu organoïde préchauffé (tableau 1) et 10 'M Y-27632 et les transférer dans le puits enduit. Placer la plaque de 24 puits dans un incubateur (37 oC, 5 % CO2).
- Les cellules supplémentaires de tumeur de réservoir souple peuvent être stockées avec 1 ml de DMEM contenant 10% FBS, 1% pénicilline/streptomycine, et 10% sulfoxide de diméthyle (DMSO) dans 1.5 mL cryovials. Placez-les dans un contenant de congélation cryoviale et transférez le contenant dans un congélateur de -80 oC. Après avoir été entreposés au congélateur pendant la nuit, transférer les cryovials dans de l'azote liquide pour le stockage à long terme.
- Changer le milieu tous les 2 jours à l'aide de 500 l de milieu organoïde préchauffé (Figure 1B).
- Fournir 0,1 % d'eau contenant du BBN dans une bouteille foncée à la souris ad libitum pendant 6 mois. Changer l'eau contenant du BBN 2 fois par semaine.
- Organoïdes de tumeur de réservoir souple de sous-culture.
REMARQUE : Il est recommandé de passer des organoïdes tumoraux de la vessie lorsqu'ils atteignent 100 à 150 m de diamètre.- Ajouter 500 l de collagène/dispase au milieu organoïde dans la plaque de 24 puits avec des organoïdes tumoraux. Pipette de haut en bas de la matrice de membrane de sous-sol et du milieu. Incuber pendant 20 min à 37 oC et récolter les cellules dans un tube de 15 ml.
REMARQUE : Examinez les organoïdes isolés de la matrice de membrane de sous-sol sous un microscope. Si les organoïdes ne sont pas détachés de la matrice membranaire du sous-sol, augmentez le temps d'incubation ou la pipette plus de fois. - Ajouter 5 ml de DMEM préchauffé, centriper le tube à 400 x g pendant 3 min à 4 oC, et aspirer le supernatant.
- Resuspendre la pastille à l'aide de 1 ml de trypsine-EDTA préchauffée de 0,25 % et de 10 M Y-27632. Incuber 5 min dans un bain d'eau de 37 oC. Vigoureusement pipette les cellules de haut en bas et de neutraliser la trypsine en utilisant 5 ml de DMEM avec 10% FBS.
- Centrifuger le tube à 400 x g pendant 3 min à 4 oC et aspirer le supernatant.
- Resuspendre la pastille à l'aide de 1 ml de milieu organoïde préchauffé et compter le nombre de cellules tumorales uniques.
- Répéter les étapes 1.1.14-1.1.18.
- Ajouter 500 l de collagène/dispase au milieu organoïde dans la plaque de 24 puits avec des organoïdes tumoraux. Pipette de haut en bas de la matrice de membrane de sous-sol et du milieu. Incuber pendant 20 min à 37 oC et récolter les cellules dans un tube de 15 ml.
2. Manipulation génétique des organoïdes tumoraux de la vessie à l'aide de la transduction médiée par lentivirus (Figure 2A)
- Produire les particules lentivirales exprimant le GFP.
- Le jour 0, plaque HEK 293T cellules à une densité de 5 à 6 x 106 cellules par plaque de culture cellulaire de 10 cm dans le milieu de culture de ligne cellulaire (c.-à-d., DMEM avec 10% FBS et 1% pénicilline/streptomycine).
- Le jour 1, préparez la solution de transfection de l'ADN, y compris le plasmide de transfert contenant du GFP (8 g), le plasmide d'emballage lentiviral (10 g de pCMVR 8,74 et 3 g de pMD2.G), et 1 ml de milieu sérique réduit(Tableau des matériaux).
- Ajouter 3 ll de réactif de transfection (Table des matériaux) par 1 g de plasmide total selon les instructions du fabricant et mélanger délicatement par pipetting. Incuber pendant 20 min à RT et ajouter 9 ml de DMEM avec 10% FBS.
- Aspirer le milieu de culture dans la plaque de culture cellulaire avec des HEK 293T cellules. Transférer soigneusement 10 ml de la solution de transfection de l'ADN sur les cellules HEK 293T et couver dans un incubateur de culture cellulaire à 37 oC.
- Le jour 3, observez les cellules sous un microscope à fluorescence (excitation à 488 nm et émission à 512 nm) pour déterminer l'efficacité de la transfection. Près de 90 % à 100 % des cellules de l'ensemble de la population cellulaire devraient exprimer le PFG.
- Recueillir le supernatant (contenant le virus) et filtrate le supernatant avec un filtre en polyéthersulfone (PES) de 0,45 m.
REMARQUE : Utilisez un filtre à faible liaison protéique comme un filtre PES. - Pour concentrer le virus, centrifuger le supernatant du virus à 98 768 x g dans un ultracentrifugeur pendant 2 h à 4 oC dans un rotor de seau oscillant(Table of Materials) et jeter soigneusement le supernatant.
- Resuspendre la pastille dans 2,5 ml de milieu organoïde froid.
- Pour le stockage à long terme, aliquot 250 'L de milieu lentiviral en flacons cryogéniques et les congeler à l'aide d'azote liquide. Conserver les stocks de virus congelés dans un congélateur de -80 oC.
- Effectuer la transduction lentivirus-négociée des organoïdes de tumeur de réservoir souple.
- Le jour 2, diviser les organoïdes de tumeur comme décrit ci-dessus (étape 1.2) 12 h avant la transduction lentivirus-négociée.
- Le jour 3, décongeler rapidement un aliquot (étape 2.1.9) contenant le virus dans un bain d'eau de 37 oC et ajouter les 250 oL de milieu organoïde avec 10 M Y-27632 et 8 'g/mL de bromure d'hexadimethrine.
- Remplacer le milieu organoïde dans la plaque de 24 puits par des organoïdes tumoraux par 500 l de milieu contenant le virus et incuber pendant 12 à 16 h dans un incubateur (37 oC, 5 % CO2).
- Le jour 4, changer le milieu avec 500 l de milieu organoïde frais.
REMARQUE: Après 12-16 h d'incubation, le milieu doit être changé, parce que le milieu contenant le lentivirus et le bromure d'hexadimethrine est cytotoxique. - Le jour 6, surveillez le signal GFP des organoïdes tumoraux 3 jours après la transduction sous un microscope à fluorescence (Figure 2B).
- Le jour 10, passage et stock des organoïdes 7 jours après la transduction comme décrit dans l'étape 1.2, pour maintenir les lignes organoïdes de tumeur génétiquement modifiées.
3. Transplantation orthotopique d'organoïde vésicaire (Figure 3A)
- Préparer les organoïdes tumoraux de la vessie pour la transplantation orthotopic.
- Avant la transplantation, la culture des organoïdes de tumeur de réservoir souple pendant 5-7 jours, comme décrit ci-dessus (étape 1.2).
- Ajouter 500 L de collagène/dispase au milieu organoïde dans une plaque de 24 puits avec les organoïdes tumoraux. Pipette de haut en bas de la matrice de membrane de sous-sol et du milieu. Incuber pendant 20 min à 37 oC et recueillir les cellules dans un tube de 15 ml.
- Ajouter 5 ml de DMEM préchauffé, centriper le tube à 400 x g pendant 3 min à 4 oC, et aspirer le supernatant.
- Resuspendre la pastille avec 1 ml de DMEM et transférer la solution dans un plat Petri de 90 mm.
- Au microscope, prenez les organoïdes tumoraux de 10 à 100 à l'aide d'une micropipette p200 et collectez-les dans un microtube sur glace.
- Centrifuger le tube à 400 x g pendant 3 min à 4 oC et jeter soigneusement le supernatant.
- Maintenir la pastille cellulaire sur la glace jusqu'à ce que les souris soient prêtes pour la chirurgie.
- Transplantation submucosal de paroi de réservoir souple
REMARQUE: Cette procédure est modifiée à partir du protocole publié par Fu et al18.- Préparer une souris nue mâle de 8 à 10 semaines (CAnN.Cg-Foxn1nu/Crl) au moins une semaine avant l'expérience pour lui permettre de s'acclimater à un nouvel environnement. Injecter de l'enrofloxacine (5 mg/kg) sous-cutanée24 h avant la chirurgie.
- Nettoyer la surface du banc par du savon et de l'eau. Autoclave les instruments chirurgicaux avant l'intervention chirurgicale et effectuer la chirurgie à l'aide d'instruments stériles.
- Gardez la seringue à insuline 29 G, les pointes de pipette et la matrice de membrane du sous-sol sur la glace. Administrer le kétoprofène (5 mg/kg) sous-cutané avant l'administration de l'anesthésie.
- Anesthésiez la souris avec 4% d'isoflurane dans une chambre d'induction. Une fois l'anesthésie générale réalisée, placez la souris dans une position de supine et maintenez l'anesthésie par l'inhalation de masque de 2% d'isoflurane vaporisé de 2%.
REMARQUE : Si le temps d'anesthésiation est de plus de 30 min, appliquez la pommade oculaire sur les deux yeux à l'aide d'un coton-tige pour éviter le séchage cornéen. - Appliquer le povidone-iode avec une gaze stérile et essuyez-la avec 70% d'éthanol. Répéter 3x avec une nouvelle gaze ou un coton-tige à chaque fois.
- Couvrez l'anus et le champ chirurgical à l'aide de rideaux chirurgicaux jetables et stériles.
- À l'aide d'un microscope disséquant pour le grossissement, faire une petite incision transversale (plus petite que 1,5 cm) dans la peau et la paroi musculaire de l'abdomen inférieur de la ligne médiane avec des ciseaux chirurgicaux stériles. Exposez la vessie de la cavité abdominale et soutenez-la avec des cotons-tiges imbibés de salin.
REMARQUE : Si la vessie est pleine d'urine, appuyez doucement sur la vessie pour la décompresser légèrement. - Resuspendre les granulés organoïdes (étape 3.1.7) dans 80 'L de milieu organoïde contenant 50% de matrice de membrane de sous-sol à haute concentration (Tableau des matériaux).
- Injecter la suspension organoïde dans l'aspect antérieur du dôme de la vessie à l'aide de la seringue d'insuline 29 G sous un microscope disséquant.
- Fermez la couche interne de la paroi abdominale avec une suture absorbable antibactérienne, puis fermez la couche externe avec 4-0 suture en nylon. Désinfecter le site chirurgical avec de la povidone-iode et 70% de l'éthanol.
- Permettre à la souris de récupérer sous un irradiateur infrarouge de 10 à 15 min. Surveillez la souris jusqu'à ce qu'elle retrouve conscience et motilité.
- Un jour après la chirurgie, vérifiez l'état général de la souris et la fuite anastomotique. Administrer le kétoprofène (5 mg/kg) une fois par jour pendant 3 jours après l'opération et traiter l'enrofloxacine (5 mg/kg) une fois par jour pendant 10 jours après l'opération.
- Lorsque le site d'incision a guéri (10-14 jours après la chirurgie), enlever les sutures. Surveiller la croissance de la tumeur de la vessie de la souris pendant 2 à 3 semaines après l'injection d'organoïdes tumoraux.
- Si la croissance de tumeur de réservoir souple est observée, euthanasiez la souris utilisant l'inhalation de dioxyde de carbone, et récoltez la tumeur entière de réservoir souple. Lavez-le à l'aide de DPBS à froid (Figure 3B)16.
- Pour analyser l'histologie de tumeur de réservoir souple, tachez la section paraffine-incorporée du tissu utilisant l'hématoxylin et l'éosine (H et E) coloration (figure 3B)16.
Résultats
Culture in vitro d'organoïdes tumoraux de la vessie de souris
Le nombre de cellules tumorales dissociées d'une tumeur induite par leBBN d'au moins 4 x 10 5 cellules est d'au moins 4 x 105 cellules. Lorsque les cellules sont initialement ensemencées dans la matrice membranaire du sous-sol, des cellules et des débris non cancéreux peuvent être observés. Les débris ont été progressivement dilués en continuant la sous-culture. La figure 1B montre des images des organoïdes cultivés à différents moments. Si les cellules tumorales ne forment pas d'organoïdes tumoraux, les cellules sont potentiellement mortes pendant l'étape de dissociation. Dans un tel cas, les procédures de dissociation, y compris le temps d'incubation avec l'enzyme doivent être ajustées pour augmenter la viabilité cellulaire.
Expression de GFP dans les organoïdes de tumeur de réservoir souple utilisant la manipulation génétique lentivirus-négociée
Les organoïdes de tumeur de réservoir souple ont exhibé les signaux forts de GFP avec l'infection lentiviral réussie (figure 2B). Après concentration, un total de 250 l de médias contenant des virus a été suffisant pour infecter 3 x 104 cellules tumorales uniques sur la matrice de membrane du sous-sol, maintenant 90% - 100% efficacité de l'infection. Les signaux de GFP pourraient être détectés des organoïdes de tumeur de réservoir souple 3 jours après transduction lentiviral. Si les signaux de fluorescence sont faibles, l'efficacité de l'infection virale est potentiellement faible. Cela peut être dû à de nombreux facteurs, tels que le faible titre viral, et les procédures doivent être ajustées en conséquence.
Transplantation orthotopic des organoïdes de tumeur de réservoir souple
Un allogreffe de tumeur de réservoir souple obtenu des organoïdes de tumeur de réservoir souple BBN-induits est présenté dans la figure 3B16. Des allogreffes de tumeur de réservoir souple ont été moissonnées 3 semaines après transplantation orthotopic. L'histologie de la tumeur transplantée de réservoir souple a été analysée utilisant la coloration de H et d'E. Les greffes orthotopiques des organoïdes de tumeur peuvent se développer comme tumeurs de réservoir souple pendant 2-3 semaines.

Figure 1 : Culture in vitro d'organoïdes tumoraux de la vessie de souris. (A) Diagramme schématique pour l'établissement des organoïdes de tumeur de réservoir de souris. (B) Images représentatives pour la culture des organoïdes tumoraux de la vessie à différents moments. Des organoïdes de tumeur de réservoir de souris ont été établis et cultivés sur 9 jours. Barre d'échelle de 100 m. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
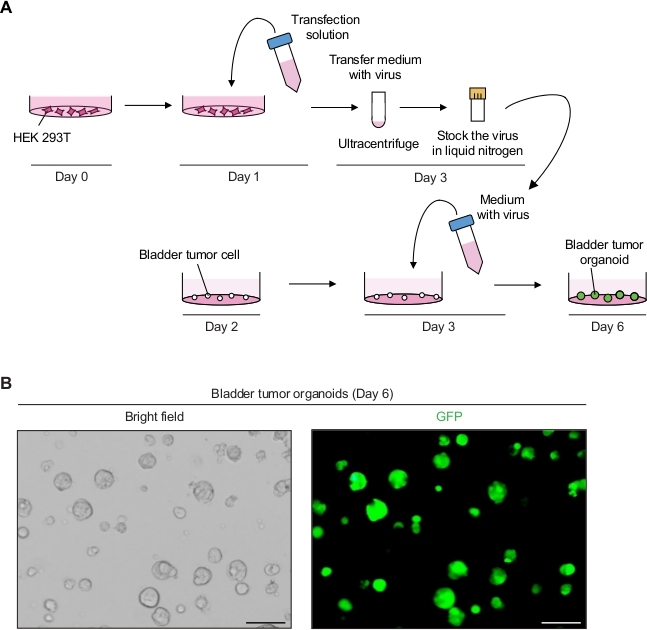
Figure 2 : Expression du GFP dans les organoïdes de tumeur de réservoir souple utilisant la manipulation génétique lentivirus-négociée. (A) Diagramme schématique de transfection lentivirale et transduction des organoïdes de tumeur de réservoir souple. (B) Images représentatives des organoïdes de tumeur de réservoir souple exprimant GFP. Barres d'échelle de 100 m. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 3 : Transplantation orthotopic des organoïdes de tumeur de réservoir souple. (A) Diagramme schématique de la transplantation orthotopic des organoïdes de tumeur de réservoir souple à une souris nue. (B) Images représentatives des vessies et des sections tachées H et E de souris orthotopiquement transplantées avec des organoïdes tumoraux de la vessie. Les vues agrandies des régions en boîte dans les panneaux du milieu sont affichées dans les panneaux de gauche. Barre d'échelle de 500 m. Ce chiffre a été reproduit à partir de la figure 1-Figure Supplément 1, Kim et al.16, publié sous la Creative Commons Attribution 4.0 International Public License (CC BY 4.0; https://creativecommons.org/licenses/by/4.0/). Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
| Organoïdes de tumeur de souris | |
| Advanced DMEM/F-12 (moyen de base) | 10 mM HEPES (pH 7,4) |
| 10 mM Nicotinamide | 0.5x Supplément sans sérum |
| 2 mM L-alanyl-L-glutamine dipeptide | 1% pénicilline/Streptomycine |
| 1 mM N-acétyl-L-cystéine | 50 ng/mL Facteur de croissance épidermique Murine |
| 1 M A 83-01 | |
Tableau 1 : Composition du milieu organoïde de tumeur de réservoir souple.
Discussion
Ce protocole décrit les procédures expérimentales à la culture et à maintenir des organoïdes de tumeur de réservoir souple dérivés des tumeurs de réservoir souple cancérogènes-induites.
Dans ce protocole, il y a plusieurs étapes expérimentales dans lesquelles les procédures pourraient avoir besoin d'un certain dépannage. Tout d'abord, le nombre de cellules tumorales qui sont initialement ensemencées est un facteur critique parce que le faible nombre de cellules tumorales en culture (lt;2 x 104 cellules) conduisent principalement à la mort cellulaire en raison du manque d'interactions entre les cellules tumorales. En revanche, en commençant par trop de cellules (5 x 104 cellules) à l'ensemencement conduit à des organoïdes surpeuplés, ce qui entraîne des difficultés lors de la manipulation des cultures avec une faible croissance de chaque organoïde. Il est fortement suggéré que plusieurs plaques avec des nombres différents de cellules soient établies au début pour optimiser les conditions expérimentales. L'identification du bon nombre de cellules tumorales initiales est cruciale pour atteindre la plus haute viabilité cellulaire et pour établir des organoïdes de tumeur de réservoir souple réussis. En outre, dans la culture à long terme de plus de 2 semaines sans passaging, la plupart des organoïdes de tumeur cessent de se développer, potentiellement dû à l'approvisionnement insuffisant des éléments nutritifs au centre des organoïdes et à l'épuisement du facteur de croissance dans la matrice de membrane de sous-sol. Par conséquent, la sous-culture des organoïdes en temps opportun est une étape critique pour maintenir la culture organoïde tumorale.
Deuxièmement, la production de particules lentivirales à haut tigre est essentielle à la manipulation génétique efficace des organoïdes tumoraux. Pour dépanner les problèmes liés au virus, il est fortement suggéré que les titres de virus soient déterminés avant la transduction virale à chaque fois parce que les constructions lentivirales ont tendance à produire des particules virales avec une efficacité variable. Si les organoïdes tumoraux présentent une faible viabilité à la suite d'une infection virale, il est probable que les titreleurs viraux sont potentiellement trop élevés. Il est fortement suggéré d'utiliser une plus faible quantité de virus dans ce cas. Troisièmement, pendant la transplantation orthotopic des organoïdes de tumeur de réservoir souple BBN-induits, il est critique pour maintenir l'intégrité de la paroi de réservoir souple. Dans le cas où l'injection atteint le lumen de la vessie en pénétrant la couche de la paroi de la vessie, l'expérience doit être terminée et jetée. Si possible, la surveillance de la croissance de tumeur de réservoir souple utilisant un système d'imagerie d'ultrason est recommandée.
Une limitation des techniques actuelles est l'absence du microenvironnement tumoral ou du stroma dans ces organoïdes. Pour surmonter ce problème, il est fortement suggéré que la transplantation orthotopic des organoïdes de tumeur emploient un système in vivo pour imiter le microenvironnement indigène de tumeur. À l'avenir, il sera nécessaire de développer des systèmes organoïdes in vitro 3D qui sont composés d'organoïdes tumoraux avec d'autres composants du stroma tumoral.
Une des implications principales de notre technique est que, dans la transplantation orthotopic des organoïdes de tumeur, seulement 10 organoïdes de tumeur de réservoir souple peuvent induire la croissance de tumeur dans la vessie. Comparé aux expériences conventionnelles de transplantation de tumeur qui exigent 5 x 105x 1 x 106 cellules de tumeur de réservoir souple simple, nos méthodes sont beaucoup plus efficaces et robustes. Une autre différence significative est que les organoïdes peuvent être diversement manipulés à l'aide de divers vecteurs lentiviraux, tels que les constructions lentivirales contenant de l'ARN à épingle courte, le système CRISPR-Cas9, ou des gènes d'intérêt. Ce seraient des outils puissants à ajouter à la technologie organoïde actuelle. Dans l'ensemble, les approches expérimentales présentées ici peuvent faciliter l'établissement de modèles tumoraux in vitro qui peuvent améliorer notre compréhension de la pathogénie du cancer de la vessie plutôt que d'utiliser des lignées de cellules cancéreuses de la vessie 2D.
Cette méthode a pu établir des organoïdes de tumeur de réservoir souple dérivés d'une tumeur cancérogène-induite de réservoir souple. L'article fournit une description des procédures expérimentales lentivirus-négociées par lesquelles les modifications génétiques sont introduites et maintenues de façon stable dans les organoïdes de tumeur de réservoir souple. En outre, une procédure pour la transplantation orthotopic des organoïdes de tumeur est incluse. En combinaison avec les modèles actuels de cancer in vivo, cette technique sera un outil utile pour étudier la base moléculaire de la tumorigénèse de la vessie.
Déclarations de divulgation
Les auteurs ne déclarent aucun intérêt financier concurrent.
Remerciements
Cette recherche a été soutenue par des subventions de la National Research Foundation of Korea à K.S: NRF-2017R1A2B4006043, NRF-2017M3C7A1047875, NRF-2017R1A5A1015366, Creative Economy Leading Technology Development Programme (SF317001A), POSCO (2018Y006) et POSCO (2018Y000) et bk21 Plus Research Fellowship.
matériels
| Name | Company | Catalog Number | Comments |
| 0.45 µm syringe filter (PES membrane) | Millipore | SLHP033RS | |
| 10 cm culture plate | Eppendorf | 0030-702-115 | |
| 90 mm Petri dish | SPL | 10090 | |
| 100 µm cell strainer | Corning | 352360 | |
| 15 mL conical tube | SPL | 50015 | |
| 24-well plate | Corning | 3526 | |
| 29 G 1/2 insulin syringe | SHINA | B299473538 | |
| 3 mL syringe | Norm-ject | N7.A03 | |
| 50 mL conical tube | SPL | 50050 | |
| A8301 | Tocris | 2939 | stock concentration: 25 mM |
| Absolute ethanol | Daejung | 4023-2304 | |
| Absorbable suture | Henry Schein | 039010 | |
| Advanced DMEM/F-12 | Thermo | 12634028 | |
| Ammonium-chloride-potassium (ACK) lysing buffer | Thermo | A1049201 | |
| B-27 | Gibco | 17504-044 | stock concentration: 50X |
| BBN(N-butyl-N-(4-hydroxybutyl) nitrosamine) | Tokyo Chemical Industry | B0938 | |
| Blue nylon 5/0-13mm | AILEE | NB521 | |
| C57BL Mouse | The Jackson Laboratory | 000664 | |
| CAnN.Cg-Foxn1nu/Crl (nude mouse) | Charles River | 194 | |
| Collagenase type I | Thermo | 17100017 | stock concentration: 20 mg/mL |
| Collagenase type II | Thermo | 17100015 | stock concentration: 20 mg/mL |
| Collagenase/dispase | Sigma | 10269638001 | stock concentration: 1 mg/mL |
| Cyrovial | Corning | 430488 | |
| DMEM(Dulbecco's modified minimum essential media) | Gibco | 11965-118 | |
| DMSO(Dimethyl sulfoxide) | Sigma | D8418 | |
| DPBS(Dulbecco's phosphate-buffered saline) | Welgene | LB 001-02 | |
| Enrofloxacin (Baytril) | Bayer Healthcare | DIN: 02169428 | |
| FBS(Fetal bovine serum) | Millipore | ES009B-KC | |
| Glutamax | Gibco | 35050061 | 100X |
| HEK 293T | ATCC | CRL-11268 | |
| HEPES(4-(2-hydroxyethyl)-1-piperazineethanesulfonic acid) | Welgene | BB001-01 | |
| Isoflurane | Hana Pharm Co., Ltd. | ||
| Ketoprofen (Anafen) | Merial | DIN: 02150999 | |
| Matrigel growth factor reduced (GFR) Growth Factor Reduced (GFR) | Corning | 354230 | use for organoid culture in plate |
| Matrigel high concentration (HC) | Corning | 354248 | use for organoid transplantation |
| 1.5 mL microtube | Axygen | MCT-150-C | |
| LT1 transfection reagent | Mirus Bio | MIR 2300 | |
| murine EGF(epidermal growth factor) | Peprotech | 315-09 | stock concentration: 100 µg/mL |
| N-acetyl-L-cysteine | Sigma | A9165 | stock concentration: 200 mM |
| Nicotinamide | Sigma | N0636 | stock concentration: 1M |
| Opti-MEM | Gibco | 31985070 | |
| pCMV.R 8.74 | Addgene | 22036 | Packaging plasmid |
| Penicillin/streptomycin | Gibco | 15140122 | 100X |
| pMD2.G | Addgene | 12259 | Envelope plasmid |
| Polybrene(hexadim ethrine bromide) | Sigma | H9286 | stock concentration: 2 µg/mL |
| pSiCoR | Addgene | 11579 | Lentiviral plasmid |
| Razor blade | |||
| Saline buffer | JW Pharmaceutical | ||
| SW41Ti swinging bucket rotor | Beckman Coulter | ||
| Thermolysin, Bacillus thermoproteolyticus | Millipore | 58656-2500KUCN | stock concentration: 250 KU/mL |
| Trypsin-EDTA (0.25%) | Gibco | 25200072 | |
| Ultracentrifugation tube | Beckman Coulter | 331372 | |
| Y-27632 dihydrochloride | Abmole | M1817 | stock concentration: 10 mM |
Références
- Sanli, O., et al. Bladder cancer. Nature Reviews Disease Primers. 3, 17022(2017).
- Stenzl, A., et al. Treatment of muscle-invasive and metastatic bladder cancer: update of the EAU guidelines. European Urology. 59 (6), 1009-1018 (2011).
- Barretina, J., et al. The Cancer Cell Line Encyclopedia enables predictive modelling of anticancer drug sensitivity. Nature. 483 (7391), 603(2012).
- Caponigro, G., Sellers, W. R. Advances in the preclinical testing of cancer therapeutic hypotheses. Nature Reviews Drug Discovery. 10 (3), 179(2011).
- Drost, J., Clevers, H. Organoids in cancer research. Nature Reviews Cancer. 18 (7), 407(2018).
- Fatehullah, A., Tan, S. H., Barker, N. Organoids as an in vitro model of human development and disease. Nature Cell Biology. 18 (3), 246(2016).
- Pauli, C., et al. Personalized in vitro and in vivo cancer models to guide precision medicine. Cancer discovery. 7 (5), 462-477 (2017).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- van de Wetering, M., et al. Prospective derivation of a living organoid biobank of colorectal cancer patients. Cell. 161 (4), 933-945 (2015).
- Lee, S. H., et al. Tumor evolution and drug response in patient-derived organoid models of bladder cancer. Cell. 173 (2), 515-517 (2018).
- Boj, S. F., et al. Organoid models of human and mouse ductal pancreatic cancer. Cell. 160 (1-2), 324-338 (2015).
- Huang, L., et al. Ductal pancreatic cancer modeling and drug screening using human pluripotent stem cell-and patient-derived tumor organoids. Nature Medicine. 21 (11), 1364(2015).
- Gao, D., et al. Organoid cultures derived from patients with advanced prostate cancer. Cell. 159 (1), 176-187 (2014).
- Broutier, L., et al. Human primary liver cancer–derived organoid cultures for disease modeling and drug screening. Nature Medicine. 23 (12), 1424(2017).
- Sachs, N., et al. A living biobank of breast cancer organoids captures disease heterogeneity. Cell. 172 (1-2), 373-386 (2018).
- Kim, S., et al. Epigenetic regulation of mammalian Hedgehog signaling to the stroma determines the molecular subtype of bladder cancer. eLife. 8, 43024(2019).
- Shin, K., et al. Cellular origin of bladder neoplasia and tissue dynamics of its progression to invasive carcinoma. Nature Cell Biology. 16 (5), 469(2014).
- Fu, C. L., Apelo, C. A., Torres, B., Thai, K. H., Hsieh, M. H. Mouse bladder wall injection. JoVE (Journal of Visualized Experiments). (53), e2523(2011).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon