Method Article
Kultur, Manipulation und orthotopische Transplantation von Mausblase Tumororganoiden
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Dieses Protokoll enthält detaillierte experimentelle Schritte zur Etablierung einer dreidimensionalen In-vitro-Kultur von Blasentumororganoiden, die aus krebserregendem murinen Blasenkrebs gewonnen werden. Kulturmethoden wie Passaging, Gentechnik und orthotopische Transplantation von Tumororganoiden werden beschrieben.
Zusammenfassung
Die Entwicklung fortschrittlicher Tumormodelle wird seit langem gefördert, da aktuelle Krebsmodelle Einschränkungen wie den Mangel an dreidimensionaler (3D) Tumorarchitektur und eine geringe Relevanz für menschlichen Krebs aufgezeigt haben. Forscher haben vor kurzem ein 3D-In-vitro-Krebsmodell entwickelt, das als Tumororganoide bezeichnet wird und die Eigenschaften eines nativen Tumors in einer Kulturschale nachahmen kann. Hier werden experimentelle Verfahren für die Etablierung von Blasentumororganoiden aus einem krebserregend-induzierten murinen Blasentumor, einschließlich Kultur, Passage und Aufrechterhaltung der resultierenden 3D-Tumororganoide in vitro, detailliert beschrieben. Darüber hinaus werden Protokolle zur Manipulation der etablierten Blasentumor-Organoidlinien für die Gentechnik mit Lentivirus-vermittelter Transduktion beschrieben, einschließlich optimierter Bedingungen für die effiziente Einführung neuer genetischer Elemente in den Tumor. Organoide. Schließlich wird das Verfahren zur orthotopischen Transplantation von Blasentumororganoiden in die Wand der murinen Blase zur weiteren Analyse angelegt. Die in diesem Artikel beschriebenen Methoden können die Etablierung eines In-vitro-Modells für Blasenkrebs zur Entwicklung besserer therapeutischer Möglichkeiten erleichtern.
Einleitung
Blasenkrebs ist der häufigste Harnwegskrebs, etwa 165.000 Patienten sterben jährlich1. Unter den verschiedenen Arten von Blasenkrebs, muskelinvasive surotheliale Karzinom zeigt einen aggressiven Phänotyp, und seine 5-Jahres-Überlebensrate ist niedriger als 50%2. Neue therapeutische Möglichkeiten für invasive urotheliale Tumoren wurden in den letzten Jahrzehnten nicht erweitert1.
Krebszelllinien wurden ausgiebig für das Arzneimittelscreening verwendet3. Obwohl günstige Ergebnisse bei zahlreichen Arzneimittelkandidaten in Krebszelllinien beobachtet wurden, werden schlechte Ergebnisse in klinischenStudien4 berichtet. Nach einer verstärkten Anpassung an in vitro zweidimensionale (2D) Kulturumgebungen ist es immer schwieriger geworden, native Tumoren in Zelllinien zu rekapitulieren. Tierkrebsmodelle oder von Patienten abgeleitete Tumor-Xenografts können verwendet werden, um die Einschränkungen zu beheben, die in Blasenkrebszelllinien beobachtet werden. Tierkrebsmodelle sind jedoch zeit- und ressourcenintensiv. Daher sind verbesserte Krankheitsmodelle seit Jahren auf Abruf und ein neuartiges Modellsystem, Organoide, wurde entwickelt, um die Mängel der bestehenden Modelle zu überwinden5.
Ein Organoid ist ein multizelluläres 3D-Konstrukt, das in vitro die physiologischen Eigenschaften seines entsprechenden In-vivo-Organs rekapitulieren kann. Normale und Tumor-Organoide können entweder aus pluripotenten oder adulten Stammzellen und primären Tumorzellen bzw.5,6abgeleitet werden. In den letzten Jahren, Tumor-Organoide wurden aus einer großen Anzahl von verschiedenen Tumorgewebe7, einschließlich Dickdarm8,9, Blase10, Bauchspeicheldrüse11,12, Prostata13, Leber14, und Brust15 Tumorgewebe. Solche Tumororganoide imitieren ihre ursprünglichen Tumoren phänotypisch und genetisch. Aufgrund ihrer Ähnlichkeit mit In-vivo-Tumorgeweben und ihren zahlreichen praktischen Anwendungen haben Forscher sie als neuartige Krankheitsmodelle bei der Erforschung der Krebspathogenese übernommen.
Hier werden die Verfahren zur Etablierung von Tumororganoiden aus einem krebserregend-induzierten murinen invasiven Urotheltumor16 angelegt. N-Butyl-N-(4-Hydroxybutyl)-Nitrosamin (BBN) wird als Karzinogen verwendet, um invasives urotheliale Karzinom bei Mäusen17 zu induzieren und die Tumororganoide, die die pathologischen Eigenschaften von Mausmuskel-invasiven Blasentumoren aufweisen, werden aus dem BBN-induzierten murinen Blasenkrebs16nachgewiesen. Die Methode zur genetischen Manipulation der Tumororganoide wird anhand der lentivirusvermittelten Transduktion veranschaulicht, um ein Modellsystem zur Untersuchung der molekularen Grundlagen der Entwicklung von Blasenkrebs zu entwickeln. Darüber hinaus wird eine Methode zur orthotopischen Transplantation von Organoiden in eine Blase beschrieben, um die Rolle der einheimischen Blasenumgebung bei Blasenkrebs zu untersuchen.
Protokoll
Alle Verfahren wurden nach den Richtlinien des Institutionellen Ausschusses für Tierpflege und -nutzung bei POSTECH (IACUC-Nummer: POSTECH-2019-0055) genehmigt und durchgeführt.
1. In Vitro Kultur der Blasentumor-Organoide
- Bladdertumor-Organoide aus dem murinen Blasentumor (Abbildung 1Eine).
HINWEIS: Das Verfahren zur Erzeugung von BBN-induzierten Mausblasentumoren ist in Shin et al. beschrieben.17.- Geben Sie 0,1% BBN-haltiges Wasser in einer dunklen Flasche an Maus ad libitum für 6 Monate. BBN-haltiges Wasser 2x pro Woche wechseln.
HINWEIS: Es wurde eine C57BL/6-Maus mit einem Körpergewicht von ca. 25 g im Alter von 8–10 Wochen verwendet. BBN-haltiges Wasser kann bis zu fünf Mäusen in einem Käfig verabreicht werden. - Nach 6 Monaten die Maus mit Kohlendioxid-Inhalation einschläfern und den gesamten Blasentumor isolieren. Auf eine 90 mm Petrischale übertragen.
- Entfernen Sie nicht-kanzeröse Teile und nekrotische Regionen mit sterilen chirurgischen Scheren und waschen Sie die Blasentumorfragmente 2-3 Mal mit kalter 1x Dulbecco Phosphat-gepufferter Kochsaline (DPBS). Sammeln Sie die Fragmente und übertragen Sie sie in eine neue 90 mm Petrischale.
- Fügen Sie 1 ml des modifizierten minimalen essentiellen Mediums (DMEM) von Dulbecco mit 10 mM 4-(2-hydroxyethyl)-1-piperazinethanesulfonsäure (HEPES) hinzu.
- Schneiden Sie das Tumorgewebe mit einer sterilisierten Rasierklinge so klein wie möglich (0,5–1 mm3) in Stücke.
- Fügen Sie 9 ml DMEM mit 10 mM HEPES, 250 g/ml Kollagenase Typ I, 250 g/ml Kollagenase Typ II und 250 U/ml Thermolysin hinzu. Inkubieren Sie das gehackte Tumorgewebe für 1,5-2 h auf einem Orbitalshaker in einem Inkubator (37 °C, 5%CO2), um die Fragmente in die Zellsuspension zu dissoziieren. Übertragen Sie die Zellsuspension in ein 50 ml Rohr.
HINWEIS: Wenn die Größe des tumors, der von der Maus geerntet wird, größer als 1 cm3ist, behandeln Sie ihn mit dem 2-fachen der Menge an Thermolysin oder erhöhen Sie die Inkubationszeit. - Zentrifugieren Sie das Rohr bei 400 x g für 5 min bei 4 °C und aspirieren Sie den Überstand.
- Setzen Sie das Pellet mit 5 ml Ammoniumchlorid-Kalium (ACK)-Lysingpuffer aus, um rote Blutkörperchen zu lysieren. Inkubieren Sie die Röhre für 3-5 min bei Raumtemperatur (RT) bis zur vollständigen Lyse der roten Blutkörperchen.
HINWEIS: Wenn die roten Blutkörperchen nicht beobachtet werden, lassen Sie den Lysing-Prozess weg. - 20 ml DMEM in die Röhre geben. Zentrifugieren Sie das Rohr bei 400 x g für 5 min bei 4 °C und aspirieren Sie den Überstand.
- Setzen Sie das Pellet mit 1 ml 0,25% Trypsin-EDTA und 10 'M Y-27632 Dihydrochlorid (Y-27632) wieder auf, um das Pellet in einzelzellen zu dissoziieren. Inkubieren Sie das Rohr für 5 min in einem 37 °C Wasserbad.
HINWEIS: Beobachten Sie den Tumor unter dem Mikroskop, um die vollständige Dissoziation in einzelne Zellen zu bestätigen. Wenn Zellteile bestehen bleiben, pipette die Suspension weiter. - Neutralisieren Sie Trypsin mit 10 ml DMEM mit 10% fetalem Rinderserum (FBS). Filtern Sie die Zellsuspension durch ein 100-m-Zellsieb auf einem neuen 50 ml-Rohr, um die unverdauten Trümmer zu entfernen.
- Zentrifugieren Sie das Rohr bei 400 x g für 5 min bei 4 °C und aspirieren Sie den Überstand.
- Beschichten Sie einen Brunnen in einer 24-Well-Platte mit 150 l eiskalten Wachstumsfaktor reduziert Kellermembranmatrix (Tabelle der Materialien) und legen Sie die 24 Well-Platte in einem Inkubator (37 °C, 5%CO2) für 30 min, um die Kellermembranmatrix zu erstarren.
HINWEIS: Tauen und halten Sie die Kellermembranmatrix bei 4 °C, um eine Erstarrung vor Gebrauch zu verhindern. - Setzen Sie das Pellet mit 1 ml DMEM wieder auf und zählen Sie die Zellen mit einem Hämozytometer. Übertragen Sie 3–4 x 104 Tumorzellen in ein 1,5 ml Mikrorohr auf Eis.
- Zentrifugieren Sie das Mikrorohr bei 400 x g für 3 min bei 4 °C und entsorgen Sie den Überstand sorgfältig.
- Die Zellen mit 500 l vorgewärmtem Organoidmedium (Tabelle 1) und 10 M Y-27632 wieder aufhängen und in den beschichteten Brunnen übertragen. Legen Sie die 24 Well-Platte in einen Inkubator (37 °C, 5% CO2).
- Zusätzliche Blasentumorzellen können mit 1 ml DMEM mit 10% FBS, 1% Penicillin/Streptomycin und 10% Dimethylsulfoxid (DMSO) in 1,5 ml Kryovials gelagert werden. Legen Sie sie in einen kryovialen Gefrierbehälter und überführen Sie den Behälter in einen -80 °C Gefrierschrank. Nach der Lagerung im Gefrierschrank über Nacht die Kryovials zur Langzeitlagerung in flüssigen Stickstoff übertragen.
- Ändern Sie das Medium alle 2 Tage mit 500 l vorgewärmten organoiden Mediums (Abbildung 1B).
- Geben Sie 0,1% BBN-haltiges Wasser in einer dunklen Flasche an Maus ad libitum für 6 Monate. BBN-haltiges Wasser 2x pro Woche wechseln.
- Subkultur Blasentumor-Organoide.
HINWEIS: Es wird empfohlen, die Durchfahrt von Blasentumororganoiden zu erreichen, wenn sie einen Durchmesser von 100–150 m erreichen.- Fügen Sie dem Organoidmedium 500 l Kollagennase/Dispase in die 24-Well-Platte mit Tumororganoiden hinzu. Pipette auf und ab der Kellermembranmatrix und dem Medium. 20 min bei 37 °C inkubieren und die Zellen in ein 15 ml-Rohr ernten.
HINWEIS: Untersuchen Sie die aus der Kellermembranmatrix isolierten Organoide unter dem Mikroskop. Wenn die Organoide nicht von der Kellermembranmatrix gelöst sind, erhöhen Sie die Inkubationszeit oder Pipette um ein Vielfaches. - 5 ml vorgewärmtes DMEM hinzufügen, das Rohr bei 400 x g für 3 min bei 4 °C zentrieren und den Überstand ansaugen.
- Setzen Sie das Pellet mit 1 ml vorgewärmten 0,25% Trypsin-EDTA und 10 'M Y-27632 wieder auf. Inkubieren Sie für 5 min in einem 37 °C Wasserbad. Die Zellen kräftig nach oben und unten pipetteundieren und das Trypsin mit 5 ml DMEM mit 10% FBS neutralisieren.
- Zentrifugieren Sie das Rohr bei 400 x g für 3 min bei 4 °C und aspirieren Sie den Überstand.
- Setzen Sie das Pellet mit 1 ml vorgewärmten organoiden Mediums aus und zählen Sie die Anzahl der einzelnen Tumorzellen.
- Wiederholen Sie die Schritte 1.1.14-1.1.18.
- Fügen Sie dem Organoidmedium 500 l Kollagennase/Dispase in die 24-Well-Platte mit Tumororganoiden hinzu. Pipette auf und ab der Kellermembranmatrix und dem Medium. 20 min bei 37 °C inkubieren und die Zellen in ein 15 ml-Rohr ernten.
2. Genetische Manipulation von Blasentumororganoiden mit Lentivirus-vermittelter Transduktion (Abbildung 2A)
- Produzieren Sie die GFP-exemittierenden lentiviralen Partikel.
- Am Tag 0, Platte HEK 293T Zellen mit einer Dichte von 5–6 x 106 Zellen pro 10 cm Zellkulturplatte in Zelllinienkulturmedium (d.h. DMEM mit 10% FBS und 1% Penicillin/Streptomycin).
- Bereiten Sie am ersten Tag die DNA-Transfektionslösung vor, einschließlich des transferhaltigen Plasmids, das GFP (8 g), das lentivirale Verpackungsplasmid (10 g pCMVR 8,74 und 3 g pMD2.G) und 1 ml reduziertes Serummedium(Materialtabelle)enthält.
- Fügen Sie 3 l Transfektionsreagenz (Materialtabelle) pro 1 g Desatogens des gesamten Plasmids gemäß den Anweisungen des Herstellers hinzu und mischen Sie vorsichtig durch Pipettieren. 20 min bei RT inkubieren und 9 ml DMEM mit 10% FBS hinzufügen.
- Aspirieren Sie das Kulturmedium in der Zellkulturplatte mit HEK 293T Zellen. 10 ml der DNA-Transfektionslösung vorsichtig auf die HEK 293T-Zellen übertragen und in einem Zellkultur-Inkubator bei 37 °C inkubieren.
- Beobachten Sie am 3. Tag die Zellen unter einem Fluoreszenzmikroskop (Erregung bei 488 nm und Emission bei 512 nm), um die Transfektionseffizienz zu bestimmen. Fast 90% –100% der Zellen in der gesamten Zellpopulation sollten GFP ausdrücken.
- Sammeln Sie den Überstand (das virushaltige) und filtrieren Sie den Überstand mit einem 0,45 m Polyethersulfonfilter (PES).
HINWEIS: Verwenden Sie einen schwachen Proteinbindungsfilter, z. B. einen PES-Filter. - Um das Virus zu konzentrieren, zentrifugieren Sie den Virusüberstand bei 98.768 x g in einer Ultrazentrifuge für 2 h bei 4 °C in einem schwingenden Schaufelrotor (Materialtabelle) und entsorgen Sie den Überstand sorgfältig.
- Das Pellet in 2,5 ml kaltem organoiden Medium wieder aufhängen.
- Zur Langzeitlagerung, aliquot 250 l lentiviralen Medium in kryogenen Fläschchen und Snap-Freeze sie mit flüssigem Stickstoff. Bewahren Sie die gefrorenen Virusbestände in einem Gefrierschrank von -80 °C auf.
- Führen Sie lentivirus-vermittelte Transduktion der Blasentumor-Organoide durch.
- Teilen Sie am 2. Tag die Tumororganoide wie oben beschrieben (Schritt 1.2) 12 h vor der lentivirusvermittelten Transduktion.
- Am 3. Tag schnell ein Aliquot (Schritt 2.1.9) mit Virus in einem 37 °C-Wasserbad auftauen und die 250 L Organoidmedium mit 10 'M Y-27632 und 8 'g/ml Hexadimethrinbromid hinzufügen.
- Ersetzen Sie das Organoidmedium in der 24-Well-Platte durch Tumororganoide durch 500 l virenhaltiges Medium und inkubieren Sie 12–16 h in einem Inkubator (37 °C, 5% CO2).
- Wechseln Sie am 4. Tag das Medium mit 500 l frischem Organoidmedium.
HINWEIS: Nach 12-16 h Inkubation sollte das Medium gewechselt werden, da das Medium, das Lentivirus und Hexadimethrinbromid enthält, zytotoxisch ist. - Überwachen Sie am 6. Tag das GFP-Signal der Tumororganoide 3 Tage nach der Transduktion unter einem Fluoreszenzmikroskop (Abbildung 2B).
- Am 10. Tag, Durchgang und Lager der Organoide 7 Tage nach der Transduktion, wie in Schritt 1.2 beschrieben, um die genetisch veränderten Tumororganoidlinien zu erhalten.
3. Orthotopische Transplantation von Blasenorganoid (Abbildung 3A)
- Bereiten Sie die Blasentumor-Organoide für die orthotopische Transplantation vor.
- Vor der Transplantation, Kultur der Blasentumor Organoide für 5-7 Tage, wie oben beschrieben (Schritt 1.2).
- Fügen Sie 500 L Kollagennase/Dispase zu organoiden Medien in einer 24-Well-Platte mit den Tumororganoiden hinzu. Pipette auf und ab der Kellermembranmatrix und Medium. 20 min bei 37 °C inkubieren und die Zellen in einem 15 ml-Rohr sammeln.
- 5 ml vorgewärmtes DMEM hinzufügen, das Rohr bei 400 x g für 3 min bei 4 °C zentrieren und den Überstand ansaugen.
- Das Pellet mit 1 ml DMEM aussetzen und die Lösung in eine 90 mm Petrischale geben.
- Unter dem Mikroskop nehmen Sie die 10–100 Tumororganoide mit einer p200-Mikropipette auf und sammeln sie in einem Mikrorohr auf Eis.
- Zentrifugieren Sie das Rohr bei 400 x g für 3 min bei 4 °C und entsorgen Sie den Überstand sorgfältig.
- Bewahren Sie das Zellpellet auf Eis auf, bis die Mäuse für eine Operation bereit sind.
- Submucosale Blasenwandtransplantation
HINWEIS: Dieses Verfahren wird aus dem von Fu et al18veröffentlichten Protokoll geändert.- Bereiten Sie eine 8 bis 10 Wochen alte männliche Nacktmaus (CAnN.Cg-Foxn1nu/Crl) mindestens 1 Woche vor dem Experiment vor, damit sie sich an eine neue Umgebung akklimatisieren kann. Injizieren Enrofloxacin (5 mg/kg) subkutan 24 h vor der Operation.
- Reinigen Sie die Bankoberfläche mit Seife und Wasser. Autoclavdien Sie die chirurgischen Instrumente vor dem chirurgischen Eingriff und führen Sie eine Operation mit sterilen Instrumenten durch.
- Halten Sie die 29 G Insulinspritze, Pipettenspitzen und Kellermembranmatrix auf Eis. Ketoprofen (5 mg/kg) vor Verabreichung der Anästhesie subkutan verabreichen.
- Anästhetisieren Sie die Maus mit 4% Isofluran in einer Induktionskammer. Sobald die Vollnarkose erreicht ist, legen Sie die Maus in eine Supine-Position und halten Anästhesie durch Maskeneinatmung von 2% verdampftem Isofluran.
HINWEIS: Wenn die Anästhesisierungszeit über 30 min beträgt, tragen Sie die Augensalbe auf beide Augen mit einem Wattestäbchen auf, um eine Hornhauttrocknung zu vermeiden. - Povidon-Jod mit einer sterilen Gaze auftragen und mit 70% Ethanol abwischen. 3x mit einer neuen Gaze oder einem Wattestäbchen jedes Mal wiederholen.
- Bedecken Sie den Anus und das chirurgische Feld mit Einweg-, sterilen chirurgischen Vorhängen.
- Mit einem Sezieren Mikroskop für die Vergrößerung, machen Sie einen kleinen Querschnitt (kleiner als 1,5 cm) in der Haut und Muskelwand des unteren Mittellinienbauchs mit steriler chirurgischer Schere. Setzen Sie die Blase aus der Bauchhöhle aus und unterstützen Sie sie mit kochsäuregetränkten Wattestäbchen.
HINWEIS: Wenn die Blase voller Urin ist, drücken Sie vorsichtig die Blase, um sie leicht zu dekomprimieren. - Die Organoidpellets (Schritt 3.1.7) in 80 l Organoidmedium mit 50% hochkonzentrierter Kellermembranmatrix(Tabelle der Materialien) wieder aufsetzen
- Injizieren Sie die organoide Suspension mit der 29 G Insulinspritze unter einem Sezierendes Mikroskop in den vorderen Aspekt der Blasenkuppel.
- Schließen Sie die innere Schicht der Bauchwand mit antibakteriell resorbierbarer Naht und schließen Sie dann die äußere Schicht mit 4-0 Nylon-Nähte. Desinfizieren Sie die chirurgische Stelle mit Povidon-Jod und 70% Ethanol.
- Lassen Sie die Maus unter einem Infrarot-Bestrahlungskörper 10-15 min erholen. Überwachen Sie die Maus, bis sie Bewusstsein und Beweglichkeit wiedererlangt.
- Einen Tag nach der Operation, überprüfen Sie den allgemeinen Zustand der Maus und anastomotische Leckage. Ketoprofen (5 mg/kg) einmal täglich für 3 Tage nach der Operation ieren und Enrofloxacin (5 mg/kg) einmal täglich für 10 Tage nach der Operation behandeln.
- Wenn die Einschnittstelle verheilt ist (10-14 Tage nach der Operation), entfernen Sie die Nähte. Überwachen Sie das Wachstum des Mausblasentumors für 2-3 Wochen nach der Tumororganoid-Injektion.
- Wenn Blasentumorwachstum beobachtet wird, einschläfern Sie die Maus mit Kohlendioxid-Inhalation, und ernten Sie den gesamten Blasentumor. Waschen Sie es mit kalten DPBS (Abbildung 3B)16.
- Um die Blasentumor-Histologie zu analysieren, färben Sie den paraffin-eingebetteten Abschnitt des Gewebes mit Hämatoxylin und Eosin (H und E) Färbung (Abbildung 3B)16.
Ergebnisse
In-vitro-Kultur von Mausblase Tumororganoiden
Die Anzahl der Tumorzellen, die von einem 1 cm3 BBN-induzierten Tumor getrennt sind, beträgt mindestens 4 x 105 Zellen. Wenn die Zellen zunächst in der Kellermembranmatrix gesät werden, können nicht-kanzeröse Zellen und Ablagerungen beobachtet werden. Die Trümmer wurden durch die Fortsetzung der Subkultur allmählich verdünnt. Abbildung 1B zeigt Bilder der kultivierten Organoide zu verschiedenen Zeitpunkten. Wenn die Tumorzellen keine Tumororganoide bilden, sind die Zellen während des Dissoziationsschritts potenziell tot. In einem solchen Fall müssen Dissoziationsverfahren einschließlich der Inkubationszeit mit dem Enzym angepasst werden, um die Zelllebensfähigkeit zu erhöhen.
Expression von GFP in Blasentumororganoiden mit Lentivirus-vermittelter genetischer Manipulation
Blasentumor-Organoide zeigten starke GFP-Signale mit erfolgreicher lentiviraler Infektion (Abbildung 2B). Nach der Konzentration reichten insgesamt 250 L virenhaltige Medien aus, um 3 x 104 einzelne Tumorzellen in der Kellermembranmatrix zu infizieren, wobei die Infektionseffizienz von 90 % bis 100 % erhalten blieb. GFP-Signale konnten 3 Tage nach der lentiviralen Transduktion von den Blasentumororganoiden nachgewiesen werden. Wenn die Fluoreszenzsignale niedrig sind, ist die Effizienz einer Virusinfektion potenziell gering. Dies kann auf zahlreiche Faktoren, wie z. B. niedrigen viralen Titer, und die Verfahren müssen entsprechend angepasst werden.
Orthotope Transplantation von Blasentumororganoiden
Ein Blasentumor-Allograft aus BBN-induzierten Blasentumororganoiden ist in Abbildung 3B16dargestellt. Blasentumor-Allografts wurden 3 Wochen nach orthotopischer Transplantation geerntet. Die Histologie des transplantierten Blasentumors wurde mit H- und E-Färbung analysiert. Orthotopische Transplantationen von Tumororganoiden können als Blasentumoren für 2-3 Wochen wachsen.

Abbildung 1: In-vitro-Kultur von Mausblasentumororganoiden. (A) Schematisches Diagramm für die Etablierung von Mausblasentumororganoiden. (B) Repräsentative Bilder für die Kultur der Blasentumor-Organoide zu verschiedenen Zeitpunkten. Mausblase Tumor Organoide wurden etabliert und kultiviert über 9 Tage. Maßstabsleiste = 100 m. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
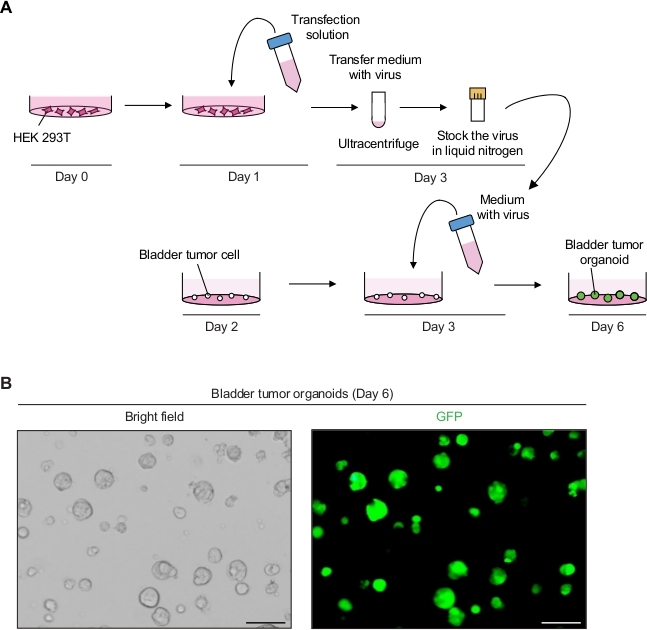
Abbildung 2: Expression von GFP in Blasentumororganoiden unter Verwendung von lentivirusvermittelter genetischer Manipulation. (A) Schematische Darstellung der lentiviralen Transfektion und Transduktion von Blasentumororganoiden. (B) Repräsentative Bilder von Blasentumororganoiden, die GFP exemitenieren. Skalenbalken = 100 m. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Orthotopische Transplantation von Blasentumororganoiden. (A) Schematische Darstellung der orthotopischen Transplantation von Blasentumororganoiden an eine Nackte Maus. (B) Repräsentative Bilder von Blasen und H- und E-gefärbten Abschnitten von Mäusen orthotopisch transplantiert mit Blasentumororganoiden. Vergrößerte Ansichten der geschachtelten Bereiche in den mittleren Bedienfeldern sind in den linken Bereichen dargestellt. Skalenbalken = 500 m. Diese Zahl wurde aus Abbildung 1– Abbildung Beilage 1, Kim et al.16, reproduziert, die unter der Creative Commons Attribution 4.0 International Public License (CC BY 4.0; https://creativecommons.org/licenses/by/4.0/) veröffentlicht wurde. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Mausblase Tumor Organoide medium | |
| Fortgeschrittene DMEM/F-12 (Grundmedium) | 10 mM HEPES(pH 7.4) |
| 10 mM Nicotinamid | 0.5x Serumfreier Zuschlag |
| 2 mM L-Alanyl-L-Glutamin-Dipeptid | 1% Penicillin/Streptomycin |
| 1 mM N-Acetyl-L-Cystein | 50 ng/mL Murine-Epidermal-Wachstumsfaktor |
| 1 M A 83-01 | |
Tabelle 1: Zusammensetzung des Organoidmediums Desblasetumors.
Diskussion
Dieses Protokoll beschreibt die experimentellen Verfahren zur Kultur und Aufrechterhaltung von Blasentumororganoiden, die aus krebserregenden murinen Blasentumoren abgeleitet sind.
In diesem Protokoll gibt es mehrere experimentelle Schritte, in denen die Prozeduren möglicherweise eine Fehlerbehebung benötigen. Erstens ist die Anzahl der Tumorzellen, die zunächst gesät werden, ein kritischer Faktor, da eine geringe Anzahl von Tumorzellen in der Kultur (<2 x 104 Zellen) meist zum Zelltod aufgrund fehlender Wechselwirkungen zwischen Tumorzellen führen. Im Gegensatz dazu führt der Beginn mit zu vielen Zellen (>5 x 104 Zellen) bei der Aussaat zu überfüllten Organoiden, was zu Schwierigkeiten beim Umgang mit Kulturen mit schlechtem Wachstum jedes Organoids führt. Es wird dringend empfohlen, dass mehrere Platten mit unterschiedlicher Anzahl von Zellen am Anfang etabliert werden, um die experimentellen Bedingungen zu optimieren. Die Identifizierung der richtigen Anzahl von Anfangstumorzellen ist entscheidend, um die höchste Zelllebensfähigkeit zu erreichen und erfolgreiche Blasentumor-Organoide zu etablieren. Auch in der Langzeitkultur von mehr als 2 Wochen ohne Passaging, die meisten Tumor-Organoide aufhören zu wachsen, möglicherweise aufgrund der unzureichenden Versorgung mit Nährstoffen im Zentrum der Organoide und die Erschöpfung des Wachstumsfaktors in der Kellermembranmatrix. Daher ist die rechtzeitige Subkultivierung von Organoiden ein entscheidender Schritt, um die Tumororganoidkultur aufrechtzuerhalten.
Zweitens ist die Produktion von hochtiter lentiviralen Partikeln entscheidend für die effiziente genetische Manipulation von Tumororganoiden. Um Probleme mit Virustitern zu beheben, wird dringend empfohlen, die Virustitter jedes Mal vor der viralen Transduktion zu bestimmen, da lentivirale Konstrukte dazu neigen, virale Partikel mit unterschiedlicher Effizienz zu produzieren. Wenn Tumororganoide nach einer Virusinfektion eine geringe Lebensfähigkeit aufweisen, ist es wahrscheinlich, dass die viralen Titter potenziell zu hoch sind. Es wird dringend empfohlen, geringere Menge an Virus in diesem Fall zu verwenden. Drittens, während der orthotopischen Transplantation von BBN-induzierten Blasentumororganoiden, ist es wichtig, die Integrität der Blasenwand zu erhalten. Für den Fall, dass die Injektion das Lumen der Blase erreicht, indem sie in die Blasenwandschicht eindringt, sollte das Experiment beendet und verworfen werden. Wenn möglich, wird die Überwachung des Blasentumorwachstums mit einem Ultraschall-Bildgebungssystem empfohlen.
Eine Einschränkung der aktuellen Techniken ist das Fehlen der Tumor-Mikroumgebung oder Stroma in diesen Organoiden. Um dieses Problem zu überwinden, wird dringend empfohlen, dass die orthotopische Transplantation von Tumororganoiden ein In-vivo-System verwendet, um die native Tumormikroumgebung nachzuahmen. In Zukunft wird es notwendig sein, 3D-In-vitro-Organoidsysteme zu entwickeln, die aus Tumororganoiden mit anderen Komponenten von Tumorstroma bestehen.
Eine der wichtigsten Implikationen unserer Technik ist, dass bei der orthotopischen Transplantation von Tumororganoiden nur 10 Blasentumor-Organoide Tumorwachstum in der Blase induzieren können. Im Vergleich zu den konventionellen Tumortransplantationsexperimenten, die 5 x 105–1 x 106 Einzelblasentumorzellen erfordern, sind unsere Methoden viel effizienter und robuster. Ein weiterer signifikanter Unterschied besteht darin, dass die Organoide mit verschiedenen lentiviralen Vektoren, wie z. B. lentiviralen Konstrukten, die Kurzhaar-RNA enthalten, dem CRISPR-Cas9-System oder Genen von Interesse diversifiziert werden können. Dies wären leistungsfähige Werkzeuge, um die aktuelle Organoid-Technologie hinzuzufügen. Insgesamt können die hier vorgestellten experimentellen Ansätze die Etablierung von In-vitro-Tumormodellen erleichtern, die unser Verständnis der Pathogenese von Blasenkrebs verbessern können, anstatt 2D-Blasenkrebszelllinien zu verwenden.
Diese Methode war in der Lage, Blasentumor-Organoide aus einem karzinogen-induzierten murinen Blasentumor abgeleitet zu etablieren. Der Artikel enthält eine Beschreibung der mit Lentivirus vermittelten experimentellen Verfahren, durch die die genetischen Veränderungen in Blasentumororganoiden eingeführt und stabil aufrechterhalten werden. Darüber hinaus ist ein Verfahren zur orthotopischen Transplantation von Tumororganoiden enthalten. In Kombination mit aktuellen In-vivo-Krebsmodellen wird diese Technik ein nützliches Werkzeug sein, um die molekulare Grundlage der Blasentumorigenese zu untersuchen.
Offenlegungen
Die Autoren erklären keine konkurrierenden finanziellen Interessen.
Danksagungen
Diese Forschung wurde durch Stipendien der National Research Foundation of Korea an K.S. unterstützt: NRF-2017R1A2B4006043, NRF-2017M3C7A1047875, NRF-2017R1A5A1015366, Creative Economy Leading Technology Development Programme (SF317001A), POSCO (2018Y060) das BK21 Plus Research Fellowship.
Materialien
| Name | Company | Catalog Number | Comments |
| 0.45 µm syringe filter (PES membrane) | Millipore | SLHP033RS | |
| 10 cm culture plate | Eppendorf | 0030-702-115 | |
| 90 mm Petri dish | SPL | 10090 | |
| 100 µm cell strainer | Corning | 352360 | |
| 15 mL conical tube | SPL | 50015 | |
| 24-well plate | Corning | 3526 | |
| 29 G 1/2 insulin syringe | SHINA | B299473538 | |
| 3 mL syringe | Norm-ject | N7.A03 | |
| 50 mL conical tube | SPL | 50050 | |
| A8301 | Tocris | 2939 | stock concentration: 25 mM |
| Absolute ethanol | Daejung | 4023-2304 | |
| Absorbable suture | Henry Schein | 039010 | |
| Advanced DMEM/F-12 | Thermo | 12634028 | |
| Ammonium-chloride-potassium (ACK) lysing buffer | Thermo | A1049201 | |
| B-27 | Gibco | 17504-044 | stock concentration: 50X |
| BBN(N-butyl-N-(4-hydroxybutyl) nitrosamine) | Tokyo Chemical Industry | B0938 | |
| Blue nylon 5/0-13mm | AILEE | NB521 | |
| C57BL Mouse | The Jackson Laboratory | 000664 | |
| CAnN.Cg-Foxn1nu/Crl (nude mouse) | Charles River | 194 | |
| Collagenase type I | Thermo | 17100017 | stock concentration: 20 mg/mL |
| Collagenase type II | Thermo | 17100015 | stock concentration: 20 mg/mL |
| Collagenase/dispase | Sigma | 10269638001 | stock concentration: 1 mg/mL |
| Cyrovial | Corning | 430488 | |
| DMEM(Dulbecco's modified minimum essential media) | Gibco | 11965-118 | |
| DMSO(Dimethyl sulfoxide) | Sigma | D8418 | |
| DPBS(Dulbecco's phosphate-buffered saline) | Welgene | LB 001-02 | |
| Enrofloxacin (Baytril) | Bayer Healthcare | DIN: 02169428 | |
| FBS(Fetal bovine serum) | Millipore | ES009B-KC | |
| Glutamax | Gibco | 35050061 | 100X |
| HEK 293T | ATCC | CRL-11268 | |
| HEPES(4-(2-hydroxyethyl)-1-piperazineethanesulfonic acid) | Welgene | BB001-01 | |
| Isoflurane | Hana Pharm Co., Ltd. | ||
| Ketoprofen (Anafen) | Merial | DIN: 02150999 | |
| Matrigel growth factor reduced (GFR) Growth Factor Reduced (GFR) | Corning | 354230 | use for organoid culture in plate |
| Matrigel high concentration (HC) | Corning | 354248 | use for organoid transplantation |
| 1.5 mL microtube | Axygen | MCT-150-C | |
| LT1 transfection reagent | Mirus Bio | MIR 2300 | |
| murine EGF(epidermal growth factor) | Peprotech | 315-09 | stock concentration: 100 µg/mL |
| N-acetyl-L-cysteine | Sigma | A9165 | stock concentration: 200 mM |
| Nicotinamide | Sigma | N0636 | stock concentration: 1M |
| Opti-MEM | Gibco | 31985070 | |
| pCMV.R 8.74 | Addgene | 22036 | Packaging plasmid |
| Penicillin/streptomycin | Gibco | 15140122 | 100X |
| pMD2.G | Addgene | 12259 | Envelope plasmid |
| Polybrene(hexadim ethrine bromide) | Sigma | H9286 | stock concentration: 2 µg/mL |
| pSiCoR | Addgene | 11579 | Lentiviral plasmid |
| Razor blade | |||
| Saline buffer | JW Pharmaceutical | ||
| SW41Ti swinging bucket rotor | Beckman Coulter | ||
| Thermolysin, Bacillus thermoproteolyticus | Millipore | 58656-2500KUCN | stock concentration: 250 KU/mL |
| Trypsin-EDTA (0.25%) | Gibco | 25200072 | |
| Ultracentrifugation tube | Beckman Coulter | 331372 | |
| Y-27632 dihydrochloride | Abmole | M1817 | stock concentration: 10 mM |
Referenzen
- Sanli, O., et al. Bladder cancer. Nature Reviews Disease Primers. 3, 17022 (2017).
- Stenzl, A., et al. Treatment of muscle-invasive and metastatic bladder cancer: update of the EAU guidelines. European Urology. 59 (6), 1009-1018 (2011).
- Barretina, J., et al. The Cancer Cell Line Encyclopedia enables predictive modelling of anticancer drug sensitivity. Nature. 483 (7391), 603 (2012).
- Caponigro, G., Sellers, W. R. Advances in the preclinical testing of cancer therapeutic hypotheses. Nature Reviews Drug Discovery. 10 (3), 179 (2011).
- Drost, J., Clevers, H. Organoids in cancer research. Nature Reviews Cancer. 18 (7), 407 (2018).
- Fatehullah, A., Tan, S. H., Barker, N. Organoids as an in vitro model of human development and disease. Nature Cell Biology. 18 (3), 246 (2016).
- Pauli, C., et al. Personalized in vitro and in vivo cancer models to guide precision medicine. Cancer discovery. 7 (5), 462-477 (2017).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- van de Wetering, M., et al. Prospective derivation of a living organoid biobank of colorectal cancer patients. Cell. 161 (4), 933-945 (2015).
- Lee, S. H., et al. Tumor evolution and drug response in patient-derived organoid models of bladder cancer. Cell. 173 (2), 515-517 (2018).
- Boj, S. F., et al. Organoid models of human and mouse ductal pancreatic cancer. Cell. 160 (1-2), 324-338 (2015).
- Huang, L., et al. Ductal pancreatic cancer modeling and drug screening using human pluripotent stem cell-and patient-derived tumor organoids. Nature Medicine. 21 (11), 1364 (2015).
- Gao, D., et al. Organoid cultures derived from patients with advanced prostate cancer. Cell. 159 (1), 176-187 (2014).
- Broutier, L., et al. Human primary liver cancer–derived organoid cultures for disease modeling and drug screening. Nature Medicine. 23 (12), 1424 (2017).
- Sachs, N., et al. A living biobank of breast cancer organoids captures disease heterogeneity. Cell. 172 (1-2), 373-386 (2018).
- Kim, S., et al. Epigenetic regulation of mammalian Hedgehog signaling to the stroma determines the molecular subtype of bladder cancer. eLife. 8, 43024 (2019).
- Shin, K., et al. Cellular origin of bladder neoplasia and tissue dynamics of its progression to invasive carcinoma. Nature Cell Biology. 16 (5), 469 (2014).
- Fu, C. L., Apelo, C. A., Torres, B., Thai, K. H., Hsieh, M. H. Mouse bladder wall injection. JoVE (Journal of Visualized Experiments). (53), e2523 (2011).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten