Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Aprovechar la turbidez y la tromboelastografía para la caracterización complementaria del coágulo
En este artículo
Resumen
La fibrina es responsable de la formación de coágulos durante la hemostasia y la trombosis. Los ensayos de turbidez y tromboelastograhy (TEG) se pueden utilizar como herramientas sinérgicas que proporcionan una evaluación complementaria de un coágulo. Estas dos técnicas juntas pueden dar más información sobre cómo las condiciones de coagulación afectan la formación de coágulos fibrina.
Resumen
La trombosis es una de las principales causas de muerte en todo el mundo. La fibrina (génica) es la proteína principal responsable de la formación de coágulos o trombosis. Por lo tanto, caracterizar la formación de coágulos de fibrina es beneficioso para el estudio de la trombosis. La turbidez y la tromboelastografía (TEG) son ensayos in vitro ampliamente utilizados para monitorear la formación de coágulos. La turbidez mide dinámicamente la transmitancia de luz a través de una estructura de coágulo de fibrina a través de un espectrómetro y se utiliza a menudo en laboratorios de investigación. TEG es una técnica viscoelástica especializada que mide directamente la fuerza del coágulo sanguíneo y se utiliza principalmente en entornos clínicos para evaluar la hemostasia de los pacientes. Con la ayuda de estas dos herramientas, este estudio describe un método para caracterizar un coágulo de fibrina in vitro utilizando un modelo simplificado de coágulo de fibrinógeno/trombina. Las tendencias de datos en ambas técnicas se compararon en diversas condiciones de coagulación. Los coágulos de fibrina humana y bovina se formaron uno al lado del otro en este estudio, ya que los factores de coagulación bovina se utilizan a menudo como sustitutos de los factores de coagulación humanos en entornos clínicos y de investigación. Los resultados demuestran que el TEG y la formación de coágulos de la pista de turbidez a través de dos métodos distintos y cuando se utilizan juntos proporcionan resistencia complementaria al coágulo e información estructural de fibra a través de diversas condiciones de coagulación.
Introducción
La trombosis es la formación patológica de un coágulo de sangre en el cuerpo que bloquea la circulación sanguínea que conduce a una alta morbilidad y mortalidad en todo el mundo. Hay de 1 a 2 casos de tromboembolismo venoso y de 2 a 3 casos de enfermedades vasculares inducidas por trombosis por cada 1000 personas anualmente1,2. Aquí se presenta un método que aprovecha la tromboelastografía (TEG) y la turbidez para controlar la formación de coágulos bajo diversas condiciones de coagulación. La fibrina (ogen) es la proteína primaria que es responsable de la formación de coágulos en el cuerpo. En los últimos pasos de la cascada de coagulación, los fibrinopéptidos se cortan del fibrinógeno por trombina iniciando la polimerización de monómeros de fibrina insolubles a medida que el coágulo se desarrolla3,4. Para entender la formación de coágulos en trombosis patológica, es necesario caracterizar la formación de fibrina bajo diversas circunstancias de coagulación. Múltiples ensayos de monitorización de coágulos se han utilizado para estudiar la formación de coágulos de fibrina in vitro. El tiempo de protrombina (PT/INR) y el tiempo de tromboplastina parcial activado (aPTT) son dos ensayos clínicos comunes que miden la integridad de una vía de coagulación específica. Sin embargo, utilizan el tiempo como la única variable que no da ninguna indicación de las propiedades del coágulo físico5. La microscopía electrónica permite la visualización de la microe estructura de un coágulo de fibrina completamente formado, pero no proporciona información sobre el proceso de formación de coágulos en sí6. Entre todos los ensayos, los ensayos de turbidez y TEG ofrecen la capacidad de rastrear las características del coágulo dinámicamente a lo largo del tiempo. Estas técnicas permiten la medición de perfiles de coagulación integrales y, por lo tanto, proporcionan algún beneficio sobre otras herramientas de caracterización de coágulos de fibrina.
Específicamente, los ensayos de turbidez (o turbidimetría de coágulos) se utilizan ampliamente para la investigación y aplicaciones clínicas debido a su implementación simplista y la amplia accesibilidad de los espectrómetros en los laboratorios de investigación. Este ensayo permite una medición dinámica de la transmitancia de luz a través de un coágulo formando tomando lecturas repetitivas individuales a una longitud de onda definida (más comúnmente en una longitud de onda en el rango de 350 – 700 nm)7. La temperatura en la cámara de lectura también se puede ajustar. A medida que se forma el gel de fibrina, la cantidad de luz que viaja a través de la red de proteínas se reduce causando un aumento en la absorbancia con el tiempo. Del mismo modo, la absorbancia disminuye cuando la red de coágulos se degrada. Los ensayos de turbidez se pueden multiplexar fácilmente utilizando un formato de placa de varios pozos para permitir el cribado de muestras de alto rendimiento en placas de 96 y 384 pozos. Varias características del coágulo se pueden derivar de una curva de trazado de turbidez (medición de absorción en el tiempo) que incluyen: turbidez máxima, tiempo hasta la máxima turbidez, tiempo de inicio de la coagulación y tasa de formación de coágulos (Vmax). Una relación masa/longitud de fibra de fibrina también se puede derivar de datos de turbidez en bruto para estimar el espesor de la fibra de fibrina8,9,10.
EL TEG se utiliza principalmente en el entorno clínico para evaluar la hemostasia de los pacientes y la lelisis del coágulo. También se utiliza comúnmente en aplicaciones quirúrgicas para determinar cuándo se deben administrar medicamentos antifibrinolíticos o hemolíticos11,12. La formación de coágulos se produce dentro de una copa TEG con todos los componentes de coagulación que se añaden a la copa antes del inicio del ensayo. La copa, con coágulo en evolución, gira físicamente contra un alfiler que se inserta en su centro y un sensor de torsión electromecánica mide la creciente fuerza viscoelástica del coágulo. Este ensayo se lleva a cabo típicamente a la temperatura fisiológica de 37 oC; sin embargo, la temperatura se puede ajustar manualmente en el instrumento. La amplitud máxima (MA), la velocidad de reacción (R), el tiempo cinético (K), el ángulo de la interfaz (ángulo) y el tiempo hasta la amplitud máxima (TMA) son extraídos por el software TEG del trazado TEG dinámico. Estos valores se comparan típicamente con los rangos clínicos normales para evaluar el estado de coagulación de un paciente. Aunque TEG no es precisamente un viscosímetro, ya que mide la fuerza del coágulo en unidades milimétricas, proporciona importantes datos de coágulos viscoelásticos y funciona como una valiosa herramienta de toma de decisiones clínicas para que los médicos decidan administrar productos sanguíneos específicos y ajustar la dosificación terapéutica13. Cuando los ensayos de TEG y turbidez se utilizan juntos, proporcionan información complementaria de caracterización de coágulos, ya que la fuerza del coágulo y la cinética se extraen fácilmente de TEG y se puede acceder al grosor de la fibra de fibrina mediante mediciones de turbidez óptica.
Como la fibrina es un componente crítico de un coágulo de sangre, la caracterización de coágulos de fibrina bajo diversas condiciones de formación de coágulos puede proporcionar información valiosa sobre cómo una variable específica contribuye al proceso de formación de coágulos y a las propiedades definitivas del coágulo. Comprender esto puede proporcionar orientación para el diagnóstico de trombosis y el desarrollo de terapias. Para obtener una caracterización más representativa de los coágulos de fibrina, el plasma se puede sustituir para supervisar la formación de coágulos, ya que se asemeja más a las condiciones de coagulación in vivo que un sistema de modelo simplificado de fibrinógeno/trombina. Sin embargo, debido a la naturaleza intrincada de la cascada de coagulación, la formación de coágulos utilizando plasma aumenta la complejidad, lo que hace más difícil aislar el impacto de factores individuales. El uso de un modelo simplificado de fibrinógeno/trombina evita la necesidad de iniciar toda la cascada de coagulación permitiendo el aislamiento del paso final de formación de la fibrina. Al incluir dos componentes principales de formación de fibrina (fibrinógeno y trombina), esta configuración crea una condición de formación de coágulos altamente controlada. También es importante tener en cuenta que mientras que el modelo de coágulo simplificado se utiliza aquí, este protocolo también se puede utilizar para caracterizar coágulos más complejos mediante la inclusión de factores de coagulación adicionales. En este estudio, la caracterización de coágulos de fibrina utilizando turbidez y TEG se llevan a cabo variando las concentraciones de fibrinógeno y trombina, fuerza iónica, pH y concentración total de proteínas en la solución de coagulación para imitar diferentes circunstancias de coagulación en vivo14. Los detalles relativos a estas variaciones del protocolo se han incluido en la Sección 5.
Protocolo
1. Preparación de la solución salina tampón de fosfato (PBS)
NOTA: PBS se utilizó a lo largo de este estudio, ya que los ensayos descritos no requerían la adición de calcio. Es importante tener en cuenta que al agregar calcio, a menudo utilizado para recalcificar los productos sanguíneos citrated, PBS debe evitarse como calcio se sabe que precipita en tampones de fosfato.
- Haga un tampón de 0,01 M, pH 7,4 PBS mezclando cloruro sódico de 137 mM, fosfato de potasio monobásico de 1,8 mM, dibásico de fosfato sódico de 10 mM y cloruro de potasio de 2,7 mM en agua DI.
- Verifique el pH tampón utilizando una sonda de pH y ajuste el pH utilizando hidróxido de sodio o ácido clorhídrico según sea necesario.
- Utilice este PBS para la preparación de ensayos de fibrinógeno y coagulación (a menos que se especifique lo contrario).
NOTA: Se sugiere tampón para reconstituir el polvo de fibrinógeno, ya que la rehidratación en agua DI puede dar lugar a precipitación de fibrinógeno incluso a 37 oC.
2. Preparación y almacenamiento de proteínas
NOTA: A lo largo del protocolo, las concentraciones de proteínas se preparan a diferentes concentraciones de turbidez y TEG para permitir la relación consistente de sal, agua DI, PBS y otros factores residuales en las soluciones de coagulación final.
- Preparación y almacenamiento de fibrinógeno
NOTA: Los contaminantes en el fibrinógeno disponible comercialmente incluyen una cantidad significativa de factor XIII, cantidades residuales de otros factores de coagulación, tampón de almacenamiento y sales. En presencia de calcio, se sabe que el factor XIII reticula la red de coágulos de fibrina. Este efecto contribuye a una estructura de coágulos apretada y a una mayor fuerza del coágulo que afecta a la caracterización de la fibrina. Los kits de actividad disponibles comercialmente se pueden utilizar para determinar los niveles de factor activo XIIIa. Para minimizar la variabilidad causada por el factor XIIIa, los experimentos deben diseñarse con la exclusión de calcio o se deben incorporar en este protocolo los experimentos o pasos adicionales para eliminar el factor XIIIa. Además, se debe evaluar la sal de almacenamiento de proteínas y el tipo de tampón y, si es necesario, se puede realizar diálisis para transferirse a un tampón de trabajo de ensayo preferido.- Pesar y alícuota de fibrinógeno liofilizado en polvo (bovino o humano) en tubos de 2 ml a 20 mg de proteína por tubo y almacenar alícuotas a -20 oC durante un máximo de 6 meses.
- Permita que la alícuota de fibrinógeno se aclimate a RT (temperatura ambiente) durante 10 minutos el día del experimento. Reconstituir el fibrinógeno añadiendo 600 l de PBS a la alícuota 20 min antes de su uso.
- Tomar 10 ml de fibrinógeno y diluirlo con 190 s de PBS en una placa UV transparente de 96 pocillos o una cubeta. Determinar la concentración de fibrinógenos tomando la absorbancia a 280 nm a través de un espectrómetro comercial y su software.
- Calcular la concentración de fibrinógenos (mg/ml) utilizando la ley de cerveza. Preparar 12 mg/ml (para ensayos de turbidez) y 3,2 mg/ml (para TEG) soluciones de stock de fibrinógeno por dilución adicional con PBS (a menos que se especifique lo contrario).
NOTA: Determinación de la concentración de fibrinógenos (mg/ml) por la ley de cerveza: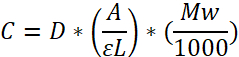
Coeficiente de extinción molar: 513.400 L mol-1 cm ɛ -1 a 280 nm; Longitud de trayecto (L); Factor de dilución (D); El peso molecular (MW) a 340.000 Da. se deriva multiplicando E0,1% a 1,51 (280 nm) (coeficiente de extinción, dado por el proveedor) con MW.
- Preparación y almacenamiento de la trombina
- Reconstituir la trombina liofilizada (bovina o humana, 1000 U en 200 ml de agua desionizada (DI) para hacer 200 l de solución de trombina U/ml de 5000 U/ml.
- Haga alícuotas de 5 l (20 U/tubo) de la solución y mantenga las alícuotas congeladas a 20 oC.
- Descongelar las alícuotas de trombina en RT durante 15 minutos el día del experimento y hacer la solución de trabajo de trombina diluyéndola a 20 U/ml para ensayos de turbidez y 18 U/ml para TEG con agua DI (a menos que se especifique lo contrario).
NOTA: Se deben tomar precauciones para mantener la actividad enzimática que se puede lograr manteniendo enzimas en el hielo durante la descongelación y el uso; sin embargo, no se observó ninguna reducción en la actividad de la trombina cuando se utilizó directamente después de descongelar en RT.
3. Turbidez
- Utilice cualquier espectrómetro disponible comercialmente que tenga un rango de absorbancia de 350 - 700 nm y un software correspondiente para monitorear la turbidez del coágulo a lo largo del tiempo (ver Tabla de Materiales).
- Encienda el espectrómetro y abra el software de análisis correspondiente.
- Seleccione la placa 1 y abra la pestaña de configuración de la placa. Haga clic en el modo ABS y Kinetic para supervisar una lectura de absorbancia dinámica a lo largo del tiempo.
- Seleccione 550 nm (o cualquier valor en el rango de 350 – 700 nm) en la pestaña de longitud de onda y ajuste el tiempo de ejecución total para que sea de 60 min con un intervalo de 30 s en la pestaña de sincronización. Seleccione pozos de interés para la lectura resaltando los pozos. Ajuste otros ajustes si es necesario.
NOTA: La selección de una longitud de onda en el extremo inferior del rango (alrededor de 350 nm) aporta una mejor sensibilidad, pero la absorbancia también podría superar el límite de detección del espectrómetro. La longitud de onda más utilizada para la medición de turbidez es 405 nm en la literatura; sin embargo, este protocolo utiliza 550 nm para asegurarse de que los valores de turbidez dinámicos están dentro del límite de detección para todos los experimentos. El intervalo de lectura seleccionado debe ser lo más corto posible para alcanzar el nivel más alto de sensibilidad al ensayo. Esto dependerá del espectrómetro y el número de pozos que se leen durante un ensayo dado. - Tome una placa UV transparente de 96 pozos. Pipetear PBS de 140 l en un pozo seleccionado para la lectura. Añadir y mezclar 10 l de trombina (20 U/ml) en el pozo.
NOTA: No utilice placas de ensayo de alta unión para minimizar la unión de proteínas inespecíficos a la superficie del pozo. Esto podría afectar la dispersión de proteínas en la solución y dar lugar a una alta variabilidad del ensayo. - Inicie la coagulación inmediatamente añadiendo 50 ml de fibrinógeno (12 mg/ml) en el pozo para obtener una solución de coagulación de 200 l con una concentración final de fibrinógeno de 3 mg/ml y 1 trombina U/ml. Mezclar el contenido en el pozo pipeteando hacia arriba y hacia abajo cinco veces teniendo cuidado para evitar la creación de burbujas en la solución, ya que afectarán la absorción por dispersión de la luz.
NOTA: Utilice una pipeta multicanal cuando ejecute varias muestras de coágulos en la misma placa al mismo tiempo. Registre las diferencias de tiempo entre los pozos y el período de tiempo anterior a la primera lectura del instrumento para compensar los tiempos de coagulación. - Coloque la placa de 96 pozos en el soporte y haga clic en Iniciar en el software para iniciar la lectura de turbidez en RT.
NOTA: Si se lleva a cabo el ensayo a una temperatura elevada, el espectrómetro, la placa y los reactivos deben mantenerse a la temperatura deseada antes del inicio de la coagulación. - Una vez completado, recupere los datos de turbidez y obtenga una curva de trazado de turbidez trazando el cambio de absorbancia con el tiempo en un software de trazado.
- Derive TurbMax (máxima turbidez indicativa del espesor de la fibra de fibrina y la densidad de la red de fibrina) tomando el valor máximo de absorbancia de la curva con el tiempo.
NOTA: La relación masa/longitud de la fibra de fibrina se puede calcular a partir de valores de turbidez utilizando la ecuación proporcionada en el siguiente manuscrito8. - Calcula la turbidez máxima del 90% multiplicando TurbMax por un 90%. Derive El tiempo detubo calculando el tiempo desde el inicio de la coagulación hasta la turbidez máxima del 90%.
NOTA: El tiempo hasta un 90% de turbidez máxima es una métrica más fiable que el tiempo hasta la turbidez máxima absoluta, ya que representa mejor el tiempo de coágulo al eliminar el período de formación de coágulos final altamente variable. También se pueden extraer de los trazados de turbidez parámetros de coagulación como el tiempo de inicio del coágulo (tiempo desde el inicio de la prueba hasta cuando la absorción comienza a aumentar) y la tasa de formación de coágulos (Vmax, la pendiente más grande de la región lineal en la curva de trazado de turbidez).
4. Tromboelastografía (TEG)
- Encienda el analizador de tromboelastógrafo y espere a que la temperatura se estabilice a 37 oC.
- Open TEG - software. Una vez que haya iniciado sesión, cree un nombre de experimento en la sección ID.
- Realice una prueba electrónica para todos los canales siguiendo las indicaciones del software en pantalla. Vuelva a colocar la palanca en la posición de carga una vez que se completen todas las comprobaciones.
NOTA: Se requiere una prueba electrónica TEG que debe realizarse cada vez que utilice el instrumento. Los ensayos de control de coagulación TEG (utilizando controles de nivel 1 y nivel 2 de TEG) son necesarios a intervalos sugeridos por el fabricante cuando se utilizan para muestras clínicas. - Haga clic en la pestaña TEG, introduzca información de muestra para los canales que se utilizarán. Coloque una taza TEG transparente sin recubrimiento en su canal correspondiente. Deslice el portaobjetos hacia arriba y presione la parte inferior de la copa 5 veces para fijar el pasador a la varilla de torsión. Baje el soporte y presione la copa hacia abajo en la base del portador hasta que "haga clic".
- Pipetear 20 l de solución de trombina (18 U/ml) en la copa TEG. Inicie la coagulación inmediatamente añadiendo 340 ml de fibrinógeno (3,2 mg/ml) en la copa TEG para obtener una solución de coagulación de 360 l con una concentración final de fibrinógeno de 3 mg/ml y trombina de 1 U/ml en la copa. Mezclar el contenido pipeteando hacia arriba y hacia abajo cinco veces.
NOTA: Durante este paso se deben añadir posibles factores de coagulación u otros componentes de interés, teniendo cuidado de mantener siempre un volumen final de 360 l en la copa TEG. - Deslice el portaobjetos cargado hacia arriba, mueva la palanca a la posición de lectura y haga clic en Iniciar en el software para iniciar la lectura teg.
- Una vez que teg se haya completado (después de aproximadamente una hora), recupere los parámetros TEG y obtenga una curva de seguimiento TEG trazando amplitud a lo largo del tiempo en un software de trazado.
- Recoja MA como TEGMax (la amplitud máxima es indicativa de la fuerza del coágulo) y TMA comotiempo TEG (tiempo a la amplitud máxima) del software.
NOTA: MA es calculada por el software como la amplitud máxima en el momento en que la amplitud tiene menos de una desviación del 5% durante un período de tiempo de 3 minutos. El TMA se determina como el tiempo desde la velocidad máxima de generación del trombo (cerca del punto de división) al MA. Otros parámetros también pueden ser útiles para evaluar al realizar el análisis de coágulos. Algunos ejemplos de estos parámetros incluyen: tiempo R (el tiempo desde el inicio de la prueba hasta cuando la amplitud alcanza los 2 mm), K (el tiempo desde el final de R hasta cuando la amplitud alcanza los 20 mm), alfa (pendiente de línea entre R y K) y CLT (tiempo de lisis de coágulo).
5. Caracterización de fibrina bajo diferentes condiciones de coagulación
NOTA: Realizar experimentos de caracterización de fibrina modulando una variable específica en las soluciones de coagulación tales como: concentraciones de fibrinógeno y trombina, fuerza iónica, pH, y concentraciones totales de proteínas. Las preparaciones experimentales con estas variables de ejemplo se describen en esta sección; sin embargo, otros factores de coagulación y condiciones de interés también pueden ser sustituidos. Seleccione cuidadosamente un sistema de búfer adecuado teniendo en cuenta cada requisito de ensayo único. Para los ensayos de turbidez y TEG, incluya un control solo de búfer para garantizar una resta de fondo precisa mientras analiza el efecto de estas variables.
- Concentración variable de fibrinógeno (1, 2, 3, 4, 5 mg/ml)
- Ajuste el paso 2.1.4 para preparar el stock de fibrinógeno en diferentes concentraciones (4, 8, 12, 16, 20 mg/ml para ensayos de turbidez y 1.1, 2.1, 3.2, 4.2, 5.3 mg/ml para TEG).
- Ajuste el paso 3.6 para "añadir fibrinógeno de 50 l (4, 8, 12, 16, 20 mg/ml) en múltiples pozos de la placa de 96 bien" para ensayos de turbidez.
- Ajuste el paso 4.5 para "añadir fibrinógeno de 340 l (1.1, 2.1, 3.2, 4.2, 5.3 mg/ml) en tazas TEG claras" para TEG.
- Concentración variable de trombina (0,1, 0,3, 0,6, 0,8, 1, 2,5, 5, 10 U/ml)
- Ajuste el paso 2.2.3 para preparar el stock de trombina a diferentes concentraciones (2, 6, 12, 16, 20, 50, 100, 200 U/ml para ensayos de turbidez y 1,8, 5,4, 10,8, 14,4, 18, 45, 90, 180 U/ml para TEG).
- Ajuste el paso 3.5 para "añadir trombina de 10 l (2, 6, 12, 16, 20, 50, 100, 200 U/ml) en múltiples pozos de la placa de 96 bien" para ensayos de turbidez.
- Ajuste el paso 4.5 a "pipetea trombina de 20 l (1,8, 5,4, 10,8, 14,4, 18, 45, 90, 180 U/ml) en tazas TEG claras" para TEG.
- Concentración de resistencia iónica (0.05, 0.13, 0.14, 0.15, 0.16, 0.17 y 0.3 M)
- Disolver cloruro de sodio (21, 101, 111, 121, 131, 141 y 271 mM) junto con 1,8 mM de fosfato de potasio monobásico, fosfato sódico dibásico de 10 mM y cloruro de potasio de 2,7 mM en agua DI para hacer soluciones de 0,01 M PBS con diferentes concentraciones iónicas.
- Ajuste el paso 1.3 para utilizar PBS fabricado a diferentes concentraciones iónicas para preparar soluciones de fibrinógeno y coagulación para ensayos de turbidez y TEG.
- Variedad de pH (5,8, 6,6, 7,3, 7,4, 7,5 y 8,0)
- Disolver fosfato sódico dibásico (0,7, 3,2, 7,7, 8,1, 8,4, 9,5 mM) y fosfato de potasio monobásico (8,2, 6,0, 2,0, 1,7, 1,4, 0,5 mM) junto con 2,7 mM de cloruro de potasio y cloruro de sodio (153, 147, 138, 137, 136, 134 mM) para hacer soluciones DE 0,01 M PBS con un pH variable y una fuerza iónica final a 0,165 MM.
- Verifique el valor del pH del tampón a través de la sonda de pH y ajuste el pH si es necesario.
- Ajuste el paso 1.3 para utilizar PBS fabricado a diferentes pH para preparar fibrinógeno y solución de coagulación para ensayos de turbidez y TEG.
- Concentración de albúmina variable (0, 20, 40, 50, 60, 80, 100 mg/ml)
- Disolver 2 g de albúmina liofilizada en 500 l de PBS en RT durante 20 minutos el día del experimento.
- Determinar la concentración de albúmina utilizando el mismo procedimiento mencionado en los pasos 2.1.3 y 2.1.4 con un coeficiente de extinción molar de 43.800 L mol1 cma 1 (a 280 nm) para la albúmina.
- Preparar el stock de albúmina en diferentes concentraciones.
- Ajuste el paso 3.5 a "Pipette 40 l PBS en un pozo que esté seleccionado para leer y agregue trombina de 10 l (20 U/mL)". Ajuste el paso 3.6 a "Iniciar la coagulación inmediatamente añadiendo fibrinógeno de 50 l (12 mg/ml) con albúmina de 100 l (0, 40, 80, 100, 120, 160, 200 mg/ml) en pozos múltiples a una concentración final de 3 mg/ml de fibrinógeno, 1 trombina U/ml y 0, 20, 40, 50, 60, 80, 100 mg/ml de álbum en pozos."
- Ajuste el paso 4.5 a "Iniciar la coagulación inmediatamente añadiendo una mezcla de albúmina de 200 l (36, 72, 90, 108, 144, 180 mg/ml) y 140 l 7,7 mg/ml de fibrinógeno en vasos TEG para obtener una solución de coagulación de 360 l con una concentración final de fibrinógeno de 3 mg/ml, trombina de 1 U/ml y 0, 20, 40, 50, 60, 80, 100 mg/ml de albúmina en tazas TEG."
Resultados
Los experimentos mostrados en la Figura 1 son curvas representativas de trazado de turbidez de coágulos de fibrina humana y bovina a diferentes niveles de fibrinógeno. En la Figura 2se muestran curvas representativas de trazado de TEG para la formación de coágulos de fibrina a diferentes niveles de fibrinógeno. Ambas curvas de trazado demuestran que después de un período de retraso después de la iniciación de la coagulación, la turbidez del coágulo o ...
Discusión
Este protocolo demuestra la utilización de dos herramientas de caracterización de coágulos distintas que prueban un modelo simplificado de coágulos fibrinógenos/trombina utilizando componentes disponibles comercialmente. Tanto los ensayos de TEG como los de turbidez son fáciles de llevar a cabo. No sólo proporcionan exámenes de coágulos de punto final como la formación máxima de coágulos (TurbMax y TEGMax)y los tiempos de formación de coágulos(Tiempo de turba yTiempo
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Ninguno.
Materiales
| Name | Company | Catalog Number | Comments |
| 96-Well Clear Flat Bottom UV-Transparent Microplate | Corning | 3635 | Non-treated acrylic copolymer, non-sterile |
| Albumin from human serum | Millipore Sigma | A1653 | ≥96%, lyophilized powder |
| Arium Mini Plus Ultrapure Water System | Sartorius | NA | DI water source |
| Bovine serum albumin | Millipore Sigma | A2153 | ≥96%, lyophilized powder |
| Disposable Cups and Pins for TEG 5000 (Clear) | Haemonetics | REF 6211 | |
| Fibrinogen, Bovine Plasma | Millipore Sigma | 341573 | contains more than 95% clottable protein |
| Fibrinogen, Plasmingogen-Depleted, Human Plasma | Millipore Sigma | 341578 | Contains ≥ 95% clottable proteins. |
| Phosphate buffered saline | Millipore Sigma | P3813 | Powder, pH 7.4, for preparing 1 L solutions |
| Potassium chloride | Millipore Sigma | 60130 | ≥99.5% purity |
| Potassium phosphate monobasic | Millipore Sigma | P9791 | ≥98% purity |
| SevenEasy pH Meter | Mettler Toledo | S20 | |
| Sodium chloride | Millipore Sigma | 71378 | ≥99.5% purity |
| Sodium phosphate dibasic | Millipore Sigma | 71636 | ≥99.5% purity |
| SpectraMax M5 multi-detection microplate reader system | Molecular Devices | M5 | |
| TEG 5000 Thrombelastograph Hemostasis analyzer system | Haemonetics | 07-022 | |
| Thrombin, Bovine | Millipore Sigma | 605157 | |
| Thrombin, Human Plasma, High Activity | Millipore Sigma | 605195 |
Referencias
- Beckman, M. G., Hooper, W. C., Critchley, S. E., Ortel, T. L. Venous Thromboembolism. A Public Health Concern. American Journal of Preventive Medicine. 38, 495-501 (2010).
- Goldhaber, S. Z., Bounameaux, H. Pulmonary embolism and deep vein thrombosis. The Lancet. 379 (9828), 1835-1846 (2012).
- Weisel, J. W., Litvinov, R. I. Mechanisms of fibrin polymerization and clinical implications. Blood. 121 (10), 1712-1719 (2013).
- Weisel, J. W. Fibrin assembly. Lateral aggregation and the role of the two pairs of fibrinopeptides. Biophysical Journal. 50 (6), 1079-1093 (1986).
- Tripathi, M. M., et al. Clinical evaluation of whole blood prothrombin time (PT) and international normalized ratio (INR) using a Laser Speckle Rheology sensor. Scientific Reports. 7 (1), 1-8 (2017).
- Ryan, E. A., Mockros, L. F., Weisel, J. W., Lorand, L. Structural origins of fibrin clot rheology. Biophysical Journal. 77 (5), 2813-2826 (1999).
- Carr, M. E., Hermans, J. Size and Density of Fibrin Fibers from Turbidity. Macromolecules. 11 (1), 46-50 (1978).
- Carr, M. E., Shen, L. L., Hermans, J. A. N., Chapel, H. . Mass-Length Ratio of Fibrin Fibers from Gel Permeation and Light Scattering. 16, 1-15 (1977).
- Gabriel, D. A., Muga, K., Boothroyd, E. M. . The Effect of Fibrin Structure on Fibrinolysis. , 24259-24263 (1992).
- Wolberg, A. S., Gabriel, D. A., Hoffman, M. Analyzing fibrin clot structure using a microplate reader. Blood Coagulation and Fibrinolysis. 13 (6), 533-539 (2002).
- da Luz, L. T., Nascimento, B., Rizoli, S. Thrombelastography (TEG): practical considerations on its clinical use in trauma resuscitation. Scandinavian Journal of Trauma, Resuscitation and Emergency Medicine. 21 (1), 29 (2013).
- Whitten, C. W., Greilich, P. E. Thromboelastography: past, present, and future . Anesthesiology: The Journal of the American Society of Anesthesiologists. 92 (5), 1223-1225 (2000).
- Ranucci, M., Laddomada, T., Ranucci, M., Baryshnikova, E. Blood viscosity during coagulation at different shear rates. Physiological Reports. 2 (7), 1-7 (2014).
- Zeng, Z., Fagnon, M., Nallan Chakravarthula, T., Alves, N. J. Fibrin clot formation under diverse clotting conditions: Comparing turbidimetry and thromboelastography. Thrombosis Research. 187, 48-55 (2020).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados