É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Alavancando a Turbidez e a Tromboelastografia para Caracterização Complementar do Coágulo
Neste Artigo
Resumo
A fibrina é responsável pela formação de coágulos durante a hemostasia e trombose. Ensaios de turbidez e tromboelastograhy (TEG) podem ser utilizados como ferramentas sinérgicas que fornecem avaliação complementar de um coágulo. Essas duas técnicas juntas podem dar mais informações sobre como as condições de coagulação afetam a formação de coágulos fibrinas.
Resumo
A trombose é a principal causa de morte em todo o mundo. Fibrin(ogen) é a proteína principal responsável pela formação de coágulos ou trombose. Portanto, caracterizar a formação de coágulos fibrinas é benéfico para o estudo da trombose. A turbidez e a tromboelastografia (TEG) são ambos ensaios in vitro amplamente utilizados para monitorar a formação de coágulos. A turbidez mede dinamicamente a transmissão da luz através de uma estrutura de coágulos de fibrina através de um espectrômetro e é frequentemente usada em laboratórios de pesquisa. O TEG é uma técnica viscoelástica especializada que mede diretamente a força do coágulo sanguíneo e é utilizada principalmente em ambientes clínicos para avaliar a hemostasia dos pacientes. Com a ajuda dessas duas ferramentas, este estudo descreve um método para caracterizar um coágulo de fibrina in vitro usando um modelo simplificado de coágulo fibrinogênio/trombina. As tendências de dados em ambas as técnicas foram comparadas em várias condições de coagulação. Os coágulos de fibrina humana e bovina foram formados lado a lado neste estudo, pois os fatores de coagulação bovina são frequentemente usados como substitutos de fatores de coagulação humana em ambientes clínicos e de pesquisa. Os resultados demonstram que o TEG e a turbidez acompanham a formação do coágulo por meio de dois métodos distintos e, quando utilizados em conjunto, fornecem informações estruturais complementares de resistência ao coágulo e fibras em diversas condições de coagulação.
Introdução
Trombose é a formação patológica de um coágulo sanguíneo no corpo que bloqueia a circulação sanguínea levando à alta morbidade e mortalidade em todo o mundo. Há 1 a 2 casos de tromboembolismo venoso e 2 a 3 casos de doenças vasculares induzidas por trombose por 1000 pessoas anualmente1,,2. Apresentado aqui é um método que aproveita a tromboelastografia (TEG) e a turbidez para monitorar a formação de coágulos em várias condições de coagulação. Fibrin(ogen) é a proteína primária responsável pela formação de coágulos no corpo. Nas etapas finais da cascata de coagulação, as fibrinopeptídeos são cortadas do fibrinogênio por trombina iniciando a polimerização de monômeros fibrinos insolúveis à medida que o coágulo se desenvolve3,,4. Para compreender a formação de coágulos em trombose patológica, é necessário caracterizar a formação de fibrinas em diversas circunstâncias de coagulação. Vários ensaios de monitoramento de coágulos foram utilizados para estudar a formação de coágulos de fibrina in vitro. Tempo de protrombina (PT/INR) e tempo de tromboplastina parcial ativado (aPTT) são dois ensaios clínicos comuns que medem a integridade de uma via específica de coagulação. No entanto, eles usam o tempo como a única variável que não dá nenhuma indicação de propriedades de coágulo físico5. A microscopia eletrônica permite a visualização da microestruturn de um coágulo fibrina completamente formado, mas não fornece informações sobre o processo de formação de coágulos em si6. Entre todos os ensaios, ensaios de turbidez e TEG oferecem a capacidade de rastrear as características do coágulo dinamicamente ao longo do tempo. Essas técnicas permitem a medida de perfis abrangentes de coagulação e, portanto, proporcionam algum benefício sobre outras ferramentas de caracterização de coágulos fibrinos.
Especificamente, ensaios de turbidez (ou turbidimetria de coágulo) são amplamente utilizados para pesquisas e aplicações clínicas devido à sua implementação simplista e à ampla acessibilidade de espectrômetros em laboratórios de pesquisa. Este ensaio permite uma medição dinâmica da transmissão de luz através de um coágulo formador, fazendo leituras repetitivas individuais em um comprimento de onda definido (mais comumente em um comprimento de onda na faixa de 350 – 700 nm)7. A temperatura na câmara de leitura também pode ser ajustada. À medida que o gel fibrin se forma, a quantidade de luz que viaja através da rede proteica é reduzida causando um aumento na absorção ao longo do tempo. Da mesma forma, a absorvância diminui quando a rede de coágulos se degrada. Ensaios de turbidez podem ser facilmente multiplexados usando um formato de placa multi-poço para permitir uma triagem de amostra de alto rendimento em placas de 96 e 384 poços. Várias características do coágulo podem ser derivadas de uma curva de rastreamento de turbidez (absorvância ao longo do tempo) que incluem: turbidez máxima, tempo para turbidez máxima, tempo para início do coágulo e taxa de formação de coágulos (Vmax). Uma relação de massa/comprimento de fibra fibrina também pode ser derivada de dados de turbidez bruta para estimar a espessura da fibra fibrina8,,9,,10.
O TEG é utilizado principalmente no cenário clínico para avaliar a hemostasia e a lise do coágulo dos pacientes. Também é comumente usado em aplicações cirúrgicas para determinar quando drogas anti-fibriníticas ou produtos sanguíneos hemostáticos devem ser administrados11,12. A formação de coágulos ocorre dentro de um copo TEG com todos os componentes de coagulação sendo adicionados ao copo antes do início do ensaio. O copo, com coágulo em evolução, gira fisicamente contra um pino que é inserido em seu centro e um sensor de torção eletromecânica mede a crescente força viscoelástica do coágulo. Este ensaio é normalmente realizado a temperatura fisiológica de 37 °C; no entanto, a temperatura pode ser ajustada manualmente no instrumento. A amplitude máxima (MA), a taxa de reação (R), o tempo cinético (K), o ângulo α (Ângulo) e o tempo de amplitude máxima (TMA) são extraídos pelo software TEG a partir do rastreamento DINÂMICO TEG. Esses valores são tipicamente comparados com faixas normais clínicas para avaliar o estado de coagulação do paciente. Embora o TEG não seja precisamente um viscométrico, pois mede a força do coágulo em unidades milimétricas, ele fornece dados importantes de coágulos viscoelásticos e funciona como uma valiosa ferramenta de tomada de decisão clínica para que os médicos decidam administrar produtos sanguíneos específicos e ajustar a dosagem terapêutica13. Quando os ensaios teg e turbidez são utilizados em conjunto, eles fornecem informações complementares de caracterização de coágulos, pois a força do coágulo e a cinética são facilmente extraídas do TEG e a espessura da fibra fibrina pode ser acessada por medições ópticas de turbidez.
Como a fibrina é um componente crítico de um coágulo sanguíneo, a caracterização do coágulo fibrina em diversas condições de formação de coágulos pode fornecer uma visão valiosa de como uma variável específica contribui para o processo de formação de coágulos e propriedades finais do coágulo. Entender isso pode fornecer orientação para o diagnóstico de trombose e o desenvolvimento da terapêutica. Para obter uma caracterização mais representativa do coágulo fibrina, o plasma pode ser substituído para monitorar a formação de coágulos, pois se assemelha a condições de coagulação in vivo mais de perto do que um sistema simplificado de modelo fibrinogênio/trombina. No entanto, devido à natureza intrincada da cascata de coagulação, a formação de coágulos usando plasma aumenta a complexidade, tornando mais difícil isolar o impacto de fatores individuais. A utilização de um modelo simplificado de fibrinogen/trombina impede a necessidade de iniciar toda a cascata de coagulação permitindo o isolamento da etapa final de formação de fibrinas. Ao incluir dois componentes principais de formação de fibrinas (fibrinogênio e trombina), esta configuração cria uma condição de formação de coágulos altamente controlada. Também é importante notar que, embora o modelo de coágulo simplificado seja utilizado aqui, este protocolo também pode ser utilizado para caracterizar coágulos mais complexos, incluindo fatores adicionais de coagulação. Neste estudo, a caracterização do coágulo fibrina utilizando turbidez e TEG é realizada por diferentes concentrações de fibrinogênio e trombina, força iônica, pH e concentração total de proteínas na solução de coagulação para imitar diferentes circunstâncias de coagulação ao vivo14. Os detalhes sobre essas variações ao protocolo foram incluídos na Seção 5.
Protocolo
1. Preparação de soro fisiológico tampão fosfato (PBS)
NOTA: A PBS foi utilizada ao longo deste estudo, pois os ensaios descritos não necessitaram da adição de cálcio. É importante notar que ao adicionar cálcio, muitas vezes utilizado para recalcar produtos sanguíneos avaliados, a PBS deve ser evitada, pois o cálcio é conhecido por precipitar em tampões fosfatos.
- Faça um tampão de 0,01 M, pH 7.4 PBS misturando cloreto de sódio de 137 mM, 1,8 mM de fosfato de potássio monobásico, 10 mM de fosfato de sódio dibasic e 2,7 mM de cloreto de potássio em água DI.
- Verifique o pH tampão usando uma sonda de pH e ajuste o pH usando hidróxido de sódio ou ácido clorídrico, conforme necessário.
- Use este PBS para a preparação de ensaios fibrinogênio e coagulação (a menos que especificado de outra forma).
NOTA: O buffer é sugerido a reconstituir o pó fibrinogênio, uma vez que a reidratação na água DI pode resultar em precipitação fibrinogênio mesmo a 37 °C.
2. Preparação e armazenamento de proteínas
NOTA: Ao longo do protocolo, as concentrações de estoque de proteínas são preparadas em diferentes concentrações para turbidez e TEG para permitir a proporção consistente de sal, água DI, PBS e outros fatores residuais nas soluções finais de coagulação.
- Preparação e armazenamento de fibrinogênio
NOTA: Os contaminantes em fibrinogen disponíveis comercialmente incluem uma quantidade significativa de fator XIII, quantidades residuais de outros fatores de coagulação, tampão de armazenamento e sais. Na presença de cálcio, o fator XIII é conhecido por cruzar a rede de coágulos fibrinas. Esse efeito contribui para uma estrutura de coágulos mais apertada e maior força do coágulo, afetando a caracterização da fibrina. Kits de atividade disponíveis comercialmente podem ser usados para determinar os níveis XIIIA do fator ativo. Para minimizar a variabilidade causada pelo fator XIIIa, os experimentos devem ser projetados com a exclusão do cálcio ou etapas adicionais para remover o fator XIIIa deve ser incorporado neste protocolo. Além disso, o sal de armazenamento de proteínas e o tipo de tampão devem ser avaliados e, se necessário, a diálise pode ser realizada para transferência para um amortecedor de ensaio preferencial.- Pesar e aliquot lyophilized fibrinogen em pó (bovino ou humano) em tubos de 2 mL a 20 mg de proteína por tubo e armazenar alíquotas a -20 °C por até 6 meses.
- Deixe que a alíquota de fibrinogen se aclimata até RT (temperatura ambiente) por 10 minutos no dia do experimento. Reconstituir fibrinogen adicionando 600 μL de PBS à alíquota de 20 minutos antes do uso.
- Pegue 10 μL de fibrinogênio e dilua-o com 190 μL de PBS em uma placa UV transparente de 96 poços ou um cuvette. Determine a concentração de fibrinogênio tomando absorvância a 280 nm através de um espectrômetro comercial e seu software.
- Calcule a concentração de fibrinogênio (mg/mL) usando a lei da cerveja. Prepare 12 mg/mL (para ensaios de turbidez) e 3,2 mg/mL (para TEG) soluções de estoque fibrinogênio por diluição adicional com PBS (salvo especificação em contrário).
NOTA: Determinação de concentração de fibrinogênio (mg/mL) pela lei de Beer: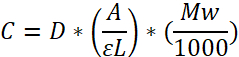
Coeficiente de extinção molar: ɛ = 513.400 L mol-1 cm-1 a 280 nm; Comprimento de caminho (L); Fator de diluição (D); Peso Molecular (MW) = 340.000 Da. ɛ é derivado pela multiplicação de E0,1% = 1,51 (280 nm) (coeficiente de extinção, dado pelo fornecedor) com MW.
- Preparação e armazenamento de trombina
- Trombina liofilizada reconstituída (bovina ou humana, 1000 U) em 200 μL de água desionizada (DI) para fazer 200 μL de 5000 U/mL de solução de estoque de trombina.
- Faça 5 μL (20 U/tube) alíquotas da solução e mantenha as alíquotas congeladas a −20 °C.
- Descongele as alíquotas de trombina na RT por 15 minutos no dia do experimento e faça a solução de trabalho de trombina diluindo-a para 20 U/mL para ensaios de turbidez e 18 U/mL para TEG com água DI (a menos que especificada de outra forma).
NOTA: Devem ser tomadas precauções para manter a atividade enzimada que pode ser realizada mantendo enzimas no gelo durante o descongelamento e uso; no entanto, não foi observada redução da atividade da trombina quando utilizada diretamente após o descongelamento na RT.
3. Turbidez
- Use qualquer espectrômetro comercialmente disponível que tenha uma faixa de absorção de 350 a 700 nm e um software correspondente para monitorar a turbidez do coágulo ao longo do tempo (ver Tabela de Materiais).
- Ligue o espectrômetro e abra o software de análise correspondente.
- Selecione a guia de configurações da placa 1 e abra a placa. Clique no modo ABS e no Kinetic para monitorar uma leitura dinâmica de absorvência ao longo do tempo.
- Selecione 550 nm (ou qualquer valor na faixa de 350 – 700 nm) na guia comprimento de onda e ajuste o tempo total de execução para 60 minutos com um intervalo de 30 s na guia de tempo. Selecione poços de interesse para leitura destacando os poços. Ajuste outras configurações, se necessário.
NOTA: Selecionar um comprimento de onda na extremidade inferior da faixa (cerca de 350 nm) traz uma melhor sensibilidade, mas a absorção também pode exceder o limite de detecção do espectrômetro. O comprimento de onda mais utilizado para a medição da turbidez é de 405 nm na literatura; no entanto, este protocolo usa 550 nm para garantir que os valores dinâmicos de turbidez estejam dentro do limite de detecção de todos os experimentos. O intervalo de leitura selecionado deve ser o mais curto possível para alcançar o mais alto nível de sensibilidade ao ensaio. Isso dependerá do espectrômetro e do número de poços que estão sendo lidos durante um determinado ensaio. - Pegue uma placa UV transparente de 96 poços. Pipeta 140 μL PBS em um poço selecionado para leitura. Adicione e misture 10 μL de trombina (20 U/mL) no poço.
NOTA: Não utilize placas de ensaio de alta ligação para minimizar a ligação de proteínas não específicas à superfície do poço. Isso pode afetar a dispersão de proteínas na solução e resultar em alta variabilidade de ensaio. - Inicie a coagulação imediatamente adicionando 50 μL de fibrinogênio (12 mg/mL) no poço para obter uma solução de coagulação de 200 μL com uma concentração final de fibrinogen de 3 mg/mL e trombina de 1 U/mL. Misture o conteúdo no poço, esvoando cinco vezes, tomando cuidado para evitar a criação de bolhas na solução, pois elas impactarão a absorção espalhando luz.
NOTA: Use uma pipeta multicanal ao executar várias amostras de coágulos na mesma placa ao mesmo tempo. Registo as diferenças de tempo entre os poços e o período de tempo anterior à primeira leitura do instrumento para compensar os tempos de coagulação. - Coloque a placa de 96 poços no suporte e clique em Iniciar no software para iniciar a leitura de turbidez no RT.
NOTA: Se realizar o ensaio a uma temperatura elevada, então o espectrômetro, placa e reagentes devem ser todos mantidos na temperatura desejada antes do início do coágulo. - Uma vez concluído, recupere os dados de turbidez e obtenha uma curva de rastreamento de turbidez plotando a mudança de absorvência ao longo do tempo em um software de plotagem.
- Deriva TurbMax (turbidez máxima indicativa de espessura de fibra fibrina e densidade da rede de fibrinas) tomando o valor máximo de absorção da curva ao longo do tempo.
NOTA: A relação massa/comprimento da fibra fibrina pode ser calculada a partir de valores de turbidez usando a equação fornecida no manuscrito a seguir8. - Calcule 90% de turbidez máxima multiplicando a TurbMax por 90%. DerivarTurb Time por tempo computacional desde a iniciação do coágulo até 90% de turbidez máxima.
NOTA: O tempo até 90% de turbidez máxima é uma métrica mais confiável do que o tempo para a turbidez máxima absoluta, pois representa melhor o tempo de coágulo, eliminando o período de formação final de coágulos altamente variável. Parâmetros adicionais de coagulação, como o tempo de início do coágulo (tempo do início do teste para quando a absorção começa a aumentar), e a taxa de formação de coágulos (Vmax, a maior inclinação da região linear na curva de rastreamento de turbidez) também podem ser extraídos dos traçados da turbidez.
4. Tromboelastografia (TEG)
- Ligue o analisador de tromboelastograma e aguarde a temperatura se estabilizar a 37 °C.
- Abra o TEG - software. Uma vez logado, crie um nome de experimento na seção ID.
- Realize um teste eletrônico para todos os canais seguindo as instruções de software na tela. Coloque a alavanca de volta à posição de carga assim que todas as verificações estiverem completas.
NOTA: É necessário um teste eletrônico TEG e deve ser realizado sempre que estiver usando o instrumento. Os ensaios de controle de coagulação TEG (utilizando controles teg nível 1 e nível 2) são necessários no fabricante regular sugerido intervalos quando utilizados para amostras clínicas. - Clique na guia TEG, insira informações de amostra para canais que serão usados. Coloque um copo TEG claro e não revestido em seu canal correspondente. Deslize o porta-aviões até a parte superior e pressione o fundo do copo 5 vezes para fixar o pino na haste de torção. Abaixe o porta-aviões e pressione o copo para baixo na base do porta-aviões até que ele "clique".
- Pipeta 20 μL de solução de trombina (18 U/mL) no copo TEG. Inicie a coagulação imediatamente adicionando 340 μL de fibrinogênio (3,2 mg/mL) no copo TEG para obter uma solução de coagulação de 360 μL com uma concentração final de fibrinogen de 3 mg/mL e 1 U/mL de trombina no copo. Misture o conteúdo pipetting para cima e para baixo cinco vezes.
NOTA: Fatores potenciais de coagulação ou outros componentes de interesse devem ser adicionados durante esta etapa, tendo o cuidado de manter sempre um volume final de 360 μL no copo TEG. - Deslize o porta-copo carregado para cima, mova a alavanca para a posição de leitura e clique em Iniciar no software para iniciar a leitura TEG.
- Uma vez que o TEG seja concluído (após cerca de uma hora), recupere os parâmetros TEG e obtenha uma curva de rastreamento TEG, plotando amplitude ao longo do tempo em um software de plotagem.
- Colete MA como TEGMax (amplitude máxima é indicativo de força de coágulo) e TMA comoTEMPO TEG (tempo de amplitude máxima) do software.
NOTA: O MA é calculado pelo software como a amplitude máxima no momento em que a amplitude tem menos de 5% de desvio durante um período de 3 minutos de tempo. O TMA é determinado como o tempo desde a taxa máxima de geração de trombos (perto do ponto dividido) até o MA. Outros parâmetros também podem ser úteis para avaliar ao realizar a análise do coágulo. Alguns exemplos desses parâmetros incluem: R-time (o tempo do início do teste para quando a amplitude atinge 2 mm), K (o tempo do final de R para quando a amplitude atinge 20 mm), alfa (inclinação da linha entre R e K) e CLT (tempo de lise de coágulo).
5. Caracterização fibrina em diferentes condições de coagulação
NOTA: Realizar experimentos de caracterização fibrina modulando uma variável específica nas soluções de coagulação como: concentrações de fibrinogênio e trombina, resistência iônica, pH e concentrações totais de proteínas. Preparações experimentais com essas variáveis de exemplo são descritas nesta seção; no entanto, outros fatores de coagulação e condições de interesse também podem ser substituídos. Selecione cuidadosamente um sistema de buffer adequado levando em consideração cada requisito único de ensaio. Para ensaios de turbidez e TEG, inclua um controle somente de buffer para garantir uma subtração de fundo precisa enquanto analisa o efeito dessas variáveis.
- Concentração de fibrinogênio variado (1, 2, 3, 4, 5 mg/mL)
- Ajuste a etapa 2.1.4 para preparar o estoque de fibrinogênio em diferentes concentrações (4, 8, 12, 16, 20 mg/mL para ensaios de turbidez e 1.1, 2.1, 3.2, 4.2, 5.3 mg/mL para TEG).
- Ajuste a etapa 3.6 para "adicionar 50 μL fibrinogen (4, 8, 12, 16, 20 mg/mL) em vários poços do poço 96" para ensaios de turbidez.
- Ajuste a etapa 4.5 para "adicionar 340 μL fibrinogen (1.1, 2.1, 3.2, 4.2, 5.3 mg/mL) em copos TEG claros" para TEG.
- Concentração de trombina variada (0,1, 0,3, 0,6, 0,8, 1, 2,5, 5, 10 U/mL)
- Ajuste a etapa 2.2.3 para preparar o estoque de trombina em diferentes concentrações (2, 6, 12, 16, 20, 50, 100, 200 U/mL para ensaios de turbidez e 1,8, 5,4, 10,8, 14,4, 18, 45, 90, 180 U/mL para TEG).
- Ajuste a etapa 3.5 para "adicionar trombina de 10 μL (2, 6, 12, 16, 20, 50, 100, 200 U/mL) em vários poços do poço 96" para ensaios de turbidez.
- Ajuste a etapa 4.5 para "pipeta 20 μL thrombin (1.8, 5.4, 10.8, 14.4, 18, 45, 90, 180 U/mL) em copos TEG claros" para TEG.
- Força iônica variada (0,05, 0,13, 0,14, 0,15, 0,16, 0,17 e 0,3 M)
- Dissolver cloreto de sódio (21, 101, 111, 121, 131, 141 e 271 mM) juntamente com 1,8 mM de fosfato de potássio monobásico, 10 mM de fosfato de sódio dibasico e cloreto de potássio de 2,7 mM em água DI para fazer soluções de 0,01 M PBS com diferentes pontos de força iônica.
- Ajuste a etapa 1.3 para usar PBS feito em diferentes pontos fortes iônicos para preparar soluções de fibrinogênio e coagulação tanto para ensaios de turbidez quanto de TEG.
- PH variado (5,8, 6,6, 7,3, 7,4, 7,5 e 8,0)
- Dissolver fosfato de sódio dibasic (0,7, 3.2, 7.7, 8.1, 8.4, 9,5 mM) e o fósforo de potássio monobásico (8.2, 6.0, 2.0, 1,7, 1,4, 0,5 mM) juntamente com cloreto de potássio de 2,7 mM e cloreto de sódio (153, 147, 138, 137, 136, 134 mM) para fazer soluções de PBS de 0,01 M com pH variado e força iônica final em 0,165 M.
- Verifique o valor do pH do buffer via sonda pH e ajuste o pH, se necessário.
- Ajuste a etapa 1.3 para usar PBS feito em pH diferente para preparar a solução de fibrinogênio e coagulação tanto para ensaios de turbidez quanto de TEG.
- Concentração de albumina variada (0, 20, 40, 50, 60, 80, 100 mg/mL)
- Dissolva 2 g de albumina liofilizada em 500 μL de PBS na RT por 20 minutos no dia do experimento.
- Determine a concentração de albumina usando o mesmo procedimento mencionado na etapa 2.1.3 e 2.1.4 com um coeficiente de extinção molar de 43.800 L mol−1 cm−1 (a 280 nm) para albumina.
- Prepare o albumina em ações em diferentes concentrações.
- Ajuste a etapa 3.5 para "Pipette 40 μL PBS em um poço selecionado para leitura e adicione trombina de 10 μL (20 U/mL)". Ajuste a etapa 3.6 para "Inicie a coagulação imediatamente adicionando fibrinogen de 50 μL (12 mg/mL) com albumina de 100 μL (0, 40, 80, 100, 120, 160, 200 mg/mL) em múltiplos poços para uma concentração final de 3 mg/mL fibrinogen, 1 U/mL thrombin e 0, 20, 40, 50, 60, 80, 100 mg/mL albumin em poços."
- Ajuste a etapa 4.5 para "Inicie a coagulação imediatamente adicionando uma mistura de albumina de 200 μL (36, 72, 90, 108, 144, 180 mg/mL) e 140 μL 7,7 mg/mL fibrinogen em copos TEG para obter uma solução de coagulação de 360 μL com concentração final de fibrinogen de 3 mg/mL, 1 U/mL thrombin e 0, 20, 40, 50, 60, 80, 100 mg/mL albumin em copos TEG."
Resultados
Os experimentos mostrados na Figura 1 são curvas representativas de rastreamento de turbidez de coágulos fibrinas humanos e bovinos em diferentes níveis de fibrinogênio. As curvas de rastreamento TEG representativas para formação de coágulos de fibrina em diferentes níveis de fibrinogênio são mostradas na Figura 2. Ambas as curvas de rastreamento demonstram que após um período de atraso após a iniciação do coágulo, a turbidez do coágulo ou a amp...
Discussão
Este protocolo demonstra a utilização de duas ferramentas distintas de caracterização de coágulos testando um modelo simplificado de coágulo fibrinogênio/trombina usando componentes disponíveis comercialmente. Tanto os ensaios teg quanto de turbidez são fáceis de conduzir. Eles não só fornecem exames de coágulos de ponto final, como a formação de coágulos max (TurbMax e TEGMax) e os tempos de formação de coágulos (TurbTime e TEGTime), mas também avaliam o pr...
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Nenhum.
Materiais
| Name | Company | Catalog Number | Comments |
| 96-Well Clear Flat Bottom UV-Transparent Microplate | Corning | 3635 | Non-treated acrylic copolymer, non-sterile |
| Albumin from human serum | Millipore Sigma | A1653 | ≥96%, lyophilized powder |
| Arium Mini Plus Ultrapure Water System | Sartorius | NA | DI water source |
| Bovine serum albumin | Millipore Sigma | A2153 | ≥96%, lyophilized powder |
| Disposable Cups and Pins for TEG 5000 (Clear) | Haemonetics | REF 6211 | |
| Fibrinogen, Bovine Plasma | Millipore Sigma | 341573 | contains more than 95% clottable protein |
| Fibrinogen, Plasmingogen-Depleted, Human Plasma | Millipore Sigma | 341578 | Contains ≥ 95% clottable proteins. |
| Phosphate buffered saline | Millipore Sigma | P3813 | Powder, pH 7.4, for preparing 1 L solutions |
| Potassium chloride | Millipore Sigma | 60130 | ≥99.5% purity |
| Potassium phosphate monobasic | Millipore Sigma | P9791 | ≥98% purity |
| SevenEasy pH Meter | Mettler Toledo | S20 | |
| Sodium chloride | Millipore Sigma | 71378 | ≥99.5% purity |
| Sodium phosphate dibasic | Millipore Sigma | 71636 | ≥99.5% purity |
| SpectraMax M5 multi-detection microplate reader system | Molecular Devices | M5 | |
| TEG 5000 Thrombelastograph Hemostasis analyzer system | Haemonetics | 07-022 | |
| Thrombin, Bovine | Millipore Sigma | 605157 | |
| Thrombin, Human Plasma, High Activity | Millipore Sigma | 605195 |
Referências
- Beckman, M. G., Hooper, W. C., Critchley, S. E., Ortel, T. L. Venous Thromboembolism. A Public Health Concern. American Journal of Preventive Medicine. 38, 495-501 (2010).
- Goldhaber, S. Z., Bounameaux, H. Pulmonary embolism and deep vein thrombosis. The Lancet. 379 (9828), 1835-1846 (2012).
- Weisel, J. W., Litvinov, R. I. Mechanisms of fibrin polymerization and clinical implications. Blood. 121 (10), 1712-1719 (2013).
- Weisel, J. W. Fibrin assembly. Lateral aggregation and the role of the two pairs of fibrinopeptides. Biophysical Journal. 50 (6), 1079-1093 (1986).
- Tripathi, M. M., et al. Clinical evaluation of whole blood prothrombin time (PT) and international normalized ratio (INR) using a Laser Speckle Rheology sensor. Scientific Reports. 7 (1), 1-8 (2017).
- Ryan, E. A., Mockros, L. F., Weisel, J. W., Lorand, L. Structural origins of fibrin clot rheology. Biophysical Journal. 77 (5), 2813-2826 (1999).
- Carr, M. E., Hermans, J. Size and Density of Fibrin Fibers from Turbidity. Macromolecules. 11 (1), 46-50 (1978).
- Carr, M. E., Shen, L. L., Hermans, J. A. N., Chapel, H. . Mass-Length Ratio of Fibrin Fibers from Gel Permeation and Light Scattering. 16, 1-15 (1977).
- Gabriel, D. A., Muga, K., Boothroyd, E. M. . The Effect of Fibrin Structure on Fibrinolysis. , 24259-24263 (1992).
- Wolberg, A. S., Gabriel, D. A., Hoffman, M. Analyzing fibrin clot structure using a microplate reader. Blood Coagulation and Fibrinolysis. 13 (6), 533-539 (2002).
- da Luz, L. T., Nascimento, B., Rizoli, S. Thrombelastography (TEG): practical considerations on its clinical use in trauma resuscitation. Scandinavian Journal of Trauma, Resuscitation and Emergency Medicine. 21 (1), 29 (2013).
- Whitten, C. W., Greilich, P. E. Thromboelastography: past, present, and future . Anesthesiology: The Journal of the American Society of Anesthesiologists. 92 (5), 1223-1225 (2000).
- Ranucci, M., Laddomada, T., Ranucci, M., Baryshnikova, E. Blood viscosity during coagulation at different shear rates. Physiological Reports. 2 (7), 1-7 (2014).
- Zeng, Z., Fagnon, M., Nallan Chakravarthula, T., Alves, N. J. Fibrin clot formation under diverse clotting conditions: Comparing turbidimetry and thromboelastography. Thrombosis Research. 187, 48-55 (2020).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados