A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
מינוף טורבידיות וטרומבולסטוגרפיה לאפיון קרישי דם משלימים
In This Article
Summary
פיברין אחראי על היווצרות קריש במהלך המוסטאזיס ופקקת. אסמים סוערים וhromboelastograhy (TEG) יכול להיות מנוצל ככלים סינרגטיים המספקים הערכה משלימה של קריש דם. שתי טכניקות אלה יחד יכולות לתת תובנה נוספת כיצד תנאי קרישה משפיעים על היווצרות קריש פיברין.
Abstract
פקקת היא סיבת מוות מובילה ברחבי העולם. פיברין (אוגן) הוא החלבון האחראי בעיקר על היווצרות קריש דם או פקקת. לכן, אפיון היווצרות קריש פיברין הוא מועיל לחקר פקקת. טורבידיות וטרומבולסטוגרפיה (TEG) הן שניהם מנוצלים באופן נרחב במבחנה אסרות לניטור היווצרות קריש. Turbidity מודד באופן דינמי את העברת האור באמצעות מבנה קריש פיברין באמצעות ספקטרומטר והוא משמש לעתים קרובות במעבדות מחקר. TEG היא טכניקה ויסקולסטית מיוחדת המודדת ישירות את עוצמת קריש הדם והוא מנוצל בעיקר בהגדרות קליניות כדי להעריך את המוסטאזיס של המטופלים. בעזרת שני כלים אלה, מחקר זה מתאר שיטה לאפיון קריש דם במבחנה פיברין באמצעות מודל קרישי פיברינוגן/טרומבין פשוט. מגמות נתונים על פני שתי הטכניקות הושוו בתנאי קרישה שונים. קרישי פיברין אנושיים ובצק נוצרו זה לצד זה במחקר זה כמו גורמי קרישת בקרישת בקר משמשים לעתים קרובות כתחליף גורמי קרישה אנושיים בהגדרות קליניות ומחקר. התוצאות מוכיחות כי TEG ו- turbidity לעקוב אחר היווצרות קריש דם באמצעות שתי שיטות נפרדות וכאשר מנוצל יחד לספק כוח קריש משלים ומידע מבני סיבים על פני תנאי קרישה מגוונים.
Introduction
פקקת היא היווצרות פתולוגית של קריש דם בגוף שחוסם את זרימת הדם המובילה לתמולות ותמותה גבוהות ברחבי העולם. ישנם 1-2 מקרים של פקקת ורידים ו 2-3 מקרים של פקקת המושרה מחלות כלי דם לכל 1000אנשים מדי שנה 1,,2. מוצג כאן היא שיטה מינוף טרומבולסטוגרפיה (TEG) וטורביות כדי לפקח על היווצרות קריש תחת תנאי קרישה שונים. פיברין (אוגן) הוא החלבון העיקרי האחראי על היווצרות קריש דם בגוף. בשלבים האחרונים של מפל קרישה, פיברינופטידים הם קצוצים פיברינוגן על ידי טרומבין ייזום הפולימר של מונומרים פיברין מסיסים כמו קרישמפתחת 3,,4. כדי להבין היווצרות קריש ים בפקקת פתולוגית, יש צורך לאפיין היווצרות פיברין בנסיבות קרישה מגוונות. מספר ניטור קרישים נעשה שימוש כדי ללמוד היווצרות קריש פיברין במבחנה. זמן פרותרומבין (PT/INR) וזמן טרומבופלסטיקן חלקי פעיל (aPTT) הם שני נושאים קליניים נפוצים המודדים את השלמות של מסלול קרישה ספציפי. עם זאת, הם משתמשים בזמן כמשתנה היחיד שלא נותן שום אינדיקציה של תכונות קריש פיזי5. מיקרוסקופאלקטרונים מאפשר הדמיה של המיקרו-מבנה של קריש פיברין שנוצר לחלוטין, אך אינו מספק מידע על תהליך יצירת הקריש עצמו6. בין כל ההתבטאויות, ההתבטאות הסוערת וה-TEG מציעות את היכולת לעקוב אחר מאפייני קריש דם באופן דינמי לאורך זמן. טכניקות אלה מאפשרות מידה של פרופילי קרישה מקיפים ולכן, לספק תועלת מסוימת על פני כלים אחרים אפיון קריש פיברין.
באופן ספציפי, תקרת טורבידיות (או turbidimetry קריש) משמש נרחב עבור מחקר ויישומים קליניים בשל הטמעתו פשטנית ואת הנגישות הרחבה של ספקטרומטרים במעבדות מחקר. אסייד זה מאפשר מדידה דינמית של שידור אור באמצעות קריש דם יוצר על ידי לקיחת קריאות חוזרות בודדות באורך גל מוגדר (הנפוץ ביותר באורך גל בטווח של 350 – 700 נק')7. ניתן גם להתאים את הטמפרטורה בתא הקריאה. כמו צורות ג'ל פיברין, כמות האור שעובר דרך רשת החלבון מופחתת גורם לעלייה בספיגה לאורך זמן. באופן דומה, הספיגה פוחתת כאשר רשת הקרישים מתדרדרת. ניתן בקלות לבצע את ההכפלה של Turbidity באמצעות תבנית צלחת מרובת בארות כדי לאפשר הקרנה של מדגם תפוקה גבוהה הן ב-96 ו-384 בארות. מספר מאפייני קריש ניתן לגזור עקומת מעקב turbidity (ספיגה לאורך מדידת זמן) הכוללים: מערבולת מקסימלית, זמן למערבולת מקסימלית, זמן לתחילת קריש, וקצב היווצרות קריש (Vmax). יחס מסה/אורך סיב פיברין יכול גם להיות נגזר מנתוני מערבולת גולמית כדי להעריךעובי סיבים פיברין 8,9,10.
TEG מנוצל בעיקר בסביבה הקלינית כדי להעריך את ההמוסטזיס של המטופלים ואת הליזה קריש. הוא משמש גם ביישומים כירורגיים כדי לקבוע מתי תרופות אנטי-פיברינוליטיות או מוצרי דם המוסאטיים צריך להינתן11,,12. היווצרות קריש מתרחשת בתוך TEG עם כל רכיבי קרישת ההתווספו לספל לפני החניכה של ההסתה. הספל, עם קריש דם מתפתח, מסתובב פיזית כנגד סיכה המוכנסת למרכזה וחיישן פיתול אלקטרומכני מודד את הכוח ההולך וגדל של הקריש. אסייפ זה מתבצע בדרך כלל בטמפרטורה הפיזיולוגית של 37 °C; עם זאת, ניתן לכוונן את הטמפרטורה באופן ידני על המכשיר. משרעת מקסימלית (MA), קצב תגובה (R), זמן קינטיקה (K), α-זווית (זווית) וזמן למשרעת מקסימלית (TMA) מופקים על-ידי תוכנת TEG ממעקב TEG דינמי. ערכים אלה מושווים בדרך כלל עם טווחים נורמליים קליניים כדי להעריך את מצב קרישה של המטופל. בעוד TEG הוא לא בדיוק viscometer, כפי שהוא מודד כוח קריש ביחידות מילימטר, זה מספק נתוני קריש ויסות ופונקציות חשובות ככלי קבלת החלטות קליניות יקרות ערך עבור רופאים להחליט לנהל מוצרי דם ספציפיים ולהתאים מינוןטיפולי 13. כאשר הן TEG והן מערבולת assays מנוצלים יחד, הם מספקים מידע אפיון קריש משלים כמו כוח קריש קינטיקה מופקים בקלות מ TEG ועובי סיבים פיברין ניתן לגשת על ידי מדידות turbidity אופטי.
כמו fibrin הוא מרכיב קריטי של קריש דם, אפיון קריש פיברין בתנאים מגוונים היווצרות קריש יכול לספק תובנה חשובה כיצד משתנה מסוים תורם לתהליך היווצרות קריש ומאפייני קריש דם האולטימטיבי. הבנת זה יכול לספק הדרכה לאבחון פקקת ופיתוח של טיפולית. כדי להשיג אפיון קריש פיברין מייצג יותר, פלזמה ניתן להחליף כדי לפקח על היווצרות קריש כפי שהוא דומה בתנאי קרישת vivo יותר מקרוב מאשר מערכת מודל פיברינוגן/ טרומבין פשוטה. עם זאת, בשל האופי המורכב של מפל קרישה, היווצרות קריש באמצעות פלזמה מוסיף למורכבות, מה שהופך את זה קשה יותר לבודד את ההשפעה של גורמים בודדים. שימוש במודל פיברינוגן/טרומבין פשוט מונע את הצורך ליזום את כל מפל הקרישה המאפשר בידוד של שלב היווצרות פיברין הסופי. על ידי הכללת שני רכיבים עיקריים ליצירת פיברין (פיברינוגן ותרומבין), התקנה זו יוצרת מצב היווצרות קריש מבוקר מאוד. חשוב גם לציין כי בעוד מודל קרישי דם פשוטה משמש כאן, פרוטוקול זה יכול לשמש גם כדי לאפיין קרישי דם מורכבים יותר על ידי הכללת גורמי קרישה נוספים. במחקר זה, אפיון קריש פיברין באמצעות turbidity ו TEG מתבצעים על ידי ריכוזי פיברינוגן ותרומבין שונים, כוח יוני, pH, וריכוז חלבון כולל בתמיסת קרישה לחקות שונה בנסיבות קרישת vivo14. פרטים אודות וריאציות אלה בפרוטוקול נכללו בסעיף 5.
Protocol
1. הכנת תמיסת מלח מאגר פוספט (PBS)
הערה: PBS שימש לאורך כל מחקר זה כמו ההתארות לא דורשים תוספת של סידן. חשוב לציין כי בעת הוספת סידן, מנוצל לעתים קרובות כדי re-calcify מוצרי דם citrated, PBS יש להימנע כמו סידן ידוע לזרז במאגרי פוספט.
- להפוך 0.01 M, pH 7.4 PBS מאגר על ידי ערבוב 137 mM נתרן כלוריד, 1.8 mM אשלגן פוספט מונובאסי, 10 mM נתרן פוספט dibasic ו 2.7 mM אשלגן כלורי במים DI.
- ודא את החומציות במאגר באמצעות בדיקה של חומציות ותכוונן את ה-pH באמצעות נתרן הידרוקסיד או חומצה הידרוכלורית לפי הצורך.
- השתמש ב- PBS זה להכנת פיברינוגן וקרישת דם (אלא אם צוין אחרת).
הערה: המאגר מוצע לשחזר אבקת פיברינוגן מאז התייבשות במים DI יכול לגרום משקעים פיברינוגן אפילו ב 37 °C.
2. הכנה ואחסון של חלבונים
הערה: לאורך הפרוטוקול ריכוזי מלאי החלבון מוכנים בריכוזים שונים עבור מערבולת ו TEG כדי לאפשר יחס עקבי של מלח, מי DI, PBS וגורמים שיורית אחרים בפתרונות קרישה הסופיים.
- הכנה ואחסון של פיברינוגן
הערה: מזהמים בפיברינוגן זמין מסחרית כוללים כמות משמעותית של גורם XIII, כמויות שיורית של גורמי קרישה אחרים, מאגר אחסון ומלחים. בנוכחות סידן, פקטור 13 ידוע כדי לחצות את רשת קרישי הפיברין. אפקט זה תורם למבנה קריש מהודק וכוח קריש משופר המשפיע על אפיון פיברין. ניתן להשתמש ערכות פעילות זמינות מסחרית כדי לקבוע את רמות הגורם הפעיל XIIIa. כדי למזער את השונות הנגרמת על-ידי פקטור XIIIa, יש לתוועד ניסויים עם הדרת סידן או שלבים נוספים להסרת פקטור XIIIa יש לשלב בפרוטוקול זה. בנוסף, יש להעריך את מלח אחסון החלבון ואת סוג המאגר, ובמידת הצורך ניתן לבצע דיאליזה כדי לעבור למאגר עבודה מועדף.- לשקול וallyquot lyophilized אבקת פיברינוגן (בקר או אדם) בצינורות 2 מ"ל ב 20 מ"ג של חלבון לכל צינור ולאחסן aliquots ב -20 ° C עד 6 חודשים.
- אפשר aliquot fibrinogen להסתגל RT (טמפרטורת החדר) במשך 10 דקות ביום הניסוי. Reconstitute fibrinogen על ידי הוספת 600 μL של PBS aliquot 20 דקות לפני השימוש.
- קח 10 μL של פיברינוגן ולדלל אותו עם 190 μL של PBS בצלחת UV שקוף 96-גם או cuvette. לקבוע ריכוז פיברינוגן על ידי לקיחת ספיגה ב 280 ננומטר באמצעות ספקטרומטר מסחרי והתוכנה שלה.
- לחשב ריכוז פיברינוגן (מ"ג / מ"ל) באמצעות החוק של בירה. הכן 12 מ"ג/מ"ל (לתאגידות סוערות) ו-3.2 מ"ג/מ"ל (עבור TEG) פתרונות מניות פיברינוגן על ידי דילול נוסף עם PBS (אלא אם צוין אחרת).
הערה: קביעת ריכוז פיברינוגן (מ"ג/מ"ל) על פי חוק הבירה: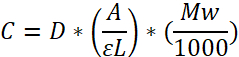
מקדם הכחדה טוחנת: ɛ = 513,400 L mol-1 ס"מ-1 ב 280 נה"מ; אורך נתיב (L); גורם דילול (D); משקל מולקולרי (MW) = 340,000 Da. ɛ נגזר על ידיהכפלת E 0.1% = 1.51 (280 נה"מ) (מקדם הכחדה, שניתן על ידי הספק) עם MW.
- הכנה ואחסון של טרומבין
- Reconstitute lyophilized thrombin (בקר או אדם, 1000 U מניות) ב 200 μL של מים deionized (DI) כדי להפוך 200 μL של 5000 U /mL תרומבין פתרון מניות.
- הפוך 5 μL (20 U / שפופרת) aliquots של הפתרון ולשמור aliquots קפוא ב -20 °C.
- להפשיר את תרומבין aliquots ב RT במשך 15 דקות ביום הניסוי והפוך את פתרון העבודה thrombin על ידי דילול אותו 20 U / מ"ל עבור תקרה turbidity ו 18 U /mL עבור TEG עם מים DI (אלא אם צוין אחרת).
הערה: יש לנקוט באמצעי זהירות כדי לשמור על פעילות אנזימים אשר ניתן לבצע על ידי שמירה על אנזימים על קרח במהלך הפשרה ושימוש; עם זאת, לא נצפתה ירידה בפעילות תרומבין כאשר נוצלה ישירות לאחר הפשרה ב- RT.
3. טורבידיות
- השתמש בכל ספקטרומטר זמין מסחרית בעלת טווח ספיגה של 350 - 700 ננומטר ותוכנה מתאימה כדי לפקח על מערבולת קריש לאורך זמן (ראה טבלת חומרים).
- הפעל את הספקטרומטר ופתח את תוכנת הניתוח המתאימה.
- בחר לוח 1 ופתח את כרטיסיית הגדרות לוח. לחץ על מצב ABS ועל קינטי כדי לפקח על קריאת ספיגה דינמית לאורך זמן.
- בחר 550 דפים לשעה (או כל ערך בטווח של 350 - 700 נה"מ) בכרטיסיה אורך הגל והתאם את זמן הריצה הכולל ל- 60 דקות עם מרווח של 30 שניות בכרטיסיה תזמון. בחר בארות מעניינות לקריאה על-ידי הדגשת בארות. התאם הגדרות אחרות במידת הצורך.
הערה: בחירת אורך גל בקצה התחתון של הטווח (כ- 350 ננומטר) מביאה לרגישות טובה יותר, אך הספיגה עשויה גם לחרוג ממגבלת הזיהוי של הספקטרומטר. אורך הגל הנפוץ ביותר למדידת מערבולת הוא 405 נה"מ בספרות; עם זאת, פרוטוקול זה משתמש ב- 550 nm כדי להבטיח שערכי הערר הדינאמיים יהיה במסגרת מגבלת הזיהוי עבור כל הניסויים. מרווח הקריאה שנבחר צריך להיות קצר ככל האפשר כדי להשיג את הרמה הגבוהה ביותר של רגישות ל- assay. זה יהיה תלוי ספקטרומטר ומספר בארות לקרוא במהלך הודעה נתונה. - קח צלחת UV שקופה 96-באר. פיפט 140 μL PBS בבאר שנבחרה לקריאה. להוסיף ולערבב 10 μL של טרומבין (20 U /mL) בבאר.
הערה: אין להשתמש לוחות כריכה גבוהה כדי למזער כריכת חלבון לא ספציפית אל פני הבאר. זה יכול להשפיע על פיזור חלבון בפתרון וכתוצאה מכך השתנות גבוהה. - ליזום קרישה באופן מיידי על ידי הוספת 50 μL של פיברינוגן (12 מ"ג / מ"ל) בבאר כדי להשיג 200 μL קרישה פתרון עם ריכוז סופי של 3 מ"ג / מ"ל פיברינוגן ו 1 U /mL תרומבין. לערבב את התוכן בבאר על ידי pipetting למעלה ומטה חמש פעמים טיפול כדי למנוע את יצירת בועות בפתרון כפי שהם ישפיעו על ספיגה על ידי פיזור אור.
הערה: השתמש בפיפטה רב-ערוצית בעת הפעלת דגימות קרישי דם מרובות באותה צלחת בו-זמנית. הקלט הבדלי זמן בין בארות ואת פרק הזמן לפני הקריאה הראשונה על-ידי המכשיר כדי לקזז את זמני הקרישה. - מקם את צלחת 96 באר במחזיק ולחץ על התחל בתוכנה כדי להתחיל קריאה סוערת ב RT.
הערה: אם ביצוע ההסכם בטמפרטורה גבוהה אז ספקטרומטר, צלחת, ריגנטים יש לשמור על כל בטמפרטורה הרצויה לפני חניכת קריש. - לאחר השלמת, לאחזר את נתוני turbidity ולקבל עקומת מעקב turbidity על ידי התוויית שינוי ספיגה לאורך זמן בתוכנה מתווה.
- להפיק TurbMax (מערבולת מקסימלית המעידה על עובי סיב פיברין וצפיפות רשת fibrin) על ידי לקיחת ערך הספיגה המרבי של העקומה לאורך זמן.
הערה: ניתן לחשב יחס מסה/אורך של סיב פיברין מתוך ערכי טורביות באמצעות המשוואה המסופקת בכתב היד הבא8. - חשב 90% מערבולת מקסימלית על ידי הכפלת טורב מקס ב-90%.Max להפיק זמן Turbעל ידי זמן מחשוב מחניכת קריש ל 90% מערבולת מקסימלית.
הערה: הזמן ל-90% מערבולת מקסימלית הוא מדד אמין יותר מהזמן למערבולת מקסימלית מוחלטת כפי שהוא מייצג טוב יותר את זמן קריש הדם על ידי ביטול תקופת היווצרות קריש הדם הסופי משתנה מאוד. פרמטרי קרישה נוספים כגון זמן תחילת קריש דם (זמן מתחילת הבדיקה עד כאשר הספיגה מתחילה לגדול), וקצב היווצרות קריש (Vmax, המדרון הגדול ביותר של האזור הליניארי בעקומת המעקב turbidity) ניתן לחלץ גם מן המעקבים turbidity.
4. טרמבולסטוגרפיה (TEG)
- הפעל את מנתח הטרמבולסטוגרף והמתן שהטמפרטורה תתייצב ב-37°C.
- פתח TEG - תוכנה. לאחר שאתה מחובר, צור שם ניסוי תחת המקטע מזהה.
- ערוך בדיקה אלקטרונית עבור כל הערוצים על-ידי ביצוע ההנחיות של התוכנה שעל המסך. הזמן את הידית בחזרה למיקום העומס לאחר השלמת כל הבדיקות.
הערה: נדרשת בדיקת TEG אלקטרונית ויש לבצעה בכל פעם בעת השימוש במכשיר. בדיקות בקרת קרישה TEG (באמצעות TEG רמה 1 ופקדים ברמה 2) נדרשים ביצרן הרגיל הציע מרווחי זמן כאשר מנוצל עבור דגימות קליניות. - לחץ על הכרטיסיה TEG, קלט מידע לדוגמה עבור ערוצים בהם יייעשה שימוש. מקם TEG לא מרשימה ברורה בערוץ המתאים שלה. החלק את המוביל למעלה ולחץ על הספל התחתון 5 פעמים כדי להצמיד את הסיכה למוט הפיתול. מנמיך את המוביל ולחץ את הספל כלפי מטה לתוך בסיס המוביל עד שהוא "לוחץ".
- פיפטה 20 μL של תמיסת טרומבין (18 U/mL) לתוך TEG. ליזום קרישה באופן מיידי על ידי הוספת 340 μL של פיברינוגן (3.2 מג / מל) לתוך TEG כדי להשיג תמיסת קרישה μL 360 עם ריכוז סופי של 3 מג /מל פיברינוגן ו 1 U /mL thrombin ב. מערבבים את התוכן על-ידי התפתלות למעלה ומטה חמש פעמים.
הערה: גורמי קרישה פוטנציאליים או רכיבים אחרים של עניין יש להוסיף במהלך שלב זה להיות זהיר תמיד לשמור על נפח סופי של 360 μL ב גביע TEG. - החלק את המוביל הטעון של הספל למעלה, הזז את הידית למיקום הקריאה ולחץ על התחל בתוכנה כדי ליזום את קריאת ה- TEG.
- לאחר השלמת TEG (לאחר כשעה), לאחזר פרמטרים TEG ולקבל עקומת מעקב TEG על-ידי התוויית משרעת לאורך זמן בתוכנה מתווה.
- לאסוף MA כמו TEGמקס (משרעת מקסימלית מעידה על כוח קריש דם) וTMA כמו זמן TEG (זמן למשרעת מקסימלית) מהתוכנה.
הערה: MA מחושב על-ידי התוכנה כמשרעת המרבית בזמן שבו למשרעת יש פחות מ-5% סטייה על פני פרק זמן של 3 דקות. TMA נקבע כזמן מקצב יצירת תרומבוס המרבי (ליד נקודת הפיצול) ל-MA. פרמטרים אחרים עשויים גם להיות שימושיים כדי להעריך בעת ביצוע ניתוח קרישי דם. כמה דוגמאות לפרמטרים אלה כוללות: R-time (הזמן מתחילת הבדיקה ועד למשרעת מגיעה ל-2 מ"מ), K (הזמן מסוף R ועד למשרעת מגיעה ל-20 מ"מ), אלפא (מדרון הקו בין R ל-K) ו-CLT (זמן קריש דם).
5. אפיון פיברין בתנאי קרישה שונים
הערה: לבצע ניסויי אפיון פיברין על ידי לווסת משתנה מסוים בפתרונות קרישה כגון: ריכוזי פיברינוגן וטרומבין, כוח יוני, pH, וריכוזי חלבון הכולל. הכנות ניסיוניות עם משתני דוגמה אלה מתוארות בסעיף זה; עם זאת, גורמי קרישה אחרים ותנאי עניין יכולים להיות מוחלף גם כן. בחר בקפידה מערכת חיץ מתאימה תוך התחשבות בכל דרישות מאפיין ייחודיות. עבור הסתערות ו- TEG, כלול בקרה במאגר רק כדי להבטיח חיסור רקע מדויק בעת ניתוח ההשפעה של משתנים אלה.
- ריכוז פיברינוגן משתנה (1, 2, 3, 4, 5 מ"ג/מ"ל)
- כוונון שלב 2.1.4 כדי להכין את מלאי פיברינוגן בריכוזים שונים (4, 8, 12, 16, 20 מ"ג/מ"ל לתאגידות סוערות ו-1.1, 2.1, 3.2, 4.2, 5.3 מ"ג/מ"ל עבור TEG).
- להתאים את שלב 3.6 כדי "להוסיף 50 μL fibrinogen (4, 8, 12, 16, 20 מ"ג / מ"ל) לתוך בארות מרובות של 96 צלחת היטב" עבור בדיקות turbidity.
- כוונון שלב 4.5 כדי "להוסיף 340 μL fibrinogen (1.1, 2.1, 3.2, 4.2, 5.3 מ"ג / מ"ל) לתוך כוסות TEG ברור" עבור TEG.
- ריכוז טרומבין משתנה (0.1, 0.3, 0.6, 0.8, 1, 2.5, 5, 10 U/mL)
- התאמת שלב 2.2.3 כדי להכין את מלאי טרומבין בריכוזים שונים (2, 6, 12, 16, 20, 50, 100, 200 U/mL עבור תסדירות סוערות ו- 1.8, 5.4, 10.8, 14.4, 18, 45, 90, 180 U/mL עבור TEG).
- להתאים את שלב 3.5 כדי "להוסיף 10 μL thrombin (2, 6, 12, 16, 20, 50, 100, 200 U /mL) לתוך בארות מרובות של 96 צלחת היטב" עבור בדיקות turbidity.
- כוונון שלב 4.5 ל"פיפטה 20 μL thrombin (1.8, 5.4, 10.8, 14.4, 18, 45, 90, 180 U/mL) לתוך כוסות TEG ברורות" עבור TEG.
- עוצמה יונית משתנה (0.05, 0.13, 0.14, 0.15, 0.16, 0.17 ו- 0.3 M)
- להמיס נתרן כלורי (21, 101, 111, 121, 131, 141 ו- 271 מ') יחד עם אשלגן כלורי 1.8 מ"מ פוספט מונובאסי, 10 mM נתרן פוספט דיבאסיק ו 2.7 mM אשלגן כלורי במים DI כדי להפוך 0.01 M PBS פתרונות עם חוזקות ionic שונות.
- כוונן את שלב 1.3 לשימוש PBS עשה ביתרונות יוניים שונים כדי להכין פיברינוגן ופתרונות קרישה הן עבור מערבולת ו- TEG.
- pH משתנה (5.8, 6.6, 7.3, 7.4, 7.5 ו- 8.0)
- להמיס נתרן פוספט דיבאסיק (0.7, 3.2, 7.7, 8.1, 8.4, 9.5 מ') ואשלגן פוספט מונובאסי (8.2, 6.0, 2.0, 1.7, 1.4, 0.5 מ') יחד עם אשלגן כלורי ונתרן כלורי (153, 147, 138, 137, 136, 134 מ') כדי ליצור פתרונות PBS 0.01 M עם pH משתנה וכוח יוני סופי ב 0.165 M.
- אמת ערך pH של מאגר באמצעות בדיקה pH והתאם את ה-pH במידת הצורך.
- כוונן את שלב 1.3 לשימוש PBS שנעשו ב pH שונה כדי להכין פיברינוגן ופתרון קרישה עבור גם turbidity ו- TEG assays.
- ריכוז אלבומין משתנה (0, 20, 40, 50, 60, 80, 100 מ"ג/מ"ל)
- להמיס 2 גרם של אלבומין lyophilized ב 500 μL של PBS ב RT במשך 20 דקות ביום הניסוי.
- לקבוע ריכוז אלבומין באמצעות אותו הליך המוזכר בשלב 2.1.3 ו 2.1.4 עם מקדם הכחדה טוחנת של 43,800 L mol(1 ס"מ-1 (ב 280 נה"מ) עבור אלבומין.
- הכן מלאי אלבומין בריכוזים שונים.
- להתאים את שלב 3.5 "פיפטה 40 μL PBS בבאר שנבחרה לקריאה ולהוסיף 10 μL thrombin (20 U / מ"ל)". להתאים את שלב 3.6 "ליזום קרישה באופן מיידי על ידי הוספת 50 μL fibrinogen (12 מ"ג / מ"ל) עם 100 μL אלבומין (0, 40, 80, 100, 120, 160, 200 מ"ג/מ"ל) לתוך בארות מרובות לריכוז סופי של 3 מ"ג/מ"ל פיברינוגן, 1 U/mL תרומבין ו 0, 20, 40, 50, 60, 80, 100 מ"ג / מ"ל אלבומין בארות."
- כוונון שלב 4.5 ל"ליזום קרישה באופן מיידי על ידי הוספת תערובת של 200 μL אלבומין (36, 72, 90, 108, 144, 180 מ"ג/מ"ל) ו 140 μL 7.7 מ"ג/מ"ל פיברינוגן לתוך כוסות TEG כדי להשיג פתרון קרישה 360 μL עם ריכוז סופי של 3 מ"ג/מ"ל פיברינוגן, 1 U/mL thrombin ו 0, 20, 40, 50, 60, 80, 100 מ"ג/מ"ל אלבומין ב כוסות TEG."
תוצאות
הניסויים המוצגים באיור 1 הם עקומות מעקב טורבינות מייצגות של קרישי פיברין אנושיים ושורים ברמות פיברינוגן שונות. נציג TEG עקומות מעקב עבור היווצרות קריש פיברין ברמות פיברינוגן שונות מוצגים איור 2. שתי עקומות המעקב מוכיחות כי לאחר תקופת השהיה לאחר חניכת קריש ד?...
Discussion
פרוטוקול זה מדגים את הניצול של שני כלים ייחודיים לאפיון קרישי דם בדיקת מודל קרישי פיברינוגן/טרומבין פשוט באמצעות רכיבים זמינים מסחרית. גם TEG וגם אסות טורביות קלות להתנהלות. הם לא רק מספקים בדיקות קריש קצה כגון היווצרות קריש מרבי (TurbTime Max ו TEGMax)וזמן היווצרות קריש דם (זמן טור...
Disclosures
לסופרים אין מה לחשוף.
Acknowledgements
אף לא אחד .
Materials
| Name | Company | Catalog Number | Comments |
| 96-Well Clear Flat Bottom UV-Transparent Microplate | Corning | 3635 | Non-treated acrylic copolymer, non-sterile |
| Albumin from human serum | Millipore Sigma | A1653 | ≥96%, lyophilized powder |
| Arium Mini Plus Ultrapure Water System | Sartorius | NA | DI water source |
| Bovine serum albumin | Millipore Sigma | A2153 | ≥96%, lyophilized powder |
| Disposable Cups and Pins for TEG 5000 (Clear) | Haemonetics | REF 6211 | |
| Fibrinogen, Bovine Plasma | Millipore Sigma | 341573 | contains more than 95% clottable protein |
| Fibrinogen, Plasmingogen-Depleted, Human Plasma | Millipore Sigma | 341578 | Contains ≥ 95% clottable proteins. |
| Phosphate buffered saline | Millipore Sigma | P3813 | Powder, pH 7.4, for preparing 1 L solutions |
| Potassium chloride | Millipore Sigma | 60130 | ≥99.5% purity |
| Potassium phosphate monobasic | Millipore Sigma | P9791 | ≥98% purity |
| SevenEasy pH Meter | Mettler Toledo | S20 | |
| Sodium chloride | Millipore Sigma | 71378 | ≥99.5% purity |
| Sodium phosphate dibasic | Millipore Sigma | 71636 | ≥99.5% purity |
| SpectraMax M5 multi-detection microplate reader system | Molecular Devices | M5 | |
| TEG 5000 Thrombelastograph Hemostasis analyzer system | Haemonetics | 07-022 | |
| Thrombin, Bovine | Millipore Sigma | 605157 | |
| Thrombin, Human Plasma, High Activity | Millipore Sigma | 605195 |
References
- Beckman, M. G., Hooper, W. C., Critchley, S. E., Ortel, T. L. Venous Thromboembolism. A Public Health Concern. American Journal of Preventive Medicine. 38, 495-501 (2010).
- Goldhaber, S. Z., Bounameaux, H. Pulmonary embolism and deep vein thrombosis. The Lancet. 379 (9828), 1835-1846 (2012).
- Weisel, J. W., Litvinov, R. I. Mechanisms of fibrin polymerization and clinical implications. Blood. 121 (10), 1712-1719 (2013).
- Weisel, J. W. Fibrin assembly. Lateral aggregation and the role of the two pairs of fibrinopeptides. Biophysical Journal. 50 (6), 1079-1093 (1986).
- Tripathi, M. M., et al. Clinical evaluation of whole blood prothrombin time (PT) and international normalized ratio (INR) using a Laser Speckle Rheology sensor. Scientific Reports. 7 (1), 1-8 (2017).
- Ryan, E. A., Mockros, L. F., Weisel, J. W., Lorand, L. Structural origins of fibrin clot rheology. Biophysical Journal. 77 (5), 2813-2826 (1999).
- Carr, M. E., Hermans, J. Size and Density of Fibrin Fibers from Turbidity. Macromolecules. 11 (1), 46-50 (1978).
- Carr, M. E., Shen, L. L., Hermans, J. A. N., Chapel, H. . Mass-Length Ratio of Fibrin Fibers from Gel Permeation and Light Scattering. 16, 1-15 (1977).
- Gabriel, D. A., Muga, K., Boothroyd, E. M. . The Effect of Fibrin Structure on Fibrinolysis. , 24259-24263 (1992).
- Wolberg, A. S., Gabriel, D. A., Hoffman, M. Analyzing fibrin clot structure using a microplate reader. Blood Coagulation and Fibrinolysis. 13 (6), 533-539 (2002).
- da Luz, L. T., Nascimento, B., Rizoli, S. Thrombelastography (TEG): practical considerations on its clinical use in trauma resuscitation. Scandinavian Journal of Trauma, Resuscitation and Emergency Medicine. 21 (1), 29 (2013).
- Whitten, C. W., Greilich, P. E. Thromboelastography: past, present, and future . Anesthesiology: The Journal of the American Society of Anesthesiologists. 92 (5), 1223-1225 (2000).
- Ranucci, M., Laddomada, T., Ranucci, M., Baryshnikova, E. Blood viscosity during coagulation at different shear rates. Physiological Reports. 2 (7), 1-7 (2014).
- Zeng, Z., Fagnon, M., Nallan Chakravarthula, T., Alves, N. J. Fibrin clot formation under diverse clotting conditions: Comparing turbidimetry and thromboelastography. Thrombosis Research. 187, 48-55 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved