Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Tirer parti de la turbidité et de la thromboélastographie pour la caractérisation complémentaire des caillots
Dans cet article
Résumé
La fibrine est responsable de la formation de caillots pendant l’hémostase et la thrombose. Les tests de turbidité et thromboelastograhy (TEG) peuvent être utilisés comme outils synergiques qui fournissent une évaluation complémentaire d’un caillot. Ces deux techniques ensemble peuvent donner plus de perspicacité dans la façon dont les conditions de coagulation affectent la formation de caillots de fibrine.
Résumé
La thrombose est l’une des principales causes de décès dans le monde. La fibrine(ogen) est la protéine principalement responsable de la formation de caillots ou de la thrombose. Par conséquent, caractériser la formation de caillots de fibrine est bénéfique à l’étude de la thrombose. La turbidité et la thromboélastographie (TEG) sont toutes deux largement utilisées dans les tests in vitro pour surveiller la formation de caillots. La turbidité mesure dynamiquement la transmission de la lumière à travers une structure de caillot de fibrine via un spectromètre et est souvent utilisée dans les laboratoires de recherche. Teg est une technique viscoélastique spécialisée qui mesure directement la force des caillots sanguins et est principalement utilisée en milieu clinique pour évaluer l’hémostase des patients. À l’aide de ces deux outils, cette étude décrit une méthode de caractérisation d’un caillot de fibrine in vitro à l’aide d’un modèle simplifié de caillot de fibrinogène/thrombine. Les tendances des données dans les deux techniques ont été comparées dans diverses conditions de coagulation. Des caillots de fibrine humain et bovin ont été formés côte à côte dans cette étude, car les facteurs de coagulation bovine sont souvent utilisés comme substituts aux facteurs de coagulation humaine dans les milieux cliniques et de recherche. Les résultats démontrent que le TEG et la formation de caillots de trajectoire de turbidité par l’intermédiaire de deux méthodes distinctes et lorsqu’ils sont utilisés ensemble fournissent la force complémentaire de caillot et l’information structurelle de fibre dans diverses conditions de coagulation.
Introduction
La thrombose est la formation pathologique d’un caillot sanguin dans le corps qui bloque la circulation sanguine conduisant à une morbidité et une mortalité élevées dans le monde entier. Il y a 1 à 2 cas de thromboembolie veineuse et 2 à 3 cas de maladies vasculaires induites par la thrombose pour 1000 personnes par an1,2. Présenté ici est une méthode de mise à profit de la thromboélastographie (TEG) et la turbidité pour surveiller la formation de caillots dans diverses conditions de coagulation. Fibrin(ogen) est la protéine primaire qui est responsable de la formation de caillots dans le corps. Dans les dernières étapes de la cascade de coagulation, les fibrinopeptides sont fendus du fibrinogène par la thrombine initiant la polymérisation des monomères de fibrine insolubles que le caillot se développe3,4. Pour comprendre la formation de caillot dans la thrombose pathologique, il est nécessaire de caractériser la formation de fibrine dans diverses circonstances de coagulation. Des tests multiples de surveillance des caillots ont été utilisés pour étudier la formation de caillots de fibrine in vitro. Le temps de prothrombine (PT/INR) et le temps partiel activé de thromboplastine (aPTT) sont deux essais cliniques communs qui mesurent l’intégrité d’une voie spécifique de coagulation. Cependant, ils utilisent le temps comme la seule variable qui ne donne aucune indication des propriétés physiques de caillot5. La microscopie électronique permet la visualisation de la micro-structure d’un caillot de fibrine complètement formé, mais ne fournit aucune information sur le processus de formation du caillot lui-même6. Parmi tous les tests, les tests de turbidité et teg offrent la capacité de suivre dynamiquement les caractéristiques des caillots au fil du temps. Ces techniques permettent la mesure des profils complets de coagulation et, par conséquent, fournissent un certain avantage par rapport à d’autres outils de caractérisation des caillots fibrine.
Plus précisément, les tests de turbidité (ou turbidimétrie de caillot) sont largement utilisés pour la recherche et les applications cliniques en raison de sa mise en œuvre simpliste et de la grande accessibilité des spectromètres dans les laboratoires de recherche. Ce test permet une mesure dynamique de la transmission de la lumière par un caillot formant en prenant des lectures répétitives individuelles à une longueur d’onde définie (le plus souvent à une longueur d’onde dans la gamme de 350 – 700 nm)7. La température dans la chambre de lecture peut également être ajustée. À mesure que le gel fibrine se forme, la quantité de lumière qui circule dans le réseau protéique est réduite, ce qui entraîne une augmentation de l’absorption au fil du temps. De même, l’absorption diminue lorsque le réseau de caillots se dégrade. Les tests de turbidité peuvent facilement être multiplexés à l’aide d’un format de plaque multi-puits pour permettre un dépistage à haut débit dans les plaques de 96 et 384 puits. Plusieurs caractéristiques de caillot peuvent être dérivées d’une courbe de traçage de turbidité (absorption au fil du temps) qui incluent : turbidité maximale, temps à turbidité maximale, temps pour le début de caillot, et taux de formation de caillot (Vmax). Un rapport masse/longueur de fibre de fibrine peut également être dérivé des données brutes de turbidité pour estimer l’épaisseur de fibre de fibrine8,9,10.
Teg est principalement utilisé dans le cadre clinique pour évaluer l’hémostase des patients et la lyse de caillot. Il est également couramment utilisé dans les applications chirurgicales pour déterminer quand les médicaments anti-fibrinolytiques ou les produits sanguins hémostatiques doivent être administrés11,12. La formation de caillots se produit à l’intérieur d’une tasse teg avec tous les composants de coagulation étant ajouté à la tasse avant le début de l’essai. La tasse, avec un caillot en évolution, tourne physiquement contre une goupille qui est insérée dans son centre et un capteur de torsion électromécanique mesure la force viscoélastique croissante du caillot. Ce test est généralement effectué à la température physiologique de 37 °C; toutefois, la température peut être ajustée manuellement sur l’instrument. L’amplitude maximale (MA), la vitesse de réaction (R), le temps cinétique (K), l’angle α (angle) et le temps jusqu’à l’amplitude maximale (TMA) sont extraits par le logiciel TEG du traçage teg dynamique. Ces valeurs sont généralement comparées aux gammes normales cliniques pour évaluer l’état de coagulation d’un patient. Bien que teg n’est pas précisément un viscomètre, car il mesure la force des caillots en unités millimétriques, il fournit des données importantes sur les caillots viscoélastiques et fonctionne comme un outil de prise de décision clinique précieux pour les médecins de décider d’administrer des produits sanguins spécifiques et ajuster le dosage thérapeutique13. Lorsque les essais de TEG et de turbidité sont utilisés ensemble, ils fournissent des informations complémentaires de caractérisation des caillots que la force du caillot et la cinétique sont facilement extraites de l’épaisseur de la fibre de TEG et fibrine peut être consulté par des mesures de turbidité optique.
Comme la fibrine est un composant critique d’un caillot de sang, la caractérisation des caillots fibrine dans diverses conditions de formation de caillots peut fournir un aperçu précieux de la façon dont une variable spécifique contribue au processus de formation des caillots et aux propriétés ultimes du caillot. Comprendre cela peut fournir des conseils pour le diagnostic de thrombose et le développement de la thérapeutique. Pour obtenir une caractérisation plus représentative des caillots de fibrine, le plasma peut être substitué pour surveiller la formation de caillots, car il ressemble plus étroitement aux conditions de coagulation in vivo qu’un système simplifié de modèle fibrinogène/thrombine. Cependant, en raison de la nature complexe de la cascade de coagulation, la formation de caillots à l’aide de plasma ajoute à la complexité, ce qui rend plus difficile d’isoler l’impact des facteurs individuels. L’utilisation d’un modèle simplifié fibrinogène/thrombine empêche la nécessité d’initier toute la cascade de coagulation permettant l’isolement de l’étape finale de formation de fibrine. En incluant deux composants majeurs de formation de fibrine (fibrinogène et thrombine), cette configuration crée une condition de formation de caillot très contrôlée. Il est également important de noter que bien que le modèle simplifié de caillot soit utilisé ici, ce protocole peut également être utilisé pour caractériser des caillots plus complexes en incluant des facteurs de coagulation supplémentaires. Dans cette étude, la caractérisation des caillots fibrines à l’aide de la turbidité et du TEG est effectuée par des concentrations variables de fibrinogène et de thrombine, de la force ionique, du pH et de la concentration totale de protéines dans la solution de coagulation pour imiter différentes circonstances de coagulation in vivo14. Les détails concernant ces variations du protocole ont été inclus à la section 5.
Protocole
1. Préparation de la solution saline tampon de phosphate (PBS)
REMARQUE : Le PBS a été utilisé tout au long de cette étude car les essais décrits n’ont pas exigé l’ajout de calcium. Il est important de noter que lors de l’ajout de calcium, souvent utilisé pour recalcifier les produits sanguins citrated, PBS doit être évitée que le calcium est connu pour précipiter dans les tampons de phosphate.
- Faire un tampon de 0,01 M, pH 7.4 PBS en mélangeant 137 mM de chlorure de sodium, 1,8 mM de phosphate de potassium monobasique, 10 mM de phosphate de sodium dibasique et 2,7 mM de chlorure de potassium dans l’eau di.
- Vérifiez le pH tampon à l’aide d’une sonde de pH et ajustez le pH à l’aide d’hydroxyde de sodium ou d’acide chlorhydrique au besoin.
- Utilisez ce PBS pour la préparation des tests de fibrinogène et de coagulation (sauf indication contraire).
REMARQUE : Il est suggéré de reconstituer la poudre de fibrinogène puisque la réhydratation dans l’eau de DI peut entraîner des précipitations de fibrinogène même à 37 °C.
2. Préparation et stockage des protéines
REMARQUE : Tout au long du protocole, les concentrations de stocks de protéines sont préparées à différentes concentrations pour la turbidité et le TEG afin de tenir compte du rapport constant de sel, d’eau di, de PBS et d’autres facteurs résiduels dans les solutions finales de coagulation.
- Préparation et stockage du fibrinogène
REMARQUE : Les contaminants présents dans les fibrinogènes disponibles dans le commerce comprennent une quantité importante de facteur XIII, des quantités résiduelles d’autres facteurs de coagulation, un tampon de stockage et des sels. En présence de calcium, le facteur XIII est connu pour relier le réseau de caillots fibrine. Cet effet contribue à une structure de caillot resserrée et à une force accrue de caillot affectant la caractérisation de fibrine. Les kits d’activité disponibles dans le commerce peuvent être utilisés pour déterminer les niveaux de facteur actif XIIIa. Pour minimiser la variabilité causée par le facteur XIIIa, les expériences doivent être conçues à l’exclusion du calcium ou des mesures supplémentaires pour éliminer le facteur XIIIa devraient être incorporées dans ce protocole. En outre, le sel de stockage des protéines et le type tampon doivent être évalués et, si nécessaire, la dialyse peut être effectuée pour être transférée à un tampon de travail d’essai préféré.- Peser et aliquot la poudre de fibrinogène lyophilisé (bovine ou humaine) dans 2 tubes mL à 20 mg de protéines par tube et stocker les aliquots à -20 °C pendant jusqu’à 6 mois.
- Laissez fibrinogène aliquot s’acclimater à RT (température ambiante) pendant 10 minutes le jour de l’expérience. Reconstituer le fibrinogène en ajoutant 600 μL de PBS à l’aliquot 20 min avant l’utilisation.
- Prenez 10 μL de fibrinogène et diluez-le avec 190 μL de PBS dans une plaque transparente UV de 96 puits ou une cuvette. Déterminer la concentration de fibrinogènes en prenant l’absorption à 280 nm via un spectromètre commercial et son logiciel.
- Calculer la concentration de fibrinogène (mg/mL) en utilisant la loi de la bière. Préparer 12 mg/mL (pour les tests de turbidité) et 3,2 mg/mL (pour teg) solutions de stock de fibrinogène par dilution ultérieure avec PBS (sauf indication contraire).
NOTE: Détermination de la concentration de Fibrinogène (mg/mL) par la loi de la bière: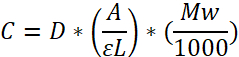
Coefficient d’extinction ɛ molaire : 513 400 L mol-1 cm-1 à 280 nm; Pathlength (L); Facteur de dilution (D); Poids moléculaire (MW) = 340 000 Da. est dérivé en multipliant E0,1% = 1,51 (280 nm) (coefficient d’extinction, donné par le fournisseur) avec MW.
- Préparation et stockage de la thrombine
- Reconstituer la thrombine lyophilisée (bovine ou humaine, 1000 U) dans 200 μL d’eau déionisée (DI) pour faire 200 μL de 5000 solution de stock de thrombine U/mL.
- Faire 5 μL (20 U/tube) aliquots de la solution et garder les aliquots congelés à −20 °C.
- Décongeler les aliquots de thrombine à RT pendant 15 min le jour de l’expérience et faire la solution de travail de thrombine en la diluant à 20 U/mL pour les tests de turbidité et 18 U/mL pour TEG avec de l’eau DI (sauf indication contraire).
REMARQUE : Des précautions doivent être prises pour maintenir l’activité enzymatique qui peut être réalisée en maintenant des enzymes sur la glace pendant le dégel et l’utilisation; cependant, aucune réduction de l’activité de thrombine n’a été observée lorsqu’elle a été utilisée directement après le dégel à RT.
3. Turbidité
- Utilisez n’importe quel spectromètre disponible dans le commerce qui a une plage d’absorption de 350 à 700 nm et un logiciel correspondant pour surveiller la turbidité des caillots au fil du temps (voir tableau des matériaux).
- Allumez le spectromètre et ouvrez le logiciel d’analyse correspondant.
- Sélectionnez la plaque 1 et ouvrez l’onglet Paramètres de la plaque. Cliquez sur le mode ABS et Kinetic pour surveiller une lecture d’absorption dynamique au fil du temps.
- Sélectionnez 550 nm (ou n’importe quelle valeur de la plage de 350 à 700 nm) dans l’onglet longueur d’onde et réglez le temps d’exécution total à 60 min avec un intervalle de 30 s dans l’onglet synchronisation. Sélectionnez les puits d’intérêt pour la lecture en mettant en évidence les puits. Ajustez les autres paramètres si nécessaire.
REMARQUE : La sélection d’une longueur d’onde à l’extrémité inférieure de la plage (environ 350 nm) apporte une meilleure sensibilité, mais l’absorption peut également dépasser la limite de détection du spectromètre. La longueur d’onde la plus couramment utilisée pour la mesure de la turbidité est de 405 nm dans la littérature; toutefois, ce protocole utilise 550 nm pour s’assurer que les valeurs de turbidité dynamique sont dans la limite de détection pour toutes les expériences. L’intervalle de lecture sélectionné doit être aussi court que possible pour atteindre le plus haut niveau de sensibilité aux tests. Cela dépendra du spectromètre et du nombre de puits lus au cours d’un test donné. - Prenez une plaque transparente UV de 96 puits. Pipette 140 μL PBS dans un puits qui est sélectionné pour la lecture. Ajouter et mélanger 10 μL de thrombine (20 U/mL) dans le puits.
REMARQUE : N’utilisez pas de plaques d’essai à haute liaison pour réduire au minimum la liaison protéique non spécifique à la surface du puits. Cela pourrait affecter la dispersion des protéines dans la solution et entraîner une variabilité élevée des tests. - Initier immédiatement la coagulation en ajoutant 50 μL de fibrinogène (12 mg/mL) dans le puits pour obtenir une solution de coagulation de 200 μL avec une concentration finale de fibrinogène de 3 mg/mL et de 1 thrombine U/mL. Mélanger le contenu dans le puits en faisant cinq fois de haut en bas en prenant soin d’éviter la création de bulles dans la solution car elles auront un impact sur l’absorption en dispersant la lumière.
REMARQUE : Utilisez une pipette multicanal lors de l’exécution de plusieurs échantillons de caillots sur la même plaque en même temps. Différences de temps record entre les puits et la période précédant la première lecture par l’instrument pour compenser les temps de coagulation. - Placez la plaque de 96 puits dans le support et cliquez sur Démarrer dans le logiciel pour commencer la lecture de turbidité à RT.
REMARQUE : Si l’exécution de l’essai à une température élevée, le spectromètre, la plaque et les réactifs doivent tous être maintenus à la température désirée avant l’initiation du caillot. - Une fois terminé, récupérez les données de turbidité et obtenez une courbe de traçage de turbidité en traçant le changement d’absorption au fil du temps dans un logiciel de traçage.
- Der dérive turbMax (turbidité maximale indicative de l’épaisseur de la fibre de fibrine et de la densité du réseau fibrine) en prenant la valeur d’absorption maximale de la courbe au fil du temps.
REMARQUE : Le rapport masse/longueur de fibre de Fibrine peut être calculé à partir des valeurs de turbidité à l’aide de l’équation fournie dans le manuscrit suivant8. - Calculer 90% de turbidité maximale en multipliant TurbMax de 90%. Dérivez TurbTemps en calculant le temps de l’initiation de caillot à 90% de turbidité maximale.
REMARQUE : Le temps de turbidité maximale de 90 % est une mesure plus fiable que le temps pour la turbidité maximale absolue, car elle représente mieux le temps de caillot en éliminant la période de formation finale de caillots très variable. Des paramètres de coagulation supplémentaires tels que le temps de début du caillot (temps du début de l’essai au moment où l’absorption commence à augmenter) et le taux de formation de caillots (Vmax, la plus grande pente de la région linéaire dans la courbe de traçage de la turbidité) peuvent également être extraits des traçages de turbidité.
4. Thromboélastographie (TEG)
- Allumez l’analyseur de thromboélastographe et attendez que la température se stabilise à 37 °C.
- Open TEG - logiciel. Une fois connecté, créez un nom d’expérience sous la section ID.
- Effectuez un test électronique pour tous les canaux en suivant les invites logicielles à l’écran. Placez le levier vers la position de chargement une fois que toutes les vérifications sont terminées.
REMARQUE : Un test électronique TEG est nécessaire et doit être effectué à chaque fois lors de l’utilisation de l’instrument. Des tests de contrôle de coagulation teg (à l’aide de contrôles teg de niveau 1 et 2) sont nécessaires aux intervalles suggérés par le fabricant régulier lorsqu’ils sont utilisés pour des échantillons cliniques. - Cliquez sur l’onglet TEG, entrez des exemples d’informations pour les canaux qui seront utilisés. Placez une tasse TEG claire non enduite dans son canal correspondant. Faites glisser le support vers le haut et appuyez sur le bas de la tasse 5 fois pour apposer la broche sur la tige de torsion. Baissez le support et appuyez sur la tasse vers le bas dans la base du transporteur jusqu’à ce qu’il « clics ».
- Pipette 20 μL de solution de thrombine (18 U/mL) dans la tasse TEG. Initier immédiatement la coagulation en ajoutant 340 μL de fibrinogène (3,2 mg/mL) dans la tasse teg pour obtenir une solution de coagulation de 360 μL avec une concentration finale de 3 mg/mL fibrinogène et 1 thrombine U/mL dans la tasse. Mélanger le contenu en faisant des pipes de haut en bas cinq fois.
REMARQUE : Des facteurs de coagulation potentiels ou d’autres composants d’intérêt devraient être ajoutés au cours de cette étape en prenant soin de toujours maintenir un volume final de 360 μL dans la tasse TEG. - Faites glisser le support chargé de tasse vers le haut, déplacez le levier à la position de lecture et cliquez sur Démarrer dans le logiciel pour initier la lecture teg.
- Une fois que TEG est terminé (après environ une heure), récupérer les paramètres TEG et obtenir une courbe de traçage TEG en traçant l’amplitude au fil du temps dans un logiciel de traçage.
- Recueillir MA comme TEGMax (l’amplitude maximale est indicative de la force du caillot) et TMA comme tempsTEG (temps à l’amplitude maximale) à partir du logiciel.
REMARQUE : MA est calculée par le logiciel comme l’amplitude maximale au moment où l’amplitude a moins d’un écart de 5 % sur une période de 3 minutes. TMA est déterminé comme le temps entre le taux de production maximale de thrombus (près du point de fractionnement) et le MA. D’autres paramètres pourraient également être utiles pour évaluer lors de l’analyse des caillots. Voici quelques exemples de ces paramètres : le temps R (le temps entre le début de l’essai et le moment où l’amplitude atteint 2 mm), K (le temps entre la fin de R et l’amplitude atteint 20 mm), l’alpha (pente de la ligne entre R et K) et le CLT (temps de lys).
5. Caractérisation de la fibrine dans différentes conditions de coagulation
REMARQUE : Effectuez des expériences de caractérisation de la fibrine en modulant une variable spécifique dans les solutions de coagulation telles que : les concentrations de fibrinogène et de thrombine, la force ionique, le pH et les concentrations totales de protéines. Les préparations expérimentales avec ces variables d’exemple sont décrites dans cette section; toutefois, d’autres facteurs de coagulation et conditions d’intérêt peuvent également être remplacés. Sélectionnez soigneusement un système tampon approprié en tenant compte de chaque exigence d’essai unique. Pour les tests de turbidité et de TEG, inclure un contrôle de mémoire tampon uniquement pour assurer une soustraction précise en arrière-plan tout en analysant l’effet de ces variables.
- Concentration variable de fibrinogène (1, 2, 3, 4, 5 mg/mL)
- Ajuster l’étape 2.1.4 pour préparer le stock de fibrinogènes à différentes concentrations (4, 8, 12, 16, 20 mg/mL pour les tests de turbidité et 1,1, 2,1, 3,2, 4,2, 5,3 mg/mL pour le TEG).
- Ajuster l’étape 3.6 pour « ajouter 50 fibrinogènes de 50 μL (4, 8, 12, 16, 20 mg/mL) dans plusieurs puits de la plaque de puits de 96 » pour les tests de turbidité.
- Ajuster l’étape 4.5 pour « ajouter 340 fibrinogènes de 340 μL (1,1, 2,1, 3,2, 4,2, 5,3 mg/mL) dans des tasses teg claires » pour teg.
- Concentration variable de thrombine (0,1, 0,3, 0,6, 0,8, 1, 2,5, 5, 10 U/mL)
- Ajuster l’étape 2.2.3 pour préparer le stock de thrombine à différentes concentrations (2, 6, 12, 16, 20, 50, 100, 200 U/mL pour les tests de turbidité et 1,8, 5,4, 10,8, 14,4, 18, 45, 90, 180 U/mL pour TEG).
- Ajuster l’étape 3.5 pour « ajouter 10 thrombine de μL (2, 6, 12, 16, 20, 50, 100, 200 U/mL) dans plusieurs puits de la 96 plaque de puits » pour les tests de turbidité.
- Ajuster l’étape 4.5 à la « pipette 20 μL thrombine (1.8, 5.4, 10.8, 14.4, 18, 45, 90, 180 U/mL) dans des tasses TEG claires » pour TEG.
- Résistance ionique variable (0,05, 0,13, 0,14, 0,15, 0,16, 0,17 et 0,3 M)
- Dissoudre le chlorure de sodium (21, 101, 111, 121, 131, 141 et 271 mM) ainsi que 1,8 mM de phosphate de potassium monobasique, 10 mM de phosphate de sodium dibasique et 2,7 mM de chlorure de potassium dans l’eau di pour faire 0,01 M de solutions PBS avec des forces ioniques variables.
- Ajuster l’étape 1.3 pour utiliser PBS fait à différentes forces ioniques pour préparer des solutions de fibrinogène et de coagulation pour la turbidité et les tests TEG.
- PH variable (5,8, 6,6, 7,3, 7,4, 7,5 et 8,0)
- Dissoudre le dibasique de phosphate de sodium (0,7, 3,2, 7,7, 8,1, 8,4, 9,5 mM) et le phosphate de potassium monobasique (8,2, 6,0, 2,0, 1,7, 1,4, 0,5 mM) ainsi que 2,7 mM de chlorure de potassium et de chlorure de sodium (153, 147, 138, 137, 136, 134 mM) pour fabriquer des solutions PBS de 0,01 M avec pH variable et une force ionique finale à 0,165 M.
- Vérifiez la valeur du pH tampon via la sonde pH et ajustez le pH si nécessaire.
- Ajuster l’étape 1.3 pour utiliser pbs fait à un pH différent pour préparer le fibrinogène et la solution de coagulation pour la turbidité et les tests TEG.
- Concentration variable d’albumine (0, 20, 40, 50, 60, 80, 100 mg/mL)
- Dissoudre 2 g d’albumine lyophilisée en 500 μL de PBS à RT pendant 20 min le jour de l’expérience.
- Déterminer la concentration d’albumine en utilisant la même procédure mentionnée à l’étape 2.1.3 et 2.1.4 avec un coefficient d’extinction molaire de 43 800 L mol−1 cm−1 (à 280 nm) pour l’albumine.
- Préparer le stock d’albumine à différentes concentrations.
- Ajuster l’étape 3.5 à « Pipette 40 μL PBS dans un puits qui est sélectionné pour la lecture et ajouter 10 μL de thrombine (20 U/mL) ». Ajuster l’étape 3.6 à « Initier immédiatement la coagulation en ajoutant 50 fibrinogène de 50 μL (12 mg/mL) avec 100 μL d’albumine (0, 40, 80, 100, 120, 160, 200 mg/mL) dans plusieurs puits à une concentration finale de 3 mg/mL fibrinogène, 1 thrombine U/mL et 0, 20, 40, 50, 60, 80, 100 mg/mL albumine dans les puits. »
- Ajuster l’étape 4.5 à « Initier immédiatement la coagulation en ajoutant un mélange d’albumine de 200 μL (36, 72, 90, 108, 144, 180 mg/mL) et 140 μL 7,7 mg/mL fibrinogène dans les tasses teg pour obtenir une solution de coagulation de 360 μL avec une concentration finale de fibrinogène de 3 mg/mL, 1 thrombine U/mL et 0, 20, 40, 50, 60, 80, 100 mg/mL albumine dans des tasses TEG. »
Résultats
Les expériences présentées à la figure 1 sont des courbes représentatives de traçage de la turbidité des caillots de fibrine humain et bovin à différents niveaux de fibrinogène. Les courbes représentatives de traçage teg pour la formation de caillots de fibrine à différents niveaux de fibrinogène sont indiquées à la figure 2. Les deux courbes de traçage démontrent qu’après une période de décalage suivant l’initiation de caillot, la turb...
Discussion
Ce protocole démontre l’utilisation de deux outils distincts de caractérisation des caillots qui testent un modèle simplifié de caillots de fibrinogène/thrombine à l’aide de composants disponibles dans le commerce. Les tests de TEG et de turbidité sont faciles à réaliser. Ils fournissent non seulement des examens de caillot de point final tels que la formation maximale de caillot (TurbMax et TEGMax)et les temps de formation de caillots (TurbTime et TEGTime)mais év...
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Aucun.
matériels
| Name | Company | Catalog Number | Comments |
| 96-Well Clear Flat Bottom UV-Transparent Microplate | Corning | 3635 | Non-treated acrylic copolymer, non-sterile |
| Albumin from human serum | Millipore Sigma | A1653 | ≥96%, lyophilized powder |
| Arium Mini Plus Ultrapure Water System | Sartorius | NA | DI water source |
| Bovine serum albumin | Millipore Sigma | A2153 | ≥96%, lyophilized powder |
| Disposable Cups and Pins for TEG 5000 (Clear) | Haemonetics | REF 6211 | |
| Fibrinogen, Bovine Plasma | Millipore Sigma | 341573 | contains more than 95% clottable protein |
| Fibrinogen, Plasmingogen-Depleted, Human Plasma | Millipore Sigma | 341578 | Contains ≥ 95% clottable proteins. |
| Phosphate buffered saline | Millipore Sigma | P3813 | Powder, pH 7.4, for preparing 1 L solutions |
| Potassium chloride | Millipore Sigma | 60130 | ≥99.5% purity |
| Potassium phosphate monobasic | Millipore Sigma | P9791 | ≥98% purity |
| SevenEasy pH Meter | Mettler Toledo | S20 | |
| Sodium chloride | Millipore Sigma | 71378 | ≥99.5% purity |
| Sodium phosphate dibasic | Millipore Sigma | 71636 | ≥99.5% purity |
| SpectraMax M5 multi-detection microplate reader system | Molecular Devices | M5 | |
| TEG 5000 Thrombelastograph Hemostasis analyzer system | Haemonetics | 07-022 | |
| Thrombin, Bovine | Millipore Sigma | 605157 | |
| Thrombin, Human Plasma, High Activity | Millipore Sigma | 605195 |
Références
- Beckman, M. G., Hooper, W. C., Critchley, S. E., Ortel, T. L. Venous Thromboembolism. A Public Health Concern. American Journal of Preventive Medicine. 38, 495-501 (2010).
- Goldhaber, S. Z., Bounameaux, H. Pulmonary embolism and deep vein thrombosis. The Lancet. 379 (9828), 1835-1846 (2012).
- Weisel, J. W., Litvinov, R. I. Mechanisms of fibrin polymerization and clinical implications. Blood. 121 (10), 1712-1719 (2013).
- Weisel, J. W. Fibrin assembly. Lateral aggregation and the role of the two pairs of fibrinopeptides. Biophysical Journal. 50 (6), 1079-1093 (1986).
- Tripathi, M. M., et al. Clinical evaluation of whole blood prothrombin time (PT) and international normalized ratio (INR) using a Laser Speckle Rheology sensor. Scientific Reports. 7 (1), 1-8 (2017).
- Ryan, E. A., Mockros, L. F., Weisel, J. W., Lorand, L. Structural origins of fibrin clot rheology. Biophysical Journal. 77 (5), 2813-2826 (1999).
- Carr, M. E., Hermans, J. Size and Density of Fibrin Fibers from Turbidity. Macromolecules. 11 (1), 46-50 (1978).
- Carr, M. E., Shen, L. L., Hermans, J. A. N., Chapel, H. . Mass-Length Ratio of Fibrin Fibers from Gel Permeation and Light Scattering. 16, 1-15 (1977).
- Gabriel, D. A., Muga, K., Boothroyd, E. M. . The Effect of Fibrin Structure on Fibrinolysis. , 24259-24263 (1992).
- Wolberg, A. S., Gabriel, D. A., Hoffman, M. Analyzing fibrin clot structure using a microplate reader. Blood Coagulation and Fibrinolysis. 13 (6), 533-539 (2002).
- da Luz, L. T., Nascimento, B., Rizoli, S. Thrombelastography (TEG): practical considerations on its clinical use in trauma resuscitation. Scandinavian Journal of Trauma, Resuscitation and Emergency Medicine. 21 (1), 29 (2013).
- Whitten, C. W., Greilich, P. E. Thromboelastography: past, present, and future . Anesthesiology: The Journal of the American Society of Anesthesiologists. 92 (5), 1223-1225 (2000).
- Ranucci, M., Laddomada, T., Ranucci, M., Baryshnikova, E. Blood viscosity during coagulation at different shear rates. Physiological Reports. 2 (7), 1-7 (2014).
- Zeng, Z., Fagnon, M., Nallan Chakravarthula, T., Alves, N. J. Fibrin clot formation under diverse clotting conditions: Comparing turbidimetry and thromboelastography. Thrombosis Research. 187, 48-55 (2020).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon