Method Article
Inhibición de la formación de la epidermis de la herida a través de la cirugía de colgajo cutáneo completo durante la regeneración de las extremidades del ajolote
En este artículo
Resumen
Este artículo describe cómo realizar un método quirúrgico para inhibir la formación de epidermis de la herida durante la regeneración de las extremidades del ajolote mediante la sutura inmediata de piel de espesor completo sobre el plano de amputación. Este método permite a los investigadores investigar las funciones funcionales de la epidermis de la herida durante las primeras etapas de la regeneración de las extremidades.
Resumen
Los experimentos clásicos en biología regenerativa de salamandras durante el último siglo han establecido durante mucho tiempo que la epidermis de la herida es una estructura de señalización crucial que se forma rápidamente después de la amputación y es necesaria para la regeneración de las extremidades. Sin embargo, los métodos para estudiar su función precisa a nivel molecular en las últimas décadas han sido limitados debido a la escasez de técnicas funcionales precisas e información genómica disponible en los sistemas modelo de salamandras. Emocionantemente, la reciente plétora de tecnologías de secuenciación junto con la liberación de varios genomas de salamandras y el advenimiento de métodos de prueba genética funcionales, incluido CRISPR, hace posible volver a visitar estos experimentos fundacionales a una resolución molecular sin precedentes. Aquí, describo cómo realizar la cirugía de colgajo cutáneo completo (FSF) desarrollada clásicamente en axolotl adultos para inhibir la formación de epidermis de la herida inmediatamente después de la amputación. La epidermis de la herida normalmente se forma a través de la migración distal de las células epiteliales en la piel proximal al plano de amputación para sellar la herida del entorno exterior. La cirugía implica la sutura inmediata de piel de espesor completo (que incluye capas epidérmicas y dérmicas) sobre el plano de amputación para dificultar la migración de células epiteliales y el contacto con los tejidos mesenquimales dañados subyacentes. Las cirugías exitosas resultan en la inhibición de la formación de blastemas y la regeneración de las extremidades. Al combinar este método de cirugía con análisis moleculares y funcionales contemporáneos, los investigadores pueden comenzar a descubrir los fundamentos moleculares de la función de la epidermis de la herida y la biología durante la regeneración de las extremidades.
Introducción
Desde que Lazzaro Spallanzani lo informó en 17681, la regeneración de las extremidades de la salamandra ha sido uno de los fenómenos regenerativos naturales más estudiados que ha enamorado a los biólogos durante siglos. La regeneración exitosa de las extremidades depende de la formación, el crecimiento y el patrón posterior de una estructura celular indiferenciada conocida como blastema. Los investigadores han logrado avances significativos en la comprensión de la composición celular del blastema, así como qué tejidos de soporte y tipos de células son necesarios para su formación2,3,4,5,6,7,8,9,10,11,12,13 . Sin embargo, los mecanismos de señalización coordinados entre diferentes tejidos y tipos de células que conducen al inicio de la formación de blastemas siguen siendo poco conocidos.
Un requisito clave para la formación y regeneración exitosa del blastema es la epidermis de la herida, un epitelio transitorio y especializado que cubre el plano de amputación dentro de las 12 horas posteriores a la amputación10. Después de la amputación, las células epiteliales de la piel intacta proximal a la lesión migran rápidamente sobre el plano de amputación para formar un epitelio de herida delgada14. A medida que el blastema se forma en las semanas siguientes, la epidermis de la herida temprana se convierte en una estructura de señalización epitelial más gruesa llamada capuchón epitelial apical (AEC)15. Mientras que la piel normal de espesor completo contiene una capa epitelial y dérmica separada por una lámina basal, la epidermis de la herida/AEC consiste únicamente en una capa epitelial y carece de una lámina basal16,17. La ausencia de la lámina basal y la dermis permite el contacto directo entre las células epiteliales de la herida y los tejidos subyacentes, lo que facilita la señalización bidireccional entre los dos compartimentos, que es crítica tanto para la formación como para el mantenimiento del blastema17,18.
Los estudios experimentales clásicos idearon varios métodos quirúrgicos innovadores para sondear la función y la necesidad de la epidermis / AEC de la herida a través de la inhibición de su formación. Estos métodos incluyeron la sutura19 o el injerto de piel de espesor completo20,21 sobre el plano de amputación, la sutura inmediata de la extremidad amputada en la cavidad corporal22 y la extracción o irradiación diaria continua de la epidermis de la herida temprana y la AEC23,24. En conjunto, estos experimentos no solo establecieron la importancia de la epidermis de la herida/AEC, sino que también determinaron aún más su papel en la histólisis tisular temprana, así como en el mantenimiento de la proliferación de células progenitoras y el crecimiento blastemal13 a lo largo de la regeneración.
Sin embargo, estos estudios previos se limitaron en gran medida a la tinción histológica, así como a los pulsos de timidina tritiados para rastrear la proliferación celular. De hecho, la revisión de estos experimentos clásicos con tecnologías modernas de secuenciación y técnicas funcionales en salamandras se ha realizado recientemente y ha llevado al descubrimiento de roles adicionales para la epidermis de la herida en la modulación de la inflamación y la degradación / deposición de ECM durante las primeras etapas de la regeneración25. Con la liberación de varias secuencias del genoma y transcriptoma de la salamandra26,27,28,29,30,31,32,33,34, así como el creciente número de métodos funcionales disponibles en las especies de salamandras11,35,36,37,38 , los investigadores ahora están bien posicionados para comenzar a desentrañar los mecanismos moleculares que impulsan la formación de la epidermis de la herida, la función y el desarrollo de AEC.
Desafortunadamente, varios de estos métodos clásicos utilizados para inhibir la formación de la epidermis de la herida son técnicamente desafiantes, presentando dificultades para la reproducibilidad entre réplicas biológicas en el mismo experimento. Por ejemplo, mantener los injertos de piel puede ser un desafío, ya que los injertos pueden eventualmente caerse de la extremidad huésped y la extirpación de la epidermis de la herida / AEC diariamente es difícil sin dañar los tejidos subyacentes. Además, suturar la extremidad amputada en la cavidad corporal es un desafío y también requiere una lesión adicional en el sitio de inserción. Por otro lado, suturar la piel de espesor completo inmediatamente sobre el plano de amputación es relativamente simple, técnicamente reproducible e introduce un daño tisular mínimo. Este método quirúrgico de colgajo de piel completa (FSF) fue desarrollado previamente por Anthony Mescher en 1976 en tritones adultos (Notophthalmus viridiscens). Demostró que la cirugía FSF inhibió la formación y función de la epidermis de la herida al prohibir tanto la migración de células epiteliales sobre el plano de amputación como el contacto directo entre las células epiteliales y los tejidos subyacentes.
Aquí, este procedimiento quirúrgico se muestra paso a paso utilizando la extremidad axolotl. Junto con las tecnologías moleculares y de secuenciación modernas, esta técnica puede resultar muy útil para que los investigadores profundicen nuestra comprensión de la formación y función de la epidermis de la herida / AEC durante la regeneración de las extremidades.
Protocolo
Todos los experimentos con animales se realizaron de acuerdo con IACUC (Protocolo #: 11-32) y las pautas aaalac de la Universidad de Harvard.
1. Preparación de soluciones y configuración para la anestesia y la recuperación
- Prepare una solución fresca de tricaína al 0,1% para la anestesia y una solución de sal sódica de sulfamerazina al 0,5% para la recuperación. Hacer que las soluciones con agua sean adecuadas para la cría de axolotl37 de acuerdo con los protocolos IACUC aprobados en la institución de investigación correspondiente (solución modificada de Holtfreter, por ejemplo). Asegúrese de que las soluciones estén bien mezcladas y que se prepare suficiente volumen para sumergir todo el axolotl.
- Para preparar una solución de tricaína al 0,1%, mezcle 1 g de tricaína y 1 g de bicarbonato de sodio con 1 L de agua. La solución se puede ampliar de acuerdo con esta receta.
- Para preparar una solución de sal sódica de sulfamerazina al 0,5%, mezcle 5 g de sal sódica de sulfamerazina con 1 L de agua. La solución se puede ampliar de acuerdo con esta receta. La solución de sulfamerazina es un antibiótico que evitará la infección bacteriana durante la recuperación quirúrgica.
- Desinfecte el área quirúrgica rociándola con Clidox-S o etanol al 70%. Esterilizar las herramientas quirúrgicas (fórceps, tijeras de disección, tijeras de resorte) en autoclave. Si realiza múltiples cirugías, asegúrese de esterilizar las herramientas quirúrgicas con un esterilizador de cuentas calientes entre los animales.
- Para configurar el área de recuperación, coloque una placa de Petri de 15 cm o cualquier recipiente que quepa el axolotl encima de un cubo lleno de hielo húmedo. Llene la placa de Petri con un bajo nivel de solución de sal sódica de sulfamerazina al 0,5%, lo suficiente como para que el axolotl no se sumerja por completo. La recuperación en hielo después de la cirugía ralentizará el movimiento del animal mientras se despierta de la anestesia, permitiendo que el área suturada se cure relativamente sin perturbaciones.
NOTA: Esta configuración puede ser personalizada por los investigadores dependiendo de los materiales que tengan disponibles.
2. Realización del procedimiento quirúrgico de colgajo cutáneo completo
- Anestesiar el axolotl sumergiéndolo en un recipiente de solución de tricaína al 0,1%. Esto tomará aproximadamente 15-20 minutos. Asegúrese de que el axolotl esté completamente anestesiado realizando un pellizco de cola. Si no hay respuesta del axolotl, proceda con la cirugía.
NOTA: Use axolotls más viejos y más grandes para esta cirugía (al menos 15 cm de tamaño). Asegúrese de que el axolotl permanezca bien hidratado durante toda la cirugía humedeciendo la piel periódicamente con agua del sistema de axolotl usando una pipeta de plástico. Asegúrese de preparar asépticamente el sitio quirúrgico regando el área con PBS estéril antes de la cirugía. El animal también debe colocarse en una cortina quirúrgica estéril para el procedimiento. - Realizar una amputación de extremidad en el extremo distal de los elementos esqueléticos zeugopodiales utilizando las tijeras de disección (Figura 1.1).
- Usando las tijeras de resorte, haga una pequeña incisión (aproximadamente 2 mm) en la porción ventral de la piel (Figura 1.2).
- Usando los fórceps, retire cuidadosamente la piel hasta aproximadamente la línea media de los elementos esqueléticos zeugopodiales, exponiendo los tejidos subyacentes de las extremidades (músculo, hueso, etc.) (Figura 1.3). Asegúrese de no dañar la piel. Consulte la nota después del paso 2.8.
- Amputar los tejidos subyacentes de las extremidades expuestas en la línea media del zeugopodo usando tijeras quirúrgicas (Figura 1.4).
- Empuje hacia atrás el tejido muscular con las tijeras quirúrgicas y recorte el hueso expuesto.
NOTA: Esto es necesario para garantizar una mejor curación y también para aumentar el éxito de la cirugía, ya que el hueso que sobresale puede dentarse contra el colgajo suturado e interrumpir la integridad de un colgajo de piel intacto más adelante. - Usando los fórceps, tire cuidadosamente de la piel de espesor extra completo sobre el plano de amputación para cubrir los tejidos subyacentes expuestos y la sutura en su lugar conectándose con la piel ventral de espesor completo (Figura 1.5).
- Sutura los lados derecho e izquierdo restantes del colgajo de la piel en las porciones ventrales subyacentes de la piel intacta. Esto se puede hacer suturando los lados del colgajo de una manera "entrecruzada" (recomendado) (Figura 1.6-1.9), o simplemente suturando directamente en la piel ventral. Use las pinzas y las tijeras curvas de resorte para suturar. Asegúrese de que no se puedan ver tejidos subyacentes expuestos y que las suturas estén atadas con fuerza (anudadas al menos tres veces).
NOTA: Es fundamental que la piel intacta no se dañe en los pasos 2.4, 2.7-2.8. Hemos encontrado que el daño a la piel de espesor completo se ha correlacionado con cirugías fallidas, ya que las áreas de daño aún pueden formar una pequeña epidermis de herida. Si es posible, trate de usar un par de fórceps más apagados al entregar el colgajo de piel de espesor completo. - Realizar una amputación en la extremidad contralateral (control interno opcional del animal) amputándola a nivel medio zeugopod con tijeras quirúrgicas. Empuje hacia atrás el tejido muscular con tijeras quirúrgicas y recorte el hueso expuesto.
NOTA: Se puede realizar un control interno de la extremidad contralateral para evaluar mejor el éxito de la cirugía durante el paso 4 en el mismo animal. Sin embargo, la amputación de la misma extremidad en un animal separado también se puede utilizar para servir como control.
3. Recuperación y cuidado postoperatorio
- Una vez completada la cirugía, coloque un Kimwipe o una toalla de papel estéril en el fondo del recipiente o una placa de Petri para mojarlo. Coloque al animal en el recipiente sobre hielo húmedo y envuelva suavemente los extremos expuestos del Kimwipe o toalla de papel alrededor de la parte superior del animal para mantenerlo bien hidratado con solución de sulfamerazina. Deje sobre hielo húmedo durante 30 minutos a 1 hora para asegurar un movimiento mínimo durante la recuperación de la anestesia.
- Coloque el animal en un recipiente de alojamiento estático con solución de sulfamerazina al 0,5%. Los ajolotes deben permanecer en esta solución durante las primeras 24 horas para prevenir la infección.
- Coloque el axolotl en el agua normal del sistema y controle la salud diariamente. Asegúrese de que no se caigan suturas todos los días, ya que esto puede provocar la formación de una pequeña epidermis de la herida que confundirá los resultados.
NOTA: Asegúrese de que el contenedor de la carcasa tenga un amplio espacio para que el axolotl se mueva y minimice las posibilidades de que la extremidad suturada en el axolotl pueda entrar en contacto con los lados del contenedor. Esto ayudará a garantizar que las suturas permanezcan en su lugar, especialmente durante la primera semana después de la cirugía.
4. Evaluación del éxito de la cirugía bajo un microscopio estereoscópico
NOTA: Recomendamos revisar a los animales bajo un microscopio estereoscópico al menos una vez a la semana para evaluar la integridad del colgajo de piel completo y el éxito de la cirugía.
- Anestesiar el axolotl en 0.1% de tricaína como en el Paso 2.1. Asegúrese de que haya un amplio espacio en el recipiente para que el axolotl se mueva.
- Si inspecciona durante las primeras dos semanas después de la cirugía, inspeccione la extremidad suturada con un estereomicroscopio para asegurarse de que no hayan salido suturas y que una epidermis de herida delgada y clara no sea visible en ninguna parte. Si inspecciona en la tercera semana después de la cirugía o más tarde, asegúrese de que no se haya formado un blastema y compare con la forma en que la extremidad amputada de control normal (ya sea del mismo animal o de un animal diferente) ha progresado durante la regeneración (es decir, si se ha formado un blastema).
- Cuando haya terminado, devuelva el axolotl a las condiciones normales de agua y cría del sistema.
Resultados
Este protocolo quirúrgico permitirá la inhibición completa de la formación de la epidermis de la herida (Figura 1) y, en última instancia, la regeneración de las extremidades. Una cirugía exitosa da como resultado que no se forme blastema en aproximadamente 2-3 semanas, dependiendo del tamaño del animal, mientras que controlar las extremidades regeneradoras debe formar un blastema normalmente.
Los investigadores deben inspeccionar la extremidad suturada a simple vista cada 2-3 días para asegurarse de que las suturas no hayan salido y que no se esté formando un blastema. Si una o más de las suturas salen, aún puede formarse una epidermis de la herida que resulta en un blastema pequeño o grande y una cirugía fallida (Figura 2). Además, los investigadores deben inspeccionar la extremidad suturada al menos una vez a la semana bajo un estereomicroscopio para asegurarse de que una epidermis de herida delgada no sea evidente en ninguna parte de la superficie de la amputación. A modo de comparación, los investigadores también deben examinar la extremidad regeneradora de control que debe tener una epidermis de la herida sobre el plano de amputación y formar un blastema durante 2-3 semanas. La epidermis de la herida aparecerá delgada y clara, mientras que la piel normal aparecerá más opaca y de color rosa pálido (casi blanco), amarillo claro o verde oscuro en ajolotes leucísticos, albinos o de tipo salvaje, respectivamente.
Si los investigadores desean recolectar tejido antes de las etapas de formación del blastema a las 2-3 semanas, deben inspeccionar las extremidades suturadas antes de la recolección de muestras para asegurarse de que las suturas permanecieran en su lugar y que no se formara una pequeña epidermis de la herida. Además, la seccionamiento sagital a través del tejido de la extremidad suturado y la realización de análisis histológicos en cualquier punto temporal también pueden verificar la presencia de la dermis del colgajo completo de la piel que rodea todo el plano de amputación y la ausencia de una epidermis de la herida (Figura 3).
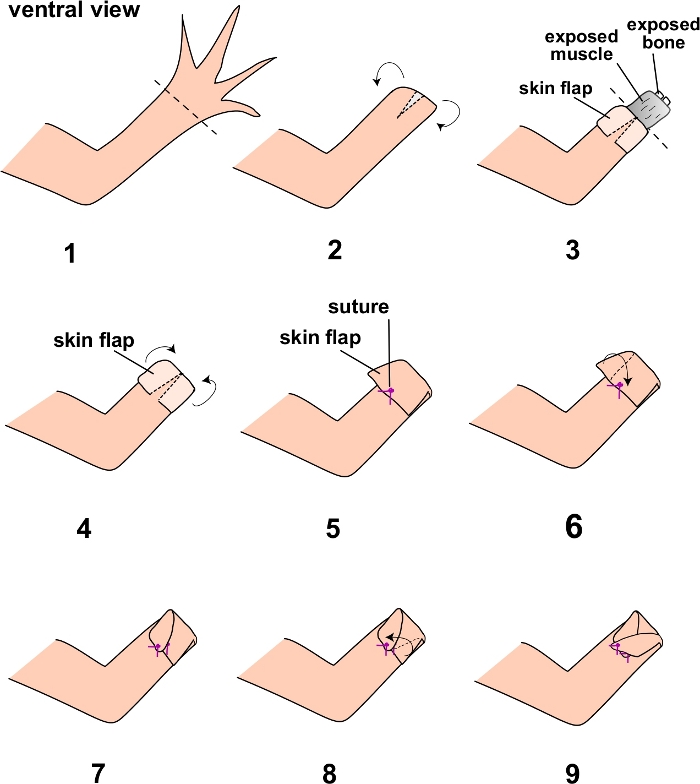
Figura 1: Esquema de los pasos de la cirugía de colgajo cutáneo completo.
Los pasos del protocolo están numerados y diagramados aquí. Las líneas punteadas denotan los planos de amputación en los pasos 1 y 3 del protocolo. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Ejemplos de cirugías de colgajo completo de piel exitosas y no exitosas.
Imagen representativa de campo brillante de una extremidad que se ha sometido a una cirugía exitosa (izquierda), una cirugía fallida (derecha) y una extremidad regeneradora de control (sin cirugía) a los 25 días después de la amputación (dpa). La cirugía exitosa tiene un plano de amputación plano donde se suturó el colgajo de piel completo, mientras que la cirugía fallida tiene un pequeño blastema en desarrollo. Las puntas de flecha denotan el plano de amputación y las líneas punteadas blancas están ahí para ayudar a la visualización de la ausencia de un blastema en la cirugía exitosa y la presencia de blastemas en la cirugía fallida y controlar las extremidades regeneradoras. Haga clic aquí para ver una versión más grande de esta figura.
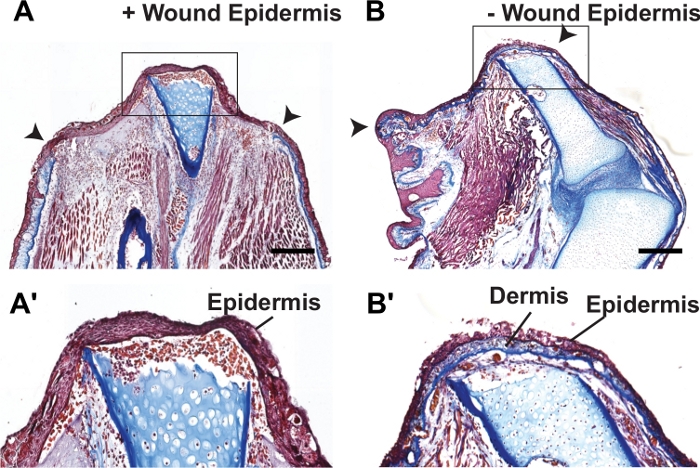
Figura 3: Tinción histológica de extremidades regeneradoras normales y suturadas por FSF.
(A-B') Imágenes representativas de campo brillante de secciones teñidas de picro-mallory de extremidades regeneradoras (A-A') y suturadas de axolotl (B-B') a 7 dpa. Los recuadros en A y B se muestran en A' y B', respectivamente. La capa dérmica pesada de colágeno recubre y cubre todo el plano de amputación en extremidades suturadas. El plano de amputación se denota con puntas de flecha en A-B. Las barras de escala representan 500 μm. Esta figura fue adaptada de Tsai et al.25. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Este artículo describe un protocolo para realizar cirugías de colgajo cutáneo completo en extremidades axolotl para inhibir la formación de epidermis de la herida. Si bien esta cirugía es relativamente simple y técnicamente reproducible en comparación con otros métodos para inhibir la formación de la epidermis de la herida, hay varios pasos críticos que pueden afectar el éxito de la cirugía. Primero, al tirar del colgajo de piel completa intacta sobre los tejidos subyacentes expuestos, es primordial que la piel de espesor completo no se dañe de ninguna manera. El daño al colgajo de la piel aún puede conducir a la formación de una pequeña epidermis de la herida, lo que puede resultar en una pequeña excrecencia similar a un blastema. En segundo lugar, asegúrese de que las suturas no se caigan durante el cuidado postoperatorio, ya que esto también puede conducir a la formación de una pequeña epidermis de la herida. Hasta este punto, minimizar el contacto potencial entre la extremidad suturada y cualquier superficie es importante, especialmente durante la primera semana después de la cirugía. Varias formas de prevenir esto implican alojar y anestesiar el axolotl en un recipiente lo suficientemente grande como para que el axolotl tenga mucho espacio para moverse después de la cirugía.
Esta cirugía también tiene varias limitaciones. Quizás lo más notable es que el éxito de las cirugías solo se puede evaluar de dos maneras: utilizando el endoscopio de disección durante las primeras dos semanas de la cirugía para buscar la ausencia de una epidermis de la herida y / o verificando si se forma un blastema dentro de las 3 semanas. Si bien estos métodos son efectivos, tienen un rendimiento relativamente bajo. El desarrollo de futuros axolotl reporteros transgénicos para marcadores específicos de la epidermis de la herida puede ayudar a una detección más rápida de las cirugías exitosas frente a las no exitosas. Además, esta cirugía es más difícil de realizar en animales más jóvenes ya que la piel intacta es más frágil. Por lo tanto, se recomienda el uso de ajolotes subadultos o adultos.
Si bien esta cirugía se desarrolló originalmente en N. viridiscens19, se ha adaptado fácilmente para axolotls25,39 y es probable que también se pueda aplicar a otras especies de salamandras. En resumen, la aplicación de esta técnica a futuros estudios regenerativos de extremidades permitirá a los investigadores desarrollar más herramientas para abordar la biología de la epidermis de la herida e identificar los mecanismos subyacentes que impulsan su función en el inicio de la formación de blastemas.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
El autor agradece a Doug por su constante aliento y apoyo inquebrantable, así como a los miembros del laboratorio Melton por sus útiles comentarios y comentarios sobre el manuscrito. El autor también desea agradecer a la Oficina de Recursos Animales de Harvard (OAR) por su dedicado cuidado de los animales.
Materiales
| Name | Company | Catalog Number | Comments |
| Curved spring scissors | Fine Scientific Tools | 15009-08 | |
| Ethyl 3-aminobenzoate methanesulfonate (Tricaine) | Sigma-Aldrich | 886-86-2 | |
| Forceps | Fine Scientific Tools | 11252-40 | Need two pairs |
| Nylon monofilament sutures (9-0) | Roboz | SUT-1000-21 | |
| Sodium bicarbonate | Sigma-Aldrich | S5761 | |
| Stereo microscope | Leica | MZ6 | |
| Sulfamerazine sodium salt | Sigma-Aldrich | 127-58-2 | |
| Surgical scissors | Fine Scientific Tools | 14002-14 |
Referencias
- Spallanzani, L. . Prodromo Di Un'opera Da Imprimersi Sopra Le Riproduzioni Animali. , (1768).
- Gerber, T., et al. Single-cell analysis uncovers convergence of cell identities during axolotl limb regeneration. Science. , (2018).
- Leigh, N. D., et al. Transcriptomic landscape of the blastema niche in regenerating adult axolotl limbs at single-cell resolution. Nature Communications. 9 (1), 5153 (2018).
- Kragl, M., et al. Cells keep a memory of their tissue origin during axolotl limb regeneration. Nature. 460 (7251), 60-65 (2009).
- McCusker, C., Bryant, S. V., Gardiner, D. M. The axolotl limb blastema: cellular and molecular mechanisms driving blastema formation and limb regeneration in tetrapods. Regeneration (Oxford). 2 (2), 54-71 (2015).
- Endo, T., Bryant, S. V., Gardiner, D. M. A stepwise model system for limb regeneration. Developmental Biology. 270 (1), 135-145 (2004).
- Tsai, S. L. The molecular interplay between progenitors and immune cells in tissue regeneration and homeostasis. Journal of Immunology and Regenerative Medicine. 7, 100024 (2020).
- Godwin, J. W., Pinto, A. R., Rosenthal, N. A. Macrophages are required for adult salamander limb regeneration. Proceedings of the National Academy of Sciences of the United States of America. 110 (23), 9415-9420 (2013).
- Tanaka, E. M. The molecular and cellular choreography of appendage regeneration. Cell. 165 (7), 1598-1608 (2016).
- Campbell, L. J., Crews, C. M. Wound epidermis formation and function in urodele amphibian limb regeneration. Cellular and Molecular Life Sciences. 65 (1), 73-79 (2008).
- Fei, J. F., et al. Efficient gene knockin in axolotl and its use to test the role of satellite cells in limb regeneration. Proceedings of the National Academy of Sciences of the United States of America. 114 (47), 12501-12506 (2017).
- Sandoval-Guzman, T., et al. Fundamental differences in dedifferentiation and stem cell recruitment during skeletal muscle regeneration in two salamander species. Cell Stem Cell. 14 (2), 174-187 (2014).
- Tassava, R. A., Mescher, A. L. The roles of injury, nerves, and the wound epidermis during the initiation of amphibian limb regeneration. Differentiation. 4 (1), 23-24 (1975).
- Hay, E. D., Fischman, D. A. Origin of the blastema in regenerating limbs of the newt Triturus viridescens. An autoradiographic study using tritiated thymidine to follow cell proliferation and migration. Developmental Biology. 3, 26-59 (1961).
- Christensen, R. N., Tassava, R. A. Apical epithelial cap morphology and fibronectin gene expression in regenerating axolotl limbs. Developmental Dynamics. 217 (2), 216-224 (2000).
- Repesh, L. A., Oberpriller, J. C. Scanning electron microscopy of epidermal cell migration in wound healing during limb regeneration in the adult newt, Notophthalmus viridescens. American Journal of Anatomy. 151 (4), 539-555 (1978).
- Neufeld, D. A., Day, F. A., Settles, H. E. Stabilizing role of the basement membrane and dermal fibers during newt limb regeneration. Anatomical Record. 245 (1), 122-127 (1996).
- Singer, M., Saltpeter, M. M., Zarrow, M. X. . Growth in Living Systems. , (1961).
- Mescher, A. L. Effects on adult newt limb regeneration of partial and complete skin flaps over the amputation surface. Journal of Experimental Zoology. 195 (1), 117-128 (1976).
- Tassava, R. A., Garling, D. J. Regenerative responses in larval axolotl limbs with skin grafts over the amputation surface. Journal of Experimental Zoology. 208 (1), 97-110 (1979).
- Tornier, G. Der Kampf der Gewebe im Regeneratbei Begunsiigung der Hautregeneralion. Arch. Entwmech. 22, 348-352 (1906).
- Goss, R. J. Regenerative inhibition following limb amputation and immediate insertion into the body cavity. Anatomical Record. 126 (1), 15-27 (1956).
- Thornton, C. S. The effect of apical cap removal on limb regeneration in Amblystoma larvae. Journal of Experimental Zoology. 134 (2), 357-381 (1957).
- Thornton, C. S. The inhibition of limb regeneration in urodele larvae by localized irradiation with ultraviolet light. Journal of Experimental Zoology. 137 (1), 153-179 (1958).
- Tsai, S. L., Baselga-Garriga, C., Melton, D. A. Midkine is a dual regulator of wound epidermis development and inflammation during the initiation of limb regeneration. Elife. 9, (2020).
- Nowoshilow, S., et al. The axolotl genome and the evolution of key tissue formation regulators. Nature. 554 (7690), 50-55 (2018).
- Elewa, A., et al. Reading and editing the Pleurodeles waltl genome reveals novel features of tetrapod regeneration. Nature Communications. 8 (1), 2286 (2017).
- Bryant, D. M., et al. A Tissue-Mapped Axolotl De Novo Transcriptome Enables Identification of Limb Regeneration Factors. Cell Reports. 18 (3), 762-776 (2017).
- Looso, M., et al. A de novo assembly of the newt transcriptome combined with proteomic validation identifies new protein families expressed during tissue regeneration. Genome Biology. 14 (2), 16 (2013).
- Abdullayev, I., Kirkham, M., Bjorklund, A. K., Simon, A., Sandberg, R. A reference transcriptome and inferred proteome for the salamander Notophthalmus viridescens. Experimental Cell Research. 319 (8), 1187-1197 (2013).
- Burns, J. A., Zhang, H., Hill, E., Kim, E., Kerney, R. Transcriptome analysis illuminates the nature of the intracellular interaction in a vertebrate-algal symbiosis. Elife. 6, (2017).
- Nakamura, K., et al. A transcriptome for the study of early processes of retinal regeneration in the adult newt, Cynops pyrrhogaster. PLoS One. 9 (10), 109831 (2014).
- Smith, J. J., et al. A chromosome-scale assembly of the axolotl genome. Genome Research. 29 (2), 317-324 (2019).
- Arenas Gomez, C. M., Woodcock, R. M., Smith, J. J., Voss, S. R., Delgado, J. P. Using transcriptomics to enable a plethodontid salamander (Bolitoglossa ramosi) for limb regeneration research. BMC Genomics. 19 (704), (2018).
- Fei, J. F., et al. Application and optimization of CRISPR-Cas9-mediated genome engineering in axolotl (Ambystoma mexicanum). Nature Protocols. 13 (12), 2908-2943 (2018).
- Flowers, G. P., Timberlake, A. T., McLean, K. C., Monaghan, J. R., Crews, C. M. Highly efficient targeted mutagenesis in axolotl using Cas9 RNA-guided nuclease. Development. 141 (10), 2165-2171 (2014).
- Khattak, S., et al. Optimized axolotl (Ambystoma mexicanum) husbandry, breeding, metamorphosis, transgenesis and tamoxifen-mediated recombination. Nature Protocols. 9 (3), 529-540 (2014).
- Joven, A., Elewa, A., Simon, A. Model systems for regeneration: salamanders. Development. 146 (14), (2019).
- Johnson, K., Bateman, J., DiTommaso, T., Wong, A. Y., Whited, J. L. Systemic cell cycle activation is induced following complex tissue injury in axolotl. Developmental Biology. 433 (2), 461-472 (2018).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados