Method Article
Inibição da Formação de Epiderme ferida através de cirurgia de retalho de pele completa durante a regeneração do membro axolotl
Neste Artigo
Resumo
Este artigo descreve como realizar um método cirúrgico para inibir a formação de epiderme de feridas durante a regeneração do membro axolotl, suturando imediatamente a pele de espessura total sobre o plano de amputação. Este método permite que os pesquisadores investiguem os papéis funcionais da epiderme da ferida durante os estágios iniciais da regeneração dos membros.
Resumo
Experimentos clássicos em biologia regenerativa salamandra ao longo do último século estabeleceram há muito tempo que a epiderme da ferida é uma estrutura de sinalização crucial que se forma rapidamente após a amputação e é necessária para a regeneração dos membros. No entanto, os métodos para estudar sua função precisa no nível molecular nas últimas décadas foram limitados devido à escassez de técnicas funcionais precisas e informações genômicas disponíveis em sistemas de modelo salamandra. Empolgante, a recente infinidade de tecnologias de sequenciamento, juntamente com a liberação de vários genomas de salamandra e o advento de métodos de teste genéticos funcionais, incluindo o CRISPR, torna possível re-visitar esses experimentos fundamentais em resolução molecular sem precedentes. Aqui, descrevo como realizar a cirurgia de retalho de pele completa (FSF) desenvolvida clássicamente em axolotls adultos, a fim de inibir a formação de epiderme ferida imediatamente após a amputação. A epiderme da ferida normalmente se forma através da migração distal de células epiteliais na pele proximal para o plano de amputação para selar a ferida do ambiente externo. A cirurgia envolve a sutura imediata da pele de espessura total (que inclui camadas epidérmicas e dérmicas) sobre o plano de amputação para dificultar a migração de células epiteliais e o contato com os tecidos mesenquimais danificados subjacentes. Cirurgias bem sucedidas resultam na inibição da formação de blastema e regeneração de membros. Combinando este método cirúrgico com análises moleculares e funcionais contemporâneas a jusante, os pesquisadores podem começar a descobrir os fundamentos moleculares da função de epiderme da ferida e da biologia durante a regeneração dos membros.
Introdução
Desde que Lazzaro Spallanzani o relatou em 17681, a regeneração de membros da salamandra tem sido um dos fenômenos regenerativos naturais mais bem estudados que tem apaixonado biólogos por séculos. A regeneração bem sucedida dos membros depende da formação, do crescimento e da padronização subsequente de uma estrutura celular indiferenciada conhecida como blastema. Pesquisadores têm feito avanços significativos na compreensão da composição celular do blastema, bem como quais tecidos de apoio e tipos celulares são necessários para sua formação2,3,4,5,6,7,8,9,10,11,12,13 . No entanto, os mecanismos coordenados de sinalização entre diferentes tecidos e tipos celulares que levam ao início da formação de blastema permanecem mal compreendidos.
Um requisito fundamental para a formação e regeneração bem sucedida de blastema é a epiderme da ferida, um epitélio transitório e especializado que cobre o plano de amputação dentro de 12 horas após a amputação10. Após a amputação, as células epiteliais da pele intacta proximal para a lesão migram rapidamente sobre o plano de amputação para formar um epitélio de ferida fina14. À medida que o blastema se forma nas semanas seguintes, a epiderme da ferida precoce desenvolve-se em uma estrutura de sinalização epitelial mais espessa chamada a tampa epitelial apical (AEC)15. Enquanto a pele de espessura total normal contém uma camada epitelial e dérmica separada por uma lamina basal, a epiderme/AEC da ferida consiste apenas de uma camada epitelial e carece de uma lamina basal16,17. A ausência da lamina basal e da derme permite o contato direto entre as células epiteliais feridas e os tecidos subjacentes, o que facilita a sinalização bidirecional entre os dois compartimentos que é fundamental tanto para a formação de blastema quanto para manutenção17,18.
Estudos experimentais clássicos elaboraram vários métodos cirúrgicos inovadores para sondar a função epiderme/AEC da ferida através da inibição de sua formação. Estes métodos incluíram sutura19 ou enxerto de espessura total da pele20,21 sobre o plano de amputação, suturando imediatamente o membro amputado na cavidade corporal22, e remoção diária contínua ou irradiação da epiderme da ferida precoce e AEC23,24. Ao todo, esses experimentos não só estabeleceram a importância da epiderme/AEC da ferida, mas também determinaram seus papéis na histolise do tecido precoce, bem como mantiveram a proliferação progenitora celular e o crescimento do blastemal13 durante toda a regeneração.
No entanto, esses estudos anteriores foram em grande parte limitados à coloração histológica, bem como pulsos tritiados de timmidina para rastrear a proliferação celular. De fato, revisitar esses experimentos clássicos com tecnologias modernas de sequenciamento e técnicas funcionais em salamandras só foi feito recentemente e levou à descoberta de papéis adicionais para a epiderme da ferida na modulação da inflamação e degradação/deposição do ECM durante os estágios iniciais da regeneração25. Com a liberação de várias sequências de genoma salamandra e transcriptome26,27,28,29,30,31,32,33,34, bem como o crescente número de métodos funcionais disponíveis em espécies de salamandra111,35,36,37,38 , os pesquisadores estão agora bem posicionados para começar a desvendar os mecanismos moleculares que conduzem a formação, função e desenvolvimento de epiderme de feridas.
Infelizmente, vários desses métodos clássicos utilizados para inibir a formação de epiderme de feridas são tecnicamente desafiadores, apresentando dificuldades para a reprodutibilidade entre réplicas biológicas no mesmo experimento. Por exemplo, a manutenção de enxertos de pele pode ser um desafio, pois os enxertos podem eventualmente cair do membro hospedeiro e a remoção da epiderme da ferida/AEC diariamente é difícil sem danificar os tecidos subjacentes. Além disso, a sutura do membro amputado na cavidade corporal é desafiadora e também requer lesões adicionais no local da inserção. Por outro lado, suturar a pele de espessura total imediatamente sobre o plano de amputação é relativamente simples, tecnicamente reproduzível, e introduz danos mínimos nos tecidos. Este método cirúrgico de retalho de pele completa (FSF) foi previamente desenvolvido por Anthony Mescher em 1976 em newts adultos (Notophthalmus viridiscens). Ele demonstrou que a cirurgia FSF inibiu a formação e função da epiderme da ferida, proibindo tanto a migração de células epiteliais sobre o plano de amputação quanto o contato direto entre as células epiteliais e os tecidos subjacentes.
Aqui, este procedimento cirúrgico é mostrado passo a passo usando o membro axolotl. Juntamente com as tecnologias moleculares e sequenciais modernas, essa técnica pode ser muito útil para os pesquisadores aprofundarem nossa compreensão da formação e função da epiderme da ferida/AEC durante a regeneração dos membros.
Protocolo
Todos os experimentos em animais foram realizados de acordo com as diretrizes da IACUC (Protocolo #: 11-32) e AAALAC na Universidade de Harvard.
1. Preparação de soluções e configuração para anestesia e recuperação
- Prepare uma solução fresca de 0,1% de tricaine para anestesia e solução de sal de sódio sulfameraína de 0,5% para recuperação. Tornar as soluções usando água adequada para a criação axolotl37 de acordo com protocolos aprovados da IACUC na instituição de pesquisa relevante (modificação da solução de Holtfreter, por exemplo). Certifique-se de que as soluções estão bem misturadas e que o volume suficiente é preparado para submergir todo o axolotl.
- Para preparar 0,1% de solução tricaina, misture 1 g de tricaine e 1 g de bicarbonato de sódio com 1 L de água. A solução pode ser ampliada de acordo com esta receita.
- Para preparar 0,5% solução de sal de sódio sulfamerazina, misture 5 g de sal de sódio sulfamerazina com 1 L de água. A solução pode ser ampliada de acordo com esta receita. A solução de sulfamerazina é um anti-biótico que evitará infecção bacteriana durante a recuperação cirúrgica.
- Higienize a área cirúrgica pulverizando-a com Clidox-S ou 70% de etanol. Esterilizar ferramentas cirúrgicas (fórceps, tesoura dissecando, tesoura de mola) por autoclavagem. Se realizar múltiplas cirurgias, certifique-se de esterilizar as ferramentas cirúrgicas com um esterilizador de contas quentes entre os animais.
- Para configurar a área de recuperação, coloque uma placa de Petri de 15 cm ou qualquer recipiente que se encaixe no axolotl em cima de um balde cheio de gelo molhado. Encha a placa de Petri com um baixo nível de 0,5% de solução de sal de sódio sulfamerazina, o suficiente para que o axolotl não fique totalmente submerso. A recuperação do gelo pós-cirurgia irá retardar o movimento do animal enquanto ele acorda da anestesia, permitindo que a área suturada se cure relativamente intacta.
NOTA: Esta configuração pode ser personalizada pelos pesquisadores, dependendo dos materiais disponíveis.
2. Realizando o procedimento cirúrgico de retalho de pele completo
- Anestesiar o axolotl submerse-o em um recipiente de 0,1% de solução tricaina. Isso levará aproximadamente 15-20 minutos. Certifique-se de que o axolotl está de fato totalmente anestesiado, realizando uma pitada de cauda. Se não houver resposta do axlotl, prossiga com a cirurgia.
NOTA: Use axlotls mais antigos e maiores para esta cirurgia (pelo menos 15 cm de tamanho). Certifique-se de que o axlotl permanece bem hidratado durante toda a cirurgia, molhando a pele periodicamente com água do sistema axolotl usando uma pipeta plástica. Certifique-se de preparar aseticamente o local cirúrgico irrigando a área com PBS estéril antes da cirurgia. O animal também deve ser colocado em uma cortina cirúrgica estéril para o procedimento. - Realize uma amputação de membro na extremidade distal dos elementos esqueléticos zeugopodial utilizando a tesoura dissecando (Figura 1.1).
- Utilizando a tesoura de mola, faça uma pequena incisão (aproximadamente 2 mm) na porção ventral da pele (Figura 1.2).
- Usando os fórceps, retire cuidadosamente a pele para aproximadamente a linha média dos elementos esqueléticos zeugopodial, expondo os tecidos subjacentes dos membros (músculo, osso, etc.) (Figura 1.3). Certifique-se de não danificar a pele. Veja nota após o passo 2.8.
- Ampute os tecidos de membros subjacentes expostos na linha média do zeugopode usando tesoura cirúrgica (Figura 1.4).
- Empurre o tecido muscular com a tesoura cirúrgica e corte o osso exposto.
NOTA: Isso é necessário para garantir uma melhor cicatrização e também para aumentar o sucesso da cirurgia, pois o osso saliente pode ser irregular contra a aba suturada e interromper a integridade de uma aba de pele intacta mais tarde. - Utilizando os fórceps, puxe cuidadosamente a pele extra de espessura total sobre o plano de amputação para cobrir os tecidos subjacentes expostos e a sutura no lugar, conectando-se com a pele de espessura total ventral (Figura 1.5).
- Suturar os lados esquerdo e esquerdo restantes da aba da pele nas porções ventrais subjacentes da pele intacta. Isso pode ser feito suturando os lados da aba de forma "cruz cruzada" (recomendada) (Figura 1.6-1.9), ou simplesmente suturando diretamente na pele ventral. Use as fórceps e a tesoura de mola curvada para sutura. Certifique-se de que nenhum tecido subjacente exposto possa ser visto e que as suturas estejam amarradas (amarradas pelo menos três vezes).
NOTA: É fundamental que a pele intacta não esteja danificada nas etapas 2.4, 2.7-2.8. Descobrimos que os danos na pele de espessura total foram correlacionados com cirurgias mal sucedidas, pois as áreas de dano ainda podem formar uma pequena epiderme ferida. Se possível, tente usar um par de fórceps mais maçante ao entregar a aba de pele de espessura total. - Realize uma amputação no membro contralateral (controle animal interno opcional) amputando-o no nível médio do zeugopod com uma tesoura cirúrgica. Empurre o tecido muscular com uma tesoura cirúrgica e corte o osso exposto.
NOTA: Um controle interno do membro contralateral pode ser feito para avaliar melhor o sucesso da cirurgia durante a etapa 4 no mesmo animal. No entanto, a amputação do mesmo membro em um animal separado também pode ser usada para servir como controle.
3. Recuperação e cuidado pós-operatórios
- Uma vez que a cirurgia esteja completa, coloque um Kimwipe ou uma toalha de papel estéril na parte inferior do recipiente ou placa de Petri para molhá-la. Coloque o animal no recipiente em gelo molhado e enrole delicadamente as extremidades expostas do Kimwipe ou toalha de papel ao redor do topo do animal para mantê-lo bem hidratado com solução de sulfamerazina. Deixe no gelo molhado por 30 minutos a 1 hora para garantir o movimento mínimo durante a recuperação da anestesia.
- Coloque o animal em um recipiente estático com solução de sulfamerazina de 0,5%. Os axolotes devem permanecer nesta solução durante as primeiras 24 horas, a fim de prevenir a infecção.
- Coloque o axlotl em água normal do sistema e monitore a saúde diariamente. Certifique-se de que nenhuma sutura caia todos os dias, pois isso pode resultar em uma pequena epiderme ferida formando que confundirá os resultados.
NOTA: Certifique-se de que o recipiente de habitação tenha amplo espaço para o axololo se mover e minimizar as chances de que o membro suturado no axolotl possa entrar em contato com as laterais do recipiente. Isso ajudará a garantir que as suturas permaneçam no lugar, especialmente durante a primeira semana pós-cirurgia.
4. Avaliar o sucesso da cirurgia sob um microscópio estéreo
NOTA: Recomendamos verificar animais sob um microscópio estereo pelo menos uma vez por semana para avaliar a integridade da retalho da pele completa e o sucesso da cirurgia.
- Anestesiar o axlotl em 0,1% de tricaine como no Passo 2.1. Certifique-se de que há amplo espaço no recipiente para que o axolotl se mova.
- Se inspecionar durante as duas primeiras semanas pós-cirurgia, inspecione o membro suturado usando um estereoscópio para garantir que nenhuma sutura tenha surgido e que uma epiderme de ferida fina clara não seja visível em lugar nenhum. Se inspecionar na terceira semana pós-cirurgia ou posterior, certifique-se de que um blastema não tenha se formado e compare com a forma como o membro amputado de controle normal (seja do mesmo animal ou de um animal diferente) progrediu durante a regeneração (ou seja, se um blastema se formou).
- Quando feito, devolva o axolotl às condições normais de água do sistema e da pecuária.
Resultados
Este protocolo cirúrgico permitirá a inibição completa da formação de epiderme da ferida (Figura 1) e, finalmente, regeneração de membros. Uma cirurgia bem sucedida resulta em nenhuma formação de blastema em aproximadamente 2-3 semanas, dependendo do tamanho do animal, enquanto os membros regeneradores de controle devem formar um blastema normalmente.
Os pesquisadores devem inspecionar o membro suturado a olho nu a cada 2-3 dias para garantir que as suturas não tenham surgido e que um blastema não esteja se formando. Se uma ou mais das suturas aparecerem, uma epiderme ferida ainda pode se formar resultando em uma pequena ou grande blastema e uma cirurgia mal sucedida (Figura 2). Além disso, os pesquisadores devem inspecionar o membro suturado pelo menos uma vez por semana sob um estereoscópio para garantir que uma epiderme de ferida fina não seja evidente em nenhum lugar da superfície de amputação. Para comparação, os pesquisadores também devem examinar o membro regenerador de controle que deve ter uma epiderme ferida sobre o plano de amputação e formar um blastema ao longo de 2-3 semanas. A epiderme ferida aparecerá fina e clara, enquanto a pele normal aparecerá mais opaca e rosa pálida (quase branca), amarelo claro ou verde escuro em axolotls leucísticos, albinos ou selvagens, respectivamente.
Se os pesquisadores desejam coletar tecido antes dos estágios de formação de blastema em 2-3 semanas, eles devem inspecionar os membros suturados antes da coleta de amostras para garantir que as suturas permanecessem no local e que uma pequena epiderme ferida não se formasse. Além disso, a seção sagitalmente através do tecido suturado do membro e a realização de análises histológicas a qualquer momento também pode verificar a presença da derme a partir da aba de pele completa circundando todo o plano de amputação e a ausência de uma epiderme ferida (Figura 3).
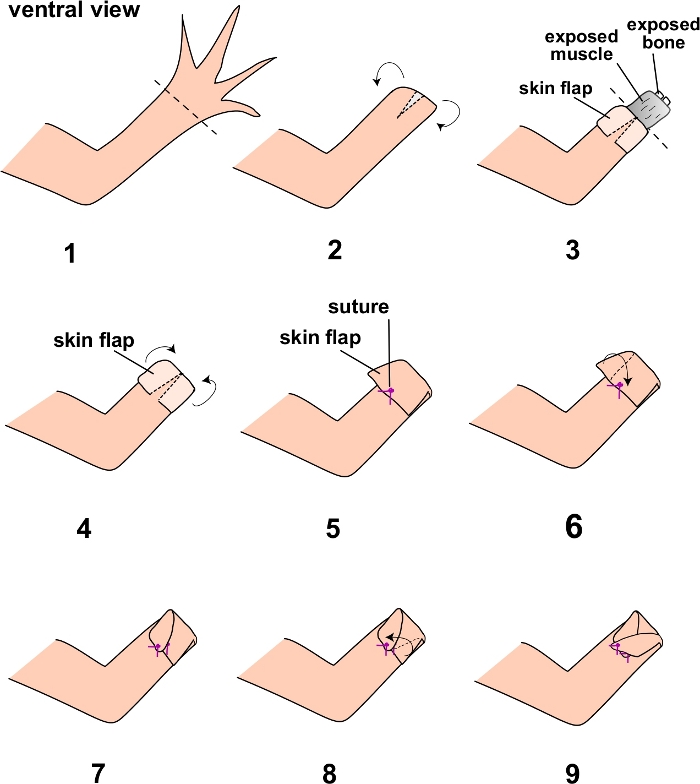
Figura 1: Esquema dos passos da cirurgia completa do retalho da pele.
As etapas do protocolo estão numeradas e diagramadas aqui. As linhas pontilhadas denotam os planos de amputação nas etapas 1 e 3 do protocolo. Clique aqui para ver uma versão maior desta figura.

Figura 2: Exemplos de cirurgias de retalhos de pele completa bem sucedidas e mal sucedidas.
Imagem representativa de brightfield de um membro que foi submetido a uma cirurgia bem sucedida (esquerda), uma cirurgia mal sucedida (direita) e um membro regenerador de controle (sem cirurgia) aos 25 dias após a amputação (dpa). A cirurgia bem sucedida tem um plano de amputação plano onde o retalho de pele foi suturado, enquanto a cirurgia mal sucedida tem uma pequena blastema se desenvolvendo. Pontas de flecha denotam o plano de amputação e linhas pontilhadas brancas estão lá para ajudar na visualização da ausência de um blastema na cirurgia bem sucedida e presença de blastemas na cirurgia mal sucedida e controlar membros regeneradores. Clique aqui para ver uma versão maior desta figura.
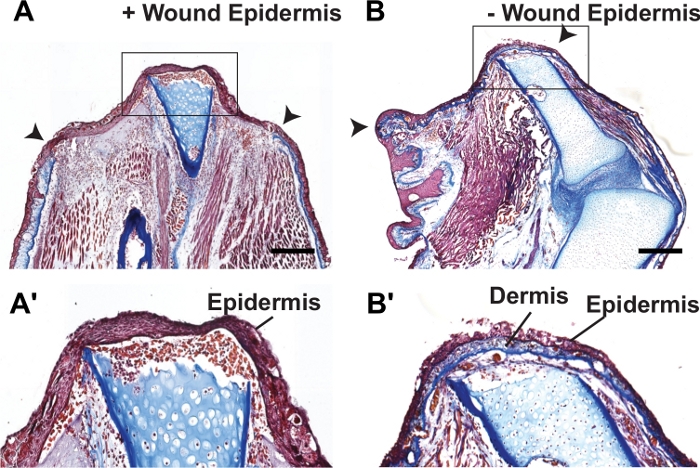
Figura 3: Coloração histológica de membros regenerados normais e FSF sutured.
(A-B') Imagens representativas de brightfield de seções manchadas picro-mallory de regeneração (A-A') e membros axolotl sutured (B-B') em 7 dpa. Os insets em A e B são mostrados em A' e B', respectivamente. O colágeno-pesado linhas de camada dérmica e cobre todo o plano de amputação em membros suturados. O avião de amputação é denotado por pontas de flecha em A-B. As barras de escala representam 500 μm. Este número foi adaptado de Tsai et al.25. Clique aqui para ver uma versão maior desta figura.
Discussão
Este artigo descreve um protocolo para a realização de cirurgias de retalhos de pele completas em membros axolotl para inibir a formação de epiderme de feridas. Embora esta cirurgia seja relativamente simples e tecnicamente reprodutível em comparação com outros métodos de inibição da formação de epiderme de feridas, existem várias etapas críticas que podem impactar o sucesso da cirurgia. Primeiro, ao puxar a aba de pele intacta sobre os tecidos subjacentes expostos, é primordial que a pele de espessura total não seja danificada de forma alguma. Danos na aba da pele ainda podem levar à formação de uma pequena epiderme de ferida, o que pode resultar em um pequeno crescimento semelhante a uma explosão. Em segundo lugar, garantir que as suturas não caiam durante o atendimento pós-operatório, pois isso também pode levar à formação de uma pequena epiderme ferida. Até este ponto, minimizar o contato potencial entre o membro suturado e quaisquer superfícies é importante, especialmente durante a primeira semana pós-cirurgia. Várias maneiras de prevenir isso implicam habitação e anestesiar o axolotl em um recipiente grande o suficiente para que o axolotl tenha muito espaço para se mover após a cirurgia.
Esta cirurgia também tem várias limitações. Talvez o mais notável seja que o sucesso das cirurgias só pode ser avaliado de duas maneiras: usar o escopo de dissecação durante as duas primeiras semanas de cirurgia para procurar a ausência de uma epiderme ferida e/ou verificar se uma blastema se forma dentro de 3 semanas. Embora esses métodos sejam eficazes, eles são relativamente baixos rendimentos. O desenvolvimento de futuros axolotis de repórter transgênicos para marcadores específicos de epiderme de feridas pode ajudar na triagem mais rápida para cirurgias bem sucedidas versus mal sucedidas. Além disso, esta cirurgia é mais difícil de realizar em animais mais jovens, pois a pele intacta é mais frágil. Recomenda-se, portanto, o uso de axlotls sub-adultos ou adultos.
Embora esta cirurgia tenha sido originalmente desenvolvida em N. viridiscens19, ela foi facilmente adaptada para axolotls25,39 e provavelmente pode ser aplicada a outras espécies de salamandra também. Em suma, a aplicação dessa técnica em futuros estudos regenerativos de membros capacitará os pesquisadores a desenvolver mais ferramentas para abordar a biologia da epiderme ferida e identificar os mecanismos subjacentes que conduzem sua função no início da formação de blastema.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
O autor agradece a Doug por seu constante encorajamento e apoio inabalável, bem como aos membros do laboratório Melton por seus comentários úteis e comentários sobre o manuscrito. O autor também gostaria de agradecer ao Escritório de Recursos Animais de Harvard (OAR) por seus cuidados dedicados aos animais.
Materiais
| Name | Company | Catalog Number | Comments |
| Curved spring scissors | Fine Scientific Tools | 15009-08 | |
| Ethyl 3-aminobenzoate methanesulfonate (Tricaine) | Sigma-Aldrich | 886-86-2 | |
| Forceps | Fine Scientific Tools | 11252-40 | Need two pairs |
| Nylon monofilament sutures (9-0) | Roboz | SUT-1000-21 | |
| Sodium bicarbonate | Sigma-Aldrich | S5761 | |
| Stereo microscope | Leica | MZ6 | |
| Sulfamerazine sodium salt | Sigma-Aldrich | 127-58-2 | |
| Surgical scissors | Fine Scientific Tools | 14002-14 |
Referências
- Spallanzani, L. . Prodromo Di Un'opera Da Imprimersi Sopra Le Riproduzioni Animali. , (1768).
- Gerber, T., et al. Single-cell analysis uncovers convergence of cell identities during axolotl limb regeneration. Science. , (2018).
- Leigh, N. D., et al. Transcriptomic landscape of the blastema niche in regenerating adult axolotl limbs at single-cell resolution. Nature Communications. 9 (1), 5153 (2018).
- Kragl, M., et al. Cells keep a memory of their tissue origin during axolotl limb regeneration. Nature. 460 (7251), 60-65 (2009).
- McCusker, C., Bryant, S. V., Gardiner, D. M. The axolotl limb blastema: cellular and molecular mechanisms driving blastema formation and limb regeneration in tetrapods. Regeneration (Oxford). 2 (2), 54-71 (2015).
- Endo, T., Bryant, S. V., Gardiner, D. M. A stepwise model system for limb regeneration. Developmental Biology. 270 (1), 135-145 (2004).
- Tsai, S. L. The molecular interplay between progenitors and immune cells in tissue regeneration and homeostasis. Journal of Immunology and Regenerative Medicine. 7, 100024 (2020).
- Godwin, J. W., Pinto, A. R., Rosenthal, N. A. Macrophages are required for adult salamander limb regeneration. Proceedings of the National Academy of Sciences of the United States of America. 110 (23), 9415-9420 (2013).
- Tanaka, E. M. The molecular and cellular choreography of appendage regeneration. Cell. 165 (7), 1598-1608 (2016).
- Campbell, L. J., Crews, C. M. Wound epidermis formation and function in urodele amphibian limb regeneration. Cellular and Molecular Life Sciences. 65 (1), 73-79 (2008).
- Fei, J. F., et al. Efficient gene knockin in axolotl and its use to test the role of satellite cells in limb regeneration. Proceedings of the National Academy of Sciences of the United States of America. 114 (47), 12501-12506 (2017).
- Sandoval-Guzman, T., et al. Fundamental differences in dedifferentiation and stem cell recruitment during skeletal muscle regeneration in two salamander species. Cell Stem Cell. 14 (2), 174-187 (2014).
- Tassava, R. A., Mescher, A. L. The roles of injury, nerves, and the wound epidermis during the initiation of amphibian limb regeneration. Differentiation. 4 (1), 23-24 (1975).
- Hay, E. D., Fischman, D. A. Origin of the blastema in regenerating limbs of the newt Triturus viridescens. An autoradiographic study using tritiated thymidine to follow cell proliferation and migration. Developmental Biology. 3, 26-59 (1961).
- Christensen, R. N., Tassava, R. A. Apical epithelial cap morphology and fibronectin gene expression in regenerating axolotl limbs. Developmental Dynamics. 217 (2), 216-224 (2000).
- Repesh, L. A., Oberpriller, J. C. Scanning electron microscopy of epidermal cell migration in wound healing during limb regeneration in the adult newt, Notophthalmus viridescens. American Journal of Anatomy. 151 (4), 539-555 (1978).
- Neufeld, D. A., Day, F. A., Settles, H. E. Stabilizing role of the basement membrane and dermal fibers during newt limb regeneration. Anatomical Record. 245 (1), 122-127 (1996).
- Singer, M., Saltpeter, M. M., Zarrow, M. X. . Growth in Living Systems. , (1961).
- Mescher, A. L. Effects on adult newt limb regeneration of partial and complete skin flaps over the amputation surface. Journal of Experimental Zoology. 195 (1), 117-128 (1976).
- Tassava, R. A., Garling, D. J. Regenerative responses in larval axolotl limbs with skin grafts over the amputation surface. Journal of Experimental Zoology. 208 (1), 97-110 (1979).
- Tornier, G. Der Kampf der Gewebe im Regeneratbei Begunsiigung der Hautregeneralion. Arch. Entwmech. 22, 348-352 (1906).
- Goss, R. J. Regenerative inhibition following limb amputation and immediate insertion into the body cavity. Anatomical Record. 126 (1), 15-27 (1956).
- Thornton, C. S. The effect of apical cap removal on limb regeneration in Amblystoma larvae. Journal of Experimental Zoology. 134 (2), 357-381 (1957).
- Thornton, C. S. The inhibition of limb regeneration in urodele larvae by localized irradiation with ultraviolet light. Journal of Experimental Zoology. 137 (1), 153-179 (1958).
- Tsai, S. L., Baselga-Garriga, C., Melton, D. A. Midkine is a dual regulator of wound epidermis development and inflammation during the initiation of limb regeneration. Elife. 9, (2020).
- Nowoshilow, S., et al. The axolotl genome and the evolution of key tissue formation regulators. Nature. 554 (7690), 50-55 (2018).
- Elewa, A., et al. Reading and editing the Pleurodeles waltl genome reveals novel features of tetrapod regeneration. Nature Communications. 8 (1), 2286 (2017).
- Bryant, D. M., et al. A Tissue-Mapped Axolotl De Novo Transcriptome Enables Identification of Limb Regeneration Factors. Cell Reports. 18 (3), 762-776 (2017).
- Looso, M., et al. A de novo assembly of the newt transcriptome combined with proteomic validation identifies new protein families expressed during tissue regeneration. Genome Biology. 14 (2), 16 (2013).
- Abdullayev, I., Kirkham, M., Bjorklund, A. K., Simon, A., Sandberg, R. A reference transcriptome and inferred proteome for the salamander Notophthalmus viridescens. Experimental Cell Research. 319 (8), 1187-1197 (2013).
- Burns, J. A., Zhang, H., Hill, E., Kim, E., Kerney, R. Transcriptome analysis illuminates the nature of the intracellular interaction in a vertebrate-algal symbiosis. Elife. 6, (2017).
- Nakamura, K., et al. A transcriptome for the study of early processes of retinal regeneration in the adult newt, Cynops pyrrhogaster. PLoS One. 9 (10), 109831 (2014).
- Smith, J. J., et al. A chromosome-scale assembly of the axolotl genome. Genome Research. 29 (2), 317-324 (2019).
- Arenas Gomez, C. M., Woodcock, R. M., Smith, J. J., Voss, S. R., Delgado, J. P. Using transcriptomics to enable a plethodontid salamander (Bolitoglossa ramosi) for limb regeneration research. BMC Genomics. 19 (704), (2018).
- Fei, J. F., et al. Application and optimization of CRISPR-Cas9-mediated genome engineering in axolotl (Ambystoma mexicanum). Nature Protocols. 13 (12), 2908-2943 (2018).
- Flowers, G. P., Timberlake, A. T., McLean, K. C., Monaghan, J. R., Crews, C. M. Highly efficient targeted mutagenesis in axolotl using Cas9 RNA-guided nuclease. Development. 141 (10), 2165-2171 (2014).
- Khattak, S., et al. Optimized axolotl (Ambystoma mexicanum) husbandry, breeding, metamorphosis, transgenesis and tamoxifen-mediated recombination. Nature Protocols. 9 (3), 529-540 (2014).
- Joven, A., Elewa, A., Simon, A. Model systems for regeneration: salamanders. Development. 146 (14), (2019).
- Johnson, K., Bateman, J., DiTommaso, T., Wong, A. Y., Whited, J. L. Systemic cell cycle activation is induced following complex tissue injury in axolotl. Developmental Biology. 433 (2), 461-472 (2018).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados