Method Article
Aksolotl Ekstremite Rejenerasyonu Sırasında Tam Cilt Flep Cerrahisi ile Yara Epidermisi Oluşumunun İnhibisyonu
Bu Makalede
Özet
Bu makalede, aksolotl ekstremite rejenerasyonu sırasında yara epidermisi oluşumunu inhibe etmek için amputasyon düzlemi üzerinde tam kalınlıkta deri dikişleyerek cerrahi bir yöntemin nasıl uygulanacağı anlatılmaktadır. Bu yöntem, araştırmacıların ekstremite rejenerasyonunun erken aşamalarında yara epidermisinin fonksiyonel rollerini araştırmalarını sağlar.
Özet
Son yüzyılda semender rejeneratif biyolojisindeki klasik deneyler, yara epidermisinin amputasyon sonrası hızla oluşan ve uzuv rejenerasyonu için gerekli olan çok önemli bir sinyal yapısı olduğunu uzun zamandır ortaya koymuştur. Bununla birlikte, son on yıllarda moleküler düzeyde kesin işlevini inceleme yöntemleri, semender model sistemlerinde bulunan kesin fonksiyonel tekniklerin ve genomik bilgilerin yetersizliği nedeniyle sınırlandırılmıştır. Heyecan verici bir şekilde, çeşitli semender genomlarının serbest bırakılması ve CRISPR de dahil olmak üzere fonksiyonel genetik test yöntemlerinin ortaya çıkmasıyla birleşen dizileme teknolojilerinin son zamanlardaki bolluğu, bu temel deneyleri benzeri görülmemiş moleküler çözünürlükte tekrar ziyaret etmeyi mümkün kılmaktadır. Burada, amputasyondan hemen sonra yara epidermisi oluşumunu inhibe etmek için yetişkin aksolotllarda klasik olarak geliştirilmiş tam deri flebi (FSF) cerrahisinin nasıl yapılacağını anlatıyorum. Yara epidermisi normalde yarayı dış ortamdan kapatmak için amputasyon düzlemine proksimal derideki epitel hücrelerinin distal göçü yoluyla oluşur. Ameliyat, epitel hücre göçünü ve altta yatan hasarlı mezenkimal dokularla teması engellemek için amputasyon düzlemi üzerinde tam kalınlıkta cildin (hem epidermal hem de dermal tabakaları içeren) derhal dikilmesini gerektirir. Başarılı ameliyatlar blastema oluşumunun ve ekstremite rejenerasyonunun inhibisyonu ile sonuçlanır. Bu cerrahi yöntemi çağdaş aşağı akış moleküler ve fonksiyonel analizlerle birleştirerek, araştırmacılar uzuv rejenerasyonu sırasında yara epidermisi fonksiyonunun ve biyolojisinin moleküler temellerini ortaya çıkarmaya başlayabilirler.
Giriş
Lazzaro Spallanzani'nin 17681'de bildirdiğinden beri, semender uzuv rejenerasyonu, yüzyıllardır biyologları büyüleyen en iyi çalışılmış doğal rejeneratif fenomenlerden biri olmuştur. Başarılı uzuv rejenerasyonu, blastema olarak bilinen farklılaşmamış bir hücresel yapının oluşumuna, büyümesine ve ardından modellenmesine bağlıdır. Araştırmacılar, blastemanın hücresel bileşimini ve oluşumu için hangi destekleyici dokuların ve hücre tiplerinin gerekli olduğunu anlamada önemli adımlar atmışlardır2,3,4,5,6,7,8,9,10,11,12,13 . Bununla birlikte, blastema oluşumunun başlamasına yol açan farklı dokular ve hücre tipleri arasındaki koordineli sinyal mekanizmaları tam olarak anlaşılamamıştır.
Başarılı blastema oluşumu ve rejenerasyonu için anahtar gereksinim, amputasyondan sonraki 12 saat içinde amputasyon düzlemini kaplayan geçici ve uzmanlaşmış bir epitel olan yara epidermidir10. Amputasyonu takiben, sağlam deri proksimal yaralanmasına kadar epitel hücreleri, ince bir yara epiteli oluşturmak için amputasyon düzlemi üzerinden hızla göç eder14. Blastema sonraki haftalarda oluştukça, erken yara epidermisi apikal epitel kapağı (AEC)15 adı verilen daha kalın bir epitel sinyal yapısına dönüşür. Normal tam kat deri, bazal lamina ile ayrılmış hem epitel hem de dermal tabaka içerirken, yara epidermis/AEC sadece epitel tabakasından oluşur ve bazal laminadan yoksundur16,17. Bazal lamina ve dermisin yokluğu, yara epitel hücreleri ile altta yatan dokular arasında doğrudan temasa izin verir ve bu da hem blastema oluşumu hem de bakım için kritik olan iki bölme arasında çift yönlü sinyalleşmeyi kolaylaştırır17,18.
Klasik deneysel çalışmalarda yara epidermis/AEK fonksiyonunu ve gerekliliğini inhibe ederek oluşumunu inhibe etmek için çeşitli yenilikçi cerrahi yöntemler geliştirilmiştir. Bu yöntemler arasında dikiş19 veya amputasyon düzlemi üzerinde tam kalınlıkta deri20,21 greftleme, ampute edilen ekstremitenin derhal vücut boşluğuna dikilmesi22 ve erken yara epidermisinin ve AEC23,24'ün sürekli günlük olarak çıkarılması veya ışınlanması yer alıyordu. Toplamda, bu deneyler sadece yara epidermisi / AEC'nin önemini ortaya koymakla kalmadı, aynı zamanda erken doku histolizindeki rollerini daha da belirledi ve rejenerasyon boyunca progenitör hücre proliferasyonunu ve blastemal büyümeyi13 sürdürdü.
Bununla birlikte, bu önceki çalışmalar büyük ölçüde histolojik boyama ve hücre proliferasyonunu izlemek için tritiated timidin pulses ile sınırlıydı. Aslında, bu klasik deneylerin semenderlerde modern dizileme teknolojileri ve fonksiyonel tekniklerle tekrar gözden geçirilmesi ancak yakın zamanda yapılmış ve rejenerasyonun erken aşamalarında inflamasyon ve ECM bozunması / birikiminin modüle edilmesinde yara epidermisi için ek rollerin keşfedilmesine yol açmıştır25. Çeşitli semender genomu ve transkriptom dizilerinin serbest bırakılmasıyla26,27,28,29,30,31,32,33,34 ve semender türlerinde mevcut fonksiyonel yöntemlerin sayısının artmasıyla11,35,36,37,38 Araştırmacılar şimdi yara epidermisi oluşumunu, fonksiyonunu ve AEC gelişimini yönlendiren moleküler mekanizmaları çözmeye başlamak için iyi konumlandırılmıştır.
Ne yazık ki, yara epidermisi oluşumunu inhibe etmek için kullanılan bu klasik yöntemlerin birçoğu teknik olarak zordur ve aynı deneydeki biyolojik replikalar arasında tekrarlanabilirlik için zorluklar ortaya koymaktadır. Örneğin, cilt greftlerinin bakımı zor olabilir, çünkü greftler sonunda konakçı uzuvdan düşebilir ve yara epidermisi / AEC'nin günlük olarak çıkarılması, altta yatan dokulara zarar vermeden zordur. Ayrıca, ampute edilmiş uzuvun vücut boşluğuna dikilmesi zordur ve ayrıca yerleştirme bölgesinde ek yaralanma gerektirir. Öte yandan, tam kalınlıktaki cildin amputasyon düzlemi üzerine dikilmesi nispeten basittir, teknik olarak tekrarlanabilir ve minimum doku hasarı sağlar. Bu tam deri flebi (FSF) cerrahi yöntemi daha önce Anthony Mescher tarafından 1976 yılında yetişkin yenilerde (Notophthalmus viridiscens) geliştirilmiştir. FSF cerrahisinin hem amputasyon düzlemi üzerinde epitel hücre göçünü hem de epitel hücreleri ile altta yatan dokular arasındaki doğrudan teması yasaklayarak yara epidermisi oluşumunu ve fonksiyonunu inhibe ettiğini gösterdi.
Burada, bu cerrahi prosedür aksolotl uzuv kullanılarak adım adım gösterilmektedir. Günümüz moleküler ve dizileme teknolojileri ile birleştiğinde, bu teknik, araştırmacıların uzuv rejenerasyonu sırasında yara epidermisi / AEC oluşumu ve fonksiyonu hakkındaki anlayışımızı derinleştirmeleri için çok yararlı olabilir.
Protokol
Tüm hayvan deneyleri, Harvard Üniversitesi'nde IACUC (Protokol #: 11-32) ve AAALAC kılavuzlarına uygun olarak gerçekleştirilmiştir.
1. Anestezi ve iyileşme için çözümler ve kurulum hazırlama
- Anestezi için taze% 0.1 trikain çözeltisi ve% 0.5 sülfamerrazin sodyum tuzu çözeltisi hazırlayın. Su kullanarak çözeltileri ilgili araştırma kurumundaki onaylı IACUC protokollerine göre aksolotl yetiştiriciliği için uygun hale getirin37 (örneğin Holtfreter'in çözümünü değiştirin). Çözeltilerin iyi karıştırıldığından ve tüm aksolotu batırmak için yeterli hacmin hazırlandığından emin olun.
- % 0.1 trikain çözeltisi hazırlamak için, 1 g trikain ve 1 g sodyum bikarbonatı 1 L su ile karıştırın. Çözelti bu tarife göre ölçeklendirilebilir.
- % 0.5 sülfamerazin sodyum tuzu çözeltisi hazırlamak için, 5 g sülfamerazin sodyum tuzunu 1 L su ile karıştırın. Çözelti bu tarife göre ölçeklendirilebilir. Sülfamerrazin çözeltisi, cerrahi iyileşme sırasında bakteriyel enfeksiyonu önleyecek bir antibiyotiktir.
- Cerrahi bölgeyi Clidox-S veya% 70 etanol ile püskürterek sterilize edin. Cerrahi aletleri (forseps, diseksiyon makasları, yaylı makas) otoklavlama ile sterilize edin. Birden fazla ameliyat yapıyorsanız, cerrahi aletleri hayvanlar arasında sıcak boncuk sterilizatörü ile sterilize ettiğinizden emin olun.
- Geri kazanım alanını ayarlamak için, 15 cm'lik bir Petri kabını veya aksolotu ıslak buzla dolu bir kovanın üzerine sığdıracak herhangi bir kabı yerleştirin. Petri kabını, aksolotlün tamamen suya batırılmaması için yeterli% 0.5'lik düşük bir sülfamerazin sodyum tuzu çözeltisi ile doldurun. Ameliyat sonrası buz üzerindeki iyileşme, anesteziden uyanırken hayvanın hareketini yavaşlatacak ve dikişli bölgenin nispeten bozulmadan iyileşmesini sağlayacaktır.
NOT: Bu kurulum, hangi malzemelere sahip olduklarına bağlı olarak araştırmacılar tarafından özelleştirilebilir.
2. Tam deri flebi cerrahi prosedürünün uygulanması
- Aksolotl'u% 0.1'lik bir trikain çözeltisine batırarak anestezi altına alın. Bu yaklaşık 15-20 dakika sürecektir. Aksolotlün gerçekten bir kuyruk tutamağı yaparak tamamen anestezi altına alındığından emin olun. Aksolotldan yanıt yoksa, ameliyata devam edin.
NOT: Bu ameliyat için daha eski, daha büyük aksolotller kullanın (en az 15 cm boyutunda). Plastik bir pipet kullanarak cildi periyodik olarak aksolotl sistem suyuyla ıslatarak aksolotlün ameliyat boyunca iyi nemlendirildiğinden emin olun. Ameliyattan önce bölgeyi steril PBS ile sulayarak cerrahi bölgeyi aseptik olarak hazırladığınızdan emin olun. Hayvan ayrıca prosedür için steril bir cerrahi örtü üzerine yerleştirilmelidir. - Diseksiyon makası kullanarak zeugopodial iskelet elemanlarının distal ucunda bir uzuv amputasyonu gerçekleştirin (Şekil 1.1).
- Yay makasını kullanarak, cildin ventral kısmında küçük bir kesi (yaklaşık 2 mm) yapın (Şekil 1.2).
- Forsepsleri kullanarak, cildi zeugopodial iskelet elemanlarının yaklaşık orta çizgisine kadar dikkatlice soyun ve altta yatan uzuv dokularını (kas, kemik vb.) (Şekil 1.3). Cilde zarar vermediğinizden emin olun. 2.8. adımdan sonraki nota bakın.
- Zeugopodun orta hattında açıkta kalan altta yatan ekstremite dokularını cerrahi makas kullanarak amputasyon yapın (Şekil 1.4).
- Kas dokusunu cerrahi makasla geri itin ve açıkta kalan kemiği kesin.
NOT: Bu, daha iyi iyileşmeyi sağlamak ve ayrıca çıkıntılı kemik dikişli flebe karşı pürüzlü olabileceğinden ve daha sonra sağlam bir cilt kapağının bütünlüğünü bozabileceğinden, ameliyatın başarısını artırmak için gereklidir. - Forsepsleri kullanarak, ventral tam kalınlıktaki deriye bağlanarak maruz kalan altta yatan dokuları örtmek ve dikişi yerinde tutmak için ekstra tam kalınlıktaki cildi amputasyon düzlemi üzerine dikkatlice çekin (Şekil 1.5).
- Cildin kalan sağ ve sol taraflarını, sağlam cildin altta yatan ventral kısımlarına dikin. Bu, flebin yanlarını "çapraz çapraz" bir şekilde dikerek (önerilen) (Şekil 1.6-1.9) veya doğrudan ventral cilde dikerek yapılabilir. Dikiş için forseps ve kavisli yay makası kullanın. Açıkta kalan altta yatan dokuların görülmediğinden ve dikişlerin sıkıca bağlandığından (en az üç kez düğümlendiğinden) emin olun.
NOT: Sağlam cildin adım 2.4, 2.7-2.8'de hasar görmemesi çok önemlidir. Tam kat deriye verilen hasarın başarısız ameliyatlarla ilişkili olduğunu bulduk, çünkü hasar alanları hala küçük bir yara epidermisi oluşturabilir. Mümkünse, tam kalınlıktaki deri kapağını verirken daha soluk bir çift forseps kullanmaya çalışın. - Kontralateral uzuv üzerinde bir amputasyon yapın (isteğe bağlı iç hayvan kontrolü), cerrahi makasla orta zeugopod seviyesinde amputasyon yapın. Kas dokusunu cerrahi makasla geri itin ve açıkta kalan kemiği kesin.
NOT: Aynı hayvanda 4. adımda ameliyatın başarısını daha iyi değerlendirmek için dahili bir kontralateral ekstremite kontrolü yapılabilir. Bununla birlikte, aynı ekstremitenin ayrı bir hayvanda amputasyonu, kontrol görevi görmek için de kullanılabilir.
3. Ameliyat sonrası iyileşme ve bakım
- Ameliyat tamamlandıktan sonra, ıslatmak için kabın veya Petri kabının altına bir Kimwipe veya steril kağıt havlu yerleştirin. Hayvanı ıslak buz üzerinde kabın içine yerleştirin ve Kimwipe veya kağıt havlunun açıkta kalan uçlarını, sülfamerrazin çözeltisi ile iyi nemlendirilmiş halde tutmak için hayvanın üst kısmına yavaşça sarın. Anesteziden iyileşme sırasında minimum hareket sağlamak için ıslak buz üzerinde 30 dakika ila 1 saat bekletin.
- Hayvanı% 0.5 sülfamerrazin çözeltisi içeren statik bir muhafaza kabına yerleştirin. Aksolotllar, enfeksiyonu önlemek için ilk 24 saat boyunca bu çözeltide kalmalıdır.
- Aksolotlü normal sistem suyuna yerleştirin ve sağlığı günlük olarak izleyin. Her gün hiçbir dikişin düşmediğinden emin olun, çünkü bu, sonuçları karıştıracak küçük bir yara epidermisi oluşumuna neden olabilir.
NOT: Muhafaza kabının, aksolotlün hareket etmesi için yeterli alana sahip olduğundan emin olun ve aksolotl üzerindeki dikişli uzuvun kabın yanlarıyla temas etme olasılığını en aza indirin. Bu, özellikle ameliyat sonrası ilk hafta boyunca dikişlerin yerinde kalmasını sağlamaya yardımcı olacaktır.
4. Ameliyatın başarısının stereo mikroskop altında değerlendirilmesi
NOT: Tam cilt flebinin bütünlüğünü ve ameliyatın başarısını değerlendirmek için hayvanları haftada en az bir kez stereo mikroskop altında kontrol etmenizi öneririz.
- Aksolotu Adım 2.1'de olduğu gibi% 0.1 trikain içinde anestezi altına alın. Kapta aksolotlün hareket etmesi için geniş bir alan olduğundan emin olun.
- Ameliyattan sonraki ilk iki hafta boyunca muayene ediliyorsa, dikişlerin çıkmadığından ve berrak bir ince yara epidermisinin hiçbir yerde görünmediğinden emin olmak için dikişli uzuvları bir stereomikroskop kullanarak inceleyin. Ameliyat sonrası üçüncü haftada veya daha sonra muayene yapıyorsanız, bir blastema oluşmadığından emin olun ve normal kontrol ampute uzuvunun (aynı hayvandan veya farklı bir hayvandan) rejenerasyon sırasında nasıl ilerlediği ile karşılaştırın (yani, bir blastema oluşup oluşmadığı).
- Tamamlandığında, aksolotlü normal sistem su ve hayvancılık koşullarına geri döndürün.
Sonuçlar
Bu cerrahi protokol, yara epidermisi oluşumunun (Şekil 1) ve nihayetinde ekstremite rejenerasyonunun tamamen inhibisyonuna izin verecektir. Başarılı bir ameliyat, hayvanın büyüklüğüne bağlı olarak yaklaşık 2-3 hafta içinde blastema oluşumu ile sonuçlanmazken, kontrol yenileyici uzuvlar normal olarak bir blastema oluşturmalıdır.
Araştırmacılar, dikişlerin dışarı çıkmadığından ve bir blastema oluşmadığından emin olmak için dikişli uzuvları her 2-3 günde bir çıplak gözle incelemelidir. Dikişlerden bir veya daha fazlası çıkarsa, küçük veya büyük bir blastema ve başarısız bir cerrahi ile sonuçlanan bir yara epidermisi oluşabilir (Şekil 2). Ek olarak, araştırmacılar, ince bir yara epidermisinin amputasyon yüzeyinin herhangi bir yerinde belirgin olmadığından emin olmak için dikişli uzuvları haftada en az bir kez stereomikroskop altında incelemelidir. Karşılaştırma için, araştırmacılar amputasyon düzlemi üzerinde bir yara epidermisine sahip olması gereken kontrol yenileyici uzuvları da incelemeli ve 2-3 hafta boyunca bir blastema oluşturmalıdır. Yara epidermisi ince ve berrak görünürken, normal cilt sırasıyla lösistik, albino veya wildtype aksolotllarda daha opak ve soluk pembe (neredeyse beyaz), açık sarı veya koyu yeşil görünecektir.
Araştırmacılar 2-3 haftada blastema oluşum aşamalarından önce doku toplamak isterlerse, dikişlerin yerinde kaldığından ve küçük bir yara epidermisinin oluşmadığından emin olmak için numune toplamadan önce dikişli uzuvları incelemelidirler. Ek olarak, dikişli ekstremite dokusundan sagital olarak kesitleme ve herhangi bir zaman noktasında histolojik analizler yapmak, tüm amputasyon düzlemini çevreleyen tam deri flebinden dermisin varlığını ve bir yara epidermisinin yokluğunu da doğrulayabilir (Şekil 3).
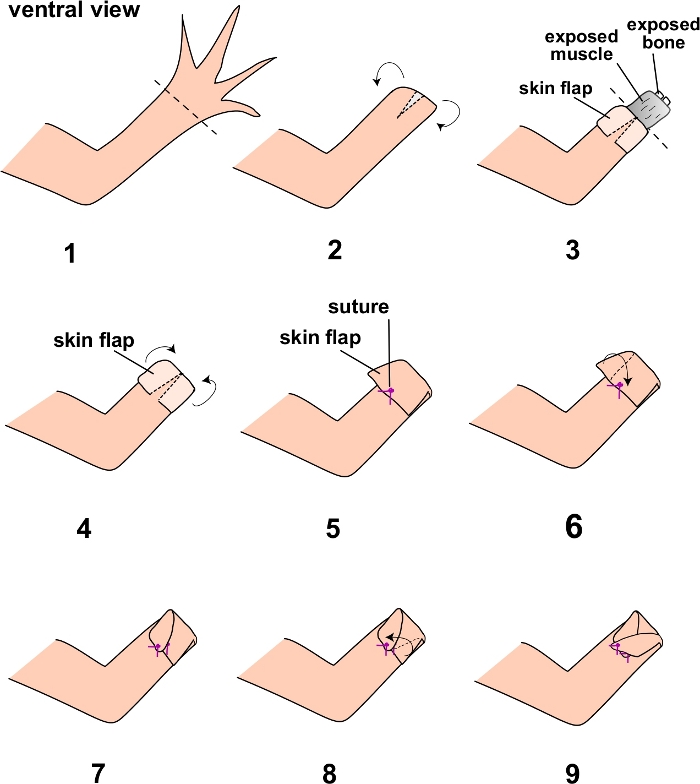
Şekil 1: Tam deri flebi ameliyatının basamaklarının şeması.
Protokolün adımları burada numaralandırılır ve diyagramı çizilir. Noktalı çizgiler, protokolün 1. ve 3. adımlarındaki amputasyon düzlemlerini gösterir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Şekil 2: Başarılı ve başarısız tam deri flebi ameliyatlarına örnekler.
Amputasyondan 25 gün sonra başarılı bir ameliyat (solda), başarısız bir ameliyat (sağda) ve kontrol yenileyici bir uzuv (ameliyat olmadan) geçirmiş bir uzuvun temsili parlak alan görüntüsü. Başarılı cerrahi, tam cilt flebinin dikildiği düz bir amputasyon düzlemine sahipken, başarısız ameliyatta küçük bir blastema gelişir. Ok uçları amputasyon düzlemini gösterir ve beyaz noktalı çizgiler, başarılı cerrahide blastema yokluğunun ve başarısız ameliyatta blastema varlığının görselleştirilmesine yardımcı olmak ve yenileyici uzuvları kontrol etmek için vardır. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
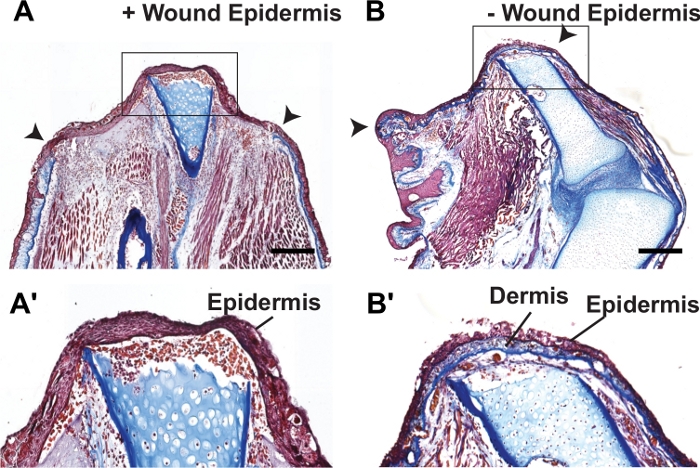
Şekil 3: Normal rejenere ve FSF dikişli uzuvların histolojik boyanması.
(A-B') 7 dpa'da rejenerasyondan (A-A') ve dikişli aksolotl uzuvlardan (B-B') pikro-mallori boyalı kesitlerin temsili parlak alan görüntüleri. A ve B'deki girintiler sırasıyla A' ve B' olarak gösterilir. Kollajen ağırlıklı dermal tabaka çizgilerini çizer ve dikişli uzuvlarda tüm amputasyon düzlemini kaplar. Amputasyon düzlemi A-B'de ok uçları ile gösterilir. Ölçek çubukları 500 μm'yi temsil eder. Bu rakam Tsai ve ark.25'ten uyarlanmıştır. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Bu makalede, yara epidermisi oluşumunu inhibe etmek için aksolotl ekstremitelerde tam deri flebi ameliyatlarının yapılması için bir protokol anlatılmaktadır. Bu ameliyat, yara epidermisi oluşumunu inhibe eden diğer yöntemlere kıyasla nispeten basit ve teknik olarak tekrarlanabilir olsa da, ameliyatın başarısını etkileyebilecek birkaç kritik adım vardır. İlk olarak, sağlam tam cilt kapağını maruz kalan altta yatan dokuların üzerine çekerken, tam kalınlıktaki cildin hiçbir şekilde zarar görmemesi çok önemlidir. Cilt kapağındaki hasar hala küçük bir yara epidermisi oluşumuna yol açabilir, bu da küçük bir blastema benzeri büyümeye neden olabilir. İkincisi, ameliyat sonrası bakım sırasında dikişlerin düşmediğinden emin olun, çünkü bu aynı zamanda küçük bir yara epidermisi oluşumuna da yol açabilir. Bu noktada, dikişli uzuv ile herhangi bir yüzey arasındaki potansiyel teması en aza indirmek, özellikle ameliyat sonrası ilk hafta boyunca önemlidir. Bunu önlemenin birkaç yolu, aksolotlün ameliyat sonrası hareket etmek için bol miktarda alana sahip olması için yeterince büyük bir kapta aksolotlün yuvalanmasını ve anestezi yapılmasını gerektirir.
Bu ameliyatın da bazı sınırlamaları vardır. Belki de en önemlisi, ameliyatların başarısının sadece iki şekilde değerlendirilebilmesidir: ameliyatın ilk iki haftasında diseksiyon kapsamını kullanarak bir yara epidermisinin yokluğunu araştırmak ve / veya 3 hafta içinde bir blastema oluşup oluşmadığını kontrol etmek. Bu yöntemler etkili olsa da, nispeten düşük aktarım hızıdır. Yara epidermise özgü belirteçler için gelecekteki transgenik muhabir aksolotlların geliştirilmesi, başarılı ve başarısız ameliyatlar için daha hızlı taramaya yardımcı olabilir. Ayrıca, sağlam cilt daha kırılgan olduğu için bu ameliyatın genç hayvanlarda yapılması daha zordur. Bu nedenle sub-adult veya adult aksolotlların kullanılması önerilir.
Bu ameliyat başlangıçta N. viridiscens19'da geliştirilmiş olsa da, aksolotllar25,39 için kolayca uyarlanmıştır ve muhtemelen diğer semender türlerine de uygulanabilir. Özetle, bu tekniğin gelecekteki uzuv rejeneratif çalışmalarına uygulanması, araştırmacıların hem yara epidermisi biyolojisini ele almak için daha fazla araç geliştirmelerini hem de blastema oluşumunu başlatmadaki işlevini yürüten altta yatan mekanizmaları tanımlamalarını sağlayacaktır.
Açıklamalar
Yazarların açıklayacak hiçbir şeyleri yoktur.
Teşekkürler
Yazar, Doug'a sürekli cesaretlendirmesi ve sarsılmaz desteği için ve Melton laboratuvarı üyelerine de yararlı geri bildirimleri ve el yazması hakkındaki yorumları için teşekkür eder. Yazar ayrıca Harvard Hayvan Kaynakları Ofisi'ne (OAR) özverili hayvan bakımı için teşekkür eder.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Curved spring scissors | Fine Scientific Tools | 15009-08 | |
| Ethyl 3-aminobenzoate methanesulfonate (Tricaine) | Sigma-Aldrich | 886-86-2 | |
| Forceps | Fine Scientific Tools | 11252-40 | Need two pairs |
| Nylon monofilament sutures (9-0) | Roboz | SUT-1000-21 | |
| Sodium bicarbonate | Sigma-Aldrich | S5761 | |
| Stereo microscope | Leica | MZ6 | |
| Sulfamerazine sodium salt | Sigma-Aldrich | 127-58-2 | |
| Surgical scissors | Fine Scientific Tools | 14002-14 |
Referanslar
- Spallanzani, L. . Prodromo Di Un'opera Da Imprimersi Sopra Le Riproduzioni Animali. , (1768).
- Gerber, T., et al. Single-cell analysis uncovers convergence of cell identities during axolotl limb regeneration. Science. , (2018).
- Leigh, N. D., et al. Transcriptomic landscape of the blastema niche in regenerating adult axolotl limbs at single-cell resolution. Nature Communications. 9 (1), 5153 (2018).
- Kragl, M., et al. Cells keep a memory of their tissue origin during axolotl limb regeneration. Nature. 460 (7251), 60-65 (2009).
- McCusker, C., Bryant, S. V., Gardiner, D. M. The axolotl limb blastema: cellular and molecular mechanisms driving blastema formation and limb regeneration in tetrapods. Regeneration (Oxford). 2 (2), 54-71 (2015).
- Endo, T., Bryant, S. V., Gardiner, D. M. A stepwise model system for limb regeneration. Developmental Biology. 270 (1), 135-145 (2004).
- Tsai, S. L. The molecular interplay between progenitors and immune cells in tissue regeneration and homeostasis. Journal of Immunology and Regenerative Medicine. 7, 100024 (2020).
- Godwin, J. W., Pinto, A. R., Rosenthal, N. A. Macrophages are required for adult salamander limb regeneration. Proceedings of the National Academy of Sciences of the United States of America. 110 (23), 9415-9420 (2013).
- Tanaka, E. M. The molecular and cellular choreography of appendage regeneration. Cell. 165 (7), 1598-1608 (2016).
- Campbell, L. J., Crews, C. M. Wound epidermis formation and function in urodele amphibian limb regeneration. Cellular and Molecular Life Sciences. 65 (1), 73-79 (2008).
- Fei, J. F., et al. Efficient gene knockin in axolotl and its use to test the role of satellite cells in limb regeneration. Proceedings of the National Academy of Sciences of the United States of America. 114 (47), 12501-12506 (2017).
- Sandoval-Guzman, T., et al. Fundamental differences in dedifferentiation and stem cell recruitment during skeletal muscle regeneration in two salamander species. Cell Stem Cell. 14 (2), 174-187 (2014).
- Tassava, R. A., Mescher, A. L. The roles of injury, nerves, and the wound epidermis during the initiation of amphibian limb regeneration. Differentiation. 4 (1), 23-24 (1975).
- Hay, E. D., Fischman, D. A. Origin of the blastema in regenerating limbs of the newt Triturus viridescens. An autoradiographic study using tritiated thymidine to follow cell proliferation and migration. Developmental Biology. 3, 26-59 (1961).
- Christensen, R. N., Tassava, R. A. Apical epithelial cap morphology and fibronectin gene expression in regenerating axolotl limbs. Developmental Dynamics. 217 (2), 216-224 (2000).
- Repesh, L. A., Oberpriller, J. C. Scanning electron microscopy of epidermal cell migration in wound healing during limb regeneration in the adult newt, Notophthalmus viridescens. American Journal of Anatomy. 151 (4), 539-555 (1978).
- Neufeld, D. A., Day, F. A., Settles, H. E. Stabilizing role of the basement membrane and dermal fibers during newt limb regeneration. Anatomical Record. 245 (1), 122-127 (1996).
- Singer, M., Saltpeter, M. M., Zarrow, M. X. . Growth in Living Systems. , (1961).
- Mescher, A. L. Effects on adult newt limb regeneration of partial and complete skin flaps over the amputation surface. Journal of Experimental Zoology. 195 (1), 117-128 (1976).
- Tassava, R. A., Garling, D. J. Regenerative responses in larval axolotl limbs with skin grafts over the amputation surface. Journal of Experimental Zoology. 208 (1), 97-110 (1979).
- Tornier, G. Der Kampf der Gewebe im Regeneratbei Begunsiigung der Hautregeneralion. Arch. Entwmech. 22, 348-352 (1906).
- Goss, R. J. Regenerative inhibition following limb amputation and immediate insertion into the body cavity. Anatomical Record. 126 (1), 15-27 (1956).
- Thornton, C. S. The effect of apical cap removal on limb regeneration in Amblystoma larvae. Journal of Experimental Zoology. 134 (2), 357-381 (1957).
- Thornton, C. S. The inhibition of limb regeneration in urodele larvae by localized irradiation with ultraviolet light. Journal of Experimental Zoology. 137 (1), 153-179 (1958).
- Tsai, S. L., Baselga-Garriga, C., Melton, D. A. Midkine is a dual regulator of wound epidermis development and inflammation during the initiation of limb regeneration. Elife. 9, (2020).
- Nowoshilow, S., et al. The axolotl genome and the evolution of key tissue formation regulators. Nature. 554 (7690), 50-55 (2018).
- Elewa, A., et al. Reading and editing the Pleurodeles waltl genome reveals novel features of tetrapod regeneration. Nature Communications. 8 (1), 2286 (2017).
- Bryant, D. M., et al. A Tissue-Mapped Axolotl De Novo Transcriptome Enables Identification of Limb Regeneration Factors. Cell Reports. 18 (3), 762-776 (2017).
- Looso, M., et al. A de novo assembly of the newt transcriptome combined with proteomic validation identifies new protein families expressed during tissue regeneration. Genome Biology. 14 (2), 16 (2013).
- Abdullayev, I., Kirkham, M., Bjorklund, A. K., Simon, A., Sandberg, R. A reference transcriptome and inferred proteome for the salamander Notophthalmus viridescens. Experimental Cell Research. 319 (8), 1187-1197 (2013).
- Burns, J. A., Zhang, H., Hill, E., Kim, E., Kerney, R. Transcriptome analysis illuminates the nature of the intracellular interaction in a vertebrate-algal symbiosis. Elife. 6, (2017).
- Nakamura, K., et al. A transcriptome for the study of early processes of retinal regeneration in the adult newt, Cynops pyrrhogaster. PLoS One. 9 (10), 109831 (2014).
- Smith, J. J., et al. A chromosome-scale assembly of the axolotl genome. Genome Research. 29 (2), 317-324 (2019).
- Arenas Gomez, C. M., Woodcock, R. M., Smith, J. J., Voss, S. R., Delgado, J. P. Using transcriptomics to enable a plethodontid salamander (Bolitoglossa ramosi) for limb regeneration research. BMC Genomics. 19 (704), (2018).
- Fei, J. F., et al. Application and optimization of CRISPR-Cas9-mediated genome engineering in axolotl (Ambystoma mexicanum). Nature Protocols. 13 (12), 2908-2943 (2018).
- Flowers, G. P., Timberlake, A. T., McLean, K. C., Monaghan, J. R., Crews, C. M. Highly efficient targeted mutagenesis in axolotl using Cas9 RNA-guided nuclease. Development. 141 (10), 2165-2171 (2014).
- Khattak, S., et al. Optimized axolotl (Ambystoma mexicanum) husbandry, breeding, metamorphosis, transgenesis and tamoxifen-mediated recombination. Nature Protocols. 9 (3), 529-540 (2014).
- Joven, A., Elewa, A., Simon, A. Model systems for regeneration: salamanders. Development. 146 (14), (2019).
- Johnson, K., Bateman, J., DiTommaso, T., Wong, A. Y., Whited, J. L. Systemic cell cycle activation is induced following complex tissue injury in axolotl. Developmental Biology. 433 (2), 461-472 (2018).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır