Method Article
Axolotl 사지 재생 중 전체 피부 플랩 수술을 통한 상처 표피 형성 억제
요약
이 글에서는 절단면을 통해 전두께의 피부를 즉시 봉합하여 액솔로틀 사지 재생 동안 상처 표피 형성을 억제하는 수술 방법을 수행하는 방법을 설명한다. 이 방법을 통해 연구자들은 사지 재생의 초기 단계에서 상처 표피의 기능적 역할을 조사 할 수 있습니다.
초록
지난 세기 동안 도롱뇽 재생 생물학의 고전 실험은 상처 표피가 절단 후 빠르게 형성되고 사지 재생에 필요한 중요한 신호 구조라는 것을 오랫동안 확립했습니다. 그러나 지난 수십 년 동안 분자 수준에서 정확한 기능을 연구하는 방법은 도롱뇽 모델 시스템에서 사용할 수있는 정확한 기능 기술과 게놈 정보가 부족하기 때문에 제한적이었습니다. 흥미롭게도, 다양한 도롱뇽 게놈의 방출과 CRISPR을 포함한 기능적 유전자 검사 방법의 출현과 결합 된 최근의 수많은 시퀀싱 기술은 전례없는 분자 분해능으로 이러한 기본 실험을 다시 방문 할 수있게합니다. 여기에서는 절단 직후 상처 표피 형성을 억제하기 위해 성체 액솔로틀에서 고전적으로 개발 된 전체 피부 플랩 (FSF) 수술을 수행하는 방법을 설명합니다. 상처 표피는 일반적으로 외부 환경으로부터 상처를 봉쇄하기 위해 절단면에 근접한 피부 내의 상피 세포의 원위 이동을 통해 형성됩니다. 수술은 상피 세포 이동 및 근본적인 손상된 중간엽 조직과의 접촉을 방해하기 위해 절단면을 통해 전체 두께의 피부 (표피 및 진피층 모두를 포함)를 즉시 봉합하는 것을 수반합니다. 성공적인 수술은 blastema 형성 및 사지 재생의 억제를 초래합니다. 이 수술 방법을 현대의 하류 분자 및 기능 분석과 결합함으로써 연구자들은 사지 재생 중 상처 표피 기능과 생물학의 분자 토대를 밝히기 시작할 수 있습니다.
서문
Lazzaro Spallanzani가 17681 년에보고 한 이래로, 도롱뇽 사지 재생은 수세기 동안 생물 학자들을 매혹시킨 가장 잘 연구 된 자연 재생 현상 중 하나였습니다. 성공적인 사지 재생은 blastema로 알려진 미분화 된 세포 구조의 형성, 성장 및 후속 패터닝에 달려 있습니다. 연구자들은 blastema의 세포 조성뿐만 아니라 그 형성에 필요한 지원 조직 및 세포 유형을 이해하는 데 상당한 진전을 이루었습니다.2,3,4,5,6,7,8,9,10,11,12,13 . 그러나, 블라스템마 형성의 개시를 유도하는 상이한 조직과 세포 유형 사이의 조정된 신호전달 메카니즘은 여전히 잘 이해되지 않고 있다.
성공적인 블라스테마 형성 및 재생을위한 핵심 요구 사항은 절단 후 12 시간 이내에 절단면을 덮는 일시적이고 전문화 된 상피 인 상처 표피입니다10. 절단 후, 손상에 근접한 무손상 피부로부터의 상피 세포는 절단면을 통해 빠르게 이동하여 얇은 상처 상피를 형성한다14. 다음 주에 blastema가 형성됨에 따라, 초기 상처 표피는 정점 상피 캡 (AEC)15라고 불리는 두꺼운 상피 신호 전달 구조로 발전합니다. 정상적인 전체 두께의 피부는 기저 라미나로 분리 된 상피 및 진피 층을 모두 포함하지만 상처 표피 / AEC는 상피층으로 만 구성되어 있으며 기본 라미나가 부족합니다 16,17. 기저 라미나와 진피의 부재는 상처 상피 세포와 하부 조직 사이의 직접적인 접촉을 허용하며, 이는 블라스템마 형성 및 유지에 중요한 두 구획 사이의 양방향 신호 전달을 용이하게합니다17,18.
고전적인 실험 연구는 상처 표피 / AEC 기능과 필요성을 억제하여 그 형성을 억제함으로써 다양한 혁신적인 수술 방법을 고안했습니다. 이러한 방법에는 봉합19 또는 절단면을 통해 전두께 피부20,21을 접목하고, 절단된 사지를 체강 내로 즉시 봉합하고22, 초기 상처 표피 및 AEC23,24를 매일 지속적으로 제거 또는 조사하는 것이 포함되었다. 전체적으로, 이러한 실험은 상처 표피/AEC의 중요성을 확립했을 뿐만 아니라, 초기 조직 조직분해에서 그 역할을 더욱 결정했을 뿐만 아니라 재생 전반에 걸쳐 전구 세포 증식 및 모세포종 증식13을 유지하였다.
그러나, 이러한 이전의 연구들은 주로 조직학적 염색뿐만 아니라 세포 증식을 추적하기 위한 트리티미딘 펄스로 제한되었다. 사실, 도롱뇽의 현대 시퀀싱 기술 및 기능 기술로 이러한 고전적 실험을 재검토하는 것은 최근에야 이루어졌으며 재생 초기 단계에서 염증 및 ECM 분해 / 침착을 조절하는 상처 표피에 대한 추가 역할의 발견으로 이어졌습니다25. 다양한 도롱뇽 게놈 및 전사체 서열26,27,28,29,30,31,32,33,34뿐만 아니라 도롱뇽 종에서 이용 가능한 기능적 방법의 급증하는 수와 함께11,35,36,37,38 연구진은 이제 상처 표피 형성, 기능 및 AEC 개발을 주도하는 분자 메커니즘을 풀기 시작할 수있는 좋은 위치에 있습니다.
불행히도, 상처 표피 형성을 억제하기 위해 사용 된 이러한 고전적인 방법 중 일부는 기술적으로 도전적이며, 동일한 실험에서 생물학적 복제물 간의 재현성에 어려움을 겪고 있습니다. 예를 들어, 이식편이 결국 숙주 사지에서 떨어질 수 있고 상처 표피 / AEC를 매일 제거하는 것이 기본 조직을 손상시키지 않으면 어렵 기 때문에 피부 이식편을 유지하는 것이 어려울 수 있습니다. 또한, 절단 된 사지를 체강으로 봉합하는 것은 어렵고 삽입 부위에서 추가 부상이 필요합니다. 한편, 절단면 바로 위에 전체 두께의 피부를 봉합하는 것은 비교적 간단하고, 기술적으로 재현성이 있으며, 조직 손상을 최소화한다. 이 전체 피부 플랩 (FSF) 수술 방법은 이전에 1976 년 Anthony Mescher가 성인 뉴트 (Notophthalmus viridiscens)에서 개발했습니다. 그는 FSF 수술이 절단면을 통한 상피 세포 이동과 상피 세포와 기저 조직 간의 직접적인 접촉을 금지함으로써 상처 표피 형성 및 기능을 억제한다는 것을 입증했습니다.
여기서, 이러한 수술 절차는 axolotl 사지를 이용한 단계별 시술이다. 현대의 분자 및 시퀀싱 기술과 결합하여이 기술은 연구자가 사지 재생 중에 상처 표피 / AEC 형성 및 기능에 대한 이해를 깊게하는 데 매우 도움이 될 수 있습니다.
프로토콜
모든 동물 실험은 하버드 대학의 IACUC (프로토콜 #: 11-32) 및 AAALAC 지침에 따라 수행되었습니다.
1. 마취 및 회복을위한 솔루션 준비 및 설정
- 마취를 위해 신선한 0.1 % 트리카인 용액과 회복을 위해 0.5 % 설파 메라 진 나트륨 염 용액을 준비하십시오. 관련 연구 기관에서 승인 된 IACUC 프로토콜 (예 : Holtfreter의 솔루션을 수정 한 경우)에 따라 axolotl 축산에 적합한 물을 사용하여 솔루션을 만드십시오. 용액이 잘 혼합되어 있고 전체 axolotl을 잠수하기 위해 충분한 부피가 준비되어 있는지 확인하십시오.
- 0.1% 트리카인 용액을 준비하려면 트리케인 1g과 중탄산나트륨 1g을 물 1L에 섞는다. 솔루션은이 레시피에 따라 확장 될 수 있습니다.
- 0.5 % 설파 메라 진 나트륨 염 용액을 준비하려면 설파 메라 진 나트륨 염 5g을 물 1L와 섞으십시오. 솔루션은이 레시피에 따라 확장 될 수 있습니다. Sulfamerazine 용액은 외과 적 회복 중에 박테리아 감염을 예방하는 항 생용제입니다.
- Clidox-S 또는 70 % 에탄올로 스프레이하여 수술 부위를 소독하십시오. 오토클레이빙으로 수술 도구 (포셉, 해부하는 가위, 스프링 가위)를 살균하십시오. 여러 수술을 수행하는 경우 동물 사이에 뜨거운 구슬 살균기로 수술 도구를 멸균하십시오.
- 복구 영역을 설정하려면 젖은 얼음으로 가득 찬 양동이 위에 axolotl에 맞는 15cm 페트리 접시 또는 용기를 놓습니다. 페트리 접시에 0.5 % 설파 메라 진 나트륨 염 용액의 낮은 수준으로 채우면 axolotl이 완전히 잠기지 않을 것입니다. 수술 후 얼음에서의 회복은 마취에서 깨어나는 동안 동물의 움직임을 늦추어 봉합 부위가 상대적으로 방해받지 않고 치유 될 수있게합니다.
참고: 이 설정은 사용 가능한 재료에 따라 연구원이 사용자 지정할 수 있습니다.
2. 전체 피부 플랩 수술 절차 수행
- axolotl을 0.1 % 트리카인 용액의 용기에 담그어 마취하십시오. 이 작업은 약 15-20분 정도 소요됩니다. axolotl이 꼬리 꼬집음을 수행하여 실제로 완전히 마취되었는지 확인하십시오. axolotl에서 반응이 없으면 수술을 진행하십시오.
참고: 이 수술에는 더 오래되고 더 큰 axolotls를 사용하십시오 (최소 15cm 크기). 플라스틱 피펫을 사용하여 axolotl 시스템 물로 주기적으로 피부를 적셔서 axolotl이 수술 내내 잘 수분을 유지하는지 확인하십시오. 수술 전에 멸균 PBS로 영역을 관개하여 수술 부위를 무균적으로 준비하십시오. 동물은 또한 절차를 위해 멸균 수술 드레이프에 놓아야합니다. - 해부 가위를 사용하여 zeugopodial 골격 요소의 원위 끝에서 사지 절단을 수행합니다 (그림 1.1).
- 스프링 가위를 사용하여 피부의 복부 부분에 작은 절개 (약 2mm)를하십시오 (그림 1.2).
- 포셉을 사용하여 피부를 zeugopodial 골격 요소의 대략 중간 선으로 조심스럽게 벗겨 내고 기본 사지 조직 (근육, 뼈 등)을 노출시킵니다. (그림 1.3). 피부를 손상시키지 않도록하십시오. 2.8단계 이후의 참고를 참조하십시오.
- 외과 용 가위를 사용하여 zeugopod의 중간 선에서 노출 된 기저 사지 조직을 절단하십시오 (그림 1.4).
- 수술 가위로 근육 조직을 뒤로 밀고 노출 된 뼈를 다듬습니다.
참고 : 이것은 향상된 치유를 보장하고 튀어 나온 뼈가 봉합 된 플랩에 대해 들쭉날쭉 해지고 나중에 손상되지 않은 피부 플랩의 무결성을 방해 할 수 있으므로 수술의 성공을 높이기 위해 필요합니다. - 포셉을 사용하여 여분의 전체 두께의 피부를 절단면 위로 조심스럽게 당겨 복부 전체 두께 피부와 연결하여 노출 된 기본 조직과 봉합사를 제자리에 덮습니다 (그림 1.5).
- 피부의 나머지 오른쪽과 왼쪽을 손상되지 않은 피부의 기본 복부 부분으로 봉합하십시오. 이것은 플랩의 측면을 "criss-cross"방식으로 봉합하거나 (권장) (그림 1.6-1.9) 복부 피부에 직접 봉합하여 수행 할 수 있습니다. 봉합을 위해 포셉과 곡선 스프링 가위를 사용하십시오. 노출 된 하부 조직을 볼 수 없으며 봉합사가 단단히 묶여 있는지 확인하십시오 (적어도 세 번 매듭 지음).
참고: 2.4, 2.7-2.8단계에서 손상되지 않은 피부가 손상되지 않는 것이 중요합니다. 우리는 전체 두께의 피부 손상이 손상 부위가 여전히 작은 상처 표피를 형성 할 수 있기 때문에 실패한 수술과 관련이 있음을 발견했습니다. 가능하다면, 전체 두께의 피부 플랩을 건네줄 때 더 둔한 포셉 쌍을 사용하십시오. - 대측 사지에서 절단을 수행하십시오 (내부 동물 통제 옵션)는 외과 용 가위로 중간 zeugopod 수준에서 절단하여 절단하십시오. 외과 용 가위로 근육 조직을 뒤로 밀고 노출 된 뼈를 다듬습니다.
참고 : 내부 대측성 사지 조절은 동일한 동물에서 4 단계 동안 수술의 성공을보다 잘 평가하기 위해 수행 될 수 있습니다. 그러나, 별도의 동물에서 동일한 사지의 절단은 또한 대조군으로 작용하기 위해 사용될 수 있다.
3. 수술 후 회복 및 관리
- 수술이 완료되면 킴 와이프 또는 멸균 종이 타월을 용기 또는 페트리 접시의 바닥에 두어 적셔주십시오. 동물을 젖은 얼음 위에 용기에 넣고 Kimwipe 또는 종이 타월의 노출 된 끝을 동물의 꼭대기 주위에 부드럽게 감싸서 설파 메라 진 용액으로 잘 수화되도록 유지하십시오. 마취에서 회복하는 동안 최소한의 움직임을 보장하기 위해 30 분에서 1 시간 동안 젖은 얼음에 두십시오.
- 동물을 0.5 % 설파 메라 진 용액으로 정적 인 하우징 용기에 넣으십시오. Axolotls는 감염을 예방하기 위해 처음 24 시간 동안이 솔루션에 남아 있어야합니다.
- axolotl을 정상 시스템 물에 넣고 매일 건강을 모니터링하십시오. 봉합사가 매일 빠지지 않도록하십시오.이 봉합사는 작은 상처 표피가 형성되어 결과를 혼란스럽게 할 수 있습니다.
참고 : 하우징 컨테이너에 axolotl이 움직일 수있는 충분한 공간이 있는지 확인하고 axolotl의 봉합 된 팔다리가 컨테이너의 측면과 접촉 할 수있는 가능성을 최소화하십시오. 이것은 봉합사가 제자리에 유지되도록하는 데 도움이되며, 특히 수술 후 첫 주 동안.
4. 스테레오 현미경으로 수술의 성공 여부 평가
참고 : 적어도 일주일에 한 번 스테레오 현미경으로 동물을 검사하여 전체 피부 플랩의 무결성과 수술 성공을 평가하는 것이 좋습니다.
- 단계 2.1에서와 같이 0.1% 트리카인에서 axolotl을 마취한다. 컨테이너에 axolotl이 움직일 수있는 충분한 공간이 있는지 확인하십시오.
- 수술 후 처음 두 주 동안 검사하는 경우 입체 현미경을 사용하여 봉합 된 사지를 검사하여 봉합사가 튀어 나오지 않았는지 확인하고 맑고 얇은 상처 표피가 어디에도 보이지 않는지 확인하십시오. 수술 후 세 번째 주 또는 그 이후에 검사하는 경우, blastema가 형성되지 않았는지 확인하고 정상적인 대조군이 절단 된 사지 (동일한 동물 또는 다른 동물로부터)가 재생 중에 어떻게 진행되었는지와 비교하십시오 (즉, blastema가 형성되었는지 여부).
- 완료되면 axolotl을 정상적인 시스템 물 및 축산 조건으로 되돌립니다.
결과
이러한 외과적 프로토콜은 상처 표피 형성의 완전한 억제(도 1) 및 궁극적으로, 사지 재생을 허용할 것이다. 성공적인 수술은 동물의 크기에 따라 약 2-3 주 내에 blastema 형성이 발생하지 않는 반면, 제어 재생 팔다리는 정상적으로 blastema를 형성해야합니다.
연구원은 봉합사가 튀어 나오지 않고 블라스테마가 형성되지 않았는지 확인하기 위해 육안으로 봉합 된 사지를 육안으로 검사해야합니다. 하나 이상의 봉합사가 튀어 나오면 상처 표피가 여전히 형성되어 작거나 큰 부진과 실패한 수술이 발생할 수 있습니다 (그림 2). 또한 연구자들은 봉합 된 사지를 입체 현미경으로 적어도 일주일에 한 번 검사하여 얇은 상처 표피가 절단 표면의 어느 곳에서도 분명하지 않은지 확인해야합니다. 비교를 위해 연구자들은 절단면에 상처 표피가 있어야하고 2-3 주 동안 블라스테마를 형성해야하는 대조군 재생 사지를 검사해야합니다. 상처 표피는 얇고 선명하게 나타나지만 정상적인 피부는 류시스틱, 알비노 또는 야생형 axolotls에서 불투명하고 옅은 분홍색 (거의 흰색), 연한 노란색 또는 짙은 녹색으로 나타납니다.
연구원이 2-3 주에 blastema 형성 단계 전에 조직을 수집하려면 샘플 수집 전에 봉합 된 팔다리를 검사하여 봉합사가 제자리에 남아 있고 작은 상처 표피가 형성되지 않았는지 확인해야합니다. 또한, 봉합된 사지 조직을 통해 진하게 절편화하고 언제든지 조직학적 분석을 수행하면 전체 절단면을 둘러싸고 있는 전체 피부 플랩으로부터 진피의 존재 여부와 상처 표피의 부재를 확인할 수 있다(그림 3).
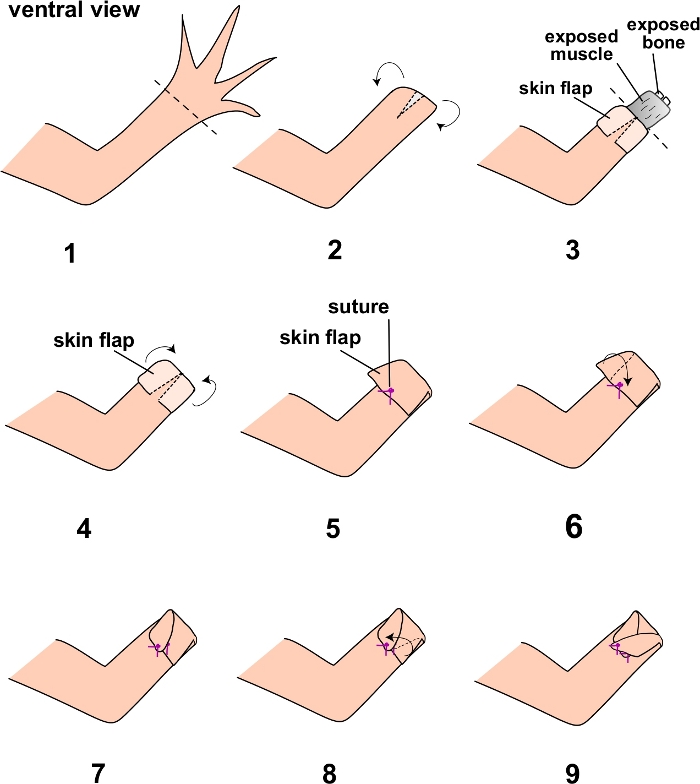
그림 1: 전체 피부 플랩 수술의 단계 개략도.
프로토콜의 단계는 여기에 번호가 매겨지고 다이어그램으로 표시됩니다. 점선은 프로토콜의 단계 1 및 3에서 절단의 평면을 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 성공적이고 실패한 전체 피부 플랩 수술의 예.
성공적인 수술(왼쪽), 실패한 수술(오른쪽), 절단 후 25일째에 사지를 재생하는 대조군(수술 없음)을 받은 사지의 대표적인 브라이트필드 이미지(dpa). 성공적인 수술은 전체 피부 플랩이 봉합 된 평평한 절단 평면을 가지고있는 반면, 실패한 수술은 작은 blastema가 발생합니다. 화살촉은 절단면을 나타내고 흰색 점선은 성공적인 수술에서 블라스테마의 부재 및 실패한 수술 및 제어 재생 사지에서 blastemas의 존재의 시각화를 돕기 위해 존재한다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
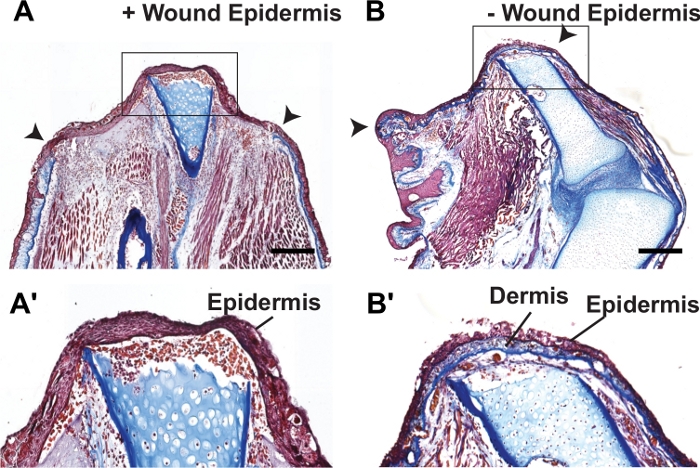
도 3: 정상 재생 및 FSF 봉합된 팔다리의 조직학적 염색.
(A-B') 7dpa에서 재생(A-A') 및 봉합된 악솔로틀 팔다리(B-B')로부터 피크로말로리 염색된 절편의 대표적인 브라이트필드 이미지. A와 B의 인셋은 각각 A'와 B'로 표시됩니다. 콜라겐이 많은 진피층은 봉합된 팔다리의 절단면 전체를 감싸고 있다. 절단 평면은 A-B에서 화살촉으로 표시됩니다. 스케일 바는 500 μm를 나타낸다. 이 수치는 Tsai et al.25에서 채택되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
이 기사는 상처 표피 형성을 억제하기 위해 axolotl 팔다리에서 전체 피부 플랩 수술을 수행하기위한 프로토콜을 설명합니다. 이 수술은 상처 표피 형성을 억제하는 다른 방법에 비해 비교적 간단하고 기술적으로 재현 가능하지만 수술의 성공에 영향을 줄 수있는 몇 가지 중요한 단계가 있습니다. 첫째, 노출 된 기저 조직 위에 손상되지 않은 전체 피부 플랩을 당길 때, 전체 두께의 피부가 어떤 식 으로든 손상되지 않는 것이 가장 중요합니다. 피부 플랩의 손상은 여전히 작은 상처 표피의 형성으로 이어질 수 있으며, 이는 작은 blastema와 같은 파생을 초래할 수 있습니다. 둘째, 수술 후 치료 중에 봉합사가 빠지지 않도록하십시오.이 봉합사는 작은 상처 표피의 형성으로 이어질 수 있습니다. 이 시점까지, 봉합 된 사지와 모든 표면 사이의 잠재적 인 접촉을 최소화하는 것이 중요하며, 특히 수술 후 첫 주에 특히 중요합니다. 이를 예방하는 몇 가지 방법은 axolotl이 수술 후 이동할 수있는 충분한 공간을 갖출 수 있도록 충분히 큰 용기에 axolotl을 수용하고 마취시키는 것을 수반합니다.
이 수술에는 몇 가지 제한 사항이 있습니다. 아마도 가장 주목할만한 것은 수술의 성공은 두 가지 방법으로 만 평가 될 수 있다는 것입니다 : 수술 첫 두 주 동안 해부 범위를 사용하여 상처 표피의 부재를 검색하거나 3 주 이내에 블라스테마가 형성되는지 여부를 확인하십시오. 이러한 방법은 효과적이지만 처리량이 상대적으로 낮습니다. 상처 표피 특이적 마커에 대한 미래의 트랜스제닉 리포터 axolotls의 개발은 성공적인 수술과 실패한 수술에 대한 신속한 스크리닝에 도움이 될 수 있습니다. 또한,이 수술은 손상되지 않은 피부가 더 약하기 때문에 어린 동물에게 수행하기가 더 어렵습니다. 따라서 성인 이하 또는 성인 axolotls를 사용하는 것이 좋습니다.
이 수술은 원래 N. viridiscens19에서 개발되었지만 axolotls25,39에 쉽게 적응할 수 있으며 다른 도롱뇽 종에도 적용될 수 있습니다. 요컨대,이 기술을 미래의 사지 재생 연구에 적용하면 연구자가 상처 표피 생물학을 다루는 더 많은 도구를 개발하고 블라스템마 형성을 시작하는 데 그 기능을 유도하는 기본 메커니즘을 식별 할 수 있습니다.
공개
저자는 공개 할 것이 없습니다.
감사의 말
저자는 Doug에게 끊임없는 격려와 확고한 지원에 감사 드리며, 멜튼 연구소 회원들은 원고에 대한 도움이되는 피드백과 의견을 보내 주셔서 감사합니다. 저자는 또한 하버드 동물 자원 사무소 (OAR)의 헌신적 인 동물 보호에 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| Curved spring scissors | Fine Scientific Tools | 15009-08 | |
| Ethyl 3-aminobenzoate methanesulfonate (Tricaine) | Sigma-Aldrich | 886-86-2 | |
| Forceps | Fine Scientific Tools | 11252-40 | Need two pairs |
| Nylon monofilament sutures (9-0) | Roboz | SUT-1000-21 | |
| Sodium bicarbonate | Sigma-Aldrich | S5761 | |
| Stereo microscope | Leica | MZ6 | |
| Sulfamerazine sodium salt | Sigma-Aldrich | 127-58-2 | |
| Surgical scissors | Fine Scientific Tools | 14002-14 |
참고문헌
- Spallanzani, L. . Prodromo Di Un'opera Da Imprimersi Sopra Le Riproduzioni Animali. , (1768).
- Gerber, T., et al. Single-cell analysis uncovers convergence of cell identities during axolotl limb regeneration. Science. , (2018).
- Leigh, N. D., et al. Transcriptomic landscape of the blastema niche in regenerating adult axolotl limbs at single-cell resolution. Nature Communications. 9 (1), 5153 (2018).
- Kragl, M., et al. Cells keep a memory of their tissue origin during axolotl limb regeneration. Nature. 460 (7251), 60-65 (2009).
- McCusker, C., Bryant, S. V., Gardiner, D. M. The axolotl limb blastema: cellular and molecular mechanisms driving blastema formation and limb regeneration in tetrapods. Regeneration (Oxford). 2 (2), 54-71 (2015).
- Endo, T., Bryant, S. V., Gardiner, D. M. A stepwise model system for limb regeneration. Developmental Biology. 270 (1), 135-145 (2004).
- Tsai, S. L. The molecular interplay between progenitors and immune cells in tissue regeneration and homeostasis. Journal of Immunology and Regenerative Medicine. 7, 100024 (2020).
- Godwin, J. W., Pinto, A. R., Rosenthal, N. A. Macrophages are required for adult salamander limb regeneration. Proceedings of the National Academy of Sciences of the United States of America. 110 (23), 9415-9420 (2013).
- Tanaka, E. M. The molecular and cellular choreography of appendage regeneration. Cell. 165 (7), 1598-1608 (2016).
- Campbell, L. J., Crews, C. M. Wound epidermis formation and function in urodele amphibian limb regeneration. Cellular and Molecular Life Sciences. 65 (1), 73-79 (2008).
- Fei, J. F., et al. Efficient gene knockin in axolotl and its use to test the role of satellite cells in limb regeneration. Proceedings of the National Academy of Sciences of the United States of America. 114 (47), 12501-12506 (2017).
- Sandoval-Guzman, T., et al. Fundamental differences in dedifferentiation and stem cell recruitment during skeletal muscle regeneration in two salamander species. Cell Stem Cell. 14 (2), 174-187 (2014).
- Tassava, R. A., Mescher, A. L. The roles of injury, nerves, and the wound epidermis during the initiation of amphibian limb regeneration. Differentiation. 4 (1), 23-24 (1975).
- Hay, E. D., Fischman, D. A. Origin of the blastema in regenerating limbs of the newt Triturus viridescens. An autoradiographic study using tritiated thymidine to follow cell proliferation and migration. Developmental Biology. 3, 26-59 (1961).
- Christensen, R. N., Tassava, R. A. Apical epithelial cap morphology and fibronectin gene expression in regenerating axolotl limbs. Developmental Dynamics. 217 (2), 216-224 (2000).
- Repesh, L. A., Oberpriller, J. C. Scanning electron microscopy of epidermal cell migration in wound healing during limb regeneration in the adult newt, Notophthalmus viridescens. American Journal of Anatomy. 151 (4), 539-555 (1978).
- Neufeld, D. A., Day, F. A., Settles, H. E. Stabilizing role of the basement membrane and dermal fibers during newt limb regeneration. Anatomical Record. 245 (1), 122-127 (1996).
- Singer, M., Saltpeter, M. M., Zarrow, M. X. . Growth in Living Systems. , (1961).
- Mescher, A. L. Effects on adult newt limb regeneration of partial and complete skin flaps over the amputation surface. Journal of Experimental Zoology. 195 (1), 117-128 (1976).
- Tassava, R. A., Garling, D. J. Regenerative responses in larval axolotl limbs with skin grafts over the amputation surface. Journal of Experimental Zoology. 208 (1), 97-110 (1979).
- Tornier, G. Der Kampf der Gewebe im Regeneratbei Begunsiigung der Hautregeneralion. Arch. Entwmech. 22, 348-352 (1906).
- Goss, R. J. Regenerative inhibition following limb amputation and immediate insertion into the body cavity. Anatomical Record. 126 (1), 15-27 (1956).
- Thornton, C. S. The effect of apical cap removal on limb regeneration in Amblystoma larvae. Journal of Experimental Zoology. 134 (2), 357-381 (1957).
- Thornton, C. S. The inhibition of limb regeneration in urodele larvae by localized irradiation with ultraviolet light. Journal of Experimental Zoology. 137 (1), 153-179 (1958).
- Tsai, S. L., Baselga-Garriga, C., Melton, D. A. Midkine is a dual regulator of wound epidermis development and inflammation during the initiation of limb regeneration. Elife. 9, (2020).
- Nowoshilow, S., et al. The axolotl genome and the evolution of key tissue formation regulators. Nature. 554 (7690), 50-55 (2018).
- Elewa, A., et al. Reading and editing the Pleurodeles waltl genome reveals novel features of tetrapod regeneration. Nature Communications. 8 (1), 2286 (2017).
- Bryant, D. M., et al. A Tissue-Mapped Axolotl De Novo Transcriptome Enables Identification of Limb Regeneration Factors. Cell Reports. 18 (3), 762-776 (2017).
- Looso, M., et al. A de novo assembly of the newt transcriptome combined with proteomic validation identifies new protein families expressed during tissue regeneration. Genome Biology. 14 (2), 16 (2013).
- Abdullayev, I., Kirkham, M., Bjorklund, A. K., Simon, A., Sandberg, R. A reference transcriptome and inferred proteome for the salamander Notophthalmus viridescens. Experimental Cell Research. 319 (8), 1187-1197 (2013).
- Burns, J. A., Zhang, H., Hill, E., Kim, E., Kerney, R. Transcriptome analysis illuminates the nature of the intracellular interaction in a vertebrate-algal symbiosis. Elife. 6, (2017).
- Nakamura, K., et al. A transcriptome for the study of early processes of retinal regeneration in the adult newt, Cynops pyrrhogaster. PLoS One. 9 (10), 109831 (2014).
- Smith, J. J., et al. A chromosome-scale assembly of the axolotl genome. Genome Research. 29 (2), 317-324 (2019).
- Arenas Gomez, C. M., Woodcock, R. M., Smith, J. J., Voss, S. R., Delgado, J. P. Using transcriptomics to enable a plethodontid salamander (Bolitoglossa ramosi) for limb regeneration research. BMC Genomics. 19 (704), (2018).
- Fei, J. F., et al. Application and optimization of CRISPR-Cas9-mediated genome engineering in axolotl (Ambystoma mexicanum). Nature Protocols. 13 (12), 2908-2943 (2018).
- Flowers, G. P., Timberlake, A. T., McLean, K. C., Monaghan, J. R., Crews, C. M. Highly efficient targeted mutagenesis in axolotl using Cas9 RNA-guided nuclease. Development. 141 (10), 2165-2171 (2014).
- Khattak, S., et al. Optimized axolotl (Ambystoma mexicanum) husbandry, breeding, metamorphosis, transgenesis and tamoxifen-mediated recombination. Nature Protocols. 9 (3), 529-540 (2014).
- Joven, A., Elewa, A., Simon, A. Model systems for regeneration: salamanders. Development. 146 (14), (2019).
- Johnson, K., Bateman, J., DiTommaso, T., Wong, A. Y., Whited, J. L. Systemic cell cycle activation is induced following complex tissue injury in axolotl. Developmental Biology. 433 (2), 461-472 (2018).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유