Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
In Vivo CRISPR/Cas9 Screening para evaluar simultáneamente la función génica en la piel del ratón y la cavidad oral
En este artículo
Resumen
Aquí describimos una metodología de detección CRISPR/Cas9 rápida y directa in vivo utilizando inyecciones lentivirales embrionarias de tero guiadas por ultrasonido para evaluar simultáneamente las funciones de varios genes en la piel y la cavidad oral de ratones inmunocompetentntes.
Resumen
Los modelos de ratón modificados genéticamente (GEMM) han sido fundamentales para evaluar la función génica, modelar enfermedades humanas y servir como modelo preclínico para evaluar las vías terapéuticas. Sin embargo, su naturaleza de tiempo, mano de obra y costo intensivo limita su utilidad para el análisis sistemático de la función génica. Los recientes avances en las tecnologías de edición del genoma superan esas limitaciones y permiten la rápida generación de perturbaciones genéticas específicas directamente dentro de órganos específicos del ratón de una manera multiplexada y rápida. Aquí, describimos un método basado en CRISPR/Cas9 (Clustered Regularly Interspaced Short Palindromic Repeats) para generar miles de clones genéticos knock-out dentro del epitelio de la piel y la cavidad oral de ratones, y proporcionar un protocolo que detalle los pasos necesarios para realizar una pantalla CRISPR directa in vivo para los genes supresores tumorales. Este enfoque se puede aplicar a otros órganos u otras tecnologías CRISPR/Cas9 como la activación CRISPR o la inactivación CRISPR para estudiar la función biológica de los genes durante la homeostasis tisular o en diversos entornos de la enfermedad.
Introducción
Uno de los desafíos para la investigación del cáncer en la era post-genómica es extraer la gran cantidad de datos del genoma para mutaciones genéticas causales e identificar nodos en la red genética que pueden ser dirigidos terapéuticamente. Si bien los análisis bioinformáticas han ayudado enormemente hacia estos objetivos, establecer modelos eficientes in vitro e in vivo es un requisito previo para descifrar la complejidad de los sistemas biológicos y los estados de enfermedades y para permitir el desarrollo de fármacos. Si bien los modelos convencionales de ratón transgénico se han utilizado ampliamente para estudios genéticos in vivo sobre el cáncer, su naturaleza intensiva en costos, tiempo y mano de obra ha prohibido en gran medida el análisis sistemático de los cientos de genes cancerosos putativos desentrañados por la genómica moderna. Para superar este cuello de botella, combinamos una tecnología de edición genética1,2 con una tecnología de edición de genes CRISPR/Cas9 (Clustered Regularly Interspaced Short Palindromic Repeats)3 para inducir y estudiar simultáneamente mutaciones de pérdida de función de cientos de genes en la piel y cavidad oral de un solo ratón.
La metodología descrita aquí utiliza inyecciones guiadas por ultrasonido de lentivirus de ingeniería en la cavidad amniótica de embriones de ratón vivos en el día embrionario E9.5. La carga lentiviral que contiene componentes CRISPR/Cas9 transduce el ectodermo superficial de una sola capa, que más tarde da lugar al epitelio de la piel y la cavidad oral. La piel se compone de una epidermis externa, seguida de membrana y dermis del sótano. Epidermis es un epitelio estratificado compuesto por una capa interior basal, que mantiene contacto con la membrana del sótano y tiene capacidad proliferativa y de células madre. La capa basal da lugar a las capas diferenciadas anteriores, como las capas de córneo espinosas, granulares y estrato2,4. Estudios de rastreo de linaje muestran que este método crispr/cas9 in vivo directo manipula genéticamente las células madre residentes en tejidos dentro de la capa basal que persisten a lo largo de la edad adulta. Como el lentivirus se puede valorar para transducir el ectodermo superficial E9.5 a densidad clonal, este método se puede utilizar para generar ratones mosaico que albergan miles de clones noqueantes genéticos discretos. A continuación, la secuenciación de próxima generación se puede utilizar para analizar el efecto de la ablación genética mediada por CRISPR/Cas9 dentro de esos clones de forma multiplexada5.
Recientemente utilizamos este método para evaluar la función de 484 genes que muestran mutaciones recurrentes en carcinoma de células escamosas de cabeza y cuello humano (HNSCC)5. El HNSCC es un cáncer devastador con una alta tasa de mortalidad del 40-50% y es el6º cáncer más común en todo el mundo6. El HNSCC surge en revestimientos mucosos de las vías respiratorias superiores o cavidad oral y se asocian con el consumo de tabaco y alcohol o la infección por el virus del papiloma humano (VPH). Carcinoma de células escamosas cutáneas (SCC) son tumores de piel y representan el segundo cáncer más común en los seres humanos7. Cutánea SCC y HNSCC son histológica y molecularmente muy similares, con un alto porcentaje de casos que exhiben alteración en TP53, PIK3CA, NOTCH1 y HRAS8. Si bien sólo hay un puñado de genes mutados a alta frecuencia, hay cientos de genes que se encuentran mutados a baja frecuencia (< 5%), un fenómeno comúnmente conocido como la distribución de cola larga. Como la mayoría de los genes de cola larga carecen de validación biológica o clínica, utilizamos esta tecnología de detección CRISPR in vivo para modelar la pérdida de la función de estos genes en ratones propensos a tumores con mutaciones sensibilizantes en p53, Pik3ca o Hras e identificamos varios genes supresores tumorales novedosos que cooperan con p53, Pik3ca o Hras para desencadenar el desarrollo tumoral5.
Aquí, describimos un protocolo detallado para generar bibliotecas de sgRNA lentiviral CRISPR lentiviral multiplexed y realizar pantallas noqueadas del gen CRISPR/Cas9 en el ectodermo de la superficie del ratón. Cabe destacar que esta metodología se puede adaptar para incorporar otras tecnologías de manipulación genética como la activación CRISPR (CRISPRa) y la inactivación CRISPR (CRISPRi) o modificarse para dirigirse a otros sistemas de órganos del ratón para estudiar las funciones genéticas.
Protocolo
Este protocolo fue aprobado y realizado de acuerdo con la UACUC de la Universidad de Toronto.
1. Diseño y clonación de bibliotecas CRISPR agrupadas
- Seleccione 4-5 sgRNAs dirigidos a genes de ratón de interés de recursos como el diseñador de esgRNA de Broad Institute (https://portals.broadinstitute.org/gpp/public/analysis-tools/sgrna-design) o el servidor CHOPCHOP (https://chopchop.cbu.uib.no). Seleccione un número igual de sgRNAs no dirigidos de, por ejemplo, Sanjana y otros9 para generar una biblioteca de gRNA de controles no dirigidos de igual tamaño.
- Mientras construye las bibliotecas de sgRNA, asegúrese de que haya suficiente cobertura para cada sgRNA en el sistema de órganos dirigido. Para la piel del ratón, la epidermis en E9.5 es una sola capa que contiene ~ 150,000 células, la mayoría de las cuales tienen capacidad de células madre4. Si la transducción lenti-viral resulta en infectividad del 15-20%, sólo 18.000-24.000 células se transducirán a E9,5. Escale el experimento en consecuencia.
- Para la clonación y amplificación de estas bibliotecas de sgRNA, añada sitios de restricción de enzimas BsmBI, así como secuencias de ADN de unión de imprimación a 5' y 3' final del sgRNA y ordene los oligos de longitud completa resultantes como chip de oligonucleótido agrupado (Figura 1A).
- Para multiplexar bibliotecas diferentes en un chip, agregue secuencias de imprimación específicas de la biblioteca.
- Utilizando los pares de imprimación adecuados, amplifica cada biblioteca por separado del chip de oligo agrupado. En un tubo PCR, mezcle 25 μL de mezcla maestra de polimerasa 2x, 20 μL de agua libre DNase/RNase, 5 ng de ADN de chip de oligo, 2,5 μL de imprimación delantera adecuada y 2,5 μL de imprimación inversa adecuada. Utilice 12-15 ciclos y amplíe con desnaturalización de 98 °C, recocido de 63-67 °C, parámetros de extensión de 72 °C para cada ciclo en la máquina PCR.
- Ejecute el producto PCR en un gel de agarose del 2,5% y purifique el producto PCR ~100 bp usando un kit de limpieza de ADN en gel.
- Prepare el plásmido de la columna vertebral.
- Digest 5 μg de la Cre-recombinasa que contiene plásmido pLKO-Cre stuffer v3 con 2 μL de BsmBI en mezcla de reacción de 50 μL durante 1 h a 55 °C, seguido de 1 μL de incubación alcalina de fosfatasa durante 45 minutos a 37 °C de acuerdo con las instrucciones del fabricante.
NOTA: Cre-recombinasa que contiene plásmido pLKO-Cre stuffer v3 es un plásmido basado en lenti-viral que contiene enzima Cre-recombinasa para eliminar el casete Lox-Stop-Lox en células de ratón y también tiene un promotor U6 para impulsar la expresión de sgRNA y tracrRNA. Una versión con Cas9 y sin Cas9 se puede utilizar y disponible en Addgene #158030 y #158031. - Ejecute el ADN digerido en un gel de agarose del 1% y purifique la banda vectorial linealizada de 7 kb usando un kit de limpieza de ADN en gel. Cabe destacar que una banda de relleno de 2 kb también debe ser visible indicando un resumen exitoso.
- Digest 5 μg de la Cre-recombinasa que contiene plásmido pLKO-Cre stuffer v3 con 2 μL de BsmBI en mezcla de reacción de 50 μL durante 1 h a 55 °C, seguido de 1 μL de incubación alcalina de fosfatasa durante 45 minutos a 37 °C de acuerdo con las instrucciones del fabricante.
- Configure la reacción de ligadura para generar una biblioteca de plásmidos de SgRNA.
- Mezclar 1 μg de vector purificado y 30 ng de inserción PCR purificada con 2 μL de BsmBI, 5 μL de ligasa de ADN T4, 10 μM ATP y 1x buffer específico de BsmBI. Incubar la mezcla de ligadura durante la noche a 37 °C. Utilice un tubo adicional que contenga todos los materiales anteriores, excepto el inserto PCR como control negativo.
- Al día siguiente por la mañana, purificar la mezcla de ligadura utilizando el kit de limpieza de oligo y elute en 7 μL de agua libre RNase /DNase.
- Electroporate la biblioteca en células competentes.
- Añadir 2 μL de biblioteca de sgRNA eluted o mezcla de ligadura de control negativo a 25 μL de células electrocompetentntes descongeladas en cubetas preenfriadas (1,0 mm) sobre hielo. Electropolar siguiendo el protocolo del fabricante (10 μF, 600 Ohmios, 1800 Voltios). A la cubeta añadir 975 μL de medio de recuperación (o medio SOC) dentro de 10 s del pulso.
- Transfiera las células electroporadas a un tubo de cultivo e incuba durante una hora a 37 °C en una incubadora de agitación bacteriana a 300 rpm.
- Calcule la eficiencia de la transformación y la cobertura de la biblioteca por sgRNA.
- Prepare una dilución de 100 veces transfiriendo 10 μL de la reacción de transformación que contiene células electroporadas con biblioteca de SgRNA o ligadura de control negativo a 990 μL de medio de recuperación y mezcle bien.
- Placa 10 μL de la mezcla de transformación diluida en una placa de agar pre-calentada de 10 cm LB + ampicilina (100 μg/L). Esto resulta en una dilución de 10.000 veces de los transformadores y utilizar esta placa para calcular la eficiencia de transformación. Realizar la incubación de las placas a 30 °C durante 14-16 h.
- Coloque el resto de la reacción de transformación extendiendo 100 μL de células recuperadas en cada placa de un total de 10 placas de agar LB + ampicilina pre-calentadas. Incubar las placas de 14-16 h a 30 °C. Cabe destacar que el crecimiento a 30 °C minimiza la recombinación entre las dos repeticiones de terminales largos dentro del plásmido viral.
- Para evaluar el éxito de clonación, calcule la eficiencia de transformación. Contar el número de colonias en la placa de dilución que contienen transformadores de la biblioteca de sgRNA o ligadura de control negativo (placas de 10 cm, paso 1.8.2). La mezcla de control negativo no debe tener ninguna o muy pocas colonias. Para obtener el número total de colonias, multiplique el número de colonias en 10.000.
NOTA: El número total de colonias contabilizadas representa una cobertura de biblioteca que debe ser mínima de 200x colonias por sgRNA.- Asegúrese de que una biblioteca con 2000 sgRNAs tendrá al menos 400.000 colonias. En caso de que no haya suficientes colonias, repita y configure más electroporación.
- Control de calidad: De la placa de dilución, elija 20 colonias y agregue cada colonia a un tubo de cultivo individual que contenga 3 ml de medios LB + ampicilina. Incuba los 20 tubos durante la noche a 30 °C sacudiendo a 250 rpm. Purifique el ADN plásmido usando un kit de mini-preparación de acuerdo con las instrucciones del fabricante y la secuencia de Sanger todas las 20 muestras de ADN plásmido para verificar que cada muestra tiene una secuencia de SgRNA diferente utilizando la imprimación U6 (5'-GAG GGC CTA TTT CCC ATG ATT CC-3').
- Cosecha las colonias de cada placa de 15 cm.
- Agregue 7 ml de media LB, luego raspe las colonias de la placa lb agar con un esparcidor celular. Utilice una pipeta de 10 ml para transferir las células a un matraz cónico estéril de 2 L. Repita para todas las placas y bacterias de la piscina en el matraz de 2 L. Incubar el matraz durante 2-3 h temblando a 30 °C. Centrífuga la cultura y recoge el pellet.
- Purifique el ADN plásmido utilizando un kit de purificación maxi-plásmido.
- Control de calidad adicional: Utilice 1 ng de ADN plásmido de biblioteca de sgRNA maxi-prep y ejecute una reacción PCR utilizando imprimaciones de secuenciación de próxima generación de acuerdo con las instrucciones del fabricante. La representación de todos los sgRNAs de la biblioteca se puede verificar mediante una plataforma de secuenciación profunda.
2. Producción de lentivirus de alto valor adecuado para la transducción in vivo
NOTA: Realice todos los pasos de esta sección del protocolo en una instalación BSL2+ en un gabinete de bioseguridad clase II, tipo A2. 293FT y especialmente las células de envasado 293NT permiten una mayor producción de virus. Utilice células heK293T, 293FT o 293NT de paso bajo (
- Prepare celdas de embalaje virales.
- El día 1, las células HEK293T de placa en 6 placas de poli-L-lisina recubiertas de 15 cm a un 35% de confluencia en medios de crecimiento (DMEM + 10% FBS + 1% Penicilina-Streptomicina solución antibiótica (w/v)). Incubar células durante la noche a 37 °C, 5% CO2.
- Una vez que las células chapadas sean 70-80% confluentes y diseminadas uniformemente, reemplace los medios de crecimiento por 25 ml de medios DMEM séricos y libres de antibióticos.
- Agregue los medios lentamente a los lados de los frascos al alimentarse, ya que las células HEK293T y 293NT pueden desprenderse fácilmente del plástico de cultivo de tejidos
- Preparar la mezcla de transfección.
- Añadir 65 μg de plásmidos de envases lentiviales psPAX2, 43 μg de plásmido de envolvente expreso VSV-G pMD2.G, 65 μg de plásmido de biblioteca de sgRNA y 240 μL de polietilenoínimina de 1 mg/ml (PEI) a 6 ml de DMEM y vórtice.
NOTA: Utilice siempre una botella de DMEM sin abrir o muy recientemente abierta para la transfección, ya que el pH en este paso es crítico, y DMEM se vuelve más básico con el tiempo una vez abierto. - Incubar durante 15 minutos a temperatura ambiente. Esta mezcla de transfección es suficiente para células chapadas en placas de 6 x 15 cm con superficie de 870 cm2. Escale la mezcla de transfección de acuerdo con los requisitos del experimento.
- Añadir 65 μg de plásmidos de envases lentiviales psPAX2, 43 μg de plásmido de envolvente expreso VSV-G pMD2.G, 65 μg de plásmido de biblioteca de sgRNA y 240 μL de polietilenoínimina de 1 mg/ml (PEI) a 6 ml de DMEM y vórtice.
- Transfección de células de envasado virales.
- Después de 15 minutos de incubación, transfecta cada una de las placas de 15 cm añadiendo 1 ml de la mezcla de transfección a la gota en todo el plato. Incubar a 37 °C, 5% CO2 para 8 h.
- Después de la incubación, retire el soporte sin suero que contiene la mezcla de transfección y agregue 30 ml de medios de cultivo regulares a las placas de 15 cm y el cultivo durante 48 h a 37 °C, 5% CO2.
- Después de 48 h, recoge el sobrenadante viral y filtra a través del filtro PVDF de 0,45 μm. Mantenga 1 ml del sobrenadante viral y guárdelo a -80 °C para el control de calidad y el cribo viral.
- Concentre el sobrenadante viral mediante centrifugación de gradiente de sacarosa en centrífuga de alta velocidad con cabezal de rotor SW28.
- Tubos ultracentrífugos prime lavándolos con un 70% de etanol, seguidos de 3 enjuagues con PBS. Distribuya uniformemente aproximadamente 30 ml del sobrenadante viral en cada uno de los tubos de 6 ultracentrífugas.
- Pipeta suavemente a la parte inferior de cada tubo 4 ml de la solución de sacarosa del 20% (20 g de sacarosa en 100 ml de PBS). Coloque los seis tubos ultracentrífugas en los seis cubos de oscilación SW28 y equilibre con precisión cada par de cubos opuestos añadiendo o eliminando sobrenadantes virales.
- Sobrenadante viral centrífuga a 4 °C durante al menos 2 h y hasta 4 h a 80.000 x g y 4 °C. Una vez que se realiza la centrifugación, deseche cuidadosamente el sobrenadante.
- Escurrir el sobrenadante restante colocando tubos ultracentrífugas boca abajo en la toalla estéril de papel blando durante al menos 2 minutos y limpie cualquier gota de sobrenadante dentro del tubo usando una toalla de papel suave para deshacerse de cualquier medio residual. Un pequeño pellet blanco grisáceo podría ser visible en la parte inferior del tubo.
- Añadir 20-25 μL de PBS frío y fresco a cada tubo. Sella tubos con película de parafina e incuba tubos en posición vertical sobre hielo con suaves temblores en un agitador de plataforma orbital durante ~2 h.
- Usando una pipeta de 20 μL, desalojar cuidadosamente y resuspend el pellet del primer tubo, teniendo cuidado de no formar burbujas. Transfiera el medio al siguiente tubo y repita el proceso hasta que todos los pellets de virus hayan sido desalojados y combinados en un tubo de aproximadamente 120-150 μL de volumen. Incuba esta suspensión viral de alto nivel para otra ~2 h sobre hielo con suave agitación.
- Transfiera la suspensión viral a un tubo de microcentrífuga de 1,5 ml y gire el tubo a 4 °C en una centrífuga refrigerada y preenfriada de mesa a 12.000 x g durante 2 minutos. Aliquot el sobrenadante viral claro cuidadosamente como 10 μL aliquots en tubos separados de 0,2 ml y almacenar a -80 °C. Deseche el pellet en la parte inferior del tubo, ya que esto obstruirá la aguja durante las inyecciones embrionarias.
- Valoración de la biblioteca de lentivirus CRISPR agrupada
NOTA: La suspensión viral resultante debe producir una concentración aproximada de 2.000 veces y la solución de virus resultante y debe tener un valor viral de 107-109,lo que es lo suficientemente bueno para más de 100 cirugías E9.5 descritas a continuación.- Semillas R26-Lox-STOP-Lox-tdTomato fibroblastos embrionarios del ratón (MEF) o R26-Lox-STOP-Lox-tdTomato queratinocitos primarios o cualquier otra línea celular Cre-reportera en una placa de pozo de 2 x 6.
- Una vez que la célula alcanza ~40% de confluencia, las células están listas para la transducción. En ese momento, determinar el número de células dentro de un pozo para permitir el cálculo de titer viral más tarde. Cambie los medios de las células de Cre-reporter a medios de crecimiento complementados con polibreno de 10 μg/ml (=bromuro de hexadimethrina).
- Diluir 1 μL de virus concentrados con 2 ml de medios de crecimiento. Añadir 0, 10, 50, 200 μL de suspensión viral diluida y 50, 200 μL de virus no concentrados desde el paso 2.4 y mezclar placas e incubar durante la noche a 37 °C, 5% CO2.
- Retire los medios de crecimiento que contienen virus al día siguiente, lave las células con PBS y reemplace con medios de crecimiento normales. El sobrenadante en este momento todavía se considera residuo viral y debe eliminarse de conformidad con las regulaciones institucionales de BSL2.
- Aproximadamente 36-48 h después de la transducción, evaluar la recombinación mediada por Cre del casete Lox-STOP-Lox y la expresión de tdTomato por FACS. Calcular titer viral. Calcule las unidades de formación de colonias (cfu)/ml utilizando la siguiente fórmula:
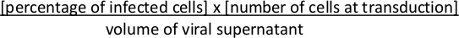
NOTA: La comparación entre la suspensión viral concentrada con su sobrenadante viral no concentrado permitirá estimar el éxito de (1) la producción viral, así como (2) la concentración viral. Alternativamente, el valor del valor viral se puede estimar utilizando el método qRT-PCR10. La producción y concentración a gran escala de lentivirus también se puede realizar utilizando una concentración de dos pasos con una concentración de cartucho seguida de ultracentrifugación como se describió anteriormente2.
3. Cirugía e inyección guiadas por ultra-sonido
NOTA: Esta tecnología fue adaptada de4,11. La microinjeción orientada a la transducción del epitelio superficial debe realizarse en el día embrionario E9.5, cuando el ectodermo superficial consiste en una sola capa y antes de la formación del periderm a partir del E10, lo que evitaría la transducción de esta capa basal. Preferiblemente instalar ratones el viernes, por lo que el primer día posible con embriones E9.5 es el lunes siguiente. Utilice ratones Rosa26-Lox-STOP-LOX-Cas9-GFP (#024857 de Laboratorio Jackson) para una eficiencia crispr/cas9 óptima12.
- Configure ratones machos y hembras apropiados para embarazos cronometrados 10 días antes de la fecha de la cirugía deseada.
- Conecte ratones durante los días siguientes para identificar ratones potencialmente embarazadas. Confirme el embarazo el día antes de la cirugía planificada (es decir, E8.5) usando ultrasonido.
- Prepara la placa modificada de Petri.
- Usando la cinta pegajosa de doble cara, pega la membrana de silicona en la parte inferior de la placa Petri que cubre la abertura circular. Con tijeras afiladas, corte una abertura ovalada de 2 x 10 mm en la membrana de silicona.
- Preparación del sistema de microinjección
- Preparar agujas de inyección de un capilar de vidrio de paredes gruesas utilizando un extractor de micropipette con los siguientes ajustes: Presión = 200; Calor = 769; Extracción = 0; Velocidad = 140; Tiempo = 100.
- Usando tijeras finas para cortar la punta de la aguja en el nivel donde su diámetro es ~30 μm. Bisele la aguja usando afilador de agujas a 20° en una placa abrasiva de grado fino con humectación regular durante 20 minutos.
- Esterilizar la aguja de microinjección empujando un 70% de etanol usando una jeringa de 10 ml con una aguja de 26 G1/2. Utilizando una jeringa de 10 ml y una aguja de 26 G1/2 cargada con aceite mineral, rellene la aguja de microinjeción. Asegúrese de que no haya burbujas en la aguja de microinyección.
- Monte la aguja del microinjector en el micromanipulador de acuerdo con las instrucciones del fabricante.
- Cargue la aguja con una biblioteca de sgRNA viral.
- Pipeta 10 μL de suspensión viral en un parafilm fijo en una superficie plana.
- Usando micromanipulador, expulse el aceite mineral. La presencia de un pequeño volumen de aceite en la aguja evitará que el lentivirus entre en contacto con el pistón. Cargue aproximadamente 4-5 μL de suspensión viral por aspiración lenta sin burbujas de aire.
- Anestesista ratón embarazada usando cámara de inducción isoflurano. Ajuste el regulador de oxígeno a 1 L/min y el vaporizador isoflurano al 2%. Para determinar si el animal está anestesiado, compruebe con pellizcar por dedo del pie después de ~3-5 min en la cámara de inducción isoflurano.
- Coloque el lado ventral animal anestesiado en el escenario de cirugía calentado (40 °C) y aplique cintas de cirugía para mantener las patas en su lugar con el tubo de anestesia del cono nasal para el suministro constante de isoflurano y oxígeno hasta que se complete la cirugía.
- Confirme el embarazo E9.5 si no se realizó en E8.5.
- Aplica una pequeña cantidad (~ 1/2 cucharadita) de una crema para la depilación en el abdomen y esparce sobre un área de 3 x 3 cm usando un aplicador con punta de algodón.
- Después de 2-3 min, retire suavemente la crema con gasa o tejido y limpie el área usando PBS y 70% etanol.
- Con la sonda de ultrasonido y el gel, compruebe el ratón embarazada para el día embrionario E9.5. Cabe destacar que esto también se puede hacer el día anterior en E8.5 para ahorrar tiempo en el día de la cirugía real.
- Retire el gel de ultrasonido y limpie el área usando BPS y luego el 70% de etanol para desinfectar.
- Inyectar 0,02 cc de buprenorfina analgésico subcutáneamente en la presa del ratón.
- Exponer quirúrgicamente el útero
- Usando fórceps estériles y tijeras, hacer una incisión vertical ~ 2 cm en la piel del ratón.
- El uso de fórceps contundentes separa la piel alrededor de la incisión del peritoneo.
- Usando fórceps estériles y tijeras, corte a través del peritoneo.
- Usando fórceps contundentes, extraiga suavemente el cuerno del útero izquierdo y derecho y cuente los embriones.
- Vuelva a insertar la mayoría de los cuernos uterinos, pero deje expuesto el extremo distal de un cuerno uterino que contiene 3 embriones expuestos.
- Usando fórceps contundentes, empuje suavemente y tire del útero con los 3 embriones a través de la abertura en la membrana de silicona de la placa modificada de Petri.
- Estabilice la placa Petri usando cubos de arcilla de modelado.
- Estabilice el útero con los tres embriones dentro de la placa De Petri usando un molde de silicona. Aplana el tapón de silicona a un lado de los embriones con un cuchillo afilado.
- Llena la placa de Petri con PBS estéril. Enjuague la membrana de silicio en la parte inferior de la placa De Petri con el vientre de la presa embarazada evitando así cualquier fuga.
- Mueva la cabeza de ultrasonido a la placa de Petri ~0,5 cm encima del embrión superior y ajuste el escenario para que la cavidad amniótica se haga claramente visible en la vista de ultrasonido.
- Alinee la aguja del inyector cuidadosamente en la placa Petri modificada. Usando el micromanipulador, coloque la punta de la aguja dentro de ~5 mm del embrión superior. A continuación, alternar la aguja de un lado a otro y pasar al plano donde su punta aparece más brillante en la imagen de ultrasonido.
- El uso del micromanipulador empuja la aguja a través de la pared uterina hacia la cavidad amniótica.
- Inyectar lentivirus que contenga biblioteca de sgRNA.
- Preprograme el inyector a 62 nL y velocidad de inyección lenta. El microinyector se puede programar para inyectar volúmenes específicos a una velocidad lenta o rápida.
- Pulse el botón Inyectar 8 veces para un total de 496 nL por embrión. Ajuste el volumen a las necesidades requeridas y al valor más ordenador viral. Un valor viral de 1 x 108 pfu/mL y un volumen de inyección de 496 nL dará lugar a aproximadamente un 30% de infectividad.
- Repita el mismo procedimiento para otros dos embriones.
- Levante la cabeza del ultrasonido y retire el tapón de silicona.
- Empuje suavemente los 3 embriones hacia el abdomen del ratón usando un intercambio estéril de algodón.
- Extraiga suavemente los siguientes 3 embriones y repita el procedimiento de inyección hasta que se inyecte el número deseado de embriones.
NOTA: No exceda de 30 minutos de anestesia, ya que las presas embarazadas son mucho más propensas a abortar sus embriones más allá de ese tiempo. Un cirujano experimentado puede inyectar hasta 12 embriones dentro de una cirugía de 30 minutos.
- Levante la cabeza del ultrasonido, retire el micromanipulador con la aguja, aspire el PBS y retire la placa de Petri. Usando toallitas estériles, absorbe cualquier PBS que pueda haberse acumulado en la cavidad abdominal.
- Cierre la incisión peritoneal con suturas absorbibles. Utilice dos grapas para cerrar la incisión en la piel abdominal.
NOTA: Mientras se realiza una guía ultranóstiva en cirugías de útero, se debe tener el máximo cuidado de mantener un ambiente limpio, mantener la esterilidad tanto como sea posible y evitar posibles contaminantes. Si se debe hacer más de una cirugía el mismo día, es importante esterilizar los instrumentos de disección usando un esterilizador de cuentas y limpiar otros aparatos que encuentran tejido del ratón limpio con etanol. Esto aumenta en gran medida la mayor supervivencia de los embriones después de la cirugía. La tasa de supervivencia para el método de cirugía descrito aquí es consistentemente entre 80-100%. - Atención post-cirugía.
- Permita que la hembra embarazada se recupere en una jaula calentada y observe durante 15-30 min.
- Revise el canal vaginal en busca de sangre, lo cual es un signo temprano de aborto y complicaciones. Para aliviar el dolor postoperatorio, entregue la administración del analgésico dos veces al día durante dos días después de la cirugía.
- Identifique embriones transducidos/ratones Rosa26-Lox-STOP-Lox-Cas9-GFP recién nacidos utilizando un microscopio diseccionador fluorescente, una linterna de proteína fluorescente y gafas de filtro o mediante genotipado para partículas virales integradas en clips de oído o cola.
NOTA: Los ratones son mejor identificados usando microscopio fluorescente hasta el día 3 postnatal antes de que el cabello comience a crecer. - Para garantizar suficiente cobertura para la biblioteca CRISPR, calcule la cobertura en función de los siguientes parámetros: E9.5 ectoderm de superficie del ratón consta de ~ 150,000 celdas; transducción de ~ 20% resulta en una tasa mínima de infección doble (~ 1/10 células infectadas dobles)4,5,11; con un 20% de infectividad, cada embrión tiene 30.000 células infectadas. Asegúrese de que al menos 100 células individuales se transducan con un esgRNA dado. Por ejemplo, un grupo de 2000 sgRNAs requiere 2 x 105 células o 6-7 animales.
4. Procedimiento de secuenciación profunda
- Tras la variable experimental como la formación de tumores o cualquier otro fenotipo, sacrifique al ratón y coseche el tejido de interés. Utilice el kit de extracción de ADN de sangre y tejidos para purificar el ADN genómico siguiendo el protocolo del fabricante. Antes de iniciar la extracción de ADN de tumores, limpie el banco de trabajo con DNA Erase y trabaje lejos del área de laboratorio donde se manejan los plásmidos.
NOTA: Es importante generar una muestra de referencia que permita calcular los cambios de pliegue de sgRNA a lo largo del tiempo. Embriones transducidos 3 días después de la infección o células transducidas (ver paso 2. 6) pueden servir como muestra de referencia para determinar la representación del ESN en la biblioteca original. - Utilice 100 ng – 1,5 μg de ADN genómico como plantilla en una reacción PCR 1 de preamplificación de 50 μL utilizando las imprimaciones externas enumeradas en el Cuadro 1 y el programa PCR descrito en el Cuadro 2. Configure suficiente reacción para producir la cobertura deseada.
NOTA: Configure la reacción de PCR de código de barras en un área dedicada separada del laboratorio o en una campana de cultivo de tejidos que se limpia a fondo mediante el borrado del ADN para evitar cualquier contaminación. Ejecute el control negativo para cada placa PCR con agua como plantilla para asegurarse de que no haya contaminación. - Agrupa toda la reacción PCR 1 y ejecuta 20 μL en un gel de agarose de control del 1,5% para verificar la amplificación exitosa de una banda de 600 bp.
- Utilice 5 μL de la reacción PCR1 agrupada como plantilla en una reacción de 50 μL de PCR 2 utilizando una combinación única de imprimación con código de barras enumerada en la Tabla 3 y el programa PCR descrito en el Cuadro 4. Ejecute 50 μL de reacción PCR 2 en un gel de agarose del 2% y purifique la banda de 200bp usando un kit de extracción de gel según las instrucciones del fabricante.
NOTA: El paso de preamplificación solo es necesario para la amplificación de un tejido transducido complejo. Si amplificar un solo tumor que presumiblemente se desarrolló forma una célula clonal y por lo tanto contiene un solo esgRNA, uno puede saltarse el PCR1 de preamplificación y proceder inmediatamente con PCR2. - Cuantificar la concentración de ADN mediante cuantificación fluorométrica y enviado para la secuenciación profunda a la instalación de secuenciación (por ejemplo, 1 millón de lecturas por tumor).
- Utilice Bowtie v1.2.3, que solo permite alineaciones sin tapar, alinear lecturas secuenciadas con la biblioteca de sgRNA13. Cree un índice bowtie utilizando el comando bowtie-build que introduce las secuencias de sgRNA en formato fasta. Asigne las lecturas mediante el comando bowtie con las opciones -m 2 -v 1, lo que permite un máximo de dos discrepancias durante la alineación de lectura y descarta lecturas que alinean más de una secuencia de sgRNA de biblioteca. Normalmente, más del 80% de las lecturas se alinean bajo estos parámetros.
- Utilice el comando mageck count para obtener la tabla de recuento de lectura utilizando el archivo alineado como entrada14. La tabla de recuento de sgRNA se puede utilizar para análisis posteriores, como determinar el esgRNA diferencial (MAGeCK) y encontrar genes esenciales (BAGEL).
Resultados
La Figura 1A muestra el diseño de los oligonucleótidos para multiplexar varias bibliotecas CRISPR personalizadas de una manera rentable en un solo chip de oligo de 12k o 92k. Una vez seleccionados los sgRNAs (color azul codificado), los oligonucleótidos están diseñados con sitios de restricción (BsmBI de color naranja) y pares de imprimación PCR específicos de la biblioteca (codificados en color verde). Varias bibliotecas se pueden diseñar mediante el uso de una combinación única ...
Discusión
La edición del genoma CRISPR/Cas9 ha sido ampliamente utilizada en estudios in vitro e in vivo para investigar las funciones genéticas y los procesos celulares. La mayoría de los estudios in vivo utilizan células editadas por genes CRISPR/Cas9 injertadas en un modelo animal (aloinjerto o xenoinjerto). Si bien esta es una poderosa herramienta para estudiar la genética del cáncer y las funciones celulares, todavía carece del microambiente de tejido nativo y podría provocar heridas y/o respuestas inmunes.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue apoyado por una subvención de proyectos del Instituto Canadiense de Investigación de la Salud (CIHR 365252), la Fundación Krembil y la Ronda 8 de Excelencia en Investigación del Fondo de Investigación de Ontario (RE08-065). Sampath Kumar Loganathan es el receptor de una beca de la Sociedad Canadiense del Cáncer (BC-F-16#31919).
Materiales
| Name | Company | Catalog Number | Comments |
| 0.45 micron filter | Sigma | S2HVU02RE | |
| 12k or 92k oligo chip | Customarray Inc. (Genscript) | ||
| 15 cm cell culture plates | Corning | ||
| 293FT | Invitrogen | R70007 | |
| 293NT | Systems Biosciences | LV900A-1 | |
| Alkaline phosphatase | NEB | M0290L | |
| Amplicillin | Fisher Scientific | BP1760-25 | |
| ATP | NEB | 9804S | |
| BsmBI | NEB | R0580L | |
| Chromic gut suture | Covidien | ||
| Deep sequencing (Next-Seq or Hi-Seq) | Illumina | ||
| DNA-cleanup kit | Zymo Research | D4008 | |
| DNAesy Blood and Tissue DNA extraction kit | Qiagen | 69506 | |
| Endura electrocompetent cells | Lucigen | 60242-1 | |
| Glass Capillaries | Drummond | 3-000-203-G/X | |
| HEK293T cells | ATCC | CRL-3216 | |
| High-Speed Centrifuge | Beckman Coulter | MLS-50 | |
| LB Agar | Wisent Technologies | 800-011-LG | |
| Micropipette puller | Sutter Instrument | P97 | |
| Mineral oil | Sigma | M5904 | |
| Mini-prep plasmid Kit | Frogga Bio | PDH300 | |
| Mouse oxygen anaesthesia system | Visual Sonics | ||
| Nanoject II micromanipulator | Drummond | ||
| NEBuffer 3.1 (Buffer for BsmBI) | NEB | R0580L | |
| Needle sharpener | Sutter Instrument | BV-10 | |
| Oligo cleanup kit | Zymo research | D4060 | |
| PAGE purified illumina sequencing primer | IDT DNA | ||
| PEI (polyethyleneimine) | Sigma | 408727-100ML | |
| Permoplast modeling clay | |||
| Petridish with central opening | Visual Sonics | ||
| pMD2.G | Addgene | 12259 | |
| psPAX2 | Addgene | 12260 | |
| Q5 Polymerase 2x Master mix | NEB | M0494L | |
| Qubit Fluorometric Quantification | Invitrogen | Q33327 | |
| Semicircular Silicone plug | Corning | ||
| Silicone membrane | Visual Sonics | ||
| T4 DNA ligase | NEB | M0202L | |
| Ultra-centrifuge tubes | Beckman Coulter | 344058 | |
| Vevo2000 ultrasound system | Visual Sonics |
Referencias
- Beronja, S., Fuchs, E. RNAi-mediated gene function analysis in skin. Methods in Molecular Biology. 961, 351-361 (2013).
- Beronja, S., Livshits, G., Williams, S., Fuchs, E. Rapid functional dissection of genetic networks via tissue-specific transduction and RNAi in mouse embryos. Nature Medicine. 16, 821-827 (2010).
- Shalem, O., et al. Genome-scale CRISPR-Cas9 knockout screening in human cells. Science. 343, 84-87 (2014).
- Beronja, S., et al. RNAi screens in mice identify physiological regulators of oncogenic growth. Nature. 501, 185-190 (2013).
- Loganathan, S. K., et al. Rare driver mutations in head and neck squamous cell carcinomas converge on NOTCH signaling. Science. 367, 1264-1269 (2020).
- Leemans, C. R., Snijders, P. J. F., Brakenhoff, R. H. The molecular landscape of head and neck cancer. Nature Reviews Cancer. 18, 269-282 (2018).
- Green, A. C., Olsen, C. M. Cutaneous squamous cell carcinoma: an epidemiological review. British Journal of Dermatology. 177, 373-381 (2017).
- Campbell, J. D., et al. pathway network, and immunologic features distinguishing squamous carcinomas. Cell Reports. 23, 194-212 (2018).
- Sanjana, N. E., Shalem, O., Zhang, F. Improved vectors and genome-wide libraries for CRISPR screening. Nature Methods. 11, 783-784 (2014).
- Geraerts, M., Willems, S., Baekelandt, V., Debyser, Z., Gijsbers, R. Comparison of lentiviral vector titration methods. BMC Biotechnology. 6, 34 (2006).
- Schramek, D., et al. Direct in vivo RNAi screen unveils myosin IIa as a tumor suppressor of squamous cell carcinomas. Science. 343, 309-313 (2014).
- Platt, R. J., et al. CRISPR-Cas9 knockin mice for genome editing and cancer modeling. Cell. 159, 440-455 (2014).
- Langmead, B., Trapnell, C., Pop, M., Salzberg, S. L. Ultrafast and memory-efficient alignment of short DNA sequences to the human genome. Genome Biology. 10, 25 (2009).
- Li, W., et al. MAGeCK enables robust identification of essential genes from genome-scale CRISPR/Cas9 knockout screens. Genome Biology. 15, 554 (2014).
- Winters, I. P., Murray, C. W., Winslow, M. M. Towards quantitative and multiplexed in vivo functional cancer genomics. Nature Reviews Genetics. 19, 741-755 (2018).
- Rogers, Z. N., et al. Mapping the in vivo fitness landscape of lung adenocarcinoma tumor suppression in mice. Nature Genetics. 50, 483-486 (2018).
- Chow, R. D., et al. AAV-mediated direct in vivo CRISPR screen identifies functional suppressors in glioblastoma. Nature Neuroscience. 20, 1329-1341 (2017).
- Wang, G., et al. Mapping a functional cancer genome atlas of tumor suppressors in mouse liver using AAV-CRISPR–mediated direct in vivo screening. Science Advances. 4, 5508 (2018).
- Chan, K., Tong, A. H. Y., Brown, K. R., Mero, P., Moffat, J. Pooled CRISPR-based genetic screens in mammalian cells. Journal of Visualized Experiments. (151), e59780 (2019).
- Hart, T., et al. High-resolution CRISPR screens reveal fitness genes and genotype-specific cancer liabilities. Cell. 163, 1515-1526 (2015).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados