JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
마우스 피부와 구강의 유전자 기능을 동시에 평가하기 위한 Vivo CRISPR/Cas9 스크리닝
요약
여기서 우리는 면역 능력 마우스의 피부와 구강에 있는 몇몇 유전자의 기능을 동시에 평가하기 위하여 자궁 배아 렌즈바이러스 주사에서 초음파 유도를 사용하여 생체 내 CRISPR/Cas9 검열 방법론을 기술합니다.
초록
유전자 변형 마우스 모델 (GEMM)은 유전자 기능을 평가하고, 인간 질병을 모델링하고, 치료 방법을 평가하기 위한 전임상 모델로 봉사하는 데 중요한 역할을해 왔습니다. 그러나, 그들의 시간, 노동 및 비용 집약적인 성격은 유전자 기능의 체계적인 분석을 위한 그들의 유틸리티를 제한합니다. 최근 게놈 편집 기술의 발전은 이러한 한계를 극복하고 멀티플렉스및 신속한 방식으로 특정 마우스 기관 내에서 직접 특정 유전자 변류의 빠른 생성을 허용합니다. 여기서, 우리는 CRISPR/Cas9 기반 방법(정기적으로 간격이 있는 짧은 Palindromic 반복군)을 기술하여 마우스의 피부와 구강의 상피 내에서 수천 개의 유전자 녹아웃 클론을 생성하고 종양 억제기 유전자에 대한 생체 내 CRISPR 화면에서 직접 수행하는 데 필요한 단계를 자세히 설명하는 프로토콜을 제공합니다. 이러한 접근법은 조직 항상성 동안 또는 다양한 질병 환경에서 유전자의 생물학적 기능을 연구하기 위해 CRISPR 활성화 또는 CRISPR 불활성화와 같은 다른 기관 또는 기타 CRISPR/Cas9 기술에 적용될 수 있다.
서문
게놈 이후 시대에 암 연구를 위한 도전의 한은 인과 유전자 돌연변이를 위한 게놈 데이터의 광대 한 양을 채굴하고 치료적으로 표적으로 할 수 있는 유전자 네트워크에 있는 노드를 확인하는 것입니다. 생물 정보 학적 분석은 이러한 목표를 향해 대단히 도움이되었지만, 시험관 및 생체 내 모델에서 효율적인 확립은 생물학적 시스템과 질병 상태의 복잡성을 해독하고 약물 개발을 가능하게하는 전제 조건입니다. 기존의 형질전환 마우스 모델은 생체 암 유전학 연구를 위해 광범위하게 사용되었지만, 그들의 비용, 시간 및 노동 집약적 인 성격은 현대 유전체학에 의해 해명 된 수백 개의 putative cancer 유전자의 체계적인 분석을 크게 금지했습니다. 이 병목 현상을 극복하기 위하여는, 우리는 한 마우스의 피부와 구강에 있는 유전자의 수백의 기능 손실 돌연변이를 동시에 유도하고 연구하기 위하여 CRISPR/Cas9 (정규로 간격짧은 Palindromic 반복군집실) 유전자 편집 기술3와 자궁 주입 방법론1,2에서 이전에 확립된 초음파 유도를 결합했습니다.
여기에서 기술된 방법론은 배아일 E9.5에서 살아있는 마우스 배아의 양수 구멍으로 설계한 렌즈바이러스의 초음파 유도 주입을 이용합니다. CRISPR/Cas9 성분이 함유된 렌티바이러스 화물은 단일 층 표면 엑토더름을 트랜스듀싱하여 나중에 피부와 구강의 상피를 초래합니다. 피부는 외부 표피로 구성되며 지하 막과 진피가 뒤따릅니다. 표피는 지하 막과의 접촉을 유지하고 증식 및 줄기 세포 용량을 가진 내부, 기저 층으로 구성된 계층화 된 상형입니다. 기저층은 가시, 세분화 및 층 각막 층2,4와같은 위의 차별화된 층을 야기한다. 리니지 추적 연구는 생체 내 CRISPR /Cas9 방법으로이 직접 성인기 전반에 걸쳐 지속되는 기저 층 내에서 조직 거주자 줄기 세포를 유전적으로 조작하는 것으로 나타났습니다. 렌티바이러스는 클론 밀도에서 E9.5 표면 ectoderm을 트랜스듀싱하기 위해 적정화될 수 있으므로, 이 방법은 수천 개의 이산 유전자 녹아웃 클론을 수용하는 모자이크 마우스를 생성하는 데 사용될 수 있다. 차세대 시퀀싱은 그 클론 내에서 CRISPR/Cas9 매개 유전자 절제의 효과를 복합화 된 방식으로5로분석하는 데 사용될 수 있다.
우리는 최근에 인간 머리와 목 편평상피세포암 (HNSCC)5에있는 재발하는 돌연변이를 보여주는 484개의 유전자의 기능을 평가하기 위하여 이 방법을 이용했습니다. HNSCC는 40-50%의 높은 사망률을 가진 파괴적인 암이고 세계6번째로 일반적인 암입니다. HNSCC는 상부 기도 또는 구강의 점막 안대기에서 발생하고 담배 와 알코올 소비 또는 인간 유두종 바이러스 (HPV) 감염과 관련이 있습니다. 피부 편평상피 세포 암 (SCC)은 피부 종양이며 인간7에서두 번째로 흔한 암을 나타낸다. 분리SCC 및 HNSCC는 조직학적 및 분자학적매우 유사하며, TP53, PIK3CA, NOTCH1 및 HRAS8에서변경을 나타내는 경우의 높은 비율을 가진다. 고주파에서 돌연변이된 유전자의 소수만이 있는 동안, 저주파에서 돌연변이된 유전자의 수백이 있습니다 (&5%), 일반적으로 긴 꼬리 분포로 불리는 현상. 긴 꼬리 유전자의 대다수가 생물학적 또는 임상 적 검증이 부족하기 때문에, 우리는 p53, Pik3ca 또는 Hras에서 민감하게 돌연변이를 가진 종양 경향이 마우스에서 이러한 유전자의 기능 상실을 모델링하기 위해 생체 내 CRISPR 스크리닝 기술을 사용하고 p53, Pik3ca 또는 Hras와 협력하는 몇 가지 새로운 종양 억제 유전자를 확인하여 종양발달을유발합니다 5.
여기서, 우리는 멀티플렉스 sgRNA 렌티바이러스 CRISPR sgRNA 라이브러리를 생성하고 마우스 표면 ectoderm에서 CRISPR/Cas9 유전자 녹아웃 스크린을 수행하는 상세한 프로토콜을 설명합니다. 참고로, 이러한 방법론은 CRISPR 활성화(CRISPRa) 및 CRISPR 불활성화(CRISPRi)와 같은 다른 유전자 조작 기술을 통합하거나 유전자 기능을 연구하기 위해 마우스의 다른 장기 시스템을 표적으로 변형하도록 조정할 수 있다.
프로토콜
이 프로토콜은 토론토 대학의 IACUC에 따라 승인및 수행되었습니다.
1. 풀링된 CRISPR 라이브러리의 설계 및 복제
- 브로드 인스티튜트 sgRNA 디자이너(https://portals.broadinstitute.org/gpp/public/analysis-tools/sgrna-design) 또는 CHOPCHOP 서버(https://chopchop.cbu.uib.no)와 같은 자원으로부터 관심 있는 마우스 유전자를 대상으로 하는 4-5sgRNAs를 선택합니다. 예를 들어 Sanjana 외.9에서 동일한 수의 비타겟팅 sgRNA를 선택하여 동일한 크기의 비타겟팅 컨트롤 gRNA 라이브러리를 생성합니다.
- sgRNA 라이브러리를 구성하는 동안, 표적 기관 시스템에서 각 sgRNA에 대한 충분한 범위가 있는지 확인하십시오. 마우스 피부에 대해, E9.5의 표피는 ~150,000세포를 포함하는 단일 층이며, 대부분은 줄기 세포 용량4를갖는다. 렌티 바이러스 성 트랜스포션이 15-20%의 감염성 으로 발생하면 18,000-24,000세포만이 E9.5에서 변환됩니다. 그에 따라 실험을 확장합니다.
- 이러한 sgRNA 라이브러리의 복제 및 증폭을 위해, BsmBI 효소 제한 부위뿐만 아니라 sgRNA의 5' 및 3'끝에 DNA 서열을 결합하는 프라이머를 추가하고 풀링된 올리고뉴클레오티드칩(그림 1A)으로결과 전체 길이 올리고를 주문한다.
- 한 칩의 다른 라이브러리를 멀티플렉스에 라이브러리 특정 프라이머 시퀀스를 추가합니다.
- 적절한 프라이머 쌍을 사용하여 각 라이브러리를 풀드올리고 칩과 별도로 증폭시합니다. PCR 튜브에서는 2x 폴리머라제 마스터 믹스 25 μL, DNase/RNase 프리 워터 20 μL, 올리고 칩 DNA 5ng, 적절한 전방 프라이머 2.5 μL 및 적절한 역프라이머 2.5 μL을 혼합합니다. PCR 기계의 각 사이클에 대해 12-15 사이클을 사용하고 98°C 의 데니션, 63-67°C 어닐링, 72°C 확장 파라미터로 증폭한다.
- PCR 제품을 2.5% 아가로즈 젤로 실행하고 젤 DNA 정화 키트를 사용하여 ~100 bp PCR 제품을 정화합니다.
- 백본 플라스미드를 준비합니다.
- 55°C에서 1시간 동안 50μL 반응 믹스에서 BsmBI2μL을 함유한 pLKO-Cre 스터퍼 v3 플라스미드를 함유한 Cre-recombinase의 5 μg, 제조사의 지시에 따라 알칼리성 인스파타아제 의 1μL이 37°C에서 45분 동안 배양하였다.
참고: pLKO-Cre 스터퍼 v3 플라스미드를 함유한 Cre-recombinase는 마우스 세포에서 록스 스톱 록스 카세트를 제거하기 위해 Cre-recombinase 효소를 함유하고 있으며 SgRNA 및 tracrRNA의 발현을 구동하는 U6 프로모터가 있는 렌티 바이러스 성 기반 플라스미드입니다. Cas9 및 Cas9없이 버전은 Addgene #158030 및 #158031 사용할 수 있습니다. - 소화된 DNA를 1% 아가로즈 젤로 실행하고 젤 DNA 정화 키트를 사용하여 7kb 선형 벡터 밴드를 정화합니다. 참고로, 2 kb 스터퍼 밴드는 성공적인 소화를 나타내는 볼 수 있어야 합니다.
- 55°C에서 1시간 동안 50μL 반응 믹스에서 BsmBI2μL을 함유한 pLKO-Cre 스터퍼 v3 플라스미드를 함유한 Cre-recombinase의 5 μg, 제조사의 지시에 따라 알칼리성 인스파타아제 의 1μL이 37°C에서 45분 동안 배양하였다.
- sgRNA 플라스미드 라이브러리를 생성하기 위해 결찰 반응을 설정합니다.
- 정제 된 벡터 1 μg와 정제 된 PCR 인서트의 30 ng를 BsmBI 2 μL, T4 DNA 리개제 5 μL, 10 μM ATP 및 BsmBI에 특정한 1x 버퍼를 혼합하십시오. 37°C에서 하룻밤 동안 결찰 믹스를 배양한다. PCR 인서트를 제외한 모든 위의 재질을 포함하는 추가 튜브를 음수 제어로 사용합니다.
- 다음날 아침, 올리고 클린업 키트를 사용하여 결찰 믹스를 정화하고 RNase/DNase 프리 워터의 7μL에서 엘루트(elute)를 사용합니다.
- 라이브러리를 유능한 셀로 전기화합니다.
- 얼음 에 미리 냉각 된 큐벳 (1.0mm)에서 해동 된 전기 능력 세포의 25 μL에 용출 된 sgRNA 라이브러리 또는 음의 제어 결찰 혼합 2 μL을 추가합니다. 제조업체의 프로토콜(10μF, 600 옴, 1800 볼트)에 따른 전기전극. 큐벳에 펄스의 10s 이내에 회수 배지(또는 SOC 배지)의 975 μL을 첨가한다.
- 300 rpm에서 세균 흔들림 인큐베이터에서 37°C에서 1시간 동안 배양 튜브로 전기폴화 된 세포를 이송한다.
- sgRNA당 변환 효율성과 라이브러리 커버리지를 예측합니다.
- sgRNA 라이브러리로 전포된 세포를 포함하는 변환 반응의 10 μL또는 음극제 결찰을 복구 매체의 990 μL로 이송하여 100배 희석을 준비하고 잘 섞는다.
- 희석 된 변환의 플레이트 10 μL은 미리 데운 10cm LB + 암피실린 (100 μg/L) 한마판에 혼합합니다. 이로 인해 변압제의 10,000배 희석이 발생하며 이 플레이트를 사용하여 변환 효율을 계산합니다. 14-16 h에 대한 30 °C에서 플레이트의 인큐베이션을 수행합니다.
- 총 10개의 미리 따뜻워진 15cm LB + 암피실린 아가르 플레이트의 각 플레이트에 100 μL의 회수된 세포를 퍼감으로써 변형 반응의 나머지 부분을 플레이트. 플레이트를 30°C에서 14-16h로 배양합니다. 참고로, 30°C에서의 성장은 바이러스 플라스미드 내에서 두 개의 긴 단말 반복 간의 재결합을 최소화한다.
- 복제 성공을 평가하려면 변환 효율성을 계산합니다. sgRNA 라이브러리 또는 음극제 결찰(10cm 플레이트, 1.8.2)으로부터 변압제를 함유하는 희석판의 콜로니 수를 계산한다. 부정적인 제어 믹스는 식민지가 없거나 거의 없어야합니다. 식민지의 총 수를 얻으려면 식민지 수를 10,000 배곱합니다.
참고: 계산된 총 식민지 수는 sgRNA 당 최소 200배의 식민지여야 하는 라이브러리 커버리지를 나타냅니다.- 2000sgRNA가 있는 도서관에 최소 400,000개의 식민지가 있는지 확인합니다. 식민지가 충분하지 않은 경우, 반복하고 더 많은 전기 화를 설정합니다.
- 품질 관리: 희석 플레이트에서 20개의 식민지를 선택하고 각 콜로니를 LB 미디어 + 암피실린 3mL가 들어있는 개별 배양 튜브에 추가합니다. 250 rpm에서 30 °C에서 밤새 20 개의 튜브를 모두 배양하십시오. 제조업체의 지침에 따라 미니 준비 키트를 사용하여 플라스미드 DNA를 정화하고 각 샘플이 U6 프라이머(5'-GAG GGC CTA TTT CCC ATT CC-3')를 사용하여 다른 sgRNA 서열을 가지고 있는지 확인하기 위해 20개의 플라스미드 DNA 샘플을 모두 확인할 수 있습니다.
- 각 15cm 접시에서 식민지를 수확하십시오.
- LB 배지 7mL를 추가한 다음 LB Agar 플레이트에서 세포 스프레더로 콜로니를 긁어냅니다. 10mL 파이펫을 사용하여 세포를 2L 멸균 원추형 플라스크로 옮기다. 2 L 플라스크의 모든 접시와 풀 박테리아를 반복하십시오. 플라스크를 30°C에서 2-3h 흔들어 배양한다. 원심 분리 문화를 수집하고 펠릿을 수집합니다.
- 맥시 플라스미드 정제 키트를 사용하여 플라스미드 DNA를 정화합니다.
- 추가 품질 관리: 맥시 준비 sgRNA 라이브러리 플라스미드 DNA의 1 ng를 사용하고 제조업체의 지침에 따라 차세대 시퀀싱 프라이머를 사용하여 PCR 반응을 실행합니다. 라이브러리의 모든 sgRNAs의 표현은 깊은 시퀀싱 플랫폼에서 확인할 수 있습니다.
2. 생체 내 트랜스포션에 적합한 하이 티터 렌티바이러스 생산
참고: 클래스 II, 유형 A2 생물 안전 캐비닛의 BSL2+ 시설에서 프로토콜의 이 섹션에서 모든 단계를 수행합니다. 293FT 및 특히 293NT 포장 셀은 더 높은 바이러스 생산을 허용합니다. 낮은 통로(&p20) HEK293T, 293FT 또는 293NT 세포를 트랜스페트에 사용합니다. 모든 미디어를 37°C로 미리 데우지 합니다. HEK293T, 293FT 또는 293NT 셀이 세분화되는 동안 컨클레이브되는 것을 결코 허용하지 마십시오. SV40 대형 T항원발현을 유지하기 위해 G418의 존재 속에서 293FT를 성장시다.
- 바이러스 성 포장 세포를 준비합니다.
- 첫날, 6폴리L-리신에 플레이트 HEK293T 세포는 성장 매체에서 35% 합류로 15cm 플레이트를 코팅하였다(DMEM + 10% FBS + 1% 페니실린-연쇄상구균 항생제 용액(w/v).. 37 °C, 5 % CO2에서하룻밤 세포를 배양한다.
- 도금 된 세포가 70-80 % 컨실루고 균등하게 퍼지면 성장 매체를 25 mL의 혈청 및 항생제없는 DMEM 미디어로 대체하십시오.
- HEK293T 및 293NT 세포가 조직 배양 플라스틱에서 쉽게 분리 할 수 있기 때문에 먹이를 줄 때 플라스크 측면에 천천히 미디어를 추가합니다.
- 트랜스펙트 믹스를 준비합니다.
- 렌즈피바이러스 포장 플라스미드 psPAX2, 43 μg의 봉투 플라스미드 pMD2.G, sgRNA 라이브러리 플라스미드의 65 μg, 1 mg/mL 폴리에틸렌네이민(PEI)의 240 μL을 DMEM과 소용돌이의 6mL에 추가합니다.
참고: 이 단계에서 pH가 중요하고 DMEM이 열리면 시간이 지남에 따라 더 기본적이기 때문에 항상 미개봉 또는 최근에 개설된 DMEM 병을 트랜스페션에 사용합니다. - 실온에서 15분 동안 배양하십시오. 이 형질 혼합물은 870cm2 표면적을 가진 6 x 15cm 플레이트에 도금된 세포에 충분합니다. 실험의 요구 사항에 따라 형질 전환 믹스를 확장합니다.
- 렌즈피바이러스 포장 플라스미드 psPAX2, 43 μg의 봉투 플라스미드 pMD2.G, sgRNA 라이브러리 플라스미드의 65 μg, 1 mg/mL 폴리에틸렌네이민(PEI)의 240 μL을 DMEM과 소용돌이의 6mL에 추가합니다.
- 바이러스 포장 세포의 트랜스페션.
- 15분 동안 배양후, 15cm 플레이트를 각각 배회한 후, 플레이트 전체에 걸쳐 1mL의 형질 혼합물을 첨가하여 배분한다. 37 °C에서 인큐베이션, 8 h에 대한 5 % CO2.
- 인큐베이션 후, 형질혼합을 포함하는 혈청프리 배지를 제거하고 37°C에서 48h, 5%CO2로48h의 15cm 플레이트 및 배양에 일반 배양 매체의 30mL를 추가한다.
- 48h 후, 바이러스 성 상체를 수집하고 0.45 μm PVDF 필터를 통해 필터링합니다. 바이러스 성 상체의 1 mL을 유지하고 품질 관리 및 바이러스 성 titering을 위해 -80 °C에 보관하십시오.
- SW28 로터 헤드를 사용하여 고속 원심분리기에서 자당 그라데이션 원심분리에 의해 바이러스 성 상체를 농축합니다.
- 주요 초원심분리기 튜브는 70%의 에탄올로 세척한 후 PBS로 3개의 헹구는 튜브를 넣습니다. 6-초원심분리기 튜브 각각에 바이러스 성 상피물의 약 30mL를 균등하게 분배한다.
- 20% 자당 용액의 각 튜브 4mL의 바닥에 부드럽게 파이펫 (PBS의 100 mL에서 자당 20 g). 6개의 초원심분리기 튜브를 6개의 SW28 스윙 버킷에 넣고 바이러스 성 상체를 추가하거나 제거하여 각 상대 버킷 쌍의 균형을 정밀하게 조정합니다.
- 원심분리기 바이러스 성 상신제는 4 °C에서 적어도 2 시간 동안 최대 4 h80,000 x g 및 4 °C에서. 원심분리가 완료되면 상체를 조심스럽게 폐기하십시오.
- 초음파 심분리기 튜브를 멸균 소프트 종이 타월에 거꾸로 놓고 최소 2분 동안 배출하고 부드러운 종이 타월을 사용하여 튜브 내부의 모든 수퍼네티를 닦아 잔여 배지를 제거하십시오. 튜브 의 하단에 작은 회색 흰색 펠릿이 보일 수 있습니다.
- 각 튜브에 20-25 μL 의 차갑고 신선한 PBS를 추가합니다. 파라핀 필름으로 튜브를 밀봉하고 - 2 h의 궤도 플랫폼 셰이커에 부드러운 흔들림으로 얼음에 수직으로 튜브를 인큐베이션합니다.
- 20 μL 파이펫을 사용하여 조심스럽게 첫 번째 튜브의 펠릿을 빼내고 다시 일시 중단하여 거품을 형성하지 않도록 주의하십시오. 배지를 다음 튜브로 옮기고 모든 바이러스 펠릿이 약 120-150 μL 부피의 한 튜브로 결합될 때까지 공정을 반복한다. 부드러운 흔들림과 얼음에 또 다른 ~ 2 h에이 하이 티터 바이러스 현탁액을 인큐베이션.
- 바이러스 현탁액을 1.5mL 마이크로센심심분리기 튜브로 옮기고 2분 동안 12,000 x g에서 냉장 및 미리 냉각된 테이블 탑 원심분리기에서 4°C에서 튜브를 회전시한다. 알리쿼트(Aliquot)는 별도의 0.2mL 튜브에 10 μL 알리쿼트로서 명확한 바이러스 상체를 신중하게 인용하고 -80°C에 보관한다. 이 배아 주사 동안 바늘을 막히기 때문에 튜브의 바닥에 펠릿을 폐기.
- 풀풀드 CRISPR 렌티바이러스 라이브러리의 적정
참고: 결과 바이러스 현탁액은 대략 2,000 배 농도와 결과 바이러스 용액을 산출해야하며, 107-109의바이러스 성 티터가 있어야합니다, 이는 아래에 설명 된 100 E9.5 수술 이상에 충분하다.- 씨앗 R26-Lox-STOP-록스-tdTomato 마우스 배아 섬유아세포(MEFs) 또는 R26-록스-락스-tdTomato 1차 각질 세포세포 또는 다른 Cre-리포터 세포주 2 x 6웰 플레이트로.
- 세포가 ~40%의 합류에 도달하면 세포는 변환을 위한 준비가 되어 있습니다. 그 때, 나중에 바이러스 성 titer의 계산을 가능하게 하기 위하여 1 개의 우물 내의 세포의 수를 결정합니다. Cre-리포터 세포의 미디어를 10 μg/mL 폴리브레네(=헥사디메린 브로마이드)로 보충된 성장 매체로 변경합니다.
- 성장 매체의 2mL로 농축 바이러스의 1 μL을 희석시. 0, 10, 50, 200 μL의 희석 된 바이러스 현탁액과 50, 200 μL의 비농축 바이러스를 단계 2.4에서 넣고 플레이트를 혼합하고 밤에 37 °C, 5 % CO2에서배양하십시오.
- 다음 날 바이러스가 함유된 성장 매체를 제거하고, PBS로 세포를 세척하고, 정상 성장 매체로 대체한다. 이 시점에서 상신수는 여전히 바이러스 성 폐기물로 간주되며 기관 BSL2 규정에 따라 폐기해야합니다.
- 약 36-48 h 트랜스포메이션 후 록스-STOP-록스 카세트의 Cre-매개 재조합과 FACS에 의한 tdTomato 의 표현을 평가합니다. 바이러스 성 티터를 계산합니다. 다음 수식을 사용하여 콜로니 성형 단위(cfu)/mL을 계산합니다.
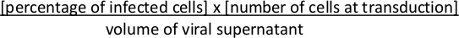
참고: 농축되지 않은 바이러스 성 상수와 농축 된 바이러스 현탁액 을 비교하여 (1) 바이러스 생산뿐만 아니라 (2) 바이러스 농도의 성공을 추정 할 수 있습니다. 대안적으로, 바이러스 성 티터는 qRT-PCR방법(10)을사용하여 추정될 수 있다. 렌티바이러스의 대규모 생산 및 농도는 또한 카트리지 농도를 가진 2단계 농도를 이용하여 수행될 수 있으며, 그 다음에 는 이전에설명된바와 같이 초원심분리가 선행된다.
3. 초음유도 수술 및 주입
참고 : 이 기술은4에서적응했다4 ,11. 표면 상피의 전도를 향해 기어드된 미세분사는 배아일 E9.5에서 수행되어야 하며, 표면 이포더름이 E10에서 시작하여 페라이더름의 형성 전 단일 층으로 구성될 때, 이는 이 기저층의 침투를 방지할 것이다. 바람직하게는 E9.5 배아를 가진 첫번째 가능한 날이 다음 월요일이 되도록, 금요일에 마우스를 설치합니다. 최적의 CRISPR/Cas9 효율12를위해 Rosa26-Lox-STOP-LOX-Cas9-Cas9-GFP 마우스(잭슨 연구소 #024857)를 사용하십시오.
- 원하는 수술 일 10 일 전에 시간 제 임신에 적합한 남성과 여성 마우스를 설정합니다.
- 잠재적으로 임신 한 마우스를 식별하기 위해 다음 일 동안 마우스를 플러그 검사합니다. 초음파를 사용하여 계획된 수술 (즉, E8.5)의 전날 임신을 확인하십시오.
- 수정된 페트리 접시를 준비합니다.
- 양면 스티커 테이프를 사용하여 실리콘 멤브레인을 원형 개구부를 덮는 페트리 접시의 바닥에 붙입니다. 날카로운 가위를 사용하여 실리콘 멤브레인에서 2 x 10mm 타원형 개구부를 잘라냅니다.
- 미세 주입 시스템의 준비
- 다음과 같은 설정으로 마이크로 피펫 풀러를 사용하여 두꺼운 벽 유리 모세관에서 주사 바늘을 준비 : 압력 = 200; 열 = 769; 풀 = 0; 속도 = 140; 시간 = 100.
- 미세 가위를 사용하여 직경이 ~30 μm인 수준에서 바늘 끝을 차단합니다. 바늘 깎는 체를 사용하여 20 분 동안 정기적으로 적재하는 고급 연마판에 20 ° 바늘을 베스팅하십시오.
- 26 G1/2 바늘로 10mL 주사기를 사용하여 70% 에탄올을 밀어 미세 주입 바늘을 살균합니다. 10mL 주사기와 미네랄 오일이 장착된 26 G1/2 바늘을 사용하여 미세 주입 바늘을 채우기. 미세 주입 바늘에 거품이 없는지 확인하십시오.
- 제조 업체 지침에 따라 미세 조작기에 마이크로 인젝터 바늘을 마운트.
- 바이러스 성 sgRNA 라이브러리와 바늘을로드합니다.
- 페펫 10 μL의 바이러스 현탁액은 평평한 표면에 고정된 파라필름에 고정되어 있습니다.
- 미세 조작기사용으로 미네랄 오일을 추방하십시오. 바늘에 소량의 오일이 있으면 렌즈바이러스가 피스톤에 접촉하는 것을 방지할 수 있습니다. 기포 없이 느린 포부에 의해 약 4-5 μL 바이러스 현탁액을 적재하십시오.
- 이소플루란 유도 챔버를 사용하여 임신 한 마우스를 마취. 산소 조절기를 1L/min 및 이소플루란 기화기를 2%로 설정합니다. 동물이 마취되는지 확인하려면 이소플루란 유도 챔버에서 ~3-5 분 후에 발가락 핀치로 확인하십시오.
- 마취된 동물 복부면을 가열수술 단계(40°C)에 올려 놓고 수술이 완료될 때까지 코콘 마취관과 함께 발을 제자리에 고정시키는 수술 테이프를 적용한다.
- E8.5에서 수행되지 않은 경우 E9.5 임신을 확인합니다.
- 소량(~ 1/2 티스푼)의 제모 크림을 복부에 바르고 면에 기울어진 어플리케이터를 사용하여 3 x 3cm 영역에 발라주세요.
- 2-3 분 후, 부드럽게 거즈 또는 조직으로 크림을 제거하고 PBS와 70 %의 에탄올을 사용하여 깨끗한 영역을 닦아.
- 초음파 프로브와 젤을 사용하여 임신 한 마우스를 배아 일 E9.5에 확인하십시오. 참고로, 이것은 또한 실제 수술 일에 시간을 절약 하기 위해 E8.5에서 전날 할 수 있습니다.
- 초음파 젤을 제거하고 BPS를 사용하여 깨끗한 영역을 닦은 다음 70 % 에탄올을 사용하여 소독하십시오.
- 마우스 댐에 부프레노르핀 진통제0.02cc를 피하한다.
- 외과적으로 자궁을 노출
- 멸균 집게와 가위를 사용하여 마우스 의 피부에 수직 ~ 2cm 절개를합니다.
- 무딘 집게를 사용하여 절개 주위의 피부를 회개에서 분리합니다.
- 멸균 집게와 가위를 사용하여 회랑을 잘라냅니다.
- 무딘 집게를 사용하여 왼쪽과 오른쪽 자궁 경적을 부드럽게 꺼내 배아를 계산합니다.
- 대부분의 자궁 뿔을 다시 삽입하지만 노출된 3개의 배아를 포함하는 1개의 자궁 뿔의 말단끝을 남깁니다.
- 무딘 집게를 사용하여 수정 된 페트리 접시의 실리콘 멤브레인의 개구부를 통해 3 배아로 자궁을 부드럽게 밀고 당깁니다.
- 모델링 점토 큐브를 사용하여 페트리 접시를 안정시하십시오.
- 실리콘 금형을 사용하여 페트리 접시 내부에 세 개의 배아로 자궁을 안정시다. 날카로운 칼을 사용하여 배아의 측면에 실리콘 플러그를 평평하게.
- 페트리 접시를 멸균 PBS로 채웁니다. 페트리 접시 바닥에 실리콘 멤브레인을 임신 한 댐의 배와 함께 씻어 누출을 방지합니다.
- 초음파 머리를 페트리 접시 ~0.5cm 상단 배아 위에 넣고 초음파 시야에서 양수 구멍이 명확하게 보이게되도록 단계를 조정합니다.
- 인젝터 바늘을 수정된 페트리 접시에 조심스럽게 정렬합니다. 마이크로 조작기를 사용하여 상단 배아의 ~5mm 내에 바늘 끝을 놓습니다. 그런 다음 바늘을 앞뒤로 전환하고 끝이 초음파 이미지에서 가장 밝은 것처럼 보이는 비행기로 이동합니다.
- 마이크로 조작기는 자궁 벽을 통해 바늘을 양수 구멍으로 밀어 넣습니다.
- sgRNA 라이브러리를 포함하는 렌즈 바이러스를 주입하십시오.
- 62 nL및 느린 사출 속도에 인젝터를 사전 프로그램. 마이크로 인젝터는 느리거나 빠른 속도로 특정 볼륨을 주입하도록 프로그래밍 할 수 있습니다.
- 배아 당 총 496 nL에 대해 주입 버튼을 8번 누릅니다. 필요한 요구 사항과 바이러스 성 티터에 볼륨을 조정합니다. 1 x 108 pfu/mL 및 496 nL 주사 부피의 바이러스 성 titer약 결과 30% 감염.
- 다른 두 배아에 대해 동일한 절차를 반복하십시오.
- 초음파 머리를 들어 올리고 실리콘 플러그를 제거합니다.
- 멸균 면 교환을 사용하여 3개의 배아를 마우스 복부에 부드럽게 밀어 넣습니다.
- 다음 3개의 배아를 부드럽게 꺼내 원하는 배아 수가 주입될 때까지 주사 절차를 반복합니다.
참고: 임신 한 댐이 그 시간 이후로 배아를 중단 할 가능성이 훨씬 높기 때문에 마취의 30 분 이상을 초과하지 마십시오. 숙련된 외과 의사는 30 분 수술 이내에 최대 12 개의 배아를 주입 할 수 있습니다.
- 초음파 머리를 들어 올리고 바늘로 미세 조작기를 제거하고 PBS를 흡인하고 페트리 접시를 제거하십시오. 멸균 물티슈를 사용하여 복강에 축적되었을 수 있는 PBS를 흡수하십시오.
- 흡수 성 봉합사를 사용하여 회중 절개를 닫습니다. 두 개의 스테이플을 사용하여 복부 피부의 절개를 닫습니다.
참고: 자궁 수술에서 유도된 초음질을 수행하는 동안 깨끗한 환경을 유지하고 가능한 한 멸균을 유지하고 가능한 오염 물질을 피하기 위해 최대한주의를 기울여야 합니다. 같은 날 두 개 이상의 수술을 해야 하는 경우, 비드 멸균제를 이용하여 해부 기구를 살균하고 에탄올로 세척된 마우스 조직을 만나는 다른 장치를 청소하는 것이 중요하다. 이것은 크게 수술 후 배아의 높은 생존을 증가시킨다. 여기서 설명된 수술 방법에 대한 생존율은 80-100%사이로 일관되게 수행된다. - 수술 후 치료.
- 임신 한 여성이 가열 된 케이지에서 회복하고 15-30 분 동안 관찰 할 수 있습니다.
- 낙태와 합병증의 초기 징후인 혈액에 대한 질 운하를 확인하십시오. 수술 후 통증 완화를 위해 수술 후 이틀 동안 하루에 두 번 진통제를 투여하십시오.
- 형광 해부 현미경, 형광 단백질 손전등 및 필터 안경을 사용하거나 귀 또는 꼬리 클립에 통합 된 바이러스 입자에 대한 genotyping을 사용하여 트랜스포밍 된 배아 / 신생아 Rosa26-Lox-STOP-Lox-Cas9-GFP 마우스를 식별합니다.
참고: 마우스는 모발이 자라기 시작하기 전에 산후 3일까지 형광 현미경을 사용하여 가장 잘 식별됩니다. - CRISPR 라이브러리에 대한 충분한 커버리지를 보장하기 위해 다음 매개 변수에 따라 커버리지를 계산하십시오: E9.5 마우스 표면 ectoderm은 ~150,000개의 세포로 구성됩니다. ~20%의 트랜스듀션은 최소 이중 감염률(~1/10 이중 감염세포)4,5,11; 20%의 감염성에서, 모든 태아에는 30,000개의 감염된 세포가 있습니다. 적어도 100개의 개별 세포가 주어진 sgRNA로 변환되는지 확인합니다. 예를 들어, 2000 sgRNAs의 풀은 2 x 105 세포 또는 6-7 동물을 필요로합니다.
4. 심층 시퀀싱 절차
- 종양 형성 이나 다른 표현형과 같은 실험 적인 종점에 마우스를 희생 하 고 관심 있는 조직을 수확. 혈액 및 조직 DNA 추출 키트를 사용하여 제조업체의 프로토콜에 따라 유전체 DNA를 정화합니다. 종양에서 DNA 추출을 시작하기 전에 DNA 지우기로 작업 벤치를 청소하고 플라스미드가 처리되는 실험실 영역에서 멀리 작동합니다.
참고: 시간이 지남에 따라 sgRNA 접이식 변화를 계산할 수 있도록 참조 샘플을 생성하는 것이 중요합니다. 트랜스포밍된 배아는 3일 사후 감염 또는 트랜스포밍된 세포(2단계 6단계 참조)를 원래 라이브러리에서 sgRNA 표현을 결정하는 기준 샘플로 작용할 수 있다. - 표 1에 나열된 외부 프라이머와 표 2에설명된 PCR 프로그램을 사용하여 50 μL 사전 증폭 PCR 1 반응에서 100 ng – 1.5 μg 게놈 DNA를 템플릿으로 사용한다. 원하는 커버리지를 산출하기에 충분한 반응을 설정합니다.
참고: 실험실의 별도의 전용 영역또는 DNA 지우기에 의해 철저하게 청소되는 조직 배양 후드에 바코드 PCR 반응을 설정하여 오염을 방지합니다. 오염이 없는지 확인하기 위해 각 PCR 플레이트에 대해 물을 템플릿으로 사용하여 음수 제어를 실행합니다. - 모든 PCR 1 반응을 풀과 실행 20 μL 에 1.5% 제어 아가로즈 젤 600 bp 밴드의 성공적인 증폭을 확인.
- 테이블 3및 표 4에설명된 PCR 프로그램을 사용하여 PCR 2 반응의 50 μL에서 풀이 된 PCR1 반응의 5 μL을 템플릿으로 사용한다. PCR 2 반응의 50 μL을 2% 아가로즈 젤에 실행하고 제조업체 지침에 따라 젤 추출 키트를 사용하여 200bp 밴드를 정화합니다.
참고: 사전 증폭 단계는 복잡한 변형 된 조직의 증폭에만 필요합니다. 아마도 개발 된 단일 종양을 증폭하는 경우 클로날 세포를 형성하고 따라서 단지 단일 sgRNA를 포함하는 경우, 하나는 사전 증폭 PCR1을 건너 뛰고 PCR2로 바로 진행할 수 있습니다. - 불소 정량화를 사용하여 DNA 농도를 정량화하고 시퀀싱 시설에 깊은 시퀀싱을 위해 전송됩니다(예를 들어, 종양 당 1백만 개 읽기).
- Bowtie v1.2.3을 사용하여 정렬정렬만 허용하고 시퀀스 된 읽기를 sgRNA 라이브러리13에정렬하십시오. fasta 형식으로 sgRNA 시퀀스를 입력하는 나비 빌드 명령을 사용하여 나비 타이 인덱스를 만듭니다. 읽기 정렬 중에 최대 두 개의 불일치를 허용하고 둘 이상의 라이브러리 sgRNA 시퀀스를 정렬하는 읽기를 폐기하는 옵션 -m 2 -v 1을사용하여 읽기를 매핑합니다. 일반적으로 읽기의 80% 이상이 이러한 매개 변수 아래에 정렬됩니다.
- MAGeCK 카운트 명령을 사용하여 정렬된 파일을 입력14로사용하여 읽기 카운트 테이블을 가져옵니다. sgRNA 카운트 테이블은 차동 sgRNA(MAGeCK)를 결정하고 필수 유전자(BAGEL)를 찾는 것과 같은 다운스트림 분석에 사용될 수 있다.
결과
도 1A는 단일 12k 또는 92k 올리고 칩에서 비용 효율적인 방식으로 여러 사용자 정의 CRISPR 라이브러리를 멀티플렉싱하기 위한 올리고뉴클레오티드의 설계를 나타낸다. sgRNA(파란색 코드)를 선택하면 올리고뉴클레오티드는 제한 부위(주황색 BsmBI) 및 라이브러리 특정 PCR 프라이머 쌍(녹색 색 코딩)으로 설계되었습니다. 여러 라이브러리는 단일 올리고 칩에서 멀티플렉스를 위한 ...
토론
CRISPR/Cas9 게놈 편집은 유전자 기능 및 세포 과정을 조사하기 위하여 시험관 내 및 생체 내 연구 결과에서 널리 이용되었습니다. 대부분의 생체 내 연구는 CRISPR/Cas9 유전자 편집 세포를 동물 모델(동종 이식 또는 xenograft)으로 이식합니다. 이것은 암 유전학 및 세포 기능을 공부하는 강력한 도구이지만, 여전히 기본 조직 미세 환경이 부족하고 상처 및 / 또는 면역 반응을 유도 할 수 있습니다.
공개
저자는 공개 할 것이 없습니다.
감사의 말
이 작품은 캐나다 보건 연구소 (CIHR 365252), Krembil 재단 및 온타리오 연구 우수 라운드 8 (RE08-065)의 프로젝트 보조금에 의해 지원되었습니다. 삼패스 쿠마르 로가나단은 캐나다 암 학회 펠로우십(BC-F-16#31919)의 수혜자입니다.
자료
| Name | Company | Catalog Number | Comments |
| 0.45 micron filter | Sigma | S2HVU02RE | |
| 12k or 92k oligo chip | Customarray Inc. (Genscript) | ||
| 15 cm cell culture plates | Corning | ||
| 293FT | Invitrogen | R70007 | |
| 293NT | Systems Biosciences | LV900A-1 | |
| Alkaline phosphatase | NEB | M0290L | |
| Amplicillin | Fisher Scientific | BP1760-25 | |
| ATP | NEB | 9804S | |
| BsmBI | NEB | R0580L | |
| Chromic gut suture | Covidien | ||
| Deep sequencing (Next-Seq or Hi-Seq) | Illumina | ||
| DNA-cleanup kit | Zymo Research | D4008 | |
| DNAesy Blood and Tissue DNA extraction kit | Qiagen | 69506 | |
| Endura electrocompetent cells | Lucigen | 60242-1 | |
| Glass Capillaries | Drummond | 3-000-203-G/X | |
| HEK293T cells | ATCC | CRL-3216 | |
| High-Speed Centrifuge | Beckman Coulter | MLS-50 | |
| LB Agar | Wisent Technologies | 800-011-LG | |
| Micropipette puller | Sutter Instrument | P97 | |
| Mineral oil | Sigma | M5904 | |
| Mini-prep plasmid Kit | Frogga Bio | PDH300 | |
| Mouse oxygen anaesthesia system | Visual Sonics | ||
| Nanoject II micromanipulator | Drummond | ||
| NEBuffer 3.1 (Buffer for BsmBI) | NEB | R0580L | |
| Needle sharpener | Sutter Instrument | BV-10 | |
| Oligo cleanup kit | Zymo research | D4060 | |
| PAGE purified illumina sequencing primer | IDT DNA | ||
| PEI (polyethyleneimine) | Sigma | 408727-100ML | |
| Permoplast modeling clay | |||
| Petridish with central opening | Visual Sonics | ||
| pMD2.G | Addgene | 12259 | |
| psPAX2 | Addgene | 12260 | |
| Q5 Polymerase 2x Master mix | NEB | M0494L | |
| Qubit Fluorometric Quantification | Invitrogen | Q33327 | |
| Semicircular Silicone plug | Corning | ||
| Silicone membrane | Visual Sonics | ||
| T4 DNA ligase | NEB | M0202L | |
| Ultra-centrifuge tubes | Beckman Coulter | 344058 | |
| Vevo2000 ultrasound system | Visual Sonics |
참고문헌
- Beronja, S., Fuchs, E. RNAi-mediated gene function analysis in skin. Methods in Molecular Biology. 961, 351-361 (2013).
- Beronja, S., Livshits, G., Williams, S., Fuchs, E. Rapid functional dissection of genetic networks via tissue-specific transduction and RNAi in mouse embryos. Nature Medicine. 16, 821-827 (2010).
- Shalem, O., et al. Genome-scale CRISPR-Cas9 knockout screening in human cells. Science. 343, 84-87 (2014).
- Beronja, S., et al. RNAi screens in mice identify physiological regulators of oncogenic growth. Nature. 501, 185-190 (2013).
- Loganathan, S. K., et al. Rare driver mutations in head and neck squamous cell carcinomas converge on NOTCH signaling. Science. 367, 1264-1269 (2020).
- Leemans, C. R., Snijders, P. J. F., Brakenhoff, R. H. The molecular landscape of head and neck cancer. Nature Reviews Cancer. 18, 269-282 (2018).
- Green, A. C., Olsen, C. M. Cutaneous squamous cell carcinoma: an epidemiological review. British Journal of Dermatology. 177, 373-381 (2017).
- Campbell, J. D., et al. pathway network, and immunologic features distinguishing squamous carcinomas. Cell Reports. 23, 194-212 (2018).
- Sanjana, N. E., Shalem, O., Zhang, F. Improved vectors and genome-wide libraries for CRISPR screening. Nature Methods. 11, 783-784 (2014).
- Geraerts, M., Willems, S., Baekelandt, V., Debyser, Z., Gijsbers, R. Comparison of lentiviral vector titration methods. BMC Biotechnology. 6, 34 (2006).
- Schramek, D., et al. Direct in vivo RNAi screen unveils myosin IIa as a tumor suppressor of squamous cell carcinomas. Science. 343, 309-313 (2014).
- Platt, R. J., et al. CRISPR-Cas9 knockin mice for genome editing and cancer modeling. Cell. 159, 440-455 (2014).
- Langmead, B., Trapnell, C., Pop, M., Salzberg, S. L. Ultrafast and memory-efficient alignment of short DNA sequences to the human genome. Genome Biology. 10, 25 (2009).
- Li, W., et al. MAGeCK enables robust identification of essential genes from genome-scale CRISPR/Cas9 knockout screens. Genome Biology. 15, 554 (2014).
- Winters, I. P., Murray, C. W., Winslow, M. M. Towards quantitative and multiplexed in vivo functional cancer genomics. Nature Reviews Genetics. 19, 741-755 (2018).
- Rogers, Z. N., et al. Mapping the in vivo fitness landscape of lung adenocarcinoma tumor suppression in mice. Nature Genetics. 50, 483-486 (2018).
- Chow, R. D., et al. AAV-mediated direct in vivo CRISPR screen identifies functional suppressors in glioblastoma. Nature Neuroscience. 20, 1329-1341 (2017).
- Wang, G., et al. Mapping a functional cancer genome atlas of tumor suppressors in mouse liver using AAV-CRISPR–mediated direct in vivo screening. Science Advances. 4, 5508 (2018).
- Chan, K., Tong, A. H. Y., Brown, K. R., Mero, P., Moffat, J. Pooled CRISPR-based genetic screens in mammalian cells. Journal of Visualized Experiments. (151), e59780 (2019).
- Hart, T., et al. High-resolution CRISPR screens reveal fitness genes and genotype-specific cancer liabilities. Cell. 163, 1515-1526 (2015).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유