Method Article
Infección recurrente del tracto urinario por Escherichia coli desencadenada por la exposición de la vejiga de Gardnerella vaginalis en ratones
En este artículo
Resumen
Se demuestra un modelo de ratón de inoculación transuretral uropatógena de E. coli (UPEC) para establecer reservorios latentes de vejiga intracelular y posterior exposición vesical a G. vaginalis para inducir itunica urinaria RECURRENTE de UPEC. También se ha demostrado la enumeración de bacterias, la citología de orina y la fijación y procesamiento de la vejiga in situ para la microscopía electrónica de barrido.
Resumen
Las infecciones recurrentes del tracto urinario (ITR) causadas por Escherichia coli uropatógena (UPEC) son comunes y costosas. Artículos anteriores que describen modelos de ITU en ratones machos y hembras han ilustrado los procedimientos para la inoculación bacteriana y la enumeración en orina y tejidos. Durante una infección inicial de la vejiga en ratones C57BL/6, la UPEC establece reservorios latentes dentro de las células epiteliales de la vejiga que persisten después de la eliminación de la bacteriuria de la UPEC. Este modelo se basa en estos estudios para examinar la ITU causada por la aparición de UPEC desde el interior de los reservorios de vejiga latente. La bacteria urogenital Gardnerella vaginalis se utiliza como desencadenante de la ITU en este modelo porque está frecuentemente presente en los tractos urogenitales de las mujeres, especialmente en el contexto de la disbiosis vaginal que se ha asociado con la ITU. Además, también se describe un método para la fijación de la vejiga in situ seguido del análisis de microscopía electrónica de barrido (SEM) del tejido de la vejiga, con posible aplicación a otros estudios que involucren la vejiga.
Introducción
Las infecciones del tracto urinario (ITU) imponen una carga sanitaria significativa en todo el mundo, afectando la calidad de vida de millones de personas cada año, especialmente las mujeres1. La Escherichia coli uropatógena (UPEC) es la causa más frecuente de ITU1. Muchos pacientes (aproximadamente 20-30%) que desarrollan ITU experimentarán una ITU recurrente (ITU) dentro de los 6 meses a pesar de la eliminación mediada por antibióticos de la infección inicial2. Desafortunadamente, hasta el 5% de las mujeres premenopáusicas sufren de 3 o más rUTI cada año 3,4. Los episodios secuenciales de ITU pueden ser causados por la persistencia de la misma cepa UPEC del caso índice 5,6,7,8. Los datos de muestras humanas y modelos de ratón sugieren que la ITU de la misma cepa podría ser causada por UPEC que reside dentro de reservorios inactivos en la vejiga. En humanos, se detectaron UPEC en células epiteliales y biopsias vesicales de pacientes con ITU 9,10,11,12,13. Los estudios en ratones C57BL/6 han demostrado que algunas cepas de UPEC pueden establecer reservorios intracelulares quiescentes en la vejiga, detectados por microscopía de fluorescencia y por homogeneización y cultivo de tejido vesical, que se mantienen durante meses después de la resolución de la bacteriuria 14,15,16. El tratamiento de la vejiga con agentes que inducen la exfoliación del epitelio vesical (urotelio), por ejemplo, sulfato de protamina17 o quitosano18, desencadenan la aparición de UPEC de los reservorios para causar ITU. Estos datos sugieren que en las mujeres que albergan reservorios de UPEC de la vejiga de una infección previa, las exposiciones de la vejiga que conducen a la exfoliación urotelial pueden desencadenar la ITU.
Cada vez hay más pruebas de que la microbiota vaginal contribuye a la infección del tracto urinario19,20. Gardnerella vaginalis es un miembro frecuente de la microbiota vaginal y urinaria 21,22,23,24,25,26,27,28,29. En la vagina, la presencia de altos niveles de G. vaginalis se asocia con una disbiosis microbiana conocida como vaginosis bacteriana (VB), que afecta a ~ 30% de las mujeres 30,31,32. Las mujeres con VB tienen un mayor riesgo de experimentar ITU en comparación con las mujeres con una comunidad vaginal dominada por Lactobacillus 33,34,35,36,37. En modelos de ratón, G. vaginalis causa exfoliación epitelial tanto en la vagina38 como en la vejiga39. En ratones C57BL/6 que albergan reservorios de vejiga DE UPEC, dos exposiciones secuenciales de la vejiga a G. vaginalis, pero no a PBS, resultan en el resurgimiento de UPEC de reservorios para causar ITU de UPEC. La aparición se evidencia por la aparición de títulos de UPEC en orina de ratones que habían resuelto previamente la bacteriuria de UPEC y una posterior disminución de los títulos homogeneizados de vejiga de UPEC en sacrificio en comparación con los animales de control expuestos a PBS39. Curiosamente, no hay una colonización duradera por G. vaginalis en la vejiga. En la gran mayoría de los casos, dos exposiciones cortas, cada una con menos de 12 (h) de G. vaginalis viable en la orina, son suficientes para provocar la exfoliación urotelial y promover la ITU.
Este protocolo describe un modelo de ratón de rUTI causada por UPEC que reside en reservorios de vejiga intracelular, utilizando la inoculación vesical de G. vaginalis para desencadenar la recurrencia. El avance logrado por este modelo es que G. vaginalis es un desencadenante biológico clínicamente relevante de rUTI en comparación con los agentes químicos utilizados anteriormente. Además, la supervivencia relativamente corta de G. vaginalis en el tracto urinario del ratón permite examinar el impacto de las exposiciones microbianas transitorias en el urotelio, como podría ocurrir después de la actividad sexual. Además de delinear el modelo rUTI, este protocolo también describe métodos para la citología de orina y la fijación de la vejiga in situ y la obtención de imágenes del urotelio mediante microscopía electrónica de barrido (SEM).
Este protocolo de UPEC UTI recurrente inducida por G. vaginalis utiliza la cepa UPEC UTI89 que lleva un cassette de resistencia a la kanamicina (UTI89kanR)40. No todas las cepas de UPEC probadas fueron capaces de formar comunidades bacterianas intracelulares durante la etapa de infección aguda en ratones41 y aún no se sabe si todas las cepas de UPEC tienen la capacidad de formar reservorios intracelulares latentes. La formación del reservorio debe confirmarse antes del uso de otras cepas UPEC en el modelo. Este protocolo utiliza un aislado espontáneo de G. vaginalis resistente a la estreptomicina, JCP8151BSmR38. La inducción de rUTI por JCP8151BSmR requiere dos inoculaciones secuenciales de G. vaginalis , administradas con 12 h o 7 días (d) de diferencia39. Queda por determinar si otras cepas de G. vaginalis inducen o no la exfoliación y/o upec rUTI con este modelo. Es esencial usar cepas de UPEC y G. vaginalis con resistencia a los antibióticos conocida (como kanamicina o espectinomicina para UPEC y estreptomicina para G. vaginalis) porque se pueden agregar antibióticos a las placas de agar para prevenir el crecimiento de la microbiota endógena del ratón que de otro modo podría interferir con la enumeración de unidades formadoras de colonias (UFC) para monitorear la infección. Esto es especialmente importante para el cultivo de muestras de orina, porque la orina de ratón con frecuencia contiene otras bacterias que pueden crecer en exceso en las placas de cultivo sin antibióticos. El origen de estas bacterias endógenas en la orina de ratón es desconocido, pero probablemente refleja bacterias periuretrales y urogenitales recogidas durante la recolección de orina.
G. vaginalis es una bacteria anaeróbica facultativa y, por lo tanto, este protocolo describe el crecimiento de G. vaginalis JCP8151BSmR en una cámara anaeróbica. Si no se dispone de una cámara anaeróbica, se pueden utilizar otros métodos para mantener las condiciones de crecimiento anaeróbico (como una bolsa GasPak en un recipiente hermético). Alternativamente, algunas cepas de G. vaginalis (incluyendo JCP8151BSmR) crecerán en una incubadora estándar de cultivo de tejidos (5% co2). Así como el uso de cepas de G. vaginalis distintas de JCP8151BSmR requiere pruebas para garantizar que las bacterias se comporten de manera similar en este modelo, las condiciones de crecimiento cambiantes requieren la determinación empírica de duraciones ideales para el cultivo (en placas y en líquido) y la densidad óptica (OD) 600 equivalentes para lograr las concentraciones de inóculo viables deseadas. Además, no se sabe si las condiciones de crecimiento influyen en la patobiología de G. vaginalis.
Finalmente, al considerar si utilizar este modelo, los investigadores deben ser conscientes de que puede requerir un mayor número de animales por grupo que los modelos típicos de ratones UTI. Esto se debe en parte a que la inducción de rUTI requiere que los ratones resuelvan la bacteriuria UPEC causada por la infección inicial de la vejiga. Por lo tanto, cualquier ratón que no logre eliminar la bacteriuria (un fenotipo generalmente indicativo de infección renal en curso) no está incluido en la fase de ITU del protocolo. El número de ratones necesarios para impulsar estos estudios también está influenciado por la tasa de aparición "espontánea" de UPEC en la orina (12-14% en promedio). Finalmente, las diferentes cepas de ratón tienen diferentes propensiones a desarrollar bacteriuria crónica frente a la formación de reservorios intracelulares42,43. Si se utilizan cepas de ratón distintas de C57BL/6 en este modelo, debe confirmarse que los animales desarrollan reservorios intracelulares UPEC inactivos.
Protocolo
El Comité Institucional de Cuidado y Uso de Animales de la Universidad de Washington (IACUC) aprobó todas las infecciones y procedimientos de ratones como parte del protocolo número 20170081, que expiró el 06/09/2020, y 20-0031, que expira el 18/03/2023. El cuidado general de los animales fue consistente con la Guía para el Cuidado y Uso de Animales de Laboratorio del Consejo Nacional de Investigación y la Guía de Recursos de Cuidado Animal del USDA. Los procedimientos de eutanasia son consistentes con las Directrices AVMA para la Eutanasia de Animales: Edición 2020.

Figura 1. Esquema del modelo de ratón. El cronograma se resalta para reflejar las fases o procedimientos del modelo descrito en el protocolo. Fase 1 (naranja): Establecimiento de reservorios intracelulares de UPEC. Los ratones son inoculados transuretralmente con UPEC y las muestras de orina se recogen y monitorean para la eliminación de bacteriuria. Solo los ratones que eliminan la bacteriuria pasan a las fases posteriores. Fase 2 (verde): Exposición de la vejiga a G. vaginalis. Los ratones son inoculados transuretralmente con G. vaginalis dos veces. La duración del tiempo entre las dos exposiciones secuenciales es de 12 h (panel superior) o 1 semana (wk; panel inferior), dependiendo del análisis posterior deseado. Fase 3 (amarillo): UPEC rUTI. La orina se recolecta diariamente después de la exposición a G. vaginalis y se monitorea para detectar bacteriuria UPEC. Además, las vejigas y los riñones se pueden recolectar en el punto final experimental para medir los títulos de tejido UPEC. En el modelo de exposición a 1 semana, la aparición de UPEC inducida por G. vaginalis a partir de reservorios intracelulares y el posterior aclaramiento del tracto urinario también se reflejan en una disminución en los títulos de tejido vesical de UPEC (en comparación con los ratones expuestos a PBS, ver Figura 3D). Esta disminución en los títulos de vejiga no fue evidente en el modelo de exposición de 12 h, presumiblemente porque se requiere más tiempo para que ocurra suficiente emergencia y aclaramiento del reservorio para reducir significativamente los títulos de tejido. Procedimiento A: La citología de orina generalmente se realiza 1 dpi (o incluso antes) durante la Fase 1 para examinar la infección aguda por UPEC y durante la Fase 3 para evaluar el contenido de PMN en la orina, que se correlaciona con la aparición de UPEC. Las muestras de orina recolectadas en otros puntos de tiempo se pueden analizar de manera similar. Procedimiento B: La microscopía electrónica de barrido de la vejiga (SEM) para examinar la exfoliación urotelial se realiza típicamente en el modelo de 12 h a las 3 h después de la segunda exposición a G. vaginalis (15 h después de administrar la primera exposición en el momento 0). También se pueden evaluar otros puntos de tiempo, como 6-24 h después de la inoculación de UPEC como se muestra en la Fase 1. Haga clic aquí para ver una versión más grande de esta figura.
1. Establecer reservorios intracelulares quiescentes UPEC en ratones
- Prepare catéteres urinarios (consulte 44,45,46,47 para ver videos de este paso).
- Agujas de calibre 30 con una longitud de tubo de PE10 que se extiende desde la base de la aguja hasta varios mm más allá de la punta de la aguja. Tenga cuidado de no perforar el tubo con la punta de la aguja. Alternativamente, use cánulas intravenosas pediátricas46.
- Coloque los catéteres preparados en una placa de Petri y esterilice con luz UV durante al menos 30 minutos. Reemplace la tapa de la placa de Petri y asegúrela para su almacenamiento hasta que sea necesario.
- Preparar el inóculo de la UPEC (Día -3 a 0)
- Día -3: Streak UTI89kanR desde -80 °C de material congelador en una placa de agar Luria-Bertani (LB). Incubar la placa a 37 °C durante 18-24 h.
NOTA: No es necesario agregar kanamicina a los medios de crecimiento del inóculo porque la resistencia a la kanamicina está integrada de manera estable en UTI89kanR. - Día -2: Inocular 20 mL de caldo LB en un matraz estéril de 125 mL con una sola colonia de UTI89kanR. No utilice un matraz más pequeño porque este método de cultivo es importante para inducir la expresión del pilus UPEC tipo 1 que es necesario para la adhesión de la vejiga.
- Incubar estáticamente (sin agitar) a 37 °C durante 18-24 h. No agregue antibióticos al medio de crecimiento. Solo use colonias frescas en placas LB (18-24 h de antigüedad) para iniciar cultivos líquidos.
- Día -1: Subcultivo UTI89kanR eliminando 20 μL de cultivo (removiendo suavemente el matraz para resuspend las bacterias asentadas) y agregando a 20 mL de caldo LB fresco en un matraz estéril de 125 mL. Incubar como en el paso 2, excepto por una duración firme de 18 h. No agregue antibióticos al medio de crecimiento.
- Día 0: Transfiera todo el cultivo a un tubo de 50 ml y gire a 3200 × g en una centrífuga de mesa durante 10 minutos a las bacterias de pellets. Aspirar sobrenadante y resuspendir el pellet bacteriano en 10 mL de PBS.
- Agregue 100 μL de la suspensión bacteriana concentrada del paso 4 a 900 μL de PBS en una cubeta y determine la densidad óptica a 600 nm (OD600) utilizando un espectrofotómetro que ha sido borrado con PBS. Multiplique el valor del espectrofotómetro por 10 (para tener en cuenta la dilución) para determinar el OD600 de la suspensión (suspensión OD).
- Para lograr la concentración de inóculo deseada de 1 x 107 UFC en 50 μL, diluya (o concentre) la suspensión de UTI89kanR utilizando la siguiente ecuación, en la que elinóculo OD deseado es 0,35 (el valor puede variar para otras cepas de UPEC) e Y es el volumen de inóculo requerido (100 μL por ratón para permitir un extra para eliminar burbujas y llenar los catéteres):
X mL xsuspensión OD = Y mL x ODinóculo
Por ejemplo, si el valor desuspensión OD es 4.7 y se requieren 5 ml de inóculo:
X ml × 4,7 = 5 × 0,35
X = (5 × 0,35) / 4,7
X = 0,372 ml
Por lo tanto, agregue 372 μL de suspensión bacteriana para hacer 5 ml (volumen final) - Use una pipeta multicanal para hacer diluciones en serie 1:10 del inóculo a 10-6 en PBS estéril en una placa de 96 pocillos. Detecte cinco réplicas de 10 μL de las 6 diluciones en una placa LB y LB + kan, permita que las manchas se sequen e incuben a 37 ° C durante la noche. La placa LB sin antibióticos se utiliza para garantizar que el inóculo no esté contaminado por otro organismo (que aparecería como una morfología de colonia adicional no presente en la placa de selección de antibióticos kan). Ambos tipos de placas deben producir el mismo resultado.
NOTA: Las placas deben dejarse secar en la mesa de trabajo durante un día antes de su uso para que absorban el líquido chapado sin manchas que se fusionen. - Cuente el número total de colonias en todos los puntos de la dilución con colonias distinguibles y use el valor para calcular la dosis real de inóculo utilizada en cada experimento. No confíe simplemente en los valores de OD600 .
- Día -3: Streak UTI89kanR desde -80 °C de material congelador en una placa de agar Luria-Bertani (LB). Incubar la placa a 37 °C durante 18-24 h.
- Inocular UTI89kanR en las vejigas de ratones hembra anestesiados (Día 0)
NOTA: Las grabaciones de vídeo de este procedimiento se han publicado anteriormente44,46. Consulte estos documentos para obtener una descripción más completa. Consulte la sección 5 de este protocolo para obtener más detalles sobre el cateterismo de ratón.- Anestesiar ratones con inhalación de isoflurano de acuerdo con los métodos aprobados por la IACUC.
- Mientras espera que los ratones se anestesian, llene la jeringa de tuberculina con inóculo UTI89kanR y luego coloque un catéter preparado. Presione el émbolo para que vacíe el aire del catéter, luego aplique el catéter en lubricante quirúrgico estéril.
- Coloque el ratón sobre su espalda y confirme la anestesia apretando firmemente la alfombrilla del ratón y observando la ausencia de un reflejo o respuesta. Localice la vejiga (se siente como un guisante en la parte inferior del abdomen) entre los dedos índice de cada mano. Exprese la orina moviendo los dedos uno hacia el otro para aplicar una presión de compresión suave a la vejiga.
- Inserte el catéter a través de la uretra del ratón en la vejiga y entregue lentamente 50 μL de inóculo.
- Espere unos segundos y luego retire suavemente el catéter tirando hacia afuera. Devuelva el ratón a su jaula y monitoree hasta que se recupere de la anestesia.
- Repita los pasos 1.3.1 - 1.3.5 con ratones adicionales, cambiando el catéter entre cada jaula (5 ratones). Si se desea, se puede utilizar el mismo procedimiento para inocular a un grupo de control de ratones con PBS, por ejemplo, para mostrar que otra cepa de G. vaginalis provoca ITU (sobre el nivel espontáneo / de fondo).
2. Monitoreo del aclaramiento de bacteriuria UPEC (Días 1 a 28)
NOTA: El video del procedimiento de recolección de orina ha sido publicado previamente44.
- Recolectar orina (mínimo 10 μL) de todos los ratones por palpación vesical como se describe44 a 1 d después de la infección y semanalmente durante 4 semanas (7, 14, 21 y 28 d después de la infección). La orina debe cultivarse a las pocas horas de la recolección para controlar la infección por UPEC. Guarde la orina a 4 °C hasta que esté chapada. La orina también se puede utilizar para la citología (ver sección 4). Ocasionalmente, si la vejiga está muy inflamada, no se pueden obtener 10 μL de orina; en este caso, pbS se puede agregar hasta 10 μL, pero el título bacteriano en orina y las puntuaciones de citología deben ajustarse en consecuencia (por ejemplo, si solo se recolectan 5 μL de orina y se agregan 5 μL de PBS, multiplique los títulos y puntuaciones por 2).
- Con una pipeta multicanal, haga diluciones en serie 1:10 a 10-6 en PBS estéril en una placa de 96 pocillos. Utilice una pipeta multicanal P10 para detectar 10 μL de las 6 diluciones de la columna 1 en una orientación vertical en el borde izquierdo de una placa LB que contenga el marcador de selección de antibióticos correspondiente. Descarte los consejos.
- Repita el recubrimiento con las muestras restantes (columna 2, luego columna 3, etc.). Una sola placa puede acomodar 5 muestras una al lado de la otra. Esto produce una placa con una matriz de 5 × 6 puntos, con diluciones crecientes de arriba a abajo y un número de muestras crecientes de izquierda a derecha (Figura 2A).
- Deje que las manchas se sequen en la mesa de trabajo, luego incube a 37 ° C durante la noche. Al día siguiente, cuente el número de colonias en el punto menos diluido en el que las colonias son distintas (Figura 2B) y use este número para calcular ufc/ml:
# de colonias en un solo punto de orina × factor de dilución × 100 = UFC/ml de orina - Trazar los títulos de orina UTI89kanR utilizando un software de gráficos (Figura 2C). Identifique ratones que no tienen UTI89kanR detectable en la orina a 28 d (~ 65-80% de los ratones C57BL / 6). Estos ratones albergan reservorios intracelulares inactivos y se utilizan en la fase experimental posterior para examinar la inducción de la ITU recurrente. Aquellos con bacterias en la orina a 28 d no se incluyen en los pasos posteriores.
3. Exposiciones de la vejiga a G. vaginalis
- Asignar ratones a grupos de exposición (Día 29). El objetivo principal de este paso es evitar tener a todos los ratones con bacteriuria más prolongada juntos en el mismo grupo de exposición, ya que se desconoce si esto afecta la probabilidad de ITU.
- Utilizando los datos de CFU en orina (Figura 2D), clasifique a los ratones en función del punto de tiempo en el que la bacteriuria UTI89kanR ya no era detectable (Figura 2E).
- Aleatorizar los ratones de cada categoría en los grupos de inoculación de G. vaginalis o PBS; por ejemplo, la mitad de los ratones que se retiraron antes del día 7 contraen G. vaginalis y la mitad recibirá PBS; la mitad de los ratones que se retiraron entre los días 8 y 14 obtendrán G. vaginalis y la mitad obtendrá PBS, etc. (como en la Figura 2E).
- Preparar G. vaginalis inoculum (todos los pasos realizados en una cámara anaeróbica)
NOTA: Los tiempos ideales de incubación del cultivo varían entre las diferentes cepas de G. vaginalis, con algunas cepas entrando en la fase estacionaria e incluso comenzando a morir más rápidamente que otras. Esto es particularmente importante dado que G. vaginalis muerto (JCP8151B) no pudo desencadenar la ITU39. Por lo tanto, los tiempos de incubación deben determinarse empíricamente para una cepa dada antes de realizar experimentos en ratones. Se desconoce si otras/todas las cepas de G. vaginalis desencadenarán los mismos efectos en este modelo.- Streak G. vaginalis cepa de -80 °C de congelador en una placa NYCIII (sin antibióticos). Incubar la placa a 37 °C anaeróbicamente durante 24 h.
- En la cámara anaeróbica, inocular 5 ml de medios anaeróbicos NYCIII con un bucle de células de 1 μL (una sola colonia es insuficiente) de la placa NYCIII e incubar el cultivo estáticamente a 37 °C en condiciones anaeróbicas durante 18 h. No incluya antibióticos en el medio de crecimiento.
- Determine el OD600 del cultivo utilizando un espectrofotómetro.
- Centrifugar un volumen definido (X) de cultivo a 9600 × g durante 1 min y aspirar el medio. Calcule el volumen (Y) de PBS para volver a suspender el pellet para lograr el inóculo deseado OD para lograr 108 UFC en 50 μL utilizando la siguiente ecuación:
X mL × cultivoOD = Y mL × ODinóculo resolver para Y
Y = (X ml ×cultivo de OD) /inóculo de OD
NOTA: Elinóculo OD para JCP8151BSmR es 5, pero esto debe determinarse empíricamente para otras cepas de G. vaginalis . Por ejemplo, si gira 3 mL de un cultivo líquido nocturno JCP8151BSmR concultivo OD = 2.0: Y= (3 mL × 2.0) / 5.0; por lo tanto, resuspenda pellet en 1,2 ml pbS - Resuspend el pellet bacteriano en PBS a la concentración deseada. Diluir en serie y colocar en placa el inóculo (como se describe en el protocolo de recubrimiento de UFC anterior) para determinar la dosis real de inóculo que se ha utilizado en cada experimento. No confíe simplemente en los valores de OD.
- Centrifugar un volumen definido (X) de cultivo a 9600 × g durante 1 min y aspirar el medio. Calcule el volumen (Y) de PBS para volver a suspender el pellet para lograr el inóculo deseado OD para lograr 108 UFC en 50 μL utilizando la siguiente ecuación:
- En el día 29-31 después de la inoculación de UPEC, inocule ratones anestesiados con G. vaginalis o PBS como se describe en el paso 1.3 anterior. Un grupo de control de PBS es esencial, ya que el acto de cateterizar la vejiga podría inducir daño y exfoliación urotelial que podría provocar algún grado de resurgimiento del reservorio de UPEC. Por lo tanto, los ratones inoculados con PBS sirven como el control con el que se comparan los ratones inoculados por G. vaginalis.
NOTA: La determinación final de bacteriuria UPEC a 28 d requiere la incubación nocturna de la placa CFU. Por lo tanto, lo más temprano que se puede realizar este paso es 29 días después de la inoculación inicial de UPEC. Si es necesario, la exposición podría administrarse hasta el día 31. Los investigadores deben ser consistentes entre los experimentos. - Repita la preparación del inóculo para administrar una segunda inoculación de G. vaginalis (o control de PBS) en el punto de tiempo deseado, como 12 h o 1 semana después de la primera inoculación. Es necesaria una segunda exposición porque una sola inoculación con G. vaginalis no da lugar a una emergencia significativa de UPEC39.
4. Monitoreo de la ITU recurrente de upEC
- Recolectar orina de ratones en los puntos de tiempo deseados después de cada inoculación de G. vaginalis (se recomienda la post-inoculación de 1, 2 y 3 d).
- Diluir en serie y enchapar la orina en placas selectivas (por ejemplo, LB + kanamicina) para determinar UTI89kanR CFU / ml. Si se desea, las diluciones de orina también se pueden colocar en placas selectivas (por ejemplo, NYCIII + 1 mg / ml de estreptomicina) para determinar G. vaginalis UFC / ml. Sin embargo, G. vaginalis JCP8151BSmR se eliminó de la orina de la mayoría de los ratones a las 12 h 39. Por lo tanto, los puntos de tiempo más tempranos serían necesarios para detectar G. vaginalis en la mayoría de los ratones.
- En el punto final experimental (por ejemplo, 3 días después de la segunda inoculación de G. vaginalis), sacrifique a los ratones de acuerdo con los métodos aprobados (por ejemplo, dislocación cervical bajo anestesia isoflurano o inhalación de CO2) y recoja vejigas y riñones para la enumeración de UFC, como se describió anteriormente 44,46.
5. Citología de orina
NOTA: Este procedimiento se puede realizar en cualquier punto de tiempo en el que se desee la visualización de las células y / o bacterias presentes en la orina. Como se indica en la Figura 1, la citología de orina se realiza típicamente a 1 dpi (o incluso antes) durante la Fase 1 para examinar la infección aguda por UPEC y durante la Fase 3 para evaluar la presencia de células polimorfonucleares (PMN) en las orinas que muestran la emergencia de UPEC.
- Agregue 10 μL de orina a 90 μL de PBS en un cassette de citofunno con filtro y portaobjetos conectados. (El método más sencillo es utilizar el resto de las diluciones 1:10 de la placa de 96 pocillos utilizada para el cultivo de orina; estas muestras pueden utilizarse hasta 24 h después del cultivo de orina si se almacenan a 4 °C). Coloque los casetes en la citocentrífuga y gire a 600-800 x g durante 6 minutos con alta aceleración.
- Retire los portaobjetos y deje secar durante la noche. Al día siguiente, tinción con un kit de tinción hematológica (por ejemplo, Wright's, Giemsa, incluido el fijador) de acuerdo con el protocolo del fabricante.
- Analizar las diapositivas por microscopía de luz para detectar la presencia de PMN y células epiteliales. Si se desea, estos se pueden calificar utilizando una métrica de puntuación cualitativa basada en la abundancia de cada tipo de célula presente en cada campo de visión de alta potencia (por ejemplo, 0 = ninguno, 1 = pocos, 2 = moderado, 3 = robusto). Asegúrese de que el individuo que analiza las diapositivas esté cegado a los grupos experimentales para minimizar el sesgo potencial.
6. Obtención de imágenes de vejigas mediante microscopía electrónica de barrido
NOTA: Este procedimiento se puede realizar en cualquier punto de tiempo en el que se desee la visualización del urotelio. Como se indica en la Figura 1 (cuadros morados), las interacciones UPEC-uroteliales se visualizan mejor entre 6 h y 24 h después de la inoculación de UPEC durante la fase de formación del reservorio, y la exfoliación urotelial desencadenada por G. vaginalis se visualiza mejor entre 3 h y 12 h después de la segunda exposición a G. vaginalis .
- Fijación vesical in situ
- Prepare el fijador inmediatamente antes de la cosecha de la vejiga agregando glutaraldehído (2.5% final) y paraformaldehído (2% final) en tampón de cacodilato de sodio de 0.15 M con 2 mM de CaCl2 a pH 7.4. Use paraformaldehído y glutaraldehído de ampollas de vidrio recién abiertas, ya que ambos fijadores se oxidan con el tiempo en recipientes abiertos.
PRECAUCIÓN: El glutaraldehído es tóxico, irritante respiratorio y corrosivo; el paraformaldehído es inflamable, cancerígeno, irritante y una toxina reproductiva; El cacodilato de sodio es tóxico y cancerígeno. - Para hacer 50 ml de solución fijadora, agregue 6.25 ml de paraformaldehído al 16%, 2 ml de glutaraldehído al 50% y 16.75 ml de agua ultrapura a 25 ml de una solución de 0.3 M de cacofolato de sodio a pH 7.4 con 4 mM de CaCl2.
- Calentar el fijador preparado a 37 °C antes de administrarlo a las vejigas.
- Llene la jeringa de punta deslizante de tuberculina con fijador y coloque un catéter en el extremo, bisel frente a las marcas opuestas de la jeringa. Corte el exceso de tubo a 1-2 mm del extremo de la aguja, teniendo cuidado de no exponer la punta de la aguja. Mueva la jeringa para eliminar las burbujas y empuje el émbolo para que vacíe el aire y llene el catéter con fijador sobre un tubo de microcentrífuga para recoger cualquier fijador para su eliminación adecuada.
- Anestesiar y sacrificar al ratón utilizando un método aprobado (por ejemplo, dislocación cervical bajo anestesia). Coloque el ratón sobre la superficie de disección con las patas aseguradas (con bandas elásticas o pasadores). Abra el área pélvica del ratón con fórceps y un par de tijeras quirúrgicas para exponer la vejiga. Empuje con cuidado a un lado la grasa adyacente, pero deje la vejiga en su lugar.
- Sostenga la jeringa con la mano dominante con la aguja apuntando hacia abajo y el bisel de la aguja y las marcas de la jeringa mirando hacia afuera de usted. Sumerja la punta del catéter en lubricante estéril.
- Coloque la punta del catéter en la abertura uretral, manteniendo el barril de la jeringa colocado en un ángulo de 30-45 ° sobre el cuerpo del ratón.
- Aplique presión hacia abajo con un movimiento muy pequeño en el sentido de las agujas del reloj con la punta e inserte suavemente el catéter en la uretra. A medida que la punta del catéter entra en la uretra, gire la jeringa hacia la cola del ratón mientras continúa deslizando el catéter más hacia la uretra hasta que el barril de la jeringa esté paralelo a la superficie de trabajo. Todo el eje de la aguja del catéter (sin incluir la base) debe entrar en el ratón, colocando la punta del catéter dentro de la luz de la vejiga.
- Administre lentamente 50-80 μL de fijador, haciendo que la vejiga se infle como un globo. Mantenga el catéter en su lugar y levante la jeringa ligeramente, inclinando la punta hacia arriba.
- Con la otra mano, abra un hemostático y deslice una punta debajo de la aguja del catéter en la intersección de la uretra. Cierre parcialmente el hemostático hasta que haga contacto con la aguja.
- Deslice suavemente la aguja del catéter fuera de la vejiga mientras se sujeta y bloquea el hemostático por completo para evitar la pérdida del fijador.
- Agarre el hemostático para que quede paralelo a la superficie de trabajo con la vejiga apoyada en la parte superior. Levante suavemente y corte cuidadosamente debajo del hemostático (lado opuesto de la vejiga) para extraer la vejiga con el hemostático aún conectado.
- Coloque la vejiga y el hemostático conectado en un tubo Falcon que contenga fijador calentado. Asegúrese de que la vejiga esté completamente sumergida en el líquido y no presionada contra las paredes del tubo. Incubar a 4 °C durante 24 h.
- Prepare el fijador inmediatamente antes de la cosecha de la vejiga agregando glutaraldehído (2.5% final) y paraformaldehído (2% final) en tampón de cacodilato de sodio de 0.15 M con 2 mM de CaCl2 a pH 7.4. Use paraformaldehído y glutaraldehído de ampollas de vidrio recién abiertas, ya que ambos fijadores se oxidan con el tiempo en recipientes abiertos.
- Procesamiento de la vejiga e imágenes con microscopía electrónica de barrido (SEM)
- Se divide la vejiga en dos partes con una cuchilla de afeitar limpia de doble cara y se hace un segundo corte tangencial al hemostático para liberar la vejiga. Esto resulta en 2 "tazas" de media vejiga. Si existen almohadillas de grasa restantes en el exterior de la vejiga, retírelas suavemente.
- Enjuague la vejiga por la mitad tres veces (10 min cada una) en tampón de cacodilato de sodio (0.15 M, pH 7.4).
- Teñir el tejido con tetróxido de osmio al 1% en tampón de cacodilato de 0,15 M durante 1 h a temperatura ambiente. El osmio es sensible a la luz; por lo tanto, realice este paso con el recipiente de tinción envuelto en papel de aluminio para mantener un ambiente oscuro.
PRECAUCIÓN: El tetróxido de osmio es tóxico y corrosivo para la piel. Haga este paso en la campana de humos con guantes. - Enjuague la vejiga por la mitad tres veces (10 minutos cada una) en agua ultrapura. Durante estos pasos, el aceite osmicado se puede ver en algún momento en la superficie del agua. Aspire o elimine esto para evitar la contaminación durante los pasos de secado.
- Deshidratar los tejidos sumergiéndolos en una serie de etanol graduado (50, 70, 90, 100 y 100%) durante 10 min cada uno.
- Seque el tejido fijo con un secador de puntos críticos que realice12 intercambios de CO 2 a la velocidad más lenta. Establezca todos los ajustes adicionales en lento, excepto el paso de ventilación que está configurado en rápido.
- Vuelva a dividir cada mitad de la vejiga con una maquinilla de afeitar limpia de doble cara para generar 4 piezas en total para reducir la curvatura de la muestra para un recubrimiento más eficiente, para facilitar la obtención de imágenes en el SEM y para exponer el tejido que puede haberse curvado durante el secado.
- Adhiera las piezas de la vejiga a una pestaña adhesiva de carbono conductor en un talón de aluminio y pinte una pequeña cantidad de adhesivo plateado alrededor del contacto inferior con un palillo de dientes, teniendo cuidado de evitar que el exceso de adhesivo se absorba en la superficie interna de la vejiga.
- Use un recubridor de pulverización de alto vacío para recubrir los talones de muestra con 6 nm de iridio. Si las muestras continúan cargándose, asegúrese de pintar una trayectoria conductora a la superficie con pintura plateada y cubra con 4 nm adicionales de iridio.
- Tome imágenes de las muestras con un microscopio electrónico de barrido. Si bien las condiciones pueden variar según el microscopio utilizado, un voltaje de aceleración de 3 KeV con una corriente de haz de 200 pA y una distancia de trabajo de 12-13 mm funcionó bien en un Zeiss Merlin FE-SEM cuando se utilizó el detector de electrones Everhart-Thornley (SE2).
Resultados
Después de la inoculación, los títulos de UPEC son detectables en la orina (Figura 2B). La falta de placas de muestras de orina en medios selectivos que contengan kanamicina probablemente resultará en un crecimiento excesivo de la microbiota endógena del ratón que contamina la orina. El nivel de bacteriuria UPEC probablemente será alto el día 1 y puede aumentar durante la primera semana antes de disminuir en puntos de tiempo posteriores (Figura 2C). Aproximadamente el 65-80% de los ratones no tendrán UPEC detectable en la orina a 28 dpi (Figura 2C, círculo verde). Estos ratones se pueden utilizar en los pasos posteriores del modelo. Los ratones que permanecen bacteriúricos (Figura 2C, elipse roja) deben ser eliminados del experimento.
Dos exposiciones secuenciales a G. vaginalis administradas a 12 h (Figura 3A) o 1 semana de distancia (Figura 3B) dan como resultado la aparición de UPEC a partir de reservorios intracelulares para causar bacteriuria recurrente. Tanto el nivel de bacteriuria UPEC (prueba de Mann-Whitney) como la fracción de ratones que muestran UPEC rUTI (prueba exacta de Fisher) son significativamente más altos en ratones expuestos a G. vaginalis en comparación con el grupo de control de PBS. El análisis de citología de orina detecta PMN en orina de ratones expuestos a G. vaginalis que mostraron emergencia de UPEC (Figura 3C). En el modelo con dos exposiciones dadas a 1 semana de diferencia, los títulos de UPEC en el tejido de la vejiga son más bajos en ratones expuestos a G. vaginalis en comparación con PBS (Figura 3D), presumiblemente debido a la aparición de UPEC a partir de reservorios y el aclaramiento posterior.
La visualización del tejido vesical fijo in situ por SEM revela grandes células uroteliales paraguas superficiales que recubren la superficie de la vejiga en ratones de control expuestos solo a PBS (Figura 4A). La exfoliación urotelial se evidencia por una pérdida de células paraguas superficiales, revelando células epiteliales de transición subyacentes más pequeñas en ratones expuestos a G. vaginalis (Figura 4B). Temprano después de la inoculación de UPEC durante el establecimiento de reservorios intracelulares, los UPEC son visibles en el urotelio y el filamento de las células exfoliantes (Figura 4C).
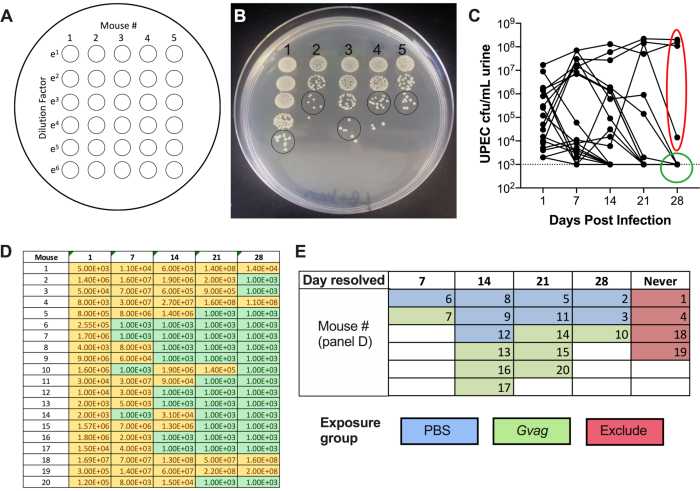
Figura 2. Monitoreo de títulos de UPEC en orina durante la Fase 1 (formación de reservorios). (A) Esquema de recubrimiento de unidades formadoras de colonias (UFC). (B) Imagen representativa de los títulos de UPEC en orina en LB+kanamicina. Los círculos negros indican manchas de muestra de orina que deben contarse para calcular la UFC/ml. (C) Curso temporal de la bacteriuria UPEC en ratones C57BL/6. Cada línea representa un ratón individual, trazando los títulos de orina UPEC a lo largo del tiempo. La línea punteada indica el límite de detección (1000 UFC/ml). La elipse roja indica cuatro ratones (de 20) que no lograron resolver la bacteriuria UPEC y, por lo tanto, no se utilizarían para el modelo de ITU inducida por G. vaginalis. Por el contrario, el círculo verde indica ratones que resolvieron la bacteriuria UPEC y procedieron a las fases posteriores. D) Tabla de datos utilizados para generar el gráfico en el panel C. Ufc amarilla detectable; verde, sin UFC. (E) Aleatorización de ratones en grupos de exposición basados en el punto de tiempo en el que la UFC UPEC ya no se detectó en la orina ("Día resuelto"). Los números del mouse en la columna izquierda del panel D son los mismos números del mouse que se indican en el panel E. Haga clic aquí para ver una versión más grande de esta figura.
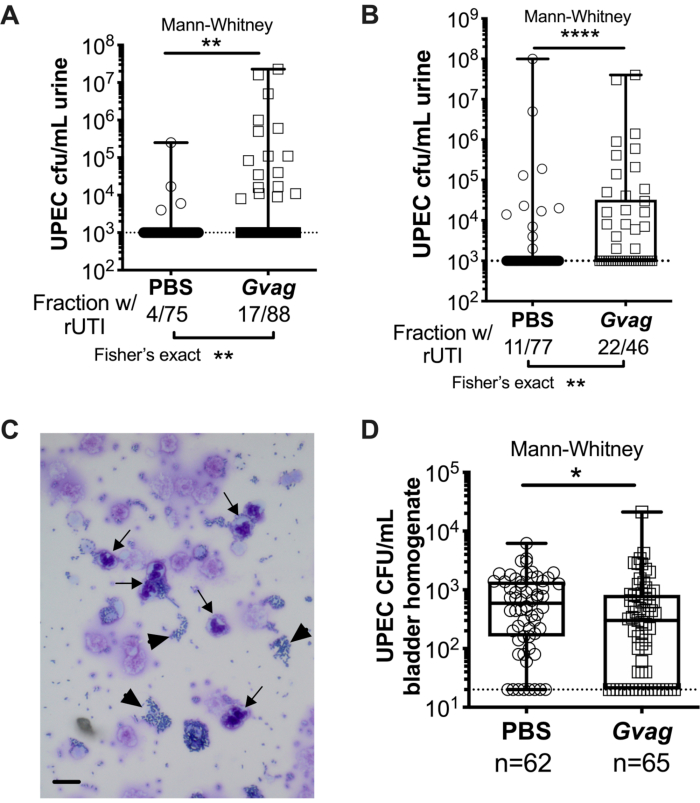
Figura 3. G. vaginalis desencadena UPEC rUTI. Títulos de UPEC en la orina después de dos exposiciones secuenciales del tracto urinario a PBS (círculos) o G. vaginalis (Gvag; cuadrados) administradas con 12 h (A) o 1 semana (B) de diferencia. Cada símbolo representa un ratón individual. Se trazan los UPEC de UFC/ml más altos detectados en cada ratón entre 1-3 d después de la segunda exposición. Los ratones sin bacteriuria detectable se trazan en el límite de detección (línea punteada). (C) Análisis de citología de orina que muestra células UPEC (puntas de flecha) y polimorfonucleares (PMN) (flechas). Barra de escala = 20 μm. (D) Títulos de UPEC en tejidos de la vejiga recogidos 3 d después de dos exposiciones secuenciales del tracto urinario administradas a 1 semana de diferencia. Cada símbolo representa un ratón diferente y los ceros se trazan en el límite de detección (línea punteada). En A, B y D, las cajas están en el primer y tercer cuartil con la mediana marcada y los bigotes de min a max. Mann-Whitney U tests * P < 0.05; ** P < 0,01; P < 0,0001. Haga clic aquí para ver una versión más grande de esta figura.
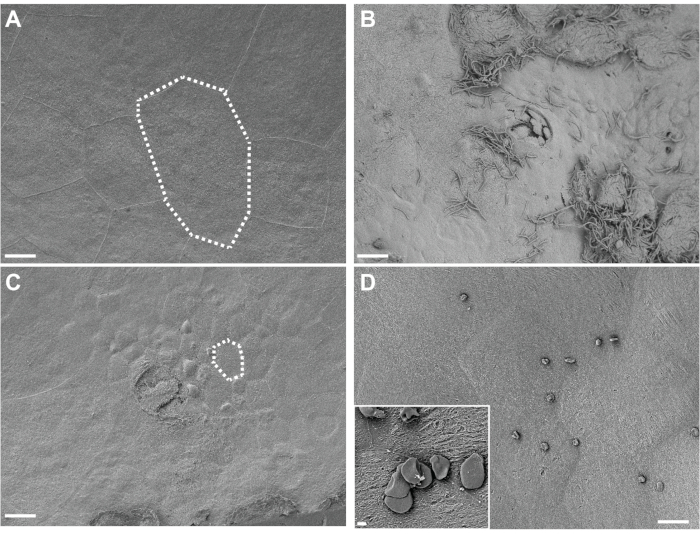
Figura 4. Análisis SEM de vejigas fijadas in situ. Las vejigas se recogieron de ratones 3 h después de dos exposiciones (12 h de diferencia) a PBS (A) o G. vaginalis (C). Las líneas punteadas ilustran una sola célula epitelial urinaria, que es más pequeña en las vejigas expuestas a G. vaginalis porque las grandes células superficiales se han exfoliado revelando el epitelio de transición subyacente. (B) Vejiga recogida 6 h después de la inoculación inicial con UPEC, durante la Fase 1 del modelo, mostrando exfoliación urotelial y UPEC extracelular. (D) Ejemplo de gotas de grasa insolubles presentes en la superficie de la vejiga. Las barras de escala son de 20 μm en las imágenes principales y 2 μm en el recuadro. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
El primer paso crítico en este modelo para identificar ratones que no han eliminado la bacteriuria UPEC durante la fase primaria de ITU. Estos ratones deben ser retirados del experimento, ya que de lo contrario confundirían las tasas de bacteriuria UPEC después de la exposición a G. vaginalis. Después de la inoculación inicial de UPEC, la orina debe recolectarse semanalmente para monitorear el aclaramiento bacteriano. Aproximadamente el 65-80% de los ratones C57BL / 6 eliminarán una infección por UTI89kanR dentro de las 4 semanas. Otras cepas de ratones endogámicos tienen diferentes propensiones para el aclaramiento de UPEC42,43 y la formación de reservorios y, por lo tanto, pueden no ser adecuadas para este modelo. El segundo punto crítico es que los estudios empíricos han determinado que dos inoculaciones secuenciales de G. vaginalis (ya sea a 12 h o 1 semana de distancia) son necesarias para desencadenar una aparición significativa de reservorios por encima de la emergencia espontánea de fondo que ocurre en ratones de control expuestos solo a PBS. No se han probado otras duraciones de tiempo entre las dos exposiciones secuenciales, pero podrían arrojar resultados similares. Es importante tener en cuenta que solo se observó una reducción en los títulos de vejiga de UPEC en el modelo en el que las exposiciones a G. vaginalis se administraron a 1 semana de diferencia39. Si bien se pueden administrar más de dos exposiciones, la evidencia empírica sugiere que el cateterismo repetido por sí solo aumenta la emergencia, lo que puede confundir la interpretación de los resultados o requerir un mayor número de animales para distinguir las diferencias entre los grupos de exposición y los controles. Finalmente, el método de fijación de la vejiga in situ tiene varios pasos críticos. Se requiere cierta habilidad para garantizar que el fijador permanezca dentro de las vejigas sujetas. Las vejigas desinfladas serán más difíciles de visualizar por SEM. También es esencial ser muy suave al inocular el fijador en la vejiga, ya que raspar el urotelio con el catéter que contiene fijador puede inducir la exfoliación urotelial independientemente de lo que desencadena G. vaginalis. Todas las concentraciones mencionadas en el cóctel fijador son concentraciones finales. Las proporciones inadecuadas de estos pueden resultar en una fijación insuficiente e hinchazón o contracción de las células. Los fijadores deben calentarse a temperaturas fisiológicas para evitar el choque de temperatura en las células y los tejidos. El calentamiento también proporciona una ligera mejora en la tasa de difusión de los fijadores a través de las membranas plasmáticas. Si bien la tinción de osmio a menudo se puede omitir para muestras preparadas para el análisis SEM, es un paso esencial en este protocolo para estabilizar los lípidos y prevenir el agrietamiento de las membranas celulares durante el secado en puntos críticos.
Este protocolo puede modificarse para probar otras cepas UPEC y/o G. vaginalis por su capacidad para formar reservorios y desencadenar su aparición, respectivamente. También se pueden agregar otros factores experimentales, como la exposición a otras bacterias vaginales (por ejemplo, Lactobacillus crispatus PVAS100) o G. vaginalis muerta por calor, ninguno de los cuales demuestra patología en este modelo39. Al seleccionar otras cepas bacterianas para probar, es importante demostrar un crecimiento consistente de tal manera que se pueda usar una concentración estándar de inóculo en todos los experimentos. El crecimiento de JCP8151BSmR se ha optimizado en una cámara anaeróbica. Esta cepa probablemente podría cultivarse en un sistema gaspak anaeróbico, pero esto requeriría optimización para garantizar un crecimiento bacteriano robusto. Finalmente, puede ser posible modificar el tiempo de ciertos pasos en el modelo. Por ejemplo, la orina se puede recolectar en puntos de tiempo más tempranos durante la fase de formación del reservorio DE UPEC para monitorear las respuestas de la UFC o del huésped. En este modelo no se ha observado un efecto adverso de la recolección de muestras de orina en puntos de tiempo tempranos (3, 6, 12 hpi) sobre la progresión de la infección o el establecimiento de reservorios. Se ha informado que la aparición de reservorios de UPEC ocurre después de dos dosis de JCP8151BSmR administradas a 12 h o 1 semana, pero aún no se han probado otros intervalos de tiempo. También puede ser posible reducir la duración total del modelo reduciendo la fase de formación del reservorio UPEC a 2 semanas (en lugar de 4 semanas), ya que muchos de los ratones eliminan la bacteriuria en este momento. Estudios previos que examinaron la aparición de UPEC después de la exposición de la vejiga a exfoliantes químicos utilizaron una fase17,18 de formación de reservorios de UPEC de 1 o 2 semanas. Sin embargo, la disminución de la cantidad de tiempo para la eliminación de la bacteriuria UPEC puede tener el costo de requerir que más animales sean sacrificados del experimento. Finalmente, el análisis SEM de la vejiga se puede realizar en puntos de tiempo adicionales para observar la duración del efecto de G. vaginalis en el urotelio.
Con respecto a la solución de problemas, hay algunas consideraciones importantes específicamente con respecto al análisis SEM de la vejiga. Dependiendo del fondo de ratón utilizado y la cantidad de inflamación presente, algunas vejigas se presentarán con paredes muy delgadas. Estas vejigas tienden a curvarse más durante el secado de puntos críticos y pueden dar lugar a una forma de concha de cowrie. Si esto ocurre, el mejor método es cortar la vejiga en forma de concha por la mitad a lo largo de la interfaz rizada y luego una segunda vez para eliminar la mayor parte del tejido colgante. El corte funciona mejor con una cuchilla de afeitar de doble filo recubierta de PTFE. El exceso de grasa a veces puede solubilizarse durante los pasos de tinción de osmio. Esto puede resultar en gotas de grasa insolubles no deseadas que pueden no lavarse durante los pasos de enjuague y deshidratación y que pueden asentarse en la superficie de la vejiga durante el secado posterior. Estas gotas pueden aparecer como pequeñas esferas o estructuras en forma de disco dispersas sobre la muestra (Figura 4D). Esto se puede mitigar asegurando que se elimine la mayor cantidad posible de tejido adiposo de alrededor de la vejiga. El platino puede ser sustituido por el recubrimiento de iridio, pero los espesores deben mantenerse al mínimo para reducir el enmascaramiento de los detalles estructurales finos. El uso de una etapa giratoria durante el recubrimiento es muy recomendable.
Una limitación de este modelo es que requiere un gran número de ratones. Solo el 65-80% de los ratones C57BL/6 eliminarán su bacteriuria UPEC y serán adecuados para la posterior inoculación de G. vaginalis o PBS (ver Figura 2C). Para obtener 10-12 ratones por grupo (inoculación de G. vaginalis vs. PBS), ~ 30 ratones deben estar infectados inicialmente con UPEC. Además, es probable que se requieran múltiples experimentos para lograr las réplicas biológicas necesarias para detectar la significación estadística. Cuando las exposiciones se administraron a 1 semana de diferencia, la emergencia de UPEC ocurrió en el 14% de los ratones expuestos a PBS (Figura 3B). Por lo tanto, la detección de un aumento significativo en upEC rUTI en ratones expuestos a G. vaginalis en relación con los controles de PBS (con una potencia de 0,8; alfa = 0,05 [un lado]) requiere probar un total acumulativo de al menos 40 ratones para cada grupo de exposición. Una consideración adicional es que estos experimentos son costosos y requieren mucha mano de obra. Los ratones deben ser monitoreados semanalmente para el aclaramiento de UPEC y el curso de tiempo experimental es de 4-5 semanas, dependiendo de si G. vaginalis se administra dos veces en un período de tiempo de 12 h o dos veces a 1 semana de distancia. SEM requiere mucha mano de obra y puede ser costoso, dependiendo de la disponibilidad del microscopio y los cargos por servicio. Preparar toda la vejiga para SEM proporciona abundante material para el análisis, pero el inconveniente es que analizar cada vejiga puede llevar mucho tiempo. Por lo tanto, es probable que solo un número limitado de vejigas pueda ser analizado por SEM en comparación con el mayor número de animales utilizados para los títulos de orina y tejido. Además, la obtención de imágenes de alta calidad de las superficies curvas de las "copas" de la vejiga requiere habilidad debido a las sombras que pueden impedir la visibilidad. Aunque el SEM de la vejiga es una herramienta útil para visualizar la exfoliación urotelial, este método es en gran medida cualitativo. Debido a que la muestra se fija en forma redonda, y debido al uso de glutaraldehído en el fijador, no es posible detectar bacterias que expresan fluorescentemente a través de microscopía de luz. La inmunotinción y los colorantes químicos son incompatibles con este proceso debido al uso de glutaraldehído que entrecruzará la mayoría de los antígenos y el osmio y que enmascarará los sitios de antígenos y oscurecerá el tejido. Dicho esto, la técnica SEM es útil para parámetros que pueden evaluarse cuantitativamente sin el uso de sondas adicionales, como el tamaño celular48,49.
Este modelo ofrece varias ventajas más allá de los métodos descritos anteriormente. Permite el examen de los mecanismos de UPEC rUTI causados por la emergencia de reservorios de la vejiga, en lugar de la reintroducción en la vejiga desde una fuente externa. Otros modelos de ITU debido a la aparición de reservorios vesicales utilizan agentes químicos (sulfato de protamina o quitosano) para causar exfoliación urotelial17,18, que no sería desencadenante de RUTI en mujeres. G. vaginalis es una bacteria urogenital prevalente que se ha detectado en la orina recogida directamente de la vejiga mediante cateterismo o aspiración suprapúbica en algunas mujeres23,26. Este hecho, junto con la asociación conocida entre la VB (en la que G. vaginalis crece demasiado en la vagina) y la ITU, sugiere que G. vaginalis es un desencadenante clínicamente plausible de la ITR. Finalmente, el método de fijación de la vejiga in situ preserva la ultraestructura de la vejiga y limita el daño, asegurando que las capas de la vejiga no se separen entre sí. Los métodos anteriores para visualizar el urotelio tradicionalmente hacen que el usuario recolecte asépticamente, biseque, estire y fije la vejiga en una bandeja de disección antes de sumergir la vejiga estirada en el fijador48. Este método da como resultado una muestra muy plana, pero no garantiza un estiramiento uniforme o natural del tejido y puede dar como resultado áreas que están demasiado y por debajo del estiramiento (lo que resulta en tejido altamente arrugado) y puede causar la separación de la capa de la vejiga. Además, estas manipulaciones físicas de la vejiga para estirar y fijar el tejido pueden causar daño, incluida la exfoliación urotelial. Otro método es sumergir las vejigas intactas en fijador antes de incrustarlas en parafina y adquirir secciones delgadas con un microtomo. Las secciones delgadas son invaluables para los experimentos de inmunohistoquímica para examinar la localización de bacterias y proteínas del huésped, pero una sección delgada no permite la visualización de la superficie urotelial. Este método SEM permite examinar la superficie de toda la vejiga a la vez.
Como se describe, las aplicaciones futuras de este modelo incluyen probar otras cepas de UPEC para determinar si forman reservorios intracelulares y probar otras cepas de G. vaginalis para evaluar si provocan la exfoliación y la aparición de UPEC para causar rUTI. También se pueden probar otras cepas de ratón más allá de los ratones C57BL / 6, aunque no se recomiendan ratones con una alta propensión a desarrollar cistitis crónica (como los ratones en el fondo C3H), ya que sería necesario seleccionar demasiados ratones del experimento. Una ventaja adicional de los ratones C57BL / 6 es que muchas cepas genéticas knockout están disponibles comercialmente. Tales cepas brindan una oportunidad para interrogar los factores del huésped involucrados en la formación y / o emergencia del reservorio.
Divulgaciones
Los autores declaran que no tienen conflictos de intereses relacionados con este estudio.
Agradecimientos
Los autores agradecen a Lynne Foster por la asistencia técnica en experimentos de infección, a James Fitzpatrick en el Centro de Imágenes Celulares de la Universidad de Washington (WUCCI) por el acceso al SEM, a Scott Hultgren por la cepa UTI89kanR UPEC y a David Hunstad por la lectura crítica del manuscrito.
Este trabajo fue apoyado por la National Science Foundation (Graduate Research Fellowship to VPO#DGE - 1143954), por el Center for Women's Infectious Disease Research de la Facultad de Medicina de la Universidad de Washington (Pilot Research Award to NMG), por la American Heart Association: #12POST12050583 (NMG) and #14POST20020011 (NMG), y por los Institutos Nacionales de Salud, NIAID: R01 AI114635 (ALL) y NIDDK: R21 DK092586 (ALL), P50 DK064540-11 (SJH, proyecto II PI:ALL) y K01 DK110225-01A1 (NMG). Algunos de los estudios en animales se realizaron en una instalación apoyada por la subvención C06 RR015502 del NCRR. El Centro de Imágenes Celulares de la Universidad de Washington (WUCCI; donde se realizó SEM) y MSJ fueron apoyados por la Escuela de Medicina de la Universidad de Washington, el Instituto de Descubrimiento De Niños de la Universidad de Washington y el Hospital de Niños de St. Louis (CDI-CORE-2015-505), la Fundación para el Hospital Barnes-Jewish (3770) y el Instituto Nacional de Trastornos Neurológicos y Accidentes Cerebrovasculares (NS086741). Los financiadores no tuvieron ningún papel en el diseño del estudio, la recopilación y el análisis de datos, la decisión de publicar o la preparación del manuscrito.
Materiales
| Name | Company | Catalog Number | Comments |
| 30G x 1/2 needles | BD | 305106 | for catheters |
| 5 1/2" straight forcep hemostat | McKesson | 487377 | in situ bladder fixation |
| ACE 600 Sputter coater | Leica | SEM sample processing | |
| aluminum SEM stub | Ted Pella | 16111 | SEM sample processing |
| Calcium chloride | EMS | 12340 | in situ bladder fixation |
| conductive carbon adhesive tab | Ted Pella | 16084-1 | SEM sample processing |
| Conductive silver paint | Ted Pella | 16034 | SEM sample processing |
| CPD 300 Critical Point Drier | Leica | SEM sample processing | |
| Cytofunnel metal clip | Simport | M964B | cytospun urinalysis |
| Ethanol | EMS | 15050 | SEM sample processing |
| Glucose | Sigma | G7528 | for NYCIII G. vaginalis growth media |
| glutaraldehyde | EMS | 16320 | in situ bladder fixation |
| Hema 3 staining kit | Fisher | 23123869 | cytospun urinalysis |
| HEPES | Cellgro | 25-060-Cl | for NYCIII G. vaginalis growth media |
| iridium | Ted Pella | 91120 | SEM sample processing |
| isofluorane | mouse anaesthesia | ||
| kanamycin | Gibco | 11815024 | add to UPEC LB selective plates (50 ug/mL) |
| Luria-Bertani agar | BD | DF0445174 | UPEC growth plates |
| Luria-Bertani broth | BD | DF0446173 | UPEC growth media |
| Merlin FE-SEM | Zeiss | scanning electron microscope | |
| Milli-Q Water Purifier | Millipore | IQ-7000 | SEM sample processing |
| NaCl | Sigma | S3014 | for NYCIII G. vaginalis growth media |
| Olympus Vanox AHBT3 microscope | Olympus | cytospun urinalysis | |
| osmium tetroxide | EMS | 19170 | SEM sample processing |
| paraformaldehyde | EMS | 15710 | in situ bladder fixation |
| polyethylene tubing | Intramedic | 427401 | for catheters |
| Proteose Peptone #3 | Fisher | DF-122-17-4 | for NYCIII G. vaginalis growth media |
| PTFE coated double edge razor blade | EMS | 72000 | cutting bladders for SEM |
| Shandon Cytocentrifuge | Thermo Scientific | A78300002 | cytospun urinalysis |
| Shandon cytofunnel filter | Simport | M965FWDV | cytospun urinalysis |
| Shandon Double cytofunnel | Simport | M964-1D | cytospun urinalysis |
| Shandon double cytoslides (coated) | Thermo Scientific | 5991055 | cytospun urinalysis |
| sodium cacodylate trihydrate | EMS | 12310 | in situ bladder fixation |
| spectrophotometer | BioChrom | 80-3000-45 | measuring bacterial OD600 |
| streptomycin | Gibco | 11860038 | add to G. vaginalis NYCIII selective plates (1 mg/mL) |
| tuberculin slip tip syringe | BD | 309659 | for catheters |
| Yeast Extract | Fisher | DF0127-17-9 | for NYCIII G. vaginalis growth media |
Referencias
- Foxman, B. Urinary tract infection syndromes: occurrence, recurrence, bacteriology, risk factors, and disease burden. Infectious Disease Clinics of North America. 28 (1), 1-13 (2014).
- Foxman, B. Recurring urinary tract infection: incidence and risk factors. American Journal of Public Health. 80 (3), 331-333 (1990).
- Foxman, B. Epidemiology of urinary tract infections: incidence, morbidity, and economic costs. American Journal of Medicine. 113, 5-13 (2002).
- Foxman, B. The epidemiology of urinary tract infection. Nature Reviews Urology. 7 (12), 653-660 (2010).
- Ikaheimo, R., et al. Recurrence of urinary tract infection in a primary care setting: analysis of a 1-year follow-up of 179 women. Clinical Infectious Diseases. 22 (1), 91-99 (1996).
- Russo, T. A., Stapleton, A., Wenderoth, S., Hooton, T. M., Stamm, W. E. Chromosomal restriction fragment length polymorphism analysis of Escherichia coli strains causing recurrent urinary tract infections in young women. Journal of Infectious Diseases. 172 (2), 440-445 (1995).
- Luo, Y., et al. Similarity and divergence of phylogenies, antimicrobial susceptibilities, and virulence factor profiles of Escherichia coli isolates causing recurrent urinary tract infections that persist or result from reinfection. Journal of Clinical Microbiology. 50 (12), 4002-4007 (2012).
- Schreiber, H. L. t., et al. Bacterial virulence phenotypes of Escherichia coli and host susceptibility determine risk for urinary tract infections. Science Translational Medicine. 9 (382), (2017).
- Rosen, D. A., Hooton, T. M., Stamm, W. E., Humphrey, P. A., Hultgren, S. J. Detection of intracellular bacterial communities in human urinary tract infection. PLoS Med. 4 (12), 329 (2007).
- Elliott, T. S., Reed, L., Slack, R. C., Bishop, M. C. Bacteriology and ultrastructure of the bladder in patients with urinary tract infections. Journal of Infection. 11 (3), 191-199 (1985).
- Robino, L., et al. Detection of intracellular bacterial communities in a child with Escherichia coli recurrent urinary tract infections. Pathogens and Disease. 68 (3), 78-81 (2013).
- Robino, L., et al. Intracellular bacteria in the pathogenesis of Escherichia coli urinary tract infection in children. Clinical Infectious Diseases. 59 (11), 158-164 (2014).
- De Nisco, N. J., et al. Direct Detection of Tissue-Resident Bacteria and Chronic Inflammation in the Bladder Wall of Postmenopausal Women with Recurrent Urinary Tract Infection. Journal of Molecular Biology. 431 (21), 4368-4379 (2019).
- Mulvey, M. A., Schilling, J. D., Hultgren, S. J. Establishment of a persistent Escherichia coli reservoir during the acute phase of a bladder infection. Infection and Immunity. 69 (7), 4572-4579 (2001).
- Kerrn, M. B., Struve, C., Blom, J., Frimodt-Moller, N., Krogfelt, K. A. Intracellular persistence of Escherichia coli in urinary bladders from mecillinam-treated mice. Journal of Antimicrobial Chemotherapy. 55 (3), 383-386 (2005).
- Eto, D. S., Sundsbak, J. L., Mulvey, M. A. Actin-gated intracellular growth and resurgence of uropathogenic Escherichia coli. Cellular Microbiology. 8 (4), 704-717 (2006).
- Mysorekar, I. U., Hultgren, S. J. Mechanisms of uropathogenic Escherichia coli persistence and eradication from the urinary tract. Proceedings of the National Academy of Sciences of the United States of America. 103 (38), 14170-14175 (2006).
- Blango, M. G., Ott, E. M., Erman, A., Veranic, P., Mulvey, M. A. Forced resurgence and targeting of intracellular uropathogenic Escherichia coli reservoirs. PLoS One. 9 (3), 93327 (2014).
- Gilbert, N. M., Lewis, A. L. Covert pathogenesis: Transient exposures to microbes as triggers of disease. PLoS Pathogens. 15 (3), 1007586 (2019).
- Lewis, A. L., Gilbert, N. M. Roles of the vagina and the vaginal microbiota in urinary tract infection: evidence from clinical correlations and experimental models. GMS Infectious Diseases. 8, (2020).
- Janulaitiene, M., et al. Prevalence and distribution of Gardnerella vaginalis subgroups in women with and without bacterial vaginosis. BMC Infectious Diseases. 17 (1), 394 (2017).
- Fredricks, D. N. Molecular methods to describe the spectrum and dynamics of the vaginal microbiota. Anaerobe. 17 (4), 191-195 (2011).
- Hilt, E. E., et al. Urine is not sterile: use of enhanced urine culture techniques to detect resident bacterial flora in the adult female bladder. Journal of Clinical Microbiology. 52 (3), 871-876 (2014).
- Klein, S., et al. Significant increase in cultivation of Gardnerella vaginalis, Alloscardovia omnicolens, Actinotignum schaalii, and Actinomyces spp. in urine samples with total laboratory automation. European Journal of Clinical Microbiology Infect Dis. 37 (7), 1305-1311 (2018).
- Pearce, M. M., et al. The female urinary microbiome in urgency urinary incontinence. American Journal of Obstetrics and Gynecology. 213 (3), 341 (2015).
- Pearce, M. M., et al. The female urinary microbiome: a comparison of women with and without urgency urinary incontinence. mBio. 5 (4), 01283 (2014).
- Gottschick, C., et al. The urinary microbiota of men and women and its changes in women during bacterial vaginosis and antibiotic treatment. Microbiome. 5 (1), 99 (2017).
- Malki, K., et al. Genomes of Gardnerella Strains Reveal an Abundance of Prophages within the Bladder Microbiome. PLoS One. 11 (11), 0166757 (2016).
- Kramer, H., et al. Diversity of the midstream urine microbiome in adults with chronic kidney disease. International Urology and Nephrology. 50 (6), 1123-1130 (2018).
- Allsworth, J. E., Peipert, J. F. Prevalence of bacterial vaginosis: 2001-2004 National Health and Nutrition Examination Survey data. Obstetrics & Gynecology. 109 (1), 114-120 (2007).
- Ravel, J., et al. Vaginal microbiome of reproductive-age women. Proceedings of the National Academy of Sciences of the United States of America. 108, 4680-4687 (2011).
- Hillier, S. L. Diagnostic microbiology of bacterial vaginosis. American Journal of Obstetrics and Gynecology. 169 (2), 455-459 (1993).
- Amatya, R., Bhattarai, S., Mandal, P. K., Tuladhar, H., Karki, B. M. Urinary tract infection in vaginitis: a condition often overlooked. Nepal Medical College Journal. 15 (1), 65-67 (2013).
- Harmanli, O. H., Cheng, G. Y., Nyirjesy, P., Chatwani, A., Gaughan, J. P. Urinary tract infections in women with bacterial vaginosis. Obstetrics & Gynecology. 95 (5), 710-712 (2000).
- Sharami, S. H., Afrakhteh, M., Shakiba, M. Urinary tract infections in pregnant women with bacterial vaginosis. Journal of Obstetrics and Gynaecology. 27 (3), 252-254 (2007).
- Hillebrand, L., Harmanli, O. H., Whiteman, V., Khandelwal, M. Urinary tract infections in pregnant women with bacterial vaginosis. American Journal of Obstetrics and Gynecology. 186 (5), 916-917 (2002).
- Sumati, A. H., Saritha, N. K. Association of urinary tract infection in women with bacterial vaginosis. Journal of Global Infectious Diseases. 1 (2), 151-152 (2009).
- Gilbert, N. M., Lewis, W. G., Lewis, A. L. Clinical features of bacterial vaginosis in a murine model of vaginal infection with Gardnerella vaginalis. PLoS One. 8 (3), 59539 (2013).
- Gilbert, N. M., O'Brien, V. P., Lewis, A. L. Transient microbiota exposures activate dormant Escherichia coli infection in the bladder and drive severe outcomes of recurrent disease. PLoS Pathogens. 13 (3), 1006238 (2017).
- Wright, K. J., Seed, P. C., Hultgren, S. J. Uropathogenic Escherichia coli flagella aid in efficient urinary tract colonization. Infection and Immunity. 73 (11), 7657-7668 (2005).
- Garofalo, C. K., et al. Escherichia coli from urine of female patients with urinary tract infections is competent for intracellular bacterial community formation. Infection and Immunity. 75 (1), 52-60 (2007).
- Hannan, T. J., Mysorekar, I. U., Hung, C. S., Isaacson-Schmid, M. L., Hultgren, S. J. Early severe inflammatory responses to uropathogenic E. coli predispose to chronic and recurrent urinary tract infection. PLoS Pathogens. 6 (8), 1001042 (2010).
- Hopkins, W. J., Gendron-Fitzpatrick, A., Balish, E., Uehling, D. T. Time course and host responses to Escherichia coli urinary tract infection in genetically distinct mouse strains. Infection and Immunity. 66 (6), 2798-2802 (1998).
- Conover, M. S., Flores-Mireles, A. L., Hibbing, M. E., Dodson, K., Hultgren, S. J. Establishment and Characterization of UTI and CAUTI in a Mouse Model. Journal of Visualized Experiments. (100), e52892 (2015).
- Hannan, T. J., Hunstad, D. A. A Murine Model for Escherichia coli Urinary Tract Infection. Methods in Molecular Biology. 1333, 159-175 (2016).
- Zychlinsky Scharff, A., Albert, M. L., Ingersoll, M. A. Urinary Tract Infection in a Small Animal Model: Transurethral Catheterization of Male and Female Mice. Journal of Visualized Experiments. (130), e54432 (2017).
- Thai, K. H., Thathireddy, A., Hsieh, M. H. Transurethral induction of mouse urinary tract infection. Journal of Visualized Experiments. (42), e2070 (2010).
- O'Brien, V. P., et al. A mucosal imprint left by prior Escherichia coli bladder infection sensitizes to recurrent disease. Nature Microbiology. 2, 16196 (2016).
- O'Brien, V. P., Dorsey, D. A., Hannan, T. J., Hultgren, S. J. Host restriction of Escherichia coli recurrent urinary tract infection occurs in a bacterial strain-specific manner. PLoS Pathogens. 14 (12), 1007457 (2018).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados