Method Article
マウスにおけるガードネレラ膣膀胱曝露によって引き起こされる再発性大腸菌尿路感染症
要約
尿路病原性 大腸菌 (UPEC)経尿道接種のマウスモデルにより、潜伏細胞内膀胱リザーバを確立し、その後の再発性UPEC UTIを誘導するための G.膣への膀胱 曝露が実証される。また、細菌の列挙、尿細胞診、および走査型電子顕微鏡のためのin situ膀胱固定および処理も実証されている。
要約
尿路原性 大腸 菌(UPEC)によって引き起こされる再発性尿路感染症(rUTI)は一般的であり、費用がかかる。雄および雌マウスにおけるUTIのモデルを説明する以前の記事は、尿および組織における細菌接種および列挙の手順を例示してきた。C57BL/6マウスにおける初期膀胱感染の間、UPECは、UPEC細菌尿症のクリアランス後に持続する膀胱上皮細胞内に潜伏リザーバを確立する。このモデルは、これらの研究に基づいて、潜伏膀胱貯留層内からのUPECの出現によって引き起こされるrUTIを調べる。泌尿生殖器細菌 ガードネレラ膣炎 は、特にUTIに関連する膣嚥下障害の文脈で、女性の泌尿生殖路に頻繁に存在するため、このモデルでrUTIのトリガーとして使用されます。さらに、膀胱組織の走査型電子顕微鏡(SEM)分析に続くin situ膀胱固定のための方法も記載されており、膀胱を含む他の研究への応用の可能性を秘めている。
概要
尿路感染症(UTI)は世界中で大きな医療負担を課しており、毎年何百万人もの人々、特に女性の生活の質に影響を与えています1。尿路病原性大腸菌(UPEC)は、UTI1の最も頻繁な原因である。UTIを発症する多くの患者(約20〜30%)は、抗生物質媒介性の初期感染のクリアランスにもかかわらず、6ヶ月以内に再発性UTI(rUTI)を経験する2。残念なことに、閉経前の女性の5%が毎年3つ以上のrUTIに苦しんでいます3,4。rUTIの逐次エピソードは、インデックスケース5、6、7、8からの同じUPEC株の持続性によって引き起こされ得る。ヒトサンプルおよびマウスモデルからのデータは、同じ株rUTIが、膀胱内の静止リザーバ内に存在するUPECによって引き起こされる可能性があることを示唆している。ヒトにおいて、UPECは、UTI 9、10、11、12、13を有する患者の上皮細胞および膀胱生検において検出された。C57BL/6マウスの研究では、UPECの一部の株が、蛍光顕微鏡検査および膀胱組織の均質化および培養によって検出されるように、膀胱内に静止期の細胞内貯留層を確立できることが実証されており、それらは細菌尿症の分離後数ヶ月間維持される14,15,16。膀胱上皮(尿路上皮)の剥離を誘導する薬剤、例えば硫酸プロタミン17またはキトサン18による膀胱の治療は、リザーバからのUPECの出現を誘発してrUTIを引き起こす。これらのデータは、以前の感染から膀胱UPECリザーバーを保有している女性において、尿路上皮剥離につながる膀胱曝露がrUTIを引き起こす可能性があることを示唆している。
膣内微生物叢が尿路感染症に寄与しているという証拠が山積みです19,20。ガードネレラ膣炎は、膣および尿中微生物叢の両方の頻繁なメンバーである21、22、23、24、25、26、27、28、29。膣内では、高レベルのG.膣炎の存在は、細菌性膣炎(BV)として知られる微生物嚥下障害と関連しており、これは女性の〜30%に影響を及ぼす30、31、32。BVを有する女性は、ラクトバチルス33,34,35,36,37が支配する膣内コミュニティを有する女性と比較して、UTIを経験するリスクが高い。マウスモデルでは、G.膣は、膣38および膀胱39の両方において上皮剥離を引き起こす。UPEC膀胱リザーバを保有するC57BL/6マウスでは、G.膣炎への2回の連続した膀胱曝露(PBSにはない)は、リザーバからのUPECの再出現をもたらし、UPEC rUTIを引き起こした。この出現は、以前にUPEC細菌尿症を解消したマウスからの尿中のUPEC力価の出現と、その後のPBS曝露対照動物と比較して犠牲時のUPEC膀胱ホモジネート力価の低下によって証明される39。興味深いことに、膀胱内のG.膣炎による永続的なコロニー形成はない。大多数の症例において、尿中の生存可能なG.膣炎のそれぞれが12(h)未満を有する2つの短時間曝露は、尿路上皮剥離を誘発し、rUTIを促進するのに十分である。
このプロトコルは、再発を誘発するために G.膣膀 胱接種を使用して、細胞内膀胱リザーバに常駐するUPECによって引き起こされるrUTIのマウスモデルを記述する。このモデルによって達成された進歩は、 G.膣炎 が以前に使用された化学薬品と比較してrUTIの臨床的に関連する生物学的トリガーであるということです。さらに、マウス尿路における G.膣 炎の比較的短命な生存は、性活動の後に起こり得るように、尿路上皮に対する一過性の微生物曝露の影響を調べることを可能にする。rUTIモデルの概要を説明することに加えて、このプロトコルは、走査型電子顕微鏡(SEM)による尿細胞診およびin situ膀胱固定および尿路皮のイメージングのための方法も記載する。
G.膣炎誘発再発性UPEC UTIのこのプロトコールは、カナマイシン耐性カセット(UTI89kanR)40を有するUPEC株UTI89を使用する。試験したUPECのすべての株がマウス41の急性感染期に細胞内細菌群集を形成できたわけではなく、UPECのすべての株が潜伏細胞内リザーバを形成する能力を有するかどうかはまだ分かっていない。リザーバの形成は、モデル内の他のUPEC株を使用する前に確認する必要があります。このプロトコルは、自発的なストレプトマイシン耐性G.膣炎単離物JCP8151BSmR38を使用する。JCP8151BSmRによるrUTIの誘導は、12時間または7日(d)離れて39のいずれかを与えられた2つの連続したG.膣炎接種を必要とする。他のG.膣炎株が剥離および/またはUPEC rUTIを誘導するかどうかは、このモデルで決定されるままである。抗生物質を寒天プレートに添加して、感染を監視するためのコロニー形成単位(CFU)の列挙を妨げる可能性のある内因性マウス微生物叢の増殖を防ぐために寒天プレートに添加できるため、既知の抗生物質耐性を有するUPECおよびG.膣炎株(UPECのカナマイシンまたはスペクチノマイシン、G.膣炎のストレプトマイシンなど)を使用することが不可欠です。マウスの尿には、抗生物質を含まない培養プレート上で過剰増殖する可能性のある他の細菌が頻繁に含まれているため、これは尿検体の培養に特に重要です。マウス尿中のこれらの内因性細菌の起源は不明であるが、尿採取中に拾われた尿道周囲および泌尿生殖器細菌を反映している可能性が高い。
G.膣炎は通性嫌気性細菌であり、したがって、このプロトコルは、嫌気性チャンバー内で成長するG.膣炎JCP8151BSmRを記載する。嫌気性チャンバが利用できない場合、嫌気性成長条件を維持するための他の方法(気密容器内のGasPakパウチなど)を利用することができる。あるいは、G.膣炎のいくつかの株(JCP8151BSmRを含む)は、標準的な組織培養インキュベーター(5%CO2)中で増殖するであろう。JCP8151BSmR以外のG.膣炎株を使用するには、細菌がこのモデルで同様に振る舞うことを確認するための試験が必要であるのと同様に、増殖条件を変えるには、所望の生存可能な接種濃度を達成するために、培養のための理想的な持続時間(プレート上および液体中)および光学密度(OD)600当量の経験的決定が必要である。さらに、成長状態がG.膣炎の病態生物学に影響を与えるかどうかは知られていない。
最後に、このモデルを利用するかどうかを検討する際には、研究者は、一般的なUTIマウスモデルよりもグループごとにより多くの動物を必要とする可能性があることに注意する必要があります。これは、rUTIの誘導が、マウスが膀胱の初期感染によって引き起こされるUPEC細菌尿症を解決することを必要とするためである。したがって、細菌尿症(通常は進行中の腎臓感染を示す表現型)をクリアできないマウスは、プロトコルのrUTIフェーズには含まれません。これらの研究に電力を供給するために必要なマウスの数は、尿中への「自発的」UPEC出現の割合(平均で12〜14%)によっても影響される。最後に、異なるマウス系統は、細胞内貯留層形成に対して慢性細菌尿症を発症する傾向が異なる42,43。このモデルでC57BL/6以外のマウス株を使用する場合、動物が静止UPEC細胞内リザーバを発達させることを確認しなければならない。
プロトコル
ワシントン大学施設動物ケアおよび使用委員会(IACUC)は、2020年6月9日に期限が切れたプロトコル番号20170081および2023年3月18日に期限が切れる20-0031の一部として、すべてのマウス感染および手順を承認しました。動物の全体的なケアは、国立研究評議会の実験動物のケアと使用のためのガイドとUSDAアニマルケアリソースガイドと一致していました。安楽死の手順は、動物の安楽死のためのAVMAガイドライン:2020年版と一致しています。

図1.マウスモデルの概略図。タイムラインは、プロトコルで概説されているモデルのフェーズまたは手順を反映するために強調表示されます。フェーズ 1 (オレンジ色):細胞内UPECリザーバの確立。マウスにUPECを経尿道的に接種し、尿サンプルを採取し、細菌尿症のクリアランスについてモニターする。細菌尿症をクリアするマウスのみが次の段階に進む。フェーズ 2 (緑):G.膣への膀胱曝露。マウスにG.膣炎を経尿道的に2回接種する。2つの連続露光間の持続時間は、所望の下流分析に応じて、12時間(トップパネル)または1週間(wk;ボトムパネル)のいずれかである。フェーズ 3 (黄色):UPEC rUTI.尿は、G.膣炎曝露後に毎日収集され、UPEC細菌尿症について監視される。さらに、膀胱および腎臓を実験エンドポイントで収集して、UPEC組織力価を測定することができる。1wkばく露モデルでは、G.膣炎誘発性細胞内貯留層からのUPECの出現およびその後の尿路からのクリアランスも、UPEC膀胱組織力価の低下に反映される(PBSばく露マウスと比較して、図3D参照)。この膀胱力価の低下は、12時間曝露モデルでは明らかではなかったが、組織力価を有意に低下させるために十分な貯留層出現およびクリアランスが起こるためにより多くの時間が必要であるためと考えられる。 手順A:尿細胞診は、通常、急性UPEC感染を調べるためにフェーズ1中に1dpi(またはそれ以前)に行われ、フェーズ3ではUPEC出現と相関する尿PMN含有量を評価します。他の時点で収集された尿サンプルも同様に分析することができる。 手順B:尿路上皮剥離を調べるための膀胱走査型電子顕微鏡(SEM)は、典型的には、第2のG.膣炎曝露後3時間(時間0で第1の曝露を投与してから15時間後)の12時間モデルにおいて行われる。他の時点も、フェーズ1に示すように、UPEC接種後6〜24時間など、評価することができる。この図の拡大版を表示するには、ここをクリックしてください。
1. マウスにおけるUPEC静止細胞内リザーバの確立
- 尿道カテーテルを準備します(このステップのビデオについては、44,45,46,47を参照してください)。
- 針基部から針先を越えて数mmまで伸びるPE10チューブの長さの30ゲージ針をねじます。針先でチューブを穿刺しないように注意してください。あるいは、小児静脈内カニューレ46を使用する。
- 準備したカテーテルをシャーレに入れ、UV光で少なくとも30分間滅菌する。シャーレのふたを交換し、必要になるまで保管用に固定します。
- UPEC接種剤を準備する(-3日目から0日目まで)
- -3日目:-80°Cの冷凍庫ストックからUTI89kanR をルリア・ベルターニ(LB)寒天プレート上にストリークする。プレートを37°Cで18〜24時間インキュベートする。
注:カナマイシン耐性はUTI89kanRに安定に集積しているため、カナマイシンを接種剤増殖培地に添加する必要はありません。 - -2日目:UTI89kanRの単一コロニーを有する滅菌125 mLフラスコに20 mLのLBブロスを接種する。 この培養方法は、膀胱接着に必要なUPECタイプ1ピルスの発現を誘導するために重要であるため、より小さなフラスコを使用しないでください。
- 37°Cで18〜24時間静的に(振とうせずに)インキュベートする。抗生物質を増殖培地に添加しないでください。液体培養を開始するには、LBプレート(18〜24時間齢)の新鮮なコロニーのみを使用してください。
- Day -1: 継代培養 UTI89kanR を 20 μL の培養物を除去し (フラスコを穏やかに旋回させて沈降細菌を再懸濁させる)、滅菌 125 mL フラスコ内の新鮮な LB ブロスを 20 mL に添加します。ステップ2のようにインキュベートしますが、18時間の持続時間を除きます。抗生物質を増殖培地に添加しないでください。
- 0日目:培養物全体を50mLチューブに移し、卓上遠心分離機で3200× g で10分間回転させて細菌をペレット化する。上清を吸引し、細菌ペレットを10mLのPBSに再懸濁する。
- ステップ4の濃縮細菌懸濁液100 μLをキュベット中のPBS900 μLに添加し、PBSでブランクした分光光度計を使用して600nmでの光学密度(OD600)を決定する。分光光度計の値に10を掛けて(希釈を考慮するため)、懸濁液(OD懸濁液)のOD600を求める。
- 50 μLで1 x107 CFUの所望の接種物濃度を達成するには、所望のOD接種量が0.35(値は他のUPEC株では変化し得る)であり、Yが必要な接種剤の体積(泡を除去し、カテーテルを充填するために余分なことを可能にするためにマウスあたり100μL)である以下の式を使用してUTI89kanR懸濁液を希釈(または濃縮)する:
X mL x OD懸濁液 = Y mL x OD接種物質
例えば、OD懸濁液 値が4.7であり、5mLの接種剤が必要な場合:
X mL × 4.7 = 5 × 0.35
X = (5 × 0.35) / 4.7
X = 0.372 mL
したがって、372 μLの細菌懸濁液を加えて5 mL(最終容量)を作ります。 - マルチチャンネルピペットを使用して、接種源の1:10の段階希釈を96ウェルプレートの滅菌PBS中の10-6 に作ります。スポット 5 つの 10 μL すべての 6 つの希釈液の複製を LB および LB+kan プレート上に複製し、スポットを乾燥させ、37 °C で一晩インキュベートします。抗生物質を含まないLBプレートは、接種物が別の生物によって汚染されていないことを確認するために使用される(これは、カン抗生物質選択プレート上に存在しない追加のコロニー形態として現れるであろう)。どちらのプレートタイプも同じ結果が得られるはずです。
注:プレートは、斑点が合体することなくメッキされた液体を吸収するように、使用前にベンチトップで1日乾燥させる必要があります。 - 希釈液のすべてのスポットにおけるコロニーの総数を区別可能なコロニーでカウントし、その値を使用して、各実験で使用した実際の接種量を計算します。単にOD600 値に頼らないでください。
- -3日目:-80°Cの冷凍庫ストックからUTI89kanR をルリア・ベルターニ(LB)寒天プレート上にストリークする。プレートを37°Cで18〜24時間インキュベートする。
- UTI89kanR を麻酔した雌マウスの膀胱に接種する(0日目)
注:この手順のビデオ録画は、以前に44,46公開されています。より詳細な説明については、これらの論文を参照してください。マウスカテーテル法の詳細については、このプロトコルのセクション5を参照してください。- IACUCが承認した方法に従ってイソフルラン吸入でマウスを麻酔する。
- マウスが麻酔をかけられるのを待っている間に、ツベルクリンシリンジにUTI89kanR 接種剤を充填し、調製したカテーテルを貼り付ける。プランジャーを押し下げてカテーテルから空気を空にし、カテーテルを滅菌手術用潤滑剤に軽くたたきます。
- マウスを背中に置き、マウスのフットパッドをしっかりと握りしめ、反射や反応がないかを観察して麻酔を確認します。各手の人差し指の間に膀胱(下腹部のエンドウ豆のように感じる)を見つけます。指を互いに動かして尿を表現し、膀胱に穏やかな圧迫圧力をかけます。
- カテーテルをマウス尿道を通して膀胱に挿入し、50μLの接種剤をゆっくりと送達する。
- 数秒待ってから、まっすぐ引き抜いてカテーテルを静かに取り外します。マウスをケージに戻し、麻酔から回復するまで監視します。
- 追加のマウスでステップ1.3.1〜1.3.5を繰り返し、各ケージ(5匹のマウス)間のカテーテルを変更します。所望により、対照群のマウスにPBSを接種するために、例えば、 G.膣炎 の別の株がrUTIを惹起する(自発的/バックグラウンドレベルにわたって)ことを示すために、同じ手順を使用することができる。
2. UPEC細菌尿症のクリアランスのモニタリング(1日目~28日目)
注:採尿手順のビデオは、以前に公開されています 44.
- すべてのマウスから尿(最小10μL)を膀胱触診により採取し、感染後1 dで44 、毎週(感染後7、14、21および28 d)に記載した。尿は、UPEC感染を監視するために、収集から数時間以内に培養する必要があります。メッキされるまで4°Cで尿を保管してください。尿は細胞診にも使用できます(セクション4を参照)。時折、膀胱が非常に炎症を起こしている場合、10μLの尿を得ることができない。この場合、PBSは10 μLまで添加することができるが、尿中細菌力価および細胞診スコアはそれに応じて調整されなければならない(例えば、5 μLの尿のみが採取され、5 μL PBSが添加される場合、力価およびスコアに2を掛ける)。
- マルチチャンネルピペットを使用して、96ウェルプレートで滅菌PBSで1:10の連続希釈を10-6 に希釈します。P10 マルチチャンネルピペットを使用して、カラム 1 からの 6 つの希釈液すべて 10 μL を垂直方向に、関連する抗生物質選択マーカーを含む LB プレートの左端にスポットします。ヒントを捨てる。
- 残りのサンプル(カラム2、カラム3など)でメッキを繰り返します。1枚のプレートで5つのサンプルを並べて収容できます。これにより、5 × 6スポットマトリックスを有するプレートが生成され、上から下に希釈が増加し、サンプル数が左から右に増加します(図2A)。
- 斑点をベンチトップで乾燥させ、37°Cで一晩インキュベートする。翌日、コロニーが異なる最も希釈されていないスポットのコロニーの数を数え(図2B)、この数を使用してCFU/mLを計算します。
単一尿スポットのコロニー数×希釈係数× 100 = CFU/mL尿 - グラフ作成ソフトウェアを使用してUTI89kanR 尿価をプロットする(図2C)。尿中に検出可能なUTI89kanR を28 dで有さないマウス(C57BL/6マウスの約65-80%)を同定する。これらのマウスは静止期の細胞内リザーバを保有し、再発性UTIの誘導を調べるためにその後の実験段階で使用される。28 dで尿中に細菌を有するものは、後続のステップには含まれない。
3.G.膣炎への膀胱曝露
- マウスをばく露群に割り当てます(29日目)。このステップの主な目的は、rUTIの可能性に影響を与えるかどうかは不明であるため、より長期の細菌尿症を有するすべてのマウスを同じ曝露群に一緒に持つことを避けることである。
- 尿CFUデータ(図2D)を用いて、UTI89kanR細菌尿症がもはや検出不能となった時点に基づいてマウスを分類する(図2E)。
- 各カテゴリーのマウスを G.膣炎 またはPBS接種群のいずれかにランダム化する。例えば、7日目より前にクリアしたマウスの半分 はG.膣炎 を、半分はPBSを取得します。8日目から14日目の間にクリアしたマウスの半分 はG.膣炎 を、半分はPBSなどを取得します( 図2Eのように)。
- G.膣炎接種剤を準備する(嫌気性チャンバーで実行されるすべてのステップ)
注:理想的な培養インキュベーション時間は 、G.膣の異なる株によって異なり、一部の株は静止期に入り、他の株よりも早く死に始めることさえあります。これは、殺された G.膣炎 (JCP8151B)がrUTI39を誘発することができなかったことを考えると、特に重要である。したがって、インキュベーション時間は、マウスで実験を行う前に、所与の株について経験的に決定されるべきである。 G.膣 炎の他の/すべての株がこのモデルで同じ効果を引き起こすかどうかは不明です。- ストリーク G.膣 炎株を-80°Cの冷凍庫ストックからNYCIIIプレート上に(抗生物質なし)。プレートを37°Cで嫌気的に24時間インキュベートする。
- 嫌気チャンバー内で、嫌気性NYCIII培地5 mLにNYCIIIプレートからの1 μLループフルの細胞(単一コロニーでは不十分)を接種し、嫌気条件下で37°Cで18時間静置培養する。増殖培地に抗生物質を含めないでください。
- 分光光度計を用いて培養物のOD600 を求める。
- 定義された培養体積(X)を9600 × g で1分間遠心分離し、培地を吸引する。PBSの体積(Y)を計算してペレットを再懸濁し、50μLで108CFU を達成するための所望の接種量ODを達成するには、次の式を使用します。
OD培養 ×XmL=YmL×OD接種源 はYについて解決する
Y = (X ml × OD培養物) / OD接種剤
注:JCP8151BSmRのOD接種量は5ですが、これは他のG.膣炎株について経験的に決定されなければなりません。例えば、JCP8151BSmRをOD培養=2.0で一晩液体培養して3 mLを紡糸する場合:Y=(3 mL× 2.0)/5.0;したがって、ペレットを1.2mL PBSに再懸濁する - 細菌ペレットをPBSに所望の濃度に再懸濁する。接種源を段階的に希釈およびプレート化し(上記のCFUめっきプロトコールに記載されるように)、各実験で使用された実際の接種剤用量を決定する。OD 値だけに頼らないでください。
- 定義された培養体積(X)を9600 × g で1分間遠心分離し、培地を吸引する。PBSの体積(Y)を計算してペレットを再懸濁し、50μLで108CFU を達成するための所望の接種量ODを達成するには、次の式を使用します。
- UPEC接種後の29〜31日目に、上記のステップ1.3に記載されるように麻酔をかけたマウスに G.膣炎 またはPBSを接種する。PBS対照群は、膀胱をカテーテル挿入する行為が、ある程度のUPECリザーバー再出現を誘発する可能性のある損傷および尿路上皮剥離を誘発する可能性があるため、不可欠である。 したがって、PBS接種マウスは、 G.膣炎接種マウスが比較される対照として役立つ。
注:28 dでの最終的なUPEC細菌尿症測定には、CFUプレートの一晩のインキュベーションが必要です。したがって、このステップを最も早く実行できるのは、最初のUPEC接種の29日後である。必要に応じて、31日目までばく露を与えることができます。研究者は実験間で一貫性を持たなければなりません。 - 接種剤調製を繰り返して、第1接種後12時間または1wkなどの所望の時点で第2の G.膣炎 (またはPBS対照)接種を投与する。 G.膣炎 の単回接種は有意なUPEC出現をもたらさないので、第2の曝露が必要である39。
4. UPEC再発性UTIのモニタリング
- 各 G.膣炎 接種後の所望の時点でマウスから尿を採取する(1、2、および3d接種後推奨)。
- 尿を選択的プレート(LB+カナマイシンなど)で段階的に希釈してプレートし、UTI89kanR CFU/mLを決定します。必要に応じて、尿希釈液を選択的プレート(例えば、NYCIII + 1mg/mLストレプトマイシン)に播種して 、G. vaginalis CFU/mLを決定することもできる。しかしながら、 G.膣炎 JCP8151BSmR は、12時間 39までにほとんどのマウスの尿から除去された。したがって、ほとんどのマウスで G.膣炎 を検出するには、より早い時点が必要であるであろう。
- 実験エンドポイント(例えば、第2のG.膣炎接種後3d)で、承認された方法(例えば、イソフルラン麻酔下またはCO2吸入下での子宮頸部脱臼)に従ってマウスを犠牲にし、CFU列挙のために膀胱および腎臓を収集する(前述のように44,46)。
5. 尿細胞診
注:この手順は、尿中に存在する細胞および/または細菌の視覚化が望まれる任意の時点で実行することができる。 図1に示すように、尿細胞診は通常、急性UPEC感染を調べるためにフェーズ1中に1dpi(またはそれ以前)で行われ、フェーズ3ではUPEC出現を示す尿中の多形核(PMN)細胞の存在を評価します。
- フィルターとスライドを取り付けたサイトロートカセットに90 μLのPBSに10 μLの尿を追加します。(最も簡単な方法は、尿培養に使用する96ウェルプレートからの1:10希釈液の残りを使用することです;これらのサンプルは、4°Cで保存すれば、尿培養後24時間まで使用できます)。カセットを細胞遠心分離機に入れ、600-800 x g で6分間、高い加速度で回転させます。
- スライドを取り除き、一晩乾燥させます。翌日、血液学染色キット(例えば、ライト社、ギムサ社、固定液を含む)を用いて、製造業者のプロトコールに従って染色する。
- PMNおよび上皮細胞の存在について光学顕微鏡によってスライドを分析する。必要に応じて、これらは、各高出力視野に存在する各細胞型の存在量に基づく定性的スコアリングメトリックを使用してスコアリングすることができる(例えば、0=なし、1=少数、2=中等度、3=堅牢)。スライドを分析する個人が実験グループに対して盲検化され、潜在的なバイアスが最小限に抑えられるようにします。
6. 走査型電子顕微鏡による膀胱のイメージング
注:この手順は、尿路上皮の視覚化が望まれる任意の時点で行うことができる。 図1 (紫色の箱)に示すように、UPECと尿路上皮の相互作用は、貯水池形成段階でのUPEC接種後6時間から24時間の間に最もよく視覚化され、 G.膣炎 によって引き起こされた尿路上皮剥離は、2回目の G.膣 炎曝露後3時間から12時間の間に最もよく視覚化される。
- その場で膀胱固定
- pH 7.4で 2 mM の CaCl 2 と共に 0.15 M カコジル酸ナトリウム緩衝液にグルタルアルデヒド (2.5% 最終) およびパラホルムアルデヒド (2 % 最終) を添加して、膀胱収穫の直前に固定液を調製します。新しく開いたガラスアンプルのパラホルムアルデヒドとグルタルアルデヒドは、両方の固定剤が開いた容器内で時間の経過とともに酸化するため、使用してください。
注意:グルタルアルデヒドは毒性があり、呼吸器刺激性であり、腐食性です。パラホルムアルデヒドは可燃性、発癌性、刺激性および生殖毒素である。カコジル酸ナトリウムは毒性があり、発がん性があります。 - 50 mLの固定液を作るには、6.25 mLの16%パラホルムアルデヒド、2 mLの50%グルタルアルデヒド、および16.75 mLの超純水を、4 mM CaCl 2を含むpH 7.4のカコジル酸ナトリウムの0.3 M溶液の25 mLに加えます。
- 調製した固定液を37°Cに温めてから膀胱に投与する。
- ツベルクリンのスリップチップシリンジに固定液を充填し、最後にカテーテルを貼り付け、反対側のシリンジマーキングに面した面取りをします。針の端から1〜2mmの余分なチューブを切り取り、針先を露出させないように注意してください。シリンジをフリックして気泡を除去し、プランジャーを押して空気を空にし、カテーテルを微小遠心チューブの上に固定液で満たして、適切な処分のために固定液を収集します。
- 承認された方法(例えば、麻酔下での子宮頸部脱臼)を用いてマウスを麻酔し、犠牲にする。脚を固定した状態で(輪ゴムやピンで)解剖面にマウスを置きます。鉗子と一対の外科用はさみでマウスの骨盤領域を開き、膀胱を露出させます。隣接する脂肪を慎重に脇に押しますが、膀胱はそのままにしておきます。
- 針を下に向けて、針のベベルと注射器のマーキングを手から離して、利き手でシリンジを持ちます。カテーテル先端を滅菌潤滑剤に浸します。
- カテーテル先端を尿道開口部に置き、シリンジバレルをマウス本体上で30〜45°の角度で離して保持します。
- 先端で非常に小さな時計回りの動きを使用して下向きの圧力をかけ、カテーテルを尿道に静かに挿入します。カテーテル先端が尿道に入ったら、シリンジバレルが作業面に平行になるまでカテーテルをさらに尿道にスライドさせながら、シリンジをマウスの尾に向かってヒンジで固定します。カテーテルニードルシャフト全体(ベースを含まない)はマウスに入り、カテーテル先端を膀胱内腔内に位置決めする必要があります。
- 50-80 μLの固定液をゆっくりと送達し、膀胱を風船のように膨張させる。カテーテルを所定の位置に保ち、シリンジをわずかに持ち上げ、先端を上に傾けます。
- 一方、止血口を開き、尿道の交差点にあるカテーテル針の下に1本の爪をスライドさせます。止血剤が針に接触するまで止血剤を部分的に閉じます。
- カテーテル針を膀胱から静かにスライドさせながら、止血剤を完全に締め付けてロックして、固定液の損失を防ぎます。
- 止血具を、膀胱を上に載せて作業面に平行になるように把持します。止血剤の下(膀胱の反対側)を優しく慎重に切り上げて、止血剤を装着したまま膀胱を取り外します。
- 膀胱を置き、止血剤を温めた固定液を含むファルコンチューブに入れます。膀胱が流体に完全に浸かっており、チューブの壁に押し付けられていないことを確認します。4°Cで24時間インキュベートする。
- pH 7.4で 2 mM の CaCl 2 と共に 0.15 M カコジル酸ナトリウム緩衝液にグルタルアルデヒド (2.5% 最終) およびパラホルムアルデヒド (2 % 最終) を添加して、膀胱収穫の直前に固定液を調製します。新しく開いたガラスアンプルのパラホルムアルデヒドとグルタルアルデヒドは、両方の固定剤が開いた容器内で時間の経過とともに酸化するため、使用してください。
- 走査型電子顕微鏡(SEM)による膀胱処理とイメージング
- 洗浄された両面カミソリの刃で膀胱を矢状に二等分し、止血に接する2回目の切断をして膀胱を解放します。これは2つの半膀胱「カップ」をもたらす。膀胱の外側に脂肪パッドが残っている場合は、静かに取り外します。
- 膀胱の半分をカコジル酸ナトリウム緩衝液(0.15 M、pH 7.4)で3回(各10分)すすいでください。
- 1%四酸化オスミウムで組織を0.15 Mカコジル酸緩衝液で室温で1時間染色する。オスミウムは光に敏感です。したがって、染色容器をホイルで包んでこの工程を行い、暗い環境を維持します。
警告: 四酸化オスミウムは皮膚に有毒で腐食性があります。手袋でヒュームフードでこのステップを行います。 - 膀胱の半分を超純水で3回(各10分)すすいでください。これらのステップの間、浸透した油は時々水の表面で見ることができる。乾燥工程中の汚染を防ぐために、これを吸引または吸い取ります。
- 段階的なエタノールシリーズ(50、70、90、100、および100%)にそれぞれ10分間浸すことによって組織を脱水する。
- 最も遅い速度で12CO2交換を行う 臨界点乾燥機を用いて固定組織を乾燥させる。高速に設定されている通気ステップを除き、すべての追加設定を低速に設定します。
- 清潔な両面カミソリで各膀胱を再び半分に二等分して4個の合計ピースを生成し、より効率的なコーティングのために標本の曲率を低減し、SEMでのイメージングを容易にし、乾燥中にカールした可能性のある組織を露出させる。
- アルミスタブの導電性カーボン接着剤タブにブラダー片を接着し、爪楊枝との底部接触の周りに少量の銀接着剤を塗布し、余分な接着剤がブラダーの内面に吸い込まれないように注意します。
- 高真空スパッタコーターを使用して、サンプルスタブを6nmのイリジウムでスパッタコートします。サンプルが充電し続ける場合は、導電パスが銀塗料で表面に塗装され、さらに4nmのイリジウムでコーティングされていることを確認してください。
- 走査型電子顕微鏡で試料を画像化する。使用する顕微鏡によって条件が異なる場合がありますが、エバーハート・ソーンリー(SE2)電子検出器を使用する場合、200pAのビーム電流と12〜13mmの作動距離で3KeVの加速電圧がツァイスマーリンFE-SEMでうまく機能しました。
結果
接種後、UPEC力価は尿中で検出可能である(図2B)。カナマイシンを含む選択培地に尿サンプルをプレートしないと、尿を汚染する内因性マウス微生物叢の過剰増殖が生じる可能性があります。UPEC細菌尿症のレベルは、1日目に高くなる可能性が高く、最初の1週間に増加してから、後の時点で減少する可能性があります(図2C)。マウスの約65〜80%は、尿中に検出可能なUPECを28dpiずつ有さない(図2C、緑色の円)。これらのマウスは、モデルの後続のステップで使用することができる。細菌尿症のままのマウス(図2C、赤い楕円)は、実験から排除されるべきである。
12時間(図3A)または1wk間隔(図3B)で2回の連続したG.膣炎曝露は、細胞内貯留層からのUPECの出現をもたらし、再発性細菌尿症を引き起こす。UPEC細菌尿症のレベル(Mann-Whitney試験)およびUPEC rUTIを示すマウスの割合(フィッシャーの正確検定)は、PBS対照群と比較してG.膣炎に曝露されたマウスにおいて有意に高い。尿細胞診解析は、UPEC出現を示したG.膣炎ばく露マウスから尿中のPMNを検出する(図3C)。1 wk間隔で2回のばく露を行ったモデルでは、膀胱組織中のUPEC力価は、G. 膣炎ばく露マウスではPBSと比較して低くなっている(図3D)が、おそらく貯水池からのUPECの出現とその後のクリアランスによるものである。
SEMによるin situ固定膀胱組織の可視化は、PBSのみに曝露された対照マウスにおいて膀胱表面を覆う大きな表在傘尿路上皮細胞を明らかにする(図4A)。尿路剥離は、表在性傘細胞の喪失によって証明され、 G.膣 炎に曝露されたマウスにおいて、より小さな根底にある移行上皮細胞を明らかにする(図4B)。細胞内貯留層の確立中のUPEC接種後早期に、UPECは尿路上皮上および剥離細胞からフィラメンテーションで見える(図4C)。
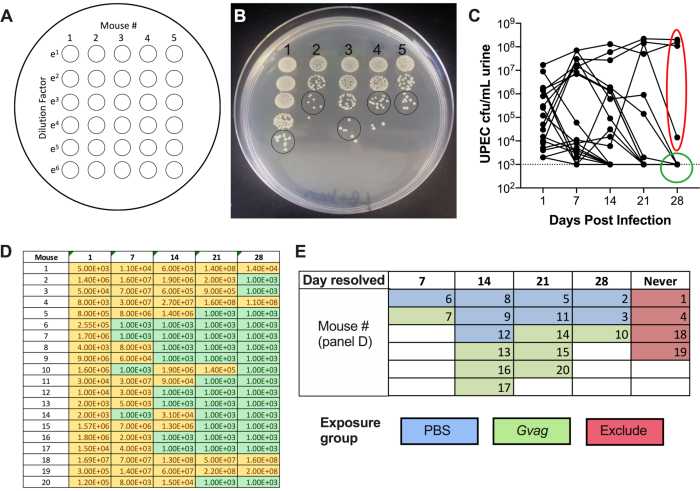
図2.フェーズ1(貯水池形成)中の尿中のUPEC力価のモニタリング。 (A)コロニー形成単位(CFU)めっきの概略図。(B)LB+カナマイシンの尿中のUPEC力価の代表的な画像。黒丸は、CFU/mLを計算するためにカウントする必要がある尿サンプルスポットを示します。(C)C57BL/6マウスにおけるUPEC細菌尿症の経時変化。各線は個々のマウスを表し、UPEC尿力価を経時的にたどります。点線は検出限界(1000CFU/mL)を示す。赤い楕円は、UPEC細菌尿症の解決に失敗した4匹のマウス(20匹中)を示し、したがって G.膣炎誘発rUTIモデルには使用されないであろう。逆に、緑色の円は、UPEC細菌尿症を解消し、その後の段階に進んだマウスを示す。(D)パネルC.イエロー、検出可能なCFUのグラフを生成するために使用されるデータのテーブル。緑、CFUなし。(E)UPEC CFUが尿中で検出されなくなった時点に基づく曝露群へのマウスの無作為化(「解決日」)。パネル D の左側の列のマウス番号は、パネル E で指定したマウス番号と同じです。 この図の拡大版を表示するには、ここをクリックしてください。
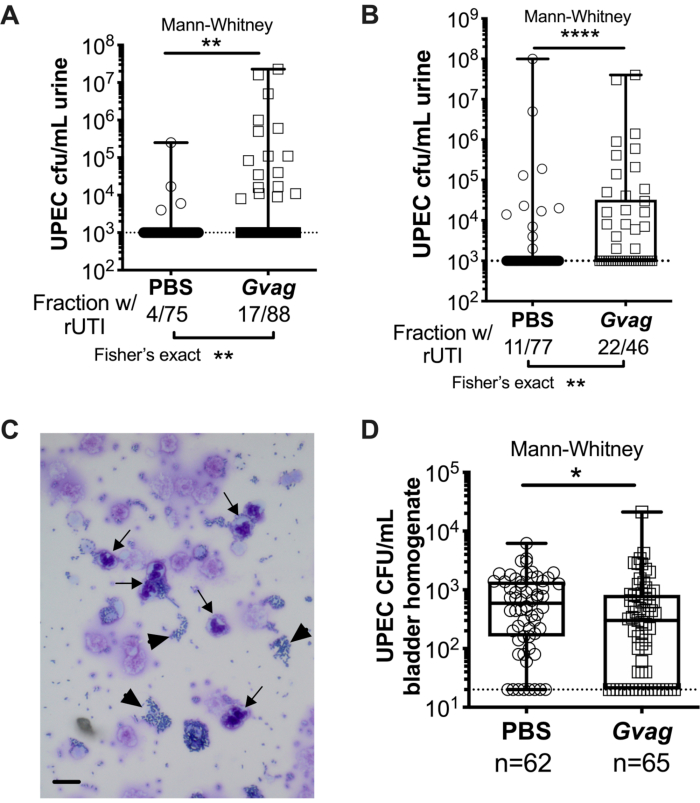
図3. G. 膣炎は UPEC rUTI をトリガーします。 12時間(A)または1wk(B)の間隔でPBS(円)または G.膣 炎(Gvag;正方形)への2つの連続した尿路曝露後の尿中のUPEC力価。各シンボルは個々のマウスを表します。2回目のばく露後1〜3 dの間に各マウスから検出された最も高いCFU/mL UPECがプロットされます。検出可能な細菌尿症を有さないマウスは、検出限界(点線)でプロットされる。(c)UPEC(矢じり)および多形核(PMN)細胞(矢印)を示す尿細胞診解析。スケールバー = 20 μm。(d)1wk間隔で与えられた2つの連続した尿路曝露に続いて3dを採取した膀胱組織におけるUPEC力価。各シンボルは異なるマウスを表し、ゼロは検出限界(点線)にプロットされます。A、B、およびDでは、ボックスは中央値がマークされ、最小から最大までのひげが付いた第1および第3四分位数にあり、Mann-Whitney U検定* P <0.05;** P < 0.01; P < 0.0001. この図の拡大版を表示するには、ここをクリックしてください。
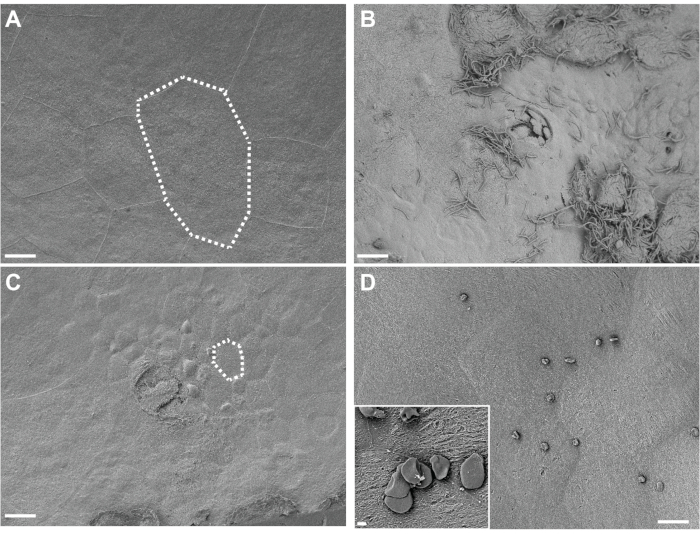
図4.その場で固定された膀胱のSEM分析。 膀胱を、PBS(A)または G.膣 炎(C)に2回(12時間間隔)曝露してから3時間後にマウスから採取した。点線は単一の尿上皮細胞を示しており、大きな表在細胞が剥離して根底にある移行上皮を明らかにしているため、 G.膣に露出した膀胱では小さくなっています。(b)UPECによる初期接種後6時間後に採取した膀胱、モデルのフェーズ1の間、尿路上皮剥離および細胞外UPECを示す。(d)膀胱表面に存在する不溶性脂肪滴の例。スケールバーは、メイン画像で20μm、インセットで2μmです。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
このモデルの最初の重要なステップは、一次UTI期にUPEC細菌尿症をクリアしていないマウスを同定する。これらのマウスは、G.膣炎曝露後のUPEC細菌尿症の割合を混乱させるため、実験から除去する必要があります。最初のUPEC接種後、細菌クリアランスを監視するために毎週尿を採取する必要があります。C57BL/6マウスの約65~80%が4週間以内にUTI89kanR感染をクリアします。他の近交系マウス系統は、UPECクリアランス42,43およびリザーバ形成に対して異なる傾向を有し、したがって、このモデルには適していない可能性がある。第2の重要な点は、実証研究により、PBSのみに曝露された対照マウスで起こるバックグラウンド自然発生よりも有意な貯水池出現を引き起こすために、G.膣炎の2つの連続接種(12時間または1wk間隔のいずれか)が必要であることが決定されたことである。2つの連続露光の間の他の時間はテストされていないが、同様の結果をもたらす可能性がある。UPEC膀胱力価の低下は、G.膣炎曝露が1wk間隔39を与えられたモデルでのみ観察されたことに注意することが重要です。2回以上のばく露を投与することができるが、経験的証拠は、反復カテーテル検査のみで出現が増加することを示唆しており、その結果の解釈を混乱させるか、または曝露群と対照群の違いを区別するためにより多くの動物を必要とする可能性がある。最後に、in situ膀胱固定法にはいくつかの重要なステップがある。固定剤がクランプされた膀胱内に留まるようにするには、いくつかのスキルが必要です。収縮した膀胱はSEMでイメージングするのがより困難になります。固定剤含有カテーテルで尿路上皮を掻き取ると、G.膣炎によって引き起こされるものとは無関係に尿路上皮剥離を誘発することができるので、固定液を膀胱に接種するときは非常に穏やかであることも不可欠です。固定剤カクテルに記載されているすべての濃度は最終濃度です。これらの不適切な比率は、不十分な固定および細胞の腫脹または収縮をもたらし得る。固定液は、細胞および組織における温度ショックを避けるために生理学的温度に加温されるべきである。温暖化はまた、原形質膜を通る固定剤の拡散速度にわずかな改善をもたらす。SEM分析用に調製したサンプルではオスミウム染色を省略できることがよくありますが、臨界点乾燥時の脂質を安定化させ、細胞膜の亀裂を防ぐためには、このプロトコルで不可欠なステップです。
このプロトコルは、他のUPECおよび/または G.膣 炎株がリザーバを形成し、それらの出現を誘発する能力についてそれぞれ試験するために変更することができる。他の実験因子、例えば、他の膣細菌(例えば、 ラクトバチルス・クリスパトゥス PVAS100)または熱死 したG.膣炎への曝露なども加えることができ、いずれもこのモデルにおいて病理を実証していない39。試験する他の細菌株を選択する場合、標準的な接種物濃度をすべての実験で使用できるように、一貫した増殖を実証することが重要です。JCP8151BSmR の成長は、嫌気性チャンバー内で最適化されています。この株は嫌気性GasPakシステムで培養できる可能性が高いが、これには堅牢な細菌増殖を確実にするための最適化が必要である。最後に、モデル内の特定のステップのタイミングを変更できる場合があります。例えば、UPECリザーバ形成段階の早い時点で尿を収集して、CFUまたは宿主の応答を監視することができる。初期の時点(3、6、12hpi)で尿サンプルを採取することの感染の進行または貯水池の確立に対する悪影響は、このモデルでは観察されていない。UPECリザーバの出現は、2回のJCP8151BSmR 用量が12時間または1wk投与された後に起こることが報告されているが、他の時間間隔はまだ試験されていない。また、多くのマウスがこの時までに細菌尿症をクリアするので、UPECリザーバ形成段階を2週間(4週間ではなく)に減少させることによって、モデルの全期間を短縮することも可能であり得る。化学角質除去剤への膀胱曝露後のUPEC出現を調べる以前の研究は、1または2wkのUPECリザーバ形成段階17、18を使用した。しかし、UPEC細菌尿症のクリアランスの時間を減らすことは、より多くの動物を実験から淘汰する必要があるという犠牲を払って来るかもしれません。最後に、膀胱のSEM分析は、尿路上皮に対する G.膣 炎の効果の持続時間を観察するために、追加の時点で行うことができる。
トラブルシューティングに関しては、特に膀胱SEM分析に関していくつかの重要な考慮事項があります。使用されるマウスの背景および存在する炎症の量に応じて、いくつかの膀胱は非常に薄い壁で提示される。これらの膀胱は臨界点乾燥中によりカールする傾向があり、カウリーシェルのような形状をもたらす可能性がある。この場合、最良の方法は、カールした界面に沿って殻状の膀胱を半分に切断し、次に2回目に張り出した組織の大部分を除去することである。切断は、PTFEコーティングされた両刃のカミソリ刃で最適に機能します。過剰な脂肪は、オスミウム染色工程中に可溶化することがあります。これは、すすぎおよび脱水ステップ中に洗い流されない可能性があり、その後の乾燥中に膀胱表面に沈降する可能性がある不要な不溶性脂肪滴をもたらし得る。これらの液滴は、小さな球体またはサンプル上に散在する円盤状の構造として現れることがあります(図4D)。これは、できるだけ多くの脂肪組織が膀胱の周囲から除去されることを確実にすることによって緩和することができる。白金はイリジウムコーティングの代わりに使用できますが、細かい構造の詳細のマスキングを減らすために厚さを最小限に抑える必要があります。コーティング中に回転ステージを使用することを強くお勧めします。
このモデルの1つの制限は、多数のマウスを必要とすることである。C57BL/6マウスの65~80%のみがUPEC細菌尿症をクリアし 、その後のG.膣炎 またはPBS接種に適している( 図2C参照)。1群あたり10〜12匹のマウス(G.膣炎 接種対PBS)を得るためには、〜30匹のマウスを最初にUPECに感染させるべきである。さらに、統計的有意性を検出するために必要な生物学的複製を達成するためには、複数の実験が必要になる可能性が高い。ばく露を1wk間隔で行った場合、UPECの出現はPBSにばく露されたマウスの14%で発生した(図3B)。したがって、PBS対照(0.8で動力を与えられた;α=0.05[片側])と比較して 、G.膣炎 ばく露マウスにおけるUPEC rUTIの有意な増加を検出するには、各ばく露群について少なくとも40匹のマウスの累積合計を試験する必要がある。追加の考慮事項は、これらの実験が高価で労働集約的であるということです。マウスはUPECクリアランスについて毎週監視する必要があり、実験の時間経過は 、G. vaginalis が12時間の時間枠で2回与えられるか、または1wk間隔で2回与えられるかに応じて4〜5wkである。SEMは労働集約的であり、顕微鏡の可用性とサービス料によってはコストがかかる場合があります。SEM用に膀胱全体を準備すると、分析のための豊富な材料が提供されますが、欠点は、各膀胱の分析に時間がかかる可能性があることです。したがって、尿および組織力価に使用されるより高い動物数と比較して、限られた数の膀胱しかSEMによって分析できない可能性が高い。さらに、膀胱「カップ」の曲面の高品質の画像を得るには、視認性を妨げる可能性のある影のためにスキルが必要です。膀胱SEMは尿路上皮剥離を視覚化するための有用なツールであるが、この方法は主に定性的である。試料は丸く固定されており、また固定液にグルタルアルデヒドを使用しているため、蛍光発現菌を光学顕微鏡でスクリーニングすることはできない。免疫染色および化学染料は、ほとんどの抗原およびオスミウムを架橋し、抗原部位をマスクし、組織を暗くするグルタルアルデヒドの使用のために、このプロセスと互換性がない。つまり、SEM技術は、細胞サイズ48、49などの追加のプローブを使用せずに定量的に評価できるパラメータに有用です。
このモデルには、前述の方法以外にもいくつかの利点があります。これは、外部源から膀胱への再導入とは対照的に、膀胱リザーバからの出現によって引き起こされるUPEC rUTIのメカニズムの検討を可能にする。膀胱貯留層からの出現によるrUTIの他のモデルは、化学薬品(硫酸プロタミンまたはキトサン)を使用して尿路上皮剥離を引き起こし、17,18、これは女性のrUTIの引き金にはならない。G.膣炎は、一部の女性においてカテーテル法または恥骨上吸引を介して膀胱から直接収集された尿中に検出された一般的な泌尿生殖器細菌である23,26。この事実は、BV(G.膣炎が膣内で過剰に増殖する)とUTIとの間の既知の関連と相まって、G.膣炎がrUTIの臨床的にもっともらしい引き金であることを示唆している。最後に、in situ膀胱固定法は、膀胱の超構造を維持し、損傷を制限し、膀胱層が互いに分離しないようにする。尿路上皮を視覚化するための以前の方法は、伝統的に、使用者が無菌的に膀胱を収穫し、二等分し、伸ばし、そして伸ばして、伸ばした膀胱を固定液48に沈める前に、解剖トレイ上に膀胱をピン留めする。この方法は、非常に平坦なサンプルをもたらすが、組織の均一または自然なストレッチを保証せず、過度および下回るストレッチされた領域(非常にしわのある組織をもたらす)をもたらし、膀胱層分離を引き起こす可能性がある。さらに、組織を伸ばして固定するための膀胱のこれらの物理的操作は、尿路上皮剥離を含む損傷を引き起こす可能性がある。別の方法は、パラフィンに包埋し、ミクロトームで薄い切片を得る前に、無傷の膀胱を固定液に沈めることである。薄い切片は、細菌および宿主タンパク質の局在を調べるための免疫組織化学実験にとって非常に貴重ですが、薄い切片では尿路上皮表面の可視化はできません。このSEM法は、膀胱全体の表面を一度に検査することを可能にする。
記載されているように、このモデルの将来の用途には、他のUPEC株を試験して細胞内リザーバを形成するかどうかを判断し、他の G.膣 炎株を試験して剥離を誘発し、UPEC出現がrUTIを引き起こすかどうかを評価することが含まれる。C57BL/6マウス以外の他のマウス系統も試験され得るが、慢性膀胱炎を発症する傾向が高いマウス(C3Hバックグラウンドのマウスなど)は、実験から淘汰される必要があるマウスが多すぎるため、推奨されない。C57BL/6マウスのさらなる利点は、多くの遺伝子ノックアウト株が市販されていることである。このような株は、貯留層の形成および/または出現に関与する宿主因子を尋問する機会を提供する。
開示事項
著者らは、この研究に関連する利益相反はないと宣言している。
謝辞
著者らは、感染実験の技術支援をしてくれたLynne Foster、SEMへのアクセスについてワシントン大学セルアーイメージングセンター(WUCCI)のJames Fitzpatrick氏、UTI89kanR UPEC株についてScott Hultgren氏、原稿を批判的に読んだDavid Hunstad氏に感謝している。
この研究は、米国国立科学財団(VPO#DGE - 1143954の大学院研究フェローシップ)、ワシントン大学医学部の女性感染症研究センター(NMGへのパイロット研究賞)、米国心臓協会:#12POST12050583(NMG)および#14POST20020011(NMG)、および国立衛生研究所、NIAID:R01 AI114635(ALL)およびNIDDKの支援を受けました。 R21 DK092586 (すべて)、P50 DK064540-11 (SJH、プロジェクト III PI:ALL) および K01 DK110225-01A1 (NMG)動物実験のいくつかは、NCRR助成金C06 RR015502によって支援された施設で行われた。ワシントン大学細胞イメージングセンター(WUCCI;SEMが実施された場所)とMSJは、ワシントン大学医学部、ワシントン大学小児発見研究所、セントルイス小児病院(CDI-CORE-2015-505)、バーンズ・ユダヤ人病院財団(3770)、国立神経障害・脳卒中研究所(NS086741)の支援を受けた。資金提供者は、研究デザイン、データ収集と分析、出版の決定、または原稿の準備において何の役割も持っていませんでした。
資料
| Name | Company | Catalog Number | Comments |
| 30G x 1/2 needles | BD | 305106 | for catheters |
| 5 1/2" straight forcep hemostat | McKesson | 487377 | in situ bladder fixation |
| ACE 600 Sputter coater | Leica | SEM sample processing | |
| aluminum SEM stub | Ted Pella | 16111 | SEM sample processing |
| Calcium chloride | EMS | 12340 | in situ bladder fixation |
| conductive carbon adhesive tab | Ted Pella | 16084-1 | SEM sample processing |
| Conductive silver paint | Ted Pella | 16034 | SEM sample processing |
| CPD 300 Critical Point Drier | Leica | SEM sample processing | |
| Cytofunnel metal clip | Simport | M964B | cytospun urinalysis |
| Ethanol | EMS | 15050 | SEM sample processing |
| Glucose | Sigma | G7528 | for NYCIII G. vaginalis growth media |
| glutaraldehyde | EMS | 16320 | in situ bladder fixation |
| Hema 3 staining kit | Fisher | 23123869 | cytospun urinalysis |
| HEPES | Cellgro | 25-060-Cl | for NYCIII G. vaginalis growth media |
| iridium | Ted Pella | 91120 | SEM sample processing |
| isofluorane | mouse anaesthesia | ||
| kanamycin | Gibco | 11815024 | add to UPEC LB selective plates (50 ug/mL) |
| Luria-Bertani agar | BD | DF0445174 | UPEC growth plates |
| Luria-Bertani broth | BD | DF0446173 | UPEC growth media |
| Merlin FE-SEM | Zeiss | scanning electron microscope | |
| Milli-Q Water Purifier | Millipore | IQ-7000 | SEM sample processing |
| NaCl | Sigma | S3014 | for NYCIII G. vaginalis growth media |
| Olympus Vanox AHBT3 microscope | Olympus | cytospun urinalysis | |
| osmium tetroxide | EMS | 19170 | SEM sample processing |
| paraformaldehyde | EMS | 15710 | in situ bladder fixation |
| polyethylene tubing | Intramedic | 427401 | for catheters |
| Proteose Peptone #3 | Fisher | DF-122-17-4 | for NYCIII G. vaginalis growth media |
| PTFE coated double edge razor blade | EMS | 72000 | cutting bladders for SEM |
| Shandon Cytocentrifuge | Thermo Scientific | A78300002 | cytospun urinalysis |
| Shandon cytofunnel filter | Simport | M965FWDV | cytospun urinalysis |
| Shandon Double cytofunnel | Simport | M964-1D | cytospun urinalysis |
| Shandon double cytoslides (coated) | Thermo Scientific | 5991055 | cytospun urinalysis |
| sodium cacodylate trihydrate | EMS | 12310 | in situ bladder fixation |
| spectrophotometer | BioChrom | 80-3000-45 | measuring bacterial OD600 |
| streptomycin | Gibco | 11860038 | add to G. vaginalis NYCIII selective plates (1 mg/mL) |
| tuberculin slip tip syringe | BD | 309659 | for catheters |
| Yeast Extract | Fisher | DF0127-17-9 | for NYCIII G. vaginalis growth media |
参考文献
- Foxman, B. Urinary tract infection syndromes: occurrence, recurrence, bacteriology, risk factors, and disease burden. Infectious Disease Clinics of North America. 28 (1), 1-13 (2014).
- Foxman, B. Recurring urinary tract infection: incidence and risk factors. American Journal of Public Health. 80 (3), 331-333 (1990).
- Foxman, B. Epidemiology of urinary tract infections: incidence, morbidity, and economic costs. American Journal of Medicine. 113, Suppl 1A 5-13 (2002).
- Foxman, B. The epidemiology of urinary tract infection. Nature Reviews Urology. 7 (12), 653-660 (2010).
- Ikaheimo, R., et al. Recurrence of urinary tract infection in a primary care setting: analysis of a 1-year follow-up of 179 women. Clinical Infectious Diseases. 22 (1), 91-99 (1996).
- Russo, T. A., Stapleton, A., Wenderoth, S., Hooton, T. M., Stamm, W. E. Chromosomal restriction fragment length polymorphism analysis of Escherichia coli strains causing recurrent urinary tract infections in young women. Journal of Infectious Diseases. 172 (2), 440-445 (1995).
- Luo, Y., et al. Similarity and divergence of phylogenies, antimicrobial susceptibilities, and virulence factor profiles of Escherichia coli isolates causing recurrent urinary tract infections that persist or result from reinfection. Journal of Clinical Microbiology. 50 (12), 4002-4007 (2012).
- Schreiber, H. L. t, et al. Bacterial virulence phenotypes of Escherichia coli and host susceptibility determine risk for urinary tract infections. Science Translational Medicine. 9 (382), (2017).
- Rosen, D. A., Hooton, T. M., Stamm, W. E., Humphrey, P. A., Hultgren, S. J. Detection of intracellular bacterial communities in human urinary tract infection. PLoS Med. 4 (12), 329(2007).
- Elliott, T. S., Reed, L., Slack, R. C., Bishop, M. C. Bacteriology and ultrastructure of the bladder in patients with urinary tract infections. Journal of Infection. 11 (3), 191-199 (1985).
- Robino, L., et al. Detection of intracellular bacterial communities in a child with Escherichia coli recurrent urinary tract infections. Pathogens and Disease. 68 (3), 78-81 (2013).
- Robino, L., et al. Intracellular bacteria in the pathogenesis of Escherichia coli urinary tract infection in children. Clinical Infectious Diseases. 59 (11), 158-164 (2014).
- De Nisco, N. J., et al. Direct Detection of Tissue-Resident Bacteria and Chronic Inflammation in the Bladder Wall of Postmenopausal Women with Recurrent Urinary Tract Infection. Journal of Molecular Biology. 431 (21), 4368-4379 (2019).
- Mulvey, M. A., Schilling, J. D., Hultgren, S. J. Establishment of a persistent Escherichia coli reservoir during the acute phase of a bladder infection. Infection and Immunity. 69 (7), 4572-4579 (2001).
- Kerrn, M. B., Struve, C., Blom, J., Frimodt-Moller, N., Krogfelt, K. A. Intracellular persistence of Escherichia coli in urinary bladders from mecillinam-treated mice. Journal of Antimicrobial Chemotherapy. 55 (3), 383-386 (2005).
- Eto, D. S., Sundsbak, J. L., Mulvey, M. A. Actin-gated intracellular growth and resurgence of uropathogenic Escherichia coli. Cellular Microbiology. 8 (4), 704-717 (2006).
- Mysorekar, I. U., Hultgren, S. J. Mechanisms of uropathogenic Escherichia coli persistence and eradication from the urinary tract. Proceedings of the National Academy of Sciences of the United States of America. 103 (38), 14170-14175 (2006).
- Blango, M. G., Ott, E. M., Erman, A., Veranic, P., Mulvey, M. A. Forced resurgence and targeting of intracellular uropathogenic Escherichia coli reservoirs. PLoS One. 9 (3), 93327(2014).
- Gilbert, N. M., Lewis, A. L. Covert pathogenesis: Transient exposures to microbes as triggers of disease. PLoS Pathogens. 15 (3), 1007586(2019).
- Lewis, A. L., Gilbert, N. M. Roles of the vagina and the vaginal microbiota in urinary tract infection: evidence from clinical correlations and experimental models. GMS Infectious Diseases. 8, (2020).
- Janulaitiene, M., et al. Prevalence and distribution of Gardnerella vaginalis subgroups in women with and without bacterial vaginosis. BMC Infectious Diseases. 17 (1), 394(2017).
- Fredricks, D. N. Molecular methods to describe the spectrum and dynamics of the vaginal microbiota. Anaerobe. 17 (4), 191-195 (2011).
- Hilt, E. E., et al. Urine is not sterile: use of enhanced urine culture techniques to detect resident bacterial flora in the adult female bladder. Journal of Clinical Microbiology. 52 (3), 871-876 (2014).
- Klein, S., et al. Significant increase in cultivation of Gardnerella vaginalis, Alloscardovia omnicolens, Actinotignum schaalii, and Actinomyces spp. in urine samples with total laboratory automation. European Journal of Clinical Microbiology Infect Dis. 37 (7), 1305-1311 (2018).
- Pearce, M. M., et al. The female urinary microbiome in urgency urinary incontinence. American Journal of Obstetrics and Gynecology. 213 (3), 341(2015).
- Pearce, M. M., et al. The female urinary microbiome: a comparison of women with and without urgency urinary incontinence. mBio. 5 (4), 01283(2014).
- Gottschick, C., et al. The urinary microbiota of men and women and its changes in women during bacterial vaginosis and antibiotic treatment. Microbiome. 5 (1), 99(2017).
- Malki, K., et al. Genomes of Gardnerella Strains Reveal an Abundance of Prophages within the Bladder Microbiome. PLoS One. 11 (11), 0166757(2016).
- Kramer, H., et al. Diversity of the midstream urine microbiome in adults with chronic kidney disease. International Urology and Nephrology. 50 (6), 1123-1130 (2018).
- Allsworth, J. E., Peipert, J. F. Prevalence of bacterial vaginosis: 2001-2004 National Health and Nutrition Examination Survey data. Obstetrics & Gynecology. 109 (1), 114-120 (2007).
- Ravel, J., et al. Vaginal microbiome of reproductive-age women. Proceedings of the National Academy of Sciences of the United States of America. 108, Suppl 1 4680-4687 (2011).
- Hillier, S. L. Diagnostic microbiology of bacterial vaginosis. American Journal of Obstetrics and Gynecology. 169 (2), Pt 2 455-459 (1993).
- Amatya, R., Bhattarai, S., Mandal, P. K., Tuladhar, H., Karki, B. M. Urinary tract infection in vaginitis: a condition often overlooked. Nepal Medical College Journal. 15 (1), 65-67 (2013).
- Harmanli, O. H., Cheng, G. Y., Nyirjesy, P., Chatwani, A., Gaughan, J. P. Urinary tract infections in women with bacterial vaginosis. Obstetrics & Gynecology. 95 (5), 710-712 (2000).
- Sharami, S. H., Afrakhteh, M., Shakiba, M. Urinary tract infections in pregnant women with bacterial vaginosis. Journal of Obstetrics and Gynaecology. 27 (3), 252-254 (2007).
- Hillebrand, L., Harmanli, O. H., Whiteman, V., Khandelwal, M. Urinary tract infections in pregnant women with bacterial vaginosis. American Journal of Obstetrics and Gynecology. 186 (5), 916-917 (2002).
- Sumati, A. H., Saritha, N. K. Association of urinary tract infection in women with bacterial vaginosis. Journal of Global Infectious Diseases. 1 (2), 151-152 (2009).
- Gilbert, N. M., Lewis, W. G., Lewis, A. L. Clinical features of bacterial vaginosis in a murine model of vaginal infection with Gardnerella vaginalis. PLoS One. 8 (3), 59539(2013).
- Gilbert, N. M., O'Brien, V. P., Lewis, A. L. Transient microbiota exposures activate dormant Escherichia coli infection in the bladder and drive severe outcomes of recurrent disease. PLoS Pathogens. 13 (3), 1006238(2017).
- Wright, K. J., Seed, P. C., Hultgren, S. J. Uropathogenic Escherichia coli flagella aid in efficient urinary tract colonization. Infection and Immunity. 73 (11), 7657-7668 (2005).
- Garofalo, C. K., et al. Escherichia coli from urine of female patients with urinary tract infections is competent for intracellular bacterial community formation. Infection and Immunity. 75 (1), 52-60 (2007).
- Hannan, T. J., Mysorekar, I. U., Hung, C. S., Isaacson-Schmid, M. L., Hultgren, S. J. Early severe inflammatory responses to uropathogenic E. coli predispose to chronic and recurrent urinary tract infection. PLoS Pathogens. 6 (8), 1001042(2010).
- Hopkins, W. J., Gendron-Fitzpatrick, A., Balish, E., Uehling, D. T. Time course and host responses to Escherichia coli urinary tract infection in genetically distinct mouse strains. Infection and Immunity. 66 (6), 2798-2802 (1998).
- Conover, M. S., Flores-Mireles, A. L., Hibbing, M. E., Dodson, K., Hultgren, S. J. Establishment and Characterization of UTI and CAUTI in a Mouse Model. Journal of Visualized Experiments. (100), e52892(2015).
- Hannan, T. J., Hunstad, D. A. A Murine Model for Escherichia coli Urinary Tract Infection. Methods in Molecular Biology. 1333, 159-175 (2016).
- Zychlinsky Scharff, A., Albert, M. L., Ingersoll, M. A. Urinary Tract Infection in a Small Animal Model: Transurethral Catheterization of Male and Female Mice. Journal of Visualized Experiments. (130), e54432(2017).
- Thai, K. H., Thathireddy, A., Hsieh, M. H. Transurethral induction of mouse urinary tract infection. Journal of Visualized Experiments. (42), e2070(2010).
- O'Brien, V. P., et al. A mucosal imprint left by prior Escherichia coli bladder infection sensitizes to recurrent disease. Nature Microbiology. 2, 16196(2016).
- O'Brien, V. P., Dorsey, D. A., Hannan, T. J., Hultgren, S. J. Host restriction of Escherichia coli recurrent urinary tract infection occurs in a bacterial strain-specific manner. PLoS Pathogens. 14 (12), 1007457(2018).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved