Method Article
Рецидивирующая инфекция мочевыводящих путей Escherichia coli , вызванная воздействием Gardnerella vaginalis на мочевой пузырь у мышей
В этой статье
Резюме
Показана мышиная модель уропатогенной трансуретральной инокуляции E. coli (UPEC) для установления скрытых внутриклеточных резервуаров мочевого пузыря и последующего воздействия G. vaginalis на мочевой пузырь с целью индуцирования рецидивирующей ИМП УПЭК. Также продемонстрировано перечисление бактерий, цитология мочи и фиксация и обработка мочевого пузыря in situ для сканирующей электронной микроскопии.
Аннотация
Рецидивирующие инфекции мочевыводящих путей (rUTI), вызванные уропатогенной кишечной палочкой (UPEC ), являются распространенными и дорогостоящими. Предыдущие статьи, описывающие модели ИМП у самцов и самок мышей, иллюстрируют процедуры бактериальной инокуляции и перечисления в моче и тканях. Во время первоначальной инфекции мочевого пузыря у мышей C57BL/6 УПЭК устанавливает латентные резервуары внутри эпителиальных клеток мочевого пузыря, которые сохраняются после клиренса бактериурии УПЭК. Эта модель основана на этих исследованиях для изучения rUTI, вызванного появлением UPEC из латентных резервуаров мочевого пузыря. Урогенитальная бактерия Gardnerella vaginalis используется в качестве триггера rUTI в этой модели, потому что она часто присутствует в урогенитальных путях женщин, особенно в контексте дисбактериоза влагалища, который был связан с ИМП. Кроме того, также описан метод фиксации мочевого пузыря in situ с последующим сканирующей электронной микроскопией (SEM) анализа ткани мочевого пузыря с потенциальным применением к другим исследованиям с участием мочевого пузыря.
Введение
Инфекции мочевыводящих путей (ИМП) налагают значительное бремя на здравоохранение во всем мире, влияя на качество жизни миллионов людей каждый год, особенно женщин1. Уропатогенная кишечная палочка (УПЭК) является наиболее частой причиной ИМП1. Многие пациенты (примерно 20-30%), у которых развивается ИМП, будут испытывать рецидивирующий ИМП (rUTI) в течение 6 месяцев, несмотря на опосредованный антибиотиками клиренс первоначальной инфекции2. К сожалению, целых 5% женщин в пременопаузе страдают от 3 или более rUTI каждый год 3,4. Последовательные эпизоды rUTI могут быть вызваны персистенцией одного и того же штамма УПЭК из индексного случая 5,6,7,8. Данные с человеческих образцов и моделей мышей свидетельствуют о том, что rUTI одного и того же штамма может быть вызван УПЭК, находящимся в покоящихся резервуарах в мочевом пузыре. У человека УПЭК были обнаружены в эпителиальных клетках и биопсии мочевого пузыря пациентов с ИМП 9,10,11,12,13. Исследования на мышах C57BL/6 показали, что некоторые штаммы УПЭК могут создавать покоящиеся внутриклеточные резервуары в мочевом пузыре, обнаруженные флуоресцентной микроскопией и гомогенизацией и культивированием ткани мочевого пузыря, которые сохраняются в течение нескольких месяцев после разрешения бактериурии 14,15,16. Лечение мочевого пузыря агентами, которые индуцируют отшелушивание эпителия мочевого пузыря (уротелия), например, протамин сульфат17 или хитозан18, вызывают появление УПЭК из резервуаров, чтобы вызвать rUTI. Эти данные свидетельствуют о том, что у женщин, имеющих резервуары УПЭК мочевого пузыря от предшествующей инфекции, воздействие мочевого пузыря, которое приводит к мочеполовому отшелушиванию, может вызвать rUTI.
Появляется все больше доказательств того, что микробиота влагалища способствует инфекции мочевыводящихпутей 19,20. Gardnerella vaginalis является частым членом микробиоты влагалища и мочи 21,22,23,24,25,26,27,28,29. Во влагалище наличие высоких уровней G. vaginalis связано с микробным дисбактериозом, известным как бактериальный вагиноз (BV), который поражает ~ 30% женщин 30,31,32. Женщины с БВ подвергаются более высокому риску развития ИМП по сравнению с женщинами с вагинальным сообществом, в котором преобладают Lactobacillus 33,34,35,36,37. На мышиных моделях G. vaginalis вызывает эпителиальное отшелушивание как во влагалище38, так и в мочевом пузыре39. У мышей C57BL/6, имеющих резервуары мочевого пузыря UPEC, два последовательных воздействия G. vaginalis на мочевой пузырь, но не на PBS, приводят к повторному появлению UPEC из резервуаров, чтобы вызвать UPEC rUTI. О появлении титров УПЭК свидетельствует появление титров УПЭК в моче у мышей, у которых ранее разрешилась бактериурия УПЭК, и последующее снижение гомогенатных титров мочевого пузыря УПЭК при жертвоприношении по сравнению с контрольными животными, подвергшимися воздействию ПБС39. Интересно, что нет длительной колонизации G. vaginalis в мочевом пузыре. В подавляющем большинстве случаев двух коротких воздействий, каждое с менее чем 12 (ч) жизнеспособного G. vaginalis в моче, достаточно, чтобы вызвать уротелиальное отшелушивание и способствовать rUTI.
Этот протокол описывает мышиную модель rUTI, вызванную UPEC, находящуюся во внутриклеточных резервуарах мочевого пузыря, используя прививку мочевого пузыря G. vaginalis для запуска рецидива. Прогресс, достигнутый этой моделью, заключается в том, что G. vaginalis является клинически значимым биологическим триггером rUTI по сравнению с ранее используемыми химическими агентами. Кроме того, относительно кратковременная выживаемость G. vaginalis в мочевыводящих путях мыши позволяет исследовать влияние преходящих микробных воздействий на уротелий, которое может произойти после сексуальной активности. В дополнение к описанию модели rUTI, этот протокол также описывает методы цитологии мочи и фиксации мочевого пузыря in situ и визуализации уротелия с помощью сканирующей электронной микроскопии (SEM).
Этот протокол G. vaginalis-индуцированного рецидивирующего UPEC UTI использует штамм UPEC UTI89 с кассетой с резистентностью к канамицину (UTI89kanR)40. Не все тестируемые штаммы УПЭК смогли сформировать внутриклеточные бактериальные сообщества на стадии острой инфекции у мышей41 и пока неизвестно, обладают ли все штаммы УПЭК способностью образовывать латентные внутриклеточные резервуары. Формирование коллектора должно быть подтверждено до использования других штаммов УПЭК в модели. Этот протокол использует спонтанный стрептомицин-резистентный изолят G. vaginalis , JCP8151BSmR38. Индукция rUTI С помощью JCP8151BSmR требует двух последовательных прививок G. vaginalis , проводимых либо через 12 ч, либо через 7 дней (d) с интерваломв 39. Независимо от того, вызывают ли другие штаммы G. vaginalis отшелушивание и / или UPEC rUTI, еще предстоит определить с помощью этой модели. Важно использовать штаммы UPEC и G. vaginalis с известной устойчивостью к антибиотикам (такие как канамицин или спектиномицин для UPEC и стрептомицин для G. vaginalis), поскольку антибиотики могут быть добавлены к агаровым пластинам для предотвращения роста эндогенной микробиоты мыши, которая в противном случае могла бы помешать перечислению колониеобразующих единиц (КОЕ) для мониторинга инфекции. Это особенно важно для культивирования образцов мочи, потому что моча мыши часто содержит другие бактерии, которые могут разрастаться на культуральных пластинах без антибиотиков. Происхождение этих эндогенных бактерий в моче мышей неизвестно, но, вероятно, отражает периуретральные и урогенитальные бактерии, обнаруженные во время сбора мочи.
G. vaginalis является факультативной анаэробной бактерией и, следовательно, этот протокол описывает выращивание G. vaginalis JCP8151BSmR в анаэробной камере. Если анаэробная камера недоступна, могут быть использованы другие методы поддержания анаэробных условий роста (например, мешочек GasPak в герметичном контейнере). В качестве альтернативы, некоторые штаммы G. vaginalis (включая JCP8151BSmR) будут расти в стандартном инкубаторе тканевых культур (5% CO2). Точно так же, как использование штаммов G. vaginalis , отличных от JCP8151BSmR , требует тестирования для обеспечения того, чтобы бактерии вели себя аналогично в этой модели, изменение условий роста требует эмпирического определения идеальных длительностей для культуры (на пластинах и в жидкости) и эквивалентов оптической плотности (OD) 600 для достижения желаемых жизнеспособных концентраций инокулята. Более того, неизвестно, влияют ли условия роста на патобиологию G. vaginalis.
Наконец, при рассмотрении вопроса о том, следует ли использовать эту модель, исследователи должны знать, что для нее может потребоваться большее количество животных в группе, чем для типичных моделей мышей с ИМП. Отчасти это связано с тем, что индукция rUTI требует, чтобы мыши разрешили бактериурию UPEC, вызванную первоначальной инфекцией мочевого пузыря. Таким образом, любая мышь, которая не может очистить бактериурию (фенотип, обычно указывающий на продолжающуюся почечную инфекцию), не включается в фазу rUTI протокола. На количество мышей, необходимых для питания этих исследований, также влияет скорость «спонтанного» появления УПЭК в моче (в среднем 12-14%). Наконец, различные штаммы мышей имеют разную склонность к развитию хронической бактериурии по сравнению с внутриклеточным образованием резервуаров42,43. При использовании в этой модели штаммов мышей, отличных от C57BL/6, необходимо подтвердить, что у животных развиваются покоящиеся внутриклеточные резервуары УПЭК.
протокол
Комитет по институциональному уходу и использованию животных Вашингтонского университета (IACUC) одобрил все мышиные инфекции и процедуры в рамках протокола No 20170081, срок действия которого истек 06/09/2020, и 20-0031, который истекает 18.03.2023. Общий уход за животными соответствовал Руководству по уходу за лабораторными животными и их использованию от Национального исследовательского совета и Руководству по ресурсам по уходу за животными Министерства сельского хозяйства США. Процедуры эвтаназии соответствуют Руководству AVMA по эвтаназии животных: издание 2020 года.

Рисунок 1. Схема мышиной модели. Временная шкала выделена для отражения этапов или процедур модели, изложенных в протоколе. Фаза 1 (оранжевый): Создание внутриклеточных резервуаров УПЭК. Мышей трансуретрально инокулируют УПЭК, а образцы мочи собирают и контролируют на клиренс бактериурии. Только мыши, очищающие бактериурию, переходят к последующим фазам. Фаза 2 (зеленая): Воздействие мочевого пузыря на G. vaginalis. Мышей прививают трансуретрально G. vaginalis два раза. Продолжительность времени между двумя последовательными экспозициями составляет либо 12 ч (верхняя панель), либо 1 неделя (нед; нижняя панель), в зависимости от желаемого последующего анализа. Фаза 3 (желтая): УПЭК рути. Моча собирается ежедневно после воздействия G. vaginalis и контролируется на предмет бактериурии УПЭК. Кроме того, мочевой пузырь и почки могут быть собраны в экспериментальной конечной точке для измерения титров тканей UPEC. В модели воздействия 1 недели G. vaginalis-индуцированное появление UPEC из внутриклеточных резервуаров и последующий клиренс из мочевыводящих путей также отражаются в снижении титров тканей мочевого пузыря UPEC (по сравнению с мышами, подвергшимися воздействию PBS, см. Рисунок 3D). Это снижение титров мочевого пузыря не было очевидным в модели 12-часового воздействия, по-видимому, потому, что требуется больше времени для достаточного возникновения резервуара и клиренса, чтобы значительно уменьшить титры тканей. Процедура A: Цитология мочи обычно выполняется 1 dpi (или даже раньше) во время фазы 1 для изучения острой инфекции UPEC и во время фазы 3 для оценки содержания PMN в моче, которое коррелирует с появлением UPEC. Образцы мочи, собранные в другие моменты времени, могут быть аналогичным образом проанализированы. Процедура B: Сканирующая электронная микроскопия мочевого пузыря (SEM) для изучения уротелиального отшелушивания обычно выполняется в 12-часовой модели через 3 ч после второго воздействия G. vaginalis (через 15 ч после введения первого воздействия в момент 0). Другие временные точки также могут быть оценены, например, через 6-24 ч после прививки УПЭК, как показано в фазе 1. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
1. Создание покоящихся внутриклеточных резервуаров УПЭК у мышей
- Подготовьте мочевые катетеры (см. 44,45,46,47 для видео этого шага).
- Нитки 30 Калибра с длиной трубки PE10 простираются от основания иглы до нескольких мм за кончик иглы. Позаботьтесь о том, чтобы не проколоть трубку кончиком иглы. В качестве альтернативы используют детские внутривенные канюли46.
- Поместите подготовленные катетеры в чашку Петри и стерилизуйте ультрафиолетовым светом не менее 30 мин. Замените крышку чашки Петри и закрепите ее для хранения до тех пор, пока это не понадобится.
- Приготовить инокулят УПЭК (День -3 до 0)
- День -3: Streak UTI89kanR от -80 °C морозильной камеры на агаровую пластину Luria-Bertani (LB). Инкубировать пластину при 37 °C в течение 18-24 ч.
ПРИМЕЧАНИЕ: Нет необходимости добавлять канамицин в среду роста инокулята, поскольку резистентность к канамицину стабильно интегрирована в UTI89kanR. - День -2: Привить 20 мл бульона LB в стерильную колбу 125 мл с одной колонией UTI89kanR. Не используйте колбу меньшего размера, потому что этот метод культивирования важен для индуцирования экспрессии пилуса УПЭК типа 1, который необходим для адгезии мочевого пузыря.
- Инкубировать статически (без встряхивания) при 37 °С в течение 18-24 ч. Не добавляйте антибиотики в питательную среду. Используйте только свежие колонии на пластинах LB (18-24 часа назад), чтобы начать жидкие культуры.
- День -1: Субкультура UTI89kanR путем удаления 20 мкл культуры (осторожно закрутите колбу для повторного суспендирования осевших бактерий) и добавления к 20 мл свежего бульона LB в стерильную колбу 125 мл. Инкубировать как на этапе 2, за исключением твердой продолжительности 18 ч. Не добавляйте антибиотики в питательную среду.
- День 0: Переложите всю культуру в пробирку объемом 50 мл и вращайте при 3200 × г в настольной центрифуге в течение 10 минут для гранулированных бактерий. Аспират супернатант и повторно суспендируют бактериальную гранулу в 10 мл PBS.
- Добавьте 100 мкл концентрированной бактериальной суспензии со стадии 4 до 900 мкл PBS в кювету и определите оптическую плотность при 600 нм (OD600) с помощью спектрофотометра, который был заглушен PBS. Умножьте значение спектрофотометра на 10 (чтобы учесть разбавление), чтобы определить OD600 суспензии (суспензии OD).
- Чтобы достичь желаемой концентрации инокулята 1 х 107 КОЕ в 50 мкл, разбавляют (или концентрируют) суспензию UTI89kanR , используя следующее уравнение, в котором желаемыйИнокулят OD составляет 0,35 (значение может варьироваться для других штаммов УПЭК), а Y - необходимый объем инокулята (100 мкл на мышь, чтобы позволить дополнительно устранить пузырьки и заполнить катетеры):
X мл x ODсуспензия = Y мл x ODinoculum
Например, если значениесуспензии OD составляет 4,7 и требуется 5 мл инокулята:
X мл × 4,7 = 5 × 0,35
X = (5 × 0,35) / 4,7
X = 0,372 мл
Поэтому добавьте 372 мкл бактериальной суспензии, чтобы получить 5 мл (конечный объем) - Используйте многоканальную пипетку, чтобы сделать последовательные разведения инокулята в соотношении 1:10 до 10-6 в стерильном PBS в 96-луночной пластине. Пятнистые реплики всех 6 разведений по 10 мкл на пластине LB и LB+kan, позволяют пятнам высохнуть и инкубируют при 37 °C в течение ночи. Пластина LB без антибиотиков используется для обеспечения того, чтобы инокулятор не был загрязнен другим организмом (который будет выглядеть как дополнительная морфология колонии, отсутствующая на пластине выбора антибиотика кан). Оба типа пластин должны давать одинаковый результат.
ПРИМЕЧАНИЕ: Тарелкам следует дать высохнуть на столешнице в течение дня перед использованием, чтобы они впитывали покрытую жидкость без образования пятен. - Подсчитайте общее количество колоний во всех точках разведения с различимыми колониями и используйте значение для расчета фактической дозы инокулята, используемой в каждом эксперименте. Не просто полагайтесь на значения OD600 .
- День -3: Streak UTI89kanR от -80 °C морозильной камеры на агаровую пластину Luria-Bertani (LB). Инкубировать пластину при 37 °C в течение 18-24 ч.
- Инокулировать UTI89kanR в мочевой пузырь обезболенных самок мышей (День 0)
ПРИМЕЧАНИЕ: Видеозаписей этой процедуры было опубликовано ранее44,46. Обратитесь к этим статьям для более подробного описания. См. раздел 5 этого протокола для получения более подробной информации о катетеризации мышей.- Обезболивание мышей ингаляцией изофлурана в соответствии с методами, одобренными IACUC.
- Ожидая, что мыши станут анестезированными, заполните туберкулиновый шприц инокулятом UTI89kanR , а затем прикрепите подготовленный катетер. Нажмите на плунжер, чтобы удалить воздух из катетера, затем смажьте катетер в стерильную хирургическую смазку.
- Расположите мышь на спине и подтвердите обезболивание, крепко сжав подножку мыши и наблюдая отсутствие рефлекса или реакции. Расположите мочевой пузырь (ощущается как горох в нижней части живота) между указательными пальцами каждой руки. Сцеживают мочу, двигая пальцами навстречу друг другу, чтобы применить мягкое сжимающее давление на мочевой пузырь.
- Вставьте катетер через мочеиспускательный канал мыши в мочевой пузырь и медленно доставьте 50 мкл инокулята.
- Подождите несколько секунд, а затем аккуратно извлеките катетер, вытащив прямо. Верните мышь в клетку и следите за тем, пока она не оправится от анестезии.
- Повторите шаги 1.3.1 - 1.3.5 с дополнительными мышами, меняя катетер между каждой клеткой (5 мышей). При желании та же процедура может быть использована для инокуляции контрольной группы мышей PBS, например, чтобы показать, что другой штамм G. vaginalis вызывает rUTI (на спонтанном / фоновом уровне).
2. Мониторинг клиренса бактериурии УПЭК (дни с 1 по 28)
ПРИМЕЧАНИЕ: Видео процедуры сбора мочи было опубликовано ранее44.
- Собирать мочу (минимум 10 мкл) у всех мышей путем пальпации мочевого пузыря, как описано44 через 1 d после заражения и еженедельно в течение 4 недель (7, 14, 21 и 28 d после заражения). Моча должна быть культивирована в течение нескольких часов после сбора, чтобы контролировать инфекцию УПЭК. Хранить мочу при температуре 4 °C до покрывания. Моча также может быть использована для цитологии (см. Раздел 4). Иногда, если мочевой пузырь сильно воспален, 10 мкл мочи не могут быть получены; в этом случае PBS может быть добавлен до 10 мкл, но бактериальный титр мочи и цитологические показатели должны быть соответствующим образом скорректированы (например, если собрано только 5 мкл мочи и добавлено 5 мкл PBS, умножьте титры и баллы на 2).
- С помощью многоканальной пипетки делайте последовательные разбавления 1:10 до 10-6 в стерильных PBS в 96-луночной пластине. Используйте многоканальную пипетку P10 для обнаружения 10 мкл всех 6 разведений из колонки 1 в вертикальной ориентации на левом краю пластины LB, содержащей соответствующий маркер выбора антибиотика. Отбросьте наконечники.
- Повторите обшивку с остальными образцами (колонка 2, затем колонка 3 и т.д.). Одна пластина может вместить 5 образцов бок о бок. Получается пластина с 5-× 6-точечной матрицей, с увеличением разбавлений сверху вниз и увеличением количества образцов слева направо (рисунок 2А).
- Дайте пятнам высохнуть на столешнице, затем высиживайте при 37 °C в течение ночи. На следующий день подсчитайте количество колоний в наименее разбавленном месте, в котором колонии различаются (рисунок 2B), и используйте это число для расчета КОЕ/мл:
количество колоний в одном пятне мочи × фактор разбавления × 100 = КОЕ/мл мочи - График титров мочи UTI89kanR с помощью графического программного обеспечения (рисунок 2C). Идентифицировать мышей, у которых нет обнаруживаемого UTI89kanR в моче при 28 d (~ 65-80% мышей C57BL / 6). Эти мыши имеют покоящиеся внутриклеточные резервуары и используются в последующей экспериментальной фазе для изучения индукции рецидивирующей ИМП. Те, у кого бактерии в моче при 28 сут, не включаются в последующие этапы.
3. Воздействие G. vaginalis на мочевой пузырь
- Назначают мышам в группы воздействия (29-й день). Основная цель этого шага состоит в том, чтобы избежать объединения всех мышей с более длительной бактериурией в одну и ту же группу воздействия, поскольку неизвестно, влияет ли это на вероятность rUTI.
- Используя данные КОЕ мочи (рисунок 2D), классифицируйте мышей на основе точки времени, в которую бактериурия UTI89kanR больше не обнаруживалась (рисунок 2E).
- Рандомизируйте мышей из каждой категории в группы инокуляции G. vaginalis или PBS; например, половина мышей, которые очистились до 7-го дня, получают G. vaginalis , а половина получает PBS; половина мышей, которые очистились между 8 и 14 днями, получат G. vaginalis , а половина получит PBS и т. Д. (как на рисунке 2E).
- Приготовить G. vaginalis inoculum (все этапы выполняются в анаэробной камере)
ПРИМЕЧАНИЕ: Время инкубации идеальной культуры варьируется между различными штаммами G. vaginalis, причем некоторые штаммы входят в стационарную фазу и даже начинают умирать быстрее, чем другие. Это особенно важно, учитывая, что убитый G. vaginalis (JCP8151B) не смог вызвать rUTI39. Таким образом, время инкубации должно быть определено эмпирически для данного штамма до проведения экспериментов на мышах. Неизвестно, будут ли другие/все штаммы G. vaginalis вызывать те же эффекты в этой модели.- Штамм Streak G. vaginalis от -80 °C в морозильной камере на пластине NYCIII (без антибиотиков). Инкубировать пластину при 37 °C анаэробно в течение 24 ч.
- В анаэробной камере инокулируют 5 мл анаэробной среды NYCIII петлей клеток 1 мкл (одной колонии недостаточно) из пластины NYCIII и статически инкубируют культуру при 37 °C в анаэробных условиях в течение 18 ч. Не включайте антибиотики в питательную среду.
- Определите OD600 культуры с помощью спектрофотометра.
- Центрифугировать определенный объем (X) культуры при 9600 × г в течение 1 мин и аспирировать среду. Рассчитайте объем (Y) PBS для повторной приостановки гранулы для достижения желаемого OD инокулята для достижения 108 КОЕ в 50 мкл, используя следующее уравнение:
X мл ×культуры OD = Y мл × ODинокулятивного решения для Y
Y = (X мл ×культуре OD) / ODinoculum
ПРИМЕЧАНИЕ:Инокулятивный OD для JCP8151BSmR равен 5, но это должно быть определено эмпирически для других штаммов G. vaginalis . Например, при вращании 3 мл ночной жидкой культуры JCP8151BSmR скультурой OD = 2,0: Y= (3 мл × 2,0) / 5,0; поэтому повторное суспендирование гранул в 1,2 мл PBS - Повторно суспендировать бактериальную гранулу в PBS до нужной концентрации. Последовательно разбавляйте и намазывайте инокулятив (как описано в протоколе покрытия КОЕ выше), чтобы определить фактическую дозу инокулята, которая была использована в каждом эксперименте. Не просто полагайтесь на значения OD.
- Центрифугировать определенный объем (X) культуры при 9600 × г в течение 1 мин и аспирировать среду. Рассчитайте объем (Y) PBS для повторной приостановки гранулы для достижения желаемого OD инокулята для достижения 108 КОЕ в 50 мкл, используя следующее уравнение:
- На 29-31 день после прививки УПЭК инокулируют анестезированных мышей G. vaginalis или PBS, как описано на этапе 1.3 выше. Контрольная группа PBS имеет важное значение, так как акт катетеризации мочевого пузыря может вызвать повреждение и мочеполовое отшелушивание, которые могут вызвать некоторую степень повторного возникновения резервуара UPEC. Таким образом, мыши, привитые PBS, служат контролем, с которым сравниваются мыши, привитые G. vaginalis.
ПРИМЕЧАНИЕ: Окончательное определение бактериурии УПЭК при 28 d требует ночной инкубации пластины КОЕ. Таким образом, самый ранний этот этап может быть выполнен через 29 дней после первоначальной прививки УПЭК. При необходимости экспозиция может быть дана уже на 31-й день. Исследователи должны быть последовательными между экспериментами. - Повторите препарат инокулята для введения второй инокуляции G. vaginalis (или PBS control) в желаемый момент времени, например, через 12 ч или 1 нед после первой прививки. Повторное воздействие необходимо, поскольку однократная прививка G. vaginalis не приводит к значительному возникновению УПЭК39.
4. Мониторинг рецидивирующих ИМП УПЭК
- Собирайте мочу у мышей в желаемые моменты времени после каждой инокуляции G. vaginalis (рекомендуется 1, 2 и 3 d после инокуляции).
- Последовательно разбавляют и пластинчатую мочу на селективных пластинах (например, LB+канамицин) для определения UTI89kanR КОЕ/мл. При желании разведения мочи также могут быть нанесены на селективные пластины (например, NYCIII + 1 мг/мл стрептомицина) для определения КОЕ G. vaginalis /мл. Тем не менее, G. vaginalis JCP8151BSmR был очищен из мочи большинства мышей через 12 ч 39. Поэтому более ранние временные точки были бы необходимы для обнаружения G. vaginalis у большинства мышей.
- В экспериментальной конечной точке (например, через 3 d после второй прививки G. vaginalis) жертвуют мышей в соответствии с утвержденными методами (например, вывих шейки матки под изофлурановой анестезией или ингаляциейCO2) и собирают мочевой пузырь и почки для перечисления КОЕ, как описано ранее 44,46.
5. Цитология мочи
ПРИМЕЧАНИЕ: Эта процедура может быть выполнена в любой момент времени, когда требуется визуализация клеток и/или бактерий, присутствующих в моче. Как показано на рисунке 1, цитология мочи обычно выполняется при 1 dpi (или даже раньше) во время фазы 1 для изучения острой инфекции UPEC и во время фазы 3 для оценки наличия полиморфноядерных (PMN) клеток в моче, которые демонстрируют появление UPEC.
- Добавьте 10 мкл мочи к 90 мкл PBS в цитофуннельной кассете с прикрепленным фильтром и слайдом. (Самый простой метод заключается в использовании оставшейся части разведения 1:10 из 96-луночной пластины, используемой для культивирования мочи; эти образцы могут быть использованы до 24 ч после культивирования мочи при хранении при 4 °C). Поместите кассеты в цитоцентрифугу и вращайте при 600-800 x g в течение 6 мин с высоким ускорением.
- Снимите горки и дайте высохнуть за ночь. На следующий день окрашивание гематологическим набором для окрашивания (например, Wright's, Giemsa, включая фиксатор) согласно протоколу производителя.
- Проанализируйте слайды с помощью световой микроскопии на наличие ПМН и эпителиальных клеток. При желании они могут быть оценены с использованием качественной метрики оценки, основанной на обилии каждого типа клеток, присутствующих в каждом мощном поле зрения (например, 0 = нет, 1 = несколько, 2 = умеренный, 3 = надежный). Убедитесь, что человек, анализирующий слайды, ослеплен экспериментальными группами, чтобы свести к минимуму потенциальную предвзятость.
6. Визуализация мочевых пузырей с помощью сканирующей электронной микроскопии
ПРИМЕЧАНИЕ: Эта процедура может быть выполнена в любой момент времени, когда требуется визуализация уротелия. Как показано на рисунке 1 (фиолетовые коробки), взаимодействия УПЭК-уротелия лучше всего визуализируются между 6 ч и 24 ч после инокуляции УПЭК во время фазы формирования резервуара, а уротелиальное отшелушивание, вызванное G. vaginalis , лучше всего визуализируется между 3 ч и 12 ч после второго воздействия G. vaginalis .
- Фиксация мочевого пузыря in situ
- Готовят фиксатор непосредственно перед сбором мочевого пузыря, добавляя глутаровый альдегид (2,5% финала) и параформальдегид (2% конечный) в буфер какодилата натрия 0,15 М с 2 мМCaCl2 при рН 7,4. Используйте параформальдегид и глутаральдегид из недавно открытых стеклянных ампул, так как оба фиксатора со временем окисляются в открытых контейнерах.
ВНИМАНИЕ: Глутаральдегид токсичен, является раздражителем дыхания и коррозионным; параформальдегид является легковоспламеняющимся, канцерогенным, раздражителем и репродуктивным токсином; какодилат натрия токсичен и канцерогенен. - Чтобы получить 50 мл фиксирующего раствора, добавляют 6,25 мл 16% параформальдегида, 2 мл 50% глутаральдегида и 16,75 мл сверхчистой воды к 25 мл 0,3 М раствора какодилата натрия при рН 7,4 с 4 мМ CaCl2.
- Согрейте приготовленное фиксатор до 37 °C перед введением в мочевой пузырь.
- Наполните туберкулиновый шприц с скользящим наконечником фиксатором и прикрепите катетер к концу, скосом облицовав противоположные шприцевые отметины. Отрежьте лишнюю трубку на 1-2 мм от конца иглы, следя за тем, чтобы не обнажить кончик иглы. Проведите шприцем, чтобы удалить пузырьки и подтолкнуть плунжер к пустому воздуху, и заполните катетер фиксатором над трубкой микроцентрифуги, чтобы собрать любое фиксатор для надлежащей утилизации.
- Обезболить и принести в жертву мышь с помощью одобренного метода (например, вывих шейки матки под наркозом). Поместите мышь на рассекающую поверхность с закрепленными ножками (резинками или булавками). Откройте область таза мыши щипцами и хирургическими ножницами, чтобы обнажить мочевой пузырь. Осторожно отодвиньте в сторону соседний жир, но оставьте мочевой пузырь на месте.
- Держите шприц доминирующей рукой с иглой, направленной вниз, и игольчатым скосом и отметинами шприца, обращенными в сторону от вас. Окуните наконечник катетера в стерильную смазку.
- Расположите наконечник катетера в отверстии уретры, удерживая ствол шприца под углом 30-45° над телом мыши.
- Приложите давление вниз, используя очень небольшое движение по часовой стрелке с наконечником и осторожно вставьте катетер в уретру. Когда кончик катетера входит в уретру, откидывайте шприц к хвосту мыши, продолжая скользить катетер дальше в уретру, пока ствол шприца не будет параллельен рабочей поверхности. Весь ствол иглы катетера (не включая основание) должен войти в мышь, расположив кончик катетера в просвете мочевого пузыря.
- Медленно доставляют 50-80 мкл фиксатора, заставляя мочевой пузырь надуваться, как воздушный шар. Держите катетер на месте и слегка приподнимите шприц, наклонив наконечник вверх.
- Другой рукой откройте гемостат и сдвиньте один зубец под иглу катетера на пересечении уретры. Частично закройте гемостат до тех пор, пока он просто не вступит в контакт с иглой.
- Осторожно выдвиньте иглу катетера из мочевого пузыря, одновременно зажимая и полностью блокируя гемостат, чтобы предотвратить потерю фиксирующего средства.
- Захватите гемостат так, чтобы он находился параллельно рабочей поверхности с упирающимся сверху мочевым пузырем. Осторожно поднимите вверх и аккуратно разрезайте под гемостатом (противоположную сторону мочевого пузыря), чтобы удалить мочевой пузырь с прикрепленным гемостатом.
- Поместите мочевой пузырь и прикрепленный гемостат в трубку Falcon, содержащую подогретый фиксатор. Убедитесь, что мочевой пузырь полностью погружен в жидкость и не прижат к стенкам трубки. Инкубировать при 4 °C в течение 24 ч.
- Готовят фиксатор непосредственно перед сбором мочевого пузыря, добавляя глутаровый альдегид (2,5% финала) и параформальдегид (2% конечный) в буфер какодилата натрия 0,15 М с 2 мМCaCl2 при рН 7,4. Используйте параформальдегид и глутаральдегид из недавно открытых стеклянных ампул, так как оба фиксатора со временем окисляются в открытых контейнерах.
- Обработка и визуализация мочевого пузыря с помощью сканирующей электронной микроскопии (SEM)
- Сагиттально пополам мочевой пузырь очищенным, двусторонним лезвием бритвы и сделайте второй разрез по касательной к гемостату, чтобы освободить мочевой пузырь. Это приводит к 2 полупузырным «чашкам». Если на внешней стороне мочевого пузыря есть какие-либо оставшиеся жировые подушечки, аккуратно удалите их.
- Промыть половинки мочевого пузыря три раза (по 10 мин) в буфере какодилата натрия (0,15 М, рН 7,4).
- Окрашивают ткань 1% тетроксидом осмия в 0,15 М какодилатного буфера в течение 1 ч при комнатной температуре. Осмий чувствителен к свету; поэтому выполните этот этап с окрашивающим сосудом, обернутым в фольгу, чтобы сохранить темную среду.
ВНИМАНИЕ: Тетроксид осмия токсичен и разъедает кожу. Сделайте этот шаг в вытяжном капюшоне в перчатках. - Промыть половинки мочевого пузыря три раза (по 10 мин) в сверхчистой воде. Во время этих этапов осмикатированное масло иногда можно увидеть на поверхности воды. Аспирируйте или отключите его, чтобы предотвратить загрязнение во время этапов сушки.
- Обезвоживание тканей путем погружения в градуированную серию этанола (50, 70, 90, 100 и 100%) в течение 10 мин каждая.
- Высушите неподвижную ткань с помощью сушилки критической точки, выполняющей 12 обменов CO2 на самой медленной скорости. Установите все дополнительные настройки на замедление, за исключением шага вентиляции, который установлен на быстрый.
- Снова разделите каждый мочевой пузырь пополам чистой двусторонней бритвой, чтобы получить 4 общих кусочка, чтобы уменьшить кривизну образца для более эффективного покрытия, для удобства визуализации в SEM и обнажить ткани, которые могли свернуться во время сушки.
- Прикрепите кусочки мочевого пузыря к проводящей углеродной клеевой вкладке на алюминиевой заглушке и покрасьте небольшое количество серебряного клея вокруг нижнего контакта с зубочисткой, заботясь о том, чтобы избыток клея не впитывался на внутреннюю поверхность мочевого пузыря.
- Используйте высоковакуумный напыляющий коатер для напыления, чтобы покрыть образцы заглушек 6 нм иридия. Если образцы продолжают заряжаться, убедитесь, что проводящий путь окрашен к поверхности серебристой краской и покрыт дополнительно 4 нм иридия.
- Изобразите образцы с помощью сканирующего электронного микроскопа. Хотя условия могут варьироваться в зависимости от используемого микроскопа, ускоряющее напряжение 3 КэВ с током пучка 200 пА и рабочим расстоянием 12-13 мм хорошо работало на Zeiss Merlin FE-SEM при использовании электронного детектора Эверхарта-Торнли (SE2).
Результаты
После инокуляции титры УПЭК обнаруживаются в моче (рисунок 2В). Неспособность разложить образцы мочи на селективных средах, содержащих канамицин, вероятно, приведет к чрезмерному росту эндогенной микробиоты мыши, загрязняющей мочу. Уровень бактериурии УПЭК, вероятно, будет высоким на 1-й день и может увеличиться в течение первой недели, прежде чем снизиться в более поздние моменты времени (рисунок 2C). Примерно у 65-80% мышей не будет обнаруживаемого УПЭК в моче на 28 dpi (рисунок 2C, зеленый круг). Эти мыши могут быть использованы на последующих этапах модели. Мыши, которые остаются бактериурными (рисунок 2C, красный эллипс), должны быть исключены из эксперимента.
Два последовательных воздействия G. vaginalis в 12 ч (рисунок 3A) или на расстоянии 1 нед друг от друга (рисунок 3B) приводят к появлению UPEC из внутриклеточных резервуаров, вызывающих рецидивирующую бактериурию. Как уровень бактериурии UPEC (тест Манна-Уитни), так и доля мышей, демонстрирующих UPEC rUTI (точный тест Фишера), значительно выше у мышей, подвергшихся воздействию G. vaginalis , по сравнению с контрольной группой PBS. Цитологический анализ мочи обнаруживает ПМН в моче мышей, подвергшихся воздействию G. vaginalis, у которых наблюдалось появление УПЭК (рисунок 3C). В модели с двумя экспозициями, данными на расстоянии 1 недели друг от друга, титры UPEC в ткани мочевого пузыря ниже у мышей, подвергшихся воздействию G. vaginalis, по сравнению с PBS (рисунок 3D), предположительно из-за появления UPEC из резервуаров и последующего клиренса.
Визуализация in situ-фиксированной ткани мочевого пузыря с помощью SEM показывает большие поверхностные зонтичные уротелиальные клетки, выстилающие поверхность мочевого пузыря у контрольных мышей, подвергшихся воздействию только PBS (рисунок 4A). Уротелиальное отшелушивание проявляется потерей поверхностных зонтичных клеток, выявляющих меньшие базовые переходные эпителиальные клетки у мышей, подвергшихся воздействию G. vaginalis (рисунок 4B). В начале после инокуляции УПЭК при создании внутриклеточных резервуаров УПЭК видны на уротелии и нити наружу из отшелушивающихся клеток (рисунок 4С).
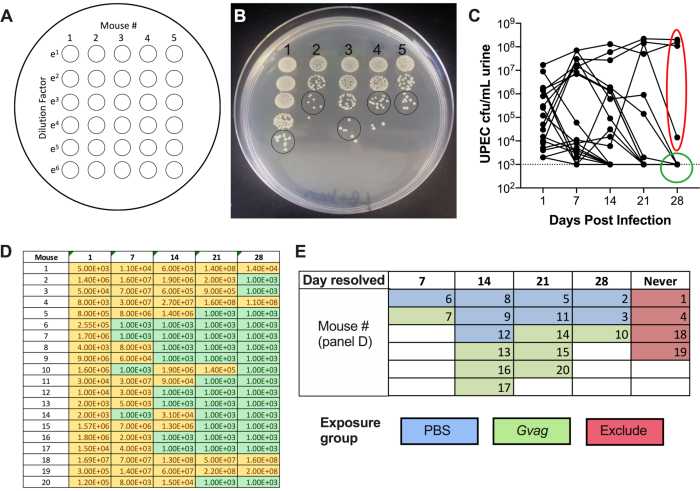
Рисунок 2. Мониторинг титров УПЭК в моче во время фазы 1 (образование резервуара). (A) Схема обшивки колониеобразующих единиц (КОЕ). (B) Репрезентативное изображение титров УПЭК в моче на LB+канамицине. Черные круги указывают на пятна образца мочи, которые должны быть подсчитаны для расчета КОЕ/мл. (C) Временное течение бактериурии УПЭК у мышей C57BL/6. Каждая линия представляет собой индивидуальную мышь, отслеживающую титры мочи УПЭК с течением времени. Пунктирная линия указывает на предел обнаружения (1000 КОЕ/мл). Красный эллипс указывает на четырех мышей (из 20), которые не смогли разрешить бактериурию UPEC и, следовательно, не будут использоваться для модели RUTI, индуцированной G. vaginalis. И наоборот, зеленый круг указывает на мышей, которые разрешили бактериурию УПЭК и перешли к последующим фазам. D) таблица данных, используемых для построения графика в панели C. Желтый, обнаруживаемый КОЕ; зеленый, без КОЕ. (E) Рандомизация мышей в группы воздействия на основе точки времени, когда КОЕ УПЭК больше не обнаруживались в моче («День разрешен»). Номера мыши в левом столбце панели D совпадают с номерами мыши, приведенными на панели E. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
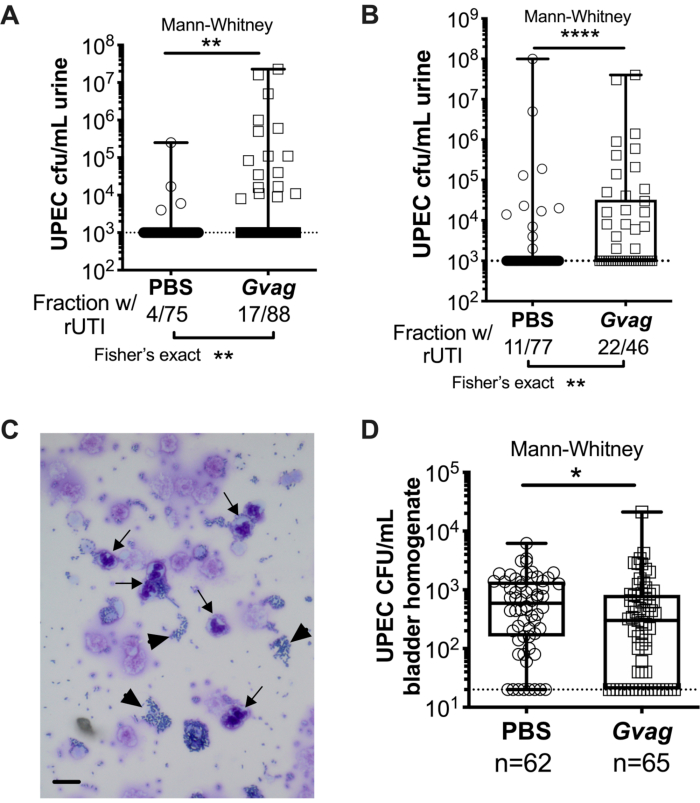
Рисунок 3. G. vaginalis вызывает УПЭК рУТИ. Титры УПЭК в моче после двух последовательных воздействий на мочевыводящие пути PBS (круги) или G. vaginalis (Gvag; квадраты) на расстоянии 12 ч (A) или 1 нед (B) друг от друга. Каждый символ представляет собой отдельную мышь. Построен график самый высокий УПК КОЕ/мл, обнаруженный у каждой мыши между 1-3 d после второго воздействия. Мыши без обнаруживаемой бактериурии строятся на пределе обнаружения (пунктирная линия). (C) Цитологический анализ мочи, показывающий УПЭК (наконечники стрел) и полиморфноядерные (ПМН) клетки (стрелки). Шкала бар = 20 мкм. (D) Титры УПЭК в тканях мочевого пузыря, собранные через 3 d после двух последовательных воздействий на мочевыводящие пути с интервалом 1 нед. Каждый символ представляет собой отдельную мышь, а нули наносятся на пределе обнаружения (пунктирная линия). В A, B и D квадраты находятся в первом и третьем квартиле с обозначенной медианой и усами от min до max. Тесты Манна-Уитни U * P < 0,05; ** P < 0,01; P < 0,0001. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
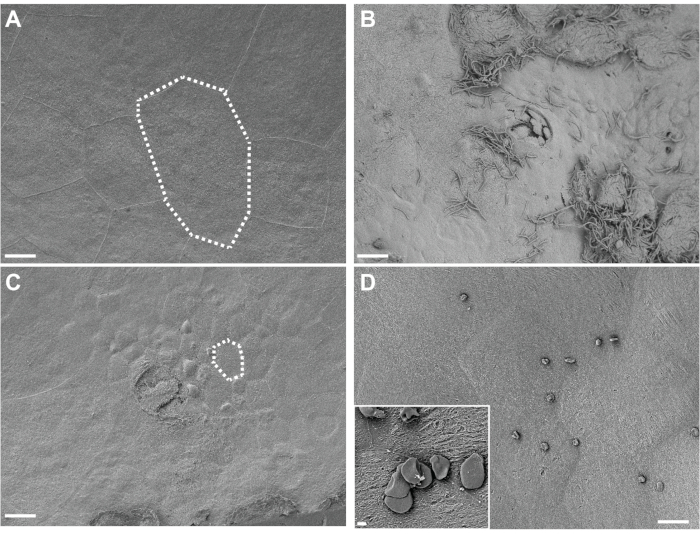
Рисунок 4. SEM анализ мочевых пузырей, зафиксированных in situ. Мочевой пузырь был собран у мышей через 3 ч после двух воздействий (с интервалом 12 ч) на PBS (A) или G. vaginalis (C). Пунктирные линии иллюстрируют одну эпителиальную клетку мочевыводящих путей, которая меньше в мочевом пузыре, подвергающемся воздействию G. vaginalis, потому что большие поверхностные клетки отшелушились, раскрывая основной переходный эпителий. (B) Мочевой пузырь собирали через 6 ч после первоначальной инокуляции УПЭК, во время фазы 1 модели, показывая мочеполовое отшелушивание и внеклеточную УПЭК. (D) Пример нерастворимых жировых капель, присутствующих на поверхности мочевого пузыря. Шкала шкалы составляет 20 мкм на основных изображениях и 2 мкм на вставке. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Первый критический шаг в этой модели для идентификации мышей, которые не очистили бактериурию УПЭК во время первичной фазы ИМП. Эти мыши должны быть удалены из эксперимента, так как в противном случае они могли бы запутать показатели бактериурии UPEC после воздействия G. vaginalis. После первоначальной прививки УПЭК следует еженедельно собирать мочу для контроля бактериального клиренса. Примерно 65-80% мышей C57BL/6 очищаются от инфекции UTI89kanR в течение 4 недель. Другие инбредные штаммы мышей имеют различную склонность к клиренсуУПЭК 42,43 и образованию коллектора и, таким образом, могут не подходить для этой модели. Второй критический момент заключается в том, что эмпирические исследования определили, что две последовательные прививки G. vaginalis (либо 12 ч, либо 1 нед друг от друга) необходимы, чтобы вызвать значительное появление резервуара выше фонового спонтанного появления, которое происходит у контрольных мышей, подвергшихся воздействию только PBS. Другие промежутки времени между двумя последовательными воздействиями не тестировались, но могут дать аналогичные результаты. Важно отметить, что снижение титров мочевого пузыря УПЭК наблюдалось только в модели, в которой воздействия G. vaginalis давались на 1 нед друг отдруга 39. Хотя можно вводить более двух воздействий, эмпирические данные свидетельствуют о том, что повторная катетеризация сама по себе увеличивает появление, что может нарушить интерпретацию результатов или потребовать большего количества животных для различения различий между группами воздействия и контрольной группой. Наконец, метод фиксации мочевого пузыря in situ имеет несколько критических этапов. Требуется некоторое мастерство, чтобы гарантировать, что фиксатор остается внутри зажатых мочевых пузырей. Спущенные мочевые пузыри будет сложнее изобразить с помощью SEM. Также важно быть очень мягким при прививке фиксатора в мочевой пузырь, так как соскабливание уротелия с помощью катетера, содержащего фиксатор, может вызвать мочеполовое отшелушивание независимо от того, что вызвано G. vaginalis. Все концентрации, упомянутые в фиксаторном коктейле, являются конечными концентрациями. Неправильное их соотношение может привести к недостаточной фиксации и отеку или усадке клеток. Фиксаторы следует нагревать до физиологических температур, чтобы избежать температурного шока в клетках и тканях. Потепление также обеспечивает небольшое улучшение скорости диффузии фиксаторов через плазматические мембраны. Хотя окрашивание осмием часто может быть опущено для образцов, подготовленных для анализа SEM, это важный шаг в этом протоколе для стабилизации липидов и предотвращения растрескивания клеточных мембран во время сушки в критической точке.
Этот протокол может быть модифицирован для тестирования других штаммов UPEC и/или G. vaginalis на их способность образовывать резервуары и вызывать их появление, соответственно. Также могут быть добавлены другие экспериментальные факторы, такие как воздействие других вагинальных бактерий (например, Lactobacillus crispatus PVAS100) или термически убитого G. vaginalis, ни один из которых не демонстрирует патологию в этой модели39. При выборе других бактериальных штаммов для тестирования важно продемонстрировать последовательный рост, чтобы стандартная концентрация инокулята могла быть использована во всех экспериментах. Рост JCP8151BSmR был оптимизирован в анаэробной камере. Этот штамм, вероятно, может быть культивирован в анаэробной системе GasPak, но это потребует оптимизации для обеспечения устойчивого роста бактерий. Наконец, может быть возможно изменить время определенных шагов в модели. Например, моча может быть собрана в более ранние моменты времени во время фазы формирования резервуара УПЭК для мониторинга КОЕ или реакции хозяина. Неблагоприятного влияния сбора образцов мочи в ранние моменты времени (3, 6, 12 hpi) на прогрессирование инфекции или создание резервуаров в этой модели не наблюдалось. Сообщалось, что появление резервуаров УПЭК происходит после двух доз JCP8151BSmR в течение 12 ч или 1 нед, но другие временные интервалы еще не были протестированы. Также может быть возможно сократить общую продолжительность времени для модели, сократив фазу формирования резервуара УПЭК до 2 недель (а не 4 недель), поскольку многие из мышей очищают бактериурию к этому времени. Предыдущие исследования, изучающие возникновение УПЭК после воздействия химических эксфолиантов на мочевой пузырь, использовали фазу формирования резервуара УПЭК17,18 нед. Тем не менее, уменьшение количества времени для очистки от бактериурии UPEC может быть связано с необходимостью отбраковки большего количества животных из эксперимента. Наконец, SEM-анализ мочевого пузыря может быть выполнен в дополнительные временные моменты для наблюдения за длительностью действия G. vaginalis на уротелий.
Что касается устранения неполадок, есть некоторые важные соображения, особенно в отношении анализа SEM мочевого пузыря. В зависимости от используемого мышей фона и количества воспаления, некоторые мочевые пузыри будут иметь очень тонкие стенки. Эти мочевые пузыри, как правило, сворачиваются больше во время сушки в критических точках и могут привести к форме раковины каури. Если это происходит, лучшим методом является разрезание раковинообразного мочевого пузыря пополам вдоль закрученного интерфейса, а затем второй раз удалить основную часть нависающей ткани. Резка лучше всего работает с обоюдоострым лезвием бритвы с покрытием из PTFE. Избыток жира может иногда солюбилизироваться во время этапов окрашивания осмия. Это может привести к нежелательным нерастворимым каплям жира, которые могут не смываться во время этапов полоскания и обезвоживания и которые могут оседать на поверхности мочевого пузыря во время последующего высыхания. Эти капли могут выглядеть как небольшие сферы или дискообразные структуры, разбросанные по образцу (рисунок 4D). Это можно смягчить, убедившись, что как можно больше жировой ткани удаляется вокруг мочевого пузыря. Платина может быть заменена иридиевым покрытием, но толщина должна быть сведена к минимуму, чтобы уменьшить маскировку мелких структурных деталей. Использование вращающейся ступени во время нанесения покрытия настоятельно рекомендуется.
Одним из ограничений этой модели является то, что она требует большого количества мышей. Только 65-80% мышей C57BL/6 очищают свою бактериурию UPEC и подходят для последующей прививки G. vaginalis или PBS (см. Рисунок 2C). Чтобы получить 10-12 мышей в группе (прививка G. vaginalis против PBS), ~ 30 мышей должны быть первоначально инфицированы УПЭК. Кроме того, вероятно, потребуются многочисленные эксперименты для достижения биологических реплик, необходимых для обнаружения статистической значимости. Когда экспозиции проводились на расстоянии 1 недель друг от друга, появление УПЭК произошло у 14% мышей, подвергшихся воздействию PBS (рисунок 3B). Таким образом, обнаружение значительного увеличения UPEC rUTI у мышей, подвергшихся воздействию G. vaginalis по сравнению с контрольной группой PBS (питанием от 0,8; альфа = 0,05 [односторонняя]), требует тестирования в общей сложности не менее 40 мышей для каждой группы воздействия. Дополнительным соображением является то, что эти эксперименты являются дорогостоящими и трудоемкими. Мышей необходимо еженедельно контролировать на предмет клиренса УПЭК, а экспериментальный временной курс составляет 4-5 недель в зависимости от того, вводится ли G. vaginalis дважды за 12-часовой интервал или дважды с интервалом в 1 нед. SEM является трудоемким и может быть дорогостоящим, в зависимости от наличия микроскопа и платы за обслуживание. Подготовка всего мочевого пузыря к SEM обеспечивает обильный материал для анализа, но недостатком является то, что анализ каждого мочевого пузыря может занять много времени. Таким образом, вполне вероятно, что только ограниченное количество мочевых пузырей может быть проанализировано SEM по сравнению с более высоким количеством животных, используемых для титров мочи и тканей. Кроме того, получение качественных изображений изогнутых поверхностей «чашек» мочевого пузыря требует сноровки из-за теней, которые могут препятствовать видимости. Хотя SEM мочевого пузыря является полезным инструментом для визуализации уротелиального пилинга, этот метод в значительной степени качественный. Поскольку образец фиксируется в круглой форме, и из-за использования глутаральдегида в фиксаторе, скрининг на флуоресцентно экспрессирующие бактерии с помощью световой микроскопии невозможен. Иммуноокрашивающие и химические красители несовместимы с этим процессом из-за использования глутаральдегида, который сшивает большинство антигенов и осмий и маскирует антигенные участки и затемняет ткани. Тем не менее, метод SEM полезен для параметров, которые могут быть оценены количественно без использования дополнительных зондов, таких как размер ячейки48,49.
Эта модель предлагает несколько преимуществ по сравнению с ранее описанными методами. Это позволяет исследовать механизмы УПЭК рУТИ, вызванные возникновением из резервуаров мочевого пузыря, в отличие от реинтродукции в мочевой пузырь из внешнего источника. Другие модели rUTI из-за появления из резервуаров мочевого пузыря используют химические агенты (сульфат протамина или хитозан), чтобы вызвать мочеполовое отшелушивание17,18, которое не было бы триггером rUTI у женщин. G. vaginalis является распространенной урогенитальной бактерией, которая была обнаружена в моче, собранной непосредственно из мочевого пузыря посредством катетеризации или надлобковой аспирации у некоторых женщин23,26. Этот факт, в сочетании с известной связью между BV (при котором G. vaginalis разрастается во влагалище) и ИМП, предполагает, что G. vaginalis является клинически правдоподобным триггером rUTI. Наконец, метод фиксации мочевого пузыря in situ сохраняет ультраструктуру мочевого пузыря и ограничивает повреждение, гарантируя, что слои мочевого пузыря не отделяются друг от друга. Предыдущие методы визуализации уротелия традиционно заставляли пользователя асептически собирать, разделять пополам, растягивать и прикреплять мочевой пузырь к лотку для рассечения перед погружением растянутого мочевого пузыря в фиксатор48. Этот метод приводит к очень плоскому образцу, но не обеспечивает равномерного или естественного растяжения ткани и может привести к областям, которые чрезмерно и недостаточно растянуты (что приводит к сильной морщинистости ткани) и может вызвать разделение слоя мочевого пузыря. Кроме того, эти физические манипуляции мочевого пузыря для растяжения и закрепления ткани могут привести к повреждению, включая мочеполовое отшелушивание. Другой метод заключается в погружении неповрежденных мочевых пузырей в фиксатор перед встраиванием в парафин и приобретением тонких срезов с микротомом. Тонкие срезы бесценны для иммуногистохимических экспериментов по изучению локализации бактерий и белка хозяина, но тонкий срез не позволяет визуализировать уротелиальную поверхность. Этот метод SEM позволяет исследовать поверхность всего мочевого пузыря сразу.
Как описано, будущие применения этой модели включают тестирование других штаммов UPEC, чтобы определить, образуют ли они внутриклеточные резервуары, и тестирование других штаммов G. vaginalis , чтобы оценить, вызывают ли они отшелушивание и появление UPEC для вызова rUTI. Другие штаммы мышей, помимо мышей C57BL/6, также могут быть протестированы, хотя мыши с высокой склонностью к развитию хронического цистита (например, мыши на фоне C3H) не рекомендуются, так как слишком много мышей должно быть отобрано из эксперимента. Дополнительным преимуществом мышей C57BL/6 является то, что многие генетические нокаутирующие штаммы коммерчески доступны. Такие штаммы дают возможность опросить факторы-хозяева, участвующие в образовании коллектора и/или всходах.
Раскрытие информации
Авторы заявляют, что у них нет конфликта интересов, связанного с этим исследованием.
Благодарности
Авторы благодарят Линн Фостер за техническую помощь в экспериментах с инфекцией, Джеймса Фитцпатрика из Центра клеточной визуализации Вашингтонского университета (WUCCI) за доступ к SEM, Скотта Халтгрена для штамма UTI89kanR UPEC и Дэвида Ханстада за критическое чтение рукописи.
Эта работа была поддержана Национальным научным фондом (Graduate Research Fellowship to VPO#DGE - 1143954), Центром исследований инфекционных заболеваний женщин при Медицинской школе Вашингтонского университета (Pilot Research Award to NMG), Американской кардиологической ассоциацией: #12POST12050583 (NMG) и #14POST20020011 (NMG), а также Национальными институтами здравоохранения, NIAID: R01 AI114635 (ALL) и NIDDK: R21 DK092586 (ALL), P50 DK064540-11 (SJH, проект II PI:ALL) и K01 DK110225-01A1 (NMG). Некоторые из исследований на животных были проведены в учреждении, поддерживаемом грантом NCRR C06 RR015502. Центр клеточной визуализации Вашингтонского университета (WUCCI; где проводился SEM) и MSJ были поддержаны Медицинской школой Вашингтонского университета, Детским институтом открытий Вашингтонского университета и Детской больницей Сент-Луиса (CDI-CORE-2015-505), Фондом еврейской больницы Барнса (3770) и Национальным институтом неврологических расстройств и инсульта (NS086741). Спонсоры не играли никакой роли в разработке исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Материалы
| Name | Company | Catalog Number | Comments |
| 30G x 1/2 needles | BD | 305106 | for catheters |
| 5 1/2" straight forcep hemostat | McKesson | 487377 | in situ bladder fixation |
| ACE 600 Sputter coater | Leica | SEM sample processing | |
| aluminum SEM stub | Ted Pella | 16111 | SEM sample processing |
| Calcium chloride | EMS | 12340 | in situ bladder fixation |
| conductive carbon adhesive tab | Ted Pella | 16084-1 | SEM sample processing |
| Conductive silver paint | Ted Pella | 16034 | SEM sample processing |
| CPD 300 Critical Point Drier | Leica | SEM sample processing | |
| Cytofunnel metal clip | Simport | M964B | cytospun urinalysis |
| Ethanol | EMS | 15050 | SEM sample processing |
| Glucose | Sigma | G7528 | for NYCIII G. vaginalis growth media |
| glutaraldehyde | EMS | 16320 | in situ bladder fixation |
| Hema 3 staining kit | Fisher | 23123869 | cytospun urinalysis |
| HEPES | Cellgro | 25-060-Cl | for NYCIII G. vaginalis growth media |
| iridium | Ted Pella | 91120 | SEM sample processing |
| isofluorane | mouse anaesthesia | ||
| kanamycin | Gibco | 11815024 | add to UPEC LB selective plates (50 ug/mL) |
| Luria-Bertani agar | BD | DF0445174 | UPEC growth plates |
| Luria-Bertani broth | BD | DF0446173 | UPEC growth media |
| Merlin FE-SEM | Zeiss | scanning electron microscope | |
| Milli-Q Water Purifier | Millipore | IQ-7000 | SEM sample processing |
| NaCl | Sigma | S3014 | for NYCIII G. vaginalis growth media |
| Olympus Vanox AHBT3 microscope | Olympus | cytospun urinalysis | |
| osmium tetroxide | EMS | 19170 | SEM sample processing |
| paraformaldehyde | EMS | 15710 | in situ bladder fixation |
| polyethylene tubing | Intramedic | 427401 | for catheters |
| Proteose Peptone #3 | Fisher | DF-122-17-4 | for NYCIII G. vaginalis growth media |
| PTFE coated double edge razor blade | EMS | 72000 | cutting bladders for SEM |
| Shandon Cytocentrifuge | Thermo Scientific | A78300002 | cytospun urinalysis |
| Shandon cytofunnel filter | Simport | M965FWDV | cytospun urinalysis |
| Shandon Double cytofunnel | Simport | M964-1D | cytospun urinalysis |
| Shandon double cytoslides (coated) | Thermo Scientific | 5991055 | cytospun urinalysis |
| sodium cacodylate trihydrate | EMS | 12310 | in situ bladder fixation |
| spectrophotometer | BioChrom | 80-3000-45 | measuring bacterial OD600 |
| streptomycin | Gibco | 11860038 | add to G. vaginalis NYCIII selective plates (1 mg/mL) |
| tuberculin slip tip syringe | BD | 309659 | for catheters |
| Yeast Extract | Fisher | DF0127-17-9 | for NYCIII G. vaginalis growth media |
Ссылки
- Foxman, B. Urinary tract infection syndromes: occurrence, recurrence, bacteriology, risk factors, and disease burden. Infectious Disease Clinics of North America. 28 (1), 1-13 (2014).
- Foxman, B. Recurring urinary tract infection: incidence and risk factors. American Journal of Public Health. 80 (3), 331-333 (1990).
- Foxman, B. Epidemiology of urinary tract infections: incidence, morbidity, and economic costs. American Journal of Medicine. 113, 5-13 (2002).
- Foxman, B. The epidemiology of urinary tract infection. Nature Reviews Urology. 7 (12), 653-660 (2010).
- Ikaheimo, R., et al. Recurrence of urinary tract infection in a primary care setting: analysis of a 1-year follow-up of 179 women. Clinical Infectious Diseases. 22 (1), 91-99 (1996).
- Russo, T. A., Stapleton, A., Wenderoth, S., Hooton, T. M., Stamm, W. E. Chromosomal restriction fragment length polymorphism analysis of Escherichia coli strains causing recurrent urinary tract infections in young women. Journal of Infectious Diseases. 172 (2), 440-445 (1995).
- Luo, Y., et al. Similarity and divergence of phylogenies, antimicrobial susceptibilities, and virulence factor profiles of Escherichia coli isolates causing recurrent urinary tract infections that persist or result from reinfection. Journal of Clinical Microbiology. 50 (12), 4002-4007 (2012).
- Schreiber, H. L. t., et al. Bacterial virulence phenotypes of Escherichia coli and host susceptibility determine risk for urinary tract infections. Science Translational Medicine. 9 (382), (2017).
- Rosen, D. A., Hooton, T. M., Stamm, W. E., Humphrey, P. A., Hultgren, S. J. Detection of intracellular bacterial communities in human urinary tract infection. PLoS Med. 4 (12), 329 (2007).
- Elliott, T. S., Reed, L., Slack, R. C., Bishop, M. C. Bacteriology and ultrastructure of the bladder in patients with urinary tract infections. Journal of Infection. 11 (3), 191-199 (1985).
- Robino, L., et al. Detection of intracellular bacterial communities in a child with Escherichia coli recurrent urinary tract infections. Pathogens and Disease. 68 (3), 78-81 (2013).
- Robino, L., et al. Intracellular bacteria in the pathogenesis of Escherichia coli urinary tract infection in children. Clinical Infectious Diseases. 59 (11), 158-164 (2014).
- De Nisco, N. J., et al. Direct Detection of Tissue-Resident Bacteria and Chronic Inflammation in the Bladder Wall of Postmenopausal Women with Recurrent Urinary Tract Infection. Journal of Molecular Biology. 431 (21), 4368-4379 (2019).
- Mulvey, M. A., Schilling, J. D., Hultgren, S. J. Establishment of a persistent Escherichia coli reservoir during the acute phase of a bladder infection. Infection and Immunity. 69 (7), 4572-4579 (2001).
- Kerrn, M. B., Struve, C., Blom, J., Frimodt-Moller, N., Krogfelt, K. A. Intracellular persistence of Escherichia coli in urinary bladders from mecillinam-treated mice. Journal of Antimicrobial Chemotherapy. 55 (3), 383-386 (2005).
- Eto, D. S., Sundsbak, J. L., Mulvey, M. A. Actin-gated intracellular growth and resurgence of uropathogenic Escherichia coli. Cellular Microbiology. 8 (4), 704-717 (2006).
- Mysorekar, I. U., Hultgren, S. J. Mechanisms of uropathogenic Escherichia coli persistence and eradication from the urinary tract. Proceedings of the National Academy of Sciences of the United States of America. 103 (38), 14170-14175 (2006).
- Blango, M. G., Ott, E. M., Erman, A., Veranic, P., Mulvey, M. A. Forced resurgence and targeting of intracellular uropathogenic Escherichia coli reservoirs. PLoS One. 9 (3), 93327 (2014).
- Gilbert, N. M., Lewis, A. L. Covert pathogenesis: Transient exposures to microbes as triggers of disease. PLoS Pathogens. 15 (3), 1007586 (2019).
- Lewis, A. L., Gilbert, N. M. Roles of the vagina and the vaginal microbiota in urinary tract infection: evidence from clinical correlations and experimental models. GMS Infectious Diseases. 8, (2020).
- Janulaitiene, M., et al. Prevalence and distribution of Gardnerella vaginalis subgroups in women with and without bacterial vaginosis. BMC Infectious Diseases. 17 (1), 394 (2017).
- Fredricks, D. N. Molecular methods to describe the spectrum and dynamics of the vaginal microbiota. Anaerobe. 17 (4), 191-195 (2011).
- Hilt, E. E., et al. Urine is not sterile: use of enhanced urine culture techniques to detect resident bacterial flora in the adult female bladder. Journal of Clinical Microbiology. 52 (3), 871-876 (2014).
- Klein, S., et al. Significant increase in cultivation of Gardnerella vaginalis, Alloscardovia omnicolens, Actinotignum schaalii, and Actinomyces spp. in urine samples with total laboratory automation. European Journal of Clinical Microbiology Infect Dis. 37 (7), 1305-1311 (2018).
- Pearce, M. M., et al. The female urinary microbiome in urgency urinary incontinence. American Journal of Obstetrics and Gynecology. 213 (3), 341 (2015).
- Pearce, M. M., et al. The female urinary microbiome: a comparison of women with and without urgency urinary incontinence. mBio. 5 (4), 01283 (2014).
- Gottschick, C., et al. The urinary microbiota of men and women and its changes in women during bacterial vaginosis and antibiotic treatment. Microbiome. 5 (1), 99 (2017).
- Malki, K., et al. Genomes of Gardnerella Strains Reveal an Abundance of Prophages within the Bladder Microbiome. PLoS One. 11 (11), 0166757 (2016).
- Kramer, H., et al. Diversity of the midstream urine microbiome in adults with chronic kidney disease. International Urology and Nephrology. 50 (6), 1123-1130 (2018).
- Allsworth, J. E., Peipert, J. F. Prevalence of bacterial vaginosis: 2001-2004 National Health and Nutrition Examination Survey data. Obstetrics & Gynecology. 109 (1), 114-120 (2007).
- Ravel, J., et al. Vaginal microbiome of reproductive-age women. Proceedings of the National Academy of Sciences of the United States of America. 108, 4680-4687 (2011).
- Hillier, S. L. Diagnostic microbiology of bacterial vaginosis. American Journal of Obstetrics and Gynecology. 169 (2), 455-459 (1993).
- Amatya, R., Bhattarai, S., Mandal, P. K., Tuladhar, H., Karki, B. M. Urinary tract infection in vaginitis: a condition often overlooked. Nepal Medical College Journal. 15 (1), 65-67 (2013).
- Harmanli, O. H., Cheng, G. Y., Nyirjesy, P., Chatwani, A., Gaughan, J. P. Urinary tract infections in women with bacterial vaginosis. Obstetrics & Gynecology. 95 (5), 710-712 (2000).
- Sharami, S. H., Afrakhteh, M., Shakiba, M. Urinary tract infections in pregnant women with bacterial vaginosis. Journal of Obstetrics and Gynaecology. 27 (3), 252-254 (2007).
- Hillebrand, L., Harmanli, O. H., Whiteman, V., Khandelwal, M. Urinary tract infections in pregnant women with bacterial vaginosis. American Journal of Obstetrics and Gynecology. 186 (5), 916-917 (2002).
- Sumati, A. H., Saritha, N. K. Association of urinary tract infection in women with bacterial vaginosis. Journal of Global Infectious Diseases. 1 (2), 151-152 (2009).
- Gilbert, N. M., Lewis, W. G., Lewis, A. L. Clinical features of bacterial vaginosis in a murine model of vaginal infection with Gardnerella vaginalis. PLoS One. 8 (3), 59539 (2013).
- Gilbert, N. M., O'Brien, V. P., Lewis, A. L. Transient microbiota exposures activate dormant Escherichia coli infection in the bladder and drive severe outcomes of recurrent disease. PLoS Pathogens. 13 (3), 1006238 (2017).
- Wright, K. J., Seed, P. C., Hultgren, S. J. Uropathogenic Escherichia coli flagella aid in efficient urinary tract colonization. Infection and Immunity. 73 (11), 7657-7668 (2005).
- Garofalo, C. K., et al. Escherichia coli from urine of female patients with urinary tract infections is competent for intracellular bacterial community formation. Infection and Immunity. 75 (1), 52-60 (2007).
- Hannan, T. J., Mysorekar, I. U., Hung, C. S., Isaacson-Schmid, M. L., Hultgren, S. J. Early severe inflammatory responses to uropathogenic E. coli predispose to chronic and recurrent urinary tract infection. PLoS Pathogens. 6 (8), 1001042 (2010).
- Hopkins, W. J., Gendron-Fitzpatrick, A., Balish, E., Uehling, D. T. Time course and host responses to Escherichia coli urinary tract infection in genetically distinct mouse strains. Infection and Immunity. 66 (6), 2798-2802 (1998).
- Conover, M. S., Flores-Mireles, A. L., Hibbing, M. E., Dodson, K., Hultgren, S. J. Establishment and Characterization of UTI and CAUTI in a Mouse Model. Journal of Visualized Experiments. (100), e52892 (2015).
- Hannan, T. J., Hunstad, D. A. A Murine Model for Escherichia coli Urinary Tract Infection. Methods in Molecular Biology. 1333, 159-175 (2016).
- Zychlinsky Scharff, A., Albert, M. L., Ingersoll, M. A. Urinary Tract Infection in a Small Animal Model: Transurethral Catheterization of Male and Female Mice. Journal of Visualized Experiments. (130), e54432 (2017).
- Thai, K. H., Thathireddy, A., Hsieh, M. H. Transurethral induction of mouse urinary tract infection. Journal of Visualized Experiments. (42), e2070 (2010).
- O'Brien, V. P., et al. A mucosal imprint left by prior Escherichia coli bladder infection sensitizes to recurrent disease. Nature Microbiology. 2, 16196 (2016).
- O'Brien, V. P., Dorsey, D. A., Hannan, T. J., Hultgren, S. J. Host restriction of Escherichia coli recurrent urinary tract infection occurs in a bacterial strain-specific manner. PLoS Pathogens. 14 (12), 1007457 (2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены