Method Article
Infection récurrente des voies urinaires à Escherichia coli déclenchée par Gardnerella vaginalis Exposition à la vessie chez la souris
Dans cet article
Résumé
Un modèle murin d’inoculation transurétrale d’E. coli uropathogène (UPEC) pour établir des réservoirs de vessie intracellulaire latents et une exposition ultérieure de la vessie à G. vaginalis pour induire une infection urinaire UPEC récurrente est démontré. Le dénombrement des bactéries, la cytologie de l’urine et la fixation et le traitement in situ de la vessie pour la microscopie électronique à balayage sont également démontrés.
Résumé
Les infections urinaires récurrentes (rUTI) causées par Escherichia coli uropathogène (UPEC) sont courantes et coûteuses. Des articles précédents décrivant des modèles d’infection urinaire chez des souris mâles et femelles ont illustré les procédures d’inoculation bactérienne et de dénombrement dans l’urine et les tissus. Au cours d’une infection initiale de la vessie chez des souris C57BL/6, l’UPEC établit des réservoirs latents à l’intérieur des cellules épithéliales de la vessie qui persistent après la clairance de la bactériurie UPEC. Ce modèle s’appuie sur ces études pour examiner les infections urinaires causées par l’émergence de l’UPEC à partir de réservoirs de vessie latente. La bactérie urogénitale Gardnerella vaginalis est utilisée comme déclencheur de l’infection urinaire dans ce modèle, car elle est fréquemment présente dans les voies urogénitales des femmes, en particulier dans le contexte de la dysbiose vaginale associée à une infection urinaire. En outre, une méthode de fixation in situ de la vessie suivie d’une analyse par microscopie électronique à balayage (MEB) du tissu vésical est également décrite, avec une application potentielle à d’autres études impliquant la vessie.
Introduction
Les infections des voies urinaires (IVU) imposent un fardeau important en matière de soins de santé dans le monde entier, affectant la qualité de vie de millions de personnes chaque année, en particulier les femmes1. Escherichia coli uropathogène (UPEC) est la cause la plus fréquente d’infection urinaire1. De nombreux patients (environ 20 à 30%) qui développent une infection urinaire connaîtront une infection urinaire récurrente (rUTI) dans les 6 mois malgré la clairance de l’infection initiale médiée par les antibiotiques2. Malheureusement, jusqu’à 5% des femmes préménopausées souffrent de 3 rUTI ou plus chaque année 3,4. Les épisodes séquentiels d’infection urinaire r peuvent être causés par la persistance de la même souche UPEC du cas index 5,6,7,8. Les données provenant d’échantillons humains et de modèles murins suggèrent que l’infection urinaire r de même souche pourrait être causée par l’UPEC résidant dans des réservoirs de repos dans la vessie. Chez l’homme, des CEPU ont été détectés dans des cellules épithéliales et des biopsies de la vessie de patients atteints d’infection urinaire 9,10,11,12,13. Des études chez des souris C57BL/6 ont démontré que certaines souches d’UPEC peuvent établir des réservoirs intracellulaires au repos dans la vessie, tels que détectés par microscopie à fluorescence et par homogénéisation et culture de tissu vésical, qui sont maintenus pendant des mois après la résolution de la bactériurie 14,15,16. Le traitement de la vessie avec des agents qui induisent l’exfoliation de l’épithélium de la vessie (urothélium), par exemple le sulfate de protamine17 ou le chitosane18, déclenche l’émergence de l’UPEC des réservoirs pour provoquer une infection urinaire. Ces données suggèrent que chez les femmes hébergeant des réservoirs UPEC de la vessie d’une infection antérieure, les expositions à la vessie qui conduisent à l’exfoliation urothéliale peuvent déclencher une rUTI.
Il existe de plus en plus de preuves que le microbiote vaginal contribue à l’infection des voies urinaires19,20. Gardnerella vaginalis est un membre fréquent du microbiote vaginal et urinaire 21,22,23,24,25,26,27,28,29. Dans le vagin, la présence de niveaux élevés de G. vaginalis est associée à une dysbiose microbienne connue sous le nom de vaginose bactérienne (BV), qui affecte environ 30% des femmes 30,31,32. Les femmes atteintes de VB courent un risque plus élevé d’infection urinaire que les femmes ayant une communauté vaginale dominée par Lactobacillus 33,34,35,36,37. Chez les modèles murins, G. vaginalis provoque une exfoliation épithéliale à la fois dans le vagin38 et dans la vessie39. Chez les souris C57BL/6 hébergeant des réservoirs vésicaux UPEC, deux expositions vésicales séquentielles à G. vaginalis - mais pas au PBS - entraînent une réémergence de l’UPEC des réservoirs pour provoquer une infection urinaire urinaire à l’UPEC. L’émergence est mise en évidence par l’apparition de titres UPEC dans l’urine de souris qui avaient précédemment résolu la bactériurie UPEC et une diminution subséquente des titres d’homogénat de la vessie UPEC au sacrifice par rapport aux animaux témoins exposés au PBS39. Fait intéressant, il n’y a pas de colonisation durable par G. vaginalis dans la vessie. Dans la grande majorité des cas, deux expositions courtes, chacune avec moins de 12 (h) de G. vaginalis viable dans l’urine, sont suffisantes pour provoquer une exfoliation urothéliale et favoriser l’infection urinaire.
Ce protocole décrit un modèle murin d’infection urinaire r causée par l’UPEC résidant dans les réservoirs intracellulaires de la vessie, en utilisant l’inoculation de la vessie de G. vaginalis pour déclencher la récidive. L’avancée obtenue par ce modèle est que G. vaginalis est un déclencheur biologique cliniquement pertinent de l’infection urinaire par rapport aux agents chimiques précédemment utilisés. De plus, la survie relativement courte de G. vaginalis dans les voies urinaires de la souris permet d’examiner l’impact des expositions microbiennes transitoires sur l’urothélium, comme cela pourrait se produire après une activité sexuelle. En plus de décrire le modèle rUTI, ce protocole décrit également des méthodes de cytologie urinaire et de fixation in situ de la vessie et d’imagerie de l’urothélium par microscopie électronique à balayage (MEB).
Ce protocole d’infection urinaire UPEC récurrente induite par G. vaginalis utilise la souche UPEC UTI89 portant une cassette de résistance à la kanamycine (UTI89kanR)40. Toutes les souches d’UPEC testées n’ont pas été en mesure de former des communautés bactériennes intracellulaires au cours de la phase d’infection aiguë chez les souris41 et on ne sait pas encore si toutes les souches d’UPEC ont la capacité de former des réservoirs intracellulaires latents. La formation de réservoirs doit être confirmée avant l’utilisation d’autres souches d’UPEC dans le modèle. Ce protocole utilise un isolat spontané de G. vaginalis résistant à la streptomycine, JCP8151BSmR38. L’induction de rUTI par JCP8151BSmR nécessite deux inoculations séquentielles de G. vaginalis , administrées soit à 12 h, soit à 7 jours (j) d’intervalle39. Il reste à déterminer si d’autres souches de G. vaginalis induisent ou non une exfoliation et/ou une infection urinaire urinaire à l’UPEC. Il est essentiel d’utiliser des souches UPEC et G. vaginalis présentant une résistance connue aux antibiotiques (telles que la kanamycine ou la spectinomycine pour l’UPEC et la streptomycine pour G. vaginalis), car des antibiotiques peuvent être ajoutés aux plaques d’agar pour prévenir la croissance du microbiote endogène de souris qui pourrait autrement interférer avec le dénombrement des unités formant des colonies (UFC) pour surveiller l’infection. Ceci est particulièrement important pour la culture d’échantillons d’urine, car l’urine de souris contient souvent d’autres bactéries qui peuvent proliférer sur les plaques de culture sans antibiotiques. L’origine de ces bactéries endogènes dans l’urine de souris est inconnue, mais reflète probablement des bactéries périurétrales et urogénitales détectées lors de la collecte d’urine.
G. vaginalis est une bactérie anaérobie facultative et, par conséquent, ce protocole décrit la croissance de G. vaginalis JCP8151BSmR dans une chambre anaérobie. Si une chambre anaérobie n’est pas disponible, d’autres méthodes pour maintenir les conditions de croissance anaérobie (comme une poche GasPak dans un récipient hermétique) peuvent être utilisées. Alternativement, certaines souches de G. vaginalis (y compris JCP8151BSmR) se développeront dans un incubateur de culture tissulaire standard (5% de CO2). Tout comme l’utilisation de souches de G. vaginalis autres que JCP8151BSmR nécessite des tests pour s’assurer que les bactéries se comportent de manière similaire dans ce modèle, l’évolution des conditions de croissance nécessite la détermination empirique des durées idéales de culture (sur plaques et dans les liquides) et des équivalents de densité optique (OD) 600 pour atteindre les concentrations d’inoculum viables souhaitées. De plus, on ne sait pas si les conditions de croissance influencent la pathobiologie de G. vaginalis.
Enfin, lorsqu’ils envisagent d’utiliser ce modèle, les chercheurs doivent savoir qu’il peut nécessiter un plus grand nombre d’animaux par groupe que les modèles murins UTI typiques. C’est en partie parce que l’induction de l’infection urinaire nécessite que les souris résolvent la bactériurie UPEC causée par l’infection initiale de la vessie. Ainsi, toute souris qui ne parvient pas à éliminer la bactériurie (un phénotype généralement révélateur d’une infection rénale en cours) n’est pas incluse dans la phase rUTI du protocole. Le nombre de souris nécessaires pour alimenter ces études est également influencé par le taux d’émergence « spontanée » de l’UPEC dans l’urine (12-14% en moyenne). Enfin, différentes souches de souris ont des propensions différentes à développer une bactériurie chronique par rapport à la formation de réservoir intracellulaire42,43. Si vous utilisez des souches de souris autres que C57BL/6 dans ce modèle, il faut confirmer que les animaux développent des réservoirs intracellulaires UPEC quiescents.
Protocole
Le Washington University Institutional Animal Care and Use Committee (IACUC) a approuvé toutes les infections et procédures de souris dans le cadre du protocole numéro 20170081, qui a expiré le 06/09/2020, et le 20-0031, qui expire le 18/03/2023. Les soins globaux aux animaux étaient conformes au Guide pour le soin et l’utilisation des animaux de laboratoire du Conseil national de recherches du Canada et au Guide de ressources en soins aux animaux de l’USDA. Les procédures d’euthanasie sont conformes aux Lignes directrices de l’AVMA pour l’euthanasie des animaux : édition 2020.

Graphique 1. Schéma du modèle de souris. La chronologie est mise en évidence pour refléter les phases ou les procédures du modèle décrit dans le protocole. Phase 1 (orange) : Établissement de réservoirs UPEC intracellulaires. Les souris sont inoculées par voie transurétrale avec UPEC et des échantillons d’urine sont prélevés et surveillés pour l’élimination de la bactériurie. Seules les souris qui nettoient la bactériurie passent aux phases suivantes. Phase 2 (vert) : Exposition de la vessie à G. vaginalis. Les souris sont inoculées par voie transurétrale avec G. vaginalis deux fois. La durée entre les deux expositions séquentielles est de 12 h (panneau supérieur) ou de 1 semaine (semaine; panneau inférieur), selon l’analyse en aval souhaitée. Phase 3 (jaune) : UPEC rUTI. L’urine est recueillie quotidiennement après l’exposition à G. vaginalis et surveillée pour la bactériurie UPEC. De plus, les vessies et les reins peuvent être prélevés au critère d’évaluation expérimental pour mesurer les titres tissulaires UPEC. Dans le modèle d’exposition à 1 semaine, l’émergence induite par G. vaginalis de l’UPEC à partir des réservoirs intracellulaires et la clairance ultérieure des voies urinaires se reflètent également dans une diminution des titres de tissu de la vessie UPEC (par rapport aux souris exposées au PBS, voir la figure 3D). Cette diminution des titres de la vessie n’était pas évidente dans le modèle d’exposition de 12 heures, probablement parce qu’il faut plus de temps pour que suffisamment d’émergence et de clairance du réservoir se produisent pour réduire considérablement les titres tissulaires. Procédure A: La cytologie urinaire est généralement effectuée à 1 dpi (ou même plus tôt) pendant la phase 1 pour examiner l’infection aiguë à l’UPEC et pendant la phase 3 pour évaluer la teneur en PMN de l’urine, qui est en corrélation avec l’émergence de l’UPEC. Les échantillons d’urine prélevés à d’autres moments peuvent être analysés de la même manière. Procédure B : La microscopie électronique à balayage de la vessie (MEB) pour examiner l’exfoliation urothéliale est généralement réalisée dans le modèle de 12 h à 3 h après la deuxième exposition à G. vaginalis (15 h après l’administration de la première exposition au temps 0). D’autres points temporels peuvent également être évalués, tels que 6 à 24 heures après l’inoculation UPEC, comme indiqué dans la phase 1. Veuillez cliquer ici pour voir une version agrandie de cette figure.
1. Établir des réservoirs intracellulaires au repos UPEC chez la souris
- Préparez les cathéters urinaires (voir 44,45,46,47 pour les vidéos de cette étape).
- Filer 30 Aiguilles de calibre avec une longueur de tube PE10 s’étendant de la base de l’aiguille à plusieurs mm au-delà de la pointe de l’aiguille. Veillez à ne pas percer le tube avec la pointe de l’aiguille. Alternativement, utilisez des canules intraveineuses pédiatriques46.
- Placez les cathéters préparés dans une boîte de Pétri et stérilisez à la lumière UV pendant au moins 30 min. Remplacez le couvercle de la boîte de Pétri et fixez-le pour le stockage jusqu’à ce que nécessaire.
- Préparer l’inoculum UPEC (Jour -3 à 0)
- Jour -3: Streak UTI89kanR à partir de -80 °C stock de congélation sur une plaque de gélose Luria-Bertani (LB). Incuber la plaque à 37 °C pendant 18-24 h.
REMARQUE: Il n’est pas nécessaire d’ajouter de la kanamycine au milieu de croissance de l’inoculum car la résistance à la kanamycine est intégrée de manière stable dans UTI89kanR. - Jour -2: Inoculer 20 mL de bouillon LB dans une fiole stérile de 125 mL avec une seule colonie d’UTI89kanR. N’utilisez pas une fiole plus petite, car cette méthode de culture est importante pour induire l’expression du pilus UPEC de type 1 nécessaire à l’adhésion de la vessie.
- Incuber statiquement (sans agitation) à 37 °C pendant 18-24 h. N’ajoutez pas d’antibiotiques au milieu de croissance. N’utilisez que des colonies fraîches sur des plaques LB (âgées de 18 à 24 h) pour commencer les cultures liquides.
- Jour -1 : Sous-culture UTI89kanR en retirant 20 μL de culture (faire tourbillonner doucement la fiole pour remettre en suspension les bactéries décantées) et en ajoutant à 20 mL de bouillon LB frais dans une fiole stérile de 125 mL. Incuber comme à l’étape 2, sauf pour une durée ferme de 18 h. N’ajoutez pas d’antibiotiques au milieu de croissance.
- Jour 0: Transférer la culture entière dans un tube de 50 mL et tourner à 3200 × g dans une centrifugeuse de table pendant 10 min pour granuler les bactéries. Aspirer le surnageant et remettre en suspension la pastille bactérienne dans 10 mL de PBS.
- Ajouter 100 μL de la suspension bactérienne concentrée de l’étape 4 à 900 μL de PBS dans une cuvette et déterminer la densité optique à 600 nm (OD600) à l’aide d’un spectrophotomètre qui a été occulté avec PBS. Multiplier la valeur du spectrophotomètre par 10 (pour tenir compte de la dilution) pour déterminer l’OD600 de la suspension (suspension OD).
- Pour atteindre la concentration d’inoculum souhaitée de 1 x 107 UFC dans 50 μL, diluer (ou concentrer) la suspension UTI89kanR à l’aide de l’équation suivante, dans laquellel’inoculum OD souhaité est de 0,35 (la valeur peut varier pour d’autres souches UPEC) et Y est le volume d’inoculum requis (100 μL par souris pour permettre un supplément pour éliminer les bulles et remplir les cathéters):
X mL xsuspension OD = Y mL xINOCULUM OD
Par exemple, si la valeur desuspension OD est de 4,7 et que 5 mL d’inoculum sont requis :
X mL × 4,7 = 5 × 0,35
X = (5 × 0,35) / 4,7
X = 0,372 mL
Par conséquent, ajouter 372 μL de suspension bactérienne pour obtenir 5 mL (volume final) - Utilisez une pipette multicanal pour effectuer des dilutions en série de 1:10 de l’inoculum à 10-6 dans un PBS stérile dans une plaque de 96 puits. Repérez cinq répliques de 10 μL des 6 dilutions sur une plaque LB et LB+kan, laissez sécher les taches et incubez à 37 °C pendant la nuit. La plaque LB sans antibiotiques est utilisée pour s’assurer que l’inoculum n’a pas été contaminé par un autre organisme (qui apparaîtrait comme une morphologie de colonie supplémentaire non présente sur la plaque de sélection des antibiotiques kan). Les deux types de plaques devraient donner le même résultat.
REMARQUE: Les plaques doivent être laissées sécher sur la paillasse pendant un jour avant utilisation afin qu’elles absorbent le liquide plaqué sans que les taches ne fusionnent. - Compter le nombre total de colonies dans tous les points de la dilution avec des colonies distinguables et utiliser la valeur pour calculer la dose réelle d’inoculum utilisée dans chaque expérience. Ne vous fiez pas simplement aux valeurs OD600 .
- Jour -3: Streak UTI89kanR à partir de -80 °C stock de congélation sur une plaque de gélose Luria-Bertani (LB). Incuber la plaque à 37 °C pendant 18-24 h.
- Inoculer UTI89kanR dans les vessies de souris femelles anesthésiées (Jour 0)
REMARQUE: Les enregistrements vidéo de cette procédure ont été publiés précédemment44,46. Reportez-vous à ces documents pour une description plus complète. Voir rubrique 5 de ce protocole pour plus de détails sur le cathétérisme de souris.- Anesthésier les souris par inhalation d’isoflurane selon les méthodes approuvées par l’IACUC.
- En attendant que les souris soient anesthésiées, remplissez la seringue à tuberculine avec de l’inoculum UTI89kanR , puis fixez un cathéter préparé. Appuyez sur le piston pour vider l’air du cathéter, puis tamponnez le cathéter dans un lubrifiant chirurgical stérile.
- Positionnez la souris sur le dos et confirmez l’anesthésie en serrant fermement le repose-pieds de la souris et en observant l’absence de réflexe ou de réponse. Localisez la vessie (ressemble à un pois dans le bas-ventre) entre les index de chaque main. Exprimez l’urine en déplaçant les doigts les uns vers les autres pour appliquer une légère pression pressante sur la vessie.
- Insérez le cathéter à travers l’urètre de la souris dans la vessie et délivrez lentement 50 μL d’inoculum.
- Attendez quelques secondes, puis retirez doucement le cathéter en tirant droit. Remettez la souris dans sa cage et surveillez jusqu’à ce qu’elle se rétablisse de l’anesthésie.
- Répétez les étapes 1.3.1 - 1.3.5 avec des souris supplémentaires, en changeant le cathéter entre chaque cage (5 souris). Si vous le souhaitez, la même procédure peut être utilisée pour inoculer un groupe témoin de souris atteintes de PBS, par exemple pour montrer qu’une autre souche de G. vaginalis provoque une rUTI (au-dessus du niveau spontané / de fond).
2. Surveillance de l’élimination de la bactériurie UPEC (jours 1 à 28)
REMARQUE: La vidéo de la procédure de collecte d’urine a été publiée précédemment44.
- Prélever l’urine (minimum 10 μL) de toutes les souris par palpation de la vessie comme décrit44 à 1 d après l’infection et chaque semaine pendant 4 semaines (7, 14, 21 et 28 d après l’infection). L’urine doit être cultivée dans les quelques heures suivant la collecte afin de surveiller l’infection à l’UPEC. Conserver l’urine à 4 °C jusqu’à ce qu’elle soit plaquée. L’urine peut également être utilisée pour la cytologie (voir rubrique 4). Parfois, si la vessie est très enflammée, 10 μL d’urine ne peuvent pas être obtenus; dans ce cas, le PBS peut être ajouté jusqu’à 10 μL, mais le titre bactérien urinaire et les scores de cytologie doivent être ajustés en conséquence (par exemple, si seulement 5 μL d’urine sont collectés et 5 μL de PBS sont ajoutés, multipliez les titres et les scores par 2).
- Avec une pipette multicanal, effectuez des dilutions en série de 1:10 à 10-6 dans un PBS stérile dans une plaque de 96 puits. Utilisez une pipette multicanal P10 pour repérer 10 μL des 6 dilutions de la colonne 1 dans une orientation verticale sur le bord gauche d’une plaque LB contenant le marqueur de sélection antibiotique approprié. Jetez les embouts.
- Répétez le placage avec les échantillons restants (colonne 2, puis colonne 3, etc.). Une seule plaque peut accueillir 5 échantillons côte à côte. Cela produit une plaque avec une matrice de 5 × 6 points, avec des dilutions croissantes de haut en bas et une augmentation du nombre d’échantillons de gauche à droite (Figure 2A).
- Laissez sécher les taches sur la paillasse, puis incubez à 37 °C pendant la nuit. Le lendemain, comptez le nombre de colonies à l’endroit le moins dilué où les colonies sont distinctes (figure 2B) et utilisez ce nombre pour calculer l’UFC/mL :
Nombre de colonies dans une seule tache d’urine × facteur de dilution × 100 = UFC/mL d’urine - Tracez les titres d’urine UTI89kanR à l’aide d’un logiciel de représentation graphique (Figure 2C). Identifier les souris qui n’ont pas d’infection urinaire détectabledans l’urine à 28 d (~ 65-80% des souris C57BL / 6). Ces souris abritent des réservoirs intracellulaires quiescents et sont utilisées dans la phase expérimentale ultérieure pour examiner l’induction d’infections urinaires récurrentes. Ceux qui ont des bactéries dans l’urine à 28 d ne sont pas inclus dans les étapes suivantes.
3. Exposition de la vessie à G. vaginalis
- Assignez des souris à des groupes d’exposition (Jour 29). L’objectif principal de cette étape est d’éviter d’avoir toutes les souris avec une bactériurie plus prolongée ensemble dans le même groupe d’exposition, car on ne sait pas si cela affecte la probabilité d’infection urinaire.
- À l’aide des données sur l’UFC urinaire (figure 2D), catégorisez les souris en fonction du moment où la bactériurie UTI89kanR n’était plus détectable (figure 2E).
- Randomiser les souris de chaque catégorie dans les groupes d’inoculation G. vaginalis ou PBS; Par exemple, la moitié des souris qui ont dégagé avant le jour 7 obtiennent G. vaginalis et la moitié aura PBS; la moitié des souris qui ont éliminé entre les jours 8 et 14 auront G. vaginalis et la moitié aura le PBS, etc. (comme dans la figure 2E).
- Préparer l’inoculum de G. vaginalis (toutes les étapes effectuées dans une chambre anaérobie)
REMARQUE: Les temps d’incubation de culture idéaux varient selon les différentes souches de G. vaginalis, certaines souches entrant dans la phase stationnaire et commençant même à mourir plus rapidement que d’autres. Ceci est particulièrement important étant donné que G. vaginalis tué (JCP8151B) était incapable de déclencher rUTI39. Ainsi, les temps d’incubation doivent être déterminés empiriquement pour une souche donnée avant d’effectuer des expériences chez la souris. On ne sait pas si d’autres ou toutes les souches de G. vaginalis déclencheront les mêmes effets dans ce modèle.- Souche Streak G. vaginalis à partir de -80 °C de stock de congélation sur une plaque NYCIII (sans antibiotiques). Plaque incubée à 37 °C anaérobie pendant 24 h.
- Dans la chambre anaérobie, inoculer 5 mL de milieux anaérobies NYCIII avec une boucle de cellules de 1 μL (une seule colonie est insuffisante) à partir de la plaque NYCIII et incuber la culture statiquement à 37 °C dans des conditions anaérobies pendant 18 h. N’incluez pas d’antibiotiques dans le milieu de croissance.
- Déterminer la DO600 de la culture à l’aide d’un spectrophotomètre.
- Centrifuger un volume défini (X) de culture à 9600 × g pendant 1 min et aspirer le milieu. Calculer le volume (Y) de PBS pour suspendre à nouveau la pastille afin d’obtenir l’inoculum OD souhaité pour atteindre 108 UFC dans 50 μL en utilisant l’équation suivante:
X mL ×od culture = Y mL × ODinoculum solve pour Y
Y = (X ml ×culture OD) /INOCULUM OD
REMARQUE:L’inoculum OD pour JCP8151BSmR est de 5, mais cela doit être déterminé empiriquement pour d’autres souches de G. vaginalis . Par exemple, si vous filez 3 mL d’une culture liquide JCP8151BSmR pendant la nuit avecculture OD = 2,0: Y = (3 mL × 2,0) / 5,0; par conséquent, remettre en suspension des granulés dans 1,2 mL de PBS - Remettre en suspension la pastille bactérienne dans le PBS à la concentration souhaitée. Diluer et plaquer en série l’inoculum (comme décrit dans le protocole de placage CFU ci-dessus) pour déterminer la dose réelle d’inoculum qui a été utilisée dans chaque expérience. Ne vous fiez pas simplement aux valeurs OD.
- Centrifuger un volume défini (X) de culture à 9600 × g pendant 1 min et aspirer le milieu. Calculer le volume (Y) de PBS pour suspendre à nouveau la pastille afin d’obtenir l’inoculum OD souhaité pour atteindre 108 UFC dans 50 μL en utilisant l’équation suivante:
- Les jours 29 à 31 suivant l’inoculation d’UPEC, inoculent des souris anesthésiées avec G. vaginalis ou PBS comme décrit à l’étape 1.3 ci-dessus. Un groupe témoin PBS est essentiel, car l’acte de cathétérisme de la vessie pourrait éventuellement induire des dommages et une exfoliation urothéliale qui pourraient provoquer un certain degré de réémergence du réservoir UPEC. Les souris inoculées au PBS servent donc de témoin auquel les souris inoculées par G. vaginalis sont comparées.
REMARQUE: La détermination finale de la bactériurie UPEC à 28 d nécessite une incubation de nuit de la plaque UFC. Par conséquent, la première étape pouvant être effectuée est de 29 jours après l’inoculation initiale de l’UPEC. Si nécessaire, l’exposition pourrait être donnée jusqu’au jour 31. Les chercheurs doivent être cohérents entre les expériences. - Répétez la préparation de l’inoculum pour administrer une deuxième inoculation de G. vaginalis (ou contrôle PBS) au moment souhaité, par exemple 12 h ou 1 semaine après la première inoculation. Une deuxième exposition est nécessaire parce qu’une seule inoculation avec G. vaginalis n’entraîne pas d’émergence significative d’UPEC39.
4. Surveillance des infections urinaires récurrentes upec
- Recueillir l’urine des souris aux moments souhaités après chaque inoculation de G. vaginalis (1, 2 et 3 d après l’inoculation recommandés).
- Diluer en série et plaquer l’urine sur des plaques sélectives (p. ex., LB+kanamycine) pour déterminer l’UFC/mL UTI89kanR . Si vous le souhaitez, les dilutions urinaires peuvent également être plaquées sur des plaques sélectives (par exemple, NYCIII + 1 mg / mL de streptomycine) pour déterminer G. vaginalis UFC / mL. Cependant, G. vaginalis JCP8151BSmR a été éliminé de l’urine de la plupart des souris à 12 h 39. Par conséquent, des points temporels plus précoces seraient nécessaires pour détecter G. vaginalis chez la plupart des souris.
- Au critère d’évaluation expérimental (p. ex., 3 j après la deuxième inoculation de G. vaginalis), sacrifier les souris selon des méthodes approuvées (p. ex., luxation cervicale sous anesthésie à l’isoflurane ou inhalation de CO2) et recueillir les vessies et les reins pour le dénombrement de l’UFC, comme décrit précédemment 44,46.
5. Cytologie urinaire
REMARQUE: Cette procédure peut être effectuée à n’importe quel moment où la visualisation des cellules et / ou des bactéries présentes dans l’urine est souhaitée. Comme l’indique la figure 1, la cytologie urinaire est généralement effectuée à 1 dpi (ou même plus tôt) pendant la phase 1 pour examiner l’infection aiguë par l’ECPU et pendant la phase 3 pour évaluer la présence de cellules polymorphonucléaires (PMN) dans les urines qui présentent l’émergence de l’ECUP.
- Ajouter 10 μL d’urine à 90 μL de PBS dans une cassette de cytofunnel avec filtre attaché et glissière. (La méthode la plus simple consiste à utiliser le reste des dilutions 1:10 de la plaque de 96 puits utilisée pour la culture de l’urine; ces échantillons peuvent être utilisés jusqu’à 24 h après la culture de l’urine s’ils sont conservés à 4 °C). Placez les cassettes dans une cytocentrifugation et tournez à 600-800 x g pendant 6 min avec une forte accélération.
- Retirer les lames et laisser sécher pendant la nuit. Le lendemain, tacher avec un kit de coloration hématologique (par exemple, Wright’s, Giemsa, y compris fixateur) selon le protocole du fabricant.
- Analyser les lames par microscopie optique pour détecter la présence de PMN et de cellules épithéliales. Si vous le souhaitez, ceux-ci peuvent être notés à l’aide d’une mesure de notation qualitative basée sur l’abondance de chaque type de cellule présent dans chaque champ de vision de haute puissance (par exemple, 0 = aucun, 1 = peu, 2 = modéré, 3 = robuste). Assurez-vous que la personne qui analyse les diapositives est aveuglée par les groupes expérimentaux afin de minimiser les biais potentiels.
6. Imagerie des vessies par microscopie électronique à balayage
REMARQUE: Cette procédure peut être effectuée à n’importe quel moment où la visualisation de l’urothélium est souhaitée. Comme l’indique la figure 1 (boîtes violettes), les interactions UPEC-urothéliales sont mieux visualisées entre 6 h et 24 h après l’inoculation UPEC pendant la phase de formation du réservoir, et l’exfoliation urothéliale déclenchée par G. vaginalis est mieux visualisée entre 3 h et 12 h après la deuxième exposition à G. vaginalis .
- Fixation in situ de la vessie
- Préparer le fixateur immédiatement avant la récolte de la vessie en ajoutant du glutaraldéhyde (2,5 % final) et du paraformaldéhyde (2 % final) dans un tampon de cacodylate de sodium de 0,15 M avec 2 mM deCaCl2 à pH 7,4. Utilisez le paraformaldéhyde et le glutaraldéhyde provenant d’ampoules en verre nouvellement ouvertes, car les deux fixateurs s’oxydent au fil du temps dans des récipients ouverts.
ATTENTION : Le glutaraldéhyde est toxique, irritant respiratoire et corrosif; le paraformaldéhyde est inflammable, cancérigène, irritant et toxique pour la reproduction; le cacodylate de sodium est toxique et cancérigène. - Pour obtenir 50 mL de solution fixative, ajouter 6,25 mL de paraformaldéhyde à 16 %, 2 mL de glutaraldéhyde à 50 % et 16,75 mL d’eau ultrapure à 25 mL d’une solution de cacodylate de sodium à 0,3 M à pH 7,4 avec 4 mM deCaCl2.
- Réchauffer le fixateur préparé à 37 °C avant de l’administrer à la vessie.
- Remplissez la seringue à pointe glissante de tuberculine avec un fixateur et fixez un cathéter à l’extrémité, en biseau orienté vers les marques opposées de la seringue. Coupez l’excès de tuyau à 1-2 mm de l’extrémité de l’aiguille, en prenant soin de ne pas exposer la pointe de l’aiguille. Faites glisser la seringue pour enlever les bulles et poussez le piston pour vider l’air et remplissez le cathéter de fixateur sur un tube de microcentrifugation pour recueillir tout fixateur pour une élimination appropriée.
- Anesthésier et sacrifier la souris à l’aide d’une méthode approuvée (p. ex. luxation cervicale sous anesthésie). Placez la souris sur la surface de dissection avec les jambes attachées (avec des élastiques ou des épingles). Ouvrez la région pelvienne de la souris avec une pince et une paire de ciseaux chirurgicaux pour exposer la vessie. Écartez soigneusement la graisse adjacente, mais laissez la vessie en place.
- Tenez la seringue avec la main dominante avec l’aiguille pointant vers le bas et le biseau de l’aiguille et les marques de seringue face à vous. Trempez l’extrémité du cathéter dans un lubrifiant stérile.
- Placez l’extrémité du cathéter à l’ouverture urétrale, en tenant le barillet de la seringue à un angle de 30 à 45 ° au-dessus du corps de la souris.
- Appliquez une pression vers le bas en utilisant un très petit mouvement dans le sens des aiguilles d’une montre avec la pointe et insérez doucement le cathéter dans l’urètre. Lorsque la pointe du cathéter pénètre dans l’urètre, articulez la seringue vers la queue de la souris tout en continuant à faire glisser le cathéter plus loin dans l’urètre jusqu’à ce que le barillet de la seringue soit parallèle à la surface de travail. L’arbre entier de l’aiguille du cathéter (à l’exclusion de la base) doit entrer dans la souris, en positionnant la pointe du cathéter dans la lumière de la vessie.
- Délivrez lentement 50 à 80 μL de fixateur, ce qui provoque le gonflage de la vessie comme un ballon. Maintenez le cathéter en place et soulevez légèrement la seringue en inclinant la pointe vers le haut.
- Avec l’autre main, ouvrez un hémostat et faites glisser une broche sous l’aiguille du cathéter à l’intersection de l’urètre. Fermez partiellement l’hémostat jusqu’à ce qu’il entre en contact avec l’aiguille.
- Faites glisser doucement l’aiguille du cathéter hors de la vessie tout en serrant et en verrouillant complètement l’hémostat pour éviter la perte du fixateur.
- Saisissez l’hémostat de sorte qu’il soit parallèle à la surface de travail avec la vessie reposant sur le dessus. Soulevez doucement et soigneusement coupé sous l’hémostat (côté opposé de la vessie) pour retirer la vessie avec l’hémostat encore attaché.
- Placez la vessie et l’hémostat attaché dans un tube Falcon contenant un fixateur chauffé. Assurez-vous que la vessie est complètement immergée dans le liquide et non pressée contre les parois du tube. Incuber à 4 °C pendant 24 h.
- Préparer le fixateur immédiatement avant la récolte de la vessie en ajoutant du glutaraldéhyde (2,5 % final) et du paraformaldéhyde (2 % final) dans un tampon de cacodylate de sodium de 0,15 M avec 2 mM deCaCl2 à pH 7,4. Utilisez le paraformaldéhyde et le glutaraldéhyde provenant d’ampoules en verre nouvellement ouvertes, car les deux fixateurs s’oxydent au fil du temps dans des récipients ouverts.
- Traitement et imagerie de la vessie avec microscopie électronique à balayage (MEB)
- Coupez la vessie en deux avec une lame de rasoir double face nettoyée et faites une deuxième coupe tangentielle à l’hémostat pour libérer la vessie. Il en résulte 2 « tasses » de demi-vessie. S’il reste des coussinets de graisse à l’extérieur de la vessie, retirez-les doucement.
- Rincer les moitiés de la vessie trois fois (10 min chacune) dans un tampon de cacodylate de sodium (0,15 M, pH 7,4).
- Tacher le tissu avec 1% de tétroxyde d’osmium dans un tampon de cacodylate de 0,15 M pendant 1 h à température ambiante. L’osmium est sensible à la lumière; par conséquent, effectuez cette étape avec le récipient de coloration enveloppé dans du papier d’aluminium pour maintenir un environnement sombre.
ATTENTION : Le tétroxyde d’osmium est toxique et corrosif pour la peau. Faites cette étape dans la hotte avec des gants. - Rincez les moitiés de la vessie trois fois (10 min chacune) à l’eau ultrapure. Au cours de ces étapes, l’huile osmique peut parfois être vue à la surface de l’eau. Aspirez ou mèchez-le pour éviter toute contamination pendant les étapes de séchage.
- Déshydrater les tissus en les immergeant dans une série d’éthanol gradué (50, 70, 90, 100 et 100 %) pendant 10 min chacun.
- Séchez le tissu fixe à l’aide d’un sécheur à point critique effectuant12 échanges de CO 2 à la vitesse la plus lente. Réglez tous les paramètres supplémentaires sur lent, à l’exception de l’étape de ventilation qui est réglée sur rapide.
- Coupez à nouveau chaque moitié de vessie en deux avec un rasoir double face propre pour générer 4 pièces totales afin de réduire la courbure de l’échantillon pour un revêtement plus efficace, pour faciliter l’imagerie dans le MEB et pour exposer les tissus qui peuvent s’être recourbés pendant le séchage.
- Collez les morceaux de vessie à une languette adhésive conductrice en carbone sur un talon en aluminium et peignez une petite quantité d’adhésif argenté autour du contact inférieur avec un cure-dent, en prenant soin d’empêcher l’excès d’adhésif de s’évacuer sur la surface interne de la vessie.
- Utilisez un enduit de pulvérisation à vide poussé pour recouvrir les tiges d’échantillon de 6 nm d’iridium. Si les échantillons continuent de se charger, assurez-vous qu’un chemin conducteur est peint jusqu’à la surface avec de la peinture argentée et recouvrez de 4 nm supplémentaires d’iridium.
- Imagez les échantillons avec un microscope électronique à balayage. Bien que les conditions puissent varier en fonction du microscope utilisé, une tension d’accélération de 3 KeV avec un courant de faisceau de 200 pA et une distance de travail de 12-13 mm a bien fonctionné sur un Zeiss Merlin FE-SEM lors de l’utilisation du détecteur d’électrons Everhart-Thornley (SE2).
Résultats
Après l’inoculation, les titres UPEC sont détectables dans l’urine (Figure 2B). Le fait de ne pas plaquer les échantillons d’urine sur des milieux sélectifs contenant de la kanamycine entraînera probablement une prolifération de microbiote endogène de souris contaminant l’urine. Le niveau de bactériurie UPEC sera probablement élevé le jour 1 et pourrait augmenter au cours de la première semaine avant de diminuer à des moments ultérieurs (Figure 2C). Environ 65 à 80 % des souris n’auront pas d’ECI détectable dans l’urine de 28 dpi (Figure 2C, cercle vert). Ces souris peuvent être utilisées dans les étapes suivantes du modèle. Les souris qui restent bactériides (Figure 2C, ellipse rouge) doivent être éliminées de l’expérience.
Deux expositions séquentielles à G. vaginalis à 12 h (figure 3A) ou à 1 semaine d’intervalle (figure 3B) entraînent l’émergence d’UPEC à partir de réservoirs intracellulaires pour provoquer une bactériurie récurrente. Le niveau de bactériurie UPEC (test de Mann-Whitney) et la fraction de souris présentant upEC rUTI (test exact de Fisher) sont significativement plus élevés chez les souris exposées à G. vaginalis par rapport au groupe témoin PBS. L’analyse cytologique de l’urine détecte les PMN dans l’urine de souris exposées à G. vaginalis qui présentaient une émergence UPEC (Figure 3C). Dans le modèle avec deux expositions données à 1 semaine d’intervalle, les titres UPEC dans le tissu vésical sont plus faibles chez les souris exposées à G. vaginalis que chez les souris PBS (Figure 3D), probablement en raison de l’émergence d’UPEC dans les réservoirs et de la clairance ultérieure.
La visualisation du tissu vésical fixé in situ par SEM révèle de grandes cellules urothéliales parapluie superficielles tapissant la surface de la vessie chez des souris témoins exposées uniquement au PBS (Figure 4A). L’exfoliation urothéliale est mise en évidence par une perte de cellules parapluie superficielles, révélant des cellules épithéliales transitionnelles sous-jacentes plus petites chez des souris exposées à G. vaginalis (Figure 4B). Tôt après l’inoculation d’UPEC lors de l’établissement de réservoirs intracellulaires, les UPEC sont visibles sur l’urothélium et s’infiltrent dans les cellules exfoliantes (Figure 4C).
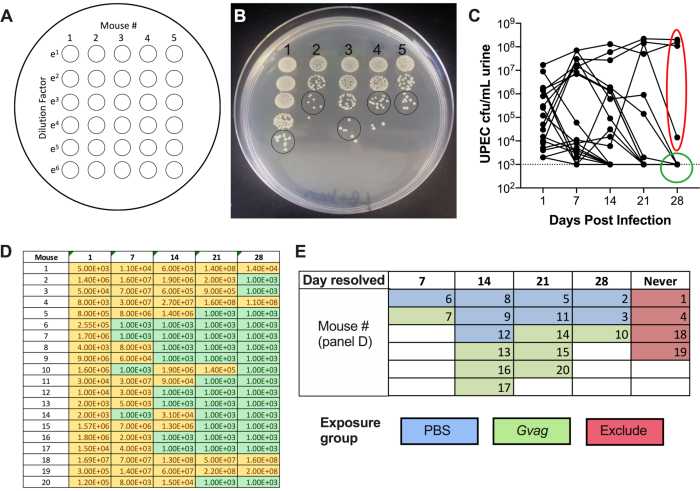
Graphique 2. Surveillance des titres UPEC dans l’urine pendant la phase 1 (formation du réservoir). (A) Schéma du placage des unités formant des colonies (UFC). (B) Image représentative des titres UPEC dans l’urine sur LB+kanamycine. Les cercles noirs indiquent les taches d’échantillon d’urine qui doivent être comptées pour calculer l’UFC / mL. (C) Évolution temporelle de la bactériurie UPEC chez les souris C57BL/6. Chaque ligne représente une souris individuelle, traçant les titres d’urine UPEC au fil du temps. La ligne pointillée indique la limite de détection (1000 UFC/mL). L’ellipse rouge indique quatre souris (sur 20) qui n’ont pas réussi à résoudre la bactériurie UPEC et ne seraient donc pas utilisées pour le modèle rUTI induit par G. vaginalis. Inversement, le cercle vert indique les souris qui ont résolu la bactériurie UPEC et sont passées aux phases suivantes. D) Tableau des données utilisées pour générer un graphique dans le panneau C. Jaune, UFC détectable; vert, pas d’UFC. (E) Randomisation des souris en groupes d’exposition en fonction du moment où l’UFC UPEC n’a plus été détectée dans l’urine (« Jour résolu »). Les numéros de souris dans la colonne de gauche du panneau D sont les mêmes que ceux indiqués dans le panneau E. Veuillez cliquer ici pour afficher une version plus grande de cette figure.
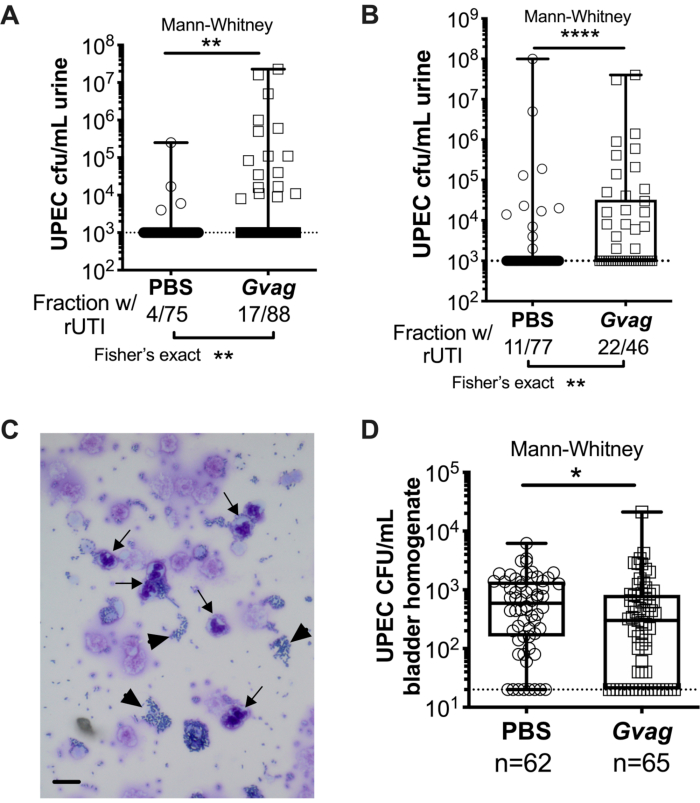
Graphique 3. G. vaginalis déclenche UPEC rUTI. Titres UPEC dans l’urine après deux expositions séquentielles des voies urinaires au PBS (cercles) ou à G. vaginalis (Gvag; carrés) à 12 h (A) ou 1 semaine (B) d’intervalle. Chaque symbole représente une souris individuelle. Les UPEC CFU/mL les plus élevés détectés chez chaque souris entre 1 et 3 j après la deuxième exposition sont tracés. Les souris sans bactériurie détectable sont tracées à la limite de détection (ligne pointillée). (C) Analyse cytologique urinaire montrant des cellules UPEC (pointes de flèches) et polymorphonucléaires (PMN) (flèches). Barre d’échelle = 20 μm. (D) Titres UPEC dans les tissus vésicaux prélevés 3 d à la suite de deux expositions séquentielles aux voies urinaires séparées de 1 semaine. Chaque symbole représente une souris différente et les zéros sont tracés à la limite de détection (ligne pointillée). Dans A, B et D, les boîtes sont au premier et au troisième quartile avec la médiane marquée et les moustaches de min à max. Tests de Mann-Whitney U * P < 0,05; ** P < 0,01; P < 0,0001. Veuillez cliquer ici pour voir une version agrandie de cette figure.
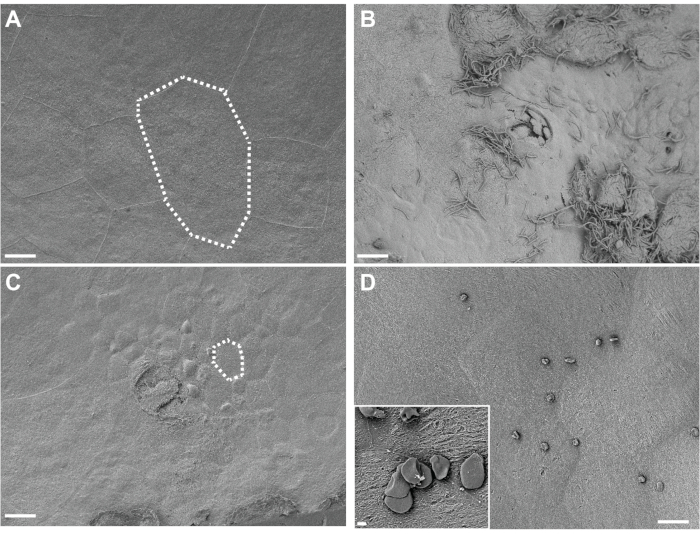
Graphique 4. Analyse SEM des vessies fixées in situ. Les vessies ont été prélevées sur des souris 3 h après deux expositions (à 12 h d’intervalle) au PBS (A) ou à G. vaginalis (C). Les lignes pointillées illustrent une seule cellule épithéliale urinaire, qui est plus petite dans les vessies exposées à G. vaginalis parce que les grandes cellules superficielles se sont exfoliées, révélant l’épithélium transitionnel sous-jacent. (B) Vessie collectée 6 h après l’inoculation initiale avec UPEC, au cours de la phase 1 du modèle, montrant une exfoliation urothéliale et une UPEC extracellulaire. (D) Exemple de gouttelettes de graisse insolubles présentes à la surface de la vessie. Les barres d’échelle sont de 20 μm dans les images principales et de 2 μm dans l’encart. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
La première étape critique de ce modèle consiste à identifier les souris qui n’ont pas éliminé la bactériurie UPEC au cours de la phase primaire d’infection urinaire. Ces souris doivent être retirées de l’expérience car elles confondraient autrement les taux de bactériurie UPEC après l’exposition à G. vaginalis. Après l’inoculation initiale de l’UPEC, l’urine doit être prélevée chaque semaine pour surveiller la clairance bactérienne. Environ 65 à 80 % des souris C57BL/6 élimineront une infection par UTI89kanR dans les 4 semaines. D’autres souches de souris consanguines ont des propensions différentes pour le dégagement UPEC42,43 et la formation de réservoirs et peuvent donc ne pas convenir à ce modèle. Le deuxième point critique est que des études empiriques ont déterminé que deux inoculations séquentielles de G. vaginalis (soit 12 h ou 1 semaine d’intervalle) sont nécessaires pour déclencher une émergence significative du réservoir au-dessus de l’émergence spontanée de fond qui se produit chez les souris témoins exposées uniquement au PBS. D’autres durées entre les deux expositions séquentielles n’ont pas été testées, mais pourraient donner des résultats similaires. Il est important de noter qu’une réduction des titres de vessie UPEC n’a été observée que dans le modèle dans lequel les expositions à G. vaginalis ont été données à 1 semained’intervalle 39. Bien que plus de deux expositions puissent être administrées, les preuves empiriques suggèrent que le cathétérisme répété à lui seul augmente l’émergence, ce qui peut confondre l’interprétation des résultats ou nécessiter un plus grand nombre d’animaux pour distinguer les différences entre les groupes d’exposition et les témoins. Enfin, la méthode de fixation de la vessie in situ comporte plusieurs étapes critiques. Une certaine habileté est nécessaire pour s’assurer que le fixateur reste à l’intérieur des vessies serrées. Les vessies dégonflées seront plus difficiles à imager par SEM. Il est également essentiel d’être très doux lors de l’inoculation du fixateur dans la vessie, car gratter l’urothélium avec le cathéter contenant un fixateur peut induire une exfoliation urothéliale indépendamment de ce qui est déclenché par G. vaginalis. Toutes les concentrations mentionnées dans le cocktail fixateur sont des concentrations finales. Des rapports inappropriés de ceux-ci peuvent entraîner une fixation insuffisante et un gonflement ou un rétrécissement des cellules. Les fixateurs doivent être réchauffés à des températures physiologiques pour éviter les chocs thermiques dans les cellules et les tissus. Le réchauffement apporte également une légère amélioration du taux de diffusion des fixateurs à travers les membranes plasmiques. Bien que la coloration à l’osmium puisse souvent être omise pour les échantillons préparés pour l’analyse SEM, il s’agit d’une étape essentielle de ce protocole pour stabiliser les lipides et prévenir la fissuration des membranes cellulaires lors du séchage aux points critiques.
Ce protocole peut être modifié pour tester d’autres souches UPEC et/ou G. vaginalis pour leur capacité à former des réservoirs et à déclencher leur émergence, respectivement. D’autres facteurs expérimentaux peuvent également être ajoutés, tels que l’exposition à d’autres bactéries vaginales (par exemple, Lactobacillus crispatus PVAS100) ou G. vaginalis tué par la chaleur, dont aucun ne démontre une pathologie dans ce modèle39. Lors de la sélection d’autres souches bactériennes à tester, il est important de démontrer une croissance constante de sorte qu’une concentration d’inoculum standard puisse être utilisée dans toutes les expériences. La croissance de JCP8151BSmR a été optimisée dans une chambre anaérobie. Cette souche pourrait probablement être cultivée dans un système GasPak anaérobie, mais cela nécessiterait une optimisation pour assurer une croissance bactérienne robuste. Enfin, il peut être possible de modifier le timing de certaines étapes du modèle. Par exemple, l’urine peut être recueillie à des moments plus précoces pendant la phase de formation du réservoir UPEC pour surveiller les réponses de l’UFC ou de l’hôte. Un effet indésirable de la collecte d’échantillons d’urine à des moments précoces (3, 6, 12 hpi) sur la progression de l’infection ou l’établissement de réservoirs n’a pas été observé dans ce modèle. L’émergence de réservoirs UPEC a été signalée après deux doses de JCP8151BSmR administrées 12 h ou 1 semaine, mais d’autres intervalles de temps n’ont pas encore été testés. Il peut également être possible de réduire la durée totale du modèle en réduisant la phase de formation du réservoir UPEC à 2 semaines (au lieu de 4 semaines), car de nombreuses souris éliminent la bactériurie à ce moment-là. Des études antérieures portant sur l’émergence de l’UPEC après l’exposition de la vessie à des exfoliants chimiques ont utilisé une phase de formation de réservoir UPEC de 1 ou 2 semainesen phase 17,18. Cependant, la diminution du temps nécessaire à l’élimination de la bactériurie UPEC peut se faire au prix d’exiger que davantage d’animaux soient éliminés de l’expérience. Enfin, l’analyse SEM de la vessie peut être effectuée à des moments supplémentaires pour observer la durée de l’effet de G. vaginalis sur l’urothélium.
En ce qui concerne le dépannage, il y a quelques considérations importantes spécifiquement en ce qui concerne l’analyse SEM de la vessie. Selon le fond de souris utilisé et la quantité d’inflammation présente, certaines vessies présenteront des parois très minces. Ces vessies ont tendance à s’enrouler davantage pendant le séchage des points critiques et peuvent donner une forme de coquille de cauris. Si cela se produit, la meilleure méthode consiste à couper la vessie en forme de coquille en deux le long de l’interface recourbée, puis une deuxième fois pour enlever la majeure partie du tissu en surplomb. La coupe fonctionne mieux avec une lame de rasoir à double tranchant revêtue de PTFE. L’excès de graisse peut parfois se solubiliser pendant les étapes de coloration à l’osmium. Cela peut entraîner des gouttelettes de graisse insolubles indésirables qui peuvent ne pas se laver pendant les étapes de rinçage et de déshydratation et qui peuvent se déposer à la surface de la vessie lors du séchage ultérieur. Ces gouttelettes peuvent apparaître sous la forme de petites sphères ou de structures en forme de disque dispersées sur l’échantillon (Figure 4D). Cela peut être atténué en s’assurant que le plus de tissu adipeux possible est retiré autour de la vessie. Le platine peut être substitué au revêtement à l’iridium, mais les épaisseurs doivent être réduites au minimum pour réduire le masquage des détails structurels fins. L’utilisation d’une étape rotative pendant le revêtement est fortement recommandée.
Une limitation de ce modèle est qu’il nécessite un grand nombre de souris. Seulement 65 à 80 % des souris C57BL/6 élimineront leur bactériurie UPEC et conviendront à l’inoculation ultérieure de G. vaginalis ou de PBS (voir la figure 2C). Pour obtenir 10 à 12 souris par groupe (inoculation de G. vaginalis vs PBS), environ 30 souris doivent être initialement infectées par l’UPEC. En outre, de multiples expériences sont probablement nécessaires pour obtenir les répliques biologiques nécessaires pour détecter la signification statistique. Lorsque les expositions ont été séparées de 1 semaine, l’émergence de l’UPEC s’est produite chez 14 % des souris exposées au PBS (figure 3B). Ainsi, la détection d’une augmentation significative de l’INFECTION URINAIRE À L’UPEC chez les souris exposées à G. vaginalis par rapport aux témoins PBS (puissance à 0,8; alpha = 0,05 [unilatérale]) nécessite de tester un total cumulatif d’au moins 40 souris pour chaque groupe d’exposition. Une considération supplémentaire est que ces expériences sont coûteuses et nécessitent beaucoup de main-d’œuvre. Les souris doivent être surveillées chaque semaine pour la clairance UPEC et le cours temporel expérimental est de 4-5 semaines selon que G. vaginalis est administré deux fois dans un délai de 12 heures ou deux fois à 1 semaine d’intervalle. Le SEM est exigeant en main-d’œuvre et peut être coûteux, en fonction de la disponibilité du microscope et des frais de service. La préparation de la vessie entière pour le SEM fournit un matériel abondant pour l’analyse, mais l’inconvénient est que l’analyse de chaque vessie peut prendre beaucoup de temps. Ainsi, il est probable que seul un nombre limité de vessies peut être analysé par SEM par rapport au nombre plus élevé d’animaux utilisés pour les titres d’urine et de tissu. En outre, l’obtention d’images de haute qualité des surfaces incurvées des « tasses » de la vessie nécessite des compétences en raison des ombres qui peuvent entraver la visibilité. Bien que le SEM de la vessie soit un outil utile pour visualiser l’exfoliation urothéliale, cette méthode est en grande partie qualitative. Étant donné que l’échantillon est fixé dans une forme ronde et qu’en raison de l’utilisation de glutaraldéhyde dans le fixateur, il n’est pas possible de dépister les bactéries exprimant par fluorescence par microscopie optique. Les colorants immunocolorants et chimiques sont incompatibles avec ce processus en raison de l’utilisation de glutaraldéhyde qui réticule la plupart des antigènes et de l’osmium et qui masquera les sites antigéniques et assombrira les tissus. Cela dit, la technique SEM est utile pour les paramètres qui peuvent être évalués quantitativement sans l’utilisation de sondes supplémentaires, telles que la taille des cellules48,49.
Ce modèle offre plusieurs avantages au-delà des méthodes décrites précédemment. Il permet d’examiner les mécanismes de l’UPEC rUTI causés par l’émergence des réservoirs de la vessie, par opposition à la réintroduction dans la vessie à partir d’une source extérieure. D’autres modèles d’infection urinaire r due à l’émergence de réservoirs de la vessie utilisent des agents chimiques (sulfate de protamine ou chitosane) pour provoquer une exfoliation urothéliale17,18, qui ne serait pas un déclencheur de l’infection urinaire chez les femmes. G. vaginalis est une bactérie urogénitale répandue qui a été détectée dans l’urine recueillie directement de la vessie par cathétérisme ou aspiration suprapubienne chez certaines femmes23,26. Ce fait, associé à l’association connue entre la VB (dans laquelle G. vaginalis envahit le vagin) et l’infection urinaire, suggère que G. vaginalis est un déclencheur cliniquement plausible de l’infection urinaire. Enfin, la méthode de fixation in situ de la vessie préserve l’ultrastructure de la vessie et limite les dommages, en veillant à ce que les couches de la vessie ne se séparent pas les unes des autres. Les méthodes précédentes de visualisation de l’urothélium demandaient traditionnellement à l’utilisateur de récolter, de couper en deux, d’étirer et d’épingler la vessie de manière aseptique sur un plateau de dissection avant d’immerger la vessie étirée dans le fixateur48. Cette méthode donne un échantillon très plat mais n’assure pas un étirement uniforme ou naturel du tissu et peut entraîner des zones trop et sous étirées (entraînant un tissu très ridé) et peut provoquer une séparation de la couche de la vessie. De plus, ces manipulations physiques de la vessie pour étirer et épingler le tissu peuvent causer des dommages, y compris l’exfoliation urothéliale. Une autre méthode consiste à immerger les vessies intactes dans un fixateur avant de les incorporer dans de la paraffine et d’acquérir des sections minces avec un microtome. Les sections minces sont inestimables pour les expériences d’immunohistochimie visant à examiner la localisation des bactéries et des protéines hôtes, mais une section mince ne permet pas de visualiser la surface urothéliale. Cette méthode SEM permet d’examiner la surface de toute la vessie en même temps.
Comme décrit, les applications futures de ce modèle comprennent l’essai d’autres souches UPEC pour déterminer si elles forment des réservoirs intracellulaires et le test d’autres souches de G. vaginalis pour évaluer si elles provoquent une exfoliation et l’émergence UPEC pour provoquer une infection urinaire. D’autres souches de souris au-delà des souris C57BL /6 peuvent également être testées, bien que les souris ayant une forte propension à développer une cystite chronique (comme les souris sur le fond C3H) ne soient pas recommandées, car trop de souris devraient être éliminées de l’expérience. Un avantage supplémentaire des souris C57BL/6 est que de nombreuses souches génétiques knockout sont disponibles dans le commerce. De telles souches offrent l’occasion d’interroger les facteurs hôtes impliqués dans la formation et/ou l’émergence des réservoirs.
Déclarations de divulgation
Les auteurs déclarent qu’ils n’ont aucun conflit d’intérêts lié à cette étude.
Remerciements
Les auteurs remercient Lynne Foster pour son assistance technique dans les expériences d’infection, James Fitzpatrick du Washington University Center for Celluar Imaging (WUCCI) pour l’accès au SEM, Scott Hultgren pour la souche UTI89kanR UPEC et David Hunstad pour la lecture critique du manuscrit.
Ce travail a été soutenu par la National Science Foundation (Graduate Research Fellowship to VPO#DGE - 1143954), par le Center for Women’s Infectious Disease Research de la Washington University School of Medicine (Pilot Research Award to NMG), par l’American Heart Association: #12POST12050583 (NMG) et #14POST20020011 (NMG), et par les National Institutes of Health, NIAID: R01 AI114635 (ALL) et NIDDK: R21 DK092586 (ALL), P50 DK064540-11 (SJH, projet II PI:ALL) et K01 DK110225-01A1 (NMG). Certaines des études sur les animaux ont été réalisées dans une installation soutenue par la subvention C06 RR015502 du NCRR. Le Washington University Center for Cellular Imaging (WUCCI; où sem a été effectué) et MSJ ont été soutenus par la Washington University School of Medicine, le Children’s Discovery Institute de l’Université de Washington et le St. Louis Children’s Hospital (CDI-CORE-2015-505), la Foundation for Barnes-Jewish Hospital (3770) et le National Institute for Neurological Disorders and Stroke (NS086741). Les bailleurs de fonds n’ont joué aucun rôle dans la conception de l’étude, la collecte et l’analyse des données, la décision de publier ou la préparation du manuscrit.
matériels
| Name | Company | Catalog Number | Comments |
| 30G x 1/2 needles | BD | 305106 | for catheters |
| 5 1/2" straight forcep hemostat | McKesson | 487377 | in situ bladder fixation |
| ACE 600 Sputter coater | Leica | SEM sample processing | |
| aluminum SEM stub | Ted Pella | 16111 | SEM sample processing |
| Calcium chloride | EMS | 12340 | in situ bladder fixation |
| conductive carbon adhesive tab | Ted Pella | 16084-1 | SEM sample processing |
| Conductive silver paint | Ted Pella | 16034 | SEM sample processing |
| CPD 300 Critical Point Drier | Leica | SEM sample processing | |
| Cytofunnel metal clip | Simport | M964B | cytospun urinalysis |
| Ethanol | EMS | 15050 | SEM sample processing |
| Glucose | Sigma | G7528 | for NYCIII G. vaginalis growth media |
| glutaraldehyde | EMS | 16320 | in situ bladder fixation |
| Hema 3 staining kit | Fisher | 23123869 | cytospun urinalysis |
| HEPES | Cellgro | 25-060-Cl | for NYCIII G. vaginalis growth media |
| iridium | Ted Pella | 91120 | SEM sample processing |
| isofluorane | mouse anaesthesia | ||
| kanamycin | Gibco | 11815024 | add to UPEC LB selective plates (50 ug/mL) |
| Luria-Bertani agar | BD | DF0445174 | UPEC growth plates |
| Luria-Bertani broth | BD | DF0446173 | UPEC growth media |
| Merlin FE-SEM | Zeiss | scanning electron microscope | |
| Milli-Q Water Purifier | Millipore | IQ-7000 | SEM sample processing |
| NaCl | Sigma | S3014 | for NYCIII G. vaginalis growth media |
| Olympus Vanox AHBT3 microscope | Olympus | cytospun urinalysis | |
| osmium tetroxide | EMS | 19170 | SEM sample processing |
| paraformaldehyde | EMS | 15710 | in situ bladder fixation |
| polyethylene tubing | Intramedic | 427401 | for catheters |
| Proteose Peptone #3 | Fisher | DF-122-17-4 | for NYCIII G. vaginalis growth media |
| PTFE coated double edge razor blade | EMS | 72000 | cutting bladders for SEM |
| Shandon Cytocentrifuge | Thermo Scientific | A78300002 | cytospun urinalysis |
| Shandon cytofunnel filter | Simport | M965FWDV | cytospun urinalysis |
| Shandon Double cytofunnel | Simport | M964-1D | cytospun urinalysis |
| Shandon double cytoslides (coated) | Thermo Scientific | 5991055 | cytospun urinalysis |
| sodium cacodylate trihydrate | EMS | 12310 | in situ bladder fixation |
| spectrophotometer | BioChrom | 80-3000-45 | measuring bacterial OD600 |
| streptomycin | Gibco | 11860038 | add to G. vaginalis NYCIII selective plates (1 mg/mL) |
| tuberculin slip tip syringe | BD | 309659 | for catheters |
| Yeast Extract | Fisher | DF0127-17-9 | for NYCIII G. vaginalis growth media |
Références
- Foxman, B. Urinary tract infection syndromes: occurrence, recurrence, bacteriology, risk factors, and disease burden. Infectious Disease Clinics of North America. 28 (1), 1-13 (2014).
- Foxman, B. Recurring urinary tract infection: incidence and risk factors. American Journal of Public Health. 80 (3), 331-333 (1990).
- Foxman, B. Epidemiology of urinary tract infections: incidence, morbidity, and economic costs. American Journal of Medicine. 113, 5-13 (2002).
- Foxman, B. The epidemiology of urinary tract infection. Nature Reviews Urology. 7 (12), 653-660 (2010).
- Ikaheimo, R., et al. Recurrence of urinary tract infection in a primary care setting: analysis of a 1-year follow-up of 179 women. Clinical Infectious Diseases. 22 (1), 91-99 (1996).
- Russo, T. A., Stapleton, A., Wenderoth, S., Hooton, T. M., Stamm, W. E. Chromosomal restriction fragment length polymorphism analysis of Escherichia coli strains causing recurrent urinary tract infections in young women. Journal of Infectious Diseases. 172 (2), 440-445 (1995).
- Luo, Y., et al. Similarity and divergence of phylogenies, antimicrobial susceptibilities, and virulence factor profiles of Escherichia coli isolates causing recurrent urinary tract infections that persist or result from reinfection. Journal of Clinical Microbiology. 50 (12), 4002-4007 (2012).
- Schreiber, H. L. t., et al. Bacterial virulence phenotypes of Escherichia coli and host susceptibility determine risk for urinary tract infections. Science Translational Medicine. 9 (382), (2017).
- Rosen, D. A., Hooton, T. M., Stamm, W. E., Humphrey, P. A., Hultgren, S. J. Detection of intracellular bacterial communities in human urinary tract infection. PLoS Med. 4 (12), 329 (2007).
- Elliott, T. S., Reed, L., Slack, R. C., Bishop, M. C. Bacteriology and ultrastructure of the bladder in patients with urinary tract infections. Journal of Infection. 11 (3), 191-199 (1985).
- Robino, L., et al. Detection of intracellular bacterial communities in a child with Escherichia coli recurrent urinary tract infections. Pathogens and Disease. 68 (3), 78-81 (2013).
- Robino, L., et al. Intracellular bacteria in the pathogenesis of Escherichia coli urinary tract infection in children. Clinical Infectious Diseases. 59 (11), 158-164 (2014).
- De Nisco, N. J., et al. Direct Detection of Tissue-Resident Bacteria and Chronic Inflammation in the Bladder Wall of Postmenopausal Women with Recurrent Urinary Tract Infection. Journal of Molecular Biology. 431 (21), 4368-4379 (2019).
- Mulvey, M. A., Schilling, J. D., Hultgren, S. J. Establishment of a persistent Escherichia coli reservoir during the acute phase of a bladder infection. Infection and Immunity. 69 (7), 4572-4579 (2001).
- Kerrn, M. B., Struve, C., Blom, J., Frimodt-Moller, N., Krogfelt, K. A. Intracellular persistence of Escherichia coli in urinary bladders from mecillinam-treated mice. Journal of Antimicrobial Chemotherapy. 55 (3), 383-386 (2005).
- Eto, D. S., Sundsbak, J. L., Mulvey, M. A. Actin-gated intracellular growth and resurgence of uropathogenic Escherichia coli. Cellular Microbiology. 8 (4), 704-717 (2006).
- Mysorekar, I. U., Hultgren, S. J. Mechanisms of uropathogenic Escherichia coli persistence and eradication from the urinary tract. Proceedings of the National Academy of Sciences of the United States of America. 103 (38), 14170-14175 (2006).
- Blango, M. G., Ott, E. M., Erman, A., Veranic, P., Mulvey, M. A. Forced resurgence and targeting of intracellular uropathogenic Escherichia coli reservoirs. PLoS One. 9 (3), 93327 (2014).
- Gilbert, N. M., Lewis, A. L. Covert pathogenesis: Transient exposures to microbes as triggers of disease. PLoS Pathogens. 15 (3), 1007586 (2019).
- Lewis, A. L., Gilbert, N. M. Roles of the vagina and the vaginal microbiota in urinary tract infection: evidence from clinical correlations and experimental models. GMS Infectious Diseases. 8, (2020).
- Janulaitiene, M., et al. Prevalence and distribution of Gardnerella vaginalis subgroups in women with and without bacterial vaginosis. BMC Infectious Diseases. 17 (1), 394 (2017).
- Fredricks, D. N. Molecular methods to describe the spectrum and dynamics of the vaginal microbiota. Anaerobe. 17 (4), 191-195 (2011).
- Hilt, E. E., et al. Urine is not sterile: use of enhanced urine culture techniques to detect resident bacterial flora in the adult female bladder. Journal of Clinical Microbiology. 52 (3), 871-876 (2014).
- Klein, S., et al. Significant increase in cultivation of Gardnerella vaginalis, Alloscardovia omnicolens, Actinotignum schaalii, and Actinomyces spp. in urine samples with total laboratory automation. European Journal of Clinical Microbiology Infect Dis. 37 (7), 1305-1311 (2018).
- Pearce, M. M., et al. The female urinary microbiome in urgency urinary incontinence. American Journal of Obstetrics and Gynecology. 213 (3), 341 (2015).
- Pearce, M. M., et al. The female urinary microbiome: a comparison of women with and without urgency urinary incontinence. mBio. 5 (4), 01283 (2014).
- Gottschick, C., et al. The urinary microbiota of men and women and its changes in women during bacterial vaginosis and antibiotic treatment. Microbiome. 5 (1), 99 (2017).
- Malki, K., et al. Genomes of Gardnerella Strains Reveal an Abundance of Prophages within the Bladder Microbiome. PLoS One. 11 (11), 0166757 (2016).
- Kramer, H., et al. Diversity of the midstream urine microbiome in adults with chronic kidney disease. International Urology and Nephrology. 50 (6), 1123-1130 (2018).
- Allsworth, J. E., Peipert, J. F. Prevalence of bacterial vaginosis: 2001-2004 National Health and Nutrition Examination Survey data. Obstetrics & Gynecology. 109 (1), 114-120 (2007).
- Ravel, J., et al. Vaginal microbiome of reproductive-age women. Proceedings of the National Academy of Sciences of the United States of America. 108, 4680-4687 (2011).
- Hillier, S. L. Diagnostic microbiology of bacterial vaginosis. American Journal of Obstetrics and Gynecology. 169 (2), 455-459 (1993).
- Amatya, R., Bhattarai, S., Mandal, P. K., Tuladhar, H., Karki, B. M. Urinary tract infection in vaginitis: a condition often overlooked. Nepal Medical College Journal. 15 (1), 65-67 (2013).
- Harmanli, O. H., Cheng, G. Y., Nyirjesy, P., Chatwani, A., Gaughan, J. P. Urinary tract infections in women with bacterial vaginosis. Obstetrics & Gynecology. 95 (5), 710-712 (2000).
- Sharami, S. H., Afrakhteh, M., Shakiba, M. Urinary tract infections in pregnant women with bacterial vaginosis. Journal of Obstetrics and Gynaecology. 27 (3), 252-254 (2007).
- Hillebrand, L., Harmanli, O. H., Whiteman, V., Khandelwal, M. Urinary tract infections in pregnant women with bacterial vaginosis. American Journal of Obstetrics and Gynecology. 186 (5), 916-917 (2002).
- Sumati, A. H., Saritha, N. K. Association of urinary tract infection in women with bacterial vaginosis. Journal of Global Infectious Diseases. 1 (2), 151-152 (2009).
- Gilbert, N. M., Lewis, W. G., Lewis, A. L. Clinical features of bacterial vaginosis in a murine model of vaginal infection with Gardnerella vaginalis. PLoS One. 8 (3), 59539 (2013).
- Gilbert, N. M., O'Brien, V. P., Lewis, A. L. Transient microbiota exposures activate dormant Escherichia coli infection in the bladder and drive severe outcomes of recurrent disease. PLoS Pathogens. 13 (3), 1006238 (2017).
- Wright, K. J., Seed, P. C., Hultgren, S. J. Uropathogenic Escherichia coli flagella aid in efficient urinary tract colonization. Infection and Immunity. 73 (11), 7657-7668 (2005).
- Garofalo, C. K., et al. Escherichia coli from urine of female patients with urinary tract infections is competent for intracellular bacterial community formation. Infection and Immunity. 75 (1), 52-60 (2007).
- Hannan, T. J., Mysorekar, I. U., Hung, C. S., Isaacson-Schmid, M. L., Hultgren, S. J. Early severe inflammatory responses to uropathogenic E. coli predispose to chronic and recurrent urinary tract infection. PLoS Pathogens. 6 (8), 1001042 (2010).
- Hopkins, W. J., Gendron-Fitzpatrick, A., Balish, E., Uehling, D. T. Time course and host responses to Escherichia coli urinary tract infection in genetically distinct mouse strains. Infection and Immunity. 66 (6), 2798-2802 (1998).
- Conover, M. S., Flores-Mireles, A. L., Hibbing, M. E., Dodson, K., Hultgren, S. J. Establishment and Characterization of UTI and CAUTI in a Mouse Model. Journal of Visualized Experiments. (100), e52892 (2015).
- Hannan, T. J., Hunstad, D. A. A Murine Model for Escherichia coli Urinary Tract Infection. Methods in Molecular Biology. 1333, 159-175 (2016).
- Zychlinsky Scharff, A., Albert, M. L., Ingersoll, M. A. Urinary Tract Infection in a Small Animal Model: Transurethral Catheterization of Male and Female Mice. Journal of Visualized Experiments. (130), e54432 (2017).
- Thai, K. H., Thathireddy, A., Hsieh, M. H. Transurethral induction of mouse urinary tract infection. Journal of Visualized Experiments. (42), e2070 (2010).
- O'Brien, V. P., et al. A mucosal imprint left by prior Escherichia coli bladder infection sensitizes to recurrent disease. Nature Microbiology. 2, 16196 (2016).
- O'Brien, V. P., Dorsey, D. A., Hannan, T. J., Hultgren, S. J. Host restriction of Escherichia coli recurrent urinary tract infection occurs in a bacterial strain-specific manner. PLoS Pathogens. 14 (12), 1007457 (2018).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon