Method Article
Infecção recorrente do trato urinário de Escherichia coli desencadeada por gardnerella vaginalis exposição bexiga em camundongos
Neste Artigo
Resumo
Um modelo de camundongos de uropatogenic E. coli (UPEC) inoculação transuretral para estabelecer reservatórios de bexiga intracelular latente e subsequente exposição à bexiga a G. vaginalis para induzir a UTI UPEC recorrente é demonstrado. Também são demonstradas a enumeração de bactérias, citologia urinária, e fixação e processamento in situ bexiga para a varredura de microscopia eletrônica.
Resumo
Infecções recorrentes do trato urinário (rUTI) causadas pela Escherichia coli uropatgênica (UPEC) são comuns e caras. Artigos anteriores descrevendo modelos de UTI em camundongos machos e femininos ilustraram os procedimentos para inoculação bacteriana e enumeração na urina e tecidos. Durante uma infecção inicial da bexiga em camundongos C57BL/6, a UPEC estabelece reservatórios latentes dentro de células epiteliais da bexiga que persistem após a liberação da bacteriúria UPEC. Este modelo baseia-se nesses estudos para examinar o rUTI causado pelo surgimento da UPEC dentro de reservatórios latentes de bexiga. A bactéria urogenital Gardnerella vaginalis é usada como gatilho do rUTI neste modelo porque está frequentemente presente nos tratos urogenitais das mulheres, especialmente no contexto da disbiose vaginal que tem sido associada à UTI. Além disso, também é descrito um método de fixação in situ da bexiga seguido de análise de microscopia eletrônica (SEM) de escaneamento do tecido da bexiga, com potencial aplicação a outros estudos envolvendo a bexiga.
Introdução
As infecções do trato urinário (ITU) impõem uma carga significativa de cuidados de saúde em todo o mundo, impactando a qualidade de vida de milhões de pessoas a cada ano, especialmente as mulheres1. A Escherichia coli uropatogênica (UPEC) é a causa mais frequente da UTI1. Muitos pacientes (aproximadamente 20-30%) que desenvolvem UTI experimentarão uma UTI recorrente (rUTI) dentro de 6 meses, apesar da liberação mediada por antibióticos da infecção inicial2. Infelizmente, cerca de 5% das mulheres na pré-menopausa sofrem de 3 ou mais rUTI a cada ano 3,4. Os episódios sequenciais de rUTI podem ser causados pela persistência da mesma cepa da UPEC do caso do índice 5,6,7,8. Dados de amostras humanas e modelos de camundongos sugerem que a mesma cepa rUTI pode ser causada pela UPEC residente dentro de reservatórios quiescentes na bexiga. Em humanos, a UPEC foi detectada em células epiteliais e biópsias da bexiga de pacientes com UTI 9,10,11,12,13. Estudos em camundongos C57BL/6 demonstraram que algumas cepas de UPEC podem estabelecer reservatórios intracelulares quiescentes na bexiga, detectados pela microscopia de fluorescência e pela homogeneização e cultura do tecido da bexiga, que são mantidos por meses após a resolução da bacteriúria 14,15,16. Tratamento da bexiga com agentes que induzem a esfoliação do epitélio da bexiga (urotélio), por exemplo, sulfato de protamina17 ou quitosan18, desencadear o surgimento da UPEC dos reservatórios para causar rUTI. Esses dados sugerem que em mulheres que abrigam reservatórios de UPEC de bexiga de uma infecção anterior, exposições de bexiga que levam à esfoliação urotelial podem desencadear rUTI.
Há evidências crescentes de que a microbiota vaginal contribui para a infecção do trato urinário19,20. Gardnerella vaginalis é um membro frequente da microbiota vaginal e urinária 21,22,23,24,25,26,27,28,29. Na vagina, a presença de altos níveis de G. vaginalis está associada a uma disbiose microbiana conhecida como vaginose bacteriana (VUL), que afeta ~30% das mulheres 30,31,32. Mulheres com IV têm maior risco de experimentar UTI em comparação com mulheres com uma comunidade vaginal dominada por Lactobacillus 33,34,35,36,37. Em modelos de camundongos, G. vaginalis causa esfoliação epitelial tanto na vagina38 quanto na bexiga39. Em C57BL/6 camundongos que abrigam reservatórios de bexiga da UPEC, duas exposições sequenciais de bexiga à G. vaginalis - mas não à PBS - resultam em ressurgimento da UPEC dos reservatórios para causar rUTI upec. O surgimento é evidenciado pelo aparecimento de tetas upec na urina de camundongos que haviam resolvido anteriormente bacteriúria upec e uma subsequente diminuição nos títulos homogeneizados da bexiga UPEC em sacrifício em comparação com animais de controle expostos à PBS39. Curiosamente, não há uma colonização duradoura por G. vaginalis na bexiga. Na grande maioria dos casos, duas exposições curtas, cada uma com menos de 12 (h) de G. vaginalis viáveis na urina, são suficientes para provocar a esfoliação urotelial e promover a rUTI.
Este protocolo descreve um modelo de camundongo de rUTI causado pela UPEC residente em reservatórios intracelulares de bexiga, usando a inoculação da bexiga G. vaginalis para desencadear a recorrência. O avanço alcançado por este modelo é que a G. vaginalis é um gatilho biológico clinicamente relevante da rUTI em comparação com os agentes químicos usados anteriormente. Além disso, a sobrevida relativamente curta de G. vaginalis no trato urinário do camundongo permite o exame do impacto das exposições microbianas transitórias no urotélio, como pode ocorrer após a atividade sexual. Além de delinear o modelo rUTI, este protocolo também descreve métodos de citologia urinária e fixação in situ bexiga e imagem do urotélio por meio da varredura de microscopia eletrônica (SEM).
Este protocolo de UTI UPEC recorrente induzida por vaginalis usa a cepa UPEC UTI89 com um de resistência à kanamicina (UTI89kanR)40. Nem todas as cepas de UPEC testadas foram capazes de formar comunidades bacterianas intracelulares durante o estágio de infecção aguda em camundongos41 e ainda não se sabe se todas as cepas de UPEC têm a capacidade de formar reservatórios intracelulares latentes. A formação do reservatório deve ser confirmada antes do uso de outras cepas upec no modelo. Este protocolo utiliza um isolado G. vaginalis resistente à estreptomicina espontânea, JCP8151BSmR38. Indução de rUTI por JCP8151BSmR requer duas inoculações sequenciais de G. vaginalis , dadas 12 h ou 7 dias (d) separadas39. Se outras cepas G. vaginalis induzem ou não a esfoliação e/ou UPEC rUTI permanece a ser determinada com este modelo. É essencial usar cepas de UPEC e G. vaginalis com resistência a antibióticos conhecidos (como kanamycin ou espectinicina para UPEC e estreptomicina para G. vaginalis) porque antibióticos podem ser adicionados a placas de ágar para evitar o crescimento de microbiota de camundongos endógenos que poderiam interferir com unidades de formação de colônias enumeradas (CFU) para monitorar a infecção. Isso é especialmente importante para cultivar amostras de urina, porque a urina do rato frequentemente contém outras bactérias que podem crescer demais em placas de cultura sem antibióticos. A origem dessas bactérias endógenas na urina de camundongos é desconhecida, mas provavelmente reflete bactérias periuretrais e urogenitais captadas durante a coleta de urina.
G. vaginalis é uma bactéria anaeróbica facultativa e, portanto, este protocolo descreve o crescimento G. vaginalis JCP8151BSmR em uma câmara anaeróbica. Se uma câmara anaeróbica não estiver disponível, outros métodos para manter condições de crescimento anaeróbicos (como uma bolsa GasPak em um recipiente hermético) podem ser utilizados. Alternativamente, algumas cepas de G. vaginalis (incluindo JCP8151BSmR) crescerão em uma incubadora padrão de cultura tecidual (5% CO2). Assim como o uso de cepas de G. vaginalis que não sejam JCP8151BSmR requer testes para garantir que as bactérias se comportem de forma semelhante neste modelo, mudar as condições de crescimento requer determinação empírica de durações ideais para cultura (em placas e em líquido) e densidade óptica (OD)600 equivalentes para alcançar concentrações inóculos viáveis desejadas. Além disso, não se sabe se as condições de crescimento influenciam a patobiologia de G. vaginalis.
Finalmente, ao considerar se utilizar esse modelo, os pesquisadores devem estar cientes de que ele pode exigir um número maior de animais por grupo do que os modelos típicos de mouses UTI. Isso ocorre em parte porque a indução do rUTI requer que os camundongos resolvam a bacteriúria UPEC causada pela infecção inicial da bexiga. Assim, qualquer camundongo que não consiga limpar bacteriúria (um fenótipo geralmente indicativo de infecção renal contínua) não está incluído na fase rUTI do protocolo. O número de camundongos necessários para alimentar esses estudos também é influenciado pela taxa de emergência "espontânea" da UPEC na urina (12-14% em média). Finalmente, diferentes cepas de camundongos têm diferentes propensões para o desenvolvimento de bacteriúria crônica versus formação de reservatório intracelular42,43. Se usar cepas de camundongos diferentes de C57BL/6 neste modelo, deve-se confirmar que os animais desenvolvem reservatórios intracelulares quiescentes da UPEC.
Protocolo
O Comitê Institucional de Cuidados e Uso de Animais da Universidade de Washington (IACUC) aprovou todas as infecções e procedimentos de camundongos como parte do número de protocolo 20170081, que expirou em 06/09/2020, e 20-0031, que expira em 18/03/2023. O cuidado geral dos animais foi consistente com o Guia para o Cuidado e Uso de Animais de Laboratório do Conselho Nacional de Pesquisa e o Guia de Recursos de Cuidados Com Animais do USDA. Os procedimentos de eutanásia são consistentes com as Diretrizes AVMA para a Eutanásia dos Animais: Edição 2020.

Figura 1. Esquema de Modelo de Rato. O cronograma é destacado para refletir as fases ou procedimentos do modelo descritos no protocolo. Fase 1 (laranja): Estabelecendo reservatórios UPEC intracelulares. Os camundongos são transuretraismente inoculados com UPEC e amostras de urina são coletadas e monitoradas para liberação de bacteriúria. Apenas os camundongos que limpam bacteriúrias prosseguem para as fases subsequentes. Fase 2 (verde): Exposição na bexiga a G. vaginalis. Camundongos são inoculados transuretralmente com G. vaginalis duas vezes. A duração do tempo entre as duas exposições sequenciais é de 12 h (painel superior) ou 1 semana (wk; painel inferior), dependendo da análise a jusante desejada. Fase 3 (amarelo): UPEC rUTI. A urina é coletada diariamente após a exposição g. vaginalis e monitorada para bacteriuria upec. Além disso, bexigas e rins podem ser coletados no ponto final experimental para medir os teciduais da UPEC. No modelo de exposição de 1 wk, o surgimento induzido por G. vaginalis de UPEC de reservatórios intracelulares e o despejo subsequente do trato urinário também são refletidos em uma diminuição nos de tecido da bexiga upec (em comparação com camundongos expostos à PBS, ver Figura 3D). Essa diminuição dos títricos da bexiga não ficou evidente no modelo de exposição de 12 h, presumivelmente porque é necessário mais tempo para que ocorram um surgimento e liberação suficientes do reservatório para reduzir significativamente os teciduais. Procedimento A: A citologia urinária é normalmente realizada 1 dpi (ou até mais cedo) durante a Fase 1 para examinar a infecção aguda da UPEC e durante a Fase 3 para avaliar o teor de PMN de urina, que se correlaciona com o surgimento da UPEC. Amostras de urina coletadas em outros pontos de tempo podem ser analisadas da mesma forma. Procedimento B: Microscopia eletrônica de varredura de bexiga (SEM) para examinar a esfoliação urotelial é tipicamente realizada no modelo de 12 h a 3 h após a segunda exposição G. vaginalis (15 h após a administração da primeira exposição no tempo 0). Outros pontos de tempo também podem ser avaliados, como 6-24 h após a inoculação da UPEC, conforme mostrado na Fase 1. Clique aqui para ver uma versão maior desta figura.
1. Estabelecer reservatórios intracelulares quiescentes da UPEC em camundongos
- Prepare cateteres urinários (consulte 44,45,46,47 para vídeos desta etapa).
- Rosca 30 Agulhas gauge com um comprimento de tubo PE10 estendendo-se da base da agulha para vários mm além da ponta da agulha. Tome cuidado para não perfurar a tubulação com a ponta da agulha. Alternativamente, use cânulas intravenosas pediátricas46.
- Coloque cateteres preparados em uma placa de petri e esterilize com luz UV por pelo menos 30 min. Substitua a tampa da placa de petri e fixe para armazenamento até que seja necessário.
- Prepare o inóculo UPEC (Dia -3 a 0)
- Dia -3: Streak UTI89kanR de -80 °C de caldo congelador em uma placa de ágar Luria-Bertani (LB). Incubar placa a 37 °C para 18-24 h.
NOTA: Não é necessário adicionar kanamicina à mídia de crescimento inóculo porque a resistência à kanamicina é firmemente integrada em UTI89kanR. - Dia -2: Inocular 20 mL de caldo LB em um frasco estéril de 125 mL com uma única colônia de UTI89kanR. Não utilize um frasco menor porque este método de cultura é importante para induzir a expressão do pilus tipo 1 da UPEC que é necessário para a adesão da bexiga.
- Incubar estaticamente (sem tremer) a 37 °C para 18-24 h. Não adicione antibióticos ao meio de crescimento. Use apenas colônias frescas em placas LB (18-24 h de idade) para iniciar culturas líquidas.
- Dia -1: Subcultura UTI89kanR removendo 20 μL de cultura (gire suavemente o frasco para resuspend bactérias assentadas) e adicionando a 20 mL de caldo LB fresco em um frasco estéril de 125 mL. Incubar como na etapa 2, exceto por uma duração firme de 18 horas. Não adicione antibióticos ao meio de crescimento.
- Dia 0: Transfira toda a cultura para um tubo de 50 mL e gire a 3200 × g em uma centrífuga de mesa por 10 minutos para a bactéria de pelotas. Aspirar supernante e resuspensar a pelota bacteriana em 10 mL de PBS.
- Adicione 100 μL da suspensão bacteriana concentrada da etapa 4 a 900 μL de PBS em um cuvette e determine a densidade óptica a 600 nm (OD600) usando um espectotômetro que foi apagado com PBS. Multiplique o valor do espectrômetro por 10 (para explicar a diluição) para determinar o OD600 da suspensão (suspensão OD).
- Para alcançar a concentração inóculo desejada de 1 x 107 UFC em 50 μL, diluir (ou concentrar) a suspensãoUTI89 kanR usando a seguinte equação, na qual oinóculo OD desejado é 0,35 (o valor pode variar para outras cepas UPEC) e Y é o volume de inóculo necessário (100 μL por mouse para permitir extra para eliminar bolhas e encher os cateteres):
X mL xsuspensão OD = Y mL x ODinóculo
Por exemplo, se o valor dasuspensão OD for de 4,7 e 5 mL de inóculo são necessários:
X mL × 4,7 = 5 × 0,35
X = (5 × 0,35) / 4,7
X = 0,372 mL
Portanto, adicione 372 μL de suspensão bacteriana para fazer 5 mL (volume final) - Use uma pipeta multicanal para fazer diluições seriais de 1:10 do inóculo para 10-6 em PBS estéril em uma placa de 96 poços. Local apenas 10 μL se reproduz de todas as 6 diluições em uma placa LB e LB+kan, deixe as manchas secarem e incubar a 37 °C durante a noite. A placa LB sem antibióticos é usada para garantir que o inóculo não foi contaminado por outro organismo (o que apareceria como uma morfologia adicional da colônia não presente na placa de seleção de antibióticos kan). Ambos os tipos de placas devem produzir o mesmo resultado.
NOTA: As placas devem ser permitidas a secar no banco por um dia antes do uso para que absorvam o líquido banhado sem manchas coalescendo. - Conte o número total de colônias em todos os pontos da diluição com colônias distintas e use o valor para calcular a dose real de inóculo usada em cada experimento. Não confie simplesmente nos valores OD600 .
- Dia -3: Streak UTI89kanR de -80 °C de caldo congelador em uma placa de ágar Luria-Bertani (LB). Incubar placa a 37 °C para 18-24 h.
- Inoculado UTI89kanR nas bexigas de camundongos fêmeas anestesiadas (Dia 0)
NOTA: As gravações de vídeo deste procedimento foram publicadas anteriormente44,46. Consulte estes trabalhos para obter uma descrição mais completa. Consulte a seção 5 deste protocolo para obter mais detalhes sobre o cateterismo do mouse.- Anestesiar camundongos com inalação de isoflurane de acordo com métodos aprovados pela IACUC.
- Enquanto aguarda ratos para se tornarem anestesiados, encha a seringa tuberculina com UTI89kanR inóculo e, em seguida, afixe um cateter preparado. Deprimir o êmbolo para anular o ar do cateter, em seguida, dab o cateter em lubrificante cirúrgico estéril.
- Posicione o mouse de costas e confirme a anestesia apertando firmemente o footpad do mouse e observando a ausência de um reflexo ou resposta. Localize a bexiga (parece uma ervilha no abdômen inferior) entre os dedos indicadores de cada mão. Expresse urina movendo os dedos em direção um ao outro para aplicar uma pressão suave na bexiga.
- Insira o cateter através da uretra do rato na bexiga e entregue lentamente 50 μL de inóculo.
- Espere alguns segundos e, em seguida, remova suavemente o cateter puxando para fora. Volte o mouse para sua gaiola e monitore até que ele se recupere da anestesia.
- Repetir passos 1.3.1 - 1.3.5 com ratos adicionais, mudando o cateter entre cada gaiola (5 ratos). Se desejar, o mesmo procedimento pode ser usado para inocular um grupo controle de camundongos com PBS, por exemplo, para mostrar outra cepa de G. vaginalis provoca rUTI (sobre o nível espontâneo/fundo).
2. Monitoramento da liberação da bacteriúria upec (dias 1 a 28)
NOTA: O vídeo do procedimento de coleta de urina foi publicado anteriormente44.
- Coletar urina (mínimo de 10 μL) de todos os camundongos por palpação da bexiga como descrito44 a 1 d infecção pós e semanalmente por 4 wk (7, 14, 21 e 28 d pós infecção). A urina deve ser cultivada dentro de algumas horas após a coleta, a fim de monitorar a infecção da UPEC. Armazene urina a 4 °C até emplacar. A urina também pode ser usada para citologia (ver Seção 4). Ocasionalmente, se a bexiga estiver muito inflamada, 10 μL de urina não podem ser obtidas; neste caso, o PBS pode ser adicionado até 10 μL, mas os escores de titulação bacteriana de urina e citologia devem ser ajustados de acordo (por exemplo, se apenas 5 μL de urina for coletada e 5 μL PBS for adicionada, multiplique titers e escores por 2).
- Com uma pipeta multicanal, faça diluições seriais de 1:10 para 10-6 em PBS estéril em uma placa de 96 poços. Use uma pipeta multicanal P10 para detectar 10 μL de todas as 6 diluições da coluna 1 em uma orientação vertical na borda esquerda de uma placa LB contendo o marcador de seleção de antibióticos relevante. Descarte dicas.
- Repita o revestimento com as amostras restantes (coluna 2, depois coluna 3, etc.). Uma única placa pode acomodar 5 amostras lado a lado. Isso produz uma placa com matriz de 5 × 6 pontos, com diluições crescentes de cima para baixo e números amostrais crescentes da esquerda para a direita (Figura 2A).
- Deixe as manchas secarem no banco e, em seguida, incubar a 37 °C durante a noite. No dia seguinte, conte o número de colônias no local menos diluído em que as colônias são distintas (Figura 2B) e use este número para calcular CFU/mL:
# de colônias em ponto de urina única × fator de diluição × 100 = urina de UFC/mL - Plot UTI89kanR urine titers usando software de grafing (Figura 2C). Identifique camundongos que não tenhamUTI89 kanR detectável na urina em 28 d (~65-80% de camundongos C57BL/6). Estes camundongos abrigam reservatórios intracelulares quiescentes e são usados na fase experimental subsequente para examinar a indução da UTI recorrente. Aqueles com bactérias na urina a 28 d não estão incluídos nas etapas subsequentes.
3. Exposições de bexiga a G. vaginalis
- Atribua camundongos a grupos de exposição (Dia 29). O objetivo principal desta etapa é evitar ter todos os camundongos com bacteriurias mais prolongadas juntos no mesmo grupo de exposição, uma vez que não se sabe se isso afeta a probabilidade de rUTI.
- Utilizando os dados da CFU de urina (Figura 2D), categorize os camundongos com base no ponto de tempo em que a bacteriúriaUTI89 kanR não era mais detectável (Figura 2E).
- Randomizar os camundongos de cada categoria nos grupos de inoculação G. vaginalis ou PBS; por exemplo, metade dos camundongos que limparam antes do dia 7 obter G. vaginalis e metade terá PBS; metade dos camundongos que limparam entre os dias 8 e 14 obterão G. vaginalis e metade terá PBS, etc. (como na Figura 2E).
- Prepare G. vaginalis inoculum (todos os passos realizados em uma câmara anaeróbica)
NOTA: Os tempos ideais de incubação da cultura variam entre diferentes cepas de G. vaginalis, com algumas cepas entrando na fase estacionária e até começando a morrer mais rapidamente do que outras. Isso é particularmente importante, dado que g. vaginalis (JCP8151B) não foi capaz de desencadear rUTI39. Assim, os tempos de incubação devem ser determinados empiricamente para uma determinada cepa antes de realizar experimentos em camundongos. Não se sabe se outras/todas as cepas de G. vaginalis desencadearão os mesmos efeitos neste modelo.- Streak G. vaginalis coa de -80 °C de caldo congelador em uma placa NYCIII (sem antibióticos). Incubar placa a 37 °C anaerobicamente por 24 h.
- Na câmara anaeróbica, inocular 5 mL de mídia aneróbica NYCIII com um loopful de 1 μL de células (uma única colônia é insuficiente) da placa NYCIII e incubar a cultura estaticamente a 37 °C sob condições anaeróbicas por 18 h. Não inclua antibióticos no meio de crescimento.
- Determine o OD600 da cultura usando um espectotômetro.
- Centrifugar um volume definido (X) de cultura a 9600 × g por 1 min e aspirar a mídia. Calcule o volume (Y) do PBS para suspender a pelota para alcançar o OD inóculo desejado para alcançar 108 CFU em 50 μL usando a seguinte equação:
X mL ×cultura OD = Y mL × soluçãoinóculo OD para Y
Y = (X ml ×cultura OD) / ODinoculum
NOTA: Oinóculo OD para JCP8151BSmR é 5, mas isso deve ser determinado empiricamente para outras cepas G. vaginalis . Por exemplo, se girar 3 mL de uma cultura líquida JCP8151Bdurante a noite comcultura OD = cultura OD = 2,0: Y= (3 mL × 2,0) / 5.0; portanto, resuspend pelotas em 1,2 mL PBS - Resuspente a pelota bacteriana na PBS para a concentração desejada. Diluir e emplacar o inóculo (como descrito no protocolo de chapeamento da UFC acima) para determinar a dose real de inóculo que tem sido usada em cada experimento. Não confie simplesmente nos valores de OD.
- Centrifugar um volume definido (X) de cultura a 9600 × g por 1 min e aspirar a mídia. Calcule o volume (Y) do PBS para suspender a pelota para alcançar o OD inóculo desejado para alcançar 108 CFU em 50 μL usando a seguinte equação:
- No dia 29-31, após a inoculação da UPEC, inoculam camundongos anestesiados com G. vaginalis ou PBS como descrito na etapa 1.3 acima. Um grupo controle da PBS é essencial, pois o ato de cateterizar a bexiga poderia possivelmente induzir danos e esfoliação urotelial que poderia provocar algum grau de ressurgimento do reservatório upec. Os camundongos inoculados de PBS servem, portanto, como o controle ao qual os camundongos g . vaginalis-inoculados são comparados.
NOTA: A determinação final da bacteriúria da UPEC em 28 d requer a incubação noturna da placa de CFU. Portanto, o mais cedo que essa etapa pode ser realizada é 29 dias após a inoculação inicial da UPEC. Se necessário, a exposição pode ser dada até o dia 31. Os pesquisadores devem ser consistentes entre os experimentos. - Repita a preparação do inóculo para administrar uma segunda inoculação G. vaginalis (ou controle PBS) no ponto de tempo desejado, como 12 h ou 1 wk após a primeira inoculação. Uma segunda exposição é necessária porque uma única inoculação com G. vaginalis não resulta em emergência upecsignificativa 39.
4. Monitoramento da UTI recorrente da UPEC
- Coletar urina de camundongos nos pontos de tempo desejados após cada inoculação G. vaginalis (1, 2 e 3 d pós-inoculação recomendada).
- Diluir em série e urina de placa em placas seletivas (por exemplo, LB+kanamycin) para determinar UTI89kanR CFU/mL. Se desejar, as diluições de urina também podem ser emplacar em placas seletivas (por exemplo, NYCIII + 1 mg/mL streptomicina) para determinar g. vaginalis CFU/mL. No entanto, g. vaginalis JCP8151BSmR foi liberado da urina da maioria dos camundongos por 12 h 39. Portanto, pontos de tempo anteriores seriam necessários para detectar G. vaginalis na maioria dos camundongos.
- No ponto final experimental (por exemplo, 3 d após a segunda inoculação de G. vaginalis), sacrifique os camundongos de acordo com métodos aprovados (por exemplo, luxação cervical sob anestesia isoflurane ou inalação de CO2) e colete bexigas e rins para enumeração da UFC, como descrito anteriormente 44,46.
5. Citologia urinária
NOTA: Este procedimento pode ser realizado a qualquer momento em que a visualização das células e/ou bactérias presentes na urina seja desejada. Conforme indicado na Figura 1, a citologia urinária é normalmente realizada em 1 dpi (ou até mais cedo) durante a Fase 1 para examinar a infecção aguda da UPEC e durante a Fase 3 para avaliar a presença de células polimorfonucleares (PMN) em urinas que apresentam emergência upec.
- Adicione 10 μL de urina a 90 μL de PBS em um cassete citofunnel com filtro e slide conectados. (O método mais simples é usar o restante das diluições de 1:10 da placa de 96 poços usada para cultivo de urina; estas amostras podem ser usadas até 24 h após a colheita da urina se armazenadas a 4 °C). Coloque em cito-centrífuga e gire a 600-800 x g por 6 min com alta aceleração.
- Remova os slides e deixe secar durante a noite. No dia seguinte, colori a mancha com um kit de coloração de hematologia (por exemplo, Wright's, Giemsa, incluindo fixação) de acordo com o protocolo do fabricante.
- Analise os slides por microscopia leve para a presença de PMNs e células epiteliais. Se desejar, estes podem ser pontuados usando uma métrica de pontuação qualitativa com base na abundância de cada tipo de célula presente em cada campo de visão de alta potência (por exemplo, 0=nenhum, 1=poucos, 2= moderado, 3=robusto). Certifique-se de que o indivíduo que analisa os slides esteja cego aos grupos experimentais para minimizar o viés potencial.
6. Imagens de bexigas por meio da microscopia eletrônica
NOTA: Este procedimento pode ser realizado em qualquer ponto de tempo em que a visualização do urothelium é desejada. Conforme indicado na Figura 1 (caixas roxas), as interações UPEC-urotelial são melhor visualizadas entre 6h e 24h pós inoculação UPEC durante a fase de formação do reservatório, e a esfoliação urotelial desencadeada por G. vaginalis é melhor visualizada entre 3h e 12 h após a segunda exposição G. vaginalis .
- Fixação da bexiga in situ
- Prepare fixação imediatamente antes da colheita da bexiga adicionando glutaraldeído (2,5% final) e paraformaldeído (2% final) em 0,15 M tampão de cacodilato de sódio com 2 mM de CaCl2 no pH 7.4. Use paraformaldeído e glutaraldeído de ampolas de vidro recém-abertas, pois ambos os fixativos oxidam ao longo do tempo em recipientes abertos.
ATENÇÃO: O glutaraldeído é tóxico, irritante respiratório e corrosivo; paraformaldeído é inflamável, cancerígeno, irritante e uma toxina reprodutiva; cacodilato de sódio é tóxico e cancerígeno. - Para fazer 50 mL de solução fixa, adicione 6,25 mL de 16% de paraformaldeído, 2 mL de glutaraldeído de 50% e 16,75 mL de água ultrauso a 25 mL de uma solução de 0,3 M de cacodito de sódio em pH 7,4 com 4 mM CaCllate2.
- Aqueça o fixador preparado a 37 °C antes de administrar as bexigas.
- Encha a seringa de ponta de deslizamento tuberculina com fixação e afixe um cateter até o final, chanfrado voltado para marcas de seringa opostas. Corte o excesso de tubos de 1 a 2 mm da extremidade da agulha, tomando cuidado para não expor a ponta da agulha. Flick a seringa para remover bolhas e empurre o êmbolo para anular o ar e encha o cateter com fixação sobre um tubo de microcentrifutura para coletar qualquer fixação para o descarte adequado.
- Anestesiar e sacrificar o rato usando um método aprovado (por exemplo, luxação cervical sob anestesia). Coloque o mouse na superfície de dissecação com as pernas presas (com elásticos ou pinos). Abra a área pélvica do rato com fórceps e um par de tesouras cirúrgicas para expor a bexiga. Afaste cuidadosamente a gordura adjacente, mas deixe a bexiga no lugar.
- Segure a seringa com a mão dominante com a agulha apontada para baixo e as marcas de bevel e seringa de agulha voltadas para longe de você. Mergulhe a ponta do cateter em lubrificante estéril.
- Posicione a ponta do cateter na abertura uretral, segurando o barril de seringa posicionado em um ângulo de 30-45° sobre o corpo do rato.
- Aplique pressão para baixo usando um movimento muito pequeno no sentido horário com a ponta e insira suavemente o cateter na uretra. À medida que a ponta do cateter entra na uretra, dobradiça a seringa em direção à cauda do mouse enquanto continua a deslizar o cateter ainda mais para dentro da uretra até que o barril de seringa esteja paralelo à superfície de trabalho. Todo o eixo da agulha do cateter (sem incluir a base) deve entrar no mouse, posicionando a ponta do cateter dentro do lúmen da bexiga.
- Entregue lentamente 50-80 μL de fixação, fazendo com que a bexiga infle como um balão. Mantenha o cateter no lugar e levante ligeiramente a seringa, inclinando a ponta para cima.
- Por outro lado, abra um hemostat e deslize um pino sob a agulha do cateter na intersecção da uretra. Feche parcialmente o hemostat até que ele faça contato com a agulha.
- Deslize suavemente a agulha do cateter para fora da bexiga enquanto aperta simultaneamente e bloqueia completamente o hemostat para evitar a perda do fixador.
- Segure o hemostat para que seja paralelo à superfície de trabalho com a bexiga descansando em cima. Levante suavemente e cuidadosamente cortado sob o hemostat (lado oposto da bexiga) para remover a bexiga com o hemostat ainda ligado.
- Coloque a bexiga e o hemostat em um tubo Falcão contendo fixação aquecida. Certifique-se de que a bexiga está totalmente submersa no fluido e não pressionada contra as paredes do tubo. Incubar a 4 °C por 24 h.
- Prepare fixação imediatamente antes da colheita da bexiga adicionando glutaraldeído (2,5% final) e paraformaldeído (2% final) em 0,15 M tampão de cacodilato de sódio com 2 mM de CaCl2 no pH 7.4. Use paraformaldeído e glutaraldeído de ampolas de vidro recém-abertas, pois ambos os fixativos oxidam ao longo do tempo em recipientes abertos.
- Processamento da bexiga e imagem com microscopia eletrônica de varredura (SEM)
- Sagilmente bissecte a bexiga com uma lâmina de barbear limpa, de dois lados, e faça um segundo corte tangencial ao hemostat para liberar a bexiga. Isso resulta em 2 "xícaras" de meia bexiga. Se houver alguma almofada de gordura remanescente no exterior da bexiga, remova-as suavemente.
- Enxágüe as metades da bexiga três vezes (10 min cada) em tampão de cacodilato de sódio (0,15 M, pH 7,4).
- Manche o tecido com 1% de tetroxida de ósmio em 0,15 M tampão de cacodilato por 1 h à temperatura ambiente. O ósmio é sensível à luz; portanto, realize esta etapa com o vaso de coloração envolto em papel alumínio para manter um ambiente escuro.
ATENÇÃO: O tetroxida de ósmio é tóxico e corrosivo para a pele. Faça este passo no capô da fumaça com luvas. - Enxágüe as metades da bexiga três vezes (10 min cada) em água ultrauso. Durante essas etapas, o óleo osmicated pode ser visto em algum momento na superfície da água. Aspire ou mestigue isso para evitar contaminação durante as etapas de secagem.
- Desidratar tecidos submergindo em uma série de etanol classificado (50, 70, 90, 100 e 100%) para 10 min cada.
- Seque o tecido fixo usando um secador de ponto crítico realizando 12 trocas de CO2 na velocidade mais lenta. Defina todas as configurações adicionais para diminuir, exceto para a etapa de ventilação que é definida como rápida.
- Bisect cada bexiga metade novamente com uma navalha de dupla lateragem limpa para gerar 4 peças totais para reduzir a curvatura do espécime para um revestimento mais eficiente, para facilitar a imagem no SEM, e para expor tecido que pode ter enrolado durante a secagem.
- Adere as peças da bexiga a uma guia de adesivo de carbono condutor em uma barra de alumínio e pinte uma pequena quantidade de adesivo de prata ao redor do contato inferior com um palito de dente, tomando cuidado para evitar que o excesso de adesivos se enfiem na superfície interna da bexiga.
- Use um cabador de sputter de alto vácuo para respirar os stubs de amostra com 6 nm de irídio. Se as amostras continuarem a carregar, certifique-se de que um caminho condutor seja pintado à superfície com tinta prateada e casaco com um adicional de 4 nm de irídio.
- Imagem as amostras com um microscópio eletrônico de varredura. Embora as condições possam variar dependendo do microscópio utilizado, uma tensão acelerada de 3 KeV com uma corrente de feixe de 200 pA e uma distância de trabalho de 12-13 mm funcionou bem em um Zeiss Merlin FE-SEM ao usar o detector de elétrons Everhart-Thornley (SE2).
Resultados
Após a inoculação, os títulos UPEC são detectáveis na urina (Figura 2B). A não colocação de amostras de urina em meios seletivos contendo kanamicina provavelmente resultará em crescimento excessivo de microbiota de camundongos endógenos contaminando a urina. O nível de bacteriúria upec provavelmente será alto no dia 1 e pode aumentar durante a primeira semana antes de diminuir em momentos posteriores (Figura 2C). Aproximadamente 65-80% dos camundongos não terão UPEC detectável na urina por 28 dpi (Figura 2C, círculo verde). Estes camundongos podem ser usados nas etapas subsequentes do modelo. Os camundongos que permanecem bacteriúricos (Figura 2C, elipse vermelha) devem ser eliminados do experimento.
Duas exposições sequenciais de G. vaginalis dadas a 12 h (Figura 3A) ou 1 wk de distância (Figura 3B) resultam no surgimento da UPEC de reservatórios intracelulares para causar bacteriurias recorrentes. Tanto o nível de bacteriúria UPEC (teste mann-whitney) quanto a fração de camundongos que exibem upec rUTI (teste exato de Fisher) são significativamente mais elevados em camundongos expostos a G. vaginalis em comparação com o grupo controle pbs. A análise de citologia urinária detecta PMNs na urina de camundongos expostos a G. vaginalis que apresentaram emergência UPEC (Figura 3C). No modelo com duas exposições dadas a 1 wk de distância, os UPEC no tecido da bexiga são menores em camundongos expostos a G. vaginalis em comparação com a PBS (Figura 3D), presumivelmente devido ao surgimento da UPEC dos reservatórios e posterior desembaraço.
A visualização do tecido da bexiga in situ-fixo pela SEM revela grandes células urtelial superficiais que revestem a superfície da bexiga em camundongos de controle expostos apenas à PBS (Figura 4A). A esfoliação urotelial é evidenciada pela perda de células superfênricas do guarda-chuva, revelando células epiteliais transitórias menores subjacentes em camundongos expostos a G. vaginalis (Figura 4B). Logo após a inoculação da UPEC durante o estabelecimento de reservatórios intracelulares, a UPEC é visível no urotélio e filamentos de células esfoliantes (Figura 4C).
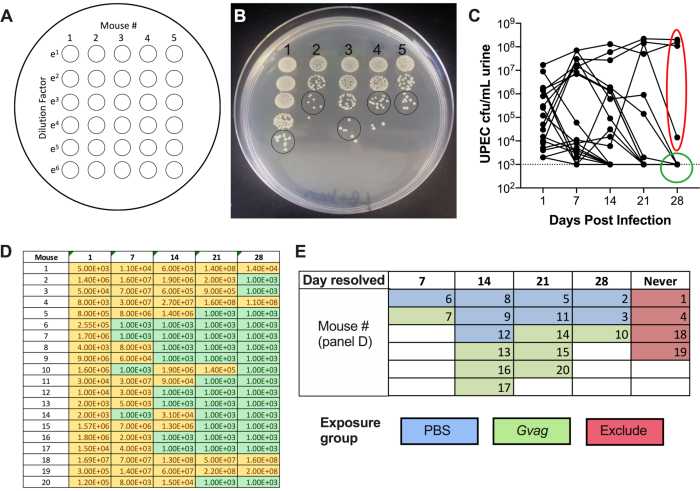
Figura 2. Monitoramento de tetas UPEC na urina durante a Fase 1 (formação do reservatório). (A) Esquema de revestimento de unidades formadoras de colônias (UFC). (B) Imagem representativa dos títulos UPEC na urina em LB+kanamycin. Círculos negros indicam manchas de amostra de urina que devem ser contadas para calcular CFU/mL. (C) Curso de tempo de bacteriúria UPEC em camundongos C57BL/6. Cada linha representa um mouse individual, traçando os títulos de urina UPEC ao longo do tempo. A linha pontilhada indica o limite de detecção (1000 UFC/mL). A elipse vermelha indica quatro camundongos (de 20) que não conseguiram resolver a bacteriúria upec e, portanto, não seriam usados para o modelo rUTI induzido por vaginalis. Por outro lado, o círculo verde indica camundongos que resolveram bacteriúrias UPEC e passaram para fases subsequentes. (D) Tabela de dados utilizados para gerar gráfico no painel C. CFU amarela e detectável; verde, sem CFU. (E) Randomização de camundongos em grupos de exposição com base no ponto de tempo em que a UFC UPEC não foi mais detectada na urina ("Dia resolvido"). Os números do mouse na coluna esquerda do painel D são os mesmos números do mouse dados no painel E. Por favor, clique aqui para ver uma versão maior desta figura.
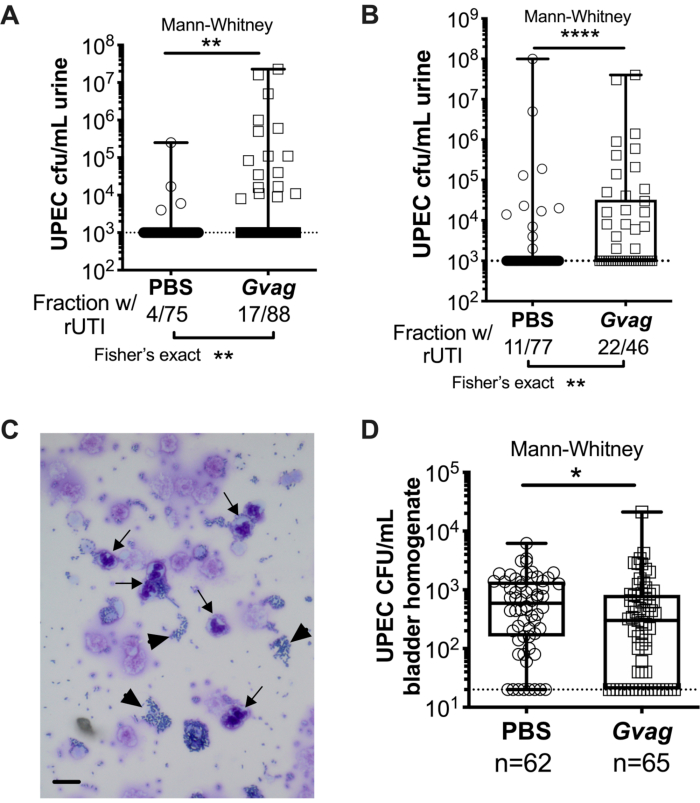
Figura 3. G. vaginalis aciona UPEC rUTI. Upec titers na urina após duas exposições sequenciais do trato urinário para PBS (círculos) ou G. vaginalis (Gvag; quadrados) dado 12 h (A) ou 1 wk (B) de distância. Cada símbolo representa um rato individual. A UPEC de CFU/mL mais alta detectada de cada mouse entre 1-3 d após a segunda exposição são plotadas. Camundongos sem bacteriúria detectável são plotados no limite de detecção (linha pontilhada). (C) Análise de citologia urinária mostrando células UPEC (pontas de flecha) e polimorfonuclear (PMN) (setas). Barra de escala = 20 μm. (D) Os UPEC nos tecidos da bexiga coletados 3 d após duas exposições sequenciais do trato urinário dado 1 wk de distância. Cada símbolo representa um mouse diferente e zeros são plotados no limite de detecção (linha pontilhada). Em A, B e D, as caixas estão no primeiro e terceiro quartil com a mediana marcada e os bigodes de min a max. Mann-Whitney U testes * P < 0,05; ** P < 0,01; P < 0,0001. Clique aqui para ver uma versão maior desta figura.
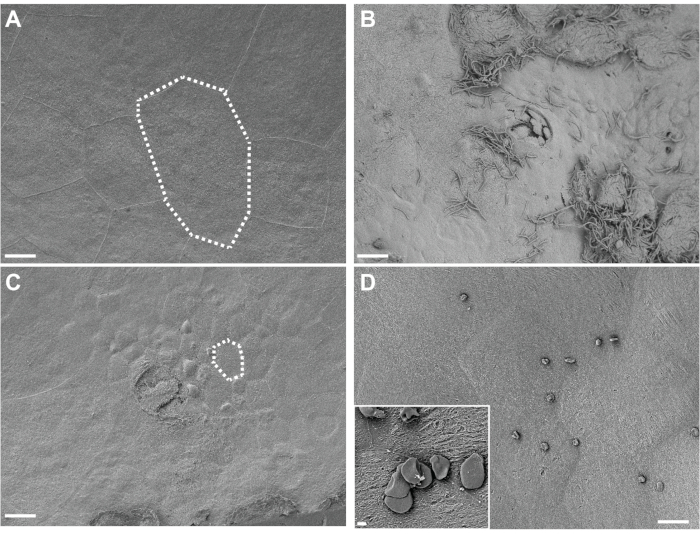
Figura 4. Análise SEM de bexigas fixadas in situ. As bexigas foram coletadas em camundongos 3h após duas exposições (12 h de distância) a PBS (A) ou G. vaginalis (C). Linhas pontilhadas ilustram uma única célula epitelial urinária, que é menor em bexigas expostas por G. vaginalis porque as grandes células superficiais esfoliaram revelando o epitélio transitório subjacente. (B) A bexiga coletada 6h após a inoculação inicial com UPEC, durante a Fase 1 do modelo, mostrando esfoliação urotelial e UPEC extracelular. (D) Exemplo de gotículas de gordura insolúveis presentes na superfície da bexiga. As barras de escala são de 20 μm nas imagens principais e 2 μm no inset. Clique aqui para ver uma versão maior desta figura.
Discussão
O primeiro passo crítico neste modelo para identificar camundongos que não limparam a bacteriúria UPEC durante a fase primária da UTI. Esses camundongos devem ser removidos do experimento, pois de outra forma confundiriam as taxas de bacteriúria upec após a exposição g. vaginalis. Após a inoculação inicial da UPEC, a urina deve ser coletada semanalmente para monitorar a liberação bacteriana. Aproximadamente 65-80% dos camundongos C57BL/6 vão limpar uma infecçãopor UTI89 kanR dentro de 4 semanas. Outras cepas de camundongos de raça têm diferentes propensões para o desembaraço upec 42,43 e formação de reservatórios e, portanto, pode não ser adequado para este modelo. O segundo ponto crítico é que estudos empíricos determinaram que duas inoculações sequenciais de G. vaginalis (12 h ou 1 wk de distância) são necessárias para desencadear um surgimento significativo de reservatórios acima do surgimento espontâneo de fundo que ocorre em camundongos de controle expostos apenas à PBS. Outras durações de tempo entre as duas exposições sequenciais não foram testadas, mas podem produzir resultados semelhantes. É importante notar que a redução dos da bexiga upec só foi observada no modelo em que as exposições de G. vaginalis foram dadas 1 wk de distância39. Embora mais de duas exposições possam ser administradas, evidências empíricas sugerem que o cateterismo repetido sozinho aumenta o surgimento, o que pode confundir a interpretação dos resultados ou exigir um número maior de animais para distinguir diferenças entre grupos de exposição e controles. Finalmente, o método de fixação da bexiga in situ tem vários passos críticos. Alguma habilidade é necessária para garantir que o fixador permaneça dentro das bexigas presas. Bexigas deflacionadas serão mais difíceis de serem imagens pela SEM. Também é essencial ser muito gentil ao inocular o fixador na bexiga, pois raspar o urotélio com o cateter fixador pode induzir a esfoliação urotelial independente do que é desencadeado por G. vaginalis. Todas as concentrações mencionadas no coquetel fixador são concentrações finais. Proporções inadequadas destes podem resultar em fixação insuficiente e inchaço ou encolhimento das células. Fixações devem ser aquecidas a temperaturas fisiológicas para evitar choque de temperatura nas células e tecidos. O aquecimento também proporciona uma leve melhora na taxa de difusão de fixações através de membranas plasmáticas. Embora a coloração de ósmio possa ser frequentemente omitida para amostras preparadas para análise sem, é um passo essencial neste protocolo para estabilizar lipídios e evitar a quebra de membranas celulares durante a secagem de pontos críticos.
Este protocolo pode ser modificado para testar outras cepas de UPEC e/ou G. vaginalis para sua capacidade de formar reservatórios e desencadear seu surgimento, respectivamente. Outros fatores experimentais também podem ser adicionados, como a exposição a outras bactérias vaginais (por exemplo, Lactobacillus crispatus PVAS100) ou G. vaginalis, nenhuma das quais demonstram patologia neste modelo39. Ao selecionar outras cepas bacterianas para testar, é importante demonstrar um crescimento consistente de tal forma que uma concentração padrão de inóculo possa ser usada em todos os experimentos. O crescimento daRS JCP8151B foi otimizado em uma câmara anaeróbica. Esta cepa provavelmente poderia ser cultivada em um sistema gaspak anaeróbico, mas isso exigiria otimização para garantir um crescimento bacteriano robusto. Finalmente, pode ser possível modificar o tempo de certas etapas do modelo. Por exemplo, a urina pode ser coletada em momentos anteriores durante a fase de formação do reservatório upec para monitorar as respostas da UFC ou do host. Não foi observado um efeito adverso da coleta de amostras de urina em momentos iniciais (3, 6, 12 hpi) sobre a progressão da infecção ou estabelecimento de reservatórios neste modelo. O surgimento de reservatórios UPEC foi relatado para ocorrer após duas doses deRS JCP8151B dadas 12 h ou 1 wk, mas outros intervalos de tempo ainda não foram testados. Também pode ser possível reduzir o tempo total do modelo reduzindo a fase de formação do reservatório upec para 2 semanas (em vez de 4 semanas), já que muitos dos camundongos limpam bacteriúrias até agora. Estudos anteriores que examinaram o surgimento da UPEC após a exposição da bexiga a esfoliantes químicos utilizaram uma fase de formação de reservatóriosUPEC de 1 ou 2 wk 17,18. No entanto, a diminuição do tempo para a liberação de bacteriúrias da UPEC pode vir ao custo de exigir que mais animais sejam abatidos do experimento. Por fim, a análise SEM da bexiga pode ser realizada em pontos de tempo adicionais para observar a duração do efeito de G. vaginalis no urotélio.
Em relação à solução de problemas, existem algumas considerações importantes especificamente no que diz respeito à análise da SEM bexiga. Dependendo do fundo do camundongo utilizado e da quantidade de inflamação presente, algumas bexigas apresentarão paredes muito finas. Essas bexigas tendem a se enrolar mais durante a secagem de pontos críticos e podem resultar em uma forma de casca de vaca. Se isso ocorrer, o melhor método é cortar a bexiga em forma de concha ao meio ao longo da interface enrolada e, em seguida, uma segunda vez para remover a maior parte do tecido pendente. O corte funciona melhor com uma lâmina de barbear de dois gumes revestido de PTFE. O excesso de gordura às vezes pode solubilizar durante as etapas de coloração de ósmio. Isso pode resultar em gotículas de gordura insolúveis indesejadas que podem não ser lavadas durante as etapas de lavagem e desidratação e que podem se estabelecer na superfície da bexiga durante a secagem subsequente. Essas gotículas podem aparecer como pequenas esferas ou estruturas semelhantes a discos espalhadas pela amostra (Figura 4D). Isso pode ser mitigado, garantindo que o máximo possível de tecido adiposo seja removido ao redor da bexiga. A platina pode ser substituída por revestimento irídio, mas as espessuras devem ser mantidas ao mínimo para reduzir o mascaramento de detalhes estruturais finos. O uso de um estágio rotativo durante o revestimento é altamente recomendado.
Uma limitação deste modelo é que ele requer um grande número de ratos. Apenas 65-80% dos camundongos C57BL/6 limparão suas bacteriúrias UPEC e serão adequados para a subsequente inoculação G. vaginalis ou PBS (ver Figura 2C). Para obter 10-12 camundongos por grupo (G. vaginalis inoculação vs. PBS), ~30 camundongos devem ser inicialmente infectados com UPEC. Além disso, vários experimentos são provavelmente necessários para alcançar as réplicas biológicas necessárias para detectar significância estatística. Quando as exposições foram dadas 1 wk de distância, o surgimento da UPEC ocorreu em 14% dos camundongos expostos à PBS (Figura 3B). Assim, detectar um aumento significativo no UPEC rUTI em G. vaginalis expostos em relação aos controles pbs (alimentados em 0,8; alfa=0,05 [um lado]) requer testar um total acumulado de pelo menos 40 ratos para cada grupo de exposição. Uma consideração adicional é que esses experimentos são caros e intensivos em mão-de-obra. Os camundongos devem ser monitorados semanalmente para liberação da UPEC e o curso de tempo experimental é de 4-5 wk, dependendo se g. vaginalis é dado duas vezes em um período de 12 horas ou duas vezes 1 wk de distância. O SEM é intensivo em mão-de-obra e pode ser caro, dependendo da disponibilidade de microscópio e das taxas de serviço. Preparar toda a bexiga para SEM fornece material abundante para análise, mas a desvantagem é que analisar cada bexiga pode ser demorado. Assim, é provável que apenas um número limitado de bexigas possa ser analisado pela SEM em comparação com os maiores números de animais usados para urina e tetas de tecido. Além disso, a obtenção de imagens de alta qualidade das superfícies curvas dos "copos" da bexiga requer habilidade devido a sombras que podem impedir a visibilidade. Embora a bexiga SEM seja uma ferramenta útil para visualizar a esfoliação urotelial, este método é em grande parte qualitativo. Como a amostra é fixada em forma redonda, e devido ao uso de glutaraldeído no fixador, não é possível a triagem para bactérias fluorescentes expressas através de microscopia leve. Imunostaining e corantes químicos são incompatíveis com este processo devido ao uso de glutaraldeído que vai interligar a maioria dos antígenos e osmium e que irá mascarar locais de antígeno e escurecer o tecido. Dito isto, a técnica SEM é útil para parâmetros que podem ser avaliados quantitativamente sem o uso de sondas adicionais, como tamanhocelular 48,49.
Este modelo oferece várias vantagens além dos métodos descritos anteriormente. Permite o exame de mecanismos de UPEC rUTI causados pelo surgimento de reservatórios de bexiga, em vez de reintrodução na bexiga a partir de uma fonte externa. Outros modelos de rUTI devido ao surgimento de reservatórios de bexiga utilizam agentes químicos (sulfato de protamina ou quitosan) para causar esfoliação urotelial 17,18, o que não seriam gatilhos de rUTI em mulheres. G. vaginalis é uma bactéria urogenital prevalente que foi detectada na urina coletada diretamente da bexiga através de cateterismo ou aspiração suprapúbica em algumas mulheres23,26. Este fato, juntamente com a associação conhecida entre o BV (no qual g. vaginalis cresce demais na vagina) e UTI, sugere que g. vaginalis é um gatilho clinicamente plausível de rUTI. Finalmente, o método de fixação da bexiga in situ preserva a ultraestrutura da bexiga e limita os danos, garantindo que as camadas da bexiga não se separem umas das outras. Métodos anteriores para visualizar o urotélio tradicionalmente têm o usuário asepticamente colher, bissecto, esticar e fixar a bexiga em uma bandeja de dissecção antes de submergir a bexiga esticada emfixação 48. Este método resulta em uma amostra muito plana, mas não garante o alongamento uniforme ou natural do tecido e pode resultar em áreas que estão mais e sob esticadas (resultando em tecido altamente enrugado) e podem causar separação da camada da bexiga. Além disso, essas manipulações físicas da bexiga para esticar e fixar o tecido podem causar danos, incluindo esfoliação urotelial. Outro método é submergir bexigas intactas em fixação antes de incorporar em parafina e adquirir seções finas com um microtome. Seções finas são inestimáveis para experimentos de imunohistoquímica para examinar bactérias e localização de proteínas hospedeiras, mas uma seção fina não permite a visualização da superfície urotelial. Este método SEM permite que a superfície de toda a bexiga seja examinada de uma só vez.
Como descrito, aplicações futuras deste modelo incluem testar outras cepas da UPEC para determinar se formam reservatórios intracelulares e testar outras cepas de G. vaginalis para avaliar se elas provocam esfoliação e emergência da UPEC para causar rUTI. Outras cepas de camundongos além de camundongos C57BL/6 também podem ser testadas, embora camundongos com alta propensão para o desenvolvimento de cistite crônica (como ratos no fundo C3H) não sejam recomendados, já que muitos ratos precisariam ser eliminados do experimento. Uma vantagem adicional dos camundongos C57BL/6 é que muitas cepas genéticas de nocaute estão disponíveis comercialmente. Tais cepas fornecem uma oportunidade para interrogar os fatores hospedeiros envolvidos na formação e/ou emergência dos reservatórios.
Divulgações
Os autores declaram que não têm conflitos de interesse relacionados a este estudo.
Agradecimentos
Os autores agradecem a Lynne Foster pela assistência técnica em experimentos de infecção, James Fitzpatrick do Centro de Imagem de Porção de Adega (WUCCI) da Universidade de Washington pelo acesso ao SEM, Scott Hultgren pela cepaUTI89 kanR UPEC, e David Hunstad pela leitura crítica do manuscrito.
Este trabalho foi apoiado pela National Science Foundation (Graduate Research Fellowship to VPO#DGE - 1143954), pelo Center for Women's Infectious Disease Research da Washington University School of Medicine (Prêmio de Pesquisa Piloto para NMG), pela American Heart Association: #12POST12050583 (NMG) e #14POST20020011 (NMG), e pelos Institutos Nacionais de Saúde, NIAID: R01 AI114635 (ALL) e NIDDK: R21 DK092586 (ALL), P50 DK064540-11 (SJH, projeto II PI:ALL) e K01 DK110225-01A1 (NMG). Alguns dos estudos em animais foram realizados em uma instalação apoiada pela concessão NCRR C06 RR015502. O Centro de Imagem Celular da Universidade de Washington (WUCCI; onde o SEM foi realizado) e o MSJ foram apoiados pela Escola de Medicina da Universidade de Washington, pelo Instituto de Descoberta Infantil da Universidade de Washington e pelo Hospital Infantil de St. Louis (CDI-CORE-2015-505), pela Fundação para o Hospital Barnes-Judeu (3770) e pelo Instituto Nacional de Distúrbios Neurológicos e Derrame (NS086741). Os financiadores não tiveram papel na concepção do estudo, coleta e análise de dados, decisão de publicar ou elaboração do manuscrito.
Materiais
| Name | Company | Catalog Number | Comments |
| 30G x 1/2 needles | BD | 305106 | for catheters |
| 5 1/2" straight forcep hemostat | McKesson | 487377 | in situ bladder fixation |
| ACE 600 Sputter coater | Leica | SEM sample processing | |
| aluminum SEM stub | Ted Pella | 16111 | SEM sample processing |
| Calcium chloride | EMS | 12340 | in situ bladder fixation |
| conductive carbon adhesive tab | Ted Pella | 16084-1 | SEM sample processing |
| Conductive silver paint | Ted Pella | 16034 | SEM sample processing |
| CPD 300 Critical Point Drier | Leica | SEM sample processing | |
| Cytofunnel metal clip | Simport | M964B | cytospun urinalysis |
| Ethanol | EMS | 15050 | SEM sample processing |
| Glucose | Sigma | G7528 | for NYCIII G. vaginalis growth media |
| glutaraldehyde | EMS | 16320 | in situ bladder fixation |
| Hema 3 staining kit | Fisher | 23123869 | cytospun urinalysis |
| HEPES | Cellgro | 25-060-Cl | for NYCIII G. vaginalis growth media |
| iridium | Ted Pella | 91120 | SEM sample processing |
| isofluorane | mouse anaesthesia | ||
| kanamycin | Gibco | 11815024 | add to UPEC LB selective plates (50 ug/mL) |
| Luria-Bertani agar | BD | DF0445174 | UPEC growth plates |
| Luria-Bertani broth | BD | DF0446173 | UPEC growth media |
| Merlin FE-SEM | Zeiss | scanning electron microscope | |
| Milli-Q Water Purifier | Millipore | IQ-7000 | SEM sample processing |
| NaCl | Sigma | S3014 | for NYCIII G. vaginalis growth media |
| Olympus Vanox AHBT3 microscope | Olympus | cytospun urinalysis | |
| osmium tetroxide | EMS | 19170 | SEM sample processing |
| paraformaldehyde | EMS | 15710 | in situ bladder fixation |
| polyethylene tubing | Intramedic | 427401 | for catheters |
| Proteose Peptone #3 | Fisher | DF-122-17-4 | for NYCIII G. vaginalis growth media |
| PTFE coated double edge razor blade | EMS | 72000 | cutting bladders for SEM |
| Shandon Cytocentrifuge | Thermo Scientific | A78300002 | cytospun urinalysis |
| Shandon cytofunnel filter | Simport | M965FWDV | cytospun urinalysis |
| Shandon Double cytofunnel | Simport | M964-1D | cytospun urinalysis |
| Shandon double cytoslides (coated) | Thermo Scientific | 5991055 | cytospun urinalysis |
| sodium cacodylate trihydrate | EMS | 12310 | in situ bladder fixation |
| spectrophotometer | BioChrom | 80-3000-45 | measuring bacterial OD600 |
| streptomycin | Gibco | 11860038 | add to G. vaginalis NYCIII selective plates (1 mg/mL) |
| tuberculin slip tip syringe | BD | 309659 | for catheters |
| Yeast Extract | Fisher | DF0127-17-9 | for NYCIII G. vaginalis growth media |
Referências
- Foxman, B. Urinary tract infection syndromes: occurrence, recurrence, bacteriology, risk factors, and disease burden. Infectious Disease Clinics of North America. 28 (1), 1-13 (2014).
- Foxman, B. Recurring urinary tract infection: incidence and risk factors. American Journal of Public Health. 80 (3), 331-333 (1990).
- Foxman, B. Epidemiology of urinary tract infections: incidence, morbidity, and economic costs. American Journal of Medicine. 113, 5-13 (2002).
- Foxman, B. The epidemiology of urinary tract infection. Nature Reviews Urology. 7 (12), 653-660 (2010).
- Ikaheimo, R., et al. Recurrence of urinary tract infection in a primary care setting: analysis of a 1-year follow-up of 179 women. Clinical Infectious Diseases. 22 (1), 91-99 (1996).
- Russo, T. A., Stapleton, A., Wenderoth, S., Hooton, T. M., Stamm, W. E. Chromosomal restriction fragment length polymorphism analysis of Escherichia coli strains causing recurrent urinary tract infections in young women. Journal of Infectious Diseases. 172 (2), 440-445 (1995).
- Luo, Y., et al. Similarity and divergence of phylogenies, antimicrobial susceptibilities, and virulence factor profiles of Escherichia coli isolates causing recurrent urinary tract infections that persist or result from reinfection. Journal of Clinical Microbiology. 50 (12), 4002-4007 (2012).
- Schreiber, H. L. t., et al. Bacterial virulence phenotypes of Escherichia coli and host susceptibility determine risk for urinary tract infections. Science Translational Medicine. 9 (382), (2017).
- Rosen, D. A., Hooton, T. M., Stamm, W. E., Humphrey, P. A., Hultgren, S. J. Detection of intracellular bacterial communities in human urinary tract infection. PLoS Med. 4 (12), 329 (2007).
- Elliott, T. S., Reed, L., Slack, R. C., Bishop, M. C. Bacteriology and ultrastructure of the bladder in patients with urinary tract infections. Journal of Infection. 11 (3), 191-199 (1985).
- Robino, L., et al. Detection of intracellular bacterial communities in a child with Escherichia coli recurrent urinary tract infections. Pathogens and Disease. 68 (3), 78-81 (2013).
- Robino, L., et al. Intracellular bacteria in the pathogenesis of Escherichia coli urinary tract infection in children. Clinical Infectious Diseases. 59 (11), 158-164 (2014).
- De Nisco, N. J., et al. Direct Detection of Tissue-Resident Bacteria and Chronic Inflammation in the Bladder Wall of Postmenopausal Women with Recurrent Urinary Tract Infection. Journal of Molecular Biology. 431 (21), 4368-4379 (2019).
- Mulvey, M. A., Schilling, J. D., Hultgren, S. J. Establishment of a persistent Escherichia coli reservoir during the acute phase of a bladder infection. Infection and Immunity. 69 (7), 4572-4579 (2001).
- Kerrn, M. B., Struve, C., Blom, J., Frimodt-Moller, N., Krogfelt, K. A. Intracellular persistence of Escherichia coli in urinary bladders from mecillinam-treated mice. Journal of Antimicrobial Chemotherapy. 55 (3), 383-386 (2005).
- Eto, D. S., Sundsbak, J. L., Mulvey, M. A. Actin-gated intracellular growth and resurgence of uropathogenic Escherichia coli. Cellular Microbiology. 8 (4), 704-717 (2006).
- Mysorekar, I. U., Hultgren, S. J. Mechanisms of uropathogenic Escherichia coli persistence and eradication from the urinary tract. Proceedings of the National Academy of Sciences of the United States of America. 103 (38), 14170-14175 (2006).
- Blango, M. G., Ott, E. M., Erman, A., Veranic, P., Mulvey, M. A. Forced resurgence and targeting of intracellular uropathogenic Escherichia coli reservoirs. PLoS One. 9 (3), 93327 (2014).
- Gilbert, N. M., Lewis, A. L. Covert pathogenesis: Transient exposures to microbes as triggers of disease. PLoS Pathogens. 15 (3), 1007586 (2019).
- Lewis, A. L., Gilbert, N. M. Roles of the vagina and the vaginal microbiota in urinary tract infection: evidence from clinical correlations and experimental models. GMS Infectious Diseases. 8, (2020).
- Janulaitiene, M., et al. Prevalence and distribution of Gardnerella vaginalis subgroups in women with and without bacterial vaginosis. BMC Infectious Diseases. 17 (1), 394 (2017).
- Fredricks, D. N. Molecular methods to describe the spectrum and dynamics of the vaginal microbiota. Anaerobe. 17 (4), 191-195 (2011).
- Hilt, E. E., et al. Urine is not sterile: use of enhanced urine culture techniques to detect resident bacterial flora in the adult female bladder. Journal of Clinical Microbiology. 52 (3), 871-876 (2014).
- Klein, S., et al. Significant increase in cultivation of Gardnerella vaginalis, Alloscardovia omnicolens, Actinotignum schaalii, and Actinomyces spp. in urine samples with total laboratory automation. European Journal of Clinical Microbiology Infect Dis. 37 (7), 1305-1311 (2018).
- Pearce, M. M., et al. The female urinary microbiome in urgency urinary incontinence. American Journal of Obstetrics and Gynecology. 213 (3), 341 (2015).
- Pearce, M. M., et al. The female urinary microbiome: a comparison of women with and without urgency urinary incontinence. mBio. 5 (4), 01283 (2014).
- Gottschick, C., et al. The urinary microbiota of men and women and its changes in women during bacterial vaginosis and antibiotic treatment. Microbiome. 5 (1), 99 (2017).
- Malki, K., et al. Genomes of Gardnerella Strains Reveal an Abundance of Prophages within the Bladder Microbiome. PLoS One. 11 (11), 0166757 (2016).
- Kramer, H., et al. Diversity of the midstream urine microbiome in adults with chronic kidney disease. International Urology and Nephrology. 50 (6), 1123-1130 (2018).
- Allsworth, J. E., Peipert, J. F. Prevalence of bacterial vaginosis: 2001-2004 National Health and Nutrition Examination Survey data. Obstetrics & Gynecology. 109 (1), 114-120 (2007).
- Ravel, J., et al. Vaginal microbiome of reproductive-age women. Proceedings of the National Academy of Sciences of the United States of America. 108, 4680-4687 (2011).
- Hillier, S. L. Diagnostic microbiology of bacterial vaginosis. American Journal of Obstetrics and Gynecology. 169 (2), 455-459 (1993).
- Amatya, R., Bhattarai, S., Mandal, P. K., Tuladhar, H., Karki, B. M. Urinary tract infection in vaginitis: a condition often overlooked. Nepal Medical College Journal. 15 (1), 65-67 (2013).
- Harmanli, O. H., Cheng, G. Y., Nyirjesy, P., Chatwani, A., Gaughan, J. P. Urinary tract infections in women with bacterial vaginosis. Obstetrics & Gynecology. 95 (5), 710-712 (2000).
- Sharami, S. H., Afrakhteh, M., Shakiba, M. Urinary tract infections in pregnant women with bacterial vaginosis. Journal of Obstetrics and Gynaecology. 27 (3), 252-254 (2007).
- Hillebrand, L., Harmanli, O. H., Whiteman, V., Khandelwal, M. Urinary tract infections in pregnant women with bacterial vaginosis. American Journal of Obstetrics and Gynecology. 186 (5), 916-917 (2002).
- Sumati, A. H., Saritha, N. K. Association of urinary tract infection in women with bacterial vaginosis. Journal of Global Infectious Diseases. 1 (2), 151-152 (2009).
- Gilbert, N. M., Lewis, W. G., Lewis, A. L. Clinical features of bacterial vaginosis in a murine model of vaginal infection with Gardnerella vaginalis. PLoS One. 8 (3), 59539 (2013).
- Gilbert, N. M., O'Brien, V. P., Lewis, A. L. Transient microbiota exposures activate dormant Escherichia coli infection in the bladder and drive severe outcomes of recurrent disease. PLoS Pathogens. 13 (3), 1006238 (2017).
- Wright, K. J., Seed, P. C., Hultgren, S. J. Uropathogenic Escherichia coli flagella aid in efficient urinary tract colonization. Infection and Immunity. 73 (11), 7657-7668 (2005).
- Garofalo, C. K., et al. Escherichia coli from urine of female patients with urinary tract infections is competent for intracellular bacterial community formation. Infection and Immunity. 75 (1), 52-60 (2007).
- Hannan, T. J., Mysorekar, I. U., Hung, C. S., Isaacson-Schmid, M. L., Hultgren, S. J. Early severe inflammatory responses to uropathogenic E. coli predispose to chronic and recurrent urinary tract infection. PLoS Pathogens. 6 (8), 1001042 (2010).
- Hopkins, W. J., Gendron-Fitzpatrick, A., Balish, E., Uehling, D. T. Time course and host responses to Escherichia coli urinary tract infection in genetically distinct mouse strains. Infection and Immunity. 66 (6), 2798-2802 (1998).
- Conover, M. S., Flores-Mireles, A. L., Hibbing, M. E., Dodson, K., Hultgren, S. J. Establishment and Characterization of UTI and CAUTI in a Mouse Model. Journal of Visualized Experiments. (100), e52892 (2015).
- Hannan, T. J., Hunstad, D. A. A Murine Model for Escherichia coli Urinary Tract Infection. Methods in Molecular Biology. 1333, 159-175 (2016).
- Zychlinsky Scharff, A., Albert, M. L., Ingersoll, M. A. Urinary Tract Infection in a Small Animal Model: Transurethral Catheterization of Male and Female Mice. Journal of Visualized Experiments. (130), e54432 (2017).
- Thai, K. H., Thathireddy, A., Hsieh, M. H. Transurethral induction of mouse urinary tract infection. Journal of Visualized Experiments. (42), e2070 (2010).
- O'Brien, V. P., et al. A mucosal imprint left by prior Escherichia coli bladder infection sensitizes to recurrent disease. Nature Microbiology. 2, 16196 (2016).
- O'Brien, V. P., Dorsey, D. A., Hannan, T. J., Hultgren, S. J. Host restriction of Escherichia coli recurrent urinary tract infection occurs in a bacterial strain-specific manner. PLoS Pathogens. 14 (12), 1007457 (2018).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados