Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Monocapa epitelial derivada de organoides: un modelo in vitro clínicamente relevante para la función de barrera intestinal
En este artículo
Resumen
Aquí, describimos la preparación de monocapas epiteliales intestinales derivadas de organoides humanos para estudiar la función de barrera intestinal, la permeabilidad y el transporte. Como los organoides representan la respuesta original del tejido epitelial a los estímulos externos, estos modelos combinan las ventajas de la capacidad de expansión de las líneas celulares y la relevancia y complejidad del tejido primario.
Resumen
En el pasado, los sistemas de modelos epiteliales intestinales se limitaban a líneas celulares transformadas y tejido primario. Estos sistemas modelo tienen limitaciones inherentes ya que los primeros no representan fielmente la fisiología tisular original, y la disponibilidad de los segundos es limitada. Por lo tanto, su aplicación dificulta la investigación fundamental y de desarrollo de fármacos. Los organoides adultos basados en células madre (en adelante denominados organoides) son miniaturas de tejido epitelial normal o enfermo del que se derivan. Se pueden establecer de manera muy eficiente a partir de diferentes regiones del tracto gastrointestinal (GI), tienen capacidad de expansión a largo plazo y simulan respuestas específicas de tejidos y pacientes a los tratamientos in vitro. Aquí, se ha demostrado el establecimiento de monocapas epiteliales derivadas de organoides intestinales junto con métodos para medir la integridad de la barrera epitelial, la permeabilidad y el transporte, la secreción de proteínas antimicrobianas, así como la histología. Además, las monocapas derivadas de organoides intestinales pueden enriquecerse con células madre proliferantes y amplificadoras de tránsito, así como con células epiteliales diferenciadas clave. Por lo tanto, representan un sistema modelo que se puede adaptar para estudiar los efectos de los compuestos en las células diana y su modo de acción. Aunque los cultivos organoides son técnicamente más exigentes que las líneas celulares, una vez establecidos, pueden reducir los fallos en las últimas etapas del desarrollo de fármacos, ya que realmente representan la complejidad del epitelio in vivo y la heterogeneidad entre pacientes.
Introducción
El epitelio intestinal actúa como una barrera física entre el contenido luminal de los intestinos y el tejido subyacente. Esta barrera comprende una sola capa epitelial de enterocitos principalmente absorbentes que están conectados por uniones estrechas, que establecen fuertes conexiones intercelulares entre las células adyacentes. Estas células forman un revestimiento epitelial polarizado que separa los lados apical (lumen) y basolateral del intestino, al tiempo que regula el transporte paracelular de nutrientes y metabolitos digeridos. Además de los enterocitos, otras células epiteliales importantes como las células caliciformes, paneth y enteroendocrinas también contribuyen a la homeostasis intestinal al producir moco, péptidos antimicrobianos y hormonas, respectivamente. El epitelio intestinal se repone constantemente dividiendo las células madre del receptor 5 positivo (LGR5+) ricas en leucina que contienen repetición que contienen proteína G en el fondo de las criptas intestinales que producen células amplificadoras de tránsito (TA) que migran hacia arriba y se diferencian en otros tipos de células1. La interrupción de la homeostasis epitelial intestinal por factores genéticos y ambientales, como la exposición a alérgenos alimentarios, compuestos medicinales y patógenos microbianos, conduce a la interrupción de la función de barrera intestinal. Estas afecciones causan varias enfermedades intestinales, incluida la enfermedad inflamatoria intestinal (EII), la enfermedad celíaca y la toxicidad gastrointestinal inducida por medicamentos2.
Los estudios sobre el epitelio intestinal se realizan utilizando varios sistemas de plataforma in vitro, como insertos de membrana, sistemas de órganos en un chip, cámaras de Ussing y anillos intestinales. Estas plataformas son adecuadas para establecer monocapas epiteliales polarizadas con acceso a los lados apical y basolateral de la membrana, utilizando líneas celulares transformadas o tejido primario como modelos. Aunque las líneas celulares transformadas, como las líneas celulares colorrectal (adeno)carcinoma Caco-2, T84 y HT-29, son capaces de diferenciarse en enterocitos intestinales polarizados o células productoras de moco hasta cierto punto, no son representativas del epitelio in vivo ya que faltan varios tipos de células, y varios receptores y transportadores se expresan aberrantemente3 . Además, como las líneas celulares se derivan de un solo donante, no representan la heterogeneidad entre pacientes y sufren de una complejidad reducida y relevancia fisiológica. Aunque los tejidos primarios utilizados en las cámaras de Ussing y como anillos intestinales son más representativos de la situación in vivo, su disponibilidad limitada, viabilidad a corto plazo y falta de capacidad de expansión los hacen inadecuados como medio para estudios de alto rendimiento (HT).
Los organoides son cultivos epiteliales in vitro establecidos a partir de diferentes órganos como el intestino, el riñón, el hígado, el páncreas y el pulmón. Se ha demostrado que tienen una capacidad de expansión estable a largo plazo, así como una estabilidad genética y fenotípica y, por lo tanto, son miniaturas biológicas representativas del epitelio del órgano original con respuestas fieles a estímulos externos 4,5,6,7,8,9. Los organoides se establecen eficientemente a partir de tejido normal, enfermo, inflamado o canceroso resecado o biopsiado, lo que representa respuestas heterogéneas específicas del paciente 10,11,12,13,14,15,16. Este artículo demuestra cómo establecer monocapas epiteliales intestinales derivadas de cultivos de organoides. Las monocapas se han establecido con éxito a partir de cultivos de organoides del intestino delgado, así como del colon y el recto. Este modelo crea una oportunidad para estudiar el transporte y la permeabilidad de las células epiteliales a los fármacos, así como sus efectos toxicológicos sobre el epitelio. Además, el modelo permite el cocultivo con células inmunes y bacterias para estudiar sus interacciones con el epitelio intestinal 17,18,19. Además, este modelo se puede utilizar para estudiar las respuestas a las terapias de una manera específica del paciente e iniciar esfuerzos de detección para buscar la próxima ola de terapias centradas en la barrera epitelial. Tal enfoque podría extenderse a la clínica y allanar el camino hacia tratamientos personalizados.
Aunque las monocapas epiteliales en este protocolo se preparan a partir de organoides intestinales normales humanos, el protocolo se puede aplicar y optimizar para otros modelos de organoides. Las monocapas organoides epiteliales se cultivan en un medio de expansión organoide intestinal que contiene Wnt para apoyar la proliferación de células madre y representar la composición celular de la cripta intestinal. Los organoides intestinales se pueden enriquecer para tener diferentes destinos epiteliales intestinales, como enterocitos, Paneth, copas y células enteroendocrinas, mediante la modulación de las vías Wnt, Notch y factor de crecimiento epidérmico (EGF). Aquí, después del establecimiento de monocapas en medio de expansión, se conducen hacia células epiteliales intestinales más diferenciadas, como se describió anteriormente 20,21,22,23,24,25. Para fines de detección, dependiendo del modo de acción del compuesto de interés, sus células objetivo y las condiciones experimentales, las monocapas se pueden conducir hacia la composición celular de elección para medir los efectos del compuesto con lecturas funcionales relevantes.
Protocolo
1. Preparación de reactivos para el cultivo
NOTA: Realice todos los pasos dentro de un gabinete de bioseguridad y siga las pautas estándar para trabajar con cultivos celulares. La luz ultravioleta se utiliza durante 10 minutos antes de poner en marcha el gabinete de bioseguridad. Antes y después de su uso, la superficie del gabinete de bioseguridad se limpia con un papel de seda empapado en etanol al 70%. Para facilitar la formación de gotas tridimensionales de matriz extracelular (ECM), mantenga un stock precalentado de placas de 96, 24 y 6 pocillos listas en la incubadora a 37 ° C.
- Preparación del medio basal
- Prepare el medio basal (BM) en una botella mediana Eagle modificada de 500 mL Advanced Dulbecco con la mezcla de nutrientes F-12 (Ad-DF) de Jamón agregando 5 ml de glutamina de 200 mM, 5 ml de ácido 4-(2-hidroxiétil)-1piperazinatenesulfónico (HEPES) y 5 ml de soluciones de penicilina/estreptomicina (pluma/estreptococo) (10.000 U/mL o 10.000 μg/mL). Esto se puede almacenar en el refrigerador a 4 ° C durante al menos 4 semanas.
- Fuentes Wnt
- Preparar el medio acondicionado Wnt3a (Wnt3aCM) de acuerdo con el método descrito anteriormente26.
NOTA: Recientemente, se ha generado un sustituto de próxima generación Wnt (NGS-Wnt), que también apoya la expansión de organoides intestinales humanos, 27.
- Preparar el medio acondicionado Wnt3a (Wnt3aCM) de acuerdo con el método descrito anteriormente26.
- Preparación del medio base organoide intestinal
NOTA: Utilice todos los factores de crecimiento y reactivos de acuerdo con las recomendaciones del fabricante. Use pequeñas alícuotas y evite los ciclos de congelación-descongelación; Los factores de crecimiento funcional son esenciales para el éxito del cultivo de organoides.- Preparar 2x medio base organoide intestinal concentrado (2x IBM) suplementando BM con 1 μM A83-01, 2.5 mM N-acetilcisteína, 2x suplemento de B27, 100 ng/mL de factor de crecimiento epidérmico humano (hEGF), 10 nM gastrina, 200 ng/mL hNoggin y 100 μg/mL de una formulación antimicrobiana para células primarias (ver la Tabla de Materiales).
- Alícuota el 2x IBM y congela a -20 °C durante un máximo de 4 meses. Cuando sea necesario, descongele una alícuota durante la noche a 4 °C o durante varias horas a temperatura ambiente (RT).
- Para preparar el medio de expansión organoide intestinal (IEM), complemente 2x IBM con 50% Wnt3aCM o 50% BM y 0.5 nM NGS-Wnt, 250 ng / mL Rspondin-3 humano (hRspo3), 10 mM nicotinamida y 10 μM SB202190.
- Preparación del medio de diferenciación organoide intestinal
- Preparar el medio de diferenciación de enterocitos (eDM) suplementando 2x IBM con 50% de BM, 250 ng/mL hRspo3 e inhibidor de la vía Wnt de 1,5 μM (IWP-2). Conservar eDM a 4 °C durante un máximo de 10 días.
- Prepare el medio de diferenciación combinada (cDM) complementando 2x IBM con 40% BM y 10% Wnt3aCM o 50% BM y 0.1 nM NGS-Wnt, 250 ng/mL hRspo3, 10 μM DAPT y 100 nM PD0325901. Conservar cDM a 4 °C durante un máximo de 10 días.
- Manipulación de la matriz extracelular (ECM)
NOTA: Prepare la matriz extracelular (ECM) (consulte la Tabla de Materiales) de acuerdo con la recomendación del fabricante.- Descongelar ECM durante la noche en hielo; transfiera el ECM de la botella a un tubo cónico de 15 ml utilizando una pipeta de 5 ml, ambas preenfriadas a -20 °C. Vuelva a congelar las alícuotas una sola vez a -20 °C. Una vez descongelado, guarde el ECM en un refrigerador a 4 °C durante un máximo de 7 días. Incubar durante al menos 30 min en hielo antes de su uso.
NOTA: Mezcle ECM correctamente y asegúrese de que esté frío antes de incrustar criptas u organoides.
- Descongelar ECM durante la noche en hielo; transfiera el ECM de la botella a un tubo cónico de 15 ml utilizando una pipeta de 5 ml, ambas preenfriadas a -20 °C. Vuelva a congelar las alícuotas una sola vez a -20 °C. Una vez descongelado, guarde el ECM en un refrigerador a 4 °C durante un máximo de 7 días. Incubar durante al menos 30 min en hielo antes de su uso.
2. Cultivos organoides
- Establecimiento de cultivos a partir de organoides congelados
NOTA: Deje que BM alcance RT, y mantenga una alícuota de 12 ml, calentada a 37 ° C, lista antes de comenzar el procedimiento de descongelación de un criovial que contenga organoides congelados.- Descongele el organoide criovial rápidamente agitando en un baño de agua de 37 °C hasta que solo quede una astilla de hielo. Agregue inmediatamente 500 μL de BM caliente gota a gota al criovial, y canalice hacia arriba y hacia abajo varias veces para diluir el medio de congelación y mezclar el contenido con cuidado.
- Usando una pipeta P1000, transfiera los organoides a un tubo cónico de 15 ml y agregue otro 1 ml de BM caliente en forma de gota mientras mezcla suavemente la parte inferior del tubo. Pipetee hacia arriba y hacia abajo varias veces para diluir el medio de congelación y mezclar el contenido con cuidado.
- Agregue hasta 12 ml de BM caliente gota a gota al tubo cónico de 15 ml que contiene los organoides, y pipetee hacia arriba y hacia abajo con una pipeta estéril de 10 ml para resuspendir suavemente los organoides.
- Centrifugar la suspensión organoide durante 5 min a 85 × g y 8 °C. Deseche el sobrenadante con cuidado sin alterar el gránulo y resuspenda los organoides en un 30% v/v de IEM suplementado con 10 μM Y27632 u otro inhibidor de la proteína formadora de bobina en espiral asociado a rho/inhibidor de la treonina quinasa (inhibidor de ROCK). Coloque el tubo sobre hielo.
- Añadir un 70% v/v de ECM en el tubo cónico de 15 ml que contiene los organoides. Mezcle la suspensión organoide manteniendo el tubo cónico de 15 ml en hielo y selle 5 μL de la suspensión para verificar la densidad (Figura 1A). Continuar el recubrimiento si la densidad es apropiada; si la densidad es demasiado alta, agregue más solución IEM/ECM en la misma proporción de 30-70% v/v, respectivamente.
- En cada pocillo de una placa de 24 pocillos precalentada, sembra 50 μL de la suspensión organoide mediante pipeteo de 5 gotas separadas de 10 μL (Figura 1B). Gire la placa boca abajo y déjela en el gabinete de bioseguridad durante 5 minutos. Transfiera la placa aún boca abajo a la incubadora de 37 ° C y déjela durante otros 30 minutos.
- Agregue 500 μL de IEM con un inhibidor de ROCK de 10 μM a cada pocillo y transfiera la placa a la incubadora. Imagine una gota regularmente para monitorear el crecimiento y actualice IEM cada 2-3 días aspirando el medio antiguo y agregando 500 μL de IEM fresco.
- Pasar los organoides una vez que se hayan recuperado adecuadamente de la descongelación y hayan alcanzado el tamaño adecuado para ser procesados (Figura 1C), tal y como se describe en la sección 2.2.
- Pasaje de organoides intestinales
NOTA: Enfríe el ECM en hielo durante al menos 30 minutos y mantenga el IEM en RT durante al menos 1 h antes de su uso.- Use el medio de un pozo de cultivo para romper las cúpulas organoides utilizando una punta de filtro de baja retención de 1250 μL, y transfiera el contenido del pozo a un tubo cónico de 15 ml marcado. Lave el pozo con 1 ml de BM y transfiéralo al mismo tubo cónico de 15 ml.
- Repita los pasos 2.2.1 y 2.2.2 con todos los demás pocillos (se puede lavar un máximo de media placa o 600 μL de gotas de ECM y agregarlas a un tubo cónico de 15 ml).
- Agregue BM para llenar el tubo hasta 12 ml, y canalice hacia arriba y hacia abajo 10 veces usando una pipeta de 10 ml. Centrifugar a 85 × g durante 5 min a 8 °C.
- Antes de retirar el BM, verifique bajo el microscopio si todos los organoides están granulados en la parte inferior del tubo cónico de 15 ml (Figura 1D). Si no hay ECM superponiendo el pellet organoide o la capa ECM está limpia o contiene solo escombros, células individuales o muy pocos organoides en comparación con los organoides granulados, aspire el sobrenadante y garabateo el ECM superponiendo el pellet organoide con mucho cuidado usando una pipeta P200.
NOTA: Los organoides pueden quedar atrapados en el ECM y no sedimentan como un pellet compacto debido a la baja fuerza de centrifugación. Si la ECM contiene organoides, centrifugar el tubo de nuevo a 450 × g durante 5 min a 8 °C, y retirar cuidadosamente el sobrenadante como se describe en 2.2.4. Si hay varios tubos cónicos de 15 ml, se pueden agrupar después del paso 2.2.4. - Añadir 1 ml de BM a cada pellet (de volumen de 50-200 μL, dependiendo del cultivo y la densidad de los organoides), y resuspendir cuidadosamente. Pipetear los organoides hacia arriba y hacia abajo al menos 5 veces para cortarlos, evitando la formación de espuma. Verifique bajo el microscopio si los organoides están alterados (Figura 2A). Si los organoides se interrumpen, continúe con el paso 2.2.7; si los organoides no están alterados, pipetearlos otras 5 veces. Esta vez, toque la pared del tubo de plástico con la punta de la pipeta para ejercer más fuerza mecánica para interrumpir los organoides.
NOTA: El cizallamiento mecánico de organoides quísticos (Figura 1C) y en ciernes (Figura 1E) es posible con una punta de pipeta de plástico de 200 μL o 10 μL instalada en una punta de filtro de baja retención de 1250 μL (Figura 1F), dependiendo del volumen requerido para interrumpir los organoides. Se recomienda el uso de una pipeta de vidrio estrechada (Figura 1F) cuando se procesan más de 200 μL de ECM que contienen los organoides (un pocillo de una placa de 6 pocillos o 4 pocillos de una placa de 24 pocillos). - Verifique bajo el microscopio nuevamente para ver si los organoides están alterados. Si se interrumpe, continúe con el siguiente paso; de lo contrario, pipetee los organoides hasta 20x, revisando los organoides bajo el microscopio regularmente. Si los organoides aún no están alterados, agregue un 25% de reactivo de disociación de células v/ v 1 (consulte la Tabla de materiales) a la suspensión, incube en el baño de agua a 37 ° C durante 2 min y pipetee los organoides hasta 20x, revisando los organoides bajo el microscopio regularmente para asegurarse de que no se digieran en células individuales.
- Agregue hasta 12 ml de BM al tubo cónico de 15 ml y lave el gránulo organoide canalizando hacia arriba y hacia abajo. Centrifugar a 85 × g durante 5 min a 8 °C. Deseche el sobrenadante y ajuste la concentración final al 70% v/v ECM agregando IEM y ECM al gránulo organoide.
- Comience a resuspender el pellet organoide con el doble del volumen de IEM / ECM recolectado para el pasaje, y selle 5 μL de la suspensión para verificar la densidad. Continuar el chapado si la densidad es apropiada (Figura 2B); agregue más solución IEM/ECM si la densidad es demasiado alta. Agregue 200 μL de la suspensión a cada pocillo de una placa de 6 pocillos precalentada, haciendo gotas separadas de 10 μL de volumen.
- Gire la placa boca abajo y déjela en el gabinete de bioseguridad durante 5 minutos. Transfiera la placa aún boca abajo a la incubadora de 37 °C, dejándola durante otros 30 minutos. Agregue 2 ml de IEM con un inhibidor de ROCK de 10 μM a cada pozo y transfiera la placa a la incubadora.
- Imagine una gota regularmente para monitorear el crecimiento y actualice IEM cada 2-3 días aspirando el medio antiguo y agregando 2 ml de IEM fresco.
- Paso a través de organoides intestinales para la preparación monocapa epitelial
- Pasaje de organoides 3 días antes de la recolección para la preparación monocapa siguiendo el mismo protocolo de paso descrito en la sección 2.2 con una excepción. En el paso 2.2.7, resuspend los organoides en 1-1.5x el volumen inicial de IEM/ECM para tener una mayor densidad y potencial de expansión cuando se cosechan para la preparación monocapa (Figura 3A).
3. Preparación monocapa epitelial
- Cultivo de monocapas epiteliales en insertos de membrana de 24 y 96 pocillos con una variedad de tipos de placas disponibles (Tabla 1). Utilice insertos de membrana de sistema de alto rendimiento (HTS) para ambos tamaños, ya que contienen una bandeja integral con los insertos de membrana y una placa receptora. Para el formato de 24 pocillos, también es posible el uso de placas con insertos de membrana extraíbles separados.
NOTA: Diferentes tipos de membrana (tereftalato de polietileno (PET) o policarbonato) y tamaños de poro (0.4-8.0 μm) están disponibles y se pueden usar dependiendo de las necesidades experimentales. Las monocapas solo pueden ser fotografiadas por campo brillante cuando se utilizan insertos con membranas de PET. Las membranas herméticas a la luz bloquean la fuga de luz fluorescente desde el compartimento apical al basolateral y se pueden considerar cuando se estudia el transporte dinámico o la permeabilidad de sustratos marcados fluorescentemente. El protocolo actual utiliza insertos de membrana de 24 pocillos; las adaptaciones para insertos de membrana de 96 pocillos se describen en la sección 5. Dependiendo de la densidad, morfología y tamaño de los organoides (Figura 3A), 6 pocillos de una placa de 6 pocillos (como se siembra en la sección 2.3) son suficientes para sembrar una placa completa de 24 pocillos de insertos de membrana. - Revestimiento de insertos de membrana con ECM
NOTA: Si hay dudas sobre tener suficientes células, cubra las inserciones después de contar las celdas. Esto es para evitar el recubrimiento innecesario y la pérdida de los costosos insertos de membrana.- Coloque los insertos de membrana en la placa de soporte en el gabinete de bioseguridad. Diluya el ECM 40x en solución salina tamponada con fosfato (DPBS) de Dulbecco helada con Ca2+ y Mg2+, y pipetee 150 μL del ECM diluido en el compartimento apical de cada inserto. Incubar la placa a 37 °C durante al menos 1 h.
- Preparación de células para la siembra.
- Alícuotas precalentadas del reactivo de disociación celular 2 en el baño de agua (37 °C). Prepare 2 ml del reactivo para cada pocillo de una placa de 6 pocillos.
- Transfiera la placa de cultivo que contiene los organoides (preparada en la sección 2.3) de la incubadora al gabinete de bioseguridad. Procese los organoides, como se describe en los pasos 2.2.1.-2.2.4. No acumule varios tubos en un tubo.
- Llene el tubo, que contiene organoides de un máximo de 3 pocillos de una placa de 6 pocillos, hasta 12 ml con DPBS (sin Ca2 + y Mg2 +), y bi pipetee hacia arriba y hacia abajo 10x usando una pipeta de 10 ml. Centrifugar a 85 × g durante 5 min a 8 °C, y aspirar el sobrenadante sin perturbar la bolita organoide.
- Agregue 2 ml del reactivo de disociación celular precalentado 2 por pocillo de una placa de 6 pocillos utilizada como material de partida y resuspenda. Incubar los tubos en diagonal u horizontalmente durante 5 min en el baño de agua a 37 °C, para evitar el hundimiento de los organoides en el fondo del tubo.
- Pipetee hacia arriba y hacia abajo 10x usando una pipeta de plástico estéril de 5 ml o una pipeta P1000, dependiendo del volumen total del reactivo de disociación celular. Verifique la suspensión de organoides bajo el microscopio para ver si se ha formado una mezcla de células individuales y algunos grupos celulares que consisten en 2-4 células (Figura 3B). Si es necesario, continúe la digestión repitiendo los pasos 3.3.4-3.3.5 (no aumente el volumen del reactivo de disociación celular) hasta que la mezcla se vea similar a la Figura 3B.
NOTA: Evite digerir los organoides completamente a células individuales. Es necesario tener algunos grupos pequeños de células (es decir, grupos de 2-4 células). - Detenga la disociación celular agregando hasta 12 ml de BM, incluido el inhibidor de ROCK de 10 μM a la suspensión celular. Centrifugar a 450 × g durante 5 min a 8 °C, y aspirar el sobrenadante sin perturbar la bolita celular. Cuando se maneje el mismo cultivo de organoides en varios tubos cónicos de 15 ml, agrupe los gránulos celulares y resuspóndalos en 12 ml de BM.
- Filtre la suspensión celular a través de un colador de 40 μm preestablecido con BM, y recolecte el flujo a través en un tubo cónico de 50 ml. Lave el colador con 10 ml de BM y coseche el flujo en el mismo tubo cónico de 50 ml.
- Transfiera la suspensión de células tensadas a dos nuevos tubos cónicos de 15 ml. Centrifugar a 450 × g durante 5 min a 8 °C, y aspirar el sobrenadante sin perturbar la bolita celular. Resuspend las células en 4 ml de IEM suplementado con un inhibidor de ROCK de 10 μM por placa de cultivo completa utilizada como material de partida.
- Mezcle una pequeña cantidad de suspensión celular en una proporción de 1: 1 con azul de tripano para contar. Cuente las células vivas, no azules (Figura 3C) y calcule el número total de células vivas. En grupos pequeños, cuente cada célula individual.
- Preparar una suspensión celular que contenga 3 × 106 células vivas por ml de IEM suplementada con un inhibidor de ROCK de 10 μM.
- Células de siembra en insertos de membrana de poliéster
- Aspire cuidadosamente DPBS desde los insertos recubiertos de ECM (paso 3.2.1), manteniendo la placa horizontalmente. Pipeta 800 μL de IEM suplementada con inhibidor de ROCK en cada compartimento basolateral. Pipeta 150 μL de la suspensión celular preparada en el paso 3.3.10 sobre la membrana recubierta de ECM en el compartimento apical hacia abajo. Por placa, asegúrese de tener al menos un pozo "en blanco" con BM solamente.
- Una vez que las células se hayan sedimentado en la membrana, mida la resistencia eléctrica transepitelial (TEER), como se describe en la sección 4.1, y tome una imagen de los insertos de membrana con un microscopio. Coloque la placa en la incubadora a 37 °C y 5% de CO2. Mida TEER todos los días y adquiera imágenes regularmente para monitorear la formación de monocapa (Figura 4A-D).
- Monocapas refrescantes
NOTA: Refresque el medio cada 2-3 días, siguiendo el siguiente orden para mantener una presión hidrostática positiva sobre las células y evitar que las células sean empujadas fuera de la membrana. Mientras refresca el medio, asegúrese de que la monocapa, que es visible tras la aspiración del medio, no esté dañada por la punta de la pipeta.- Retire el medio de los compartimentos basolaterales de la placa que contiene los insertos de membrana. Luego, aspire cuidadosamente el medio desde los compartimentos apicales de los insertos de membrana.
- Agregue 150 μL de IEM fresco gota a gota a cada compartimento apical, y luego agregue 800 μL de IEM fresco a cada compartimento basolateral.
- Enriquecimiento de la monocapa para los tipos de células epiteliales intestinales deseadas
- Permita que la monocapa se vuelva confluente en IEM, lo que corresponde a un valor TEER de alrededor de 100 Ω·cm² (como se calcula en el paso 4.1.1.4). Verifique bajo el microscopio para determinar si las monocapas se han formado completamente (Figura 4D) y si hay ausencia de agujeros (como se ve en la Figura 4B, C).
- Retire cuidadosamente el IEM de los compartimentos basolateral y apical de los insertos de membrana y sustitúyalo por eDM o cDM según lo preparado en la sección 1.4. Cultive la monocapa durante otros 3-4 días en el medio de diferenciación específico para obtener las células organoides enriquecidas con el tipo de célula específica deseada. Actualice el medio cada 2-3 días, como se describe en la sección 3.4.
- Mida el TEER diariamente y adquiera imágenes regularmente si lo desea (Figura 5A-C).
NOTA: El valor TEER que indica una monocapa enriquecida totalmente organizada varía según el cultivo de organoides; normalmente, los valores de TEER aumentan a 600 y pueden aumentar hasta 1000 Ω·cm2 (como se calcula en el paso 4.1.1.4) después de 3 días en medios de diferenciación y son estables durante 3-5 días.
4. Lecturas de ensayos monocapa epiteliales
- Medición de la resistencia eléctrica transepitelial (TEER)
NOTA: Las mediciones de TEER son ampliamente aceptadas como un método para analizar la dinámica de la unión estrecha y la integridad de la función de barrera en modelos biológicos de barreras fisiológicas, como las monocapas epiteliales28,29. El aumento de TEER después de la diferenciación debido al aumento de la interacción celular en uniones estrechas se puede medir utilizando un medidor TEER manual o un robot de medición TEER automatizado.- Medición de TEER mediante un medidor TEER manual
- Limpie el electrodo con etanol al 70% y déjelo secar al aire dentro del gabinete de bioseguridad. Coloque el electrodo en un tubo que contenga BM. Conecte el electrodo al medidor TEER manual. Gire el interruptor función para medir en ohmios (Ω).. Encienda el interruptor de encendido.
- Coloque el electrodo corto en el compartimento apical del inserto, mientras que el electrodo largo se coloca en el compartimento basolateral (Figura 6A). Evite tocar la monocapa.
- Mida la resistencia en el pozo en blanco (Ren blanco) y, a continuación, mida las muestras restantes (muestra R) de la misma manera. Lave el electrodo con BM entre muestras con diferentes condiciones. Limpie el electrodo primero con agua demi y luego con etanol al 70% y déjelo secar al aire.
- Calcular TEER (Ω·cm2):[Muestra R (Ω) - Ren blanco (Ω)] × área de membrana (cm2) (Tabla 1 y Figura 6B).
- Medición de TEER utilizando un robot de medición TEER automatizado (Tabla de Materiales)
- Realice mediciones TEER automatizadas cuando utilice sistemas HTS para placas HTS de 96 y 24 pocillos que contengan insertos de membrana. Utilice diferentes electrodos para la medición TEER para ambos tipos (insertos de membrana 24 y 96 HTS). Para medir TEER utilizando un robot de medición TEER automatizado, siga las instrucciones del fabricante.
- Medición de TEER mediante un medidor TEER manual
- Medición de la integridad y permeabilidad de la barrera epitelial
NOTA: Este protocolo introduce la permeabilidad de Lucifer Yellow desde el compartimento apical al basolateral como una indicación de la integridad de la monocapa. Esta sección describe la medición de la fluorescencia en el compartimento basolateral después de una etapa de incubación de 1 h para evaluar la permeabilidad monocapa y, por lo tanto, la integridad de la barrera. Esta medición es un ensayo de punto final y es especialmente útil cuando se prueban compuestos por su efecto sobre la integridad de la barrera.- Descongele Lucifer Yellow en hielo y deje que BM se equilibre a RT. Para una placa de 24 pocillos de insertos de membrana, prepare 5 ml de solución de trabajo de 60 μM Lucifer Yellow en BM.
NOTA: Lucifer Yellow es sensible a la luz. Prepare las diluciones en tubos estériles oscuros de 1,5 ml y realice todos los pasos con la luz del gabinete de bioseguridad apagada. - Retire cuidadosamente el medio de los compartimentos basolateral y apical de los insertos de membrana, como se describe en el paso 3.5.1. Si lo desea, raye una monocapa sin tratar usando una punta de pipeta como control positivo para la fuga de Lucifer Yellow a través de una barrera dañada.
- Agregue 150 μL de BM con 60 μM lucifer amarillo a cada compartimento apical, y agregue 800 μL de BM sin amarillo Lucifer a cada compartimento basolateral. Coloque la placa en un agitador a 37 °C, 50 rpm durante 60 min.
- Mientras tanto, prepare una curva estándar de Lucifer Yellow en BM comenzando con la solución de trabajo preparada en el paso 4.2.1. Diluir 1:3 en cada paso hasta alcanzar una concentración de 3 nM. Incluya un control negativo (solo BM).
- Transfiera 100 μL de cada estándar por triplicado a una placa transparente de 96 pocillos. Después de 60 min de incubación, retire los insertos de membrana y transfiera 100 μL de cada pozo basolateral (paso 4.2.3) por triplicado a la placa transparente de 96 pocillos. Mida la fluorescencia de la placa utilizando un lector de placas a una longitud de onda de excitación de 430 nm y una longitud de onda de emisión de 530 nm.
- Después de corregir el valor de control negativo (solo BM), use los valores de la curva estándar para calcular la concentración de Lucifer Yellow en el compartimento basolateral (concentración del receptor final (μM)).
- Calcular el coeficiente de permeabilidad aparente (Papp) según la siguiente fórmula (Figura 6C):

- Para una placa de 24 pocillos que contiene insertos de membrana, use la siguiente fórmula:
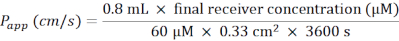
- Descongele Lucifer Yellow en hielo y deje que BM se equilibre a RT. Para una placa de 24 pocillos de insertos de membrana, prepare 5 ml de solución de trabajo de 60 μM Lucifer Yellow en BM.
- Fijación de monocapas y preparación de bloques de parafina para histología
NOTA: Las monocapas epiteliales se pueden utilizar para la tinción histológica para la evaluación de su composición celular, polaridad y expresión de diferentes proteínas de interés, como proteínas de unión, proliferación o marcadores de diferenciación. Esta sección describe la preparación del bloque de parafina para la tinción histológica.- Retire cuidadosamente el medio de los compartimentos basolateral y apical de los insertos de membrana, como se describe en los pasos 3.5.1.
- Lavar las monocapas añadiendo 150 μL de DPBS (sin Ca2+ y Mg2+) a cada compartimento apical y 800 μL a cada compartimento basolateral. Aspire cuidadosamente el DPBS nuevamente, primero desde el compartimiento basolateral y luego desde el compartimiento apical.
NOTA: El compartimento basolateral permanecerá vacío a partir de este paso. - En una campana extractora, agregue 150 μL de paraformaldehído al 4% a cada compartimento apical e incube durante 30 min a RT.
NOTA: A partir de este paso, realice todas las acciones en esta sección dentro de una campana de humos, ya que el paraformaldehído es tóxico. - Aspire cuidadosamente el fijador de los compartimentos apicales de los insertos de membrana y deséchelo como residuo halógeno líquido.
NOTA: A partir de este paso, elimine todos los residuos líquidos como residuos halógenos líquidos. - Lave las monocapas agregando 200 μL de DPBS (sin Ca2+ y Mg2+) a cada compartimento apical, y aspire cuidadosamente el DPBS nuevamente. Repita este paso una vez más.
- Añadir 200 μL de alcohol etílico al 25% (EtOH) a cada compartimento apical e incubar durante 15 min a RT. Después de 15 min, aspire cuidadosamente el EtOH al 25% de los compartimentos apicales de los insertos de membrana. Repetir con solución de EtOH al 50% y posteriormente con solución de EtOH al 70%.
- Agregue 200 μL de EtOH al 70% a cada compartimento apical y envuelva la placa con parafilm. Guárdelo a 4 °C hasta su uso posterior.
- Aspire cuidadosamente el 70% de EtOH y use un bisturí para cortar cuidadosamente las membranas monocapa de los insertos. Corte desde el lado basolateral, alrededor del borde del inserto.
- Prepare bloques de parafina siguiendo el procedimiento estándar.
- Cuando la parafina todavía esté caliente, tome la monocapa de la parafina con pinzas y colóquela sobre una superficie preenfriada.
- Tenga cuidado de no dañar la monocapa. Cortar la monocapa por la mitad con una cuchilla de un solo borde.
- Cuando la parafina en la parte inferior del cassette comience a solidificarse, use pinzas calentadas para colocar las dos partes monocapa en la parafina, una al lado de la otra con el lado recto hacia abajo y en una dirección vertical para garantizar que la monocapa sea vertical en el coupé.
- Cuando los bloques de parafina estén listos, corte los bloques con un microtomo y haga diapositivas de secciones de 4 μm de espesor siguiendo el procedimiento estándar. Asegúrese de que las monocapas terminen verticales en el coupé.
- Realizar tinciones histológicas como se describió anteriormente 7,9. Use hematoxilina y eosina (H&E), Ki67, mucina-2 (MUC2) y azul alciano para mostrar la morfología general, las células proliferativas, la producción de moco y las células caliciformes, respectivamente (Figura 6E).
NOTA: También se pueden usar marcadores de diferenciación adicionales, como la lisozima para las células de Paneth. Este marcador no se presenta en la Figura 6E ya que las células de Paneth están presentes en el epitelio del intestino delgado en lugar del epitelio del colon.
- Medición de proteína secretada en sobrenadante medio
- Mida los niveles de lisozima en el sobrenadante apical de monocapas ileales (ver Figura 6D) utilizando el kit listado en la Tabla de Materiales. Si lo desea, mida los niveles de diferentes citoquinas y otras proteínas de interés.
- Análisis de expresión génica
- Cuantificar los efectos de los medios de diferenciación sobre la expresión de genes marcadores de células epiteliales utilizando la reacción en cadena de la polimerasa con transcripción inversa cuantitativa (qRT-PCR).
- Lisar las monocapas en 350 μL de tampón de lisis de ARN seguido de aislamiento de ARN de acuerdo con las instrucciones del fabricante. Realizar síntesis de ADNc y qPCRs, como se describió anteriormente 7,9, utilizando los kits de síntesis de cDNA, mezcla maestra y oligonucleótidos enumerados en la Tabla de Materiales.
- Cuantificar los efectos de los medios de diferenciación sobre la expresión de genes marcadores de células epiteliales utilizando la reacción en cadena de la polimerasa con transcripción inversa cuantitativa (qRT-PCR).
5. Escalado a placas de 96 pocillos que contienen insertos de membrana
NOTA: Prepare monocapas epiteliales para exámenes de drogas de mayor rendimiento o condiciones de múltiples medios utilizando placas HTS de 96 pocillos que contengan insertos de membrana.
- Adaptaciones al preparar monocapas en formato de 96 pocillos
- Siga todos los pasos descritos en este protocolo para placas de 24 pocillos que contienen insertos de membrana, cambiando los volúmenes y los números de celda a los descritos en la Tabla 1. Para la preparación de monocapas en placas de 96 pocillos con inserciones de membrana, proceda como se describe en la sección 3 con las siguientes diferencias.
- Se necesitan aproximadamente 9 pocillos de una placa de cultivo de 6 pocillos con densidad organoide representada en la Figura 3A para sembrar una placa completa de 96 pocillos con inserciones de membrana. En el paso 3.2.1, recubrir previamente las membranas con 67 μL de ECM diluido 40x en DPBS (con Ca2+ y Mg2+).
- En la sección 3.5, primero transfiera la placa integral de insertos de membrana a otra placa de 96 pocillos para permitir el refresco medio de los compartimentos apical y basolateral.
- Siga todos los pasos descritos en este protocolo para placas de 24 pocillos que contienen insertos de membrana, cambiando los volúmenes y los números de celda a los descritos en la Tabla 1. Para la preparación de monocapas en placas de 96 pocillos con inserciones de membrana, proceda como se describe en la sección 3 con las siguientes diferencias.
Resultados
La Figura 1A muestra una imagen representativa de campo brillante de organoides intestinales después de descongelarlos de un criovial. Es importante descongelar los organoides a una alta densidad para garantizar una recuperación óptima. Los organoides están chapados en placas de 24 o 6 pocillos en domos ECM de aproximadamente 10 μL (Figura 1B). La mayoría de los organoides intestinales normales tienen una morfología quística. Después de recuperarse del ...
Discusión
Este protocolo describe la manipulación general y el mantenimiento de los organoides intestinales, así como la preparación y posibles aplicaciones de monocapas epiteliales derivadas de estos organoides. Hasta la fecha, las monocapas se han preparado con éxito a partir del duodeno, el íleon y diferentes regiones de organoides del colon derivados del tejido intestinal normal y previamente inflamado (datos no publicados). La aplicación de monocapas organoides derivadas del paciente facilita el estudio de la función d...
Divulgaciones
Los autores declaran no tener conflicto de intereses.
Agradecimientos
Este trabajo cuenta con el apoyo de Topsector Life Sciences & Health - Topconsortium voor Kennis en Innovatie Health~Holland (LSH-TKI) public-private partnerships (PPP) allowance of the Dutch LSH sector with Project number LSHM16021 Organoids as novel tool for toxicology modelling to Hubrecht Organoid Technology (HUB) and HUB internal funding to Disease Modeling and Toxicology department. Agradecemos a los laboratorios de Sabine Middendorp (División de Gastroenterología Pediátrica, Wilhelmina Children's Hospital, UMC, Utrecht) y Hugo R. de Jonge y Marcel J.C. Bijvelds (Departamento de Gastroenterología y Hepatología, Erasmus MC, Rotterdam) por proporcionar apoyo técnico inicial para establecer monocapas en insertos de membrana.
Materiales
| Name | Company | Catalog Number | Comments |
| 100% ethanol | Fisher Emergo | 10644795 | |
| 1250, 300, and 20 µL low-retention filter-tips | Greiner bio-one | 732-1432 / 732-1434 / 732-2383 | |
| 15 mL conical tubes | Greiner bio-one | 188271 | |
| 24-well cell culture plates | Greiner bio-one | 662160 | |
| 24-well HTS Fluoroblok Transwell plate (light-tight) | Corning | 351156 | |
| 24-well HTS Transwell plates (Table 1) | Corning | 3378 | |
| 24-well plate with Transwell inserts | Corning | 3470 | |
| 40 µm cell strainer | PluriSelect | 43-50040-01 | |
| 50 mL conical tubes | Greiner bio-one | 227261 | |
| 6-well cell culture plates | Greiner bio-one | 657160 | |
| 96-well black plate transparent bottom | Greiner bio-one | 655090 | |
| 96-well fast thermal cycling plates | Life Technologies Europe BV | 4346907 | |
| 96-well HTS Fluoroblok Transwell plate | Corning | 351162 | |
| 96-well HTS Transwell plates (Table 1) | Corning | 7369 | |
| 96-well transparent culture plate | Greiner bio-one | 655180 | |
| A83-01 | Bio-Techne Ltd | 2939 | |
| Accutase Cell Dissociation Reagent | Life Technologies Europe BV | A11105-01 | Cell dissociation reagent 2 |
| Advanced DMEM/F-12 | Life Technologies Europe BV | 12634028 | |
| B27 supplement | Life Technologies Europe BV | 17504001 | |
| Cell culture microscope (light / optical microscope) | Leica | ||
| CellTiter-Glo | Promega | G9683 | |
| Centrifuge | Eppendorf | ||
| CO2 incubator | PHCBI | ||
| DAPT | Sigma-Aldrich | D5942 | |
| DEPC treated H2O | Life Technologies Europe BV | 750024 | |
| Dulbecco's phosphate-buffered saline (DPBS) with Ca2+ and Mg2+ | Life Technologies Europe BV | 14040091 | |
| DPBS, powder, no calcium, no magnesium | Life Technologies Europe BV | 21600069 | |
| EnzChek Lysozyme Assay Kit | Life Technologies Europe BV | E22013 | |
| EVOM2 meter with STX electrode | WTI | ||
| Gastrin | Bio-Techne Ltd | 3006 | |
| Glass pipettes | Volac | ||
| GlutaMAX | Life Technologies Europe BV | 35050038 | |
| hEGF | Peprotech | AF-100-15 | |
| HEPES | Life Technologies Europe BV | 15630056 | |
| Human Noggin | Peprotech | 120-10C | |
| Human Rspo3 | Bio-Techne Ltd | 3500-RS/CF | |
| IWP-2 | Miltenyi Biotec | 130-105-335 | |
| Ki67 primary antibody | Sanbio | BSH-7302-100 | |
| Ki67 secondary antibody | Agilent | K400111-2 | |
| Kova International Glasstic Slide with Counting grids | Fisher Emergo | 10298483 | |
| Laminar flow hood | Thermo scientific | ||
| Lucifer Yellow CH dilithium salt | Sigma-Aldrich | L0259 | |
| Matrigel, Growth Factor Reduced (GFR) | Corning | 356231 | extracellular matrix (ECM) |
| MicroAmp Fast 8-Tube Strip, 0.1 mL | Life Technologies Europe BV | 4358293 | |
| MicroAmp Optical 8-Cap Strips | Life Technologies Europe BV | 4323032 | |
| Microcentrifuge tubes | Eppendorf | 0030 120 086 | |
| Micropipettes (1000, 200, and 20 µL) | Gilson | ||
| Microtome | Leica | ||
| MUC2 primary antibody | Santa Cruz Biotechnology | sc-15334 | |
| MUC2 secondary antibody | VWR | VWRKS/DPVR-HRP | |
| Multichannel pipette (200 µL) | Gilson | ||
| N-acetylcysteine | Sigma-Aldrich | A9165 | |
| NGS Wnt | U-Protein Express | N001-0.5mg | |
| Nicotinamide | Sigma-Aldrich | N0636 | |
| Oligonucleotide ALPI1/Forward | Custom-made | GGAGTTATCCTGCTCCCCAC | |
| Oligonucleotide ALPI1/Reverse | Custom-made | CTAGGAGGTGAAGGTCCAACG | |
| Oligonucleotide LGR5/Forward | Custom-made | ACACGTACCCACAGAAGCTC | |
| Oligonucleotide LGR5/Reverse | Custom-made | GGAATGCAGGCCACTGAAAC | |
| Oligonucleotide MUC2/Forward | Custom-made | AGGATCTGAAGAAGTGTGTCACTG | |
| Oligonucleotide MUC2/Reverse | Custom-made | TAATGGAACAGATGTTGAAGTGCT | |
| Oligonucleotide TBP/Forward | Custom-made | ACGCCGAATATAATCCCAAGCG | |
| Oligonucleotide TBP/Reverse | Custom-made | AAATCAGTGCCGTGGTTCGTG | |
| Optical adhesive covers | Life Technologies Europe BV | 4311971 | |
| PD0325901 | Stemcell Technologies | 72184 | |
| Penicillin/streptomycin | Life Technologies Europe BV | 15140122 | |
| Plate shaker | Panasonic | ||
| PowerUp SYBR Green Master Mix | Fisher Emergo | A25776 | |
| Primocin | InvivoGen | ANT-PM-2 | antimicrobial formulation for primary cells |
| Qubit RNA HS Assay Kit | Life Technologies Europe BV | Q32852 | |
| Reagent reservoir for multichannel pipet | Sigma-Aldrich | CLS4870 | |
| REMS AutoSampler with 24-probe or 96C-probe | WTI | ||
| Richard-Allan Scientific Alcian Blue/PAS Special Stain Kit | Thermo scientific | 87023 | |
| RNase-Free DNase Set | Qiagen | 79254 | |
| RNeasy Mini Kit | Qiagen | 74106 | |
| SB202190 | Sigma-Aldrich | S7076 | |
| Serological pipettes | Greiner bio-one | 606180 / 607180 / 760180 | |
| Serological pipettor (Pipet-Aid) | Drummond | ||
| Single edge razor blade | GEM Scientific | ||
| Superscript 1st strand system for RT-PCR | Life Technologies Europe BV | 11904018 | |
| Tecan Spark 10M plate reader | Tecan | ||
| Trypan Blue Solution, 0.4% | Life Technologies Europe BV | 15250-061 | |
| TrypLE Express Enzyme (1x) | Life Technologies Europe BV | 12605-010 | Cell dissociation reagent 1 |
| Water bath | Grant | ||
| Y27632 (ROCK inhibitor) | AbMole | M1817 |
Referencias
- Haegebarth, A., Clevers, H. Wnt signaling, lgr5, and stem cells in the intestine and skin. The American Journal of Pathology. 174 (3), 715-721 (2009).
- Schoultz, I., Keita, &. #. 1. 9. 7. ;. V. The intestinal barrier and current techniques for the assessment of gut permeability. Cells. 9 (8), 1909 (2020).
- Martínez-Maqueda, D., Miralles, B., Recio, I., Verhoeckx, K. HT29 Cell Line. The Impact of Food Bio-Actives on Gut Health: In Vitro and Ex Vivo Models. , 113-124 (2015).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Huch, M., et al. In vitro expansion of single Lgr5(+) liver stem cells induced by Wnt-driven regeneration. Nature. 11 (2), 179-194 (2013).
- Sachs, N., et al. Long-term expanding human airway organoids for disease modeling. The EMBO Journal. 38 (4), 1-20 (2019).
- Karthaus, W. R., et al. Identification of multipotent luminal progenitor cells in human prostate organoid cultures. Cell. 159 (1), 163-175 (2014).
- Boj, S. F., et al. Organoid models of human and mouse ductal pancreatic cancer. Cell. 160 (1-2), 324-338 (2015).
- Sachs, N., et al. A living biobank of breast cancer organoids captures disease heterogeneity. Cell. 172 (1-2), 373-386 (2018).
- Vlachogiannis, G., et al. Patient-derived organoids model treatment response of metastatic gastrointestinal cancers. Science. 359 (6378), 920-926 (2018).
- Van De Wetering, M., et al. Prospective derivation of a living organoid biobank of colorectal cancer patients. Cell. 161 (4), 933-945 (2015).
- Driehuis, E., et al. Pancreatic cancer organoids recapitulate disease and allow personalized drug screening. Proceedings of the National Academy of Sciences of the United States of America. 116 (52), 26580-26590 (2019).
- Tiriac, H., et al. Organoid profiling identifies common responders to chemotherapy in pancreatic cancer. Cancer Discovery. 8 (9), 1112-1129 (2018).
- d'Aldebert, E., et al. Characterization of human colon organoids from inflammatory bowel disease patients. Frontiers in Cell and Developmental Biology. 8, 363 (2020).
- Dotti, I., et al. Alterations in the epithelial stem cell compartment could contribute to permanent changes in the mucosa of patients with ulcerative colitis. Gut. 66 (12), 2069-2079 (2017).
- VanDussen, K. L., et al. Development of an enhanced human gastrointestinal epithelial culture system to facilitate patient-based assays. Gut. 64 (6), 911-920 (2015).
- Noel, G., et al. A primary human macrophage-enteroid co-culture model to investigate mucosal gut physiology and host-pathogen interactions. Scientific Reports. 7, 45270 (2017).
- Bartfeld, S., et al. In vitro expansion of human gastric epithelial stem cells and their responses to bacterial infection. Gastroenterology. 148 (1), 126-136 (2015).
- van Es, J. H., et al. Wnt signalling induces maturation of Paneth cells in intestinal crypts. Nature Cell Biology. 7 (4), 381-386 (2005).
- van Es, J. H., et al. Dll1 marks early secretory progenitors in gut crypts that can revert to stem cells upon tissue damage. Nature Cell Biology. 14 (10), 1099-1104 (2012).
- de Lau, W. B. M., Snel, B., Clevers, H. C. The R-spondin protein family. Genome Biology. 13 (3), 1-10 (2012).
- Basak, O., Beumer, J., Wiebrands, K., Seno, H., van Oudenaarden, A., Clevers, H. Induced quiescence of Lgr5+ stem cells in intestinal organoids enables differentiation of hormone-producing enteroendocrine cells. Cell Stem Cell. 20 (2), 177-190 (2017).
- Beumer, J., et al. Enteroendocrine cells switch hormone expression along the crypt-to-villus BMP signalling gradient. Nature Cell Biology. 20 (8), 909-916 (2018).
- Yin, X., Farin, H. F., van Es, J. H., Clevers, H., Langer, R., Karp, J. M. Niche-independent high-purity cultures of Lgr5+ intestinal stem cells and their progeny. Nature Methods. 11 (1), 106-112 (2014).
- Boj, S. F., et al. Forskolin-induced swelling in intestinal organoids: An in vitro assay for assessing drug response in cystic fibrosis patients. Journal of Visualized Experiments. (120), (2017).
- Miao, Y., et al. Next-generation surrogate Wnts support organoid growth and deconvolute Frizzled pleiotropy in vivo. Cell Stem Cell. 27 (5), 840-851 (2020).
- Srinivasan, B., et al. TEER measurement techniques for in vitro barrier model systems. Journal of Laboratory Automation. 20 (2), 107-126 (2015).
- Blume, L. -. F., Denker, M., Gieseler, F., Kunze, T. Temperature corrected transepithelial electrical resistance (TEER) measurement to quantify rapid changes in paracellular permeability. Die Pharmazie. 65 (1), 19-24 (2010).
- Lea, T., Verhoeckx, K., et al. Caco-2 cell line. The Impact of Food Bio-Actives on Gut Health: In Vitro and Ex Vivo Models. , 103-111 (2015).
- Heo, I., et al. Modelling Cryptosporidium infection in human small intestinal and lung organoids. Nature Microbiology. 3 (7), 814-823 (2018).
- Watanabe, K., et al. A ROCK inhibitor permits survival of dissociated human embryonic stem cells. Nature Biotechnology. 25 (6), 681-686 (2007).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados