JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
오가노이드 유래 상피 단층: 장 장벽 기능을 위한 임상적으로 관련된 시험관내 모델
요약
여기에서, 우리는 장 장벽 기능, 투과성 및 수송을 연구하기 위한 인간 오가노이드 유래 장 상피 단층의 제조를 기술한다. 오가노이드가 외부 자극에 대한 원래의 상피 조직 반응을 나타내기 때문에, 이들 모델은 세포주의 확장성과 일차 조직의 관련성 및 복잡성의 이점을 결합한다.
초록
과거에는 장 상피 모델 시스템이 형질전환 세포주 및 일차 조직으로 제한되었습니다. 이들 모델 시스템은 전자가 원래의 조직 생리학을 충실하게 나타내지 않기 때문에 내재적인 한계를 가지며, 후자의 이용가능성은 제한된다. 따라서 그들의 응용 프로그램은 기초 및 약물 개발 연구를 방해합니다. 성인 줄기 세포 기반 오가노이드 (이하 오가노이드라고 함)는 그들이 파생 된 정상 또는 병든 상피 조직의 미니어처입니다. 이들은 상이한 위장관 (GI) 관 영역에서 매우 효율적으로 확립될 수 있고, 장기간의 확장성을 가지며, 시험관내 치료에 대한 조직 및 환자 특이적 반응을 시뮬레이션할 수 있다. 여기서, 장 유래 오가노이드 유래 상피 단층의 확립은 상피 장벽 완전성, 투과성 및 수송성, 항균 단백질 분비 및 조직학을 측정하는 방법과 함께 입증되었다. 또한, 장 유래 오가노이드 단층은 증식하는 줄기 및 경이 증폭 세포뿐만 아니라 주요 분화 된 상피 세포로 농축 될 수 있습니다. 따라서, 이들은 표적 세포에 대한 화합물의 효과 및 그들의 작용 방식을 연구하도록 맞춤화될 수 있는 모델 시스템을 나타낸다. 오가노이드 배양은 세포주보다 기술적으로 더 까다 롭지 만, 일단 확립되면 생체 내 상피 복잡성과 환자 간 이질성을 진정으로 나타내기 때문에 약물 개발의 후기 단계에서 실패를 줄일 수 있습니다.
서문
장 상피는 장의 발광 함량과 기저 조직 사이의 물리적 장벽 역할을합니다. 이 장벽은 인접한 세포 사이에 강한 세포 간 연결을 확립하는 단단한 접합에 의해 연결되는 주로 흡수성 장세포의 단일 상피층을 포함한다. 이 세포들은 장의 정점 (루멘)과 기저변을 분리하는 편광 상피 내막을 형성하면서 동시에 소화 된 영양소와 대사 산물의 부세포 수송을 조절합니다. 장세포 이외에, 잔, 파네스 및 장내분비 세포와 같은 다른 중요한 상피 세포도 점액, 항균 펩티드 및 호르몬을 각각 생산함으로써 장 항상성에 기여한다. 장 상피는 류신이 풍부한 반복 함유 G-단백질 결합 수용체 5 양성 (LGR5+) 줄기 세포를 장내 크립트의 바닥에 나누어 지속적으로 보충하여 위쪽으로 이동하여 다른 세포 유형으로 분화되는 트랜스 증폭 (TA) 세포를 생산합니다1. 식품 알레르겐, 의약 화합물 및 미생물 병원균에 대한 노출과 같은 유전 적 및 환경 적 요인에 의한 장 상피 항상성의 붕괴는 장 장벽 기능의 중단으로 이어집니다. 이러한 상태는 염증성 장 질환 (IBD), 체강 질환 및 약물 유발 GI 독성2를 포함한 여러 장 질환을 유발합니다.
장 상피에 대한 연구는 막 삽입물, 장기 온 칩 시스템, Ussing 챔버 및 장 링과 같은 여러 시험관 내 플랫폼 시스템을 사용하여 수행됩니다. 이들 플랫폼은 형질전환된 세포주 또는 일차 조직을 모델로서 사용하여 막의 정점 및 기저측 양쪽 모두에 접근할 수 있는 편광된 상피 단층을 확립하는데 적합하다. 대장(adeno)암종 세포주인 Caco-2, T84 및 HT-29와 같은 형질전환 세포주는 어느 정도 편광된 장내세포 또는 점액 생성 세포로 분화할 수 있지만, 이들은 여러 세포 유형이 누락되고 다양한 수용체 및 운반체가 비정상적으로 발현됨에 따라 생체내 상피를 대표하지 않는다3 . 또한, 세포주는 단일 공여체로부터 유래되기 때문에, 이들은 환자간 이질성을 나타내지 않으며 감소된 복잡성 및 생리학적 관련성을 겪는다. Ussing 챔버 및 장 고리로 사용되는 일차 조직은 생체 내 상황을 더 대표하지만, 제한된 가용성, 단기 생존력 및 확장성 부족으로 인해 고처리량 (HT) 연구를위한 매개체로 부적합합니다.
오가노이드는 장, 신장, 간, 췌장 및 폐와 같은 다른 기관으로부터 확립된 시험관내 상피 배양물이다. 그들은 장기적이고 안정적인 확장성뿐만 아니라 유전 적 및 표현형 안정성을 갖는 것으로 입증되었으므로 외부 자극에 충실한 반응을 보이는 원래 기관의 상피의 대표적인 생물학적 미니어처입니다 4,5,6,7,8,9. 오가노이드는 절제되거나 생검된 정상, 병, 염증 또는 암성 조직으로부터 효율적으로 확립되며, 이질적인 환자 특이적 반응10,11,12,13,14,15,16을 나타낸다. 이 논문은 오가노이드 문화에서 유래 된 장 상피 단층을 확립하는 방법을 보여줍니다. 단층은 소장뿐만 아니라 결장 및 직장 오가노이드 문화에서 성공적으로 확립되었습니다. 이 모델은 상피 세포가 약물에 대한 수송 및 투과성뿐만 아니라 상피에 대한 독성 학적 영향을 연구 할 수있는 기회를 창출합니다. 또한이 모델은 면역 세포 및 박테리아와의 공동 배양을 통해 장 상피와의 상호 작용을 연구 할 수 있습니다17,18,19. 또한,이 모델은 환자 특정 방식으로 치료법에 대한 반응을 연구하고 상피 장벽 중심의 치료제의 다음 물결을 찾기 위해 스크리닝 노력을 시작하는 데 사용될 수 있습니다. 이러한 접근법은 클리닉으로 확장 될 수 있으며 개인화 된 치료를위한 길을 닦을 수 있습니다.
이 프로토콜의 상피 단층은 인간 정상 장 오가노이드로부터 제조되지만, 프로토콜은 다른 오가노이드 모델에 적용되고 최적화될 수 있다. 상피 오가노이드 단층은 줄기 세포 증식을 지원하고 장내 크립트 세포 조성물을 나타내기 위해 Wnt를 함유하는 장내 오가노이드 확장 배지에서 배양된다. 장내 오가노이드는 Wnt, Notch 및 표피 성장 인자 (EGF) 경로를 조절함으로써 장내분비 세포, 파네스, 잔 및 장내분비 세포와 같은 상이한 장 상피 운명을 갖도록 농축될 수 있다. 여기서, 확장 배지에서 단층의 확립 후에, 이들은 이전에 기술된 바와 같이 더 분화된 장 상피 세포,20,21,22,23,24,25로 구동된다. 스크리닝 목적을 위해, 관심있는 화합물의 작용 모드, 그의 표적 세포, 및 실험 조건에 따라, 단층은 관련 기능적 판독을 갖는 화합물의 효과를 측정하기 위해 선택된 세포 조성을 향해 구동될 수 있다.
프로토콜
1. 배양용 시약 준비
참고: 생물 안전 캐비닛 내부의 모든 단계를 수행하고 세포 배양 작업에 대한 표준 지침을 따르십시오. 자외선은 생물 안전 캐비닛을 시작하기 전에 10 분 동안 사용됩니다. 사용 전후에 생물 안전 캐비닛의 표면을 70 % 에탄올에 적신 티슈 페이퍼로 청소합니다. 세포외 매트릭스 (ECM)의 3차원 방울의 형성을 용이하게 하기 위해, 96-, 24-, 및 6-웰 플레이트의 예열 스톡을 37°C의 인큐베이터에서 준비된 상태로 유지한다.
- 기초 중간 준비
- Ham's Nutrient Mixture F-12(Ad-DF) 배지 병과 함께 500mL Advanced Dulbecco의 개질 이글 배지에 기본 배지(BM)를 준비하여 200mM 글루타민 5mL, 1M 4-(2-하이드록시에틸)-1피페라진에탄술폰산(HEPES) 5mL, 페니실린/스트렙토마이신(펜/스트렙) 용액 5mL(10,000 U/mL 또는 10,000 μg/mL)를 첨가합니다. 이것은 적어도 4주 동안 4°C에서 냉장고에 저장될 수 있다.
- Wnt 소스
- 앞서 기술된 방법26에 따라 Wnt3a 컨디셔닝 배지(Wnt3aCM)를 준비한다.
참고 : 최근에는 인간 장 오가노이드의 확장을 지원하는 차세대 대리 Wnt (NGS-Wnt)가생성되었습니다 27.
- 앞서 기술된 방법26에 따라 Wnt3a 컨디셔닝 배지(Wnt3aCM)를 준비한다.
- 장 오가노이드 염기 배지 준비
참고: 모든 성장 인자와 시약은 제조업체의 권장 사항에 따라 사용하십시오. 작은 분취량을 사용하고 동결 - 해동 사이클을 피하십시오. 기능적 성장 인자는 성공적인 오가노이드 배양에 필수적입니다.- BM에 1 μM A83-01, 2.5 mM N-아세틸시스테인, 2x B27 보충제, 100 ng/mL 인간 표피 성장 인자 (hEGF), 10 nM 가스트린, 200 ng/mL hNoggin 및 100 μg/mL의 1차 세포를 위한 항균 제제를 보충하여 농축된 2x 장내 오가노이드 베이스 배지 (2x IBM)를 준비한다 ( 물질 표 참조).
- 2x IBM을 분취하여 -20°C에서 최대 4개월 동안 동결시킨다. 필요한 경우, 분취량을 4°C에서 하룻밤 또는 실온(RT)에서 수 시간 동안 해동시킨다.
- 장내 오가노이드 확장 배지(IEM)를 준비하려면 2x IBM에 50% Wnt3aCM 또는 50% BM 및 0.5nM NGS-Wnt, 250ng/mL 인간 Rspondin-3(hRspo3), 10mM 니코틴아미드 및 10μM SB202190을 보충합니다.
- 장 오가노이드 분화 배지 제제
- 2x IBM에 50% BM, 250ng/mL hRspo3 및 1.5μM Wnt 경로 억제제(IWP-2)를 보충하여 장세포 분화 배지(eDM)를 준비합니다. eDM을 4°C에서 최대 10일 동안 보관하십시오.
- 2x IBM에 40% BM 및 10% Wnt3aCM 또는 50% BM 및 0.1 nM NGS-Wnt, 250 ng/mL hRspo3, 10 μM DAPT 및 100 nM PD0325901을 보충하여 조합 분화 배지 (cDM)를 준비한다. cDM을 4°C에서 최대 10일 동안 보관하십시오.
- 세포외 매트릭스 (ECM)의 조작
참고: 제조업체의 권장 사항에 따라 세포외 매트릭스(ECM)( 재료 표 참조)를 준비하십시오.- 얼음 위에서 밤새 ECM을 해동; 병으로부터 ECM을 5 mL 피펫을 사용하여 15 mL 원뿔형 튜브로 옮기고, 둘 다 -20°C에서 예비냉각시켰다. 분취량을 -20°C에서 한 번만 재동결시킨다. 일단 해동되면, ECM을 최대 7일 동안 4°C의 냉장고에 보관한다. 사용하기 전에 얼음 위에서 적어도 30 분 동안 배양하십시오.
참고: ECM을 올바르게 혼합하고 크립트 또는 오가노이드를 포함하기 전에 ECM이 차가워 졌는지 확인하십시오.
- 얼음 위에서 밤새 ECM을 해동; 병으로부터 ECM을 5 mL 피펫을 사용하여 15 mL 원뿔형 튜브로 옮기고, 둘 다 -20°C에서 예비냉각시켰다. 분취량을 -20°C에서 한 번만 재동결시킨다. 일단 해동되면, ECM을 최대 7일 동안 4°C의 냉장고에 보관한다. 사용하기 전에 얼음 위에서 적어도 30 분 동안 배양하십시오.
2. 오가노이드 문화
- 냉동 오가노이드로부터 문화 확립
참고: BM이 RT에 도달하게 하고, 12 mL 분취량을 유지하고, 37°C로 가온하고, 냉동 오가노이드를 함유하는 냉동고를 해동하는 절차를 시작하기 전에 준비한다.- 얼음 조각만이 남을 때까지 37°C 수조에서 교반함으로써 오르가노이드 동결을 빠르게 해동시킨다. 즉시 500 μL의 따뜻한 BM을 냉동 장치에 적하하고, 몇 번 위아래로 피펫팅하여 동결 배지를 희석하고 내용물을 조심스럽게 혼합하십시오.
- P1000 피펫을 사용하여 오가노이드를 15mL 원뿔형 튜브로 옮기고 튜브 바닥을 부드럽게 혼합하면서 따뜻한 BM 1mL를 적가합니다. 몇 번 위아래로 피펫을 올려 동결 매체를 희석하고 내용물을 조심스럽게 섞으십시오.
- 최대 12mL의 따뜻한 BM을 오가노이드가 들어있는 15 mL 원뿔형 튜브에 적가하고, 10 mL 멸균 피펫으로 위아래로 피펫을 올려 오가노이드를 부드럽게 재현탁시킨다.
- 오가노이드 현탁액을 85 × g 및 8°C에서 5분 동안 원심분리한다. 펠렛을 방해하지 않고 상청액을 조심스럽게 폐기하고, 10 μM Y27632 또는 다른 rho-associated coiled-coil-forming protein serine/threonine kinase inhibitor (ROCK inhibitor)로 보충된 IEM의 30% v/v에서 오가노이드를 재현탁시킨다. 튜브를 얼음 위에 놓습니다.
- ECM의 70% v/v를 오가노이드가 들어있는 15mL 원뿔형 튜브에 첨가합니다. 15 mL 원뿔형 튜브를 얼음 위에 유지한 오가노이드 현탁액을 혼합하고, 현탁액의 시드 5 μL를 혼합하여 밀도를 확인하였다(도 1A). 밀도가 적절한 경우 도금을 계속하십시오. 밀도가 너무 높으면 IEM / ECM 용액을 각각 30-70 % v / v의 동일한 비율로 추가하십시오.
- 예열된 24-웰 플레이트의 각 웰에서, 시드 50 μL의 오가노이드 현탁액을 10 μL의 5개의 분리된 방울을 피펫팅함으로써 피펫팅한다(도 1B). 플레이트를 거꾸로 뒤집어 5 분 동안 생물 안전 캐비닛에 두십시오. 플레이트를 여전히 거꾸로 37°C 인큐베이터로 옮기고, 또 다른 30분 동안 방치한다.
- 10 μM ROCK 억제제를 갖는 500 μL의 IEM을 각 웰에 첨가하고, 플레이트를 인큐베이터로 옮긴다. 성장을 모니터링하기 위해 정기적으로 한 방울씩 이미지를 이미지화하고, 오래된 배지를 흡인하고 500μL의 신선한 IEM을 추가하여 2-3일마다 IEM을 새로 고칩니다.
- 오가노이드가 해동으로부터 적절하게 회복되고 섹션 2.2에 설명된 바와 같이 처리될 적당한 크기에 도달하면(그림 1C) 통과시킨다.
- 장 오가노이드의 통과
참고: ECM을 얼음 위에서 30분 이상 식히고 사용하기 전에 IEM을 RT에 1시간 이상 두십시오.- 하나의 배양 웰로부터의 배지를 사용하여 1250 μL 저보유 필터-팁을 사용하여 오가노이드 돔을 분해하고, 웰 내용물을 표지된 15 mL 원뿔형 튜브로 옮긴다. 1 mL의 BM으로 웰을 세척하고, 동일한 15 mL 코니컬 튜브로 옮긴다.
- 다른 모든 웰과 함께 단계 2.2.1 및 2.2.2를 반복한다(최대 절반 플레이트 또는 600 μL의 ECM 방울을 세척하고 하나의 15 mL 코니컬 튜브에 첨가할 수 있음).
- BM을 첨가하여 튜브를 최대 12mL까지 채우고, 10mL 피펫을 사용하여 10x 위아래로 피펫을 만듭니다. 85 × g 에서 8°C에서 5분 동안 원심분리한다.
- BM을 제거하기 전에 현미경으로 모든 오가노이드가 15mL 원뿔형 튜브의 바닥에서 펠릿화되었는지 확인하십시오 (그림 1D). 오가노이드 펠릿을 오버레이하는 ECM이 없거나 ECM 층이 깨끗하거나 펠릿화된 오가노이드에 비해 단지 파편, 단일 세포 또는 매우 적은 오가노이드를 포함하는 경우, 상청액을 흡인하고 P200 피펫을 사용하여 ECM 오버레이된 오가노이드 펠릿을 매우 조심스럽게 꺼낸다.
참고 : 오가노이드는 ECM에 갇힐 수 있으며 낮은 원심분리력으로 인해 소형 펠렛으로 침전되지 않습니다. ECM에 오가노이드가 포함된 경우, 튜브를 8°C에서 5분 동안 450 × g 에서 다시 원심분리하고, 2.2.4에 기재된 바와 같이 상청액을 조심스럽게 제거하였다. 15mL 코니컬 튜브가 여러 개 있는 경우 2.2.4단계 후에 풀링할 수 있습니다. - 각 펠렛에 1 mL의 BM을 첨가하고(오가노이드 배양 및 밀도에 따라 50-200 μL의 부피의), 조심스럽게 재현탁시켰다. 오가노이드를 적어도 5x 이상 위아래로 피펫하여 전단하여 거품 형성을 피하십시오. 현미경으로 오가노이드가 파쇄되었는지 확인하십시오 (그림 2A). 오가노이드가 파괴되면 단계 2.2.7로 진행하십시오. 오가노이드가 중단되지 않으면 다른 5x를 피펫하십시오. 이번에는 플라스틱 튜브의 벽을 피펫 팁으로 만져서 오가노이드를 방해하는 기계적 힘을 발휘하십시오.
참고: 낭포성(그림 1C) 및 신진 오가노이드(그림 1E)의 기계적 전단은 오가노이드를 파괴하는 데 필요한 부피에 따라 저보존 1250μL 필터 팁(그림 1F)에 장착된 200μL 또는 10μL 플라스틱 피펫 팁으로 가능합니다. 좁아진 유리 피펫(그림 1F)의 사용은 오가노이드를 포함하는 200μL 이상의 ECM을 처리할 때 권장됩니다(6웰 플레이트의 한 웰 또는 24웰 플레이트의 4웰). - 현미경 아래에서 오가노이드가 파괴되었는지 다시 확인하십시오. 중단되면 다음 단계를 진행하십시오. 그렇지 않은 경우 오가노이드를 최대 20x까지 피펫팅하여 현미경으로 오가노이드를 정기적으로 검사하십시오. 오가노이드가 여전히 파쇄되지 않은 경우, 현탁액에 25% v/v 세포 해리 시약 1( 물질 표 참조)을 첨가하고, 37°C의 수조에서 2분 동안 배양한 다음, 오가노이드를 최대 20배까지 피펫팅하여 현미경으로 오가노이드가 단일 세포로 소화되지 않았는지 정기적으로 점검합니다.
- 최대 12 mL의 BM을 15 mL 코니컬 튜브에 첨가하고, 위아래로 피펫팅하여 오가노이드 펠릿을 세척한다. 85 × g 에서 8°C에서 5분 동안 원심분리한다. 상청액을 버리고 유기형 펠릿에 IEM 및 ECM을 추가하여 최종 농도를 70% v/v ECM으로 조정합니다.
- 통과를 위해 수집된 IEM/ECM의 두 배 부피로 오가노이드 펠릿을 재현탁하기 시작하고, 밀도를 확인하기 위해 현탁액 5μL를 시드한다. 밀도가 적절한 경우 도금을 계속합니다(그림 2B). 밀도가 너무 높은 경우 IEM / ECM 솔루션을 더 추가하십시오. 200 μL의 현탁액을 예열된 6-웰 플레이트의 각 웰에 첨가하고, 10 μL 부피의 개별 방울을 만든다.
- 플레이트를 거꾸로 뒤집어 5 분 동안 생물 안전 캐비닛에 두십시오. 플레이트를 여전히 거꾸로 37°C 인큐베이터로 옮기고, 30분 동안 더 방치한다. 10 μM ROCK 억제제가 있는 IEM 2 mL를 각 웰에 첨가하고, 플레이트를 인큐베이터로 옮긴다.
- 성장을 모니터링하기 위해 정기적으로 한 방울씩 이미지를 찍고, 오래된 배지를 흡인하고 2mL의 신선한 IEM을 추가하여 2-3일마다 IEM을 새로 고칩니다.
- 상피 단층 준비를위한 장 오가노이드의 통과
- 통과 오가노이드는 단층 제제를 위해 수확하기 3일 전에 한 가지 예외를 제외하고 섹션 2.2에 기술된 동일한 패시징 프로토콜을 따른다. 단계 2.2.7에서, 오가노이드가 단층 준비를 위해 수확될 때 더 높은 밀도 및 팽창 전위를 갖도록 IEM/ECM의 시작 부피의 1-1.5배에 재현탁한다(그림 3A).
3. 상피 단층 준비
- 다양한 사용 가능한 플레이트 유형을 갖는 24-웰 및 96-웰 멤브레인 인서트 둘 다에 상피 단층을 배양하였다(표 1). 두 크기 모두에 대해 고처리량 시스템(HTS) 멤브레인 인서트를 사용하십시오. 이 인서트는 멤브레인 인서트와 수신기 플레이트가 있는 일체형 트레이를 포함하고 있기 때문입니다. 24웰 포맷의 경우, 별도의 탈착식 멤브레인 인서트가 있는 플레이트를 사용하는 것도 가능합니다.
참고: 다양한 멤브레인 유형(폴리에틸렌 테레프탈레이트(PET) 또는 폴리카보네이트)과 기공 크기(0.4-8.0μm)를 사용할 수 있으며 실험 요구에 따라 사용할 수 있습니다. 단층은 PET 멤브레인이 있는 인서트를 사용할 때만 브라이트필드로 이미징할 수 있습니다. 광-밀폐 멤브레인은 정점으로부터 기저측 구획으로의 형광 광 누출을 차단하고, 형광 표지된 기판의 동적 수송 또는 투과성이 연구될 때 고려될 수 있다. 현재 프로토콜은 24-웰 멤브레인 인서트를 사용합니다. 96-웰 멤브레인 인서트에 대한 적응은 섹션 5에 설명되어 있다. 오가노이드의 밀도, 형태 및 크기에 따라(도 3A), 6-웰 플레이트의 6개 웰(섹션 2.3에서 시딩된 바와 같이)은 멤브레인 인서트의 전체 24웰 플레이트를 시딩하기에 충분하다. - ECM으로 코팅 멤브레인 인서트
참고: 셀이 충분한지 의심이 가는 경우 셀 수를 계산한 후 삽입물을 코팅하십시오. 이는 불필요한 코팅과 고가의 멤브레인 인서트의 손실을 방지하기 위함이다.- 멤브레인 인서트를 생물안전 캐비닛의 지지판에 넣습니다. ECM 40x를 빙저온 둘베코 포스페이트 완충 식염수(DPBS)에 Ca2+ 및Mg2+로 희석하고, 희석된 ECM 150 μL를 각 삽입물의 정점 구획에 피펫팅한다. 플레이트를 적어도 1시간 동안 37°C에서 인큐베이션한다.
- 시딩을 위한 세포의 제조
- 세포 해리 시약 2의 분취량을 수조(37°C)에서 예열한다. 6-웰 플레이트의 각 웰에 대해 시약 2 mL를 준비한다.
- 오가노이드(섹션 2.3에서 제조됨)를 함유하는 배양 플레이트를 인큐베이터에서 생물안전 캐비닛으로 옮긴다. 단계 2.2.1.-2.2.4에 기재된 바와 같이 오가노이드를 처리한다. 여러 튜브를 하나의 튜브에 풀링하지 마십시오.
- 6웰 플레이트의 최대 3웰에서 오가노이드가 들어있는 튜브를 채우고, DPBS로 최대 12mL(Ca2+ 및 Mg2+ 제외), 10mL 피펫을 사용하여 10x 위아래로 피펫을 채웁니다. 8°C에서 5분 동안 85 × g 에서 원심분리하고, 오가노이드 펠릿을 방해하지 않고 상청액을 흡인하였다.
- 출발 물질로 사용된 6-웰 플레이트의 웰 당 2 mL의 미리 차온 된 세포 해리 시약 2를 첨가하고 재현탁시켰다. 튜브를 37°C의 수조에서 5분 동안 대각선 또는 수평으로 인큐베이션하여, 오가노이드가 튜브의 바닥으로 가라앉는 것을 방지한다.
- 세포 해리 시약의 총 부피에 따라 5 mL 멸균 플라스틱 피펫 또는 P1000 피펫을 사용하여 10x 상하 피펫. 현미경으로 오가노이드 현탁액을 확인하여 단일 세포와 2-4 세포로 구성된 일부 세포 덩어리의 혼합물이 형성되었는지 확인하십시오 (그림 3B). 필요한 경우, 혼합물이 도 3B와 유사하게 보일 때까지 단계 3.3.4-3.3.5(세포 해리 시약의 부피를 증가시키지 않음)를 반복함으로써 소화를 계속한다.
참고: 오가노이드를 단일 세포로 완전히 소화하지 마십시오. 세포의 일부 작은 그룹 (즉, 2-4 세포의 그룹)을 가질 필요가 있습니다. - 세포 현탁액에 10 μM ROCK 억제제를 포함하는 BM 12 mL를 첨가함으로써 세포 해리를 중지시킨다. 450 × g 에서 8°C에서 5분 동안 원심분리하고, 세포 펠릿을 교란시키지 않고 상층액을 흡인하였다. 여러 15 mL 원뿔형 튜브에서 동일한 오가노이드 배양물을 처리할 때, 세포 펠릿을 풀링하고 12 mL의 BM에 재현탁시킨다.
- BM으로 예습된 40 μm 스트레이너를 통해 세포 현탁액을 여과하고, 유동을 50 mL 코니컬 튜브 내로 수확한다. 스트레이너를 10 mL의 BM으로 세척하고, 동일한 50 mL 코니컬 튜브 내로 유동을 수확한다.
- 긴장된 세포 현탁액을 두 개의 새로운 15mL 원뿔형 튜브로 옮깁니다. 450 × g 에서 8°C에서 5분 동안 원심분리하고, 세포 펠릿을 교란시키지 않고 상청액을 흡인하였다. 세포를 출발 물질로 사용된 전체 배양 플레이트 당 10 μM ROCK 억제제로 보충된 IEM 4 mL에 재현탁시켰다.
- 소량의 세포 현탁액을 1:1 비율로 트리판 블루와 혼합하여 계수하십시오. 파란색이 아닌 라이브 셀을 계산하고(그림 3C), 살아있는 셀의 총 수를 계산합니다. 작은 덩어리에서 각 개별 세포를 계산하십시오.
- 10 μM ROCK 억제제로 보충된 IEM mL 당 3 × 106 개의 살아있는 세포를 함유하는 세포 현탁액을 제조하였다.
- 폴리에스터 멤브레인 인서트에 세포 시드
- 플레이트를 수평으로 유지하면서 ECM 코팅 인서트(단계 3.2.1)에서 DPBS를 조심스럽게 흡인합니다. ROCK 억제제로 보충된 IEM의 피펫 800 μL를 각 기저측부 구획에 넣었다. 단계 3.3.10에서 제조된 세포 현탁액 150 μL를 정점 구획 내의 ECM 코팅된 막 상에 적가한다. 접시 당 BM만으로 적어도 하나의 "공백"우물이 있어야합니다.
- 일단 세포가 막 상에 침전되면, 섹션 4.1에 설명된 바와 같이, 경상피 전기 저항(TEER)을 측정하고, 현미경을 사용하여 막 삽입물을 이미지화한다. 플레이트를 37°C 및 5%CO2의 인큐베이터에 놓는다. 매일 TEER를 측정하고 정기적으로 이미지를 수집하여 단층 형성을 모니터링합니다(그림 4A-D).
- 새로 고침 모노레이어
참고: 2-3일마다 배지를 새로 고치고 다음 순서를 준수하여 세포 위에 양의 정수압을 유지하고 세포가 막에서 밀려나지 않도록 합니다. 매체를 상쾌하게하는 동안 매체의 흡인시 볼 수있는 단층이 피펫 팁에 의해 손상되지 않았는지 확인하십시오.- 멤브레인 인서트를 포함하는 플레이트의 기저측 구획으로부터 배지를 제거한다. 그런 다음, 멤브레인 인서트의 정점 구획으로부터 배지를 조심스럽게 흡인한다.
- 신선한 IEM 150μL를 각 정점 구획에 적하한 다음 800μL의 신선한 IEM을 각 기저 구획에 첨가합니다.
- 원하는 장 상피 세포 유형에 대한 단층의 농축
- 단층이 약 100 Ω·cm²의 TEER 값에 해당하는 IEM에서 합류하도록 허용하십시오 (4.1.1.4 단계에서 계산 된 바와 같이). 현미경으로 단층이 완전히 형성되었는지 여부(그림 4D)와 구멍이 없는지 확인합니다( 그림 4B, C에서 볼 수 있음).
- 멤브레인 인서트의 기저측 및 정점 구획에서 IEM을 조심스럽게 제거하고 섹션 1.4에서 준비한 대로 eDM 또는 cDM으로 교체합니다. 단층을 특정 분화 배지에서 또 다른 3-4일 동안 배양하여 원하는 특정 세포 유형으로 농축된 오가노이드 세포를 얻는다. 섹션 3.4에 설명된 대로 2-3일마다 배지를 새로 고칩니다.
- 매일 TEER를 측정하고 원하는 경우 정기적으로 이미지를 수집합니다(그림 5A-C).
참고: 완전히 조직된 농축 단층을 나타내는 TEER 값은 오가노이드 배양에 따라 다릅니다. 전형적으로 TEER 값은 600까지 증가하고, 분화 배지에서 3일 후에 1000 Ω·cm2( 단계 4.1.1.4에서 계산됨)까지 증가할 수 있고 3-5일 동안 안정하다.
4. 상피 단층 분석 판독
- 경상피 전기 저항의 측정 (TEER)
참고: TEER 측정은 상피 단층28,29와 같은 생리학적 장벽의 생물학적 모델에서 타이트한 접합 역학 및 장벽 기능 무결성을 분석하는 방법으로 널리 받아들여지고 있습니다. 타이트한 접합부에서 증가된 세포 상호작용으로 인한 분화 후 TEER의 증가는 수동 TEER 미터 또는 자동화된 TEER 측정 로봇을 사용하여 측정할 수 있다.- 수동 TEER 미터를 사용한 TEER 측정
- 전극을 70 % 에탄올로 청소하고 생물 안전 캐비닛 내부에서 공기 건조하게하십시오. 전극을 BM이 들어있는 튜브에 넣습니다. 전극을 수동 TEER 미터에 연결합니다. 기능 스위치를 돌려 옴(Ω)으로 측정합니다. 전원 스위치를 켭니다.
- 짧은 전극을 인서트의 정점 구획에 놓고, 긴 전극은 기저측 구획에 위치한다(도 6A). 단층을 만지지 마십시오.
- 블랭크 웰(Rblank)에서 저항을 측정하고, 이어서 동일한 방법으로 나머지 샘플(R샘플)을 측정한다. 다른 조건을 가진 샘플 사이에서 BM으로 전극을 세척하십시오. 먼저 데미 물로 전극을 닦은 다음 70 % 에탄올로 닦고 공기 건조하게하십시오.
- TEER 계산 (Ω·cm2): [R샘플 (Ω) - R블랭크 (Ω)] × 막 면적 (cm2) (표 1 및 그림 6B).
- 자동화된 TEER 측정 로봇을 사용한 TEER 측정 (Table of Materials)
- 멤브레인 인서트가 포함된 96웰 및 24웰 HTS 플레이트에 HTS 시스템을 사용할 때 자동화된 TEER 측정을 수행합니다. 두 유형 (24- 및 96- HTS 멤브레인 인서트)에 대해 TEER 측정을 위해 서로 다른 전극을 사용하십시오. 자동화된 TEER 측정 로봇을 사용하여 TEER를 측정하려면 제조업체의 지침을 따르십시오.
- 수동 TEER 미터를 사용한 TEER 측정
- 상피 장벽 무결성 및 투과성 측정
참고: 이 프로토콜은 단층 무결성의 표시로 정점에서 기저 구획까지 루시퍼 옐로우 투과성을 도입합니다. 이 섹션에서는 단층 투과성 및 이에 따라, 장벽 무결성을 평가하기 위해 1시간 인큐베이션 단계 후에 기저측성 구획에서의 형광 측정을 설명한다. 이 측정은 끝점 분석이며 화합물이 장벽 무결성에 미치는 영향을 테스트할 때 특히 유용합니다.- 루시퍼 옐로우를 얼음 위에서 해동시키고 BM이 RT와 평형을 이루도록 한다. 멤브레인 인서트의 24웰 플레이트 하나에 대해 BM 중의 60μM 루시퍼 옐로우의 작업 용액 5mL를 준비합니다.
참고: 루시퍼 옐로우는 빛에 민감합니다. 어두운 1.5 mL 멸균 튜브에서 희석액을 준비하고 생물 안전 캐비닛 조명을 끄고 모든 단계를 수행하십시오. - 단계 3.5.1에 기술된 바와 같이, 막 삽입물의 기저측부 및 정점 구획으로부터 배지를 조심스럽게 제거한다. 원하는 경우, 피펫 팁을 사용하여 처리되지 않은 단층 하나를 손상된 장벽을 통한 루시퍼 옐로우 누출에 대한 양성 대조군으로 긁어냅니다.
- 60μM 루시퍼 옐로우가 있는 BM 150μL를 각 정점 구획에 첨가하고, 루시퍼 옐로우가 없는 BM 800μL를 각 기저측 구획에 첨가한다. 플레이트를 60분 동안 37°C, 50 rpm에서 진탕기 상에 놓는다.
- 그 동안, 단계 4.2.1에서 제조된 작업 용액으로 시작하여 BM에서 루시퍼 옐로우의 표준 곡선을 준비한다. 3 nM의 농도에 도달할 때까지 각 단계에서 1:3으로 희석한다. 음성 대조군(BM만 해당)을 포함합니다.
- 각 표준의 100 μL를 삼중으로 96-웰 투명 플레이트로 옮긴다. 60분 인큐베이션 후, 막 삽입물을 제거하고, 각 기저측성 웰로부터 100 μL를 3회 이송(단계 4.2.3)하여 96-웰 투명 플레이트로 옮긴다. 플레이트 리더를 사용하여 430 nm의 여기 파장 및 530 nm의 방출 파장에서 플레이트의 형광을 측정한다.
- 음성 대조군 값(BM만)을 보정한 후, 표준 곡선 값을 사용하여 기저측성 구획에서의 루시퍼 옐로우 농도(최종 수용자 농도(μM))를 계산한다.
- 다음 공식에 따라 겉보기 투과도 계수(Papp)를 계산합니다(그림 6C).

- 멤브레인 인서트가 포함된 24웰 플레이트의 경우 다음 공식을 사용합니다.
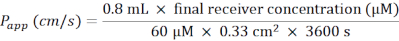
- 루시퍼 옐로우를 얼음 위에서 해동시키고 BM이 RT와 평형을 이루도록 한다. 멤브레인 인서트의 24웰 플레이트 하나에 대해 BM 중의 60μM 루시퍼 옐로우의 작업 용액 5mL를 준비합니다.
- 단층 고정 및 조직학을위한 파라핀 블록 준비
참고: 상피 단층은 그들의 세포 조성, 극성 및 접합 단백질, 증식 또는 분화 마커와 같은 관심있는 다른 단백질의 발현을 평가하기 위해 조직학적 염색에 사용될 수 있다. 이 섹션에서는 조직학적 염색을 위한 파라핀 블록 제제에 대해 설명한다.- 단계 3.5.1에 설명된 바와 같이, 막 삽입물의 기저측 및 정점 구획으로부터 배지를 조심스럽게 제거한다.
- 150 μL의 DPBS (Ca2+ 및Mg2+ 없이)를 각각의 정점 구획에 첨가하고 800 μL를 각각의 기저측성 구획에 첨가함으로써 단층을 세척한다. DPBS를 다시 조심스럽게 흡인하십시오, 먼저 기저 측부 구획에서, 그리고 정점 구획에서.
참고: 기저 측부 구획은 이 단계부터 비어 있습니다. - 흄 후드에서, 150 μL의 4% 파라포름알데히드를 각 정점 구획에 첨가하고, RT에서 30분 동안 인큐베이션한다.
참고: 이 단계부터 파라포름알데히드가 독성이 있으므로 흄 후드 내부에서 이 섹션의 모든 작업을 수행합니다. - 멤브레인 인서트의 정점 구획에서 고정제를 조심스럽게 흡인하고 액체 할로겐 폐기물로 폐기하십시오.
참고: 이 단계부터 모든 액체 폐기물을 액체 할로겐 폐기물로 폐기하십시오. - 200 μL의 DPBS (Ca2+ 및Mg2+ 없이)를 각각의 정점 구획에 첨가하여 단층을 세척하고, DPBS를 다시 조심스럽게 흡인시킨다. 이 단계를 한 번 더 반복합니다.
- 200 μL의 25% 에틸 알콜 (EtOH)을 각각의 정점 구획에 첨가하고, RT에서 15분 동안 인큐베이션한다. 15분 후, 막 삽입물의 정점 구획으로부터 25% EtOH를 조심스럽게 흡인한다. 50% EtOH 용액으로 반복한 다음 70% EtOH 용액으로 반복한다.
- 200 μL의 70% EtOH를 각각의 정점 구획에 첨가하고, 플레이트를 파라필름으로 감싸십시오. 추가 사용 시까지 4°C에 보관한다.
- 조심스럽게 70% EtOH를 흡인하고, 메스를 사용하여 인서트로부터 단층 멤브레인을 조심스럽게 절단한다. 인서트의 가장자리 주위의 기저면에서 자릅니다.
- 표준 절차에 따라 파라핀 블록을 준비하십시오.
- 파라핀이 여전히 따뜻하면 핀셋으로 파라핀에서 단층을 가져 와서 미리 냉각 된 표면에 놓습니다.
- 단층이 손상되지 않도록주의하십시오. 단일 모서리 블레이드를 사용하여 단층을 반으로 자릅니다.
- 카세트 바닥에있는 파라핀이 응고되기 시작하면 가열 된 핀셋을 사용하여 파라핀에 두 개의 단층 부분을 배치하고 직선을 아래로 그리고 수직 방향으로 서로 옆에 배치하여 단층이 쿠페에서 수직이되도록하십시오.
- 파라핀 블록이 준비되면 마이크로톰을 사용하여 블록을 자르고 표준 절차에 따라 4 μm 두께의 슬라이드를 만듭니다. 모노레이어가 쿠페에서 수직으로 끝나는지 확인하십시오.
- 앞서 7,9에 기재된 바와 같이 조직학적 염색을 수행한다. 헤마톡실린과 에오신(H&E), Ki67, 뮤신-2(MUC2) 및 알시안 블루를 사용하여 각각 일반적인 형태학, 증식성 세포, 점액 생산 및 잔 세포를 보여줍니다(그림 6E).
참고: 파네스 세포에 대한 라이소자임과 같은 추가적인 분화 마커도 사용할 수 있다. 이러한 마커는 파네스 세포가 결장 상피보다는 소장 상피에 존재하기 때문에 도 6E 에 제시되지 않는다.
- 배지 상청액에서의 분비 단백질 측정
- 장폐색 단층의 정점 상청액에서 리소자임 수준을 측정하고( 도 6D 참조) 물질 표에 열거된 키트를 사용한다. 원하는 경우, 상이한 사이토카인 및 관심있는 다른 단백질의 수준을 측정한다.
- 유전자 발현 분석
- 정량적 역전사-중합효소 연쇄반응(qRT-PCR)을 이용하여 상피세포 마커 유전자의 발현에 대한 분화 배지의 효과를 정량화한다.
- 단층을 350 μL의 RNA 용해 완충액에 용해시킨 다음, 제조자의 지시에 따라 RNA를 분리한다. 앞서7,9에서 설명한 바와 같이, cDNA 합성 키트, 마스터 믹스 및 물질 표에 열거된 올리고뉴클레오티드를 사용하여 cDNA 합성 및 qPCR을 수행한다.
- 정량적 역전사-중합효소 연쇄반응(qRT-PCR)을 이용하여 상피세포 마커 유전자의 발현에 대한 분화 배지의 효과를 정량화한다.
5. 멤브레인 인서트를 포함하는 96웰 플레이트로 업스케일링
참고: 멤브레인 인서트가 포함된 HTS 96-웰 플레이트를 사용하여 더 높은 처리량의 약물 스크리닝 또는 다중 중간 조건을 위해 상피 단층을 준비하십시오.
- 96-well 형식의 모노레이어를 준비할 때의 적응
- 막 삽입물을 함유하는 24-웰 플레이트에 대해 이 프로토콜에 설명된 모든 단계를 따르고, 부피 및 세포 번호를 표 1에 기재된 것으로 변경한다. 멤브레인 인서트가 있는 96웰 플레이트 상에 단층을 제조하려면 섹션 3에 설명된 대로 다음과 같은 차이점을 가지고 진행하십시오.
- 도 3A에 표현된 오가노이드 밀도를 갖는 6-웰 배양 플레이트의 대략 9개의 웰은 멤브레인 인서트가 있는 전체 96-웰 플레이트를 시드하기 위해 필요하다. 단계 3.2.1에서, 막을 DPBS에 희석된 67 μL의 40x ECM으로 프리코트한다(Ca2+ 및Mg2+를사용함).
- 섹션 3.5에서, 먼저 멤브레인 인서트의 일체형 플레이트를 다른 96웰 플레이트로 옮겨 정점 및 기저측 구획 모두의 중간 다과를 가능하게 한다.
- 막 삽입물을 함유하는 24-웰 플레이트에 대해 이 프로토콜에 설명된 모든 단계를 따르고, 부피 및 세포 번호를 표 1에 기재된 것으로 변경한다. 멤브레인 인서트가 있는 96웰 플레이트 상에 단층을 제조하려면 섹션 3에 설명된 대로 다음과 같은 차이점을 가지고 진행하십시오.
결과
도 1A는 이를 동결 상태로부터 해동시킨 후의 장내 오가노이드의 대표적인 밝은 필드 이미지를 도시한다. 최적의 회복을 보장하기 위해 오가노이드를 고밀도로 해동하는 것이 중요합니다. 오가노이드는 약 10μL의 ECM 돔에 있는 24웰 또는 6웰 플레이트에 도금됩니다(그림 1B). 대부분의 정상적인 장 오가노이드는 낭성 형태를 가지고 있습니다. 해동 과정?...
토론
이 프로토콜은 장 오가노이드의 일반적인 조작 및 유지뿐만 아니라 이러한 오가노이드로부터 유래된 상피 단일층의 준비 및 가능한 응용을 기술한다. 현재까지, 단층은 십이지장, 장폐색 및 정상 뿐만 아니라 이전에 그리고 활발하게 염증을 일으킨 장 조직으로부터 유래된 결장 오가노이드의 상이한 영역으로부터 성공적으로 제조되었다(공개되지 않은 데이터). 환자 유래 오가노이드 단일층의 ?...
공개
저자는 이해 상충이 없다고 선언합니다.
감사의 말
이 작업은 Topsector Life Sciences & Health - Topconsortium voor Kennis en Innovatie Health~Holland (LSH-TKI) 공공 - 민간 파트너십 (PPP) 프로젝트 번호 LSHM16021 Organoids와 함께 네덜란드 LSH 부문의 수당을 Hubrecht Organoid Technology (HUB) 및 HUB 내부 자금 조달 질병 모델링 및 독성학 부서에 대한 독성학 모델링을위한 새로운 도구로 지원합니다. 우리는 Sabine Middendorp (소아 위장병학, Wilhelmina Children 's Hospital, UMC, Utrecht)와 Hugo R. de Jonge와 Marcel J.C. Bijvelds (위장병 및 간학과, Erasmus MC, Rotterdam)의 실험실에 멤브레인 삽입물에 단층을 설정하는 초기 기술 지원을 제공 한 것에 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| 100% ethanol | Fisher Emergo | 10644795 | |
| 1250, 300, and 20 µL low-retention filter-tips | Greiner bio-one | 732-1432 / 732-1434 / 732-2383 | |
| 15 mL conical tubes | Greiner bio-one | 188271 | |
| 24-well cell culture plates | Greiner bio-one | 662160 | |
| 24-well HTS Fluoroblok Transwell plate (light-tight) | Corning | 351156 | |
| 24-well HTS Transwell plates (Table 1) | Corning | 3378 | |
| 24-well plate with Transwell inserts | Corning | 3470 | |
| 40 µm cell strainer | PluriSelect | 43-50040-01 | |
| 50 mL conical tubes | Greiner bio-one | 227261 | |
| 6-well cell culture plates | Greiner bio-one | 657160 | |
| 96-well black plate transparent bottom | Greiner bio-one | 655090 | |
| 96-well fast thermal cycling plates | Life Technologies Europe BV | 4346907 | |
| 96-well HTS Fluoroblok Transwell plate | Corning | 351162 | |
| 96-well HTS Transwell plates (Table 1) | Corning | 7369 | |
| 96-well transparent culture plate | Greiner bio-one | 655180 | |
| A83-01 | Bio-Techne Ltd | 2939 | |
| Accutase Cell Dissociation Reagent | Life Technologies Europe BV | A11105-01 | Cell dissociation reagent 2 |
| Advanced DMEM/F-12 | Life Technologies Europe BV | 12634028 | |
| B27 supplement | Life Technologies Europe BV | 17504001 | |
| Cell culture microscope (light / optical microscope) | Leica | ||
| CellTiter-Glo | Promega | G9683 | |
| Centrifuge | Eppendorf | ||
| CO2 incubator | PHCBI | ||
| DAPT | Sigma-Aldrich | D5942 | |
| DEPC treated H2O | Life Technologies Europe BV | 750024 | |
| Dulbecco's phosphate-buffered saline (DPBS) with Ca2+ and Mg2+ | Life Technologies Europe BV | 14040091 | |
| DPBS, powder, no calcium, no magnesium | Life Technologies Europe BV | 21600069 | |
| EnzChek Lysozyme Assay Kit | Life Technologies Europe BV | E22013 | |
| EVOM2 meter with STX electrode | WTI | ||
| Gastrin | Bio-Techne Ltd | 3006 | |
| Glass pipettes | Volac | ||
| GlutaMAX | Life Technologies Europe BV | 35050038 | |
| hEGF | Peprotech | AF-100-15 | |
| HEPES | Life Technologies Europe BV | 15630056 | |
| Human Noggin | Peprotech | 120-10C | |
| Human Rspo3 | Bio-Techne Ltd | 3500-RS/CF | |
| IWP-2 | Miltenyi Biotec | 130-105-335 | |
| Ki67 primary antibody | Sanbio | BSH-7302-100 | |
| Ki67 secondary antibody | Agilent | K400111-2 | |
| Kova International Glasstic Slide with Counting grids | Fisher Emergo | 10298483 | |
| Laminar flow hood | Thermo scientific | ||
| Lucifer Yellow CH dilithium salt | Sigma-Aldrich | L0259 | |
| Matrigel, Growth Factor Reduced (GFR) | Corning | 356231 | extracellular matrix (ECM) |
| MicroAmp Fast 8-Tube Strip, 0.1 mL | Life Technologies Europe BV | 4358293 | |
| MicroAmp Optical 8-Cap Strips | Life Technologies Europe BV | 4323032 | |
| Microcentrifuge tubes | Eppendorf | 0030 120 086 | |
| Micropipettes (1000, 200, and 20 µL) | Gilson | ||
| Microtome | Leica | ||
| MUC2 primary antibody | Santa Cruz Biotechnology | sc-15334 | |
| MUC2 secondary antibody | VWR | VWRKS/DPVR-HRP | |
| Multichannel pipette (200 µL) | Gilson | ||
| N-acetylcysteine | Sigma-Aldrich | A9165 | |
| NGS Wnt | U-Protein Express | N001-0.5mg | |
| Nicotinamide | Sigma-Aldrich | N0636 | |
| Oligonucleotide ALPI1/Forward | Custom-made | GGAGTTATCCTGCTCCCCAC | |
| Oligonucleotide ALPI1/Reverse | Custom-made | CTAGGAGGTGAAGGTCCAACG | |
| Oligonucleotide LGR5/Forward | Custom-made | ACACGTACCCACAGAAGCTC | |
| Oligonucleotide LGR5/Reverse | Custom-made | GGAATGCAGGCCACTGAAAC | |
| Oligonucleotide MUC2/Forward | Custom-made | AGGATCTGAAGAAGTGTGTCACTG | |
| Oligonucleotide MUC2/Reverse | Custom-made | TAATGGAACAGATGTTGAAGTGCT | |
| Oligonucleotide TBP/Forward | Custom-made | ACGCCGAATATAATCCCAAGCG | |
| Oligonucleotide TBP/Reverse | Custom-made | AAATCAGTGCCGTGGTTCGTG | |
| Optical adhesive covers | Life Technologies Europe BV | 4311971 | |
| PD0325901 | Stemcell Technologies | 72184 | |
| Penicillin/streptomycin | Life Technologies Europe BV | 15140122 | |
| Plate shaker | Panasonic | ||
| PowerUp SYBR Green Master Mix | Fisher Emergo | A25776 | |
| Primocin | InvivoGen | ANT-PM-2 | antimicrobial formulation for primary cells |
| Qubit RNA HS Assay Kit | Life Technologies Europe BV | Q32852 | |
| Reagent reservoir for multichannel pipet | Sigma-Aldrich | CLS4870 | |
| REMS AutoSampler with 24-probe or 96C-probe | WTI | ||
| Richard-Allan Scientific Alcian Blue/PAS Special Stain Kit | Thermo scientific | 87023 | |
| RNase-Free DNase Set | Qiagen | 79254 | |
| RNeasy Mini Kit | Qiagen | 74106 | |
| SB202190 | Sigma-Aldrich | S7076 | |
| Serological pipettes | Greiner bio-one | 606180 / 607180 / 760180 | |
| Serological pipettor (Pipet-Aid) | Drummond | ||
| Single edge razor blade | GEM Scientific | ||
| Superscript 1st strand system for RT-PCR | Life Technologies Europe BV | 11904018 | |
| Tecan Spark 10M plate reader | Tecan | ||
| Trypan Blue Solution, 0.4% | Life Technologies Europe BV | 15250-061 | |
| TrypLE Express Enzyme (1x) | Life Technologies Europe BV | 12605-010 | Cell dissociation reagent 1 |
| Water bath | Grant | ||
| Y27632 (ROCK inhibitor) | AbMole | M1817 |
참고문헌
- Haegebarth, A., Clevers, H. Wnt signaling, lgr5, and stem cells in the intestine and skin. The American Journal of Pathology. 174 (3), 715-721 (2009).
- Schoultz, I., Keita, &. #. 1. 9. 7. ;. V. The intestinal barrier and current techniques for the assessment of gut permeability. Cells. 9 (8), 1909 (2020).
- Martínez-Maqueda, D., Miralles, B., Recio, I., Verhoeckx, K. HT29 Cell Line. The Impact of Food Bio-Actives on Gut Health: In Vitro and Ex Vivo Models. , 113-124 (2015).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Huch, M., et al. In vitro expansion of single Lgr5(+) liver stem cells induced by Wnt-driven regeneration. Nature. 11 (2), 179-194 (2013).
- Sachs, N., et al. Long-term expanding human airway organoids for disease modeling. The EMBO Journal. 38 (4), 1-20 (2019).
- Karthaus, W. R., et al. Identification of multipotent luminal progenitor cells in human prostate organoid cultures. Cell. 159 (1), 163-175 (2014).
- Boj, S. F., et al. Organoid models of human and mouse ductal pancreatic cancer. Cell. 160 (1-2), 324-338 (2015).
- Sachs, N., et al. A living biobank of breast cancer organoids captures disease heterogeneity. Cell. 172 (1-2), 373-386 (2018).
- Vlachogiannis, G., et al. Patient-derived organoids model treatment response of metastatic gastrointestinal cancers. Science. 359 (6378), 920-926 (2018).
- Van De Wetering, M., et al. Prospective derivation of a living organoid biobank of colorectal cancer patients. Cell. 161 (4), 933-945 (2015).
- Driehuis, E., et al. Pancreatic cancer organoids recapitulate disease and allow personalized drug screening. Proceedings of the National Academy of Sciences of the United States of America. 116 (52), 26580-26590 (2019).
- Tiriac, H., et al. Organoid profiling identifies common responders to chemotherapy in pancreatic cancer. Cancer Discovery. 8 (9), 1112-1129 (2018).
- d'Aldebert, E., et al. Characterization of human colon organoids from inflammatory bowel disease patients. Frontiers in Cell and Developmental Biology. 8, 363 (2020).
- Dotti, I., et al. Alterations in the epithelial stem cell compartment could contribute to permanent changes in the mucosa of patients with ulcerative colitis. Gut. 66 (12), 2069-2079 (2017).
- VanDussen, K. L., et al. Development of an enhanced human gastrointestinal epithelial culture system to facilitate patient-based assays. Gut. 64 (6), 911-920 (2015).
- Noel, G., et al. A primary human macrophage-enteroid co-culture model to investigate mucosal gut physiology and host-pathogen interactions. Scientific Reports. 7, 45270 (2017).
- Bartfeld, S., et al. In vitro expansion of human gastric epithelial stem cells and their responses to bacterial infection. Gastroenterology. 148 (1), 126-136 (2015).
- van Es, J. H., et al. Wnt signalling induces maturation of Paneth cells in intestinal crypts. Nature Cell Biology. 7 (4), 381-386 (2005).
- van Es, J. H., et al. Dll1 marks early secretory progenitors in gut crypts that can revert to stem cells upon tissue damage. Nature Cell Biology. 14 (10), 1099-1104 (2012).
- de Lau, W. B. M., Snel, B., Clevers, H. C. The R-spondin protein family. Genome Biology. 13 (3), 1-10 (2012).
- Basak, O., Beumer, J., Wiebrands, K., Seno, H., van Oudenaarden, A., Clevers, H. Induced quiescence of Lgr5+ stem cells in intestinal organoids enables differentiation of hormone-producing enteroendocrine cells. Cell Stem Cell. 20 (2), 177-190 (2017).
- Beumer, J., et al. Enteroendocrine cells switch hormone expression along the crypt-to-villus BMP signalling gradient. Nature Cell Biology. 20 (8), 909-916 (2018).
- Yin, X., Farin, H. F., van Es, J. H., Clevers, H., Langer, R., Karp, J. M. Niche-independent high-purity cultures of Lgr5+ intestinal stem cells and their progeny. Nature Methods. 11 (1), 106-112 (2014).
- Boj, S. F., et al. Forskolin-induced swelling in intestinal organoids: An in vitro assay for assessing drug response in cystic fibrosis patients. Journal of Visualized Experiments. (120), (2017).
- Miao, Y., et al. Next-generation surrogate Wnts support organoid growth and deconvolute Frizzled pleiotropy in vivo. Cell Stem Cell. 27 (5), 840-851 (2020).
- Srinivasan, B., et al. TEER measurement techniques for in vitro barrier model systems. Journal of Laboratory Automation. 20 (2), 107-126 (2015).
- Blume, L. -. F., Denker, M., Gieseler, F., Kunze, T. Temperature corrected transepithelial electrical resistance (TEER) measurement to quantify rapid changes in paracellular permeability. Die Pharmazie. 65 (1), 19-24 (2010).
- Lea, T., Verhoeckx, K., et al. Caco-2 cell line. The Impact of Food Bio-Actives on Gut Health: In Vitro and Ex Vivo Models. , 103-111 (2015).
- Heo, I., et al. Modelling Cryptosporidium infection in human small intestinal and lung organoids. Nature Microbiology. 3 (7), 814-823 (2018).
- Watanabe, K., et al. A ROCK inhibitor permits survival of dissociated human embryonic stem cells. Nature Biotechnology. 25 (6), 681-686 (2007).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유