È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Monostrato epiteliale derivato da organoidi: un modello in vitro clinicamente rilevante per la funzione di barriera intestinale
In questo articolo
Riepilogo
Qui, descriviamo la preparazione di monostrati epiteliali intestinali derivati da organoidi umani per studiare la funzione, la permeabilità e il trasporto della barriera intestinale. Poiché gli organoidi rappresentano la risposta originale del tessuto epiteliale agli stimoli esterni, questi modelli combinano i vantaggi dell'espandibilità delle linee cellulari e la rilevanza e la complessità del tessuto primario.
Abstract
In passato, i sistemi modello epiteliali intestinali erano limitati alle linee cellulari trasformate e al tessuto primario. Questi sistemi modello hanno limitazioni intrinseche in quanto i primi non rappresentano fedelmente la fisiologia tissutale originale e la disponibilità del secondo è limitata. Quindi, la loro applicazione ostacola la ricerca fondamentale e lo sviluppo di farmaci. Gli organoidi a base di cellule staminali adulte (d'ora in poi denominati organoidi) sono miniature di tessuto epiteliale normale o malato da cui derivano. Possono essere stabiliti in modo molto efficiente da diverse regioni del tratto gastrointestinale (GI), avere espandibilità a lungo termine e simulare risposte tessuto-specifiche e del paziente ai trattamenti in vitro. Qui, è stata dimostrata la creazione di monostrati epiteliali derivati da organoidi intestinali insieme a metodi per misurare l'integrità della barriera epiteliale, la permeabilità e il trasporto, la secrezione proteica antimicrobica e l'istologia. Inoltre, i monostrati derivati dagli organoidi intestinali possono essere arricchiti con cellule staminali proliferanti e che amplificano il transito, nonché con cellule epiteliali differenziate chiave. Pertanto, rappresentano un sistema modello che può essere adattato per studiare gli effetti dei composti sulle cellule bersaglio e la loro modalità d'azione. Sebbene le colture organoidi siano tecnicamente più esigenti delle linee cellulari, una volta stabilite, possono ridurre i fallimenti nelle fasi successive dello sviluppo del farmaco in quanto rappresentano veramente la complessità dell'epitelio in vivo e l'eterogeneità interpaziente.
Introduzione
L'epitelio intestinale agisce come una barriera fisica tra il contenuto luminale dell'intestino e il tessuto sottostante. Questa barriera comprende un singolo strato epiteliale di enterociti principalmente assorbenti che sono collegati da giunzioni strette, che stabiliscono forti connessioni intercellulari tra cellule adiacenti. Queste cellule formano un rivestimento epiteliale polarizzato che separa i lati apicale (lume) e basolaterale dell'intestino, regolando contemporaneamente il trasporto paracellulare di nutrienti e metaboliti digeriti. Oltre agli enterociti, anche altre importanti cellule epiteliali come calice, paneth e cellule enteroendocrine contribuiscono all'omeostasi intestinale producendo rispettivamente muco, peptidi antimicrobici e ormoni. L'epitelio intestinale viene costantemente reintegrato dividendo le cellule staminali del recettore 5-positivo (LGR5+) contenenti ripetizioni ricche di leucina nel fondo delle cripte intestinali producendo cellule che amplificano il transito (TA) che migrano verso l'alto e si differenziano in altri tipi di cellule1. L'interruzione dell'omeostasi epiteliale intestinale da parte di fattori genetici e ambientali, come l'esposizione ad allergeni alimentari, composti medicinali e agenti patogeni microbici, porta all'interruzione della funzione di barriera intestinale. Queste condizioni causano diverse malattie intestinali tra cui la malattia infiammatoria intestinale (IBD), la celiachia e la tossicità GI indotta da farmaci2.
Gli studi sull'epitelio intestinale vengono eseguiti utilizzando diversi sistemi di piattaforma in vitro come inserti a membrana, sistemi organ-on-a-chip, camere di Ussing e anelli intestinali. Queste piattaforme sono adatte per stabilire monostrati epiteliali polarizzati con accesso sia ai lati apicali che basolaterali della membrana, utilizzando linee cellulari trasformate o tessuto primario come modelli. Sebbene le linee cellulari trasformate, come le linee cellulari del carcinoma del colon-retto (adeno)Carcinoma Caco-2, T84 e HT-29, siano in grado di differenziarsi in enterociti intestinali polarizzati o cellule produttrici di muco in una certa misura, non sono rappresentative dell'epitelio in vivo poiché mancano diversi tipi di cellule e vari recettori e trasportatori sono espressi in modo aberrante3 . Inoltre, poiché le linee cellulari sono derivate da un singolo donatore, non rappresentano l'eterogeneità interpaziente e soffrono di ridotta complessità e rilevanza fisiologica. Sebbene i tessuti primari utilizzati nelle camere di Ussing e come anelli intestinali siano più rappresentativi della situazione in vivo, la loro limitata disponibilità, vitalità a breve termine e mancanza di espandibilità li rendono inadatti come mezzo per studi ad alto rendimento (HT).
Gli organoidi sono colture epiteliali in vitro stabilite da diversi organi come intestino, rene, fegato, pancreas e polmone. Hanno dimostrato di avere espandibilità stabile a lungo termine e stabilità genetica e fenotipica e quindi sono miniature biologiche rappresentative dell'epitelio dell'organo originale con risposte fedeli agli stimoli esterni 4,5,6,7,8,9. Gli organoidi sono stabiliti in modo efficiente da tessuto resecato o biopsiato normale, malato, infiammato o canceroso, rappresentando risposte eterogenee specifiche del paziente 10,11,12,13,14,15,16. Questo articolo dimostra come stabilire monostrati epiteliali intestinali derivati da colture organoidiche. I monostrati sono stati stabiliti con successo da colture organoidi dell'intestino tenue e del colon e del retto. Questo modello crea l'opportunità di studiare il trasporto e la permeabilità delle cellule epiteliali ai farmaci, nonché i loro effetti tossicologici sull'epitelio. Inoltre, il modello consente la co-coltura con cellule immunitarie e batteri per studiare le loro interazioni con l'epitelio intestinale 17,18,19. Inoltre, questo modello può essere utilizzato per studiare le risposte alle terapie in modo specifico per il paziente e avviare gli sforzi di screening per cercare la prossima ondata di terapie focalizzate sulla barriera epiteliale. Un tale approccio potrebbe essere esteso alla clinica e aprire la strada a trattamenti personalizzati.
Sebbene i monostrati epiteliali in questo protocollo siano preparati da organoidi intestinali normali umani, il protocollo può essere applicato e ottimizzato per altri modelli organoidi. I monostrati organoidi epiteliali vengono coltivati in un mezzo di espansione organoide intestinale contenente Wnt per supportare la proliferazione delle cellule staminali e rappresentare la composizione cellulare della cripta intestinale. Gli organoidi intestinali possono essere arricchiti per avere diversi destini epiteliali intestinali, come enterociti, Paneth, calice e cellule enteroendocrine, modulando le vie Wnt, Notch e fattore di crescita epidermico (EGF). Qui, dopo la costituzione di monostrati nel mezzo di espansione, sono spinti verso cellule epiteliali intestinali più differenziate, come descritto in precedenza 20,21,22,23,24,25. Ai fini dello screening, a seconda della modalità d'azione del composto di interesse, delle sue cellule bersaglio e delle condizioni sperimentali, i monostrati possono essere guidati verso la composizione cellulare scelta per misurare gli effetti del composto con letture funzionali pertinenti.
Protocollo
1. Preparazione dei reagenti per la coltura
NOTA: eseguire tutti i passaggi all'interno di un armadio di biosicurezza e seguire le linee guida standard per lavorare con colture cellulari. La luce ultravioletta viene utilizzata per 10 minuti prima di avviare l'armadio di biosicurezza. Prima e dopo l'uso, la superficie dell'armadio di biosicurezza viene pulita con una carta velina inzuppata al 70% di etanolo. Per facilitare la formazione di gocce tridimensionali di matrice extracellulare (ECM), mantenere uno stock prebellico di piastre a 96, 24 e 6 pozzetti pronte nell'incubatore a 37 °C.
- Preparazione del mezzo basale
- Preparare il mezzo basale (BM) in un bottiglia media Advanced Dulbecco's Modified Eagle Medium da 500 mL con ham's Nutrient Mixture F-12 (Ad-DF) medio aggiungendo 5 mL di glutammina da 200 mM, 5 mL di acido 1 M 4-(2-idrossiethil)-1piperazineetanosolfonico (HEPES) e 5 mL di penicillina/streptomicina (penna/streptococco) (10.000 U/mL o 10.000 μg/mL). Questo può essere conservato in frigorifero a 4 °C per almeno 4 settimane.
- Fonti Wnt
- Preparare il mezzo condizionato Wnt3a (Wnt3aCM) secondo il metodo26 precedentemente descritto.
NOTA: Recentemente, un surrogato di nuova generazione Wnt (NGS-Wnt), che supporta anche l'espansione degli organoidi intestinali umani, è stato generato27.
- Preparare il mezzo condizionato Wnt3a (Wnt3aCM) secondo il metodo26 precedentemente descritto.
- Preparazione media organoide intestinale
NOTA: utilizzare tutti i fattori di crescita e i reagenti in base alle raccomandazioni del produttore. Utilizzare piccole aliquote ed evitare cicli di congelamento-disgelo; i fattori di crescita funzionali sono essenziali per una coltura organoide di successo.- Preparare 2x mezzo base organoide intestinale concentrato (2x IBM) integrando BM con 1 μM A83-01, 2,5 mM N-acetilcisteina, 2x integratore B27, 100 ng/mL fattore di crescita epidermico umano (hEGF), 10 nM gastrina, 200 ng/mL hNoggin e 100 μg/mL di una formulazione antimicrobica per cellule primarie (vedere la Tabella dei materiali).
- Aliquotare il 2x IBM e congelare a -20 °C per un massimo di 4 mesi. Se necessario, scongelare un'aliquota durante la notte a 4 °C o per diverse ore a temperatura ambiente (RT).
- Per preparare il mezzo di espansione organoide intestinale (IEM), integrare 2x IBM con il 50% di Wnt3aCM o il 50% di BM e 0,5 nM di NGS-Wnt, 250 ng/mL di Rspondin-3 umano (hRspo3), 10 mM di nicotinamide e 10 μM di SB202190.
- Preparazione del mezzo di differenziazione organoide intestinale
- Preparare il mezzo di differenziazione degli enterociti (eDM) integrando 2x IBM con il 50% di BM, 250 ng/mL hRspo3 e 1,5 μM di inibitore della via Wnt (IWP-2). Conservare l'eDM a 4 °C per un massimo di 10 giorni.
- Preparare il mezzo di differenziazione combinato (cDM) integrando 2x IBM con 40% BM e 10% Wnt3aCM o 50% BM e 0,1 nM NGS-Wnt, 250 ng/mL hRspo3, 10 μM DAPT e 100 nM PD0325901. Conservare il cDM a 4 °C per un massimo di 10 giorni.
- Manipolazione della matrice extracellulare (ECM)
NOTA: Preparare la matrice extracellulare (ECM) (vedere la tabella dei materiali) secondo la raccomandazione del produttore.- Scongelare ECM durante la notte sul ghiaccio; trasferire l'ECM dalla bottiglia a un tubo conico da 15 mL utilizzando una pipetta da 5 mL, entrambi pre-raffreddati a -20 °C. Ricongelare le aliquote una sola volta a -20 °C. Una volta scongelato, conservare l'ECM in frigorifero a 4 °C per un massimo di 7 giorni. Incubare per almeno 30 minuti sul ghiaccio prima dell'uso.
NOTA: Mescolare correttamente e assicurarsi che sia freddo prima di incorporare cripte o organoidi.
- Scongelare ECM durante la notte sul ghiaccio; trasferire l'ECM dalla bottiglia a un tubo conico da 15 mL utilizzando una pipetta da 5 mL, entrambi pre-raffreddati a -20 °C. Ricongelare le aliquote una sola volta a -20 °C. Una volta scongelato, conservare l'ECM in frigorifero a 4 °C per un massimo di 7 giorni. Incubare per almeno 30 minuti sul ghiaccio prima dell'uso.
2. Colture organoidi
- Stabilire colture da organoidi congelati
NOTA: Lasciare che BM raggiunga RT e tenere pronta un'aliquota di 12 ml, riscaldata a 37 °C, prima di iniziare la procedura di scongelamento di un organoide crioviale contenente congelati.- Scongelare rapidamente l'organoide crioviale agitandolo a bagnomaria a 37 °C fino a quando rimane solo un frammento di ghiaccio. Aggiungere immediatamente 500 μL di BM caldo a goccia al crioviale e pipettare su e giù un paio di volte per diluire il mezzo di congelamento e mescolare accuratamente il contenuto.
- Utilizzando una pipetta P1000, trasferire gli organoidi in un tubo conico da 15 ml e aggiungere un altro 1 mL di BM caldo a goccia mescolando delicatamente il fondo del tubo. Pipettare su e giù un paio di volte per diluire il mezzo di congelamento e mescolare attentamente il contenuto.
- Aggiungere fino a 12 mL di BM caldo a goccia al tubo conico da 15 mL contenente gli organoidi e pipettare su e giù con una pipetta sterile da 10 mL per risospescere delicatamente gli organoidi.
- Centrifugare la sospensione organoide per 5 min a 85 × g e 8 °C. Scartare accuratamente il surnatante senza disturbare il pellet e risospesciare gli organoidi nel 30% v/v di IEM integrato con 10 μM Y27632 o altre proteine serine/treonine chinasi associate a spirale associata a rho (inibitore ROCK). Posizionare il tubo sul ghiaccio.
- Aggiungere il 70% v/v di ECM nel tubo conico da 15 ml contenente gli organoidi. Mescolare la sospensione organoide mantenendo il tubo conico da 15 mL su ghiaccio e seminare 5 μL della sospensione per verificare la densità (Figura 1A). Continuare la placcatura se la densità è appropriata; se la densità è troppo alta, aggiungere più soluzione IEM/ECM nello stesso rapporto del 30-70% v/v, rispettivamente.
- In ogni pozzetto di una piastra preriscaldata a 24 pozzetti, seminare 50 μL della sospensione organoide mediante pipettaggio di 5 gocce separate da 10 μL (Figura 1B). Capovolgere la piastra e lasciarla nell'armadio di biosicurezza per 5 minuti. Trasferire la piastra ancora capovolta nell'incubatrice a 37 °C e lasciarla per altri 30 minuti.
- Aggiungere 500 μL di IEM con inibitore ROCK da 10 μM a ciascun pozzetto e trasferire la piastra all'incubatore. Immagina una goccia regolarmente per monitorare la crescita e aggiorna IEM ogni 2-3 giorni aspirando il vecchio mezzo e aggiungendo 500 μL di IEM fresco.
- Passare gli organoidi una volta che si sono ripresi correttamente dallo scongelamento e hanno raggiunto la giusta dimensione per essere lavorati (Figura 1C), come descritto al paragrafo 2.2.
- Passaggio di organoidi intestinali
NOTA: Raffreddare l'ECM sul ghiaccio per almeno 30 minuti e mantenere l'IEM a RT per almeno 1 ora prima dell'uso.- Utilizzare il mezzo di una coltura per rompere le cupole organoidi utilizzando una punta filtrante a bassa ritenzione da 1250 μL e trasferire il contenuto del pozzo in un tubo conico da 15 mL etichettato. Lavare il pozzetto con 1 mL di BM e trasferirlo nello stesso tubo conico da 15 ml.
- Ripetere i passaggi 2.2.1 e 2.2.2 con tutti gli altri pozzetti (un massimo di mezza piastra o 600 μL di gocce ECM possono essere lavati e aggiunti a un tubo conico da 15 mL).
- Aggiungere BM per riempire il tubo fino a 12 ml e pipettare su e giù 10 volte usando una pipetta da 10 ml. Centrifugare a 85 × g per 5 min a 8 °C.
- Prima di rimuovere il BM, controllare al microscopio se tutti gli organoidi sono pellettati sul fondo del tubo conico da 15 ml (Figura 1D). Se non c'è ECM sovrapposto il pellet organoide o lo strato ECM è pulito o contiene solo detriti, singole celle o pochissimi organoidi rispetto agli organoidi pellettati, aspirare il surnatante e pipettare l'ECM sovrapponendo il pellet organoide con molta attenzione usando una pipetta P200.
NOTA: gli organoidi possono rimanere intrappolati nell'ECM e non sedimentare come un pellet compatto a causa della bassa forza di centrifugazione. Se l'ECM contiene organoidi, centrifugare nuovamente il tubo a 450 × g per 5 minuti a 8 °C e rimuovere con cautela il surnatante come descritto al punto 2.2.4. Se sono presenti più tubi conici da 15 ml, questi possono essere raggruppati dopo il passaggio 2.2.4. - Aggiungere 1 mL di BM a ciascun pellet (di volume di 50-200 μL, a seconda della coltura organoide e della densità) e risospensionare con attenzione. Pipettare gli organoidi su e giù almeno 5 volte per tagliarli, evitando la formazione di schiuma. Controllare al microscopio se gli organoidi sono interrotti (Figura 2A). Se gli organoidi sono interrotti, procedere al passaggio 2.2.7; se gli organoidi non vengono interrotti, pipettarli un altro 5x. Questa volta, tocca la parete del tubo di plastica con la punta della pipetta per esercitare più forza meccanica per interrompere gli organoidi.
NOTA: La cesoiatura meccanica di organoidi cistici (Figura 1C) e in erba (Figura 1E) è possibile con una punta di pipetta in plastica da 200 μL o 10 μL montata su una punta filtrante da 1250 μL a bassa ritenzione (Figura 1F), a seconda del volume richiesto per interrompere gli organoidi. L'uso di una pipetta di vetro ristretta (Figura 1F) è raccomandato quando vengono lavorati più di 200 μL di ECM contenenti gli organoidi (un pozzetto di una piastra a 6 pozzetti o 4 pozzetti di una piastra a 24 pozzetti). - Controllare di nuovo al microscopio per vedere se gli organoidi sono interrotti. Se interrotto, procedere con il passaggio successivo; in caso contrario, pipettare gli organoidi fino a 20x, controllando regolarmente gli organoidi al microscopio. Se gli organoidi non sono ancora interrotti, aggiungere il reagente di dissociazione cellulare 1 al 25% v/v (vedere la tabella dei materiali) alla sospensione, incubare a bagnomaria a 37 °C per 2 minuti e pipettare gli organoidi fino a 20 volte, controllando regolarmente gli organoidi al microscopio per assicurarsi che non vengano digeriti in singole cellule.
- Aggiungere fino a 12 ml di BM al tubo conico da 15 ml e lavare il pellet organoide tubando su e giù. Centrifugare a 85 × g per 5 min a 8 °C. Scartare il surnatante e regolare la concentrazione finale al 70% v/v ECM aggiungendo IEM ed ECM al pellet organoide.
- Iniziare a risospendere il pellet organoide con il doppio del volume di IEM/ECM raccolto per il passaggio e seminare 5 μL della sospensione per verificarne la densità. Continuare la placcatura se la densità è appropriata (Figura 2B); aggiungere più soluzione IEM/ECM se la densità è troppo alta. Aggiungere 200 μL della sospensione a ciascun pozzetto di una piastra a 6 pozzetti preribalzata, ottenendo gocce separate di 10 μL di volume.
- Capovolgere la piastra e lasciarla nell'armadio di biosicurezza per 5 minuti. Trasferire la piastra ancora capovolta nell'incubatrice a 37 °C, lasciandola per altri 30 minuti. Aggiungere 2 mL di IEM con inibitore ROCK da 10 μM a ciascun pozzetto e trasferire la piastra all'incubatore.
- Immagina una goccia regolarmente per monitorare la crescita e aggiorna IEM ogni 2-3 giorni aspirando il vecchio mezzo e aggiungendo 2 ml di IEM fresco.
- Passaggio di organoidi intestinali per la preparazione di monostrati epiteliali
- Organoidi di passaggio 3 giorni prima della raccolta per la preparazione monostrato seguendo lo stesso protocollo di passaggio descritto al paragrafo 2.2 con una sola eccezione. Nella fase 2.2.7, risospese gli organoidi in 1-1,5 volte il volume iniziale di IEM/ECM per avere una densità e un potenziale di espansione più elevati quando vengono raccolti per la preparazione monostrato (Figura 3A).
3. Preparazione monostrato epiteliale
- Monostrati epiteliali di coltura su inserti a membrana a 24 pozzetti e a 96 pozzetti con una varietà di tipi di piastre disponibili (Tabella 1). Utilizzare inserti a membrana HTS (High-Throughput System) per entrambe le dimensioni in quanto contengono un vassoio integrato con gli inserti a membrana e una piastra ricevente. Per il formato a 24 pozzetti, è anche possibile l'uso di piastre con inserti a membrana rimovibili separati.
NOTA: Sono disponibili diversi tipi di membrane (polietilene tereftalato (PET) o policarbonato) e dimensioni dei pori (0,4-8,0 μm) che possono essere utilizzati a seconda delle esigenze sperimentali. I monostrati possono essere ripresi da brightfield solo quando vengono utilizzati inserti con membrane in PET. Le membrane a tenuta di luce bloccano la perdita di luce fluorescente dal compartimento apicale a quello basolaterale e possono essere prese in considerazione quando si studia il trasporto dinamico o la permeabilità di substrati marcati fluorescentmente. L'attuale protocollo utilizza inserti a membrana a 24 pozzetti; gli adattamenti per gli inserti a membrana a 96 pozzetti sono descritti nella sezione 5. A seconda della densità, della morfologia e delle dimensioni degli organoidi (Figura 3A), 6 pozzetti di una piastra a 6 pozzetti (come seminato nella sezione 2.3) sono sufficienti per seminare una piastra completa a 24 pozzetti di inserti di membrana. - Inserti a membrana di rivestimento con ECM
NOTA: Se ci sono dubbi sull'avere abbastanza celle, rivestire gli inserti dopo aver contato le celle. Questo per evitare rivestimenti non necessari e perdita dei costosi inserti a membrana.- Posizionare gli inserti a membrana nella piastra di supporto nell'armadio di biosicurezza. Diluire l'ECM 40x nella soluzione salina tamponata con fosfato (DPBS) di Dulbecco ghiacciata con Ca2+ e Mg2+ e pipettare 150 μL dell'ECM diluito nel compartimento apicale di ciascun inserto. Incubare la piastra a 37 °C per almeno 1 ora.
- Preparazione delle cellule per la semina
- Aliquote prebelliche del reagente di dissociazione cellulare 2 a bagnomaria (37 °C). Preparare 2 ml del reagente per ogni pozzetto di una piastra a 6 pozzetti.
- Trasferire la piastra di coltura contenente gli organoidi (preparata al punto 2.3) dall'incubatore all'armadio di biosicurezza. Trattare gli organoidi, come descritto nei passaggi 2.2.1.-2.2.4. Non raggruppare più tubi in un unico tubo.
- Riempire il tubo, contenente organoidi da un massimo di 3 pozzetti di una piastra a 6 pozzetti, fino a 12 mL con DPBS (senza Ca2+ e Mg2+), e pipettare su e giù 10x usando una pipetta da 10 mL. Centrifugare a 85 × g per 5 min a 8 °C e aspirare il surnatante senza disturbare il pellet organoide.
- Aggiungere 2 mL del reagente di dissociazione cellulare preribalizzata 2 per pozzetto di una piastra a 6 pozzetti utilizzata come materiale di partenza e risospese. Incubare i tubi in diagonale o orizzontalmente per 5 minuti a bagnomaria a 37 °C, per evitare l'affondamento degli organoidi sul fondo del tubo.
- Pipettare su e giù 10 volte utilizzando una pipetta di plastica sterile da 5 ml o una pipetta P1000, a seconda del volume totale del reagente di dissociazione cellulare. Controllare la sospensione organoide al microscopio per vedere se si è formata una miscela di singole cellule e alcuni grumi cellulari costituiti da 2-4 cellule (Figura 3B). Se necessario, continuare la digestione ripetendo i passaggi 3.3.4-3.3.5 (non aumentare il volume del reagente di dissociazione cellulare) fino a quando la miscela appare simile alla Figura 3B.
NOTA: Evitare di digerire completamente gli organoidi in singole cellule. È necessario avere alcuni piccoli gruppi di cellule (cioè gruppi di 2-4 cellule). - Arrestare la dissociazione cellulare aggiungendo fino a 12 mL di BM, incluso l'inibitore ROCK da 10 μM , alla sospensione cellulare. Centrifugare a 450 × g per 5 min a 8 °C e aspirare il surnatante senza disturbare il pellet cellulare. Quando si maneggia la stessa coltura organoide in diversi tubi conici da 15 ml, raggruppare i pellet cellulari e risospescerli in 12 mL di BM.
- Filtrare la sospensione cellulare attraverso un filtro da 40 μm prewetted con BM e raccogliere il flusso attraverso un tubo conico da 50 ml. Lavare il filtro con 10 ml di BM e raccogliere il flusso attraverso lo stesso tubo conico da 50 ml.
- Trasferire la sospensione cellulare tesa in due nuovi tubi conici da 15 mL. Centrifugare a 450 × g per 5 min a 8 °C, e aspirare il surnatante senza disturbare il pellet cellulare. Risospesare le cellule in 4 mL di IEM integrato con 10 μM di inibitore ROCK per piastra di coltura completa utilizzata come materiale di partenza.
- Mescolare una piccola quantità di sospensione cellulare in un rapporto 1: 1 con tripano blu per il conteggio. Contare le celle vive, non blu (Figura 3C) e calcolare il numero totale di cellule vive. In piccoli grumi, conta ogni singola cellula.
- Preparare una sospensione cellulare contenente 3 × 106 cellule vive per mL di IEM integrata con 10 μM di inibitore ROCK.
- Celle di semina su inserti a membrana di poliestere
- Aspirare accuratamente DPBS dagli inserti rivestiti in ECM (punto 3.2.1), mantenendo la piastra orizzontalmente. Pipetta 800 μL di IEM integrata con inibitore ROCK in ciascun compartimento basolaterale. Pipetta 150 μL della sospensione cellulare preparata al punto 3.3.10 sulla membrana rivestita in ECM nel compartimento apicale a goccia. Per piastra, assicurati di avere almeno un pozzo "vuoto" solo con BM.
- Una volta che le cellule si sono sedimentate sulla membrana, misurare la resistenza elettrica transepiteliale (TEER), come descritto al paragrafo 4.1, e visualizzare gli inserti della membrana usando un microscopio. Posizionare la piastra nell'incubatore a 37 °C e al 5% di CO2. Misurare TEER ogni giorno e acquisire regolarmente immagini per monitorare la formazione di monostrato (Figura 4A-D).
- Monostrati rinfrescanti
NOTA: Aggiornare il mezzo ogni 2-3 giorni, aderendo al seguente ordine per mantenere una pressione idrostatica positiva sopra le cellule e impedire che le cellule vengano spinte fuori dalla membrana. Mentre rinfreschi il mezzo, assicurati che il monostrato, che è visibile all'aspirazione del mezzo, non sia danneggiato dalla punta della pipetta.- Rimuovere il mezzo dai compartimenti basolaterali della piastra contenente gli inserti a membrana. Quindi, aspirare accuratamente il mezzo dai compartimenti apicali degli inserti a membrana.
- Aggiungere 150 μL di IEM fresco a goccia a ciascun compartimento apicale, quindi aggiungere 800 μL di IEM fresco a ciascun compartimento basolaterale.
- Arricchimento del monostrato per i tipi di cellule epiteliali intestinali desiderate
- Lasciare che il monostrato diventi confluente in IEM, corrispondente a un valore TEER di circa 100 Ω·cm² (come calcolato al punto 4.1.1.4). Controllare al microscopio per determinare se i monostrati si sono completamente formati (Figura 4D) e per l'assenza di fori (come si vede nella Figura 4B,C).
- Rimuovere con cautela l'IEM dai compartimenti basolaterali e apicali degli inserti a membrana e sostituirli con eDM o cDM come preparato al paragrafo 1.4. Coltivare il monostrato per altri 3-4 giorni nello specifico mezzo di differenziazione per ottenere le cellule organoidi arricchite con il tipo di cellula specifico desiderato. Aggiornare il mezzo ogni 2-3 giorni, come descritto al paragrafo 3.4.
- Misurare TEER quotidianamente e acquisire immagini regolarmente se lo si desidera (Figura 5A-C).
NOTA: Il valore TEER che indica un monostrato arricchito completamente organizzato varia a seconda della coltura organoide; tipicamente i valori teer aumentano a 600 e possono aumentare fino a 1000 Ω·cm2 (come calcolato nel punto 4.1.1.4) dopo 3 giorni nei mezzi di differenziazione e sono stabili per 3-5 giorni.
4. Letture del saggio monostrato epiteliale
- Misurazione della resistenza elettrica transepiteliale (TEER)
NOTA: Le misurazioni TEER sono ampiamente accettate come metodo per analizzare la dinamica delle giunzioni strette e l'integrità della funzione di barriera in modelli biologici di barriere fisiologiche, come i monostrati epiteliali28,29. L'aumento del TEER dopo la differenziazione a causa della maggiore interazione cellulare a giunzioni strette può essere misurato utilizzando un misuratore TEER manuale o un robot di misurazione TEER automatizzato.- Misurazione di TEER utilizzando un misuratore TEER manuale
- Pulire l'elettrodo con etanolo al 70% e lasciarlo asciugare all'aria all'interno dell'armadio di biosicurezza. Posizionare l'elettrodo in un tubo contenente BM. Collegare l'elettrodo al misuratore TEER manuale. Ruotare l'interruttore Funzione per misurare in Ohm (Ω). Accendere l'interruttore di accensione .
- Posizionare l'elettrodo corto nel compartimento apicale dell'inserto, mentre l'elettrodo lungo è posizionato nel compartimento basolaterale (Figura 6A). Evitare di toccare il monostrato.
- Misurare la resistenza nel pozzetto vuoto (R vuoto) e quindi misurare i campioni rimanenti (campione R) allo stesso modo. Lavare l'elettrodo con BM tra campioni con condizioni diverse. Pulire l'elettrodo prima con acqua demi e poi con etanolo al 70% e lasciarlo asciugare all'aria.
- Calcolare TEER (Ω·cm2): [Campione R (Ω) - Rbianco (Ω)] ×'area della membrana (cm2) (Tabella 1 e Figura 6B).
- Misurazione di TEER utilizzando un robot di misura TEER automatizzato (Tabella dei materiali)
- Eseguire misurazioni TEER automatizzate quando si utilizzano sistemi HTS per piastre HTS a 96 pozzetti e 24 pozzetti contenenti inserti a membrana. Utilizzare elettrodi diversi per la misurazione TEER per entrambi i tipi (inserti a membrana 24 e 96 HTS). Per misurare TEER utilizzando un robot di misura TEER automatizzato, seguire le istruzioni del produttore.
- Misurazione di TEER utilizzando un misuratore TEER manuale
- Misurazione dell'integrità e della permeabilità della barriera epiteliale
NOTA: Questo protocollo introduce la permeabilità luciferina dal compartimento apicale a quello basolaterale come indicazione dell'integrità del monostrato. Questa sezione descrive la misurazione della fluorescenza nel compartimento basolaterale dopo una fase di incubazione di 1 ora per valutare la permeabilità del monostrato e, quindi, l'integrità della barriera. Questa misurazione è un test end-point ed è particolarmente utile quando si testano i composti per il loro effetto sull'integrità della barriera.- Scongela Lucifer Yellow sul ghiaccio e lascia che BM si equilibri a RT. Per una piastra a 24 pozzetti di inserti a membrana, preparare 5 ml di soluzione di lavoro di 60 μM Lucifer Yellow in BM.
NOTA: Lucifer Yellow è sensibile alla luce. Preparare le diluizioni in tubi sterili scuri da 1,5 ml ed eseguire tutte le fasi con la luce dell'armadio di biosicurezza spenta. - Rimuovere con attenzione il mezzo dai compartimenti basolaterale e apicale degli inserti a membrana, come descritto al punto 3.5.1. Se lo si desidera, graffiare un monostrato non trattato utilizzando una punta della pipetta come controllo positivo per la perdita di Lucifer Yellow attraverso una barriera danneggiata.
- Aggiungere 150 μL di BM con 60 μM Di Giallo Lucifero a ciascun compartimento apicale e aggiungere 800 μL di BM senza Giallo Lucifero a ciascun compartimento basolaterale. Posizionare la piastra su uno shaker a 37 °C, 50 giri/min per 60 min.
- Nel frattempo, preparare una curva standard di Lucifer Yellow in BM iniziando con la soluzione di lavoro preparata nel passaggio 4.2.1. Diluire 1:3 in ogni passaggio fino a raggiungere una concentrazione di 3 nM. Includere un controllo negativo (solo BM).
- Trasferire 100 μL di ogni standard in triplice copia su una piastra trasparente a 96 pozzetti. Dopo 60 minuti di incubazione, rimuovere gli inserti a membrana e trasferire 100 μL da ciascun pozzetto basolaterale (fase 4.2.3) in triplice copia alla piastra trasparente a 96 pozzetti. Misurare la fluorescenza della piastra utilizzando un lettore di piastre a una lunghezza d'onda di eccitazione di 430 nm e una lunghezza d'onda di emissione di 530 nm.
- Dopo aver corretto il valore di controllo negativo (solo BM), utilizzare i valori della curva standard per calcolare la concentrazione di Lucifer Yellow nel compartimento basolaterale (concentrazione del ricevitore finale (μM)).
- Calcolare il coefficiente di permeabilità apparente (P app) secondo la seguente formula (Figura 6C):

- Per una piastra a 24 pozzetti contenente inserti a membrana, utilizzare la seguente formula:
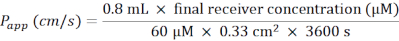
- Scongela Lucifer Yellow sul ghiaccio e lascia che BM si equilibri a RT. Per una piastra a 24 pozzetti di inserti a membrana, preparare 5 ml di soluzione di lavoro di 60 μM Lucifer Yellow in BM.
- Fissaggio di monostrati e preparazione di blocchi di paraffina per l'istologia
NOTA: I monostrati epiteliali possono essere utilizzati per la colorazione istologica per la valutazione della loro composizione cellulare, polarità ed espressione di diverse proteine di interesse come proteine giunzionali, proliferazione o marcatori di differenziazione. Questa sezione descrive la preparazione del blocco di paraffina per la colorazione istologica.- Rimuovere con cautela il mezzo dai compartimenti basolaterale e apicale degli inserti a membrana, come descritto nei passaggi 3.5.1.
- Lavare i monostrati aggiungendo 150 μL di DPBS (senza Ca2+ e Mg2+) a ciascun compartimento apicale e 800 μL a ciascun compartimento basolaterale. Aspirare accuratamente nuovamente il DPBS, prima dal compartimento basolaterale e poi dal compartimento apicale.
NOTA: il compartimento basolaterale rimarrà vuoto da questo passaggio in poi. - In una cappa aspirante, aggiungere 150 μL di paraformaldeide al 4% a ciascun compartimento apicale e incubare per 30 minuti a RT.
NOTA: Da questo passaggio in poi, eseguire tutte le azioni in questa sezione all'interno di una cappa aspirante, poiché la paraformaldeide è tossica. - Aspirare accuratamente il fissativo dai compartimenti apicali degli inserti a membrana e smaltirlo come rifiuto alogeno liquido.
NOTA: Da questo passaggio in poi, smaltire tutti i rifiuti liquidi come rifiuti alogeni liquidi. - Lavare i monostrati aggiungendo 200 μL di DPBS (senza Ca2+ e Mg2+) a ciascun compartimento apicale e aspirare nuovamente con cura il DPBS. Ripetere questo passaggio ancora una volta.
- Aggiungere 200 μL di alcol etilico al 25% (EtOH) a ciascun compartimento apicale e incubare per 15 minuti a RT. Dopo 15 minuti, aspirare accuratamente l'EtOH al 25% dai compartimenti apicali degli inserti a membrana. Ripetere con la soluzione di EtOH al 50% e successivamente con la soluzione di EtOH al 70%.
- Aggiungere 200 μL di EtOH al 70% a ciascun compartimento apicale e avvolgere la piastra con parafilm. Conservare a 4 °C fino a nuovo utilizzo.
- Aspirare accuratamente l'EtOH al 70% e utilizzare un bisturi per tagliare con cura le membrane monostrato dagli inserti. Tagliare dal lato basolaterale, attorno al bordo dell'inserto.
- Preparare i blocchi di paraffina seguendo la procedura standard.
- Quando la paraffina è ancora calda, prendere il monostrato dalla paraffina con una pinzetta e posizionarlo su una superficie preraffreddata.
- Fare attenzione a non danneggiare il monostrato. Tagliare il monostrato a metà usando una singola lama di bordo.
- Quando la paraffina nella parte inferiore della cassetta inizia a solidificarsi, utilizzare pinzette riscaldate per posizionare le due parti monostrato nella paraffina, una accanto all'altra con il lato dritto verso il basso e in direzione verticale per garantire che il monostrato sia verticale nella coupé.
- Quando i blocchi di paraffina sono pronti, tagliare i blocchi usando un microtomo e fare diapositive di sezioni spesse 4 μm seguendo la procedura standard. Assicurati che i monostrati finiscano verticalmente nella coupé.
- Eseguire macchie istologiche come descritto in precedenza 7,9. Utilizzare ematossilina ed eosina (H & E), Ki67, muucin-2 (MUC2) e Alcian Blue per mostrare la morfologia generale, le cellule proliferative, la produzione di muco e le cellule del calice, rispettivamente (Figura 6E).
NOTA: Possono essere utilizzati anche marcatori di differenziazione aggiuntivi, come il lisozima per le cellule di Paneth. Questo marcatore non è presentato nella Figura 6E in quanto le cellule di Paneth sono presenti nell'epitelio intestinale piccolo piuttosto che nell'epitelio del colon.
- Misurazione delle proteine secrete in surnatante medio
- Misurare i livelli di lisozima nel surnatante apicale dei monostrati ileali (vedi Figura 6D) utilizzando il kit elencato nella Tabella dei materiali. Se lo si desidera, misurare i livelli di diverse citochine e altre proteine di interesse.
- Analisi dell'espressione genica
- Quantificare gli effetti dei mezzi di differenziazione sull'espressione dei geni marcatori delle cellule epiteliali utilizzando la reazione a catena quantitativa trascrizione inversa-polimerasi (qRT-PCR).
- Lisare i monostrati in 350 μL di tampone di lisi dell'RNA seguito dall'isolamento dell'RNA secondo le istruzioni del produttore. Eseguire la sintesi del cDNA e i qPCR, come descritto in precedenza 7,9, utilizzando i kit di sintesi del cDNA, il master mix e gli oligonucleotidi elencati nella Tabella dei materiali.
- Quantificare gli effetti dei mezzi di differenziazione sull'espressione dei geni marcatori delle cellule epiteliali utilizzando la reazione a catena quantitativa trascrizione inversa-polimerasi (qRT-PCR).
5. Upscaling a piastre a 96 pozzetti contenenti inserti a membrana
NOTA: Preparare monostrati epiteliali per screening farmacologici a più alta produttività o condizioni medie multiple utilizzando piastre HTS a 96 pozzetti contenenti inserti a membrana.
- Adattamenti durante la preparazione di monostrati in formato a 96 pozzetti
- Seguire tutti i passaggi descritti in questo protocollo per le piastre a 24 pozzetti contenenti inserti a membrana, cambiando volumi e numeri di cella in quelli descritti nella Tabella 1. Per preparare monostrati su piastre a 96 pozzetti con inserti a membrana, procedere come descritto nella sezione 3 con le seguenti differenze.
- Sono necessari circa 9 pozzetti di una piastra di coltura a 6 pozzetti con densità organoide rappresentata nella Figura 3A per seminare una piastra completa a 96 pozzetti con inserti a membrana. Nella fase 3.2.1, preverminare le membrane con 67 μL di ECM diluito 40x in DPBS (con Ca2+ e Mg2+).
- Nella sezione 3.5, trasferire prima la piastra integrale degli inserti a membrana in un'altra piastra a 96 pozzetti per consentire un medio rinfresco dei compartimenti apicali e basolaterali.
- Seguire tutti i passaggi descritti in questo protocollo per le piastre a 24 pozzetti contenenti inserti a membrana, cambiando volumi e numeri di cella in quelli descritti nella Tabella 1. Per preparare monostrati su piastre a 96 pozzetti con inserti a membrana, procedere come descritto nella sezione 3 con le seguenti differenze.
Risultati
La Figura 1A mostra un'immagine rappresentativa in campo luminoso degli organoidi intestinali dopo averli scongelati da una crioviale. È importante scongelare gli organoidi ad alta densità per garantire un recupero ottimale. Gli organoidi sono placcati in piastre a 24 o 6 pozzetti in cupole ECM di circa 10 μL (Figura 1B). La maggior parte degli organoidi intestinali normali ha una morfologia cistica. Dopo il recupero dal processo di scongelamento, gli organoi...
Discussione
Questo protocollo descrive la manipolazione generale e il mantenimento degli organoidi intestinali, nonché la preparazione e le possibili applicazioni di monostrati epiteliali derivati da questi organoidi. Ad oggi, i monostrati sono stati preparati con successo dal duodeno, dall'ileo e da diverse regioni di organoidi del colon derivati dal tessuto intestinale normale e precedentemente e attivamente infiammato (dati non pubblicati). L'applicazione di monostrati organoidi derivati dal paziente facilita lo studio della fun...
Divulgazioni
Gli autori non dichiarano alcun conflitto di interessi.
Riconoscimenti
Questo lavoro è supportato dal Topsector Life Sciences & Health - Topconsortium voor Kennis en Innovatie Health~Holland (LSH-TKI) public-private partnerships (PPP) allowances del settore olandese LSH con numero di progetto LSHM16021 Organoids come nuovo strumento per la modellazione tossicologica alla Hubrecht Organoid Technology (HUB) e finanziamenti interni HUB al dipartimento di modellazione e tossicologia delle malattie. Ringraziamo i laboratori di Sabine Middendorp (Divisione di Gastroenterologia Pediatrica, Wilhelmina Children's Hospital, UMC, Utrecht) e Hugo R. de Jonge e Marcel J.C. Bijvelds (Dipartimento di Gastroenterologia ed Epatologia, Erasmus MC, Rotterdam) per aver fornito il supporto tecnico iniziale per la realizzazione di monostrati su inserti a membrana.
Materiali
| Name | Company | Catalog Number | Comments |
| 100% ethanol | Fisher Emergo | 10644795 | |
| 1250, 300, and 20 µL low-retention filter-tips | Greiner bio-one | 732-1432 / 732-1434 / 732-2383 | |
| 15 mL conical tubes | Greiner bio-one | 188271 | |
| 24-well cell culture plates | Greiner bio-one | 662160 | |
| 24-well HTS Fluoroblok Transwell plate (light-tight) | Corning | 351156 | |
| 24-well HTS Transwell plates (Table 1) | Corning | 3378 | |
| 24-well plate with Transwell inserts | Corning | 3470 | |
| 40 µm cell strainer | PluriSelect | 43-50040-01 | |
| 50 mL conical tubes | Greiner bio-one | 227261 | |
| 6-well cell culture plates | Greiner bio-one | 657160 | |
| 96-well black plate transparent bottom | Greiner bio-one | 655090 | |
| 96-well fast thermal cycling plates | Life Technologies Europe BV | 4346907 | |
| 96-well HTS Fluoroblok Transwell plate | Corning | 351162 | |
| 96-well HTS Transwell plates (Table 1) | Corning | 7369 | |
| 96-well transparent culture plate | Greiner bio-one | 655180 | |
| A83-01 | Bio-Techne Ltd | 2939 | |
| Accutase Cell Dissociation Reagent | Life Technologies Europe BV | A11105-01 | Cell dissociation reagent 2 |
| Advanced DMEM/F-12 | Life Technologies Europe BV | 12634028 | |
| B27 supplement | Life Technologies Europe BV | 17504001 | |
| Cell culture microscope (light / optical microscope) | Leica | ||
| CellTiter-Glo | Promega | G9683 | |
| Centrifuge | Eppendorf | ||
| CO2 incubator | PHCBI | ||
| DAPT | Sigma-Aldrich | D5942 | |
| DEPC treated H2O | Life Technologies Europe BV | 750024 | |
| Dulbecco's phosphate-buffered saline (DPBS) with Ca2+ and Mg2+ | Life Technologies Europe BV | 14040091 | |
| DPBS, powder, no calcium, no magnesium | Life Technologies Europe BV | 21600069 | |
| EnzChek Lysozyme Assay Kit | Life Technologies Europe BV | E22013 | |
| EVOM2 meter with STX electrode | WTI | ||
| Gastrin | Bio-Techne Ltd | 3006 | |
| Glass pipettes | Volac | ||
| GlutaMAX | Life Technologies Europe BV | 35050038 | |
| hEGF | Peprotech | AF-100-15 | |
| HEPES | Life Technologies Europe BV | 15630056 | |
| Human Noggin | Peprotech | 120-10C | |
| Human Rspo3 | Bio-Techne Ltd | 3500-RS/CF | |
| IWP-2 | Miltenyi Biotec | 130-105-335 | |
| Ki67 primary antibody | Sanbio | BSH-7302-100 | |
| Ki67 secondary antibody | Agilent | K400111-2 | |
| Kova International Glasstic Slide with Counting grids | Fisher Emergo | 10298483 | |
| Laminar flow hood | Thermo scientific | ||
| Lucifer Yellow CH dilithium salt | Sigma-Aldrich | L0259 | |
| Matrigel, Growth Factor Reduced (GFR) | Corning | 356231 | extracellular matrix (ECM) |
| MicroAmp Fast 8-Tube Strip, 0.1 mL | Life Technologies Europe BV | 4358293 | |
| MicroAmp Optical 8-Cap Strips | Life Technologies Europe BV | 4323032 | |
| Microcentrifuge tubes | Eppendorf | 0030 120 086 | |
| Micropipettes (1000, 200, and 20 µL) | Gilson | ||
| Microtome | Leica | ||
| MUC2 primary antibody | Santa Cruz Biotechnology | sc-15334 | |
| MUC2 secondary antibody | VWR | VWRKS/DPVR-HRP | |
| Multichannel pipette (200 µL) | Gilson | ||
| N-acetylcysteine | Sigma-Aldrich | A9165 | |
| NGS Wnt | U-Protein Express | N001-0.5mg | |
| Nicotinamide | Sigma-Aldrich | N0636 | |
| Oligonucleotide ALPI1/Forward | Custom-made | GGAGTTATCCTGCTCCCCAC | |
| Oligonucleotide ALPI1/Reverse | Custom-made | CTAGGAGGTGAAGGTCCAACG | |
| Oligonucleotide LGR5/Forward | Custom-made | ACACGTACCCACAGAAGCTC | |
| Oligonucleotide LGR5/Reverse | Custom-made | GGAATGCAGGCCACTGAAAC | |
| Oligonucleotide MUC2/Forward | Custom-made | AGGATCTGAAGAAGTGTGTCACTG | |
| Oligonucleotide MUC2/Reverse | Custom-made | TAATGGAACAGATGTTGAAGTGCT | |
| Oligonucleotide TBP/Forward | Custom-made | ACGCCGAATATAATCCCAAGCG | |
| Oligonucleotide TBP/Reverse | Custom-made | AAATCAGTGCCGTGGTTCGTG | |
| Optical adhesive covers | Life Technologies Europe BV | 4311971 | |
| PD0325901 | Stemcell Technologies | 72184 | |
| Penicillin/streptomycin | Life Technologies Europe BV | 15140122 | |
| Plate shaker | Panasonic | ||
| PowerUp SYBR Green Master Mix | Fisher Emergo | A25776 | |
| Primocin | InvivoGen | ANT-PM-2 | antimicrobial formulation for primary cells |
| Qubit RNA HS Assay Kit | Life Technologies Europe BV | Q32852 | |
| Reagent reservoir for multichannel pipet | Sigma-Aldrich | CLS4870 | |
| REMS AutoSampler with 24-probe or 96C-probe | WTI | ||
| Richard-Allan Scientific Alcian Blue/PAS Special Stain Kit | Thermo scientific | 87023 | |
| RNase-Free DNase Set | Qiagen | 79254 | |
| RNeasy Mini Kit | Qiagen | 74106 | |
| SB202190 | Sigma-Aldrich | S7076 | |
| Serological pipettes | Greiner bio-one | 606180 / 607180 / 760180 | |
| Serological pipettor (Pipet-Aid) | Drummond | ||
| Single edge razor blade | GEM Scientific | ||
| Superscript 1st strand system for RT-PCR | Life Technologies Europe BV | 11904018 | |
| Tecan Spark 10M plate reader | Tecan | ||
| Trypan Blue Solution, 0.4% | Life Technologies Europe BV | 15250-061 | |
| TrypLE Express Enzyme (1x) | Life Technologies Europe BV | 12605-010 | Cell dissociation reagent 1 |
| Water bath | Grant | ||
| Y27632 (ROCK inhibitor) | AbMole | M1817 |
Riferimenti
- Haegebarth, A., Clevers, H. Wnt signaling, lgr5, and stem cells in the intestine and skin. The American Journal of Pathology. 174 (3), 715-721 (2009).
- Schoultz, I., Keita, &. #. 1. 9. 7. ;. V. The intestinal barrier and current techniques for the assessment of gut permeability. Cells. 9 (8), 1909 (2020).
- Martínez-Maqueda, D., Miralles, B., Recio, I., Verhoeckx, K. HT29 Cell Line. The Impact of Food Bio-Actives on Gut Health: In Vitro and Ex Vivo Models. , 113-124 (2015).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Huch, M., et al. In vitro expansion of single Lgr5(+) liver stem cells induced by Wnt-driven regeneration. Nature. 11 (2), 179-194 (2013).
- Sachs, N., et al. Long-term expanding human airway organoids for disease modeling. The EMBO Journal. 38 (4), 1-20 (2019).
- Karthaus, W. R., et al. Identification of multipotent luminal progenitor cells in human prostate organoid cultures. Cell. 159 (1), 163-175 (2014).
- Boj, S. F., et al. Organoid models of human and mouse ductal pancreatic cancer. Cell. 160 (1-2), 324-338 (2015).
- Sachs, N., et al. A living biobank of breast cancer organoids captures disease heterogeneity. Cell. 172 (1-2), 373-386 (2018).
- Vlachogiannis, G., et al. Patient-derived organoids model treatment response of metastatic gastrointestinal cancers. Science. 359 (6378), 920-926 (2018).
- Van De Wetering, M., et al. Prospective derivation of a living organoid biobank of colorectal cancer patients. Cell. 161 (4), 933-945 (2015).
- Driehuis, E., et al. Pancreatic cancer organoids recapitulate disease and allow personalized drug screening. Proceedings of the National Academy of Sciences of the United States of America. 116 (52), 26580-26590 (2019).
- Tiriac, H., et al. Organoid profiling identifies common responders to chemotherapy in pancreatic cancer. Cancer Discovery. 8 (9), 1112-1129 (2018).
- d'Aldebert, E., et al. Characterization of human colon organoids from inflammatory bowel disease patients. Frontiers in Cell and Developmental Biology. 8, 363 (2020).
- Dotti, I., et al. Alterations in the epithelial stem cell compartment could contribute to permanent changes in the mucosa of patients with ulcerative colitis. Gut. 66 (12), 2069-2079 (2017).
- VanDussen, K. L., et al. Development of an enhanced human gastrointestinal epithelial culture system to facilitate patient-based assays. Gut. 64 (6), 911-920 (2015).
- Noel, G., et al. A primary human macrophage-enteroid co-culture model to investigate mucosal gut physiology and host-pathogen interactions. Scientific Reports. 7, 45270 (2017).
- Bartfeld, S., et al. In vitro expansion of human gastric epithelial stem cells and their responses to bacterial infection. Gastroenterology. 148 (1), 126-136 (2015).
- van Es, J. H., et al. Wnt signalling induces maturation of Paneth cells in intestinal crypts. Nature Cell Biology. 7 (4), 381-386 (2005).
- van Es, J. H., et al. Dll1 marks early secretory progenitors in gut crypts that can revert to stem cells upon tissue damage. Nature Cell Biology. 14 (10), 1099-1104 (2012).
- de Lau, W. B. M., Snel, B., Clevers, H. C. The R-spondin protein family. Genome Biology. 13 (3), 1-10 (2012).
- Basak, O., Beumer, J., Wiebrands, K., Seno, H., van Oudenaarden, A., Clevers, H. Induced quiescence of Lgr5+ stem cells in intestinal organoids enables differentiation of hormone-producing enteroendocrine cells. Cell Stem Cell. 20 (2), 177-190 (2017).
- Beumer, J., et al. Enteroendocrine cells switch hormone expression along the crypt-to-villus BMP signalling gradient. Nature Cell Biology. 20 (8), 909-916 (2018).
- Yin, X., Farin, H. F., van Es, J. H., Clevers, H., Langer, R., Karp, J. M. Niche-independent high-purity cultures of Lgr5+ intestinal stem cells and their progeny. Nature Methods. 11 (1), 106-112 (2014).
- Boj, S. F., et al. Forskolin-induced swelling in intestinal organoids: An in vitro assay for assessing drug response in cystic fibrosis patients. Journal of Visualized Experiments. (120), (2017).
- Miao, Y., et al. Next-generation surrogate Wnts support organoid growth and deconvolute Frizzled pleiotropy in vivo. Cell Stem Cell. 27 (5), 840-851 (2020).
- Srinivasan, B., et al. TEER measurement techniques for in vitro barrier model systems. Journal of Laboratory Automation. 20 (2), 107-126 (2015).
- Blume, L. -. F., Denker, M., Gieseler, F., Kunze, T. Temperature corrected transepithelial electrical resistance (TEER) measurement to quantify rapid changes in paracellular permeability. Die Pharmazie. 65 (1), 19-24 (2010).
- Lea, T., Verhoeckx, K., et al. Caco-2 cell line. The Impact of Food Bio-Actives on Gut Health: In Vitro and Ex Vivo Models. , 103-111 (2015).
- Heo, I., et al. Modelling Cryptosporidium infection in human small intestinal and lung organoids. Nature Microbiology. 3 (7), 814-823 (2018).
- Watanabe, K., et al. A ROCK inhibitor permits survival of dissociated human embryonic stem cells. Nature Biotechnology. 25 (6), 681-686 (2007).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon