Method Article
Un ensayo basado en fluorescencia del potencial de membrana para el estudio funcional de alto rendimiento de dos canales iónicos endógenos en dos líneas celulares epiteliales
En este artículo
Resumen
Este protocolo describe un método para el estudio de proteínas de membrana electrogénicas midiendo los cambios en el potencial de membrana. Este ensayo proporciona una plataforma para la lectura funcional de múltiples canales iónicos expresados endógenamente en líneas celulares epiteliales.
Resumen
Los estudios basados en fluorescencia son adecuados para ensayos de lectores de placas de alto rendimiento de células en cultivo. Se han empleado comúnmente para campañas de descubrimiento de fármacos dirigidas a proteínas recombinantes del canal iónico sobreexpresadas en células como las células HEK-293. Sin embargo, hay un énfasis creciente en el uso de líneas celulares relevantes para el tejido para estudiar los efectos de las intervenciones de moléculas pequeñas. El siguiente protocolo describe la adaptación de un ensayo de potencial de membrana basado en fluorescencia para el estudio de canales iónicos expresados endógenamente en líneas celulares epiteliales. El ensayo de potencial de membrana detalla un ensayo de alto rendimiento para la actividad del canal de cloruro del regulador de conductancia transmembrana de fibrosis quística (CFTR) en dos líneas celulares epiteliales comúnmente estudiadas, Caco-2 y Calu-3. Además, este documento describe una aplicación novedosa de este sistema para medir la actividad del canal epitelial de sodio (ENaC) en un formato de alto rendimiento en las mismas líneas celulares epiteliales. Juntos, estos ensayos basados en fluorescencia proporcionan una plataforma robusta y flexible para estudiar moduladores de moléculas pequeñas, dirigidos a dos canales epiteliales en un contexto celular relevante.
Introducción
Los ensayos de actividad de alto rendimiento basados en fluorescencia de proteínas de canales recombinantes han sido altamente efectivos en la identificación de moduladores de moléculas pequeñas que tienen el potencial de convertirse en terapias futuras 1,2,3,4. Un método común para examinar bibliotecas de moléculas pequeñas en busca de moduladores de canales iónicos es medir los cambios en el potencial de membrana. Típicamente, estos cribados se realizan utilizando canales recombinantes expresados heterólogamente en líneas celulares como las células HEK-293 5,6,7.
Sin embargo, existe la necesidad de validar los "hits" en los tipos de células relevantes. Proponemos que es deseable un cribado secundario en líneas celulares relevantes que expresen endógenamente los canales de interés. Dicha pantalla secundaria identificará aquellos moduladores con mayor probabilidad de ser efectivos en los ensayos de validación final que dependen de tejidos humanos primarios menos accesibles.
También existe la necesidad de sistemas de ensayo que tengan la flexibilidad de informar la actividad de múltiples objetivos de canales iónicos en el mismo tipo de tejido. Por ejemplo, existe una literatura publicada sustancial que apoya el concepto de que CFTR y ENaC interactúan funcionalmente 8,9,10. Aunque se sabe que varias líneas celulares epiteliales bien estudiadas expresan tanto CFTR como ENaC, hasta la fecha, no se han descrito las condiciones de ensayo para estudiar ambos de una manera de alto rendimiento.
Este ensayo de potencial de membrana basado en fluorescencia es versátil, ya que emplea una sonda química exógena para medir la función de CFTR y ENaC, evitando la necesidad de sondas codificadas genéticamente11. Como prueba de principio, se estudian dos líneas celulares epiteliales de uso común como ejemplos para resaltar los pasos críticos necesarios para medir la actividad del canal tanto de CFTR como de ENaC.
Protocolo
1. Recubrimiento celular y diferenciación
- Cultive células Calu-3 y Caco-2 en EMEM que contengan un 20% de suero fetal bovino (FBS) y un 1% de penicilina-estreptomicina (pluma/estreptococo) en un matraz T-75.
- Una vez que las células alcancen el 80-100% de confluencia, aspirar el medio del matraz T-75.
- Lave suavemente las células una vez con 10 ml de solución salina tamponada con fosfato (PBS).
- Añadir 2 ml de tripsina al 0,25%/EDTA al 0,1% precalentado a la monocapa celular y colocar el matraz T-75 a 37 °C durante aproximadamente 5 minutos para permitir que las células se levanten de la superficie del matraz de cultivo y se disocien en una suspensión unicelular.
- Una vez que las células se levantan de la superficie del matraz, neutralizar la reacción con 8 ml de medio de cultivo (paso 1.1) para un total de 10 ml de suspensión celular.
NOTA: Disociar mecánicamente los grupos celulares en una suspensión unicelular con una pipeta serológica de 10 ml. - Coloque las células en una placa de 96 pocillos (~140,000-150,000 células / pocillo) o una placa de 384 pocillos (~ 45,000-50,000 células / pocillo) en una confluencia del 30-40%.
- Para colocar una placa completa de 96 pocillos, agregue 1,5 ml de la suspensión celular a 18,5 ml del medio de cultivo en un tubo cónico de 50 ml. Después de mezclar, agregue 200 μL de la suspensión celular a cada pocillo.
- Para colocar una placa completa de 384 pocillos, agregue 1 ml de la suspensión celular a 17 ml del medio de cultivo en un tubo cónico de 50 ml. Después de mezclar, agregue 50 μL de la suspensión celular a cada pocillo.
NOTA: Asegúrese de que no haya grupos de células, y las células individuales se distribuyen uniformemente en cada pocillo.
- Cambie el medio cada 2 días después del emplatado. Si las células no alcanzan la confluencia al mismo tiempo entre diferentes pocillos, deseche la placa y repita el paso 1.5.
- Una vez sembradas, espere a que las células alcancen el 100% de confluencia dentro de 3-5 días. Cambiar el medio 24 h antes de los estudios funcionales.
2. Preparación de la solución tampón del ensayo funcional CFTR
- Prepare la solución tampón libre de sodio y cloruro con los reactivos enumerados en la Tabla 1.
- Agregue los reactivos al grado de cultivo de tejidos, doble destilación deH2O(ddH2O). Permita que los reactivos se disuelvan (en un recipiente cerrado para evitar la evaporación) agitando durante la noche a temperatura ambiente.
- Una vez que la solución esté estable, mida el pH. Si el pH de la solución supera 7,4, añadir 1 M de solución de N-metil-D-glucamina (NMDG) gota a gota para ajustar el pH a 7,4.
NOTA: No ajuste el pH de la solución con HCl porque la solución debe permanecer libre de cloruro. - Deje que la solución se mezcle durante otros 30 minutos y mida la osmolaridad de la solución.
- Reducir la osmolaridad de la solución tampón a un rango fisiológico de 300 ± 5 mOsm/kg.
- Filtrar y almacenar la solución tampón en frascos estériles.
NOTA: La solución puede conservarse a 4 °C durante un máximo de 6 meses. Si se almacena durante más de 6 meses, compruebe el pH y la osmolaridad a temperatura ambiente antes de usarlo.
3. Ensayo funcional CFTR
- Disuelva el colorante de potencial de membrana en la solución tampón libre de sodio y cloruro (0,5 mg de colorante/1 ml de solución tampón) y caliéntela a 37 °C.
NOTA: Evite exponer el polvo de colorante potencial de membrana a la luz. - Retire el medio de cultivo de las monocapas celulares de Calu-3 o Caco-2 y agregue la solución que contiene colorante a cada pocillo (195 μL por pocillo para una placa de 96 pocillos, 95 μL por pocillo para una placa de 384 pocillos).
NOTA: Se pueden agregar hasta 112 μL por pocillo de placas de 384 pocillos. - Deje que las células carguen el tinte durante 35 min a 37 °C y 5% deCO2.
- Mueva las células, cargadas con solución de colorante, al lector de placas de fluorescencia. Tome medidas de fluorescencia desde la parte inferior de la placa, con excitación = 530 ± 5 nm, emisión = 560 ± 5 nm
- Comience tomando lecturas de referencia continuas durante 5 minutos a intervalos de 30 s.
- Añadir 5 μL de una solución de baja concentración de forskoline o DMSO a cada pocillo para obtener una concentración final de 1 μM de forskoline (1x). Tome una lectura de estimulación durante 20 minutos con mediciones a intervalos de 15 s.
- Para el formato de placa de 96 pocillos, prepare la solución de forskoline de baja concentración (40 μM de forskoline (dilución 1:25)) de forskolina diluyendo 2 μL de solución madre de forskoline (1,000x) de 1 mM o DMSO en 48 μL de solución tampón sin sodio y sin cloruro.
NOTA: La forskoline de baja concentración de 40 μM es seguida por una segunda dilución (dilución 1:40) en el siguiente paso para una concentración final de 1 μM de forskolina. - Para el formato de placa de 384 pocillos, prepare la solución de baja concentración (20 μM de forskoline (dilución 1:50)) diluyendo 1 μL de solución madre de forskoline de 1 mM (1,000x) o DMSO en 49 μL de solución tampón sin sodio y sin cloruro.
NOTA: La forskoline de baja concentración de 20 μM es seguida por una segunda dilución (dilución 1:20) en el siguiente paso para una concentración final de 1 μM de forskolina.
- Para el formato de placa de 96 pocillos, prepare la solución de forskoline de baja concentración (40 μM de forskoline (dilución 1:25)) de forskolina diluyendo 2 μL de solución madre de forskoline (1,000x) de 1 mM o DMSO en 48 μL de solución tampón sin sodio y sin cloruro.
- Añadir 5 μL de solución de baja concentración de CFTRInh172 para obtener una concentración final de 10 μM de CFTRInh172. Tome una lectura de inhibición durante 15 min con mediciones a intervalos de 30 s.
- Para el formato de placa de 96 pocillos, prepare la solución CFTRInh172 de baja concentración (400 μM CFTRInh172 (dilución 1:25)) diluyendo 2 μL de una solución madre de CFTRInh172 (1,000x) de 10 mM en 48 μL de solución tampón libre de sodio y cloruro.
NOTA: El CFTRInh172 de 400 μM de baja concentración es seguido por una segunda dilución (dilución 1:40) en el siguiente paso para una concentración final de 10 μM CFTRInh172. - Para el formato de placa de 384 pocillos, preparar la solución CFTRInh172 de baja concentración (200 μM CFTRInh172 (dilución 1:50)) diluyendo 1 μL de solución madre de CFTRInh172 (1.000x) de 10 mM en 49 μL de solución tampón sin cloruro y sin sodio.
NOTA: El CFTRInh172 de 200 μM de baja concentración es seguido por una segunda dilución (dilución 1:20) en el siguiente paso para una concentración final de 10 μM CFTRInh172.
- Para el formato de placa de 96 pocillos, prepare la solución CFTRInh172 de baja concentración (400 μM CFTRInh172 (dilución 1:25)) diluyendo 2 μL de una solución madre de CFTRInh172 (1,000x) de 10 mM en 48 μL de solución tampón libre de sodio y cloruro.
- Cuantifique las mediciones de intensidad de fluorescencia de cada pozo y exporte los valores como una hoja de cálculo en formato de columna que contenga pozos individuales. Para calcular los cambios inducidos por la forskolina, divida las mediciones de RFU (unidades de fluorescencia relativa) de cada pocillo de la placa de 96 o 384 pocillos por la última medición de intensidad de fluorescencia de la lectura de referencia y grafiquelas.
- Alternativamente, cuantifique la respuesta de inhibición mediada por CFTRInh172 para confirmar mejor la especificidad de la función CFTR 12, ya que el tratamiento agudo con forskoline puede resultar en la despolarización de la membrana a través de la actividad de otros canales de cloruro, como SLC26A912.
- Mida las respuestas máximas como la medida máxima de intensidad de fluorescencia desde el inicio durante la estimulación con forskolina. Utilice esta medida o área bajo la curva para cuantificar la respuesta CFTR.
4. Preparación de la solución tampón del ensayo funcional ENaC
- Prepare la solución tampón sin cloruro con alto contenido de sodio con los reactivos enumerados en la Tabla 2.
- Una vez que la solución esté estable, mida el pH. Si el pH de la solución es inferior a 7,4, añadir 1 N solución de NaOH gota a gota para ajustar el pH a 7,4.
NOTA: No ajuste el pH de la solución con HCl porque la solución debe permanecer libre de cloruro. - Reducir la osmolaridad de la solución tampón a un rango fisiológico de 300 ± 5 mOsm/kg.
- Filtrar y conservar la solución tampón en frascos estériles a 4 °C durante un máximo de 6 meses.
NOTA: Si el almacenamiento es más largo que 6 meses, verifique el pH y la osmolaridad a temperatura ambiente antes de usar.
5. Ensayo funcional ENaC
- Disuelva el colorante de potencial de membrana en la solución tampón sin cloruro con alto contenido de sodio (0,5 mg de colorante/1 ml de solución tampón) y caliéntela a 37 °C.
NOTA: Evite exponer el polvo de colorante potencial de membrana a la luz. - Retire el medio de cultivo de las monocapas celulares de Calu-3 o Caco-2 y agregue la solución que contiene colorante a cada pocillo (195 μL por pocillo para placas de 96 pocillos, 95 μL por pocillo para placas de 384 pocillos).
NOTA: Evite exponer la solución de colorante a la luz. - Deje que las células carguen el colorante durante 35 min a 37 °C y 5% deCO2.
- Mueva las células, cargadas con solución de colorante, al lector de placas de fluorescencia. Lea las mediciones de fluorescencia desde la parte inferior de la placa, con excitación = 530 ± 5 nm, emisión = 560 ± 5 nm.
- Comience tomando lecturas de referencia continuas durante 5 minutos a intervalos de 30 s.
- Para inhibir la función de ENaC, añadir 5 μL de solución de baja concentración amilorida o solución de baja concentración DMSO disuelta en la solución tampón de cloruro cero sodio para una concentración final de 10 μM amilorida.
- Para el formato de placa de 96 pocillos, preparar la solución de amilorida de baja concentración (400 μM amilorida (dilución 1:25)) diluyendo 2 μL de solución madre de amilorida (1.000x) de 10 mM en 48 μL de solución tampón sin cloruro con alto contenido de sodio.
NOTA: La amilorida de baja concentración de 400 μM es seguida por una segunda dilución (dilución 1:40) en el siguiente paso para una concentración final de 10 μM de amilorida. - Para el formato de placa de 384 pocillos, preparar la solución de amilorida de baja concentración (200 μM de amilorida (dilución 1:50)) añadiendo 1 μL de solución madre de amilorida (1.000x) de 10 mM en 49 μL de solución tampón sin cloruro con alto contenido de sodio.
NOTA: La amilorida de baja concentración de 200 μM es seguida por una segunda dilución (dilución 1:20) en el siguiente paso para una concentración final de 10 μM de amilorida.
- Para el formato de placa de 96 pocillos, preparar la solución de amilorida de baja concentración (400 μM amilorida (dilución 1:25)) diluyendo 2 μL de solución madre de amilorida (1.000x) de 10 mM en 48 μL de solución tampón sin cloruro con alto contenido de sodio.
- Tome una lectura de inhibición durante 60 min con mediciones a intervalos de 45 s.
- Repita el paso 3.7 para el análisis de datos.
- Mida la respuesta de amilorida como el porcentaje de inhibición desde el inicio hasta el punto de meseta, aproximadamente 15-20 minutos después de la adición de amilorida. Utilice esta diferencia para cuantificar la respuesta ENaC.
Resultados
Para medir la actividad del canal CFTR, se incuban células adheridas bien diferenciadas en una solución extracelular de cloruro cero que contiene el colorante sensible al potencial de membrana. La función CFTR se detecta consistentemente como despolarización de la membrana después de la estimulación con forskolina. El flujo de salida de cloruro se detecta como un fuerte aumento de la fluorescencia en comparación con el control del vehículo. La señal de fluorescencia se mantiene hasta la adición del inhibidor CFTR (CFTRInh172), lo que lleva a una rápida disminución en la intensidad de fluorescencia, como se ve en las células Caco-2 (Figura 1A), y es reproducible tanto en células Caco-2 como en células Calu-3 (Figura 1B). La evaluación de la actividad CFTR como la diferencia en el cambio máximo en la fluorescencia después de forskoline o el DMSO (vehículo). Los puntos individuales variaron entre ± 3 desviaciones estándar de la estimulación media de forskoline (puntos negros) o el control DMSO (puntos grises), que correspondieron a un factor Z' de 0,586. Esta excelente puntuación indicó la reproducibilidad de este ensayo (Figura 1C). En caso de que haya una deriva menor en la línea de base, el impacto de la deriva se puede minimizar extrapolando la línea de base a lo largo de la traza después de la activación hasta el punto de adición del inhibidor. La respuesta se puede cuantificar como el área bajo la curva, con el límite inferior definido por la línea extrapolada.
La actividad de ENaC también se puede medir en las vías respiratorias confluentes y las células epiteliales colónicas cultivadas en placas de 96 pocillos. En contraste con el ensayo para la actividad del canal CFTR, estas células se sumergen en una solución con alto contenido de sodio, lo que permite la absorción de sodio a través de ENaC. Con la adición aguda de amilorida, la absorción de sodio se bloquea y las células experimentan hiperpolarización relativa de la membrana. Esto se muestra en células Caco-2 tanto en concentraciones bajas (10 μM) (Figura 2A) como altas (50 μM) de amilorida (Figura 2A, B) y en células Calu-3 con una alta concentración de amilorida (50 μM) (Figura 2B). El ensayo ENaC se amplió a un formato de placa de 384 pocillos y demostró una gran reproducibilidad en la inhibición de ENaC. Del mismo modo, los puntos individuales variaron entre ± 3 desviaciones estándar de la inhibición media de amilorida (puntos negros) o el control de DMSO (puntos grises). La respuesta ENaC en células Calu-3 reportó un factor Z' de 0.629 con tratamiento agudo usando amilorida (50 μM) (Figura 2C), lo que indica que estos parámetros apoyan el cribado de alto rendimiento.
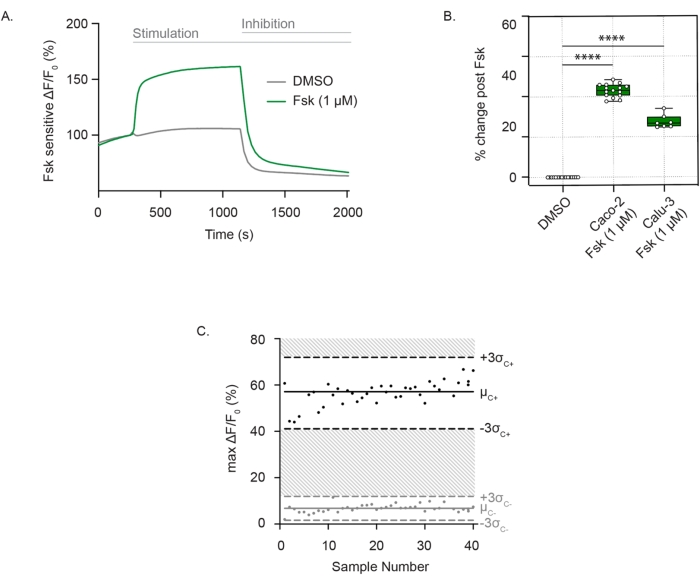
Figura 1: Medición del canal CFTR como cambios en la despolarización de membrana en células Caco-2 y Calu-3. (A) Traza representativa de estimulación CFTR con forskoline (1 μM) y control DMSO en células Caco-2. (B) Diagrama de caja y bigotes de estimulación con forskoline en células Caco-2 y Calu-3 (**** P < 0.0001, n > 3 réplicas biológicas, n > 3 réplicas técnicas). Las réplicas biológicas son pasajes independientes de la línea celular; Las réplicas técnicas se refieren a pozos independientes de las placas de pocillos múltiples. El diagrama de caja representa el valor medio; los límites representan IQR, con los bigotes definiendo los valores mínimos y máximos. (C) Diagrama de Bland-Altman de la respuesta CFTR reproducible con estimulación de forskoline en comparación con el control de DMSO en células Caco-2. Los puntos negros representan cambios absolutos máximos en la fluorescencia en respuesta a la estimulación de forskolina. Los puntos grises representan cambios en la fluorescencia en respuesta al control DMSO. Abreviaturas: CFTR = Cystic Fibrosis Transmembrane Conductance Regulator; DMSO = dimetilsulfóxido; IQR = rango intercuartílico; Fsk = forskolina; ΔF/F0 = cambio en la fluorescencia. Haga clic aquí para ver una versión más grande de esta figura.
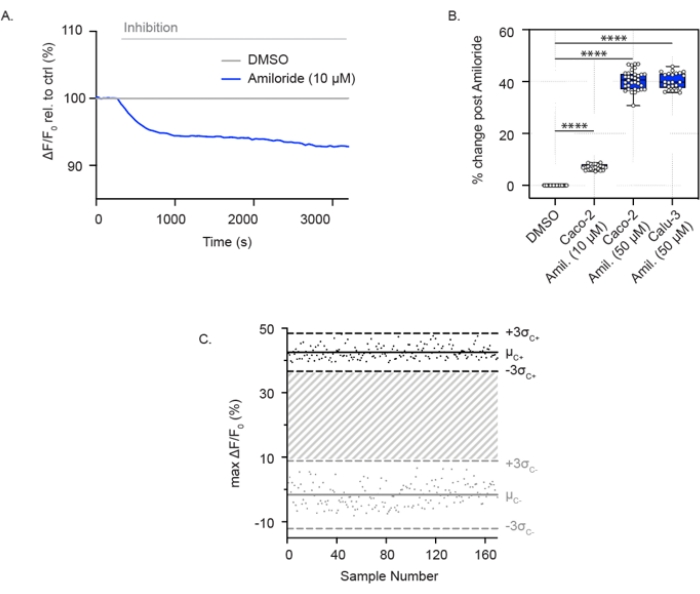
Figura 2: Mediciones de inhibición de ENaC a través de hiperpolarización de membrana en células Caco-2 y Calu-3. (A) Traza representativa de inhibición de ENaC con amilorida (10 μM) en relación con el control de DMSO en células Caco-2. (B) Diagrama de caja y bigotes de inhibición de amilorida en células Caco-2 y Calu-3 (**** P < 0.0001, n > 3 réplicas biológicas, n > 3 réplicas técnicas). (C) Diagrama de Bland-Altman de la respuesta ENaC reproducible con inhibición de amilorida en comparación con el control de DMSO en células Calu-3. Los puntos negros representan los cambios absolutos máximos en la fluorescencia en respuesta a la inhibición de amilorida. Los puntos grises representan cambios en la fluorescencia en respuesta al control DMSO. Abreviaturas: ENaC = canal epitelial de sodio; DMSO = dimetilsulfóxido; Amil. = amilorida; ΔF/F0 = cambio en la fluorescencia. Haga clic aquí para ver una versión más grande de esta figura.
| Nombre | Concentración |
| NMDG (N-metil-D-glucamina) | 150 mM |
| Ácido glucónico lactona | 150 mM |
| Gluconato de potasio | 3 mM |
| HEPES | 10 mM |
Tabla 1: Reactivos y sus correspondientes concentraciones para el ensayo funcional CFTR con cero sodio y cloruro. Abreviatura: CFTR = Cystic Fibrosis Transmembrane Conductance Regulator.
| Nombre | Concentración |
| Gluconato de sodio | 150 mM |
| Gluconato de potasio | 3 mM |
| HEPES | 10 mM |
Tabla 2: Reactivos y sus correspondientes concentraciones para tampón de ensayo funcional ENaC con alto contenido de sodio, cloruro cero. Abreviatura: ENaC = Canal epitelial de sodio (Na).
Discusión
Aquí, hemos descrito métodos basados en fluorescencia para medir la actividad de CFTR y ENaC en la línea celular de cáncer colorrectal epitelial, Caco-2, y la línea celular de cáncer de pulmón epitelial humano, Calu-3. Estos ensayos de potencial de membrana en líneas celulares epiteliales se pueden utilizar para confirmar la eficacia de compuestos moduladores de moléculas pequeñas, previamente identificados en sistemas de expresión heterólogos, antes de la validación final in vitro en cultivos epiteliales primarios derivados de pacientes.
Es imperativo confirmar que las mediciones anteriores se atribuyen adecuadamente al canal de interés. Por ejemplo, la medición atribuida a CFTR debe mostrar dependencia de la expresión de la proteína CFTR y la fuerza impulsora electroquímica del cloruro, que es modulada por forskoline y el inhibidor CFTRInh-172. Del mismo modo, los cambios potenciales de membrana causados por amilorida de 10 μM pueden atribuirse a ENaC, si dependen de la expresión de proteínas ENaC y de una fuerza impulsora de sodio hacia adentro. Aunque hemos confirmado estas propiedades de ENaC en células MDCK después de la transfección con las tres subunidades de ENaC 2, aún no hemos confirmado formalmente que la respuesta de amilorida medida en célulasCaco-2 y Calu-3 sea conferida por ENaC. Esto es particularmente importante, ya que la amilorida puede modular la función del intercambiador de sodio-protones NHE3 además de ENaC13. Posiblemente, la hiperpolarización inducida por amilorida observada en este ensayo podría reflejar parcialmente los efectos indirectos de la acidificación intracelular en otros canales. Para confirmar que la hiperpolarización inducida por amilorida medida con este colorante sensible al potencial de membrana es conferida por ENaC en las líneas celulares anteriores y sistemas celulares más complejos, como los tejidos derivados de iPSC, estamos confirmando que esta actividad se pierde al eliminar una subunidad ENaC obligada (beta) en estas líneas.
El éxito de estos ensayos requiere atención a varios factores. En primer lugar, los cultivos epiteliales deben ser confluentes y bien diferenciados. Para la medición de la función CFTR y ENaC, se deben colocar aproximadamente 145,000 celdas por pocillo en placas de 96 pocillos o 45,000 celdas por pocillo en placas de 384 pocillos. Una vez que las células epiteliales alcanzan la confluencia (dentro de los 3-4 días posteriores a la placa), permita 2-5 días de diferenciación. Este momento se determinó previamente en función de la expresión máxima de la proteína CFTR mediante inmunotransferencia14. Del mismo modo, se determinó el momento óptimo para la expresión funcional de ENaC en ambas líneas celulares, Calu-3 y Caco-2.
Las monocapas no confluentes o el sobrecrecimiento celular conducen a una baja reproducibilidad entre réplicas técnicas. En los casos en que las células en pocillos individuales no alcanzan la confluencia al mismo tiempo, estas placas deben descartarse. Además, las lecturas basales inestables o la falta de respuestas de estimulación pueden ser una indicación de mala calidad celular, que debe excluirse del análisis. La reducción de las respuestas al activador de CFTR, forskolina, o al inhibidor de ENaC, amilorida, podría reflejar potencialmente el uso de células excesivamente transitadas15. Aunque no es un problema para las células Calu-3 y Caco-2, otras células o tejidos pueden no adherirse bien a las placas y pueden requerir un recubrimiento previo de los pocillos. Por ejemplo, en estudios previos, los cultivos de colangiocitos 2D se unieron a las placas utilizando recubrimiento de colágeno16. Alternativamente, la adherencia de los tejidos intestinales 2D se incrementó utilizando Poly-L-Lisina2.
Además, al probar la modulación de los canales iónicos por moléculas pequeñas utilizando un ensayo basado en fluorescencia, es fundamental que se aborden los artefactos potenciales conferidos por las propiedades fluorescentes de las moléculas pequeñas. Para confirmar la especificidad de las respuestas funcionales, los ensayos de potencial de membrana pueden validarse aún más utilizando métodos electrofisiológicos convencionales, como los estudios de Ussing17.
Después de confirmar que la respuesta detectada por los colorantes sensibles al potencial de membrana es conferida específicamente por el canal de interés, estos ensayos tienen un enorme potencial para validar moduladores prometedores de canales iónicos epiteliales en su contexto celular relevante. Esta plataforma puede cerrar la brecha entre las pantallas moduladoras de alto rendimiento en sistemas de expresión heteróloga y las mediciones bioeléctricas que requieren mucho tiempo en tejidos primarios de difícil acceso.
Divulgaciones
Los autores declaran que no hay intereses contrapuestos.
Agradecimientos
Los autores desean agradecer a Christopher Fladd y SPARC BioCentre en el Hospital para Niños Enfermos por su ayuda en la realización de los ensayos de potencial de membrana que miden CFTR y ENaC. Este trabajo fue apoyado por el Programa CFIT con fondos proporcionados por CF Canadá y la Fundación Sick Kids. Este trabajo fue financiado por el Gobierno de Canadá a través de Genome Canada y el Instituto de Genómica de Ontario (OGI-148). Este estudio fue financiado por el Gobierno de Ontario. S.X. fue apoyado por la Asociación Canadiense de Gastroenterología (CAG) Ph.D. beca.
Materiales
| Name | Company | Catalog Number | Comments |
| Amiloride | Spectrum Chemical | TCI-A2599-5G | Dissolved in DMSO and stored at -20 °C |
| CFTRInh-172 | CF Foundation Therapeutics | Dissolved in DMSO and stored at -20 °C | |
| EMEM, 1xs | Wisent | 320-005-CL | |
| Fetal Bovine Serum (FBS) | Wisent | 080-450 | |
| FLIPR Membrane Potential Dye | Molecular Devices | R8042 | Stored at 4 °C |
| Forskolin | Sigma-Aldrich | F3917 | Dissolved in DMSO and stored at -20 °C |
| Gluconic acid lactone or (D-(+)-Gluconic acid δ-lactone) | Sigma-Aldrich | G4750 | Stored at room temperature |
| HEPES | Bioshop | HEP001.5 | Stored at room temperature |
| Human Bronchial Adenocarcinoma Cell Line (Calu-3) | ATCC | HTB-55 | |
| Human Epithelial Colorectal Adenocarcinoma Cell Line (Caco-2) | ATCC | HTB-37 | |
| N-Methyl-D-glucamine (NMDG | Sigma-Aldrich | M2004 | Stored at room temperature |
| Penicillin-Streptomycin Solution | Wisent | 450-200-EL | |
| Phosphate-Buffered Saline (PBS) | Wisent | 311-010-CL | |
| Potassium Gluconate | Sigma-Aldrich | P1847 | Stored at room temperature |
| Sodium Gluconate | Sigma-Aldrich | G9005 | Stored at room temperature |
Referencias
- Ahmadi, S., et al. Phenotypic profiling of CFTR modulators in patient-derived respiratory epithelia. NPJ Genomic Medicine. 2, 12 (2017).
- Xia, S., et al. High-throughput functional analysis of CFTR and other apically localized proteins in iPSC-derived human intestinal organoids. Cells. 10 (12), 3419 (2021).
- Jiang, J. X., et al. A new platform for high-throughput therapy testing on iPSC-derived lung progenitor cells from cystic fibrosis patients. Stem Cell Reports. 16 (11), 2825-2837 (2021).
- Hu, J., et al. Human Embryonic Kidney 293 Cells: a vehicle for biopharmaceutical manufacturing, structural biology, and electrophysiology. Cells, Tissues, Organs. 205 (1), 1-8 (2018).
- Hadida, S., et al. Discovery of N-(2,4-di-tert-butyl-5-hydroxyphenyl)-4-oxo-1,4-dihydroquinoline-3-carboxamide (VX-770, ivacaftor), a potent and orally bioavailable CFTR potentiator. Journal of Medicinal Chemistry. 57 (23), 9776-9795 (2014).
- Chen, M. X., et al. Validation and optimization of novel high-throughput assays for human epithelial sodium channels. Journal of Biomolecular Screening. 20 (2), 242-253 (2015).
- Maitra, R., Sivashanmugam, P., Warner, K. A rapid membrane potential assay to monitor CFTR function and inhibition. Journal of Biomolecular Screening. 18 (9), 1132-1137 (2013).
- Mall, M. A. ENaC inhibition in cystic fibrosis: potential role in the new era of CFTR modulator therapies. European Respiratory Journal. 56 (6), 2000946 (2020).
- Moore, P. J., Tarran, R. The epithelial sodium channel (ENaC) as a therapeutic target for cystic fibrosis lung disease. Expert Opinion on Therapeutic Targets. 22 (8), 687-701 (2018).
- Stutts, M. J., et al. CFTR as a cAMP-dependent regulator of sodium channels. Science. 269 (5225), 847-850 (1995).
- Merkert, S., et al. High-throughput screening for modulators of CFTR activity based on genetically engineered cystic fibrosis disease-specific iPSCs. Stem Cell Reports. 12 (6), 1389-1403 (2019).
- Bertrand, C. A., et al. The CFTR trafficking mutation F508del inhibits the constitutive activity of SLC26A9. American Journal of Physiology. Lung Cellular and Molecular Physiology. 312 (6), 912-925 (2017).
- Frelin, C., et al. Amiloride and its analogs as tools to inhibit Na+ transport via the Na+ channel the Na+/H+ antiport and the Na+/Ca2+ exchanger. Biochimie. 70 (9), 1285-1290 (1988).
- Di Paola, M., et al. SLC6A14 is a genetic modifier of cystic fibrosis that regulates Pseudomonas aeruginosa attachment to human bronchial epithelial cells. mBio. 8 (6), 02073 (2017).
- Schiavi, S. C., et al. Biosynthetic and growth abnormalities are associated with high-level expression of CFTR in heterologous cells. American Journal of Physiology. 270, 341-351 (1996).
- Ogawa, M., et al. Generation of functional ciliated cholangiocytes from human pluripotent stem cells. Nature Communications. 12 (1), 6504 (2021).
- Lu, C., Pribanic, S., Debonneville, A., Jiang, C., Rotin, D. The PY motif of ENaC, mutated in Liddle syndrome, regulates channel internalization, sorting and mobilization from subapical pool. Traffic. 8 (9), 1246-1264 (2007).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados