Method Article
Флуоресцентный анализ мембранного потенциала для высокопроизводительного функционального исследования двух эндогенных ионных каналов в двух эпителиальных клеточных линиях
В этой статье
Резюме
Этот протокол описывает метод исследования электрогенных мембранных белков путем измерения изменений мембранного потенциала. Этот анализ обеспечивает платформу для функционального считывания нескольких ионных каналов, эндогенно экспрессируемых в эпителиальных клеточных линиях.
Аннотация
Флуоресцентные исследования подходят для высокопроизводительных анализов клеток в культуре. Они обычно использовались для кампаний по открытию лекарств, нацеленных на белки рекомбинантных ионных каналов, сверхэкспрессируемые в клетках, таких как клетки HEK-293. Тем не менее, все больше внимания уделяется использованию тканезависимых клеточных линий для изучения эффектов вмешательств с использованием малых молекул. Следующий протокол описывает адаптацию анализа мембранного потенциала на основе флуоресценции для исследования ионных каналов, эндогенно экспрессируемых в эпителиальных клеточных линиях. Анализ мембранного потенциала детализирует высокопроизводительный анализ активности хлоридных каналов трансмембранного регулятора проводимости муковисцидоза (CFTR) в двух широко изучаемых линиях эпителиальных клеток, Caco-2 и Calu-3. Кроме того, в этой статье описывается новое применение этой системы для измерения активности эпителиального натриевого канала (ENaC) в формате с высокой пропускной способностью в тех же линиях эпителиальных клеток. Вместе эти флуоресцентные анализы обеспечивают надежную и гибкую платформу для изучения низкомолекулярных модуляторов, нацеленных на два эпителиальных канала в соответствующем клеточном контексте.
Введение
Основанные на флуоресценции высокопроизводительные анализы активности белков рекомбинантных каналов оказались очень эффективными в идентификации низкомолекулярных модуляторов, которые могут стать будущими методами лечения 1,2,3,4. Одним из распространенных методов скрининга библиотек малых молекул для модуляторов ионных каналов является измерение изменений мембранного потенциала. Как правило, эти скрининги проводятся с использованием рекомбинантных каналов, экспрессируемых гетерологически в клеточных линиях, таких как клетки HEK-293 5,6,7.
Тем не менее, существует необходимость в проверке «попаданий» в соответствующие типы клеток. Мы предполагаем, что желателен вторичный скрининг в соответствующих клеточных линиях, которые эндогенно экспрессируют интересующие каналы. Такой вторичный скрининг позволит определить те модуляторы, которые, скорее всего, будут эффективны в окончательных валидационных анализах, которые полагаются на менее доступные первичные ткани человека.
Существует также потребность в системах анализа, которые обладают гибкостью, позволяющей сообщать об активности нескольких мишеней ионных каналов в одном и том же типе ткани. Например, существует обширная опубликованная литература, которая поддерживает концепцию, согласно которой CFTR и ENaC функционально взаимодействуют 8,9,10. Хотя известно, что несколько хорошо изученных линий эпителиальных клеток экспрессируют как CFTR, так и ENaC, на сегодняшний день условия анализа для изучения обоих с высокой пропускной способностью не были описаны.
Этот анализ мембранного потенциала на основе флуоресценции является универсальным, поскольку в нем используется экзогенный химический зонд для измерения функции CFTR и ENaC, минуя необходимость в генетически кодируемых зондах11. В качестве доказательства принципа в качестве примеров изучаются две широко используемые линии эпителиальных клеток, чтобы выделить критические шаги, необходимые для измерения активности каналов как CFTR, так и ENaC.
протокол
1. Покрытие и дифференцировка ячеек
- Культивирование клеток Calu-3 и Caco-2 в EMEM, содержащих 20% эмбриональной бычьей сыворотки (FBS) и 1% пенициллина-стрептомицина (ручка/стрептококк) в колбе T-75.
- Как только ячейки достигнут 80-100% слияния, аспирируйте среду из колбы Т-75.
- Аккуратно промойте клетки один раз 10 мл фосфатно-буферного физиологического раствора (PBS).
- Добавьте 2 мл предварительно подогретого 0,25% трипсина/0,1% ЭДТА в монослой клетки и поместите колбу T-75 при 37 ° C примерно на 5 минут, чтобы клетки могли подняться с поверхности колбы для культивирования и диссоциировать в одноклеточную суспензию.
- После того, как клетки подняты с поверхности колбы, нейтрализуют реакцию 8 мл питательной среды (этап 1.1), чтобы получить в общей сложности 10 мл клеточной суспензии.
ПРИМЕЧАНИЕ: Механически диссоциируйте клеточные скопления в одноклеточную суспензию с помощью серологической пипетки объемом 10 мл. - Поместите ячейки на 96-луночную пластину (~ 140 000-150 000 клеток / лунку) или 384-луночную пластину (~ 45 000-50 000 клеток / лунку) при слиянии 30-40%.
- Чтобы пластинировать одну полную 96-луночную пластину, добавьте 1,5 мл клеточной суспензии к 18,5 мл питательной среды в конической пробирке объемом 50 мл. После смешивания добавьте 200 мкл клеточной суспензии в каждую лунку.
- Чтобы пластинировать одну полную 384-луночную пластину, добавьте 1 мл клеточной суспензии к 17 мл питательной среды в конической пробирке объемом 50 мл. После смешивания добавьте 50 мкл клеточной суспензии в каждую лунку.
ПРИМЕЧАНИЕ: Убедитесь, что нет скоплений клеток, а отдельные ячейки равномерно распределены по каждой лунке.
- Меняйте среду каждые 2 дня после нанесения покрытия. Если ячейки не достигают слияния одновременно между разными лунками, выбросьте пластину и повторите шаг 1,5.
- После посева подождите, пока клетки достигнут 100% слияния в течение 3-5 дней. Смените среду за 24 ч до начала функционального исследования.
2. Приготовление буферного раствора для функционального анализа CFTR
- Приготовьте буферный раствор, не содержащий натрия и хлоридов, с реагентами, перечисленными в таблице 1.
- Добавьте реагенты в тканевую культуру, дважды дистиллированную H 2 O (ddH2O). Дайте реагентам раствориться (в закрытой емкости, чтобы избежать испарения), помешивая в течение ночи при комнатной температуре.
- Как только раствор станет стабильным, измерьте рН. Если рН раствора превышает 7,4, добавьте 1 М раствор N-метил-D-глюкамина (NMDG) по каплям, чтобы отрегулировать рН до 7,4.
ПРИМЕЧАНИЕ: Не регулируйте рН раствора с помощью HCl, потому что раствор не должен содержать хлоридов. - Дайте раствору перемешаться еще 30 минут и измерьте осмолярность раствора.
- Снизить осмолярность буферного раствора до физиологического диапазона 300 ± 5 мОсм/кг.
- Буферный раствор фильтруют и хранят в стерильных флаконах.
ПРИМЕЧАНИЕ: Раствор можно хранить при температуре 4 °C до 6 месяцев. При хранении более 6 месяцев перед использованием проверьте рН и осмолярность при комнатной температуре.
3. Функциональный анализ CFTR
- Растворите мембранный потенциальный краситель в буферном растворе, не содержащем натрия и хлоридов (0,5 мг красителя / 1 мл буферного раствора) и нагрейте его до 37 ° C.
ПРИМЕЧАНИЕ: Не подвергайте мембранный потенциальный краситель воздействию света. - Удалите питательную среду из монослоев клеток Calu-3 или Caco-2 и добавьте раствор, содержащий краситель, в каждую лунку (195 мкл на лунку для 96-луночной пластины, 95 мкл на лунку для 384-луночной пластины).
ПРИМЕЧАНИЕ: На одну лунку из 384-луночных пластин можно добавить до 112 мкл. - Дайте клеткам загрузить краситель в течение 35 мин при 37 ° C и 5% CO2.
- Переместите ячейки, загруженные раствором красителя, в считыватель флуоресцентных пластин. Проведите измерения флуоресценции со дна пластины, с возбуждением = 530 ± 5 нм, излучение = 560 ± 5 нм
- Начните с непрерывного измерения исходного уровня в течение 5 минут с интервалом 30 с.
- Добавьте 5 мкл низкоконцентрированного раствора форсколина или ДМСО в каждую лунку для получения конечной концентрации форсколина 1 мкМ (1x). Снимайте показания стимуляции в течение 20 минут с измерениями с интервалом 15 с.
- Для 96-луночного планшета приготовьте низкоконцентрированный (40 мкМ форсколин (разбавление 1:25)) раствор форсколина, разбавив 2 мкл исходного раствора форсколина 1 мМ (1,000x) или ДМСО в 48 мкл буферного раствора, не содержащего натрия и хлоридов.
ПРИМЕЧАНИЕ: За форсколином с низкой концентрацией 40 мкМ следует второе разведение (разведение 1:40) на следующем этапе для конечной концентрации форсколина 1 мкМ. - Для 384-луночного планшета приготовьте раствор с низкой концентрацией (20 мкМ форсколина (разведение 1:50)) путем разбавления 1 мкл 1 мМ (1,000x) исходного раствора форсколина или ДМСО в 49 мкл буферного раствора, не содержащего натрия и хлоридов.
ПРИМЕЧАНИЕ: За низкоконцентрированным форсколином 20 мкМ следует второе разведение (разведение 1:20) на следующем этапе для конечной концентрации форсколина 1 мкМ.
- Для 96-луночного планшета приготовьте низкоконцентрированный (40 мкМ форсколин (разбавление 1:25)) раствор форсколина, разбавив 2 мкл исходного раствора форсколина 1 мМ (1,000x) или ДМСО в 48 мкл буферного раствора, не содержащего натрия и хлоридов.
- Добавьте 5 мкл низкоконцентрированного раствора CFTRInh172 для конечной концентрации 10 мкМ CFTRInh172. Снимайте показания ингибирования в течение 15 минут с измерениями с интервалом 30 с.
- Для 96-луночного формата планшета приготовьте раствор CFTRInh172 с низкой концентрацией (400 мкМ CFTRInh172 (разведение 1:25)) путем разбавления 2 мкл исходного раствора CFTRInh172 (1,000x) 10 мМ в 48 мкл буферного раствора, не содержащего натрия и хлоридов.
ПРИМЕЧАНИЕ: Низкоконцентрированное 400 мкМ CFTRInh172 сопровождается вторым разбавлением (разбавление 1:40) на следующем этапе для конечной концентрации 10 мкМ CFTRInh172. - Для 384-луночного формата планшета приготовьте низкоконцентрированный (200 мкМ CFTRInh172 (разбавление 1:50)) раствор CFTRInh172 (разбавление 1:50)) путем разбавления 1 мкл исходного раствора 10 мМ CFTRInh172 (1,000x) в 49 мкл буферного раствора, не содержащего натрия и хлоридов.
ПРИМЕЧАНИЕ: Низкоконцентрированное 200 мкМ CFTRInh172 сопровождается вторым разбавлением (разбавление 1:20) на следующем этапе для конечной концентрации 10 мкМ CFTRInh172.
- Для 96-луночного формата планшета приготовьте раствор CFTRInh172 с низкой концентрацией (400 мкМ CFTRInh172 (разведение 1:25)) путем разбавления 2 мкл исходного раствора CFTRInh172 (1,000x) 10 мМ в 48 мкл буферного раствора, не содержащего натрия и хлоридов.
- Количественно оцените измерения интенсивности флуоресценции каждой скважины и экспортируйте значения в виде электронной таблицы в формате столбца, содержащей отдельные лунки. Чтобы рассчитать изменения, вызванные форсколином, разделите измерения RFU (относительные единицы флуоресценции) из каждой лунки пластины с 96 или 384 лунками на последнее измерение интенсивности флуоресценции базового показания и постройте их.
- В качестве альтернативы, количественно определите реакцию ингибирования, опосредованную CFTRInh172, чтобы лучше подтвердить специфичность функцииCFTR 12, поскольку острое лечение форсколином может привести к деполяризации мембраны за счет активности других хлоридных каналов, таких как SLC26A912.
- Измерьте пиковые реакции как максимальное измерение интенсивности флуоресценции от исходного уровня во время стимуляции форсколином. Используйте это измерение или площадь под кривой для количественной оценки отклика CFTR.
4. Приготовление буферного раствора для функционального анализа ENaC
- Приготовьте буферный раствор с высоким содержанием натрия, не содержащий хлоридов, с реагентами, перечисленными в таблице 2.
- Как только раствор станет стабильным, измерьте рН. Если рН раствора ниже 7,4, добавьте 1 Н раствора NaOH по каплям, чтобы отрегулировать рН до 7,4.
ПРИМЕЧАНИЕ: Не регулируйте рН раствора с помощью HCl, потому что раствор не должен содержать хлоридов. - Снизить осмолярность буферного раствора до физиологического диапазона 300 ± 5 мОсм/кг.
- Буферный раствор фильтруют и хранят в стерильных флаконах при температуре 4 °C до 6 месяцев.
ПРИМЕЧАНИЕ: Если хранение длится более 6 месяцев, перед использованием проверьте pH и осмолярность при комнатной температуре.
5. Функциональный анализ ENaC
- Растворите мембранный потенциальный краситель в буферном растворе с высоким содержанием натрия, не содержащем хлоридов (0,5 мг красителя / 1 мл буферного раствора) и нагрейте его до 37 ° C.
ПРИМЕЧАНИЕ: Не подвергайте мембранный потенциальный краситель воздействию света. - Удалите питательную среду из монослоев клеток Calu-3 или Caco-2 и добавьте красящий раствор в каждую лунку (195 мкл на лунку для 96-луночных планшетов, 95 мкл на лунку для 384-луночных планшетов).
ПРИМЕЧАНИЕ: Не подвергайте раствор красителя воздействию света. - Дайте клеткам загрузить краситель в течение 35 минут при 37 ° C и 5% CO2.
- Переместите ячейки, загруженные раствором красителя, в считыватель флуоресцентных пластин. Считывание измерений флуоресценции с нижней части пластины, с возбуждением = 530 ± 5 нм, излучением = 560 ± 5 нм.
- Начните с непрерывного измерения исходного уровня в течение 5 минут с интервалом 30 с.
- Чтобы ингибировать функцию ENaC, добавьте 5 мкл низкоконцентрированного раствора амилорида или низкоконцентрированного раствора ДМСО, растворенного в буферном растворе с высоким содержанием натрия и нулевым содержанием хлоридов, для конечной концентрации амилорида 10 мкМ.
- Для 96-луночного формата планшета приготовьте низкоконцентрированный (400 мкМ амилорид (разведение 1:25)) раствор амилорида, разбавив 2 мкл исходного раствора 10 мМ амилорида (1,000x) в 48 мкл буферного раствора с высоким содержанием натрия, не содержащего хлоридов.
ПРИМЕЧАНИЕ: За низкоконцентрированным амилоридом 400 мкМ следует второе разведение (разведение 1:40) на следующем этапе для конечной концентрации 10 мкМ амилорида. - Для 384-луночного формата приготовьте низкоконцентрированный (200 мкМ амилорид (разведение 1:50)) раствор амилорида, добавив 1 мкл исходного раствора 10 мМ амилорида (1000x) в 49 мкл буферного раствора с высоким содержанием натрия, не содержащего хлоридов.
ПРИМЕЧАНИЕ: За амилоридом с низкой концентрацией 200 мкМ следует второе разведение (разведение 1:20) на следующем этапе для конечной концентрации 10 мкМ амилорида.
- Для 96-луночного формата планшета приготовьте низкоконцентрированный (400 мкМ амилорид (разведение 1:25)) раствор амилорида, разбавив 2 мкл исходного раствора 10 мМ амилорида (1,000x) в 48 мкл буферного раствора с высоким содержанием натрия, не содержащего хлоридов.
- Снимайте показания торможения в течение 60 минут с измерениями с интервалом 45 с.
- Повторите шаг 3.7 для анализа данных.
- Измерьте реакцию амилорида как процент ингибирования от исходного уровня до точки плато, примерно через 15-20 минут после добавления амилорида. Используйте эту разницу для количественной оценки отклика ENaC.
Результаты
Для измерения активности канала CFTR хорошо дифференцированные, адгезивные клетки инкубируют во внеклеточном растворе с нулевым содержанием хлоридов, содержащем мембранный потенциал-чувствительный краситель. Функция CFTR последовательно определяется как деполяризация мембраны после стимуляции форсколином. Хлоридный отток определяется как резкое увеличение флуоресценции по сравнению с контролем транспортного средства. Флуоресцентный сигнал сохраняется до добавления ингибитора CFTR (CFTRInh172), что приводит к быстрому снижению интенсивности флуоресценции, как это наблюдается в клетках Caco-2 (рис. 1A), и воспроизводится как в клетках Caco-2, так и в клетках Calu-3 (рис. 1B). Оценка активности CFTR как разницы в максимальном изменении флуоресценции после форсколина или ДМСО (носителя). Отдельные точки варьировались от ± до 3 стандартных отклонений от средней стимуляции форсколином (черные точки) или контроля ДМСО (серые точки), что соответствовало Z'-фактору 0,586. Эта превосходная оценка указывает на воспроизводимость этого анализа (рис. 1C). В случае незначительного дрейфа исходной линии влияние дрейфа может быть сведено к минимуму путем экстраполяции исходной линии по всей трассе после активации до точки добавления ингибитора. Отклик может быть количественно определен как площадь под кривой, при этом нижний предел определяется экстраполированной линией.
Активность ENaC также может быть измерена в сливающихся эпителиальных клетках дыхательных путей и толстой кишки, выращенных в 96-луночных планшетах. В отличие от анализа активности канала CFTR, эти клетки погружены в раствор с высоким содержанием натрия, что обеспечивает абсорбцию натрия через ENaC. При остром добавлении амилорида поглощение натрия блокируется, и в клетках наблюдается относительная гиперполяризация мембран. Это показано в клетках Caco-2 как при низких (10 мкМ) (рис. 2А), так и при высоких концентрациях (50 мкМ) амилорида (рис. 2А, В), а также в клетках Calu-3 с высокой концентрацией амилорида (50 мкМ) (рис. 2В). Анализ ENaC был расширен до формата 384-луночного планшета и продемонстрировал отличную воспроизводимость при ингибировании ENaC. Аналогичным образом, отдельные точки варьировались от ± 3 стандартных отклонений от среднего ингибирования амилорида (черные точки) или контроля ДМСО (серые точки). Ответ ENaC в клетках Calu-3 показал Z'-фактор 0,629 при остром лечении с использованием амилорида (50 мкМ) (рис. 2C), что указывает на то, что эти параметры поддерживают высокопроизводительный скрининг.
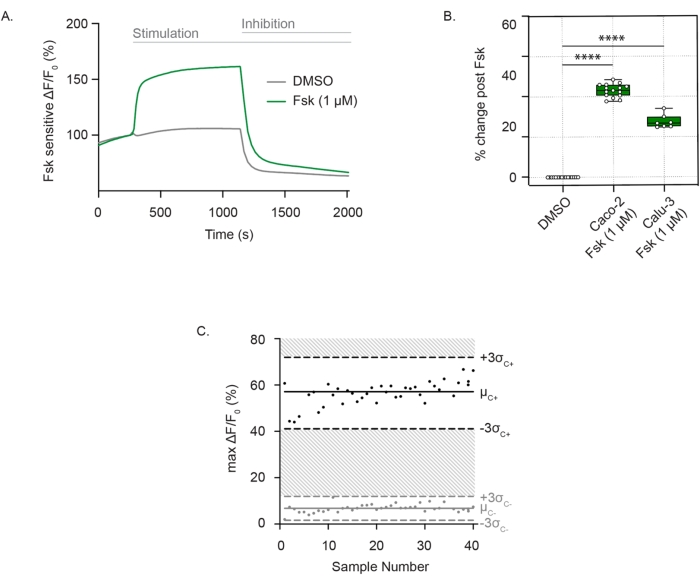
Рисунок 1: Измерение канала CFTR как изменения деполяризации мембраны в клетках Caco-2 и Calu-3. (A) Репрезентативный след стимуляции CFTR форсколином (1 мкМ) и контролем ДМСО в клетках Caco-2. (B) График коробки и уса стимуляции форсколина в клетках Caco-2 и Calu-3 (**** P < 0,0001, n > 3 биологических репликатов, n > 3 технических репликатов). Биологические реплики представляют собой независимые проходы клеточной линии; Технические повторы относятся к независимым скважинам многолуночных плит. Блочная диаграмма отображает медианное значение; границы изображают IQR, а усы определяют значения минимумов и максимумов. (C) График Бланда-Альтмана воспроизводимого ответа CFTR со стимуляцией форсколином по сравнению с контролем ДМСО в клетках Caco-2. Черные точки представляют собой максимальные абсолютные изменения флуоресценции в ответ на стимуляцию форсколином. Серые точки представляют собой изменения флуоресценции в ответ на контроль ДМСО. Сокращения: CFTR = регулятор трансмембранной проводимости муковисцидоза; ДМСО = диметилсульфоксид; IQR = межквартильный диапазон; Fsk = форсколин; ΔF/F0 = изменение флуоресценции. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
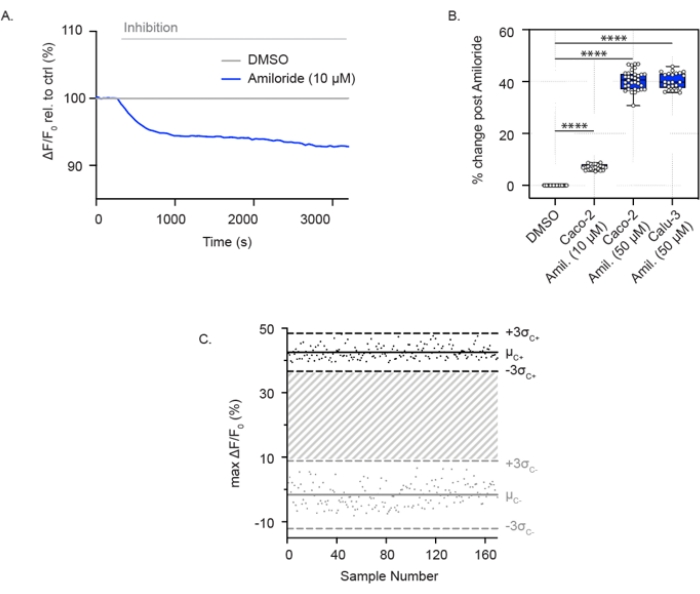
Рисунок 2: Измерения ингибирования ENaC посредством мембранной гиперполяризации в клетках Caco-2 и Calu-3. (A) Репрезентативный след ингибирования ENaC амилоридом (10 мкМ) по сравнению с контролем ДМСО в клетках Caco-2. (B) График ингибирования амилоридов в клетках Caco-2 и Calu-3 (**** P < 0,0001, n > 3 биологических репликатов, n > 3 технических репликатов). (C) График Бланда-Альтмана воспроизводимого ответа ENaC с ингибированием амилорида по сравнению с контролем ДМСО в клетках Calu-3. Черные точки представляют собой максимальные абсолютные изменения флуоресценции в ответ на ингибирование амилоридов. Серые точки представляют собой изменения флуоресценции в ответ на контроль ДМСО. Сокращения: ENaC = эпителиальный натриевый канал; ДМСО = диметилсульфоксид; Амиль. = амилорид; ΔF/F0 = изменение флуоресценции. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
| Имя | Концентрация |
| NMDG (N-метил-D-глюкамин) | 150 мМ |
| Глюконовая кислота Лактон | 150 мМ |
| Глюконат калия | 3 мМ |
| ХЕПЕС | 10 мМ |
Таблица 1: Реагенты и соответствующие им концентрации для функционального анализа CFTR с нулевым содержанием натрия и хлорида. Аббревиатура: CFTR = регулятор трансмембранной проводимости муковисцидоза.
| Имя | Концентрация |
| Глюконат натрия | 150 мМ |
| Глюконат калия | 3 мМ |
| ХЕПЕС | 10 мМ |
Таблица 2: Реагенты и соответствующие им концентрации для функционального пробирного буфера ENaC с высоким содержанием натрия и нулевым содержанием хлоридов. Аббревиатура: ENaC = эпителиальный натриевый (Na) канал.
Обсуждение
Здесь мы описали основанные на флуоресценции методы измерения активности CFTR и ENaC в эпителиальной клеточной линии колоректального рака Caco-2 и клеточной линии эпителиального рака легких человека Calu-3. Эти анализы мембранного потенциала в эпителиальных клеточных линиях могут быть использованы для подтверждения эффективности низкомолекулярных модуляторных соединений, ранее идентифицированных в гетерологичных системах экспрессии, до окончательной валидации in vitro в первичных эпителиальных культурах, полученных от пациентов.
Крайне важно подтвердить, что вышеуказанные измерения надлежащим образом отнесены к интересующему каналу. Например, измерение, приписываемое CFTR, должно показывать зависимость от экспрессии белка CFTR и электрохимической движущей силы хлорида, которая модулируется форсколином и ингибитором CFTRInh-172. Аналогичным образом, изменения мембранного потенциала, вызванные амилоридом 10 мкМ, могут быть отнесены к ENaC, если они зависят от экспрессии белка ENaC и внутренней движущей силы натрия. Хотя мы подтвердили эти свойства ENaC в клетках MDCK после трансфекции всеми тремя субъединицами ENaC 2, мы еще официально не подтвердили, что амилоридный ответ, измеренный в клетках Caco-2 и Calu-3, обеспечивается ENaC. Это особенно важно, так как амилорид может модулировать функцию натрий-протонного обменника NHE3 в дополнение к ENaC13. Можно предположить, что гиперполяризация, индуцированная амилоридом, наблюдаемая в этом анализе, может частично отражать косвенные эффекты внутриклеточного подкисления на другие каналы. Чтобы подтвердить, что гиперполяризация, индуцированная амилоридом, измеренная с использованием этого мембранного потенциал-чувствительного красителя, обеспечивается ENaC в вышеуказанных клеточных линиях и более сложных клеточных системах, таких как ткани, полученные из iPSC, мы подтверждаем, что эта активность теряется путем выбивания облигатной субъединицы ENaC (бета) в этих линиях.
Успех этих анализов требует внимания к нескольким факторам. Во-первых, эпителиальные культуры должны быть сливающимися и хорошо дифференцированными. Для измерения функции CFTR и ENaC примерно 145 000 ячеек должны быть нанесены на лунку в 96-луночных планшетах или 45 000 ячеек на лунку в 384-луночных планшетах. Как только эпителиальные клетки достигнут слияния (в течение 3-4 дней после покрытия), дайте 2-5 дней дифференцировки. Это время было определено ранее на основе максимальной экспрессии белка CFTR путем иммуноблоттинга14. Аналогичным образом, оптимальное время было определено для функциональной экспрессии ENaC в обеих клеточных линиях, Calu-3 и Caco-2.
Несливающиеся монослои или чрезмерный рост клеток приводит к низкой воспроизводимости технических реплик. В тех случаях, когда ячейки в отдельных лунках не достигают слияния одновременно, эти пластины следует выбросить. Кроме того, нестабильные исходные показания или отсутствие реакций стимуляции могут указывать на плохое качество клеток, что должно быть исключено из анализа. Снижение реакции на активатор CFTR, форсколин, или ингибитор ENaC, амилорид, потенциально может отражать использование чрезмерно пассированных клеток15. Хотя это не проблема для клеток Calu-3 и Caco-2, другие клетки или ткани могут плохо прилипать к пластинам и могут потребовать предварительного покрытия лунок. Например, в предыдущих исследованиях 2D-культуры холангиоцитов прикреплялись к пластинам с помощью коллагенового покрытия16. В качестве альтернативы, адгезия 2D-тканей кишечника была увеличена с помощью поли-L-лизина2.
Кроме того, при тестировании модуляции ионных каналов малыми молекулами с использованием анализа на основе флуоресценции крайне важно учитывать потенциальные артефакты, обусловленные флуоресцентными свойствами малых молекул. Чтобы подтвердить специфичность функциональных реакций, анализы мембранного потенциала могут быть дополнительно подтверждены с использованием обычных электрофизиологических методов, таких как исследования Ussing17.
После подтверждения того, что ответ, обнаруженный мембранными потенциал-чувствительными красителями, специфически придается интересующим каналом, эти анализы обладают огромным потенциалом для проверки перспективных модуляторов эпителиальных ионных каналов в их соответствующем клеточном контексте. Эта платформа может преодолеть разрыв между высокопроизводительными экранами модуляторов в гетерологичных системах экспрессии и трудоемкими биоэлектрическими измерениями в труднодоступных первичных тканях.
Раскрытие информации
Авторы заявляют об отсутствии конкурирующих интересов.
Благодарности
Авторы выражают благодарность Кристоферу Флэдду (Christopher Fladd) и Биоцентру SPARC в Госпитале для больных детей за помощь в проведении анализов мембранного потенциала для измерения CFTR и ENaC. Эта работа была поддержана программой CFIT при финансировании, предоставленном CF Canada и Sick Kids Foundation. Эта работа финансировалась правительством Канады через Genome Canada и Институт геномики Онтарио (OGI-148). Это исследование финансировалось правительством Онтарио. S.X. был поддержан Канадской ассоциацией гастроэнтерологов (CAG) Ph.D. Стипендия.
Материалы
| Name | Company | Catalog Number | Comments |
| Amiloride | Spectrum Chemical | TCI-A2599-5G | Dissolved in DMSO and stored at -20 °C |
| CFTRInh-172 | CF Foundation Therapeutics | Dissolved in DMSO and stored at -20 °C | |
| EMEM, 1xs | Wisent | 320-005-CL | |
| Fetal Bovine Serum (FBS) | Wisent | 080-450 | |
| FLIPR Membrane Potential Dye | Molecular Devices | R8042 | Stored at 4 °C |
| Forskolin | Sigma-Aldrich | F3917 | Dissolved in DMSO and stored at -20 °C |
| Gluconic acid lactone or (D-(+)-Gluconic acid δ-lactone) | Sigma-Aldrich | G4750 | Stored at room temperature |
| HEPES | Bioshop | HEP001.5 | Stored at room temperature |
| Human Bronchial Adenocarcinoma Cell Line (Calu-3) | ATCC | HTB-55 | |
| Human Epithelial Colorectal Adenocarcinoma Cell Line (Caco-2) | ATCC | HTB-37 | |
| N-Methyl-D-glucamine (NMDG | Sigma-Aldrich | M2004 | Stored at room temperature |
| Penicillin-Streptomycin Solution | Wisent | 450-200-EL | |
| Phosphate-Buffered Saline (PBS) | Wisent | 311-010-CL | |
| Potassium Gluconate | Sigma-Aldrich | P1847 | Stored at room temperature |
| Sodium Gluconate | Sigma-Aldrich | G9005 | Stored at room temperature |
Ссылки
- Ahmadi, S., et al. Phenotypic profiling of CFTR modulators in patient-derived respiratory epithelia. NPJ Genomic Medicine. 2, 12 (2017).
- Xia, S., et al. High-throughput functional analysis of CFTR and other apically localized proteins in iPSC-derived human intestinal organoids. Cells. 10 (12), 3419 (2021).
- Jiang, J. X., et al. A new platform for high-throughput therapy testing on iPSC-derived lung progenitor cells from cystic fibrosis patients. Stem Cell Reports. 16 (11), 2825-2837 (2021).
- Hu, J., et al. Human Embryonic Kidney 293 Cells: a vehicle for biopharmaceutical manufacturing, structural biology, and electrophysiology. Cells, Tissues, Organs. 205 (1), 1-8 (2018).
- Hadida, S., et al. Discovery of N-(2,4-di-tert-butyl-5-hydroxyphenyl)-4-oxo-1,4-dihydroquinoline-3-carboxamide (VX-770, ivacaftor), a potent and orally bioavailable CFTR potentiator. Journal of Medicinal Chemistry. 57 (23), 9776-9795 (2014).
- Chen, M. X., et al. Validation and optimization of novel high-throughput assays for human epithelial sodium channels. Journal of Biomolecular Screening. 20 (2), 242-253 (2015).
- Maitra, R., Sivashanmugam, P., Warner, K. A rapid membrane potential assay to monitor CFTR function and inhibition. Journal of Biomolecular Screening. 18 (9), 1132-1137 (2013).
- Mall, M. A. ENaC inhibition in cystic fibrosis: potential role in the new era of CFTR modulator therapies. European Respiratory Journal. 56 (6), 2000946 (2020).
- Moore, P. J., Tarran, R. The epithelial sodium channel (ENaC) as a therapeutic target for cystic fibrosis lung disease. Expert Opinion on Therapeutic Targets. 22 (8), 687-701 (2018).
- Stutts, M. J., et al. CFTR as a cAMP-dependent regulator of sodium channels. Science. 269 (5225), 847-850 (1995).
- Merkert, S., et al. High-throughput screening for modulators of CFTR activity based on genetically engineered cystic fibrosis disease-specific iPSCs. Stem Cell Reports. 12 (6), 1389-1403 (2019).
- Bertrand, C. A., et al. The CFTR trafficking mutation F508del inhibits the constitutive activity of SLC26A9. American Journal of Physiology. Lung Cellular and Molecular Physiology. 312 (6), 912-925 (2017).
- Frelin, C., et al. Amiloride and its analogs as tools to inhibit Na+ transport via the Na+ channel the Na+/H+ antiport and the Na+/Ca2+ exchanger. Biochimie. 70 (9), 1285-1290 (1988).
- Di Paola, M., et al. SLC6A14 is a genetic modifier of cystic fibrosis that regulates Pseudomonas aeruginosa attachment to human bronchial epithelial cells. mBio. 8 (6), 02073 (2017).
- Schiavi, S. C., et al. Biosynthetic and growth abnormalities are associated with high-level expression of CFTR in heterologous cells. American Journal of Physiology. 270, 341-351 (1996).
- Ogawa, M., et al. Generation of functional ciliated cholangiocytes from human pluripotent stem cells. Nature Communications. 12 (1), 6504 (2021).
- Lu, C., Pribanic, S., Debonneville, A., Jiang, C., Rotin, D. The PY motif of ENaC, mutated in Liddle syndrome, regulates channel internalization, sorting and mobilization from subapical pool. Traffic. 8 (9), 1246-1264 (2007).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены