Method Article
Essai basé sur la fluorescence du potentiel membranaire pour l’étude fonctionnelle à haut débit de deux canaux ioniques endogènes dans deux lignées cellulaires épithéliales
Dans cet article
Résumé
Ce protocole décrit une méthode pour l’étude des protéines membranaires électrogènes en mesurant les changements dans le potentiel membranaire. Ce test fournit une plate-forme pour la lecture fonctionnelle de multiples canaux ioniques exprimés de manière endogène dans des lignées cellulaires épithéliales.
Résumé
Les études basées sur la fluorescence conviennent aux essais de lecture de plaques à haut débit de cellules en culture. Ils ont été couramment utilisés pour les campagnes de découverte de médicaments ciblant les protéines des canaux ioniques recombinants surexprimées dans des cellules telles que les cellules HEK-293. Cependant, on met de plus en plus l’accent sur l’utilisation de lignées cellulaires pertinentes pour les tissus pour étudier les effets des interventions à petites molécules. Le protocole suivant décrit l’adaptation d’un test de potentiel membranaire basé sur la fluorescence pour l’étude des canaux ioniques exprimés de manière endogène dans les lignées cellulaires épithéliales. Le test de potentiel membranaire détaille un test à haut débit pour l’activité des canaux chlorures du régulateur de conductance transmembranaire de la fibrose kystique (CFTR) dans deux lignées cellulaires épithéliales couramment étudiées, Caco-2 et Calu-3. En outre, cet article décrit une nouvelle application de ce système pour mesurer l’activité du canal sodique épithélial (ENaC) dans un format à haut débit dans les mêmes lignées cellulaires épithéliales. Ensemble, ces tests basés sur la fluorescence fournissent une plate-forme robuste et flexible pour étudier les modulateurs de petites molécules, ciblant deux canaux épithéliaux dans un contexte cellulaire pertinent.
Introduction
Les essais d’activité à haut débit basés sur la fluorescence des protéines des canaux recombinants ont été très efficaces pour identifier les modulateurs de petites molécules qui ont le potentiel de devenir de futures thérapies 1,2,3,4. Une méthode courante de criblage de petites bibliothèques de molécules pour les modulateurs de canaux ioniques consiste à mesurer les changements dans le potentiel membranaire. Typiquement, ces criblages sont réalisés à l’aide de canaux recombinants exprimés de manière hétérologique dans des lignées cellulaires telles que les cellules HEK-293 5,6,7.
Cependant, il est nécessaire de valider les « résultats positifs » dans les types de cellules pertinents. Nous proposons qu’un dépistage secondaire dans les lignées cellulaires pertinentes qui expriment de manière endogène les canaux d’intérêt est souhaitable. Un tel criblage secondaire permettra d’identifier les modulateurs les plus susceptibles d’être efficaces dans les tests de validation finale qui reposent sur des tissus humains primaires moins accessibles.
Il existe également le besoin de systèmes de dosage qui ont la flexibilité de signaler l’activité de plusieurs cibles de canaux ioniques dans le même type de tissu. Par exemple, il existe une littérature publiée de fond qui appuie le concept selon lequel le CFTR et l’ENaC interagissent fonctionnellement 8,9,10. Bien que plusieurs lignées cellulaires épithéliales bien étudiées soient connues pour exprimer à la fois le CFTR et l’ENaC, à ce jour, les conditions de dosage pour étudier les deux de manière à haut débit n’ont pas été décrites.
Ce test de potentiel membranaire basé sur la fluorescence est polyvalent, car il utilise une sonde chimique exogène pour mesurer la fonction du CFTR et de l’ENaC, évitant ainsi le besoin de sondes génétiquement codées11. Comme preuve de principe, deux lignées cellulaires épithéliales couramment utilisées sont étudiées à titre d’exemples pour mettre en évidence les étapes critiques nécessaires à la mesure de l’activité des canaux CFTR et ENaC.
Protocole
1. Placage cellulaire et différenciation
- Culture de cellules Calu-3 et Caco-2 dans EMEM contenant 20 % de sérum fœtal bovin (FBS) et 1 % de pénicilline-streptomycine (stylo/streptocoque) dans une fiole T-75.
- Une fois que les cellules atteignent 80-100% de confluence, aspirer le milieu du ballon T-75.
- Lavez doucement les cellules une fois avec 10 ml de solution saline tamponnée au phosphate (PBS).
- Ajouter 2 mL de trypsine/0,1 % d’EDTA préchauffé à 0,25 % à la monocouche cellulaire et placer le ballon T-75 à 37 °C pendant environ 5 minutes pour permettre aux cellules de se soulever de la surface du ballon de culture et de se dissocier en une suspension unicellulaire.
- Une fois les cellules retirées de la surface du flacon, neutraliser la réaction avec 8 mL de milieu de culture (étape 1.1) pour un total de 10 mL de suspension cellulaire.
REMARQUE : Dissocier mécaniquement les amas de cellules en une suspension unicellulaire à l’aide d’une pipette sérologique de 10 mL. - Plaquez les cellules sur une plaque de 96 puits (~140 000-150 000 cellules/puits) ou une plaque de 384 puits (~45 000-50 000 cellules/puits) à 30-40% de confluence.
- Pour plaquer une plaque pleine de 96 puits, ajouter 1,5 mL de suspension cellulaire à 18,5 mL du milieu de culture dans un tube conique de 50 mL. Après mélange, ajouter 200 μL de la suspension cellulaire à chaque puits.
- Pour plaquer une plaque pleine de 384 puits, ajouter 1 mL de la suspension cellulaire à 17 mL du milieu de culture dans un tube conique de 50 mL. Après mélange, ajouter 50 μL de la suspension cellulaire à chaque puits.
REMARQUE: Assurez-vous qu’il n’y a pas d’amas de cellules et que les cellules individuelles sont réparties uniformément dans chaque puits.
- Changez le milieu tous les 2 jours après le placage. Si les cellules n’atteignent pas la confluence en même temps entre différents puits, jetez la plaque et répétez l’étape 1.5.
- Une fois ensemencées, attendez que les cellules atteignent 100% de confluence dans les 3-5 jours. Changez le milieu 24 h avant les études fonctionnelles.
2. Préparation de la solution tampon d’essai fonctionnel CFTR
- Préparer la solution tampon sans sodium et sans chlorure avec les réactifs énumérés dans le tableau 1.
- Ajouter les réactifs à la qualité de culture tissulaire, doubledistillé H 2 O (ddH2O). Laisser les réactifs se dissoudre (dans un récipient fermé pour éviter l’évaporation) en agitant pendant une nuit à température ambiante.
- Une fois la solution stable, mesurez le pH. Si le pH de la solution dépasse 7,4, ajouter 1 M de solution de N-méthyl-D-glucamine (NMDG) goutte à goutte pour ajuster le pH à 7,4.
NOTE: Ne pas ajuster le pH de la solution avec HCl car la solution doit rester sans chlorure. - Laisser la solution se mélanger pendant encore 30 minutes et mesurer l’osmolarité de la solution.
- Réduire l’osmolarité de la solution tampon à une plage physiologique de 300 ± 5 mOsm/kg.
- Filtrer et conserver la solution tampon dans des flacons stériles.
REMARQUE: La solution peut être conservée à 4 °C jusqu’à 6 mois. Si conservé pendant plus de 6 mois, vérifier le pH et l’osmolarité à température ambiante avant utilisation.
3. Essai fonctionnel CFTR
- Dissoudre le colorant potentiel membranaire dans la solution tampon sans sodium et sans chlorure (0,5 mg de colorant/1 mL de solution tampon) et le réchauffer à 37 °C.
REMARQUE: Évitez d’exposer la poudre de colorant potentiel de la membrane à la lumière. - Retirer le milieu de culture des monocouches cellulaires Calu-3 ou Caco-2 et ajouter la solution contenant du colorant à chaque puits (195 μL par puits pour une plaque de 96 puits, 95 μL par puits pour une plaque de 384 puits).
REMARQUE : Jusqu’à 112 μL peuvent être ajoutés par puits de plaques de 384 puits. - Laisser les cellules charger le colorant pendant 35 min à 37 °C et 5 % de CO2.
- Déplacez les cellules, chargées de solution de colorant, vers le lecteur de plaque de fluorescence. Prendre des mesures de fluorescence à partir du bas de la plaque, avec excitation = 530 ± 5 nm, émission = 560 ± 5 nm
- Commencez par prendre des lectures de base continues pendant 5 minutes à intervalles de 30 s.
- Ajouter 5 μL d’une solution à faible concentration de forskoline ou de DMSO à chaque puits pour obtenir une concentration finale de 1 μM de forskoline (1x). Prenez une lecture de stimulation pendant 20 min avec des mesures à intervalles de 15 s.
- Pour le format sur plaque à 96 puits, préparer la solution de forskoline à faible concentration (40 μM de forskoline (dilution 1:25)) en diluant 2 μL de 1 mM de solution mère de forskoline (1 000x) ou de DMSO dans 48 μL de solution tampon sans sodium et sans chlorure.
NOTE: La forskoline à faible concentration de 40 μM est suivie d’une deuxième dilution (dilution de 1:40) à l’étape suivante pour une concentration finale de 1 μM de forskoline. - Pour le format de plaque à 384 puits, préparer la solution à faible concentration (20 μM de forskoline (dilution 1:50)) en diluant 1 μL de 1 mM (1 000x) de solution mère de forskoline ou de DMSO dans 49 μL de solution tampon sans sodium et sans chlorure.
NOTE: La forskoline à faible concentration de 20 μM est suivie d’une deuxième dilution (dilution de 1:20) à l’étape suivante pour une concentration finale de 1 μM de forskoline.
- Pour le format sur plaque à 96 puits, préparer la solution de forskoline à faible concentration (40 μM de forskoline (dilution 1:25)) en diluant 2 μL de 1 mM de solution mère de forskoline (1 000x) ou de DMSO dans 48 μL de solution tampon sans sodium et sans chlorure.
- Ajouter 5 μL de solution à faible concentration de CFTRInh172 pour une concentration finale de 10 μM CFTRInh172. Prendre une lecture d’inhibition pendant 15 min avec des mesures à intervalles de 30 s.
- Pour le format de plaque à 96 puits, préparer la solution CFTRInh172 à faible concentration (400 μM CFTRInh172 (dilution 1:25)) en diluant 2 μL d’une solution mère de 10 mM CFTRInh172 (1 000x) dans 48 μL de solution tampon sans sodium et sans chlorure.
NOTA: La faible concentration de 400 μM CFTRInh172 est suivie d’une deuxième dilution (dilution de 1:40) à l’étape suivante pour une concentration finale de 10 μM CFTRInh172. - Pour le format de plaque à 384 puits, préparer la solution CFTRInh172 à faible concentration (200 μM CFTRInh172 (dilution 1:50)) en diluant 1 μL de 10 mM de solution mère CFTRInh172 (1 000x) dans 49 μL de solution tampon sans sodium et sans chlorure.
NOTA: La faible concentration 200 μM CFTRInh172 est suivie d’une deuxième dilution (dilution 1:20) à l’étape suivante pour une concentration finale de 10 μM CFTRInh172.
- Pour le format de plaque à 96 puits, préparer la solution CFTRInh172 à faible concentration (400 μM CFTRInh172 (dilution 1:25)) en diluant 2 μL d’une solution mère de 10 mM CFTRInh172 (1 000x) dans 48 μL de solution tampon sans sodium et sans chlorure.
- Quantifier les mesures d’intensité de fluorescence de chaque puits et exporter les valeurs sous forme de feuille de calcul sous forme de colonne contenant des puits individuels. Pour calculer les changements induits par la forskoline, divisez les mesures RFU (unités de fluorescence relative) de chaque puits de la plaque de 96 ou 384 puits par la dernière mesure d’intensité de fluorescence de la lecture de base et tracez-les.
- Alternativement, quantifier la réponse d’inhibition médiée par CFTRInh172 pour mieux confirmer la spécificité de la fonction CFTR 12, car le traitement aigu par la forskoline peut entraîner une dépolarisation de la membrane par l’activité d’autres canaux chlorure, tels que SLC26A912.
- Mesurer les réponses maximales en tant que mesure de l’intensité de fluorescence maximale à partir de la ligne de base pendant la stimulation de la forskoline. Utilisez cette mesure ou cette aire sous la courbe pour quantifier la réponse CFTR.
4. Préparation de la solution tampon d’essai fonctionnel ENaC
- Préparer la solution tampon riche en sodium et sans chlorure avec les réactifs énumérés dans le tableau 2.
- Une fois la solution stable, mesurez le pH. Si le pH de la solution est inférieur à 7,4, ajouter 1 N NaOH solution goutte à goutte pour ajuster le pH à 7,4.
NOTE: Ne pas ajuster le pH de la solution avec HCl car la solution doit rester sans chlorure. - Réduire l’osmolarité de la solution tampon à une plage physiologique de 300 ± 5 mOsm/kg.
- Filtrer et conserver la solution tampon dans des flacons stériles à 4 °C pendant 6 mois maximum.
NOTE: Si la conservation dure plus de 6 mois, vérifier le pH et l’osmolarité à température ambiante avant utilisation.
5. Essai fonctionnel ENaC
- Dissoudre le colorant potentiel membranaire dans la solution tampon à haute teneur en sodium et sans chlorure (0,5 mg de colorant/1 mL de solution tampon) et le réchauffer à 37 °C.
REMARQUE: Évitez d’exposer la poudre de colorant potentiel de la membrane à la lumière. - Retirer le milieu de culture des monocouches cellulaires Calu-3 ou Caco-2 et ajouter la solution contenant du colorant à chaque puits (195 μL par puits pour les plaques de 96 puits, 95 μL par puits pour les plaques de 384 puits).
REMARQUE: Évitez d’exposer la solution de colorant à la lumière. - Laisser les cellules charger le colorant pendant 35 min à 37 °C et 5% de CO2.
- Déplacez les cellules, chargées de solution de colorant, vers le lecteur de plaque de fluorescence. Lire les mesures de fluorescence à partir du fond de la plaque, avec excitation = 530 ± 5 nm, émission = 560 ± 5 nm.
- Commencez par prendre des lectures de base continues pendant 5 minutes à intervalles de 30 s.
- Pour inhiber la fonction ENaC, ajouter 5 μL de solution d’amiloride à faible concentration ou de solution de DMSO à faible concentration dissous dans la solution tampon à haute teneur en sodium et sans chlorure pour une concentration finale de 10 μM d’amiloride.
- Pour le format sur plaque à 96 puits, préparer la solution d’amiloride à faible concentration (400 μM d’amiloride (dilution 1:25)) en diluant 2 μL de solution mère d’amiloride 10 mM (1 000x) dans 48 μL de solution tampon riche en sodium et sans chlorure.
NOTE: L’amiloride 400 μM à faible concentration est suivi d’une deuxième dilution (dilution de 1:40) à l’étape suivante pour une concentration finale d’amiloride de 10 μM. - Pour le format de plaque à 384 puits, préparer la solution d’amiloride à faible concentration (amiloride 200 μM (dilution 1:50)) en ajoutant 1 μL de solution mère d’amiloride 10 mM (1 000x) dans 49 μL de solution tampon riche en sodium et sans chlorure.
NOTA: L’amiloride à faible concentration de 200 μM est suivi d’une deuxième dilution (dilution de 1:20) à l’étape suivante pour une concentration finale d’amiloride de 10 μM.
- Pour le format sur plaque à 96 puits, préparer la solution d’amiloride à faible concentration (400 μM d’amiloride (dilution 1:25)) en diluant 2 μL de solution mère d’amiloride 10 mM (1 000x) dans 48 μL de solution tampon riche en sodium et sans chlorure.
- Prendre une lecture d’inhibition pendant 60 min avec des mesures à intervalles de 45 s.
- Répétez l’étape 3.7 pour l’analyse des données.
- Mesurer la réponse amiloride en pourcentage d’inhibition entre le début de l’étude et le plateau, environ 15 à 20 minutes après l’ajout d’amilorides. Utilisez cette différence pour quantifier la réponse ENaC.
Résultats
Pour mesurer l’activité du canal CFTR, des cellules adhérentes bien différenciées sont incubées dans une solution extracellulaire sans chlorure contenant le colorant sensible au potentiel membranaire. La fonction CFTR est systématiquement détectée comme une dépolarisation de la membrane après stimulation de la forskoline. L’efflux de chlorure est détecté comme une forte augmentation de la fluorescence par rapport à la commande du véhicule. Le signal de fluorescence est maintenu jusqu’à l’ajout de l’inhibiteur de CFTR (CFTRInh172), conduisant à une baisse rapide de l’intensité de fluorescence, comme on le voit dans les cellules Caco-2 (Figure 1A), et est reproductible dans les cellules Caco-2 et Calu-3 (Figure 1B). L’évaluation de l’activité CFTR comme la différence dans le changement maximal de fluorescence après la forskoline ou le DMSO (véhicule). Les points individuels variaient entre ± 3 écarts-types de la stimulation moyenne de la forskoline (points noirs) ou du contrôle DMSO (points gris), ce qui correspondait à un facteur Z de 0,586. Cet excellent score indiquait la reproductibilité de ce test (Figure 1C). En cas de dérive mineure dans la ligne de base, l’impact de la dérive peut être minimisé en extrapolant la ligne de base dans toute la trace après activation jusqu’au point d’ajout d’inhibiteur. La réponse peut être quantifiée comme l’aire sous la courbe, avec la limite inférieure définie par la ligne extrapolée.
L’activité ENaC peut également être mesurée dans les cellules épithéliales confluentes des voies respiratoires et du côlon cultivées dans des plaques à 96 puits. Contrairement au test de l’activité des canaux CFTR, ces cellules sont immergées dans une solution riche en sodium, ce qui permet l’absorption du sodium par ENaC. Avec l’ajout aigu d’amiloride, l’absorption de sodium est bloquée et les cellules subissent une hyperpolarisation relative de la membrane. Ceci est montré dans les cellules Caco-2 à des concentrations faibles (10 μM) (Figure 2A) et élevées (50 μM) d’amiloride (Figure 2A,B) et dans les cellules Calu-3 avec une concentration élevée d’amiloride (50 μM) (Figure 2B). Le test ENaC a été étendu à un format de plaque à 384 puits et a démontré une grande reproductibilité dans l’inhibition de l’ENaC. De même, les points individuels variaient entre ± 3 écarts-types par rapport à l’inhibition moyenne de l’amiloride (points noirs) ou au contrôle DMSO (points gris). La réponse ENaC dans les cellules Calu-3 a rapporté un facteur Z' de 0,629 avec un traitement aigu par amiloride (50 μM) (Figure 2C), ce qui indique que ces paramètres favorisent le criblage à haut débit.
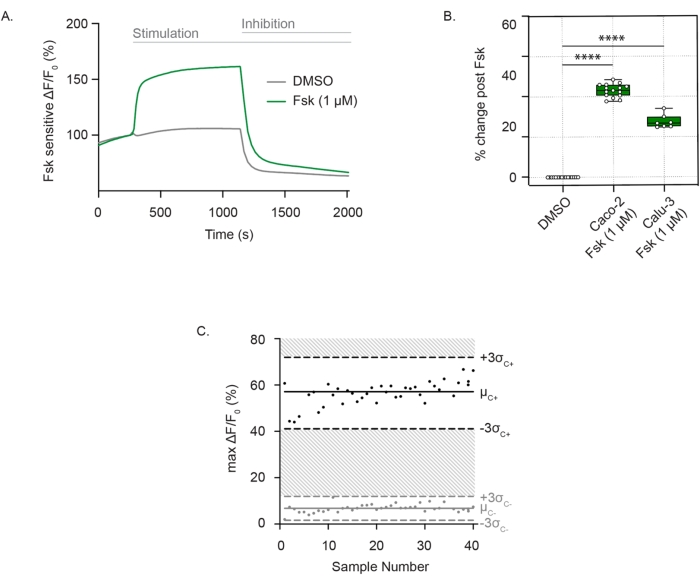
Figure 1 : Mesure du canal CFTR en tant que changements dans la dépolarisation de la membrane dans les cellules Caco-2 et Calu-3. (A) Trace représentative de la stimulation CFTR avec la forskoline (1 μM) et du contrôle du DMSO dans les cellules Caco-2. (B) Diagramme en boîte et moustache de stimulation de la forskoline dans les cellules Caco-2 et Calu-3 (**** P < 0,0001, n > 3 réplications biologiques, n > 3 réplications techniques). Les réplications biologiques sont des passages de lignées cellulaires indépendants; Les répliques techniques font référence à des puits indépendants des plaques multipuits. Le diagramme en boîte représente la valeur médiane; Les limites représentent l’IQR, les moustaches définissant les valeurs minimales et maximales. (C) Diagramme de Bland-Altman de la réponse CFTR reproductible avec stimulation de la forskoline par rapport au contrôle du DMSO dans les cellules Caco-2. Les points noirs représentent les changements absolus maximaux de la fluorescence en réponse à la stimulation de la forskoline. Les points gris représentent les changements de fluorescence en réponse au contrôle du DMSO. Abréviations : CFTR = Cystic Fibrosis Transmembrane Conductance Regulator; DMSO = diméthylsulfoxyde; IQR = intervalle interquartile; Fsk = forskoline; ΔF/F0 = changement de fluorescence. Veuillez cliquer ici pour voir une version agrandie de cette figure.
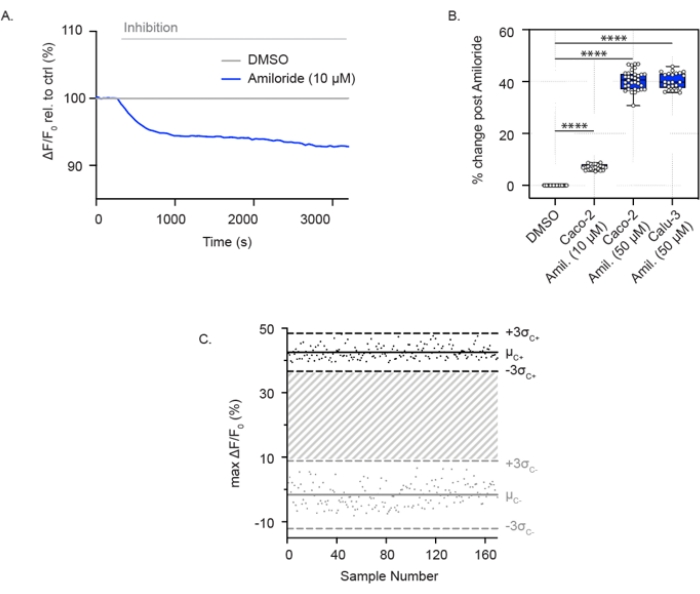
Figure 2 : Mesures d’inhibition de l’ENaC par hyperpolarisation membranaire dans les cellules Caco-2 et Calu-3. (A) Trace représentative de l’inhibition de l’ENaC avec l’amiloride (10 μM) par rapport au contrôle du DMSO dans les cellules Caco-2. (B) Diagramme en boîte et moustache de l’inhibition de l’amiloride dans les cellules Caco-2 et Calu-3 (**** P < 0,0001, n > 3 réplicats biologiques, n > 3 réplications techniques). (C) Diagramme de Bland-Altman de la réponse reproductible de l’ENaC avec inhibition de l’amiloride par rapport au contrôle du DMSO dans les cellules Calu-3. Les points noirs représentent les changements absolus maximaux de fluorescence en réponse à l’inhibition de l’amiloride. Les points gris représentent les changements de fluorescence en réponse au contrôle du DMSO. Abréviations : ENaC = canal sodique épithélial; DMSO = diméthylsulfoxyde; Amil. = amiloride; ΔF/F0 = changement de fluorescence. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Nom | Concentration |
| NMDG (N-méthyl-D-glucamine) | 150 mM |
| Lactone d’acide gluconique | 150 mM |
| Potassium Gluconate | 3 mM |
| HEPES | 10 mM |
Tableau 1 : Réactifs et leurs concentrations correspondantes pour l’essai fonctionnel CFTR avec zéro sodium ni chlorure. Abréviation : CFTR = Cystic Fibrosis Transmembrane Conductance Regulator.
| Nom | Concentration |
| Sodium Gluconate | 150 mM |
| Potassium Gluconate | 3 mM |
| HEPES | 10 mM |
Tableau 2 : Réactifs et leurs concentrations correspondantes pour le tampon d’essai fonctionnel ENaC à haute teneur en sodium et sans chlorure. Abréviation : ENaC = Canal épithélial sodique (Na).
Discussion
Ici, nous avons décrit des méthodes basées sur la fluorescence pour mesurer l’activité CFTR et ENaC dans la lignée cellulaire du cancer colorectal épithélial, Caco-2, et la lignée cellulaire du cancer du poumon épithélial humain, Calu-3. Ces essais de potentiel membranaire dans des lignées cellulaires épithéliales peuvent être utilisés pour confirmer l’efficacité de composés modulateurs de petites molécules, préalablement identifiés dans des systèmes d’expression hétérologue, avant la validation in vitro finale dans des cultures épithéliales primaires dérivées de patients.
Il est impératif de confirmer que les mesures ci-dessus sont correctement attribuées au canal d’intérêt. Par exemple, la mesure attribuée au CFTR devrait montrer une dépendance à l’expression de la protéine CFTR et à la force motrice électrochimique du chlorure, qui est modulée par la forskoline et l’inhibiteur CFTRInh-172. De même, les changements de potentiel membranaire causés par l’amiloride 10 μM peuvent être attribués à l’ENaC, s’ils dépendent de l’expression de la protéine ENaC et d’une force motrice de sodium vers l’intérieur. Bien que nous ayons confirmé ces propriétés de l’ENaC dans les cellules MDCK après transfection avec les trois sous-unités d’ENaC 2, nous n’avons pas encore formellement confirmé que la réponse amiloride mesurée dans les cellules Caco-2 et Calu-3 est conférée par ENaC. Ceci est particulièrement important, car l’amiloride peut moduler la fonction de l’échangeur sodium-proton NHE3 en plus de l’ENaC13. Il est concevable que l’hyperpolarisation induite par les amilorides observée dans ce test reflète partiellement les effets indirects de l’acidification intracellulaire sur d’autres canaux. Pour confirmer que l’hyperpolarisation induite par l’amiloride mesurée à l’aide de ce colorant sensible au potentiel membranaire est conférée par ENaC dans les lignées cellulaires ci-dessus et les systèmes cellulaires plus complexes, tels que les tissus dérivés de l’iPSC, nous confirmons que cette activité est perdue en éliminant une sous-unité ENaC obligatoire (bêta) dans ces lignées.
Le succès de ces tests nécessite une attention particulière à plusieurs facteurs. Premièrement, les cultures épithéliales doivent être confluentes et bien différenciées. Pour la mesure de la fonction CFTR et ENaC, environ 145 000 cellules doivent être plaquées par puits dans des plaques de 96 puits ou 45 000 cellules par puits dans des plaques de 384 puits. Une fois que les cellules épithéliales atteignent la confluence (dans les 3-4 jours suivant le placage), prévoyez 2-5 jours de différenciation. Ce moment a été déterminé précédemment sur la base de l’expression maximale de la protéine CFTR par immunoblot14. De même, le moment optimal a été déterminé pour l’expression fonctionnelle de l’ENaC dans les deux lignées cellulaires, Calu-3 et Caco-2.
Les monocouches non confluentes ou la prolifération cellulaire entraînent une faible reproductibilité entre les réplications techniques. Dans les cas où les cellules dans les puits individuels n’atteignent pas la confluence en même temps, ces plaques doivent être jetées. De plus, des lectures de base instables ou l’absence de réponses de stimulation peuvent être une indication d’une mauvaise qualité cellulaire, qui doit être exclue de l’analyse. Des réponses réduites à l’activateur du CFTR, la forskoline, ou à l’inhibiteur de l’ENaC, l’amiloride, pourraient potentiellement refléter l’utilisation de cellules excessivement passées15. Bien que ce ne soit pas un problème pour les cellules Calu-3 et Caco-2, d’autres cellules ou tissus peuvent ne pas adhérer bien aux plaques et peuvent nécessiter un prérevêtement des puits. Par exemple, dans des études antérieures, des cultures de cholangiocytes 2D ont été fixées aux plaques à l’aide d’un revêtement de collagène16. Alternativement, l’adhérence des tissus intestinaux 2D a été augmentée en utilisant Poly-L-Lysine2.
De plus, en testant la modulation des canaux ioniques par de petites molécules à l’aide d’un essai basé sur la fluorescence, il est essentiel que les artefacts potentiels conférés par les propriétés fluorescentes des petites molécules soient pris en compte. Pour confirmer la spécificité des réponses fonctionnelles, les essais de potentiel membranaire peuvent être validés davantage à l’aide de méthodes électrophysiologiques conventionnelles, telles que les études Ussing17.
Après avoir confirmé que la réponse détectée par les colorants sensibles au potentiel membranaire est spécifiquement conférée par le canal d’intérêt, ces essais ont un potentiel énorme pour valider les modulateurs prometteurs des canaux ioniques épithéliaux dans leur contexte cellulaire pertinent. Cette plate-forme peut combler le fossé entre les cribles modulateurs à haut débit dans les systèmes d’expression hétérologues et les mesures bioélectriques chronophages dans les tissus primaires difficiles d’accès.
Déclarations de divulgation
Les auteurs ne déclarent aucun intérêt concurrent.
Remerciements
Les auteurs aimeraient remercier Christopher Fladd et SPARC BioCentre de l’Hospital for Sick Children pour leur aide dans la réalisation des tests de potentiel membranaire mesurant le CFTR et l’ENaC. Ce travail a été soutenu par le programme CFIT grâce au financement de CF Canada et de la Sick Kids Foundation. Ces travaux ont été financés par le gouvernement du Canada par l’entremise de Génome Canada et de l’Institut de génomique de l’Ontario (OGI-148). Cette étude a été financée par le gouvernement de l’Ontario. S.X. a reçu le soutien de la bourse de doctorat de l’Association canadienne de gastroentérologie (ACG).
matériels
| Name | Company | Catalog Number | Comments |
| Amiloride | Spectrum Chemical | TCI-A2599-5G | Dissolved in DMSO and stored at -20 °C |
| CFTRInh-172 | CF Foundation Therapeutics | Dissolved in DMSO and stored at -20 °C | |
| EMEM, 1xs | Wisent | 320-005-CL | |
| Fetal Bovine Serum (FBS) | Wisent | 080-450 | |
| FLIPR Membrane Potential Dye | Molecular Devices | R8042 | Stored at 4 °C |
| Forskolin | Sigma-Aldrich | F3917 | Dissolved in DMSO and stored at -20 °C |
| Gluconic acid lactone or (D-(+)-Gluconic acid δ-lactone) | Sigma-Aldrich | G4750 | Stored at room temperature |
| HEPES | Bioshop | HEP001.5 | Stored at room temperature |
| Human Bronchial Adenocarcinoma Cell Line (Calu-3) | ATCC | HTB-55 | |
| Human Epithelial Colorectal Adenocarcinoma Cell Line (Caco-2) | ATCC | HTB-37 | |
| N-Methyl-D-glucamine (NMDG | Sigma-Aldrich | M2004 | Stored at room temperature |
| Penicillin-Streptomycin Solution | Wisent | 450-200-EL | |
| Phosphate-Buffered Saline (PBS) | Wisent | 311-010-CL | |
| Potassium Gluconate | Sigma-Aldrich | P1847 | Stored at room temperature |
| Sodium Gluconate | Sigma-Aldrich | G9005 | Stored at room temperature |
Références
- Ahmadi, S., et al. Phenotypic profiling of CFTR modulators in patient-derived respiratory epithelia. NPJ Genomic Medicine. 2, 12 (2017).
- Xia, S., et al. High-throughput functional analysis of CFTR and other apically localized proteins in iPSC-derived human intestinal organoids. Cells. 10 (12), 3419 (2021).
- Jiang, J. X., et al. A new platform for high-throughput therapy testing on iPSC-derived lung progenitor cells from cystic fibrosis patients. Stem Cell Reports. 16 (11), 2825-2837 (2021).
- Hu, J., et al. Human Embryonic Kidney 293 Cells: a vehicle for biopharmaceutical manufacturing, structural biology, and electrophysiology. Cells, Tissues, Organs. 205 (1), 1-8 (2018).
- Hadida, S., et al. Discovery of N-(2,4-di-tert-butyl-5-hydroxyphenyl)-4-oxo-1,4-dihydroquinoline-3-carboxamide (VX-770, ivacaftor), a potent and orally bioavailable CFTR potentiator. Journal of Medicinal Chemistry. 57 (23), 9776-9795 (2014).
- Chen, M. X., et al. Validation and optimization of novel high-throughput assays for human epithelial sodium channels. Journal of Biomolecular Screening. 20 (2), 242-253 (2015).
- Maitra, R., Sivashanmugam, P., Warner, K. A rapid membrane potential assay to monitor CFTR function and inhibition. Journal of Biomolecular Screening. 18 (9), 1132-1137 (2013).
- Mall, M. A. ENaC inhibition in cystic fibrosis: potential role in the new era of CFTR modulator therapies. European Respiratory Journal. 56 (6), 2000946 (2020).
- Moore, P. J., Tarran, R. The epithelial sodium channel (ENaC) as a therapeutic target for cystic fibrosis lung disease. Expert Opinion on Therapeutic Targets. 22 (8), 687-701 (2018).
- Stutts, M. J., et al. CFTR as a cAMP-dependent regulator of sodium channels. Science. 269 (5225), 847-850 (1995).
- Merkert, S., et al. High-throughput screening for modulators of CFTR activity based on genetically engineered cystic fibrosis disease-specific iPSCs. Stem Cell Reports. 12 (6), 1389-1403 (2019).
- Bertrand, C. A., et al. The CFTR trafficking mutation F508del inhibits the constitutive activity of SLC26A9. American Journal of Physiology. Lung Cellular and Molecular Physiology. 312 (6), 912-925 (2017).
- Frelin, C., et al. Amiloride and its analogs as tools to inhibit Na+ transport via the Na+ channel the Na+/H+ antiport and the Na+/Ca2+ exchanger. Biochimie. 70 (9), 1285-1290 (1988).
- Di Paola, M., et al. SLC6A14 is a genetic modifier of cystic fibrosis that regulates Pseudomonas aeruginosa attachment to human bronchial epithelial cells. mBio. 8 (6), 02073 (2017).
- Schiavi, S. C., et al. Biosynthetic and growth abnormalities are associated with high-level expression of CFTR in heterologous cells. American Journal of Physiology. 270, 341-351 (1996).
- Ogawa, M., et al. Generation of functional ciliated cholangiocytes from human pluripotent stem cells. Nature Communications. 12 (1), 6504 (2021).
- Lu, C., Pribanic, S., Debonneville, A., Jiang, C., Rotin, D. The PY motif of ENaC, mutated in Liddle syndrome, regulates channel internalization, sorting and mobilization from subapical pool. Traffic. 8 (9), 1246-1264 (2007).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon