Method Article
두 개의 상피 세포주에서 두 개의 내인성 이온 채널에 대한 고처리량 기능 연구를 위한 막 전위의 형광 기반 분석
요약
이 프로토콜은 막 전위의 변화를 측정하여 전기적 막 단백질을 연구하는 방법을 설명합니다. 이 분석은 상피 세포주에서 내인성으로 발현되는 여러 이온 채널의 기능적 판독을 위한 플랫폼을 제공합니다.
초록
형광 기반 연구는 배양 중인 세포의 고처리량 플레이트 리더 분석에 적합합니다. 그들은 HEK-293 세포와 같은 세포에서 과발현되는 재조합 이온 채널 단백질을 표적으로 하는 약물 발견 캠페인에 일반적으로 사용되었습니다. 그러나 소분자 개입의 효과를 연구하기 위해 조직 관련 세포주의 사용에 대한 강조가 증가하고 있습니다. 다음 프로토콜은 상피 세포주에서 내인성으로 발현되는 이온 채널 연구를 위한 형광 기반 막 전위 분석의 적응을 설명합니다. 막 전위 분석은 일반적으로 연구되는 두 가지 상피 세포주인 Caco-2 및 Calu-3에서 낭포성 섬유증 막횡단 전도도 조절제(CFTR)의 염화물 채널 활성에 대한 고처리량 분석을 자세히 설명합니다. 또한, 이 논문은 동일한 상피 세포주에서 고처리량 형식으로 상피 나트륨 채널(ENaC)의 활성을 측정하기 위한 이 시스템의 새로운 응용을 설명합니다. 이러한 형광 기반 분석은 관련 세포 맥락에서 두 개의 상피 채널을 표적으로 하는 소분자 조절제를 연구하기 위한 강력하고 유연한 플랫폼을 제공합니다.
서문
재조합 채널 단백질의 형광 기반, 고처리량 활성 분석은 미래의 치료법이 될 가능성이 있는 소분자 조절제를 식별하는 데 매우 효과적이다 1,2,3,4. 이온 채널 조절제에 대한 소분자 라이브러리를 스크리닝하는 일반적인 방법 중 하나는 막 전위의 변화를 측정하는 것입니다. 전형적으로, 이들 스크리닝은 HEK-293 세포 5,6,7과 같은 세포주에서 이종학적으로 발현되는 재조합 채널을 사용하여 수행된다.
그러나, 관련 세포 유형에서 "히트"의 검증이 필요하다. 우리는 관심 채널을 내인성으로 발현하는 관련 세포주에서 2차 스크리닝이 바람직하다고 제안합니다. 이러한 2차 스크리닝은 접근하기 어려운 1차 인간 조직에 의존하는 최종 검증 분석에서 가장 효과적일 가능성이 가장 높은 조절자를 식별할 것입니다.
또한 동일한 조직 유형에서 여러 이온 채널 표적의 활성을 보고할 수 있는 유연성을 갖춘 분석 시스템이 필요합니다. 예를 들어, CFTR과 ENaC가 기능적으로 상호 작용한다는 개념을 뒷받침하는 실질적인 출판 문헌이 있습니다 8,9,10. 잘 연구된 몇몇 상피 세포주가 CFTR 및 ENaC 둘 다를 발현하는 것으로 알려져 있지만, 현재까지 고처리량 방식으로 둘 다를 연구하기 위한 분석 조건은 설명되지 않았다.
이 형광 기반 막 전위 분석은 유전적으로 암호화된 프로브11의 필요성을 우회하여 CFTR 및 ENaC의 기능을 측정하기 위해 외인성 화학 프로브를 사용하기 때문에 다재다능합니다. 원리 증명으로, CFTR과 ENaC 모두의 채널 활성을 측정하는 데 필요한 중요한 단계를 강조하기 위해 일반적으로 사용되는 두 가지 상피 세포주를 예로 연구합니다.
프로토콜
1. 세포 도금 및 분화
- T-75 플라스크에서 20% 소 태아 혈청(FBS)과 1% 페니실린-스트렙토마이신(pen/strep)을 함유한 EMEM에서 Calu-3 및 Caco-2 세포를 배양합니다.
- 세포가 80-100% 밀도에 도달하면 T-75 플라스크에서 배지를 흡인합니다.
- 10mL의 인산염 완충 식염수(PBS)로 세포를 한 번 부드럽게 세척합니다.
- 예열된 0.25% 트립신/0.1% EDTA 2mL를 세포 단층에 넣고 T-75 플라스크를 37°C에서 약 5분 동안 두어 세포가 배양 플라스크 표면에서 들어 올려 단일 세포 현탁액으로 해리되도록 합니다.
- 플라스크 표면에서 세포를 들어 올리면 총 10mL의 세포 현탁액에 대해 8mL의 배양 배지(단계 1.1)로 반응을 중화합니다.
참고: 10mL 혈청학적 피펫을 사용하여 세포 덩어리를 단일 세포 현탁액으로 기계적으로 해리합니다. - 세포를 96웰 플레이트(~140,000-150,000 세포/웰) 또는 384웰 플레이트(~45,000-50,000 세포/웰)에 30-40% 밀도로 플레이트합니다.
- 하나의 전체 96웰 플레이트를 플레이트하려면 50mL 원뿔형 튜브의 배양액 18.5mL에 세포 현탁액 1.5mL를 추가합니다. 혼합 후, 200 μL의 세포 현탁액을 각 웰에 첨가한다.
- 하나의 전체 384웰 플레이트를 플레이트하려면 50mL 코니컬 튜브의 배양 배지 17mL에 세포 현탁액 1mL를 추가합니다. 혼합 후, 50 μL의 세포 현탁액을 각 웰에 첨가한다.
알림: 세포 덩어리가 없고 단일 세포가 각 웰에 고르게 분포되어 있는지 확인합니다.
- 도금 후 2 일마다 매체를 교체하십시오. 세포가 서로 다른 웰 사이에서 동시에 합류도에 도달하지 않으면 플레이트를 버리고 1.5단계를 반복합니다.
- 파종이 완료되면 세포가 3-5일 이내에 100% 밀도에 도달할 때까지 기다립니다. 기능 연구 24시간 전에 매체를 교체하십시오.
2. CFTR 기능성 분석 완충용액 준비
- 표 1에 나열된 시약으로 나트륨이 없고 염화물이 없는 완충 용액을 준비합니다.
- 조직 배양 등급의 시약을 첨가하고, 이중 증류된 H2O(ddH2O)를 첨가한다. 시약이 실온에서 밤새 교반하여 용해되도록 합니다(증발을 피하기 위해 밀폐된 용기에서).
- 용액이 안정되면 pH를 측정합니다. 용액의 pH가 7.4를 초과하면 1M N-메틸-D-글루카민(NMDG) 용액을 적가하여 pH를 7.4로 조정합니다.
알림: 용액에 염화물이 없어야 하므로 HCl로 용액의 pH를 조정하지 마십시오. - 용액을 30분 더 혼합하고 용액의 삼투압을 측정합니다.
- 완충 용액의 삼투압을 300 ± 5mOsm/kg의 생리학적 범위로 줄입니다.
- 완충 용액을 여과하고 멸균 병에 보관하십시오.
알림: 용액은 4°C에서 최대 6개월 동안 보관할 수 있습니다. 6개월 이상 보관할 경우 실온에서 pH와 삼투압을 확인한 후 사용하십시오.
3. CFTR 기능 분석
- 멤브레인 전위 염료를 나트륨, 무염화물 완충용액(염료 0.5mg/완충액 1mL)에 녹이고 37°C로 따뜻하게 합니다.
알림: 멤브레인 전위 염료 분말을 빛에 노출시키지 마십시오. - Calu-3 또는 Caco-2 세포 단층에서 배양 배지를 제거하고 염료 함유 용액을 각 웰에 추가합니다(96웰 플레이트의 경우 웰당 195μL, 384웰 플레이트의 경우 웰당 95μL).
참고: 384웰 플레이트의 웰당 최대 112μL를 추가할 수 있습니다. - 세포가 37°C 및 5%CO2에서 35분 동안 염료를 로딩하도록 허용한다.
- 염료 용액이 적재된 세포를 형광 플레이트 판독기로 이동합니다. 여기 = 530 ± 5 nm, 방출 = 560 ± 5 nm로 플레이트 바닥에서 형광 측정을 수행합니다.
- 5초 간격으로 30분 동안 연속적인 기준선 판독값을 취하는 것으로 시작합니다.
- 포스콜린 또는 DMSO의 저농도 용액 5μL를 각 웰에 추가하여 최종 농도 1μM 포스콜린(1x)을 만듭니다. 20초 간격으로 측정하여 15분 동안 자극 판독값을 측정합니다.
- 96웰 플레이트 형식의 경우, 1mM 포스콜린(1,000x) 원액 또는 DMSO 2μL를 나트륨, 무염화물 완충액 48μL에 희석하여 포스콜린의 저농도(40μM 포스콜린(1:25 희석)) 용액을 준비합니다.
참고: 저농도 40μM 포스콜린에 이어 다음 단계에서 두 번째 희석(1μM 포스콜린의 최종 농도에 대해 40:1 희석)을 합니다. - 384웰 플레이트 형식의 경우 1mM(1,000x) 포스콜린 원액 또는 DMSO 1μL를 나트륨 무함유 무염화물 완충액 49μL에 희석하여 저농도(20μM 포스콜린(1:50 희석)) 용액을 준비합니다.
참고: 저농도 20μM 포스콜린에 이어 다음 단계에서 두 번째 희석(1:20 희석)을 거쳐 최종 농도 1μM 포스콜린을 만듭니다.
- 96웰 플레이트 형식의 경우, 1mM 포스콜린(1,000x) 원액 또는 DMSO 2μL를 나트륨, 무염화물 완충액 48μL에 희석하여 포스콜린의 저농도(40μM 포스콜린(1:25 희석)) 용액을 준비합니다.
- 최종 농도 10μM CFTRInh172에 대해 CFTRInh172의 저농도 용액 5μL을 추가합니다. 15초 간격으로 측정하여 30분 동안 억제 판독값을 측정합니다.
- 96-웰 플레이트 포맷의 경우, 10 mM CFTRInh172 (1,000x) 원액 2 μL를 48 μL의 나트륨-무함유, 무염화물 완충 용액에 희석하여 CFTRInh172 저농도 (400 μM CFTRInh172 (1:25 희석)) 용액을 제조한다.
참고 : 저농도 400 μM CFTRInh172는 다음 단계에서 두 번째 희석 (10 μM CFTRInh10 희석)에 대한 두 번째 희석 (172 : 희석)이 뒤 따른다. - 384-웰 플레이트 포맷의 경우, 10 mM CFTRInh172 (1,000x) 원액 1 μL를 49 μL의 나트륨-무함유, 무염화물 완충 용액에 희석하여 CFTRInh172 저농도 (200 μM CFTRInh172 (1:50 희석)) 용액을 준비한다.
참고: 저농도 200μM CFTRInh172에 이어 다음 단계에서 두 번째 희석(10μM CFTRInh172)의 최종 농도에 대해 두 번째 희석(1:20 희석)이 이어집니다.
- 96-웰 플레이트 포맷의 경우, 10 mM CFTRInh172 (1,000x) 원액 2 μL를 48 μL의 나트륨-무함유, 무염화물 완충 용액에 희석하여 CFTRInh172 저농도 (400 μM CFTRInh172 (1:25 희석)) 용액을 제조한다.
- 각 웰의 형광 강도 측정값을 정량화하고 값을 개별 웰이 포함된 열 형식의 스프레드시트로 내보냅니다. 포스콜린으로 인한 변화를 계산하려면 96웰 또는 384웰 플레이트의 각 웰에서 RFU(상대 형광 단위) 측정값을 기준선 판독값의 마지막 형광 강도 측정값으로 나누고 플로팅합니다.
- 또는 CFTR 기능 12의 특이성을 더 잘 확인하기 위해 CFTRInh172 매개 억제 반응을 정량화할 수 있는데, 포스콜린을 사용한 급성 치료는 SLC26A9와 같은 다른 염화물 채널의 활성을 통해 막 탈분극을 초래할 수 있기 때문이다12.
- 포스콜린 자극 동안 기준선에서 측정된 최대 형광 강도로서 피크 반응을 측정합니다. 이 측정값 또는 곡선 아래 면적을 사용하여 CFTR 반응을 정량화합니다.
4. ENaC 기능성 분석 완충액 준비
- 표 2에 나열된 시약으로 고나트륨, 무염화물 완충 용액을 준비합니다.
- 용액이 안정되면 pH를 측정합니다. 용액의 pH가 7.4 미만인 경우 1N NaOH 용액을 적가하여 pH를 7.4로 조정합니다.
알림: 용액에 염화물이 없어야 하므로 HCl로 용액의 pH를 조정하지 마십시오. - 완충 용액의 삼투압을 300 ± 5mOsm/kg의 생리학적 범위로 줄입니다.
- 완충 용액을 여과하고 4°C에서 최대 6개월 동안 멸균 병에 보관합니다.
알림: 6개월 이상 보관할 경우 사용하기 전에 실온에서 pH와 삼투압을 확인하십시오.
5. ENaC 기능적 분석
- 고나트륨, 무염화물 완충용액(염료 0.5mg/완충액 1mL)에 멤브레인 전위 염료를 녹이고 37°C로 따뜻하게 합니다.
알림: 멤브레인 전위 염료 분말을 빛에 노출시키지 마십시오. - Calu-3 또는 Caco-2 세포 단층에서 배양 배지를 제거하고 염료 함유 용액을 각 웰에 추가합니다(96웰 플레이트의 경우 웰당 195μL, 384웰 플레이트의 경우 웰당 95μL).
알림: 염료 용액을 빛에 노출시키지 마십시오. - 세포가 37°C 및 5%CO2에서 35분 동안 염료를 로딩하도록 허용한다.
- 염료 용액이 적재된 세포를 형광 플레이트 판독기로 이동합니다. 여기 = 530 ± 5 nm, 방출 = 560 ± 5 nm로 플레이트 바닥에서 형광 측정값을 판독합니다.
- 5초 간격으로 30분 동안 연속적인 기준선 판독값을 취하는 것으로 시작합니다.
- ENaC 기능을 억제하려면 최종 농도 10μM 아밀로라이드에 대해 고나트륨, 제로 클로라이드 완충액에 용해된 저농도 용액 아밀로라이드 또는 저농도 용액 DMSO 5μL를 추가합니다.
- 96-웰 플레이트 포맷의 경우, 48 μL의 고나트륨, 무염화물 완충용액에 10 mM 아밀로라이드(1,000x) 원액 2 μL를 희석하여 저농도 (400 μM 아밀로라이드(1:25 희석)) 아밀로라이드 용액을 준비한다.
참고: 저농도 400μM 아밀로라이드에 이어 다음 단계에서 두 번째 희석(10μM 아밀로라이드의 최종 농도에 대한 1:40 희석)이 이어집니다. - 384-웰 플레이트 포맷의 경우, 49 μL의 고나트륨, 무염화물-무함유 완충용액에 10 mM 아밀로라이드(1,000x) 원액 1 μL를 첨가하여 저농도 (200 μM 아밀로라이드 (1:50 희석)) 아밀로라이드 용액을 준비한다.
참고: 저농도 200μM 아밀로라이드에 이어 다음 단계에서 두 번째 희석(10μM 아밀로라이드의 최종 농도에 대한 20:10 희석)이 이어집니다.
- 96-웰 플레이트 포맷의 경우, 48 μL의 고나트륨, 무염화물 완충용액에 10 mM 아밀로라이드(1,000x) 원액 2 μL를 희석하여 저농도 (400 μM 아밀로라이드(1:25 희석)) 아밀로라이드 용액을 준비한다.
- 60초 간격으로 측정하여 45분 동안 억제 판독값을 측정합니다.
- 데이터 분석을 위해 3.7단계를 반복합니다.
- 기준선에서 정체점까지의 억제율로 아밀로라이드 반응을 측정하고, 아밀로라이드 첨가 후 약 15-20분. 이 차이를 사용하여 ENaC 반응을 정량화할 수 있습니다.
결과
CFTR 채널 활성을 측정하기 위해, 잘 분화되고 부착된 세포는 막 전위에 민감한 염료를 포함하는 제로 클로라이드 세포외 용액에서 배양됩니다. CFTR 기능은 포스콜린 자극 후 막 탈분극으로 일관되게 검출됩니다. 염화물 유출은 차량 대조군에 비해 형광의 급격한 증가로 검출됩니다. 형광 신호는 CFTR 억제제(CFTRInh172)가 첨가될 때까지 지속되어 Caco-2 세포에서 볼 수 있듯이 형광 강도가 급격히 감소하며(그림 1A), Caco-2 및 Calu-3 세포 모두에서 재현 가능합니다(그림 1B). CFTR 활성의 평가는 포스콜린 또는 DMSO(비히클) 후 형광의 최대 변화의 차이입니다. 개별 포인트는 평균 포스콜린 자극(검은색 점) 또는 DMSO 대조군(회색 점)에서 ± 3 표준 편차 사이였으며, 이는 0.586의 Z 계수에 해당합니다. 이 우수한 점수는 이 분석의 재현성을 나타냅니다(그림 1C). 기준선에 약간의 드리프트가 있는 경우, 억제제 첨가 지점까지 활성화 후 트레이스 전체에 걸쳐 기준선을 외삽하여 드리프트의 영향을 최소화할 수 있습니다. 반응은 곡선 아래 면적으로 정량화할 수 있으며, 하한은 외삽된 선으로 정의됩니다.
ENaC 활성은 또한 96-웰 플레이트에서 성장한 합류성 기도 및 결장 상피 세포에서 측정할 수 있습니다. CFTR 채널 활성에 대한 분석과 달리, 이러한 세포는 고나트륨 함유 용액에 잠겨 ENaC를 통한 나트륨 흡수를 가능하게 합니다. 아밀로라이드의 급성 첨가로 나트륨 흡수가 차단되고 세포는 상대적인 막 과분극을 경험합니다. 이것은 낮은 농도(10μM)의 아밀로리드(그림 2A) 및 고농도(50μM)의 Caco-2 세포(그림 2A, B)와 고농도의 아밀로리드(50μM)를 갖는 Calu-3 세포(그림 2B)에서 나타납니다. ENaC 분석은 384웰 플레이트 형식으로 확장되었으며 ENaC 억제에서 뛰어난 재현성을 입증했습니다. 유사하게, 개별 포인트는 평균 아밀로라이드 억제(검은색 점) 또는 DMSO 대조군(회색 점)에서 ± 3 표준 편차 사이였습니다. Calu-3 세포에서의 ENaC 반응은 아밀로라이드(50 μM)를 사용한 급성 치료로 0.629의 Z' 인자를 보고했으며(도 2C), 이는 이들 파라미터가 고처리량 스크리닝을 지원한다는 것을 나타낸다.
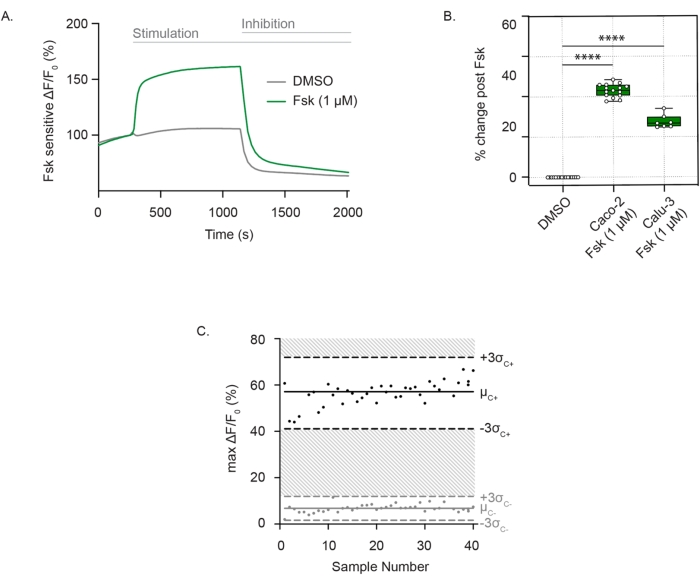
그림 1: Caco-2 및 Calu-3 세포에서 막 탈분극의 변화로 인한 CFTR 채널 측정. (A) Caco-2 세포에서 포스콜린(1μM) 및 DMSO 조절을 통한 CFTR 자극의 대표적인 흔적. (B) Caco-2 및 Calu-3 세포에서 포스콜린 자극의 상자 및 수염 플롯(**** P < 0.0001, n > 3개의 생물학적 복제물, n > 3개의 기술적 복제물). 생물학적 복제물은 독립적인 세포주 계대입니다. 기술 복제물은 멀티웰 플레이트의 독립적인 웰을 나타냅니다. 상자 그림은 중앙값을 나타냅니다. 경계는 IQR을 나타내며 수염은 최소값과 최대값을 정의합니다. (C) Caco-2 세포에서 DMSO 대조군과 비교하여 포스콜린 자극을 사용한 재현 가능한 CFTR 반응의 Bland-Altman 플롯. 검은 점은 포스콜린 자극에 대한 반응으로 형광의 최대 절대 변화를 나타냅니다. 회색 점은 DMSO 제어에 대한 반응으로 형광의 변화를 나타냅니다. 약어: CFTR = 낭포성 섬유증 막횡단 전도도 조절제; DMSO = 디메틸설폭사이드; IQR = 사분위수 범위; Fsk = 포스콜린; ΔF/F0 = 형광의 변화. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
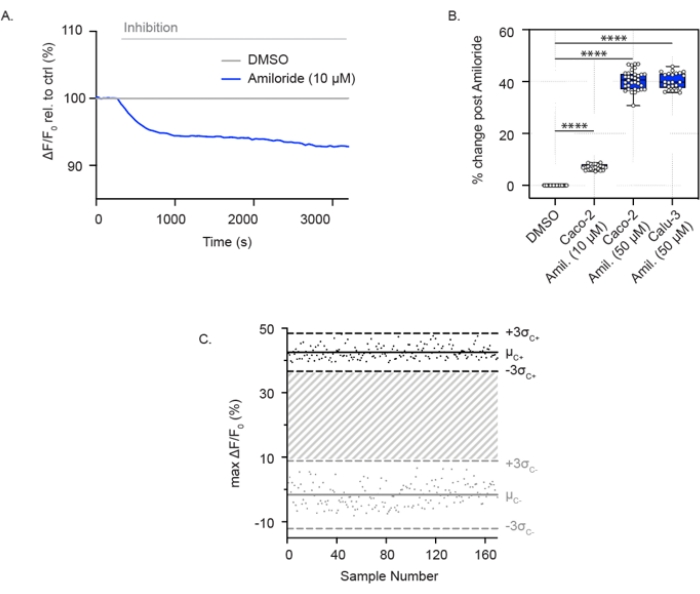
그림 2: Caco-2 및 Calu-3 세포에서 막 과분극을 통한 ENaC 억제 측정. (A) Caco-2 세포에서 DMSO 대조군과 관련하여 아밀로라이드(10μM)를 사용한 ENaC 억제의 대표적인 흔적. (B) Caco-2 및 Calu-3 세포에서 아밀로라이드 억제의 상자 및 수염 플롯(**** P < 0.0001, n > 3개의 생물학적 복제물, n > 3개의 기술적 복제물). (C) Calu-3 세포에서 DMSO 대조군과 비교하여 아밀로라이드 억제와 함께 재현 가능한 ENaC 반응의 Bland-Altman 플롯. 검은 점은 아밀로라이드 억제에 대한 반응으로 형광의 최대 절대 변화를 나타냅니다. 회색 점은 DMSO 제어에 대한 반응으로 형광의 변화를 나타냅니다. 약어: ENaC = 상피 나트륨 채널; DMSO = 디메틸설폭사이드; 아밀. = 아밀로라이드; ΔF/F0 = 형광의 변화. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 이름 | 농도 |
| NMDG (N-메틸-D-글루카민) | 150 밀리엠 |
| 글루콘산 락톤 | 150 밀리엠 |
| 글루콘산칼륨 | 3 밀리엠 |
| 헤페스 | 10 밀리엠 |
표 1: 나트륨 및 염화물이 없는 CFTR 기능 분석을 위한 시약 및 해당 농도. 약어: CFTR = 낭포성 섬유증 막횡단 전도도 조절제.
| 이름 | 농도 |
| 글루콘산나트륨 | 150 밀리엠 |
| 글루콘산칼륨 | 3 밀리엠 |
| 헤페스 | 10 밀리엠 |
표 2: 고나트륨, 제로 클로라이드를 함유한 ENaC 기능 분석 완충액에 대한 시약 및 해당 농도. 약어: ENaC = 상피 나트륨(Na) 채널.
토론
여기에서는 상피 결장직장암 세포주인 Caco-2와 인간 상피성 폐암 세포주인 Calu-3에서 CFTR 및 ENaC 활성을 측정하기 위한 형광 기반 방법을 설명했습니다. 상피 세포주에서 이러한 막 전위 분석은 1차 환자 유래 상피 배양에서 최종 시험관 내 검증 전에 이종 발현 시스템에서 이전에 확인된 소분자 조절제 화합물의 효능을 확인하는 데 사용할 수 있습니다.
위의 측정이 관심 채널에 적절하게 기인하는지 확인하는 것이 중요합니다. 예를 들어, CFTR에 기인 한 측정은 CFTR 단백질 발현 및 포스 콜린 및 억제제 CFTRInh-172에 의해 조절되는 염화물의 전기 화학적 원동력에 대한 의존성을 보여야한다. 유사하게, 10μM 아밀로라이드에 의해 야기된 막 전위 변화는 ENaC 단백질 발현 및 내부 나트륨 구동력에 의존하는 경우 ENaC에 기인할 수 있습니다. ENaC 2의 세 가지 서브유닛 모두로 형질감염 후 MDCK 세포에서 ENaC의 이러한 특성을 확인했지만, Caco-2 및 Calu-3 세포에서 측정된 아밀로라이드 반응이 ENaC에 의해 부여된다는 것을 아직 공식적으로 확인하지 않았습니다. 이것은 아밀로라이드가 ENaC13 외에도 나트륨-양성자 교환기 NHE3의 기능을 조절할 수 있기 때문에 특히 중요합니다. 아마도, 이 분석에서 관찰된 아밀로라이드 유도 과분극은 다른 채널에 대한 세포내 산성화의 간접적인 효과를 부분적으로 반영할 수 있습니다. 이 막 전위 민감성 염료를 사용하여 측정된 아밀로라이드 유도 과분극이 위 세포주 및 iPSC 유래 조직과 같은 더 복잡한 세포 시스템에서 ENaC에 의해 부여됨을 확인하기 위해, 우리는 이 활성이 손실됨을 확인하고 있습니다.
이러한 분석의 성공을 위해서는 몇 가지 요인에 주의를 기울여야 합니다. 첫째, 상피 배양은 합류하고 잘 분화되어야합니다. CFTR 및 ENaC 기능 측정을 위해 96웰 플레이트에서 웰당 약 145,000개의 세포를 플레이팅하거나 384웰 플레이트에서 웰당 45,000개의 셀을 플레이팅해야 합니다. 상피 세포가 합류 (도금 후 3-4 일 이내)에 도달하면 2-5 일 동안 분화하십시오. 이 타이밍은 면역블로팅에 의한 최대 CFTR 단백질 발현에 기초하여 이전에 결정되었다14. 유사하게, 두 세포주, Calu-3 및 Caco-2 모두에서 기능적 ENaC 발현에 대한 최적의 타이밍이 결정되었습니다.
비융합 단층 또는 세포 과증식은 기술 복제 전반에 걸쳐 낮은 재현성을 초래합니다. 개별 웰의 세포가 동시에 합류점에 도달하지 않는 경우 이러한 플레이트를 폐기해야 합니다. 또한 불안정한 기준선 판독값 또는 자극 반응의 부족은 세포 품질이 좋지 않다는 표시일 수 있으므로 분석에서 제외해야 합니다. CFTR 활성제인 포스콜린(forskolin) 또는 ENaC 억제제인 아밀로라이드(amiloride)에 대한 반응이 감소하면 잠재적으로 과도하게 계대배양된 세포의 사용을 반영할 수 있다15. Calu-3 및 Caco-2 세포에는 문제가 되지 않지만 다른 세포나 조직은 플레이트에 잘 부착되지 않을 수 있으며 웰의 사전 코팅이 필요할 수 있습니다. 예를 들어, 이전 연구에서, 2D 담관세포 배양물을 콜라겐 코팅16을 사용하여 플레이트에 부착하였다. 대안적으로, Poly-L-Lysine2를 사용하여 2D 장 조직의 부착도를 증가시켰다.
또한, 형광 기반 분석을 사용하여 소분자에 의한 이온 채널의 변조를 테스트할 때, 소분자의 형광 특성에 의해 부여되는 잠재적인 인공물을 해결하는 것이 중요합니다. 기능적 반응의 특이성을 확인하기 위해, 막 전위 분석은 Ussing 연구17과 같은 기존의 전기생리학적 방법을 사용하여 추가로 검증할 수 있습니다.
막 전위에 민감한 염료에 의해 검출된 반응이 관심 채널에 의해 구체적으로 부여된다는 것을 확인한 후, 이러한 분석은 관련 세포 맥락에서 상피 이온 채널의 유망한 조절자를 검증할 수 있는 엄청난 잠재력을 가지고 있습니다. 이 플랫폼은 이종 발현 시스템의 고처리량 변조기 스크리닝과 접근하기 어려운 1차 조직에서 시간이 많이 소요되는 생체 전기 측정 사이의 격차를 해소할 수 있습니다.
공개
저자는 경쟁 이익을 선언하지 않습니다.
감사의 말
저자는 CFTR 및 ENaC를 측정하는 막 전위 분석을 수행하는 데 도움을 준 Hospital for Sick Children의 Christopher Fladd와 SPARC BioCentre에 감사드립니다. 이 작업은 CF Canada와 Sick Kids Foundation이 제공하는 자금으로 CFIT 프로그램의 지원을 받았습니다. 이 연구는 Genome Canada와 Ontario Genomics Institute(OGI-148)를 통해 캐나다 정부의 자금 지원을 받았습니다. 이 연구는 온타리오 주 정부의 자금 지원을 받았습니다. S.X.는 캐나다 소화기내과(CAG) 박사 장학금의 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| Amiloride | Spectrum Chemical | TCI-A2599-5G | Dissolved in DMSO and stored at -20 °C |
| CFTRInh-172 | CF Foundation Therapeutics | Dissolved in DMSO and stored at -20 °C | |
| EMEM, 1xs | Wisent | 320-005-CL | |
| Fetal Bovine Serum (FBS) | Wisent | 080-450 | |
| FLIPR Membrane Potential Dye | Molecular Devices | R8042 | Stored at 4 °C |
| Forskolin | Sigma-Aldrich | F3917 | Dissolved in DMSO and stored at -20 °C |
| Gluconic acid lactone or (D-(+)-Gluconic acid δ-lactone) | Sigma-Aldrich | G4750 | Stored at room temperature |
| HEPES | Bioshop | HEP001.5 | Stored at room temperature |
| Human Bronchial Adenocarcinoma Cell Line (Calu-3) | ATCC | HTB-55 | |
| Human Epithelial Colorectal Adenocarcinoma Cell Line (Caco-2) | ATCC | HTB-37 | |
| N-Methyl-D-glucamine (NMDG | Sigma-Aldrich | M2004 | Stored at room temperature |
| Penicillin-Streptomycin Solution | Wisent | 450-200-EL | |
| Phosphate-Buffered Saline (PBS) | Wisent | 311-010-CL | |
| Potassium Gluconate | Sigma-Aldrich | P1847 | Stored at room temperature |
| Sodium Gluconate | Sigma-Aldrich | G9005 | Stored at room temperature |
참고문헌
- Ahmadi, S., et al. Phenotypic profiling of CFTR modulators in patient-derived respiratory epithelia. NPJ Genomic Medicine. 2, 12 (2017).
- Xia, S., et al. High-throughput functional analysis of CFTR and other apically localized proteins in iPSC-derived human intestinal organoids. Cells. 10 (12), 3419 (2021).
- Jiang, J. X., et al. A new platform for high-throughput therapy testing on iPSC-derived lung progenitor cells from cystic fibrosis patients. Stem Cell Reports. 16 (11), 2825-2837 (2021).
- Hu, J., et al. Human Embryonic Kidney 293 Cells: a vehicle for biopharmaceutical manufacturing, structural biology, and electrophysiology. Cells, Tissues, Organs. 205 (1), 1-8 (2018).
- Hadida, S., et al. Discovery of N-(2,4-di-tert-butyl-5-hydroxyphenyl)-4-oxo-1,4-dihydroquinoline-3-carboxamide (VX-770, ivacaftor), a potent and orally bioavailable CFTR potentiator. Journal of Medicinal Chemistry. 57 (23), 9776-9795 (2014).
- Chen, M. X., et al. Validation and optimization of novel high-throughput assays for human epithelial sodium channels. Journal of Biomolecular Screening. 20 (2), 242-253 (2015).
- Maitra, R., Sivashanmugam, P., Warner, K. A rapid membrane potential assay to monitor CFTR function and inhibition. Journal of Biomolecular Screening. 18 (9), 1132-1137 (2013).
- Mall, M. A. ENaC inhibition in cystic fibrosis: potential role in the new era of CFTR modulator therapies. European Respiratory Journal. 56 (6), 2000946 (2020).
- Moore, P. J., Tarran, R. The epithelial sodium channel (ENaC) as a therapeutic target for cystic fibrosis lung disease. Expert Opinion on Therapeutic Targets. 22 (8), 687-701 (2018).
- Stutts, M. J., et al. CFTR as a cAMP-dependent regulator of sodium channels. Science. 269 (5225), 847-850 (1995).
- Merkert, S., et al. High-throughput screening for modulators of CFTR activity based on genetically engineered cystic fibrosis disease-specific iPSCs. Stem Cell Reports. 12 (6), 1389-1403 (2019).
- Bertrand, C. A., et al. The CFTR trafficking mutation F508del inhibits the constitutive activity of SLC26A9. American Journal of Physiology. Lung Cellular and Molecular Physiology. 312 (6), 912-925 (2017).
- Frelin, C., et al. Amiloride and its analogs as tools to inhibit Na+ transport via the Na+ channel the Na+/H+ antiport and the Na+/Ca2+ exchanger. Biochimie. 70 (9), 1285-1290 (1988).
- Di Paola, M., et al. SLC6A14 is a genetic modifier of cystic fibrosis that regulates Pseudomonas aeruginosa attachment to human bronchial epithelial cells. mBio. 8 (6), 02073 (2017).
- Schiavi, S. C., et al. Biosynthetic and growth abnormalities are associated with high-level expression of CFTR in heterologous cells. American Journal of Physiology. 270, 341-351 (1996).
- Ogawa, M., et al. Generation of functional ciliated cholangiocytes from human pluripotent stem cells. Nature Communications. 12 (1), 6504 (2021).
- Lu, C., Pribanic, S., Debonneville, A., Jiang, C., Rotin, D. The PY motif of ENaC, mutated in Liddle syndrome, regulates channel internalization, sorting and mobilization from subapical pool. Traffic. 8 (9), 1246-1264 (2007).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유