Method Article
Medición de la contractilidad cardíaca en cardiomiocitos primarios humanos adultos aislados
En este artículo
Resumen
Este protocolo describe cómo medir la contractilidad en cardiomiocitos primarios humanos adultos de corazones de donantes con el sistema MyoBLAZER, una plataforma fiable para evaluar los cambios en la contractilidad inducidos por fármacos durante el desarrollo preclínico.
Resumen
La evaluación de los cambios en la contractilidad cardíaca es esencial durante el desarrollo preclínico de nuevos compuestos dirigidos al corazón y no al corazón. En este artículo se describe un protocolo para evaluar los cambios en la contractilidad en cardiomiocitos ventriculares primarios humanos adultos utilizando el método óptico no invasivo MyoBLAZER, que preserva la fisiología y farmacología normales de las células. Este método de registro óptico mide continuamente los transitorios de contractilidad de múltiples células en paralelo, proporcionando tanto un rendimiento medio como información valiosa para cada célula individual en el campo de visión, lo que permite el seguimiento en tiempo real de los efectos de los fármacos. Las contracciones de los cardiomiocitos son inducidas por estimulación del campo eléctrico estimulado, y las imágenes de campo claro adquiridas se envían a un software de procesamiento de imágenes que mide el acortamiento del sarcómero en múltiples cardiomiocitos. Este método genera rápidamente diferentes puntos finales relacionados con la cinética de las fases de contracción y relajación, y los datos resultantes pueden interpretarse en relación con diferentes concentraciones de un artículo de prueba. Este método también se emplea en las últimas etapas del desarrollo preclínico para realizar estudios mecanicistas de seguimiento para respaldar los estudios clínicos en curso. Por lo tanto, el modelo basado en cardiomiocitos primarios humanos adultos combinado con el sistema óptico para la monitorización continua de la contractilidad tiene el potencial de contribuir a una nueva era de traducibilidad de datos cardíacos in vitro en el desarrollo de terapias médicas preclínicas.
Introducción
La contractilidad miocárdica (inotropía), que representa la capacidad natural del músculo cardíaco para contraerse, es una propiedad clave de la función cardíaca y depende de la dinámica del acoplamiento electromecánico. Los cambios inducidos por fármacos en la contractilidad miocárdica son deseables para tratar la cardiopatía (p. ej., insuficiencia cardíaca) y no se buscan en el contexto de la cardiotoxicidad (p. ej., reducción de la fracción de eyección del ventrículo izquierdo). Por lo tanto, los modelos de contractilidad preclínica deben asociarse con una predictividad precisa para garantizar que los nuevos fármacos puedan tener éxito durante el desarrollo clínico. Sin embargo, las estrategias preclínicas actuales, que se basan en modelos celulares artificiales reduccionistas (p. ej., líneas celulares inmortalizadas modificadas genéticamente que sobreexpresan objetivos cardíacos específicos de interés) y modelos animales no humanos, han mostrado limitaciones significativas y se ha encontrado que están asociadas con altas tasas de deserción de fármacos (es decir, una alta tasa de señales falsas)1,2,3,4 . En consecuencia, es imperativo establecer modelos de contractilidad cardíaca celular humana nuevos y confiables que se asocien con una alta potencia (es decir, una alta tasa de señales verdaderas) para predecir los resultados de los medicamentos en humanos y, por lo tanto, ayudar a acelerar el lanzamiento de nuevas terapias5.
Los métodos innovadores recientemente establecidos para la recuperación de corazones de donantes humanos para la investigación 6,7,8,9,10 y en técnicas de aislamiento de cardiomiocitos 11,12,13,14,15 han brindado una oportunidad única para realizar estudios en humanos durante el desarrollo preclínico. Con este fin, los cardiomiocitos primarios humanos adultos ya han demostrado su utilidad en la evaluación de los cambios inducidos por fármacos en la contractilidad cardíaca humana11,12,13,14. El presente artículo detalla el protocolo para investigar los efectos de la contractilidad de nuevos compuestos en cardiomiocitos humanos adultos.
Protocolo
Todos los métodos se llevaron a cabo de acuerdo con las directrices y reglamentos pertinentes. Todos los corazones humanos utilizados para los estudios no eran trasplantables y se obtuvieron éticamente mediante el consentimiento legal informado (primera persona o pariente más cercano) de donantes de órganos cadavéricos en los Estados Unidos (EE. UU.). Los protocolos de recuperación y la experimentación in vitro fueron aprobados previamente por las Juntas de Revisión Institucional (IRB, por sus siglas en inglés) en los centros de trasplante dentro de la Red de Trasplantes de Obtención de Órganos (OPTN, por sus siglas en inglés) de los Estados Unidos. Además, todas las transferencias de corazones de donantes son totalmente rastreables y revisadas periódicamente por las autoridades federales de los Estados Unidos.
NOTA: Aplique todos los procedimientos de seguridad necesarios durante la ejecución de este protocolo, incluido el uso de equipo de protección personal adecuado (p. ej., batas de laboratorio, gafas de seguridad, guantes).
1. Aislamiento de cardiomiocitos (1 día antes de medir la contractilidad)
- Reperfundir los corazones de los donantes inmediatamente después de su llegada al laboratorio con una solución cardiopléjica patentada6 helada y aislar enzimáticamente miocitos primarios humanos adultos de los ventrículos 11,12,13,14,15.
- A continuación, mantener los cardiomiocitos en suspensión y almacenarlos con 10 mL de solución A (110 mM de sacarosa, 0,005 mM de CaCl 2, 3 mM de MgCl 2, 70 mM de KOH, 60 mM de ácido lactobiónico, 10 mM de KH 2 PO4, 20 mM de taurina, 20 mM de L-histidina, 20 mM de HEPES, 2 mM de ácido L-glutámico, 2 mM de ácido L-(-)-málico, pH 7.4 con KOH) en viales de Wheaton de 20 mL (Tabla de Materiales) a temperatura refrigerada hasta que sean interrogados experimentalmente.
NOTA: Almacene 200,000 células por vial.
2. Preparación del recubrimiento de laminina (1 día antes de medir la contractilidad)
- Coloque un solo cubreobjetos de vidrio (cuadrado de 25 mm x 25 mm, Tabla de Materiales) en cada pocillo de una placa de cultivo de ocho pocillos (Tabla de Materiales).
- A continuación, recubra los cubreobjetos con laminina a una concentración de 5 μg/mL. Para ello, añadir 800 μL de la cepa recombinante humana de Laminina 521 (Tabla de Materiales, almacenada a -20 °C) a 7,2 mL de solución B (145 mM de NaCl, 4 mM de KCl, 2,5 mM de CaCl 2, 1 mM de MgCl2, 11,1 mM de glucosa y 10 mM de HEPES, pH 7,4 con NaOH) y mezclar bien.
- Deje caer 200 μL de la solución de laminina diluida en el centro de cada cubreobjetos. A continuación, tapa el plato y apílalo en una nevera a 4 °C.
NOTA: Prepare varias placas de cultivo de ocho pocillos para asegurarse de que haya suficientes cubreobjetos recubiertos de laminina.
3. Preparación de cardiomiocitos tolerantes a Ca2+ (el día de la medición de la contractilidad)
- Sacar un vial de células de la nevera, aspirar la solución A del vial y añadir 10 ml refrigerados de solución B.
NOTA: Asegúrese de que las células no sean succionadas y disperse la solución B en el vial colocando la pipeta en el interior de la parte superior de la pared del vial. - Tape el frasco de células y luego gírelo suavemente para asegurarse de que las células se dispersen por toda la solución B. Finalmente, deje que las celdas se asienten durante 1 h a temperatura ambiente (RT).
4. Preparación del sistema de registro (el día de la medición de la contractilidad)
NOTA: El sistema de registro incluye una caja de control de temperatura, un estimulador, una perfusión controlada por ordenador y botellas de perfusión controladas por presión, un software de adquisición interno que permite la selección de regiones de interés (ROI) y la visualización de transitorios de contractilidad, microscopio invertido, cámara celular y cámara (Figura 1).
- Encienda el sistema de vacío de succión. Luego, retire la cubierta del microscopio, enciéndala, conecte la cámara (Tabla de materiales, Figura 1) y, finalmente, confirme que el ventilador esté encendido para asegurarse de que la cámara no se sobrecaliente.
- Luego, encienda la placa calefactora del microscopio (Tabla de materiales) y la caja de control de temperatura (Tabla de materiales, Figura 1) y ajústelas a la temperatura de funcionamiento adecuada. A continuación, encienda el estimulador de campo (Tabla de Materiales, Figura 1) y el sistema de presión. Finalmente, conecte el tubo de la solución (Tabla de Materiales) a la cámara de registro (Tabla de Materiales, Figura 1).
5. Preparación de los compuestos problema (el día de la medición de la contractilidad)
- Dimetilsulfóxido diluido (DMSO; Tabla de Materiales) 1.000 veces en solución C (145 mM de NaCl, 4 mM de KCl, 1,8 mM de CaCl 2, 1 mM de MgCl2, 11,1 mM de glucosa y 10 mM de HEPES, pH 7,4 con NaOH) para hacer una solución de vehículo con DMSO al 0,1 %.
- Para probar un compuesto a 1 vez, 10 veces, 100 veces y 1000 veces su exposición terapéutica de 0,001 μM, disuelva el compuesto de prueba en DMSO a una concentración de 1 mM.
- Diluya esta solución en serie con DMSO para producir tres existencias adicionales de DMSO (por ejemplo, 0,001 mM, 0,01 mM y 0,1 mM). Por último, diluir 1.000 veces cada compuesto de ensayo en 100 ml de solución C para obtener las concentraciones finales de ensayo (0,001 μM, 0,01 μM, 0,1 μM y 1 μM).
- Agregue la solución del vehículo y las soluciones de las concentraciones micromolares finales del compuesto a botellas de vidrio de 100 ml (Tabla de materiales, Figura 1) y luego conecte las botellas al sistema de perfusión accionado por presión (Tabla de materiales, Figura 1).
- A continuación, cebe el sistema de perfusión con un programa controlado por ordenador (Tabla de Materiales) utilizando una presión de 200-300 mbar para proporcionar un flujo de perfusión constante a una velocidad de 1,8 mL/min.
NOTA: No realice el experimento si se encuentra que el compuesto de prueba está asociado con un problema de solubilidad. Además, formule las soluciones de prueba compuestas a partir de soluciones madre dentro de los 30 minutos anteriores a la aplicación experimental a las células.
6. Siembra de cardiomiocitos (el día de la medición de la contractilidad)
- Tome una placa de ocho pocillos que contenga cubreobjetos recubiertos de laminina del refrigerador a 4 °C y coloque con cuidado un cubreobjetos en una cámara de registro muy limpia (Figura 1). A continuación, vuelva a colocar la placa de ocho pocillos en la nevera a 4 °C hasta el siguiente emplatado.
NOTA: Use una toallita sin pelusa (Tabla de materiales) para limpiar el cubreobjetos recubierto mientras mantiene el cubreobjetos recubierto con una capa delgada de laminina. Además, asegúrese de desechar los cubreobjetos usados en un recipiente para objetos punzocortantes. - A continuación, tome un vial escalado de células (paso 3.2) y aspire la solución B del vial para alcanzar un volumen lo más pequeño posible sin perder células (~200 μL). A continuación, dispense los 200 μL de células en la cámara del microscopio de registro montada en la platina de un microscopio invertido (Tabla de materiales).
- Deje que las células se asienten en el cubreobjetos durante 5 minutos. Mientras espera que las células se asienten por completo, abra el campo de visión en el microscopio y determine si la densidad celular es adecuada (~70%) para que comience la ejecución experimental.
NOTA: Asegúrese de que la succión no aspire todas las células si se dispensan más de 200 μL.
7. Registro de la contractilidad de los cardiomiocitos
- Una vez finalizado el recubrimiento, equilibre las células durante 5 minutos perfundiéndolas continuamente con la solución C utilizando el sistema de perfusión impulsado por presión (Tabla de materiales). Ajuste la succión correctamente, encienda tanto la caja de control de temperatura como la placa calefactora, y configúrelas para que suministren ~35 °C.
- A continuación, estimule las células con un voltaje supraumbral a una frecuencia de estimulación de 1 Hz (pulso bipolar de 3 ms de duración) en un estimulador de campo con un par de hilos de platino colocados en lados opuestos de la cámara conectados a un estimulador de campo.
- Ajuste la amplitud del pulso estimulante a 1 V, y luego auméntela hasta que los cardiomiocitos comiencen a generar ciclos de contracción-relajación. Utilice un valor de umbral de 1,5x durante todo el experimento.
NOTA: Seleccione células sanas con morfología en forma de bastoncillo y estrías claras. A continuación, ajuste el campo de visión y concéntrese en mostrar el mayor número posible de células de contracción (Figura 2A). - A continuación, muestre las imágenes digitalizadas de las células dentro del software de adquisición del sistema de registro de contractilidad óptica. Este software utiliza una cámara de alta resolución y alta velocidad de fotogramas con una velocidad de 150 FPS (Tabla de materiales, Figura 1) para grabar una secuencia de vídeo que contiene varios miocitos en el mismo fotograma.
NOTA: Esto proporciona suficiente resolución temporal y espacial para capturar y medir la dinámica del sarcómero de varios miocitos sanos simultáneamente. Los procesadores modernos de alto número de núcleos se aprovechan para permitir el cálculo paralelo de los cambios en la longitud del sarcómero a partir de la transmisión de vídeo en tiempo real (los datos de densidad óptica se recopilan de las regiones de interés [ROI] definidas por el usuario colocadas sobre las imágenes de cardiomiocitos sanos y paralelas al eje de contracción, Figura 2B). Los datos de intensidad óptica muestran bandas brillantes y oscuras correspondientes a las líneas Z de los cardiomiocitos (Figura 1, Figura 2C). Finalmente, estos datos se muestran al usuario con fines de monitoreo y se guardan en un disco para su posterior análisis (Figura 2C).- Evite las áreas de las células que no estén enfocadas. Además, no coloque los ROI cerca del borde de las células, ya que los cambios en la contracción de las células durante la aplicación de medicamentos pueden hacer que los ROI no puedan leer la contracción de las células.
- Cuando se completa la selección de las ROI y las contracciones cumplen con los estándares necesarios para su uso (p. ej., acortamiento del sarcómero >1%; contracción rítmica tras la aplicación de una frecuencia de estimulación de 1 Hz, ausencia de eventos arrítmicos), inicie el experimento para evaluar los efectos de un compuesto. En el cuadro 1 se muestran el protocolo de estimulación y la secuencia de aplicación de las concentraciones de ensayo del compuesto. El software de adquisición gestionará, de forma automatizada, la adquisición y visualización de datos y el etiquetado de las concentraciones de ensayo y el tiempo de tratamiento.
NOTA: Aplique las concentraciones de prueba si la contracción se mantiene en una amplitud estable durante todo el período de referencia del vehículo. Descalifique las celdas que muestran un run-up o run-down. Además, asegúrese de que la perfusión se cambie a las diferentes concentraciones de prueba durante todo el experimento.
- Una vez finalizado el experimento y el almacenamiento de datos en el servidor, apague la perfusión y el calentador, detenga la estimulación, limpie la cámara del microscopio con agua destilada, luego retire el cubreobjetos de vidrio y seque bien la cámara.
NOTA: Limpie la cámara a fondo, ya que esto es fundamental para evitar exponer el siguiente conjunto de células a cualquier compuesto prematuramente, invalidando así cualquier dato recopilado. - A continuación, realice una nueva siembra de cardiomiocitos y realice un experimento adicional para obtener datos suficientes para completar la prueba del compuesto o probar un nuevo compuesto.
8. Apagar el sistema de registro de contractilidad óptica
- Cuando se completen las pruebas diarias de los compuestos, primero apague todo el equipo que no sea necesario para limpiar el sistema y copie los datos para el análisis fuera de línea.
- A continuación, retire los frascos de vidrio de 100 ml (Tabla de materiales) que contienen soluciones de concentraciones de prueba final y reemplácelos con frascos de vidrio llenos hasta la mitad con la solución concentrada RBS 25 (Tabla de materiales). Perfundir la solución RBS a través de la cámara del microscopio durante 5 minutos, luego desconectar el tubo de perfusión de la cámara, limpiarlo con agua destilada y, finalmente, secarlo bien.
NOTA: Asegúrese de que la aspiradora funcione bien para evitar posibles inundaciones. - A continuación, conecte el tubo de perfusión al tubo de drenaje. Utilizando el software del sistema de perfusión accionado por presión (Tabla de materiales), haga funcionar la solución RBS durante 10 minutos mientras se asegura de que la presión y el caudal estén ajustados adecuadamente. A continuación, perfundir DMSO al 1% durante 5 min y luego agua destilada durante 15-20 min para completar la limpieza del sistema de perfusión.
- Apague la luz del microscopio y coloque su tapa. Luego, desconecte los cables de la cámara de la caja en el costado del microscopio y apague el ventilador. Asegúrese de que todas las botellas usadas se envíen para su limpieza y autoclave. Finalmente, asegúrese de que todos los cubos de drenaje estén llenos o menos.
NOTA: Asegúrese de que haya suficientes cubreobjetos recubiertos de laminina para usar al día siguiente. - Por último, copie los archivos de la carpeta de adquisición de todos los experimentos realizados en cada sistema de grabación y péguelos en un servidor de copia de seguridad seguro para realizar un análisis adicional fuera de línea. A continuación, elimine todos los archivos de datos de la carpeta de adquisición.
9. Análisis de los datos de contractilidad
- Realice análisis fuera de línea utilizando el software de análisis y una macro personalizada para promediar los datos. El software de análisis calcula e informa de varias métricas a partir de los datos de dinámica del sarcómero producidos por el software de adquisición. En la Figura 2D se proporciona una lista detallada de estos parámetros.
NOTA: La aplicación de técnicas de software de bajo nivel permite analizar muchas series de grabaciones en 5 s. El parámetro principal para evaluar los cambios en la contractilidad inducidos por fármacos es la amplitud de la contractilidad (% de acortamiento del sarcómero = cambio en la longitud del sarcómero). Se calcula como la longitud del sarcómero en la contracción máxima/longitud del sarcómero en reposo y se promedia en los últimos 20 transitorios de contractilidad para cada concentración de ensayo. - Cuantificar los efectos de los compuestos de ensayo en la amplitud de contractilidad promediada en relación con la condición de control del vehículo de referencia específica de cada cardiomiocito.
- Exprese los resultados medios como media ± SEM y elabore un gráfico que represente el efecto de la concentración del compuesto problema en la amplitud de la contractilidad. A continuación, ajuste la curva de concentración-respuesta a la ecuación de Hill utilizando un software de análisis (Tabla de Materiales) para derivar los valores de IC50 (concentración que produce una inhibición del 50% de la amplitud de la contractilidad) y EC50 (concentración que produce un aumento del 50% en la amplitud de la contractilidad).
- Además de la amplitud de contractilidad, también puede calcular otros parámetros:
- Postcontracción: Identificar la postcontracción como una contracción secundaria espontánea transitoria del cardiomiocito que se produce antes de la siguiente contracción regular y produce una contracción anormal y no sincronizada.
- Falla de contracción: Identifique la falla de contracción como la incapacidad del estímulo eléctrico para inducir una contracción.
- Variabilidad a corto plazo (VST) y alternancias: Visualice estos dos parámetros en gráficos de Poincaré de variabilidad de amplitud de contracción.
- Calcular el STV (∑|CAn + 1 − CAn| (20 × √2) −1) con los últimos 20 transitorios de cada período de concentración de los artículos de control y ensayo. Identifique los alternos como transitorios repetitivos de amplitud de contractilidad alterna corta y larga.
- Para calcular la incidencia de pro-arritmia, normalice los valores de STV al valor de control del vehículo de cada célula, grafique la postcontracción, la falla de contracción, STV y alternantes, y expréselos como % de la incidencia de células que exhiben cada una de las señales.
- Complete el perfil mecanicista multiparamétrico con el cálculo del tiempo Ato pico, decaimiento a 30% de relajación (Decay 30), decaimiento a relajación 90% (Decay 90), tiempo a relajación 90% (TR90) (Figura 2D), longitud basal del sarcómero, tiempo hasta el pico del 50%, altura del pico, longitud del sarcómero en la contractilidad máxima, velocidad máxima de contracción y velocidad máxima de relajación12. Al igual que la amplitud de la contractilidad, exprese estos parámetros en relación con la condición de control basal específica de cada cardiomiocitos y grafíquelos en gráficos de concentración-respuesta.
Resultados
En este protocolo se describe un procedimiento para medir la contractilidad en cardiomiocitos primarios humanos adultos aislados de donantes de órganos y evaluar los cambios agudos en los parámetros de contractilidad inducidos por un compuesto de prueba. La medición del transitorio de contractilidad se realiza utilizando un sistema de geometría celular basado en vídeo, el MyoBLAZER, que mide la dinámica del sarcómero, y la afección cardíaca adulta se emula mediante la inducción de la contractilidad con estimulación eléctrica a la frecuencia de estimulación fisiológica (1 Hz). La viabilidad funcional de los cardiomiocitos se confirma mediante la evaluación de su acoplamiento excitación-contracción (es decir, el procesamiento celular que vincula la excitación eléctrica [el potencial de acción sarcolemal] con la contracción). No hay transitorios de contractilidad espontánea en los cardiomiocitos humanos, y los cardiomiocitos responden a la estimulación eléctrica externa con ciclos de contractilidad/relajación (Figura 2C, E), así como al isoproterenol, un agonista β-adrenérgico (Figura 2F, G). El isoproterenol provoca un aumento de la contractilidad dependiente de la concentración (Figura 2G), y también se pueden caracterizar sus efectos sobre la cinética de la contractilidad transitoria (Figura 2D)12.

Figura 1: Configuración experimental del sistema de registro de contractilidad óptica. Los registros de contractilidad de campo claro se realizan a partir de cardiomiocitos primarios humanos adultos, como se describió anteriormente11,12,13,14. La configuración incluye una (A) caja de control de temperatura, (B) estimulador de campo, (C,D) sistema de perfusión impulsado por presión, (E) programa informático impulsado por presión, (F) presión más botellas, (G) software de adquisición, (H) selección de ROI con software de adquisición, (I) visualización de transitorios de contractilidad con software de adquisición, (J) microscopio invertido, (K) cámara de microscopio y ( L) cámara. Todas las características del equipo se indican en la Tabla de Materiales. Haga clic aquí para ver una versión más grande de esta figura.
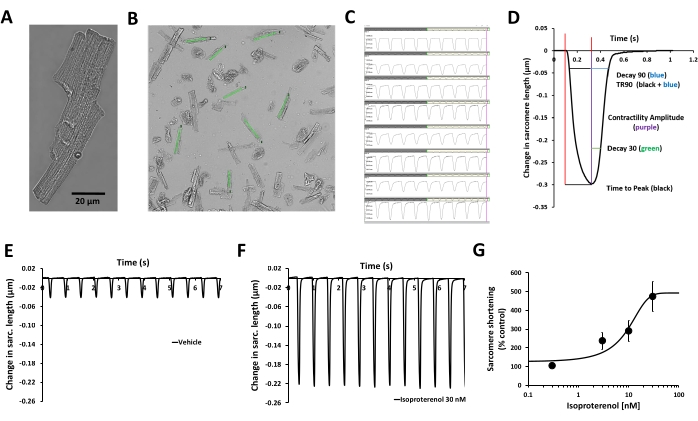
Figura 2: Validación de la medición de la contractilidad de los cardiomiocitos humanos y el efecto de la estimulación β-adrenérgica. (A) Imagen de microscopía de contraste de fase de un cardiomiocitos primario humano adulto representativo, (B) regiones de interés (ROI) definidas por el usuario colocadas sobre las imágenes de cardiomiocitos sanos y paralelas al eje de contracción, (C) visualización de transitorios de contractilidad obtenidos a partir de los mismos ROI en (B) con el software de adquisición, (D) parámetros relacionados con el transitorio de contractilidad medido con el software de adquisición: amplitud de contractilidad, tiempo hasta el pico, Decay 30, Decay 90, TR90. También se pueden medir parámetros adicionales: longitud basal del sarcómero, tiempo hasta el 50% del pico, altura del pico, longitud del sarcómero en la contractilidad máxima, velocidad máxima de contracción y velocidad máxima de relajación. (E) Transitorios típicos de contractilidad registrados en un miocito ventricular primario humano adulto a una frecuencia de estimulación de 1 Hz en presencia de control de vehículo (F) y después de la exposición a 30 nM de isoproterenol, un agonista β-adrenérgico no selectivo. Los transitorios de contractilidad demostrados en los paneles E y F se recogieron del mismo cardiomiocito. Se utilizó isoproterenol de cardiomiocitos humanos estimulados a una frecuencia de estimulación de 1 Hz para generar la información de potencia. (G) Curva típica de concentración-respuesta acumulativa generada por la medición de la contractilidad de cardiomiocitos humanos con isoproterenol (n = 8 células). Haga clic aquí para ver una versión más grande de esta figura.
| Secuencia de perfusión | Solución para vehículos | Concentración 1 (μM) | Concentración 2 (μM) | Concentración 3 (μM) | Concentración 4 (μM) | Lavar |
| Tiempo de tratamiento | 120 s | 300 s | 300 s | 300 s | 300 s | 300 s |
| Frecuencia de estimulación | 1 Hz | 1 Hz | 1 Hz | 1 Hz | 1 Hz | 1 Hz |
Tabla 1: Protocolo de estimulación y secuencia de aplicación del compuesto de ensayo. La estabilidad de los transitorios de contractilidad se evalúa mediante el registro continuo durante 120 s en la solución C, estableciendo el control del vehículo (normalmente en DMSO al 0,1%). Posteriormente, se aplica la concentración del artículo de prueba durante un mínimo de 300 s o hasta que se alcanza un efecto de estado estacionario. Se utilizan cuatro concentraciones ascendentes de artículos de prueba, lo que proporciona curvas de efecto de concentración acumulativa (C-E). Al final de las adiciones acumulativas del artículo de prueba, se puede implementar un período de lavado de 300 s.
Discusión
Este manuscrito proporciona un protocolo detallado para el sistema óptico basado en la contractilidad de cardiomiocitos humanos adultos para un método simplificado de rendimiento medio que permite probar la eficacia aguda y la cardiotoxicidad de nuevos compuestos. Este sistema de registro óptico de contractilidad es fácil de usar, permite registros de múltiples células en paralelo, permite la evaluación simultánea de la salud, la fisiología y la farmacología celular, viene con un análisis de datos automatizado y rápido (se analiza una serie de múltiples células en 5 s) y permite una rápida recopilación de datos (curva de concentración-respuesta cada 30 min/compuesto/dispositivo). Teniendo en cuenta estos atributos, el sistema de registro puede utilizarse no solo para detectar los efectos de los fármacos sobre la contractilidad de los cardiomiocitos, sino también para proporcionar datos de relación estructura-actividad para apoyar los esfuerzos de química médica durante las primeras fases del descubrimiento de fármacos16. Dado que se pueden obtener decenas de millones de células a partir de un protocolo de aislamiento de cardiomiocitos, actualmente se está explorando la aplicación del sistema óptico de registro de contractilidad-plataforma de cardiomiocitos para lograr una mayor capacidad de prueba (con el uso de placas bien fundamentadas) con un costo reducido. Además, la evaluación de los efectos de los fármacos sobre los parámetros sistólicos y de relajación medidos con el sistema de registro puede proporcionar un perfil mecanicista multiparamétrico de los fármacos inotrópicos12. Además, los datos de contractilidad de los cardiomiocitos se pueden utilizar para clasificar los nuevos fármacos de mayor a menor cardiotóxicos (p. ej., margen de seguridad) y de menor a mayor eficacia (p. ej., margen de potencia). También se pueden realizar estudios de seguimiento de la contractilidad de los cardiomiocitos para apoyar los programas de desarrollo que se han asociado con una disminución clínica de la contractilidad miocárdica12.
Otra ventaja significativa de utilizar el sistema de registro óptico de contractilidad de cardiomiocitos humanos es su alineación con el concepto de las 3R (reemplazo, reducción y refinamiento)17 , ya que puede considerarse como un método alternativo que evita o reemplaza el uso de animales para la generación de datos dentro de la industria farmacéutica. Este beneficio de las 3R también se puede extender a la investigación cardíaca académica. La totalidad del conocimiento actual de la fisiología y farmacología de los cardiomiocitos proviene de estudios de investigación académica realizados con células aisladas de corazones de animales18. Así, el modelo de contractilidad óptica de cardiomiocitos humanos abre la posibilidad de realizar estudios traslacionales críticos. Para realizar estos estudios, se deben desarrollar protocolos para la preservación y envío de cardiomiocitos adultos humanos (actualmente en evaluación en el laboratorio de AnaBios), y el sistema de contractilidad debe tener la capacidad de registrar los cambios en la longitud de los sarcómeros de los cardiomiocitos no humanos (este es el caso del sistema de registro óptico de la contractilidad, ya que los sarcómeros están bien conservados entre las especies).
El sistema de contractilidad de los cardiomiocitos humanos puede emular varias condiciones fisiológicas (p. ej., acoplamiento electromecánico, frecuencia de estimulación que imita la frecuencia cardíaca, temperatura corporal, integración de todos los objetivos cardíacos humanos) y ha demostrado valor traslacional como componente clave en el descubrimiento de fármacos11,12,13,14, aunque no puede imitar los cambios en la carga mecánica y el esfuerzo cortante observados durante el ciclo contráctil cardíaco. La estructura y la función de las matrices extracelulares cardíacas se conocen mejor19, el desarrollo de dichas matrices puede ayudar potencialmente a superar la limitación de la carga mecánica, y actualmente se están evaluando matrices con diferentes rigideces similares a las del corazón en el laboratorio de AnaBios. Otra limitación del sistema de contractilidad óptica de los cardiomiocitos humanos es la ausencia de la red de nervios que irriga el corazón (por ejemplo, fibras simpáticas y parasimpáticas)20. Este contacto neurocardíaco puede restablecerse con la aplicación conjunta de neurotransmisores (por ejemplo, isoproterenol, un agonista de los receptores de β-adrenérgicos; acetilcolina, un agonista de los receptores muscarínicos M2), y se está evaluando el compuesto por sus posibles efectos sobre la contractilidad de los cardiomiocitos. Además, los transitorios de contractilidad se registran sin mediciones simultáneas de potenciales de acción y transitorios de Ca 2+, que también son esenciales para evaluar los efectos del fármaco en el electrocardiograma y el manejo de Ca2+. Aunque esta omisión puede considerarse una limitación del sistema, no es demasiado crítico tenerla, ya que los registros de señales de potencial de acción (con el método de pinza de corriente o colorantes sensibles a la tensión) y los transitorios de Ca 2+ (con indicadores/colorantes de Ca2+) pueden asociarse con citotoxicidad. Estos efectos citotóxicos pueden afectar a la evaluación de nuevos fármacos para modular la contractilidad cardíaca. Por el contrario, el uso de un método óptico no invasivo que preserve la salud, la fisiología y la farmacología de los cardiomiocitos, como el sistema de registro descrito en este protocolo, no solo garantizaría la obtención de datos de contractilidad de la más alta calidad, sino que también proporcionaría datos que pueden predecir bien los efectos contráctiles de nuevos fármacos en humanos.
Divulgaciones
Todos los autores son empleados de la Corporación AnaBios y declaran no tener intereses contrapuestos.
Agradecimientos
Este trabajo contó con el apoyo de AnaBios Corporation y una subvención de los NIH para la Investigación de Innovación en Pequeñas Empresas (SBIR, por sus siglas en inglés) (1R44TR003162-01).
Materiales
| Name | Company | Catalog Number | Comments |
| 100–1000 µL Filtered, Wide Orifice, Sterile tips | Pipette | UF-1000W | |
| 100 mL, Duran pressure plus bottles | DWK Life Sciences | 218102406 | |
| 1 L, 0.22 µm Vacuum Filter system | VWR | 567-0020 | |
| 290 mmol/kg Osmolarity Standard | Wescor | OA-029 | |
| Benchtop pH Meter | Mettler Toledo | https://www.mt.com/us/en/home/products/Laboratory_Analytics_Browse/pH-meter/pH-meters.html | |
| Calcium Chloride dihydrate (CaCl2) | Sigma-Aldrich | C3881 | |
| Camera | Optronis GmbH | Cyclone-25-150-M | https://optronis.com/en/products/cyclone-25-150/ |
| Corning 25 mm x25 mm Square #1 Cover Glass | Corning | 2845-25 | |
| Cyclone-25-150 | Optronis | https://optronis.com/en/products/cyclone-25-150/ | |
| D-(+)-Glucose | Sigma-Aldrich | G8270 | |
| Digital Timer/Stopwatch | Fisher Scientific | 14-649-17 | |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | D8418 | |
| Eight-well rectangular polystyrene sterile culture plate | Thermo Fisher Scientific | 73521-426 | https://us.vwr.com/store/product/4679368/nunclontm-delta-rectangular-dishes-polystyrene-sterile-thermo-scientific |
| FHD Microscope Chamber System | IonOptix | ||
| Flow EZ, Modular pressure-based flow controller with a computer driven program version 1.1.0.0. | Fluigent OxyGEN | ||
| Heavy Duty Vacuum Bottles | VWR | 16211-080 | |
| HEPES | Sigma-Aldrich | H3375 | |
| Human Recombinant Laminin 521 | BioLamina | LM521-05 | |
| Idex Chromatography Tubing, Natural FEP, 1/16" OD x 0.030" ID | Cole-Palmer | 1520L | |
| Kimberly-Clark Professional Kimtech Science Kimwipes | Fisher Scientific | 06-666 | |
| L-(-)-Malic acid | Sigma-Aldrich | 112577 | |
| Lactobionic acid | Sigma-Aldrich | 153516 | |
| L-Glutamic acid | Sigma-Aldrich | 49449 | |
| L-Histidine | Sigma-Aldrich | H8000 | |
| Magnesium Chloride hexahydrate (MgCl2) | Sigma-Aldrich | M9272 | |
| Microscope Temperature Control Stage Warmer | AmScope | TCS-100 | |
| MyoPacer Field Stimulator | IonOptix | ||
| Nunc Rectangular Dishes | Thermo Scientific | 267062 | |
| Olympus IX83P1ZF Ixplore Standard microscope | Olympus | https://www.olympus-lifescience.com/en/microscopes/inverted/ixplore-standard/?campaignid=657680540&adgroupid =116963199831&keyword=ix73%20 microscope&gclid=EAIaIQobChMIl qjyiMWP-AIVVx-tBh2JoQ85EAA YASAAEgLp3fD_BwE | |
| pH 4.01, 7.00, and 10.01 Standards | Oakton | WD-05942-10 | |
| Potassium Chloride (KCl) | Sigma-Aldrich | 746436 | |
| Potassium Hydroxide (KOH) | Sigma-Aldrich | P4494 | |
| Potassium phosphate monobasic (KH2PO4) | Sigma-Aldrich | 795488 | |
| Prism Software | GraphPad Software - Dotmatics | https://www.graphpad.com/ | |
| RBS 25 Liquid Detergent | Sigma-Aldrich | 83460 | |
| Sharps Container | Uline | S-15307 | |
| SigmaPlot analysis software | Systat Software Inc. | https://systatsoftware.com/ | |
| Sodium Chloride (NaCl) | Sigma-Aldrich | S3014 | |
| Sodium Hydroxide (NaOH) | Sigma-Aldrich | 221465 | |
| Student Dumont #5 Forceps | Fine Science Tools | 91150-20 | |
| Sucrose | Sigma-Aldrich | S7903 | |
| Taurine | Sigma-Aldrich | T0625 | |
| Temperature Control Box | Warner Insturments | TC-324C | |
| Vapor Pressure Osmometer | ELITechGroup | Model 5600 | |
| Wheaton 20 mL Vials | DWK Life Sciences | 225288 |
Referencias
- Abi-Gerges, N., Miller, P. E., Ghetti, A. Human heart cardiomyocytes in drug discovery and research: new opportunities in translational sciences. Current Pharmaceutical Biotechnology. 21 (9), 787806 (2020).
- Cook, D., et al. Lessons learned from the fate of AstraZeneca's drug pipeline: A five dimensional framework. Nature Reviews Drug Discovery. 13 (6), 419-431 (2014).
- Van Meer, B. J., Tertoolen, L. G. J., Mummery, C. L. Measuring physiological responses of human pluripotent stem cell derived cardiomyocytes to drugs and disease. Stem Cell. 34 (8), 2008-2015 (2016).
- Piccini, J. P., et al. Current challenges in the evaluation of cardiac safety during drug development: translational medicine meets the critical path initiative. American Heart Journal. 158 (3), 317-326 (2009).
- Pang, L., et al. Workshop report: FDA workshop on improving cardiotoxicity assessment with human-relevant platforms. Circulation Research. 125 (9), 855-867 (2019).
- Page, G., et al. Human ex-vivo action potential model for pro-arrhythmia risk assessment. Journal of Pharmacological and Toxicological Methods. 81, 183-195 (2016).
- Britton, O. J., et al. Quantitative comparison of effects of dofetilide, sotalol, quinidine, and verapamil between human ex vivo trabeculae and in silico ventricular models incorporating inter-individual action potential variability. Frontiers in Physiology. 8, 597 (2017).
- Qu, Y., et al. Action potential recording and pro-arrhythmia risk analysis in human ventricular trabeculae. Frontiers in Physiology. 8, 1109 (2017).
- Trovato, C., et al. Human Purkinje in silico model enables mechanistic investigations into automaticity and pro-arrhythmic abnormalities. Journal of Molecular and Cellular Cardiology. 142, 24-38 (2020).
- Otsomaa, L., et al. Discovery and characterization of ORM-11372, a novel inhibitor of the sodium-calcium exchanger with positive inotropic activity. British Journal of Pharmacology. 177 (24), 5534-5554 (2020).
- Nguyen, N., et al. Adult human primary cardiomyocyte-based model for the simultaneous prediction of drug-induced inotropic and pro-arrhythmia risk. Frontiers in Physiology. 8, 1073 (2017).
- Abi-Gerges, N., et al. Multiparametric mechanistic profiling of inotropic drugs in adult human primary cardiomyocytes. Scientific Reports. 10, 7692 (2020).
- Jordaan, P., et al. Cardiotoxic potential of hydroxychloroquine, chloroquine and azithromycin in adult human primary cardiomyocytes. Toxicological Sciences. 180 (2), 356-368 (2021).
- Ton, A. T., et al. Arrhythmogenic and antiarrhythmic actions of late sustained sodium current in the adult human heart. Scientific Reports. 11, 12014 (2021).
- Schmid, C., Abi-Gerges, N., Leither, M. G., Zellner, D., Rast, G. Ion channel expression and electrophysiology of singular human (primary and induced pluripotent stem cell-derived) cardiomyocytes. Cells. 10 (12), 3370 (2021).
- Guha, R. On exploring structure activity relationships. Methods in Molecular Biology. 993, 81-94 (2013).
- Tannenbaum, J., Bennett, B. T. Russell and Burch's 3Ra then and now: The need for clarity in definition and purpose. Journal of the American Association for Laboratory Animal Science. 54 (2), 120-132 (2015).
- Ruiz-Meana, M., Martinson, E. A., Garcia-Dorado, D., Piper, H. M. Animal ethics in cardiovascular research. Cardiovascular Research. 93 (1), 1-3 (2012).
- Rienks, M., Papageorgiou, A. P., Frangogiannis, N. G., Heymans, S. Myocardial extracellular matrix. Circulation Research. 114 (5), 872-888 (2014).
- Zaglia, T., Mongillo, M. Cardiac sympathetic innervation, from a different point of (re)view. Journal of Physiology. 595 (12), 3919-3930 (2017).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados