Method Article
Misurazione della contrattilità cardiaca in cardiomiociti primari umani adulti isolati
In questo articolo
Riepilogo
Questo protocollo descrive come misurare la contrattilità nei cardiomiociti primari umani adulti provenienti da cuori di donatori con il sistema MyoBLAZER, una piattaforma affidabile per valutare i cambiamenti della contrattilità indotti da farmaci durante lo sviluppo preclinico.
Abstract
La valutazione dei cambiamenti nella contrattilità cardiaca è essenziale durante lo sviluppo preclinico di nuovi composti cardiaci e non cardiaci. Questo articolo descrive un protocollo per la valutazione dei cambiamenti nella contrattilità nei cardiomiociti ventricolari primari umani adulti utilizzando MyoBLAZER, un metodo ottico non invasivo che preserva la normale fisiologia e farmacologia delle cellule. Questo metodo di registrazione ottica misura continuamente i transitori di contrattilità da più cellule in parallelo, fornendo sia il rendimento medio che informazioni preziose per ogni singola cellula nel campo visivo, consentendo il monitoraggio in tempo reale degli effetti dei farmaci. Le contrazioni dei cardiomiociti sono indotte dalla stimolazione del campo elettrico e le immagini acquisite in campo chiaro vengono inviate a un software di elaborazione delle immagini che misura l'accorciamento del sarcomero su più cardiomiociti. Questo metodo genera rapidamente diversi endpoint relativi alla cinetica delle fasi di contrazione e rilassamento e i dati risultanti possono quindi essere interpretati in relazione alle diverse concentrazioni di un articolo di prova. Questo metodo viene utilizzato anche nelle ultime fasi dello sviluppo preclinico per eseguire studi meccanicistici di follow-up a supporto degli studi clinici in corso. Pertanto, il modello basato su cardiomiociti primari umani adulti combinato con il sistema ottico per il monitoraggio continuo della contrattilità ha il potenziale per contribuire a una nuova era di traducibilità dei dati cardiaci in vitro nello sviluppo della terapia medica preclinica.
Introduzione
La contrattilità miocardica (inotropia), che rappresenta la naturale capacità del muscolo cardiaco di contrarsi, è una proprietà chiave della funzione cardiaca e dipende dalla dinamica dell'accoppiamento elettromeccanico. I cambiamenti indotti da farmaci nella contrattilità miocardica sono auspicabili per il trattamento di malattie cardiache (ad es. insufficienza cardiaca) e non ricercati nel contesto della cardiotossicità (ad es. riduzione della frazione di eiezione ventricolare sinistra). Pertanto, i modelli di contrattilità preclinica devono essere associati a un'accurata predittività per garantire che i nuovi farmaci possano avere successo durante lo sviluppo clinico. Tuttavia, le attuali strategie precliniche, che si basano su modelli cellulari artificiali riduzionisti (ad esempio, linee cellulari immortalizzate geneticamente modificate che sovraesprimono specifici bersagli cardiaci di interesse) e modelli animali non umani, hanno mostrato limiti significativi e sono state trovate associate ad alti tassi di abbandono dei farmaci (ad esempio, un alto tasso di falsi segnali)1,2,3,4 . Di conseguenza, è imperativo stabilire modelli di contrattilità cardiaca cellulare umana nuovi e affidabili che siano associati a un'elevata potenza (cioè ad un alto tasso di segnali veri) per prevedere gli esiti dei farmaci negli esseri umani e, quindi, contribuire ad accelerare il lancio di nuove terapie5.
I metodi innovativi recentemente istituiti per il recupero di cuori di donatori umani per la ricerca 6,7,8,9,10 e nelle tecniche di isolamento dei cardiomiociti 11,12,13,14,15 hanno fornito un'opportunità unica per condurre studi sull'uomo durante lo sviluppo preclinico. A tal fine, i cardiomiociti primari umani adulti hanno già dimostrato utilità nella valutazione dei cambiamenti indotti dai farmaci nella contrattilità cardiacaumana 11,12,13,14. L'articolo descrive in dettaglio il protocollo per studiare gli effetti della contrattilità di nuovi composti nei cardiomiociti umani adulti.
Protocollo
Tutti i metodi sono stati eseguiti in conformità con le linee guida e i regolamenti pertinenti. Tutti i cuori umani utilizzati per gli studi non erano trapiantabili ed eticamente ottenuti con il consenso legale informato (in prima persona o parente prossimo) da donatori di organi da cadavere negli Stati Uniti (USA). I protocolli di recupero e la sperimentazione in vitro sono stati pre-approvati dagli Institutional Review Board (IRB) presso i centri di trapianto all'interno dell'US Organ Procurement Transplant Network (OPTN). Inoltre, tutti i trasferimenti dei cuori dei donatori sono completamente tracciabili e periodicamente rivisti dalle autorità federali statunitensi.
NOTA: Applicare tutte le procedure di sicurezza necessarie durante l'esecuzione di questo protocollo, compreso l'uso di dispositivi di protezione individuale appropriati (ad es. camici da laboratorio, occhiali di sicurezza, guanti).
1. Isolamento dei cardiomiociti (1 giorno prima della misurazione della contrattilità)
- Riperfondere i cuori dei donatori immediatamente dopo l'arrivo in laboratorio con la soluzione cardioplegica brevettata ghiacciata6 e isolare enzimaticamente i miociti primari umani adulti dai ventricoli 11,12,13,14,15.
- Quindi, mantenere i cardiomiociti in sospensione e conservarli con 10 mL di soluzione A (110 mM saccarosio, 0,005 mM CaCl 2, 3 mM MgCl 2, 70 mM KOH, 60 mM acido lattobionico, 10 mM KH 2 PO4, 20 mM taurina, 20 mM L-istidina, 20 mM HEPES, 2 mM acido L-glutammico, 2 mM acido L-(-)-malico, pH 7,4 con KOH) in flaconcini di Wheaton da 20 mL (Table of Materials) a temperatura refrigerata fino a quando non vengono interrogati sperimentalmente.
NOTA: Conservare 200.000 cellule per flaconcino.
2. Preparazione del rivestimento in laminina (1 giorno prima della misurazione della contrattilità)
- Posizionare un singolo vetrino coprioggetti (quadrato 25 mm x 25 mm, Tabella dei materiali) in ciascun pozzetto di una piastra di coltura a otto pozzetti (Tabella dei materiali).
- Quindi, rivestire i vetrini coprioggetti con laminina a una concentrazione di 5 μg/mL. A tal fine, aggiungere 800 μL di Laminina 521 ricombinante umana (Tabella dei materiali, conservata a −20 °C) a 7,2 mL di soluzione B (145 mM NaCl, 4 mM KCl, 2,5 mM CaCl 2, 1 mM MgCl2, 11,1 mM di glucosio e 10 mM di HEPES, pH 7,4 con NaOH) e mescolare bene.
- Far cadere 200 μL della soluzione di laminina diluita al centro di ciascun vetrino coprioggetto. Quindi, coprite il piatto e impilatelo in frigorifero a 4 °C.
NOTA: Preparare più piastre di coltura a otto pozzetti per assicurarsi che ci siano abbastanza vetrini coprioggetti rivestiti di laminina.
3. Preparazione di cardiomiociti tolleranti al Ca2+ (il giorno della misurazione della contrattilità)
- Rimuovere un flaconcino di cellule dal frigorifero, aspirare la soluzione A dal flaconcino e aggiungere 10 ml di soluzione B refrigerata.
NOTA: Assicurarsi che le cellule non siano aspirate e disperdere la soluzione B nel flaconcino posizionando la pipetta all'interno della parte superiore della parete del flaconcino. - Tappare il flaconcino di cellule e poi agitare delicatamente per assicurarsi che le cellule siano disperse nella soluzione B. Infine, lasciare che le celle si stabilizzino per 1 ora a temperatura ambiente (RT).
4. Preparazione del sistema di registrazione (il giorno della misurazione della contrattilità)
NOTA: Il sistema di registrazione include una scatola di controllo della temperatura, uno stimolatore, una perfusione a pressione controllata da computer, flaconi di perfusione a pressione, un software di acquisizione interno che consente la selezione delle regioni di interesse (ROI) e la visualizzazione dei transienti di contrattilità, un microscopio invertito, una camera cellulare e una telecamera (Figura 1).
- Accendere il sistema di aspirazione dell'aspirazione. Quindi, rimuovere il coperchio del microscopio, accenderlo, collegare la fotocamera (Tabella dei materiali, Figura 1) e, infine, verificare che la ventola sia accesa per assicurarsi che la fotocamera non si surriscaldi.
- Quindi, accendere la piastra riscaldante del microscopio (Tabella dei materiali) e la scatola di controllo della temperatura (Tabella dei materiali, Figura 1) e impostarle alla temperatura di esercizio corretta. Quindi, accendere lo stimolatore di campo (Tabella dei materiali, Figura 1) e il sistema di pressione. Infine, collegare il tubo della soluzione (Tabella dei materiali) alla camera di registrazione (Tabella dei materiali, Figura 1).
5. Preparazione dei composti in esame (il giorno della misurazione della contrattilità)
- Dimetil solfossido diluito (DMSO; Tabella dei materiali) 1.000 volte in soluzione C (145 mM NaCl, 4 mM KCl, 1,8 mM CaCl 2, 1 mM MgCl2, 11,1 mM di glucosio e 10 mM di HEPES, pH 7,4 con NaOH) per ottenere una soluzione per veicoli DMSO allo 0,1%.
- Per testare un composto a 1, 10 volte, 100 volte e 1000 volte della sua esposizione terapeutica di 0,001 μM, sciogliere il composto in esame in DMSO a una concentrazione di 1 mM.
- Diluire questa soluzione in serie con DMSO per produrre altri tre stock di DMSO (ad esempio, 0,001 mM, 0,01 mM e 0,1 mM). Infine, diluire ciascuna riserva di composti in esame 1.000 volte in 100 mL di soluzione C per ottenere le concentrazioni di prova finali (0,001 μM, 0,01 μM, 0,1 μM e 1 μM).
- Aggiungere la soluzione del veicolo e le soluzioni delle concentrazioni micromolari finali del composto in flaconi di vetro da 100 mL (Tabella dei materiali, Figura 1) e quindi collegare i flaconi al sistema di perfusione a pressione (Tabella dei materiali, Figura 1).
- Quindi, adescare il sistema di perfusione con un programma computerizzato (Table of Materials) utilizzando una pressione di 200-300 mbar per fornire un flusso di perfusione costante a una velocità di 1,8 mL/min.
NOTA: Non condurre l'esperimento se il composto in esame risulta essere associato a un problema di solubilità. Inoltre, formulare le soluzioni di prova composte dalle soluzioni madre entro 30 minuti prima dell'applicazione sperimentale alle cellule.
6. Placcatura dei cardiomiociti (il giorno della misurazione della contrattilità)
- Estrarre dal frigorifero a 4 °C una piastra a otto pozzetti contenente vetrini coprioggetti rivestiti di laminina e collocare con cura un vetrino coprioggetti in una camera di registrazione molto ben pulita (Figura 1). Quindi, rimettere la piastra a otto pozzetti nel frigorifero a 4 °C fino alla successiva impiattamento.
NOTA: Utilizzare un panno privo di lanugine (Tabella dei materiali) per pulire il vetrino coprioggetto rivestito mantenendo il vetrino coprioggetto ricoperto da un sottile strato di laminina. Inoltre, assicurati di smaltire i vetrini coprioggetti usati in un contenitore per oggetti taglienti. - Quindi, prelevare un flaconcino di cellule intensificato (passaggio 3.2) e aspirare la soluzione B dal flaconcino per raggiungere un volume il più piccolo possibile senza perdere cellule (~200 μL). Successivamente, erogare i 200 μL di cellule nella camera del microscopio di registrazione montata sul tavolino di un microscopio invertito (Tabella dei materiali).
- Lasciare che le cellule si depositino sul vetrino coprioggetto per 5 minuti. Mentre si attende che le cellule si stabilizzino completamente, aprire il campo visivo al microscopio e determinare se la densità cellulare è adeguata (~70%) per l'inizio dell'esperimento.
NOTA: Assicurarsi che l'aspirazione non aspiri tutte le cellule se vengono erogati più di 200 μL.
7. Registrazione della contrattilità dei cardiomiociti
- Al termine della placcatura, equilibrare le celle per 5 minuti perfondendole continuamente con la soluzione C utilizzando il sistema di perfusione a pressione (Tabella dei materiali). Regolare correttamente l'aspirazione, accendere sia la scatola di controllo della temperatura che la piastra riscaldante e impostarle per erogare ~35 °C.
- Quindi, stimolare le cellule con una tensione superiore alla soglia a una frequenza di stimolazione di 1 Hz (impulso bipolare della durata di 3 ms) su uno stimolatore di campo con una coppia di fili di platino posti ai lati opposti della camera collegata a uno stimolatore di campo.
- Impostare l'ampiezza dell'impulso stimolante a 1 V, quindi aumentarla fino a quando i cardiomiociti iniziano a generare cicli di contrazione-rilassamento. Usare un valore di soglia pari a 1,5x durante l'esperimento.
NOTA: Selezionare cellule sane con morfologia a forma di bastoncino e striature chiare. Quindi, regolare il campo visivo e concentrarsi sul portare in vista il maggior numero possibile di celle contraenti (Figura 2A). - Successivamente, visualizzare le immagini digitalizzate delle cellule all'interno del software di acquisizione del sistema di registrazione della contrattilità ottica. Questo software utilizza una telecamera ad alta risoluzione e frame rate con una velocità di 150 FPS (Table of Materials, Figura 1) per registrare un flusso video contenente più miociti nello stesso fotogramma.
NOTA: Ciò fornisce una risoluzione temporale e spaziale sufficiente per catturare e misurare contemporaneamente la dinamica del sarcomero di diversi miociti sani. I moderni processori ad alto numero di core vengono sfruttati per consentire il calcolo parallelo delle variazioni della lunghezza del sarcomero dal flusso video in tempo reale (i dati sulla densità ottica sono raccolti da regioni di interesse [ROI] definite dall'utente posizionate sopra le immagini di cardiomiociti sani e parallele all'asse di contrazione, Figura 2B). I dati di intensità ottica mostrano bande luminose e scure corrispondenti alle linee Z dei cardiomiociti (Figura 1, Figura 2C). Infine, questi dati vengono visualizzati all'utente a scopo di monitoraggio e salvati su un disco per un'analisi successiva (Figura 2C).- Evita le aree delle celle che non sono a fuoco. Inoltre, non posizionare le ROI vicino al bordo delle cellule, poiché i cambiamenti nella contrazione delle cellule durante l'applicazione dei farmaci possono far sì che le ROI non siano in grado di leggere la contrazione delle cellule.
- Quando la selezione delle ROI è completata e le contrazioni soddisfano gli standard necessari per l'uso (ad esempio, accorciamento del sarcomero >1%; contrazione ritmica all'applicazione di una frequenza di stimolazione di 1 Hz, assenza di eventi aritmici), iniziare l'esperimento per valutare gli effetti di un composto. Il protocollo di stimolazione e la sequenza di applicazione delle concentrazioni di prova da parte del composto sono riportati nella Tabella 1. Il software di acquisizione gestirà, in modo automatizzato, l'acquisizione e la visualizzazione dei dati e l'etichettatura delle concentrazioni di prova e del tempo di trattamento.
NOTA: Applicare le concentrazioni di prova se la contrazione rimane a un'ampiezza stabile per l'intero periodo di riferimento del veicolo. Squalifica le celle che visualizzano una rincorsa o una discesa. Inoltre, assicurarsi che la perfusione sia commutata alle diverse concentrazioni di prova durante l'esperimento.
- Al termine dell'esperimento e dell'archiviazione dei dati sul server, spegnere la perfusione e il riscaldatore, interrompere la stimolazione, pulire la camera del microscopio con acqua distillata, quindi rimuovere il vetrino coprioggetti e asciugare accuratamente la camera.
NOTA: Pulire accuratamente la camera in quanto ciò è fondamentale per evitare di esporre prematuramente il prossimo set di cellule a qualsiasi composto, invalidando così tutti i dati raccolti. - Successivamente, eseguire una nuova placcatura dei cardiomiociti ed eseguire un ulteriore esperimento per ottenere dati sufficienti per completare il test del composto o testare un nuovo composto.
8. Disattivazione del sistema di registrazione della contrattilità ottica
- Al termine dei test giornalieri dei composti, spegnere prima tutte le apparecchiature che non sono necessarie per pulire il sistema e copiare i dati per l'analisi offline.
- Successivamente, rimuovere i flaconi di vetro da 100 ml (Tabella dei materiali) contenenti le soluzioni delle concentrazioni finali del test e sostituirli con flaconi di vetro riempiti a metà con la soluzione concentrata RBS 25 (Tabella dei materiali). Perfondere la soluzione RBS attraverso la camera del microscopio per 5 minuti, quindi scollegare il tubo di perfusione dalla camera, pulirlo con acqua distillata e, infine, asciugarlo accuratamente.
NOTA: Assicurarsi che l'aspirapolvere funzioni bene per evitare possibili allagamenti. - Quindi, collegare il tubo di perfusione al tubo di drenaggio. Utilizzando il software del sistema di perfusione a pressione (Tabella dei materiali), far funzionare la soluzione RBS per 10 minuti assicurandosi che la pressione e la portata siano impostate in modo adeguato. Quindi, perfondere DMSO all'1% per 5 minuti e poi acqua distillata per 15-20 minuti per completare la pulizia del sistema di perfusione.
- Spegnere la luce del microscopio e mettere il coperchio. Quindi, scollegare i cavi della fotocamera dalla scatola sul lato del microscopio e spegnere la ventola. Assicurarsi che tutte le bottiglie usate vengano inviate per la pulizia e l'autoclave. Infine, assicurati che tutti i secchi di drenaggio siano pieni per 1/4 o meno.
NOTA: Assicurarsi che ci siano abbastanza vetrini coprioggetti rivestiti di laminina per l'uso il giorno successivo. - Infine, copiare i file nella cartella di acquisizione di tutti gli esperimenti eseguiti su ciascun sistema di registrazione e incollarli in un server di backup sicuro per un'ulteriore analisi offline. Successivamente, eliminare tutti i file di dati dalla cartella di acquisizione.
9. Analisi dei dati di contrattilità
- Esegui l'analisi offline utilizzando il software di analisi e una macro personalizzata per calcolare la media dei dati. Il software di analisi calcola e riporta varie metriche a partire dai dati di dinamica del sarcomero prodotti dal software di acquisizione. Un elenco dettagliato di questi parametri è fornito nella Figura 2D.
NOTA: L'applicazione di tecniche software di basso livello consente di analizzare molte sequenze di registrazioni in 5 secondi. Il parametro principale per valutare i cambiamenti della contrattilità indotti dai farmaci è l'ampiezza della contrattilità (% di accorciamento del sarcomero = variazione della lunghezza del sarcomero). Viene calcolata come la lunghezza del sarcomero al picco di contrazione/lunghezza del sarcomero a riposo e calcolata la media degli ultimi 20 transienti di contrattilità per ciascuna concentrazione di prova. - Quantificare gli effetti dei composti in esame sull'ampiezza media della contrattilità rispetto alla specifica condizione basale di controllo del veicolo di ciascun cardiomiocita.
- Esprimere i risultati medi come media ± SEM e produrre un grafico che traccia l'effetto della concentrazione del composto in esame sull'ampiezza della contrattilità. Successivamente, adattare la curva concentrazione-risposta all'equazione di Hill utilizzando un software di analisi (Table of Materials) per derivare i valori IC50 (concentrazione che produce un'inibizione del 50% dell'ampiezza della contrattilità) e EC50 (concentrazione che produce un aumento del 50% dell'ampiezza della contrattilità).
- Oltre all'ampiezza della contrattilità, è possibile calcolare anche altri parametri:
- Postcontrazione: Identificare la postcontrazione come una contrazione secondaria spontanea transitoria del cardiomiocita che si verifica prima della successiva contrazione regolare e produce una contrazione anomala e non sincronizzata.
- Fallimento della contrazione: Identificare il fallimento della contrazione come l'incapacità dello stimolo elettrico di indurre una contrazione.
- Variabilità a breve termine (STV) e alternanze: visualizza questi due parametri nei diagrammi di Poincaré della variabilità dell'ampiezza di contrazione.
- Calcolare l'STV (∑|CAn + 1 − CAn| (20 × √2) −1) con gli ultimi 20 transitori di ciascun periodo di concentrazione dell'articolo di controllo e dell'articolo di prova. Identificare gli alternani come transitori ripetitivi di contrattilità alternata breve e lunga ampiezza.
- Per calcolare l'incidenza della pro-aritmia, normalizzare i valori di STV al valore di controllo del veicolo di ciascuna cellula, tracciare la post-contrazione, il fallimento della contrazione, l'STV e le alternanze ed esprimerli come % dell'incidenza delle cellule che presentano ciascuno dei segnali.
- Completare la profilazione meccanicistica multiparametrica con il calcolo del tempo di picco Ato, del decadimento al 30% di rilassamento (Decadimento 30), del decadimento al 90% di rilassamento (Decadimento 90), del tempo al 90% di rilassamento (TR90) (Figura 2D), della lunghezza del sarcomero basale, del tempo al 50% del picco, dell'altezza del picco, della lunghezza del sarcomero alla contrattilità del picco, della velocità massima di contrazione e della velocità massima di rilassamento12. Come l'ampiezza della contrattilità, esprimere questi parametri relativi alla specifica condizione di controllo basale di ciascun cardiomiocita e rappresentarli graficamente in grafici concentrazione-risposta.
Risultati
In questo protocollo è descritta una procedura per misurare la contrattilità in cardiomiociti primari umani adulti isolati da donatori di organi e valutare i cambiamenti acuti nei parametri di contrattilità indotti da un composto in esame. La misurazione del transitorio di contrattilità viene effettuata utilizzando un sistema di geometria cellulare basato su video, il MyoBLAZER, che misura la dinamica del sarcomero, e la condizione cardiaca dell'adulto viene emulata inducendo la contrattilità con la stimolazione elettrica alla frequenza di stimolazione fisiologica (1 Hz). La vitalità funzionale dei cardiomiociti è confermata dalla valutazione del loro accoppiamento eccitazione-contrazione (cioè l'elaborazione cellulare che collega l'eccitazione elettrica [il potenziale d'azione sarcolemmale] con la contrazione). Non ci sono transienti di contrattilità spontanea nei cardiomiociti umani e i cardiomiociti rispondono alla stimolazione elettrica esterna con cicli di contrattilità/rilassamento (Figura 2C, E), così come all'isoproterenolo, un agonista β-adrenergico (Figura 2F, G). L'isoproterenolo provoca un aumento della contrattilità dipendente dalla concentrazione (Figura 2G) e i suoi effetti sulla cinetica del transitorio di contrattilità possono anche essere caratterizzati (Figura 2D)12.

Figura 1: Configurazione sperimentale del sistema di registrazione della contrattilità ottica. Le registrazioni della contrattilità in campo chiaro sono effettuate da cardiomiociti primari umani adulti come descritto in precedenza11,12,13,14. La configurazione include una (A) scatola di controllo della temperatura, (B) stimolatore di campo, (C,D) sistema di perfusione a pressione, (E) programma computerizzato guidato dalla pressione, (F) pressione più bottiglie, (G) software di acquisizione, (H) selezione del ROI con software di acquisizione, (I) visualizzazione dei transitori di contrattilità con software di acquisizione, (J) microscopio invertito, (K) camera del microscopio e ( L) macchina fotografica. Tutte le caratteristiche dell'attrezzatura sono riportate nella Tabella dei materiali. Fare clic qui per visualizzare una versione più grande di questa figura.
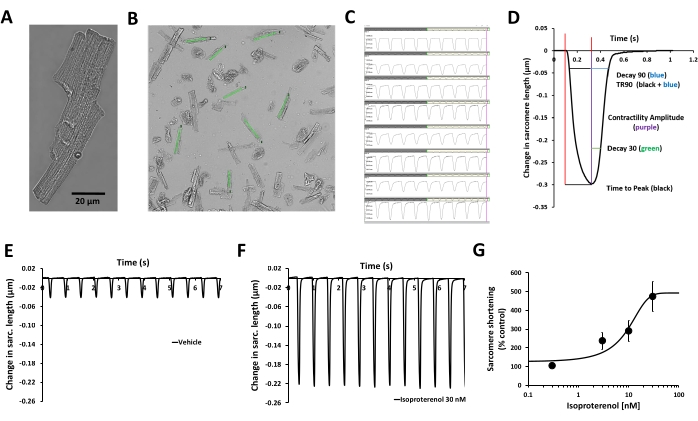
Figura 2: Validazione della misurazione della contrattilità dei cardiomiociti umani e dell'effetto della stimolazione β-adrenergica. (A) Immagine al microscopio a contrasto di fase di un cardiomiocita primario umano adulto rappresentativo, (B) regioni di interesse (ROI) definite dall'utente posizionate sopra le immagini di cardiomiociti sani e parallele all'asse di contrazione, (C) visualizzazione dei transitori di contrattilità ottenuti dalle stesse ROI in (B) con il software di acquisizione, (D) parametri relativi al transitorio di contrattilità misurato con il software di acquisizione: ampiezza della contrattilità, tempo al picco, Decadimento 30, Decadimento 90, TR90. È inoltre possibile misurare ulteriori parametri: lunghezza del sarcomero basale, tempo al picco del 50%, altezza del picco, lunghezza del sarcomero alla contrattilità del picco, velocità massima di contrazione e velocità massima di rilassamento. (E) Transitori di contrattilità tipici registrati da un miocita ventricolare primario umano adulto a una frequenza di stimolazione di 1 Hz in presenza di controllo del veicolo (F) e dopo esposizione a isoproterenolo 30 nM, un agonista β-adrenergico non selettivo. I transienti di contrattilità dimostrati nei pannelli E e F sono stati raccolti dallo stesso cardiomiocita. L'isoproterenolo da cardiomiociti umani stimolati a una frequenza di stimolazione di 1 Hz è stato utilizzato per generare le informazioni sulla potenza. (G) Curva concentrazione-risposta cumulativa tipica generata dalla misurazione della contrattilità dei cardiomiociti umani con isoproterenolo (n = 8 cellule). Fare clic qui per visualizzare una versione più grande di questa figura.
| Sequenza di perfusione | Soluzione per veicoli | Concentrazione 1 (μM) | Concentrazione 2 (μM) | Concentrazione 3 (μM) | Concentrazione 4 (μM) | Lavare |
| Tempo di trattamento | 120 secondi | 300 secondi | 300 secondi | 300 secondi | 300 secondi | 300 secondi |
| Frequenza di stimolazione | 1 Hz | 1 Hz | 1 Hz | 1 Hz | 1 Hz | 1 Hz |
Tabella 1: Protocollo di stimolazione e sequenza di applicazione del composto in esame. La stabilità dei transitori di contrattilità viene valutata mediante registrazione continua per 120 s nella soluzione C, stabilendo il controllo del veicolo (tipicamente in DMSO allo 0,1%). Successivamente, la concentrazione dell'articolo in esame viene applicata per un minimo di 300 s o fino al raggiungimento di un effetto stazionario. Vengono utilizzate quattro concentrazioni crescenti dell'articolo in esame, che forniscono curve cumulative concentrazione-effetto (C-E). Al termine delle aggiunte cumulative dell'articolo di prova, è possibile implementare un periodo di washout di 300 s.
Discussione
Questo manoscritto fornisce un protocollo dettagliato per il sistema ottico basato sulla contrattilità dei cardiomiociti umani adulti per un metodo semplificato a medio rendimento che consente di testare l'efficacia acuta e la cardiotossicità di nuovi composti. Questo sistema di registrazione ottica della contrattilità è facile da usare, consente registrazioni da più cellule in parallelo, consente la valutazione simultanea della salute, della fisiologia e della farmacologia cellulare, viene fornito con un'analisi dei dati automatizzata e rapida (una serie di più cellule viene analizzata in 5 secondi) e consente una rapida raccolta dei dati (curva concentrazione-risposta ogni 30 minuti/composto/dispositivo). Tenendo conto di questi attributi, il sistema di registrazione può essere utilizzato non solo per rilevare gli effetti dei farmaci sulla contrattilità dei cardiomiociti, ma anche per fornire dati di relazione struttura-attività per supportare gli sforzi della chimica farmaceutica durante le prime fasi della scoperta di farmaci16. Poiché decine di milioni di cellule possono essere ottenute da un protocollo di isolamento dei cardiomiociti, l'applicazione della piattaforma del sistema di registrazione ottica della contrattilità-cardiomiociti è attualmente in fase di studio per ottenere una maggiore capacità di test (con l'uso di piastre basate su pozzetti) con costi ridotti. Inoltre, la valutazione degli effetti dei farmaci sui parametri sistolici e di rilassamento misurati con il sistema di registrazione può fornire una profilazione meccanicistica multiparametrica dei farmaci inotropi12. Inoltre, i dati sulla contrattilità dei cardiomiociti possono essere utilizzati per classificare i nuovi farmaci dal più al meno cardiotossico (ad esempio, il margine di sicurezza) e dal meno al più efficace (ad esempio, il margine di potenza). Possono anche essere condotti studi di follow-up sulla contrattilità dei cardiomiociti per supportare i programmi di sviluppo che sono stati associati a una diminuzione clinica della contrattilità miocardica12.
Un altro vantaggio significativo dell'utilizzo del sistema di registrazione ottica della contrattilità dei cardiomiociti umani è il suo allineamento con il concetto delle 3R (sostituzione, riduzione e perfezionamento)17 poiché può essere considerato come un metodo alternativo che evita o sostituisce l'uso di animali per la generazione di dati all'interno dell'industria farmaceutica. Questo beneficio delle 3R può essere esteso anche alla ricerca cardiaca accademica. L'insieme delle attuali conoscenze sulla fisiologia e la farmacologia dei cardiomiociti deriva da studi di ricerca accademici condotti con cellule isolate da cuori animali18. Pertanto, il modello di contrattilità ottica dei cardiomiociti umani apre la possibilità di eseguire studi traslazionali critici. Per eseguire questi studi, devono essere sviluppati protocolli per la conservazione e la spedizione di cardiomiociti umani adulti (attualmente in fase di valutazione nel laboratorio di AnaBios) e il sistema di contrattilità deve avere la capacità di registrare i cambiamenti nella lunghezza del sarcomero da cardiomiociti non umani (questo è il caso del sistema di registrazione della contrattilità ottica poiché i sarcomeri sono ben conservati tra le specie).
Il sistema di contrattilità dei cardiomiociti umani è in grado di emulare diverse condizioni fisiologiche (ad esempio, l'accoppiamento elettromeccanico, la frequenza di stimolazione che imita la frequenza cardiaca, la temperatura corporea, l'integrazione di tutti i bersagli cardiaci umani) e ha dimostrato un valore traslazionale come componente chiave nella scoperta di farmaci11,12,13,14, sebbene non possa imitare le variazioni del carico meccanico e dello sforzo di taglio osservate durante il ciclo contrattile cardiaco. La struttura e la funzione delle matrici extracellulari cardiache sono ora meglio comprese19, lo sviluppo di tali matrici può potenzialmente aiutare a superare la limitazione del carico meccanico e matrici con diverse rigidità simili a quelle cardiache sono attualmente in fase di valutazione nel laboratorio di AnaBios. Un'altra limitazione del sistema di contrattilità ottica dei cardiomiociti umani è l'assenza della rete di nervi che alimenta il cuore (ad esempio, fibre simpatiche e parasimpatiche)20. Questo contatto neuro-cardiaco può essere ristabilito con la co-applicazione di neurotrasmettitori (ad esempio, isoproterenolo, un agonista dei recettori β-adrenergici; acetilcolina, un agonista dei recettori muscarinici M2), con il composto valutato per i suoi potenziali effetti sulla contrattilità dei cardiomiociti. Inoltre, i transienti di contrattilità vengono registrati senza misurazioni simultanee dei potenziali d'azione e dei transitori di Ca 2+, che sono anche essenziali quando si valutano gli effetti dei farmaci sull'elettrocardiogramma e sulla manipolazione di Ca2+. Sebbene questa omissione possa essere considerata un limite del sistema, non è troppo critica averla poiché le registrazioni dei segnali del potenziale d'azione (con il metodo della pinza amperometrica o dei coloranti sensibili al voltaggio) e dei transitori Ca 2+ (con indicatori/coloranti Ca2+) possono essere associate alla citotossicità. Tali effetti citotossici possono influire sulla valutazione di nuovi farmaci per modulare la contrattilità cardiaca. Al contrario, l'uso di un metodo ottico non invasivo che preservi la salute, la fisiologia e la farmacologia dei cardiomiociti, come il sistema di registrazione descritto in questo protocollo, non solo garantirebbe l'ottenimento della massima qualità dei dati sulla contrattilità, ma fornirebbe anche dati in grado di prevedere bene gli effetti contrattili dei nuovi farmaci nell'uomo.
Divulgazioni
Tutti gli autori sono dipendenti di AnaBios Corporation e dichiarano di non avere interessi concorrenti.
Riconoscimenti
Questo lavoro è stato sostenuto da AnaBios Corporation e da una sovvenzione NIH Small Business Innovation Research (SBIR) (1R44TR003162-01).
Materiali
| Name | Company | Catalog Number | Comments |
| 100–1000 µL Filtered, Wide Orifice, Sterile tips | Pipette | UF-1000W | |
| 100 mL, Duran pressure plus bottles | DWK Life Sciences | 218102406 | |
| 1 L, 0.22 µm Vacuum Filter system | VWR | 567-0020 | |
| 290 mmol/kg Osmolarity Standard | Wescor | OA-029 | |
| Benchtop pH Meter | Mettler Toledo | https://www.mt.com/us/en/home/products/Laboratory_Analytics_Browse/pH-meter/pH-meters.html | |
| Calcium Chloride dihydrate (CaCl2) | Sigma-Aldrich | C3881 | |
| Camera | Optronis GmbH | Cyclone-25-150-M | https://optronis.com/en/products/cyclone-25-150/ |
| Corning 25 mm x25 mm Square #1 Cover Glass | Corning | 2845-25 | |
| Cyclone-25-150 | Optronis | https://optronis.com/en/products/cyclone-25-150/ | |
| D-(+)-Glucose | Sigma-Aldrich | G8270 | |
| Digital Timer/Stopwatch | Fisher Scientific | 14-649-17 | |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | D8418 | |
| Eight-well rectangular polystyrene sterile culture plate | Thermo Fisher Scientific | 73521-426 | https://us.vwr.com/store/product/4679368/nunclontm-delta-rectangular-dishes-polystyrene-sterile-thermo-scientific |
| FHD Microscope Chamber System | IonOptix | ||
| Flow EZ, Modular pressure-based flow controller with a computer driven program version 1.1.0.0. | Fluigent OxyGEN | ||
| Heavy Duty Vacuum Bottles | VWR | 16211-080 | |
| HEPES | Sigma-Aldrich | H3375 | |
| Human Recombinant Laminin 521 | BioLamina | LM521-05 | |
| Idex Chromatography Tubing, Natural FEP, 1/16" OD x 0.030" ID | Cole-Palmer | 1520L | |
| Kimberly-Clark Professional Kimtech Science Kimwipes | Fisher Scientific | 06-666 | |
| L-(-)-Malic acid | Sigma-Aldrich | 112577 | |
| Lactobionic acid | Sigma-Aldrich | 153516 | |
| L-Glutamic acid | Sigma-Aldrich | 49449 | |
| L-Histidine | Sigma-Aldrich | H8000 | |
| Magnesium Chloride hexahydrate (MgCl2) | Sigma-Aldrich | M9272 | |
| Microscope Temperature Control Stage Warmer | AmScope | TCS-100 | |
| MyoPacer Field Stimulator | IonOptix | ||
| Nunc Rectangular Dishes | Thermo Scientific | 267062 | |
| Olympus IX83P1ZF Ixplore Standard microscope | Olympus | https://www.olympus-lifescience.com/en/microscopes/inverted/ixplore-standard/?campaignid=657680540&adgroupid =116963199831&keyword=ix73%20 microscope&gclid=EAIaIQobChMIl qjyiMWP-AIVVx-tBh2JoQ85EAA YASAAEgLp3fD_BwE | |
| pH 4.01, 7.00, and 10.01 Standards | Oakton | WD-05942-10 | |
| Potassium Chloride (KCl) | Sigma-Aldrich | 746436 | |
| Potassium Hydroxide (KOH) | Sigma-Aldrich | P4494 | |
| Potassium phosphate monobasic (KH2PO4) | Sigma-Aldrich | 795488 | |
| Prism Software | GraphPad Software - Dotmatics | https://www.graphpad.com/ | |
| RBS 25 Liquid Detergent | Sigma-Aldrich | 83460 | |
| Sharps Container | Uline | S-15307 | |
| SigmaPlot analysis software | Systat Software Inc. | https://systatsoftware.com/ | |
| Sodium Chloride (NaCl) | Sigma-Aldrich | S3014 | |
| Sodium Hydroxide (NaOH) | Sigma-Aldrich | 221465 | |
| Student Dumont #5 Forceps | Fine Science Tools | 91150-20 | |
| Sucrose | Sigma-Aldrich | S7903 | |
| Taurine | Sigma-Aldrich | T0625 | |
| Temperature Control Box | Warner Insturments | TC-324C | |
| Vapor Pressure Osmometer | ELITechGroup | Model 5600 | |
| Wheaton 20 mL Vials | DWK Life Sciences | 225288 |
Riferimenti
- Abi-Gerges, N., Miller, P. E., Ghetti, A. Human heart cardiomyocytes in drug discovery and research: new opportunities in translational sciences. Current Pharmaceutical Biotechnology. 21 (9), 787806(2020).
- Cook, D., et al. Lessons learned from the fate of AstraZeneca's drug pipeline: A five dimensional framework. Nature Reviews Drug Discovery. 13 (6), 419-431 (2014).
- Van Meer, B. J., Tertoolen, L. G. J., Mummery, C. L. Measuring physiological responses of human pluripotent stem cell derived cardiomyocytes to drugs and disease. Stem Cell. 34 (8), 2008-2015 (2016).
- Piccini, J. P., et al. Current challenges in the evaluation of cardiac safety during drug development: translational medicine meets the critical path initiative. American Heart Journal. 158 (3), 317-326 (2009).
- Pang, L., et al. Workshop report: FDA workshop on improving cardiotoxicity assessment with human-relevant platforms. Circulation Research. 125 (9), 855-867 (2019).
- Page, G., et al. Human ex-vivo action potential model for pro-arrhythmia risk assessment. Journal of Pharmacological and Toxicological Methods. 81, 183-195 (2016).
- Britton, O. J., et al. Quantitative comparison of effects of dofetilide, sotalol, quinidine, and verapamil between human ex vivo trabeculae and in silico ventricular models incorporating inter-individual action potential variability. Frontiers in Physiology. 8, 597(2017).
- Qu, Y., et al. Action potential recording and pro-arrhythmia risk analysis in human ventricular trabeculae. Frontiers in Physiology. 8, 1109(2017).
- Trovato, C., et al. Human Purkinje in silico model enables mechanistic investigations into automaticity and pro-arrhythmic abnormalities. Journal of Molecular and Cellular Cardiology. 142, 24-38 (2020).
- Otsomaa, L., et al. Discovery and characterization of ORM-11372, a novel inhibitor of the sodium-calcium exchanger with positive inotropic activity. British Journal of Pharmacology. 177 (24), 5534-5554 (2020).
- Nguyen, N., et al. Adult human primary cardiomyocyte-based model for the simultaneous prediction of drug-induced inotropic and pro-arrhythmia risk. Frontiers in Physiology. 8, 1073(2017).
- Abi-Gerges, N., et al. Multiparametric mechanistic profiling of inotropic drugs in adult human primary cardiomyocytes. Scientific Reports. 10, 7692(2020).
- Jordaan, P., et al. Cardiotoxic potential of hydroxychloroquine, chloroquine and azithromycin in adult human primary cardiomyocytes. Toxicological Sciences. 180 (2), 356-368 (2021).
- Ton, A. T., et al. Arrhythmogenic and antiarrhythmic actions of late sustained sodium current in the adult human heart. Scientific Reports. 11, 12014(2021).
- Schmid, C., Abi-Gerges, N., Leither, M. G., Zellner, D., Rast, G. Ion channel expression and electrophysiology of singular human (primary and induced pluripotent stem cell-derived) cardiomyocytes. Cells. 10 (12), 3370(2021).
- Guha, R. On exploring structure activity relationships. Methods in Molecular Biology. 993, 81-94 (2013).
- Tannenbaum, J., Bennett, B. T. Russell and Burch's 3Ra then and now: The need for clarity in definition and purpose. Journal of the American Association for Laboratory Animal Science. 54 (2), 120-132 (2015).
- Ruiz-Meana, M., Martinson, E. A., Garcia-Dorado, D., Piper, H. M. Animal ethics in cardiovascular research. Cardiovascular Research. 93 (1), 1-3 (2012).
- Rienks, M., Papageorgiou, A. P., Frangogiannis, N. G., Heymans, S. Myocardial extracellular matrix. Circulation Research. 114 (5), 872-888 (2014).
- Zaglia, T., Mongillo, M. Cardiac sympathetic innervation, from a different point of (re)view. Journal of Physiology. 595 (12), 3919-3930 (2017).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon