Method Article
Измерение сократительной способности сердца в изолированных первичных кардиомиоцитах взрослого человека
В этой статье
Резюме
В этом протоколе описывается, как измерять сократительную способность в первичных кардиомиоцитах взрослого человека из донорских сердец с помощью системы MyoBLAZER, надежной платформы для оценки лекарственно-индуцированных изменений сократимости во время доклинической разработки.
Аннотация
Оценка изменений сократительной способности сердца имеет важное значение во время доклинической разработки новых сердечных и некардиальных соединений. В данной работе описан протокол оценки изменений сократительной способности первичных желудочковых кардиомиоцитов взрослого человека с использованием MyoBLAZER, неинвазивного оптического метода, который сохраняет нормальную физиологию и фармакологию клеток. Этот метод оптической регистрации непрерывно измеряет переходные процессы сократимости от нескольких клеток параллельно, предоставляя как среднюю пропускную способность, так и ценную информацию для каждой отдельной клетки в поле зрения, что позволяет отслеживать эффекты лекарств в режиме реального времени. Сокращения кардиомиоцитов индуцируются стимуляцией электрического поля, а полученные изображения яркого поля передаются в программное обеспечение для обработки изображений, которое измеряет укорочение саркомеров в нескольких кардиомиоцитах. Этот метод быстро генерирует различные конечные точки, связанные с кинетикой фаз сжатия и релаксации, и полученные данные затем могут быть интерпретированы по отношению к различным концентрациям испытуемого изделия. Этот метод также используется на поздних стадиях доклинических разработок для проведения последующих механистических исследований для поддержки текущих клинических исследований. Таким образом, модель на основе первичных кардиомиоцитов взрослого человека в сочетании с оптической системой непрерывного мониторинга сократимости может внести свой вклад в новую эру переводимости кардиологических данных in vitro при разработке доклинической медицинской терапии.
Введение
Сократимость миокарда (инотропия), представляющая собой естественную способность сердечной мышцы сокращаться, является ключевым свойством сердечной функции и зависит от динамики электромеханического взаимодействия. Лекарственно-индуцированные изменения сократимости миокарда желательны для лечения сердечных заболеваний (например, сердечной недостаточности) и нежелательны в контексте кардиотоксичности (например, снижение фракции выброса левого желудочка). Таким образом, доклинические модели сократимости должны быть связаны с точной прогностической способностью, чтобы гарантировать, что новые лекарственные препараты могут быть успешными во время клинической разработки. Тем не менее, современные доклинические стратегии, основанные на редукционистских искусственных клеточных моделях (например, генетически модифицированные иммортализированные клеточные линии, которые сверхэкспрессируют специфические интересующие сердечные мишени) и моделях животных, не связанных с человеком, показали значительные ограничения и были обнаружены связанными с высокими показателями отсева лекарств (т.е. высоким уровнем ложных сигналов)1,2,3,4 . Соответственно, крайне важно создать новые и надежные модели сократительной способности клеток сердца человека, которые связаны с высокой мощностью (т.е. высокой частотой истинных сигналов) для прогнозирования результатов лечения у людей и, следовательно, помогают ускорить запуск новых методовлечения.
Новаторские методы, недавно разработанные для извлечения донорских сердец человека для исследований 6,7,8,9,10 и методов выделения кардиомиоцитов 11,12,13,14,15, предоставили уникальную возможность для проведения исследований на людях во время доклинических исследований. С этой целью первичные кардиомиоциты взрослого человека уже показали свою полезность при оценке лекарственно-индуцированных изменений сократительной способности сердца человека11,12,13,14. В настоящей статье подробно описан протокол исследования эффектов сократимости новых соединений в кардиомиоцитах взрослого человека.
протокол
Все методы проводились в соответствии с соответствующими руководящими принципами и правилами. Все человеческие сердца, использованные в исследованиях, не подлежали трансплантации и были получены по информированному юридическому согласию (первого лица или ближайших родственников) от трупных доноров органов в Соединенных Штатах (США). Протоколы восстановления и эксперименты in vitro были предварительно одобрены Институциональными наблюдательными советами (IRB) в центрах трансплантации, входящих в Сеть трансплантации органов США (OPTN). Кроме того, все случаи передачи донорских сердец полностью отслеживаются и периодически проверяются федеральными властями США.
ПРИМЕЧАНИЕ: Соблюдайте все необходимые меры безопасности во время выполнения этого протокола, включая ношение соответствующих средств индивидуальной защиты (например, лабораторных халатов, защитных очков, перчаток).
1. Выделение кардиомиоцитов (за 1 сутки до измерения сократительной способности)
- Реперфузию донорских сердец сразу по прибытии в лабораторию проводят ледяной запатентованный кардиоплегический раствор6 и ферментативно выделяют первичные миоциты взрослого человека из желудочков 11,12,13,14,15.
- Затем поддерживают кардиомиоциты во взвешенном состоянии и хранят их в 10 мл раствора А (110 мМ сахарозы, 0,005 мМ CaCl 2, 3 мМ MgCl 2, 70 мМ KOH, 60 мМ лактобионовой кислоты, 10 мМ KH 2 PO4, 20 мМ таурина, 20 мМ L-гистидина, 20 мМ HEPES, 2 мМ L-глутаминовой кислоты, 2 мМ L-(-)-яблочной кислоты, pH 7,4 с KOH) во флаконах Wheaton по 20 мл (таблица материалов) при охлажденной температуре до тех пор, пока они не будут экспериментально исследованы.
ПРИМЕЧАНИЕ: Храните 200 000 клеток во флаконе.
2. Приготовление ламининового покрытия (за 1 сутки до измерения сократительной способности)
- Поместите один стеклянный покровный лист (квадрат 25 мм x 25 мм, таблица материалов) в каждую лунку восьмилуночной планшета для культуры (таблица материалов).
- Затем покройте покровные стекла ламинином в концентрации 5 мкг/мл. Для этого добавьте 800 мкл человеческого рекомбинантного материала Laminin 521 (таблица материалов, хранящегося при −20 °C) к 7,2 мл раствора B (145 мМ NaCl, 4 мМ KCl, 2,5 мМ CaCl 2, 1 мМ MgCl2, 11,1 мМ глюкозы и 10 мМ HEPES, pH 7,4 с NaOH) и хорошо перемешайте.
- Капните 200 мкл разбавленного раствора ламинина в центр каждого покровного стекла. Затем накройте тарелку крышкой и поставьте в холодильник с температурой 4 °C.
ПРИМЕЧАНИЕ: Подготовьте несколько восьмилуночных планшетов для культивирования, чтобы убедиться, что имеется достаточное количество покрытых ламинином покровных стекол.
3. ПодготовкаСа2+-толерантных кардиомиоцитов (в день измерения сократительной способности)
- Достаньте флакон с клетками из холодильника, отсосите раствор А из флакона и добавьте охлажденные 10 мл раствора Б.
ПРИМЕЧАНИЕ: Убедитесь, что клетки не отсасываются, и диспергируйте раствор B во флакон, поместив пипетку на внутреннюю часть верхней стенки флакона. - Закройте флакон с клетками, а затем осторожно взболтайте, чтобы убедиться, что клетки распределены по раствору B. Наконец, дайте клеткам отстояться в течение 1 часа при комнатной температуре (RT).
4. Подготовка регистрирующей системы (в день измерения сократительной способности)
ПРИМЕЧАНИЕ: Система регистрации включает в себя блок контроля температуры, стимулятор, управляемую компьютером перфузию под давлением, перфузионные флаконы под давлением, собственное программное обеспечение для сбора данных, позволяющее выбирать интересующие области (ROI) и отображать переходные процессы сократимости, инвертированный микроскоп, клеточную камеру и камеру (рис. 1).
- Включите вакуумную систему всасывания. Затем снимите крышку микроскопа, включите ее, подключите камеру (Таблица материалов, рис. 1) и, наконец, убедитесь, что вентилятор включен, чтобы убедиться, что камера не перегревается.
- Затем включите нагревательную пластину микроскопа (Таблица материалов) и блок контроля температуры (Таблица материалов, Рисунок 1) и установите для них надлежащую рабочую температуру. Далее включаем стимулятор поля (Таблица материалов, рисунок 1) и систему давления. Наконец, подсоедините трубку раствора (Таблица материалов) к записывающей камере (Таблица материалов, Рисунок 1).
5. Приготовление испытуемых компаундов (в день измерения сократительной способности)
- Разбавленный диметилсульфоксид (ДМСО; Содержание материалов) 1000 раз в растворе C (145 мМ NaCl, 4 мМ KCl, 1,8 мМ CaCl 2, 1 мМ MgCl2, 11,1 мМ глюкозы и 10 мМ HEPES, pH 7,4 с NaOH) для получения 0,1% раствора ДМСО.
- Чтобы испытать соединение при 1-кратном, 10-кратном, 100-кратном и 1000-кратном терапевтическом воздействии 0,001 мкМ, растворяют исследуемое соединение в ДМСО в концентрации 1 мМ.
- Последовательно разбавляйте этот раствор ДМСО для получения еще трех запасов ДМСО (например, 0,001 мМ, 0,01 мМ и 0,1 мМ). Наконец, разбавьте каждый тестовый материал в 1000 раз в 100 мл раствора С для получения окончательных концентраций (0,001 мкМ, 0,01 мкМ, 0,1 мкМ и 1 мкМ).
- Добавьте раствор носителя и растворы конечных микромолярных концентраций соединения в стеклянные бутылки объемом 100 мл (таблица материалов, рисунок 1), а затем подключите флаконы к системе перфузии под давлением (таблица материалов, рисунок 1).
- Затем заправьте перфузионную систему компьютерной программой (таблица материалов), используя давление 200-300 мбар, чтобы обеспечить постоянный поток перфузии со скоростью 1,8 мл/мин.
ПРИМЕЧАНИЕ: Не проводите эксперимент, если обнаружено, что исследуемое соединение связано с проблемой растворимости. Кроме того, в течение 30 мин перед экспериментальным нанесением на клетки необходимо приготовить составные тестовые растворы из исходных растворов.
6. Покрытие кардиомиоцитов (в день измерения сократительной способности)
- Достаньте из холодильника при температуре 4 °C восьмилуночную пластину, содержащую покрытые ламинином листы, и осторожно поместите один покровный лист в очень хорошо очищенную записывающую камеру (рисунок 1). Затем верните восьмилуночную тарелку в холодильник с температурой 4 °C до следующего покрытия.
ПРИМЕЧАНИЕ: Используйте безворсовую салфетку (Таблица материалов), чтобы протереть покрытый покровный листок, сохраняя его покрытым тонким слоем ламинина. Кроме того, не забудьте утилизировать использованные покровные стекла в контейнере для острых предметов. - Затем возьмите увеличенный флакон с клетками (шаг 3.2) и аспирируйте раствор B из флакона, чтобы достичь как можно меньшего объема без потери клеток (~200 мкл). Затем дозируют 200 мкл клеток в камеру регистрирующего микроскопа, установленную на столике инвертированного микроскопа (таблица материалов).
- Дайте клеткам осесть на покровном стекле в течение 5 минут. Ожидая, пока клетки полностью осядут, откройте поле зрения микроскопа и определите, достаточна ли плотность клеток (~70%) для начала эксперимента.
ПРИМЕЧАНИЕ: Убедитесь, что всасывание не отсасывает все клетки, если дозируется более 200 мкл.
7. Регистрация сократительной способности кардиомиоцитов
- После завершения нанесения покрытия уравновешивайте клетки в течение 5 мин, непрерывно перфузируя их раствором С с помощью перфузионной системы под давлением (таблица материалов). Правильно отрегулируйте всасывание, включите блок контроля температуры и нагревательную пластину и установите их на подачу ~35 °C.
- Затем стимулируют клетки надпороговым напряжением с частотой стимуляции 1 Гц (биполярный импульс длительностью 3 мс) на стимуляторе поля с парой платиновых проводов, размещенных на противоположных сторонах камеры, подключенных к стимулятору поля.
- Установите амплитуду стимулирующего импульса на 1 В, а затем увеличивайте ее до тех пор, пока кардиомиоциты не начнут генерировать циклы сокращения-релаксации. Используйте значение 1,5x порогового значения на протяжении всего эксперимента.
ПРИМЕЧАНИЕ: Выбирайте здоровые клетки с палочковидной морфологией и четкими бороздками. Затем отрегулируйте поле зрения и сосредоточьтесь на том, чтобы привлечь в поле зрения как можно больше сокращающихся ячеек (рис. 2A). - Затем отобразите оцифрованные изображения клеток в программном обеспечении системы регистрации оптической сократимости. Это программное обеспечение использует камеру высокого разрешения с высокой частотой кадров и частотой кадров 150 кадров в секунду (таблица материалов, рис. 1) для записи видеопотока, содержащего несколько миоцитов в одном кадре.
ПРИМЕЧАНИЕ: Это обеспечивает достаточное временное и пространственное разрешение для захвата и измерения динамики саркомеров нескольких здоровых миоцитов одновременно. Современные процессоры с большим количеством ядер позволяют параллельно вычислять изменения длины саркомеров из видеопотока в режиме реального времени (данные об оптической плотности собираются из пользовательских областей интереса [ROI], размещенных поверх изображений здоровых кардиомиоцитов и параллельных оси сокращения, рис. 2B). Данные оптической интенсивности показывают светлые и темные полосы, соответствующие Z-линиям кардиомиоцитов (рис. 1, рис. 2В). Наконец, эти данные отображаются пользователю в целях мониторинга и сохраняются на диске для последующего анализа (рис. 2C).- Избегайте областей клеток, которые не находятся в фокусе. Кроме того, не располагайте ROI близко к краю клеток, так как изменения в сокращении клеток во время применения лекарств могут привести к тому, что ROI не смогут прочитать сокращение клеток.
- Когда выбор ROI завершен и сокращения соответствуют необходимым стандартам для использования (например, укорочение саркомера >1%; ритмичное сокращение при применении частоты стимуляции 1 Гц, отсутствие аритмических событий), приступают к эксперименту по оценке эффектов соединения. Протокол стимуляции и последовательность применения исследуемых концентраций соединения приведены в таблице 1. Программное обеспечение для сбора данных будет управлять сбором и отображением данных, а также маркировкой концентраций теста и времени обработки.
ПРИМЕЧАНИЕ: Применяйте тестовые концентрации, если сокращение остается со стабильной амплитудой в течение всего базового периода транспортного средства. Дисквалифицировать ячейки, отображающие разгон вверх или вниз. Кроме того, убедитесь, что перфузия переключается на различные тестовые концентрации на протяжении всего эксперимента.
- По завершении эксперимента и сохранения данных на сервере выключите перфузию и нагреватель, остановите стимуляцию, очистите камеру микроскопа дистиллированной водой, затем снимите стеклянное покровное стекло и тщательно высушите камеру.
ПРИМЕЧАНИЕ: Тщательно очистите камеру, так как это очень важно, чтобы избежать преждевременного воздействия какого-либо соединения на следующий набор клеток, что приведет к аннулированию любых собранных данных. - Затем выполняют новое покрытие кардиомиоцитов и проводят дополнительный эксперимент для получения достаточного количества данных для завершения тестирования соединения или тестирования нового соединения.
8. Выключение системы регистрации оптической сократимости
- После завершения ежедневного тестирования соединения (соединений) сначала выключите все оборудование, которое не требуется для очистки системы, и скопируйте данные для автономного анализа.
- Затем извлеките стеклянные флаконы объемом 100 мл (Таблица материалов), содержащие растворы конечных тестовых концентраций, и замените их стеклянными бутылками, наполовину заполненными раствором концентрата RBS 25 (Таблица материалов). Прокачайте раствор RBS через камеру микроскопа в течение 5 мин, затем отсоедините перфузионную трубку от камеры, очистите ее дистиллированной водой и, наконец, тщательно высушите.
ПРИМЕЧАНИЕ: Убедитесь, что пылесос работает хорошо, чтобы предотвратить возможное затопление. - Затем подсоедините перфузионную трубку к дренажной трубке. Используя программное обеспечение системы перфузии под давлением (таблица материалов), запустите раствор RBS в течение 10 минут, убедившись, что давление и скорость потока установлены надлежащим образом. Затем проводят перфузию 1% ДМСО в течение 5 мин, а затем дистиллированную воду в течение 15-20 мин для завершения очистки перфузионной системы.
- Выключите свет микроскопа и наденьте его крышку. Затем отсоедините провода камеры от коробки сбоку микроскопа и выключите вентилятор. Убедитесь, что все использованные бутылки отправлены на очистку и в автоклав. Наконец, убедитесь, что все дренажные ведра заполнены на 1/4 или меньше.
ПРИМЕЧАНИЕ: Убедитесь, что имеется достаточное количество покровных стеблей с ламининовым покрытием для использования на следующий день. - Наконец, скопируйте файлы в папку сбора данных обо всех экспериментах, проведенных на каждой системе записи, и вставьте их на защищенный сервер резервного копирования для дополнительного автономного анализа. Затем удалите все файлы данных из папки сбора.
9. Анализ данных о сократительной способности
- Выполняйте автономный анализ с помощью аналитического программного обеспечения и специально созданного макроса для усреднения данных. Аналитическое программное обеспечение рассчитывает и сообщает различные показатели на основе данных динамики саркомеров, полученных с помощью программного обеспечения для сбора данных. Подробный список этих параметров приведен на рисунке 2D.
ПРИМЕЧАНИЕ: Применение низкоуровневых программных методов позволяет анализировать многие прогоны записей за 5 с. Основным параметром для оценки лекарственно-индуцированных изменений сократительной способности является амплитуда сократимости (% укорочения саркомера = изменение длины саркомера). Она рассчитывается как длина саркомера при пиковой длине сокращения/покоя и усредняется за последние 20 переходных процессов сократимости для каждой тестовой концентрации. - Количественно оценить влияние исследуемого соединения на усредненную амплитуду сократимости по отношению к конкретному исходному состоянию контроля носителя каждого кардиомиоцита.
- Выразите средние результаты в виде среднего значения ± СЭМ и постройте график, показывающий влияние концентрации испытуемого соединения на амплитуду сократимости. Затем подгоните кривую «концентрация-реакция» к уравнению Хилла с помощью аналитического программного обеспечения (таблица материалов), чтобы получить значения IC50 (концентрация, приводящая к 50%-ному подавлению амплитуды сократимости) и EC50 (концентрация, приводящая к увеличению амплитуды сократимости на 50%).
- Помимо амплитуды сократимости, можно рассчитать и другие параметры:
- Послесокращение: Определите послесокращение как спонтанное вторичное транзиторное сокращение кардиомиоцита, которое происходит перед следующей регулярной схваткой и вызывает аномальное и несинхронизированное сокращение.
- Сбой схватки: Определите неудачу схватки как неспособность электрического стимула вызвать сокращение.
- Краткосрочная изменчивость (STV) и альтерны: Визуализируйте эти два параметра на графиках вариабельности амплитуды сокращения Пуанкаре.
- Расчет STV (∑|CAn + 1 − CAn| (20 × √2) −1) с последними 20 переходными процессами каждого периода концентрации контрольного и испытуемого изделия. Определите альтернаны как повторяющиеся чередующиеся короткие и длинные переходные процессы амплитуды сократимости.
- Чтобы рассчитать частоту возникновения проаритмии, нормализуйте значения STV к контрольному значению носителя каждой клетки, постройте график послесокращения, неудачи сокращения, STV и альтернанов и выразите их в % от частоты появления клеток, демонстрирующих каждый из сигналов.
- Завершите многопараметрическое механистическое профилирование расчетом времени Ato пика, затухания до 30% релаксации (Decay 30), затухания до 90% релаксации (Decay 90), времени до 90% релаксации (TR90) (Рисунок 2D), базовой длины саркомера, времени до пика 50%, пиковой высоты, длины саркомера при пиковой сократимости, максимальной скорости сжатия и максимальной скорости релаксации12. Как и амплитуду сократимости, выразите эти параметры относительно конкретного исходного контрольного состояния каждого кардиомиоцита и отобразите их на графиках «концентрация-реакция».
Результаты
В данном протоколе описана процедура измерения сократимости в выделенных первичных кардиомиоцитах взрослого человека от доноров органов и оценки острых изменений параметров сократимости, индуцированных исследуемым соединением. Измерение переходной способности осуществляется с помощью системы геометрии клеток MyoBLAZER на основе видео, которая измеряет динамику саркомеров, а состояние сердца у взрослых имитируется путем индуцирования сократимости с помощью электрической стимуляции на физиологической частоте кардиостимуляции (1 Гц). Функциональная жизнеспособность кардиомиоцитов подтверждается оценкой их связи возбуждения-сокращения (т.е. клеточной обработки, связывающей электрическое возбуждение [потенциал действия сарколемма] с сокращением). В кардиомиоцитах человека отсутствуют спонтанные переходные процессы сократимости, и кардиомиоциты реагируют на внешнюю электрическую стимуляцию циклами сократимости/релаксации (рис. 2C, E), а также на изопротеренол, β-адренергический агонист (рис. 2F, G). Изопротеренол вызывает зависящее от концентрации увеличение сократительной способности (рис. 2G), и его влияние на кинетику переходной сократимости также может быть охарактеризовано (рис. 2D)12.

Рисунок 1: Экспериментальная установка системы регистрации оптической сократимости. Записи сократимости в светлом поле делаются из первичных кардиомиоцитов взрослого человека, как описано ранее 11,12,13,14. Установка включает в себя (A) блок контроля температуры, (B) стимулятор поля, (C,D) систему перфузии под давлением, (E) компьютерную программу управления давлением, (F) баллоны под давлением, (G) программное обеспечение для сбора данных, (H) выбор ROI с помощью программного обеспечения для сбора данных, (I) отображение переходных процессов сократимости с помощью программного обеспечения для регистрации, (J) инвертированный микроскоп, (K) камеру микроскопа и ( L) камера. Все характеристики оборудования приведены в Таблице материалов. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
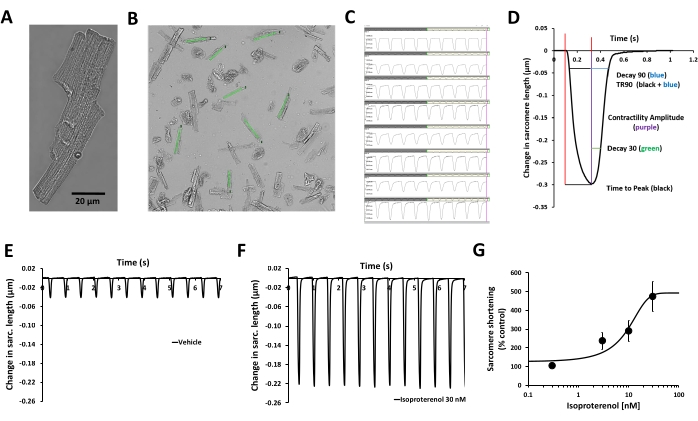
Рисунок 2: Валидация измерения сократительной способности кардиомиоцитов человека и эффекта β-адренергической стимуляции. (A) Фазово-контрастное микроскопическое изображение репрезентативного первичного кардиомиоцита взрослого человека, (B) определяемые пользователем области интереса (ROI), размещенные поверх изображений здоровых кардиомиоцитов и параллельные оси сокращения, (C) отображение переходных процессов сократимости, полученных из тех же ROI в (B) с помощью программного обеспечения для сбора данных, (D) параметры, связанные с переходной способностью сократимости, измеренные с помощью программного обеспечения для сбора данных: амплитуда сократимости, время достижения пика, Decay 30, Decay 90, TR90. Также могут быть измерены дополнительные параметры: исходная длина саркомера, время до пика 50%, пиковая высота, длина саркомера при пиковой сократительной способности, максимальная скорость сокращения и максимальная скорость релаксации. (E) Типичные переходные процессы сократимости, зарегистрированные у первичного желудочкового миоцита взрослого человека с частотой стимуляции 1 Гц в присутствии контроля транспортного средства (F) и после воздействия 30 нМ изопротеренола, неселективного β-адренергического агониста. Переходные процессы сократимости, продемонстрированные на панелях E и F, были собраны из одного и того же кардиомиоцита. Изопротеренол из кардиомиоцитов человека с частотой 1 Гц использовали для получения информации о потенции. (G) Типичная кумулятивная кривая «концентрация-реакция», полученная при измерении сократимости кардиомиоцитов человека с помощью изопротеренола (n = 8 клеток). Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
| Последовательность перфузии | Решение для транспортных средств | Концентрация 1 (мкМ) | Концентрация 2 (мкМ) | Концентрация 3 (мкМ) | Концентрация 4 (мкМ) | Мыть |
| Продолжительность лечения | 120 с | 300 с | 300 с | 300 с | 300 с | 300 с |
| Частота стимуляции | 1 Гц | 1 Гц | 1 Гц | 1 Гц | 1 Гц | 1 Гц |
Таблица 1: Протокол стимуляции и последовательность применения тестового состава. Стабильность переходных процессов сократимости оценивают путем непрерывной регистрации в течение 120 с в растворе С, устанавливая контроль над транспортным средством (обычно в 0,1% ДМСО). Затем концентрация испытуемого изделия применяется в течение не менее 300 с или до достижения установившегося эффекта. Используются четыре возрастающие концентрации испытуемых изделий, обеспечивающие кумулятивные кривые «концентрация-эффект» (C-E). По окончании кумулятивных дополнений испытуемого изделия может быть реализован 300-секундный период вымыва.
Обсуждение
В данной статье представлен подробный протокол оптической системы на основе сократимости кардиомиоцитов взрослого человека для упрощенного метода средней пропускной способности, позволяющего проверить острую эффективность и кардиотоксичность новых соединений. Эта система регистрации оптической сократимости проста в использовании, позволяет вести параллельную запись с нескольких клеток, позволяет одновременно оценивать здоровье, физиологию и фармакологию клеток, поставляется с автоматизированным и быстрым анализом данных (прогон нескольких клеток анализируется за 5 с) и позволяет быстро собирать данные (кривая «концентрация-реакция» каждые 30 минут/соединение/устройство). Принимая во внимание эти атрибуты, регистрирующая система может быть использована не только для выявления влияния лекарств на сократимость кардиомиоцитов, но и для получения данных о взаимосвязи между структурой и активностью для поддержки усилий в области медицинской химии на ранних этапах разработки лекарств16. Поскольку с помощью протокола выделения кардиомиоцитов могут быть получены десятки миллионов клеток, в настоящее время изучается применение оптической системы регистрации сократимости-платформы кардиомиоцитов для достижения увеличения возможностей тестирования (с использованием пластин с хорошим основанием) при снижении стоимости. Кроме того, оценка влияния лекарственных средств на систолические и релаксационные параметры, измеренные с помощью регистрирующей системы, может обеспечить многопараметрическое механистическое профилирование инотропных препаратов12. Кроме того, данные о сократительной способности кардиомиоцитов могут быть использованы для ранжирования новых лекарств от наиболее до наименее кардиотоксичных (например, запас безопасности) и от наименее до наиболее эффективных (например, предел эффективности). Последующие исследования сократительной способности кардиомиоцитов также могут быть проведены для поддержки программ развития, которые были связаны с клиническим снижением сократимости миокарда12.
Еще одним существенным преимуществом использования системы оптической регистрации сократимости кардиомиоцитов человека является ее соответствие концепции 3R (замена, редукция и уточнение)17 , поскольку ее можно рассматривать как альтернативный метод, который позволяет избежать или заменить использование животных для получения данных в фармацевтической промышленности. Это преимущество 3R также может быть распространено на академические кардиологические исследования. Все современные знания о физиологии и фармакологии кардиомиоцитов основаны на научных исследованиях, проведенных с клетками, выделенными из сердцаживотных. Таким образом, модель оптической сократимости кардиомиоцитов человека открывает возможность проведения критических трансляционных исследований. Для проведения этих исследований должны быть разработаны протоколы сохранения и транспортировки кардиомиоцитов взрослого человека (в настоящее время проходят оценку в лаборатории AnaBios), а система сократимости должна иметь возможность регистрировать изменения длины саркомеров у нечеловеческих кардиомиоцитов (так обстоит дело с системой регистрации оптической сократимости, поскольку саркомеры хорошо консервативны среди видов).
Система сократимости кардиомиоцитов человека может имитировать несколько физиологических состояний (например, электромеханическая связь, частота стимуляции, имитирующая частоту сердечных сокращений, температуру тела, интеграцию всех сердечных мишеней человека) и продемонстрировала трансляционную ценность в качестве ключевого компонента при разработке лекарств11,12,13,14, хотя он не может имитировать изменения механической нагрузки и напряжения сдвига, наблюдаемые во время сократительного цикла сердца. Структура и функции сердечных внеклеточных матриц в настоящеевремя лучше изучены, разработка таких матриц потенциально может помочь преодолеть ограничение механической нагрузки, и матрицы с различной сердечной жесткостью в настоящее время оцениваются в лаборатории AnaBios. Еще одним ограничением системы оптической сократимости кардиомиоцитов человека является отсутствие сети нервов, снабжающих сердце (например, симпатических и парасимпатических волокон)20. Этот нейро-сердечный контакт может быть восстановлен при совместном применении нейротрансмиттеров (например, изопротеренола, агониста рецепторов β-адренорецепторов; ацетилхолина, агониста мускариновых рецепторов М2), при этом соединение оценивается на предмет его потенциального влияния на сократимость кардиомиоцитов. Кроме того, переходные процессы сократимости регистрируются без одновременного измерения потенциалов действия и переходных процессов Са2+, что также важно при оценке влияния препарата на электрокардиограмму и обращение сСа2+. Хотя это упущение можно считать ограничением системы, оно не слишком критично, поскольку регистрация сигналов потенциала действия (с помощью тококоизмерительных клещей или потенциал-чувствительных красителей) и переходных процессов Ca2+ (с индикаторами/красителями Ca2+) может быть связана с цитотоксичностью. Такие цитотоксические эффекты могут повлиять на оценку новых препаратов для модуляции сократительной способности сердца. Напротив, использование неинвазивного оптического метода, который сохраняет здоровье, физиологию и фармакологию кардиомиоцитов, как система регистрации, описанная в этом протоколе, не только обеспечит получение данных о сократимости высочайшего качества, но и предоставит данные, которые могут хорошо предсказывать сократительные эффекты новых лекарств у людей.
Раскрытие информации
Все авторы являются сотрудниками корпорации AnaBios и заявляют об отсутствии конкурирующих интересов.
Благодарности
Эта работа была поддержана корпорацией AnaBios и грантом NIH Small Business Innovation Research (SBIR) (1R44TR003162-01).
Материалы
| Name | Company | Catalog Number | Comments |
| 100–1000 µL Filtered, Wide Orifice, Sterile tips | Pipette | UF-1000W | |
| 100 mL, Duran pressure plus bottles | DWK Life Sciences | 218102406 | |
| 1 L, 0.22 µm Vacuum Filter system | VWR | 567-0020 | |
| 290 mmol/kg Osmolarity Standard | Wescor | OA-029 | |
| Benchtop pH Meter | Mettler Toledo | https://www.mt.com/us/en/home/products/Laboratory_Analytics_Browse/pH-meter/pH-meters.html | |
| Calcium Chloride dihydrate (CaCl2) | Sigma-Aldrich | C3881 | |
| Camera | Optronis GmbH | Cyclone-25-150-M | https://optronis.com/en/products/cyclone-25-150/ |
| Corning 25 mm x25 mm Square #1 Cover Glass | Corning | 2845-25 | |
| Cyclone-25-150 | Optronis | https://optronis.com/en/products/cyclone-25-150/ | |
| D-(+)-Glucose | Sigma-Aldrich | G8270 | |
| Digital Timer/Stopwatch | Fisher Scientific | 14-649-17 | |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | D8418 | |
| Eight-well rectangular polystyrene sterile culture plate | Thermo Fisher Scientific | 73521-426 | https://us.vwr.com/store/product/4679368/nunclontm-delta-rectangular-dishes-polystyrene-sterile-thermo-scientific |
| FHD Microscope Chamber System | IonOptix | ||
| Flow EZ, Modular pressure-based flow controller with a computer driven program version 1.1.0.0. | Fluigent OxyGEN | ||
| Heavy Duty Vacuum Bottles | VWR | 16211-080 | |
| HEPES | Sigma-Aldrich | H3375 | |
| Human Recombinant Laminin 521 | BioLamina | LM521-05 | |
| Idex Chromatography Tubing, Natural FEP, 1/16" OD x 0.030" ID | Cole-Palmer | 1520L | |
| Kimberly-Clark Professional Kimtech Science Kimwipes | Fisher Scientific | 06-666 | |
| L-(-)-Malic acid | Sigma-Aldrich | 112577 | |
| Lactobionic acid | Sigma-Aldrich | 153516 | |
| L-Glutamic acid | Sigma-Aldrich | 49449 | |
| L-Histidine | Sigma-Aldrich | H8000 | |
| Magnesium Chloride hexahydrate (MgCl2) | Sigma-Aldrich | M9272 | |
| Microscope Temperature Control Stage Warmer | AmScope | TCS-100 | |
| MyoPacer Field Stimulator | IonOptix | ||
| Nunc Rectangular Dishes | Thermo Scientific | 267062 | |
| Olympus IX83P1ZF Ixplore Standard microscope | Olympus | https://www.olympus-lifescience.com/en/microscopes/inverted/ixplore-standard/?campaignid=657680540&adgroupid =116963199831&keyword=ix73%20 microscope&gclid=EAIaIQobChMIl qjyiMWP-AIVVx-tBh2JoQ85EAA YASAAEgLp3fD_BwE | |
| pH 4.01, 7.00, and 10.01 Standards | Oakton | WD-05942-10 | |
| Potassium Chloride (KCl) | Sigma-Aldrich | 746436 | |
| Potassium Hydroxide (KOH) | Sigma-Aldrich | P4494 | |
| Potassium phosphate monobasic (KH2PO4) | Sigma-Aldrich | 795488 | |
| Prism Software | GraphPad Software - Dotmatics | https://www.graphpad.com/ | |
| RBS 25 Liquid Detergent | Sigma-Aldrich | 83460 | |
| Sharps Container | Uline | S-15307 | |
| SigmaPlot analysis software | Systat Software Inc. | https://systatsoftware.com/ | |
| Sodium Chloride (NaCl) | Sigma-Aldrich | S3014 | |
| Sodium Hydroxide (NaOH) | Sigma-Aldrich | 221465 | |
| Student Dumont #5 Forceps | Fine Science Tools | 91150-20 | |
| Sucrose | Sigma-Aldrich | S7903 | |
| Taurine | Sigma-Aldrich | T0625 | |
| Temperature Control Box | Warner Insturments | TC-324C | |
| Vapor Pressure Osmometer | ELITechGroup | Model 5600 | |
| Wheaton 20 mL Vials | DWK Life Sciences | 225288 |
Ссылки
- Abi-Gerges, N., Miller, P. E., Ghetti, A. Human heart cardiomyocytes in drug discovery and research: new opportunities in translational sciences. Current Pharmaceutical Biotechnology. 21 (9), 787806 (2020).
- Cook, D., et al. Lessons learned from the fate of AstraZeneca's drug pipeline: A five dimensional framework. Nature Reviews Drug Discovery. 13 (6), 419-431 (2014).
- Van Meer, B. J., Tertoolen, L. G. J., Mummery, C. L. Measuring physiological responses of human pluripotent stem cell derived cardiomyocytes to drugs and disease. Stem Cell. 34 (8), 2008-2015 (2016).
- Piccini, J. P., et al. Current challenges in the evaluation of cardiac safety during drug development: translational medicine meets the critical path initiative. American Heart Journal. 158 (3), 317-326 (2009).
- Pang, L., et al. Workshop report: FDA workshop on improving cardiotoxicity assessment with human-relevant platforms. Circulation Research. 125 (9), 855-867 (2019).
- Page, G., et al. Human ex-vivo action potential model for pro-arrhythmia risk assessment. Journal of Pharmacological and Toxicological Methods. 81, 183-195 (2016).
- Britton, O. J., et al. Quantitative comparison of effects of dofetilide, sotalol, quinidine, and verapamil between human ex vivo trabeculae and in silico ventricular models incorporating inter-individual action potential variability. Frontiers in Physiology. 8, 597 (2017).
- Qu, Y., et al. Action potential recording and pro-arrhythmia risk analysis in human ventricular trabeculae. Frontiers in Physiology. 8, 1109 (2017).
- Trovato, C., et al. Human Purkinje in silico model enables mechanistic investigations into automaticity and pro-arrhythmic abnormalities. Journal of Molecular and Cellular Cardiology. 142, 24-38 (2020).
- Otsomaa, L., et al. Discovery and characterization of ORM-11372, a novel inhibitor of the sodium-calcium exchanger with positive inotropic activity. British Journal of Pharmacology. 177 (24), 5534-5554 (2020).
- Nguyen, N., et al. Adult human primary cardiomyocyte-based model for the simultaneous prediction of drug-induced inotropic and pro-arrhythmia risk. Frontiers in Physiology. 8, 1073 (2017).
- Abi-Gerges, N., et al. Multiparametric mechanistic profiling of inotropic drugs in adult human primary cardiomyocytes. Scientific Reports. 10, 7692 (2020).
- Jordaan, P., et al. Cardiotoxic potential of hydroxychloroquine, chloroquine and azithromycin in adult human primary cardiomyocytes. Toxicological Sciences. 180 (2), 356-368 (2021).
- Ton, A. T., et al. Arrhythmogenic and antiarrhythmic actions of late sustained sodium current in the adult human heart. Scientific Reports. 11, 12014 (2021).
- Schmid, C., Abi-Gerges, N., Leither, M. G., Zellner, D., Rast, G. Ion channel expression and electrophysiology of singular human (primary and induced pluripotent stem cell-derived) cardiomyocytes. Cells. 10 (12), 3370 (2021).
- Guha, R. On exploring structure activity relationships. Methods in Molecular Biology. 993, 81-94 (2013).
- Tannenbaum, J., Bennett, B. T. Russell and Burch's 3Ra then and now: The need for clarity in definition and purpose. Journal of the American Association for Laboratory Animal Science. 54 (2), 120-132 (2015).
- Ruiz-Meana, M., Martinson, E. A., Garcia-Dorado, D., Piper, H. M. Animal ethics in cardiovascular research. Cardiovascular Research. 93 (1), 1-3 (2012).
- Rienks, M., Papageorgiou, A. P., Frangogiannis, N. G., Heymans, S. Myocardial extracellular matrix. Circulation Research. 114 (5), 872-888 (2014).
- Zaglia, T., Mongillo, M. Cardiac sympathetic innervation, from a different point of (re)view. Journal of Physiology. 595 (12), 3919-3930 (2017).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены