Method Article
Medida da Contratilidade Cardíaca em Cardiomiócitos Primários Humanos Isolados
Neste Artigo
Resumo
Este protocolo descreve como medir a contratilidade em cardiomiócitos primários humanos adultos de corações doados com o sistema MyoBLAZER, uma plataforma confiável para avaliar mudanças na contratilidade induzidas por drogas durante o desenvolvimento pré-clínico.
Resumo
A avaliação de alterações na contratilidade cardíaca é essencial durante o desenvolvimento pré-clínico de novos compostos direcionados cardíacos e não cardíacos. Este trabalho descreve um protocolo para avaliação de alterações na contratilidade em cardiomiócitos ventrículos primários humanos adultos utilizando o MyoBLAZER, um método óptico não invasivo que preserva a fisiologia e farmacologia normais das células. Este método de registro óptico mede continuamente os transientes de contratilidade de várias células em paralelo, fornecendo rendimento médio e informações valiosas para cada célula individual no campo de visão, permitindo o rastreamento em tempo real dos efeitos da droga. As contrações dos cardiomiócitos são induzidas por estimulação de campo elétrico cadenciado, e as imagens de campo brilhante adquiridas são alimentadas por um software de processamento de imagens que mede o encurtamento do sarcômero através de múltiplos cardiomiócitos. Este método gera rapidamente diferentes desfechos relacionados à cinética das fases de contração e relaxamento, e os dados resultantes podem então ser interpretados em relação a diferentes concentrações de um artigo de teste. Este método também é empregado nos estágios finais do desenvolvimento pré-clínico para realizar estudos mecanísticos de acompanhamento para apoiar estudos clínicos em andamento. Assim, o modelo baseado em cardiomiócitos primários humanos adultos combinado com o sistema óptico para monitoramento contínuo da contratilidade tem o potencial de contribuir para uma nova era de traduzibilidade de dados cardíacos in vitro no desenvolvimento de terapia médica pré-clínica.
Introdução
A contratilidade miocárdica (inotropia), que representa a capacidade natural de contração do músculo cardíaco, é uma propriedade fundamental da função cardíaca e depende da dinâmica do acoplamento eletromecânico. Alterações induzidas por drogas na contratilidade miocárdica são desejadas para tratar doença cardíaca (por exemplo, insuficiência cardíaca) e não solicitadas no contexto de cardiotoxicidade (por exemplo, redução da fração de ejeção do ventrículo esquerdo). Portanto, modelos pré-clínicos de contratilidade devem ser associados com previsibilidade precisa para garantir que novas drogas possam ter sucesso durante o desenvolvimento clínico. No entanto, as estratégias pré-clínicas atuais, que se baseiam em modelos celulares artificiais reducionistas (por exemplo, linhagens celulares imortalizadas geneticamente modificadas que superexpressam alvos cardíacos específicos de interesse) e modelos animais não humanos, têm mostrado limitações significativas e têm sido associadas a altas taxas de atrito de drogas (ou seja, uma alta taxa de falsos sinais)1,2,3,4 . Nesse sentido, é imperativo estabelecer novos e confiáveis modelos de contratilidade cardíaca celular humana que estejam associados a alta potência (ou seja, alta taxa de sinais verdadeiros) para predizer desfechos de drogas em humanos e, assim, ajudar a acelerar o lançamento de novas terapias5.
Os métodos inovadores recentemente estabelecidos para a recuperação de corações de doadores humanos para pesquisa 6,7,8,9,10 e em técnicas de isolamento de cardiomiócitos 11,12,13,14,15 proporcionaram uma oportunidade única para a realização de estudos em humanos durante o desenvolvimento pré-clínico. Para tanto, cardiomiócitos humanos primários adultos já demonstraram utilidade na avaliação de alterações induzidas por drogas na contratilidade cardíaca humana11,12,13,14. O presente artigo detalha o protocolo para investigar os efeitos da contratilidade de novos compostos em cardiomiócitos humanos adultos.
Protocolo
Todos os métodos foram realizados de acordo com as diretrizes e regulamentações pertinentes. Todos os corações humanos utilizados para os estudos eram não transplantáveis e eticamente obtidos por consentimento legal informado (primeira pessoa ou parente próximo) de doadores de órgãos cadavéricos nos Estados Unidos (EUA). Os protocolos de recuperação e experimentação in vitro foram pré-aprovados por Comitês de Revisão Institucional (CEPs) em centros transplantadores dentro da US Organ Procurement Transplant Network (OPTN). Além disso, todas as transferências de corações doados são totalmente rastreáveis e periodicamente revisadas pelas autoridades federais dos EUA.
NOTA: Aplicar todos os procedimentos de segurança necessários durante a execução deste protocolo, incluindo o uso de equipamentos de proteção individual apropriados (por exemplo, jalecos de laboratório, óculos de segurança, luvas).
1. Isolamento dos cardiomiócitos (1 dia antes da medida da contratilidade)
- Reperfundir corações de doadores imediatamente na chegada ao laboratório com solução cardioplégica patenteada gelada6 e isolar enzimaticamente miócitos humanos adultos primários dos ventrículos 11,12,13,14,15.
- Em seguida, manter os cardiomiócitos em suspensão e armazená-los com 10 mL da solução A (sacarose 110 mM, CaCl2 0,005 mM, 2 mM MgCl 2, 70 mM KOH, ácido lactobiônico 60 mM, 10 mM KH 2 PO4, 20 mM taurina, 20 mM L-histidina, 20 mM HEPES, 2 mM L-ácido glutâmico,2 mM L-(-)-ácido málico, pH 7,4 com KOH) em frascos de 20 mL de Wheaton (Tabela de Materiais) em temperatura refrigerada até serem interrogados experimentalmente.
NOTA: Armazenar 200.000 células por frasco para injetáveis.
2. Preparação do revestimento de laminina (1 dia antes de medir a contratilidade)
- Coloque uma única lamínula de vidro (quadrado de 25 mm x 25 mm, Tabela de Materiais) em cada poço de uma placa de cultura de oito poços (Tabela de Materiais).
- Em seguida, revestir as lamínulas com laminina na concentração de 5 μg/mL. Para isso, adicione 800 μL do estoque de Laminina 521 recombinante humana (Tabela de Materiais, armazenado a −20 °C) a 7,2 mL de solução B (NaCl 145 mM, KCl 4 mM, CaCl2 2,5 mM, MgCl2 1 mM, glicose 11,1 mM e HEPES 10 mM, pH 7,4 com NaOH) e misture bem.
- Lançar 200 μL da solução de laminina diluída no centro de cada lamínula. Em seguida, tampe o prato e empilha-o em uma geladeira de 4 °C.
NOTA: Prepare várias placas de cultura de oito poços para garantir que haja laminina-revestida suficiente.
3. Preparação de cardiomiócitos tolerantes a Ca2+ (no dia da medição da contratilidade)
- Retire um frasco para injetáveis de células do frigorífico, aspirar a solução A do frasco para injetáveis e adicionar 10 ml refrigerados de solução B.
NOTA: Certifique-se de que as células não são aspiradas e disperse a solução B no frasco para injetáveis colocando a pipeta no interior da parte superior da parede do frasco para injetáveis. - Tampe o frasco para injetáveis de células e, em seguida, gire suavemente para garantir que as células estão dispersas por toda a solução B. Finalmente, deixe as células se acomodarem por 1 h à temperatura ambiente (TR).
4. Preparação do sistema de registo (no dia da medição da contratilidade)
NOTA: O sistema de registro inclui caixa de controle de temperatura, estimulador, perfusão controlada por computador, frascos de perfusão acionados por pressão, software de aquisição interno que permite a seleção de regiões de interesse (ROIs) e exibição de transientes de contratilidade, microscópio invertido, câmara celular e câmera (Figura 1).
- Ligue o sistema de vácuo de sucção. Em seguida, remova a tampa do microscópio, ligue-a, conecte a câmera (Tabela de Materiais, Figura 1) e, finalmente, confirme se o ventilador está ligado para garantir que a câmera não superaqueça.
- Em seguida, ligue a placa de aquecimento do microscópio (Tabela de Materiais) e a caixa de controle de temperatura (Tabela de Materiais, Figura 1), e ajuste-as para a temperatura de operação adequada. Em seguida, ligue o estimulador de campo (Tabela de Materiais, Figura 1) e o sistema de pressão. Por fim, conecte a tubulação da solução (Tabela de Materiais) à câmara de registro (Tabela de Materiais, Figura 1).
5. Preparação dos compostos de ensaio (no dia da medição da contratilidade)
- Dimetilsulfóxido diluído (DMSO; Tabela de Materiais) 1.000 vezes na solução C (NaCl 145 mM, KCl 4 mM, CaCl2 1,8 mM, MgCl2 1 mM, glicose 11,1 mM e HEPES 10 mM, pH 7,4 com NaOH) para fazer uma solução veicular DMSO a 0,1%.
- Para testar um composto a 1 vez, 10 vezes, 100 vezes e 1000 vezes de sua exposição terapêutica de 0,001 μM, dissolver o composto de teste em DMSO a uma concentração de 1 mM.
- Diluir esta solução em série com DMSO para produzir mais três stocks de DMSO (por exemplo, 0,001 mM, 0,01 mM e 0,1 mM). Finalmente, diluir cada estoque de composto de teste 1.000 vezes em 100 mL de solução C para obter as concentrações finais de teste (0,001 μM, 0,01 μM, 0,1 μM e 1 μM).
- Adicionar a solução do veículo e as soluções das concentrações micromolares finais do composto aos frascos de vidro de 100 mL (Tabela de Materiais, Figura 1) e, em seguida, conectar os frascos ao sistema de perfusão acionado por pressão (Tabela de Materiais, Figura 1).
- Em seguida, prime o sistema de perfusão com um programa computadorizado (Tabela de Materiais) usando uma pressão de 200-300 mbar para fornecer um fluxo de perfusão constante a uma taxa de 1,8 mL/min.
NOTA: Não conduza a experiência se se verificar que o composto de ensaio está associado a um problema de solubilidade. Além disso, formular as soluções de teste de compostos a partir de soluções-mãe dentro de 30 minutos antes da aplicação experimental nas células.
6. Plainização dos cardiomiócitos (no dia da medição da contratilidade)
- Tire uma placa de oito poços contendo laminas revestidas de laminina, para fora da geladeira a 4 °C e coloque cuidadosamente uma tampa em uma câmara de registro muito bem limpa (Figura 1). Em seguida, retorne a placa de oito poços para a geladeira de 4 °C até o próximo revestimento.
NOTA: Use um lenço sem fiapos (Tabela de Materiais) para limpar a lamínula revestida, mantendo a lamina revestida em uma fina camada de laminina. Além disso, certifique-se de descartar as lamínulas usadas em um recipiente para materiais perfurocortantes. - Em seguida, tome um frasco escalonado de células (passo 3.2) e aspirar a solução B do frasco para injetáveis para atingir o menor volume possível sem perder células (~200 μL). Em seguida, dispense os 200 μL de células na câmara do microscópio de gravação montada no palco de um microscópio invertido (Tabela de Materiais).
- Deixe as células assentarem na lamínula por 5 min. Enquanto espera que as células se estabeleçam completamente, abra o campo de visão no microscópio e determine se a densidade celular é adequada (~70%) para o início da execução experimental.
NOTA: Certifique-se de que a sucção não aspira todas as células se forem dispensados mais de 200 μL.
7. Registro da contratilidade dos cardiomiócitos
- Após o acabamento do plaqueamento, equilibre as células por 5 min perfundindo-as continuamente com a solução C usando o sistema de perfusão acionado por pressão (Tabela de Materiais). Ajuste a sucção corretamente, ligue a caixa de controle de temperatura e a placa de aquecimento e configure-as para fornecer ~35 °C.
- Em seguida, estimular as células com tensão supralimiar a uma frequência de estimulação de 1 Hz (pulso bipolar de 3 ms de duração) em um estimulador de campo com um par de fios de platina colocados em lados opostos da câmara conectados a um estimulador de campo.
- Ajuste a amplitude do pulso estimulador em 1 V e, em seguida, aumente-o até que os cardiomiócitos comecem a gerar ciclos de contração-relaxamento. Use um valor de limite de 1,5x durante todo o experimento.
NOTA: Selecione células saudáveis com morfologia em forma de bastonete e estrias claras. Em seguida, ajuste o campo de visão e concentre-se em exibir o maior número possível de células de contração (Figura 2A). - Em seguida, exibir as imagens digitalizadas das células dentro do software de aquisição do sistema de registro de contratilidade óptica. Este software utiliza uma câmera de alta resolução e alta taxa de quadros com uma taxa de 150 FPS (Tabela de Materiais, Figura 1) para gravar um fluxo de vídeo contendo vários miócitos no mesmo quadro.
NOTA: Isso fornece resolução temporal e espacial suficiente para capturar e medir a dinâmica dos sarcômeros de vários miócitos saudáveis simultaneamente. Os processadores modernos de alta contagem de núcleos são aproveitados para permitir o cálculo paralelo de mudanças no comprimento do sarcômero a partir do fluxo de vídeo em tempo real (dados de densidade óptica são coletados de regiões de interesse definidas pelo usuário [ROI] colocadas sobre as imagens de cardiomiócitos saudáveis e paralelas ao eixo de contração, Figura 2B). Os dados de intensidade óptica mostram bandas claras e escuras correspondentes às linhas Z dos cardiomiócitos (Figura 1, Figura 2C). Finalmente, esses dados são exibidos ao usuário para fins de monitoramento e salvos em um disco para análise posterior (Figura 2C).- Evite áreas das células que não estão em foco. Além disso, não posicione as ROIs próximas à borda das células, pois as mudanças na contração das células durante a aplicação de drogas podem fazer com que as ROIs não consigam ler a contração das células.
- Quando a seleção das ROIs for concluída e as contrações atenderem aos padrões necessários para uso (por exemplo, encurtamento do sarcômero >1%; contração rítmica após aplicação de uma frequência de estimulação de 1 Hz, ausência de eventos arrítmicos), inicie o experimento para avaliar os efeitos de um composto. O protocolo de estimulação e a sequência de aplicação das concentrações de teste do composto são mostrados na Tabela 1. O software de aquisição gerenciará, de forma automatizada, a aquisição e exibição de dados e rotulagem das concentrações de teste e tempo de tratamento.
NOTA: Aplicar concentrações de ensaio se a contração permanecer numa amplitude estável durante todo o período do veículo de base. Desqualificar células que exibem um run-up ou run-down. Além disso, certifique-se de que a perfusão seja alterada para as diferentes concentrações de teste ao longo do experimento.
- Após a conclusão do experimento e armazenamento de dados no servidor, desligue a perfusão e o aquecedor, pare a estimulação, limpe a câmara do microscópio com água destilada, remova a tampa de vidro e seque bem a câmara.
NOTA: Limpe bem a câmara, pois isso é fundamental para evitar expor o próximo conjunto de células a qualquer composto prematuramente, invalidando assim quaisquer dados coletados. - Em seguida, realizar um novo revestimento de cardiomiócitos e realizar um experimento adicional para obter dados suficientes para completar o teste do composto ou testar um novo composto.
8. Desligando o sistema óptico de gravação de contratilidade
- Quando o teste diário do(s) composto(s) for concluído, primeiro desligue todos os equipamentos que não são necessários para limpar o sistema e copie os dados para análise off-line.
- Em seguida, remova os frascos de vidro de 100 mL (Tabela de Materiais) contendo soluções das concentrações finais de teste e substitua-os por frascos de vidro preenchidos no meio do caminho com solução de concentrado RBS 25 (Tabela de Materiais). Perfundir a solução RBS através da câmara do microscópio por 5 min, em seguida, desconectar a tubulação de perfusão da câmara, limpá-la com água destilada e, finalmente, secá-la completamente.
NOTA: Certifique-se de que o vácuo está funcionando bem para evitar possíveis inundações. - Em seguida, conecte a tubulação de perfusão à tubulação de drenagem. Usando o software do sistema de perfusão acionado por pressão (Tabela de Materiais), execute a solução RBS por 10 min, garantindo que a pressão e a vazão estejam adequadamente ajustadas. Em seguida, perfundir DMSO 1% por 5 min e, em seguida, água destilada por 15-20 min para completar a limpeza do sistema de perfusão.
- Desligue a luz do microscópio e coloque sua tampa. Em seguida, desconecte os fios da câmera da caixa na lateral do microscópio e desligue o ventilador. Certifique-se de que todos os frascos usados sejam enviados para limpeza e autoclave. Por fim, certifique-se de que todas as caçambas de drenagem estejam 1/4 cheias ou menos.
NOTA: Certifique-se de que existem laminínicos suficientes para utilização no dia seguinte. - Finalmente, copie os arquivos na pasta de aquisição de todos os experimentos feitos em cada sistema de gravação e cole-os em um servidor de backup seguro para análise offline adicional. Em seguida, exclua todos os arquivos de dados da pasta de aquisição.
9. Análise dos dados de contratilidade
- Execute a análise off-line usando o software de análise e uma macro personalizada para calcular a média dos dados. O software de análise calcula e reporta várias métricas a partir dos dados dinâmicos do sarcômero produzidos pelo software de aquisição. Uma lista detalhada desses parâmetros é fornecida na Figura 2D.
NOTA: A aplicação de técnicas de software de baixo nível permite que muitas execuções de gravações sejam analisadas em 5 s. O principal parâmetro para avaliar as mudanças na contratilidade induzidas por drogas é a amplitude da contratilidade (% de encurtamento do sarcômero = mudança no comprimento do sarcômero). É calculado como o comprimento do sarcômero no pico de contração/comprimento do sarcômero em repouso e calculado a média dos últimos 20 transientes de contratilidade para cada concentração de teste. - Quantificar os efeitos do composto de teste na amplitude de contratilidade média em relação à condição de controle do veículo basal específica de cada cardiomiócito.
- Expresse os resultados médios como média ± MEV e produza um gráfico plotando o efeito da concentração do composto de teste na amplitude de contratilidade. Em seguida, ajuste a curva concentração-resposta à equação de Hill usando um software de análise (Tabela de Materiais) para derivar os valores de IC50 (concentração produzindo uma inibição de 50% da amplitude de contratilidade) e CE50 (concentração produzindo um aumento de 50% na amplitude de contratilidade).
- Além da amplitude de contratilidade, você também pode calcular outros parâmetros:
- Pós-contração: Identificar a pós-contração como uma contração secundária espontânea transitória do cardiomiócito que ocorre antes da próxima contração regular e produz uma contração anormal e não sincronizada.
- Falha de contração: Identificar falha de contração como a incapacidade do estímulo elétrico de induzir uma contração.
- Variabilidade de curto prazo (STV) e alternans: Visualize esses dois parâmetros em gráficos de Poincaré da variabilidade da amplitude de contração.
- Calcular o STV (∑|CAn + 1 − CAn| (20 × √2) −1) com os últimos 20 transientes de cada período de concentração dos artigos de controlo e ensaio. Identificar alternâncias como repetitivas, alternando transientes de amplitude de contratilidade curta e longa.
- Para calcular a incidência de pró-arritmia, normalizar os valores de STV para o valor de controle do veículo de cada célula, plotar pós-contração, falha de contração, STV e alternans, e expressá-los como % da incidência de células exibindo cada um dos sinais.
- Completar o perfil mecanístico multiparamétrico com o cálculo do tempo Ato pico, decaimento para 30% de relaxamento (Decay 30), decaimento para 90% de relaxamento (Decay 90), tempo para 90% de relaxamento (TR90) (Figura 2D), comprimento basal do sarcômero, tempo para 50% de pico, altura do pico, comprimento do sarcômero no pico de contratilidade, velocidade máxima de contração e velocidade máxima de relaxamento12. Assim como a amplitude de contratilidade, expresse esses parâmetros relativos à condição de controle basal específica de cada cardiomiócito e os represente graficamente em gráficos concentração-resposta.
Resultados
Descrito neste protocolo é um procedimento para medir a contratilidade em cardiomiócitos primários humanos adultos isolados de doadores de órgãos e avaliar alterações agudas nos parâmetros de contratilidade induzidas por um composto teste. A medida da transiência da contratilidade é realizada por meio de um sistema de geometria celular baseado em vídeo, o MyoBLAZER, que mede a dinâmica do sarcômero, e a condição cardíaca do adulto é emulada pela indução da contratilidade com estimulação elétrica na frequência de estimulação fisiológica (1 Hz). A viabilidade funcional dos cardiomiócitos é confirmada pela avaliação de seu acoplamento excitação-contração (isto é, processamento celular ligando excitação elétrica [o potencial de ação sarcolemal] com contração). Não há transientes de contratilidade espontânea nos cardiomiócitos humanos, e os cardiomiócitos respondem à estimulação elétrica externa com ciclos de contratilidade/relaxamento (Figura 2C, E), bem como ao isoproterenol, um agonista β-adrenérgico (Figura 2F,G). O isoproterenol provoca um aumento concentração-dependente da contratilidade (Figura 2G), e seus efeitos sobre a cinética de contratilidade transiente também podem ser caracterizados (Figura 2D)12.

Figura 1: Configuração experimental do sistema de registro óptico de contratilidade. Os registros de contratilidade em campo claro são feitos a partir de cardiomiócitos humanos primários adultos, conforme previamente descrito11,12,13,14. A configuração inclui uma (A) caixa de controle de temperatura, (B) estimulador de campo, (C,D) sistema de perfusão acionado por pressão, (E) programa computadorizado acionado por pressão, (F) pressão mais frascos, (G) software de aquisição, (H) seleção de ROIs com software de aquisição, (I) exibição de transientes de contratilidade com software de aquisição, (J) microscópio invertido, (K) câmara de microscópio e ( L) câmera. Todas as características do equipamento são dadas na Tabela de Materiais. Clique aqui para ver uma versão maior desta figura.
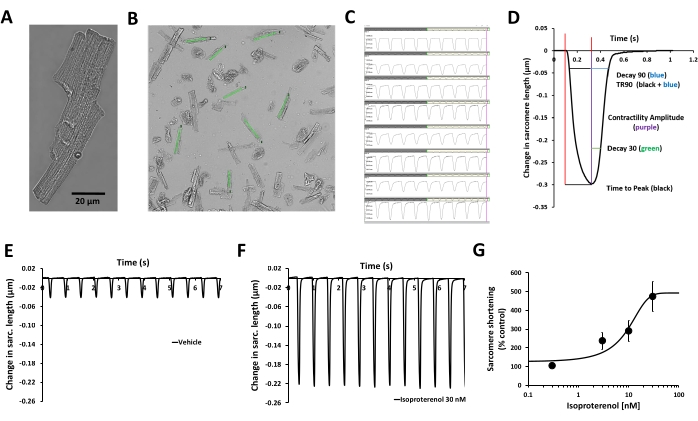
Figura 2: Validação da medida da contratilidade dos cardiomiócitos humanos e do efeito da estimulação β-adrenérgica. (A) Imagem de microscopia de contraste de fase de um cardiomiócito primário humano representativo, (B) regiões de interesse (ROI) definidas pelo usuário colocadas sobre as imagens de cardiomiócitos saudáveis e paralelas ao eixo de contração, (C) exibição de transientes de contratilidade obtidos a partir das mesmas ROIs em (B) com o software de aquisição, (D) parâmetros relacionados ao transiente de contratilidade medidos com o software de aquisição: amplitude da contratilidade, tempo até o pico, Decay 30, Decay 90, TR90. Parâmetros adicionais também podem ser medidos: comprimento basal do sarcômero, tempo até o pico de 50%, altura do pico, comprimento do sarcômero no pico de contratilidade, velocidade máxima de contração e velocidade máxima de relaxamento. (E) Transientes típicos de contratilidade registrados a partir de um miócito ventricular primário humano adulto a uma frequência de estimulação de 1 Hz na presença de veículo controle (F) e após exposição a 30 nM de isoproterenol, um agonista não seletivo β-adrenérgico. Os transientes de contratilidade demonstrados nos painéis E e F foram coletados do mesmo cardiomiócito. Isoproterenol de cardiomiócitos humanos estimulados na frequência de estimulação de 1 Hz foi usado para gerar a informação de potência. (G) Curva concentração-resposta cumulativa típica gerada pela medida da contratilidade de cardiomiócitos humanos com isoproterenol (n = 8 células). Clique aqui para ver uma versão maior desta figura.
| Sequência de Perfusão | Solução para veículos | Concentração 1 (μM) | Concentração 2 (μM) | Concentração 3 (μM) | Concentração 4 (μM) | Lavar |
| Tempo de Tratamento | 120 s | Anos 300 | Anos 300 | Anos 300 | Anos 300 | Anos 300 |
| Frequência de Estimulação | 1 Hz | 1 Hz | 1 Hz | 1 Hz | 1 Hz | 1 Hz |
Tabela 1: Protocolo de estimulação e sequência de aplicação do composto teste. A estabilidade dos transientes de contratilidade é avaliada pelo registro contínuo para 120 s na solução C, estabelecendo o controle do veículo (tipicamente em DMSO a 0,1%). Posteriormente, a concentração do artigo de ensaio é aplicada por um período mínimo de 300 s ou até que se atinja um efeito de estado estacionário. Quatro concentrações ascendentes de artigos de ensaio são usadas, fornecendo curvas cumulativas de concentração-efeito (C-E). No final das adições cumulativas do artigo de teste, um período de washout de 300 s pode ser implementado.
Discussão
Este manuscrito fornece um protocolo detalhado para o sistema óptico baseado em contratilidade de cardiomiócitos humanos adultos para um método simplificado de médio rendimento que permite testar a eficácia aguda e a cardiotoxicidade de novos compostos. Este sistema de registro óptico de contratilidade é fácil de usar, permite gravações de várias células em paralelo, permite a avaliação simultânea da saúde, fisiologia e farmacologia celular, vem com análise de dados automatizada e rápida (uma série de várias células é analisada em 5 s) e permite a rápida coleta de dados (curva de concentração-resposta a cada 30 min/composto/dispositivo). Levando em consideração esses atributos, o sistema de registro pode ser usado não apenas para detectar os efeitos de drogas sobre a contratilidade de cardiomiócitos, mas também para fornecer dados de relação estrutura-atividade para apoiar os esforços de química medicinal durante as fases iniciais da descoberta de fármacos16. Uma vez que dezenas de milhões de células podem ser obtidas a partir de um protocolo de isolamento de cardiomiócitos, a aplicação do sistema de registro óptico de contratilidade-plataforma de cardiomiócitos está sendo explorada atualmente para alcançar maior capacidade de teste (com o uso de placas bem baseadas) com custo reduzido. Além disso, a avaliação dos efeitos dos fármacos sobre os parâmetros sistólicos e de relaxamento medidos com o sistema de registro pode fornecer um perfil mecanístico multiparamétrico dosinotrópicos 12. Além disso, os dados de contratilidade dos cardiomiócitos podem ser usados para classificar novos medicamentos do mais para o menos cardiotóxico (por exemplo, margem de segurança) e do menos para o mais eficaz (por exemplo, margem de potência). Estudos de acompanhamento da contratilidade dos cardiomiócitos também podem ser realizados para subsidiar programas de desenvolvimento que têm sido associados à diminuição clínica da contratilidade miocárdica12.
Outra vantagem significativa da utilização do sistema de registro óptico da contratilidade de cardiomiócitos humanos é seu alinhamento com o conceito de 3Rs (substituição, redução e refinamento)17 , uma vez que pode ser considerado como um método alternativo que evita ou substitui o uso de animais para geração de dados dentro da indústria farmacêutica. Esse benefício dos 3Rs também pode ser estendido à pesquisa cardíaca acadêmica. Todo o conhecimento atual sobre fisiologia e farmacologia dos cardiomiócitos provém de pesquisas acadêmicas realizadas com células isoladas de corações deanimais18. Assim, o modelo de contratilidade óptica de cardiomiócitos humanos abre a possibilidade para a realização de estudos translacionais críticos. Para a realização desses estudos, protocolos de preservação e embarque de cardiomiócitos adultos humanos devem ser desenvolvidos (atualmente em avaliação no laboratório da AnaBios), e o sistema de contratilidade deve ter a capacidade de registrar mudanças no comprimento dos sarcômeros de cardiomiócitos não humanos (é o caso do sistema de registro óptico de contratilidade, uma vez que os sarcômeros são bem conservados entre as espécies).
O sistema de contratilidade de cardiomiócitos humanos pode emular várias condições fisiológicas (por exemplo, acoplamento eletromecânico, frequência de estimulação mimetizando frequência cardíaca, temperatura corporal, integração de todos os alvos cardíacos humanos) e demonstrou valor translacional como um componente-chave na descoberta de fármacos11,12,13,14, embora não possa mimetizar as mudanças na carga mecânica e no estresse de cisalhamento observadas durante o ciclo contrátil cardíaco. A estrutura e a função das matrizes extracelulares cardíacas estão agora mais bem compreendidas19, o desenvolvimento de tais matrizes pode potencialmente ajudar a superar a limitação da carga mecânica, e matrizes com diferentes rigidezes semelhantes às cardíacas estão sendo avaliadas atualmente no laboratório da AnaBios. Outra limitação do sistema de contratilidade óptica dos cardiomiócitos humanos é a ausência da rede de nervos que irriga o coração (por exemplo, fibras simpáticas e parassimpáticas)20. Esse contato neurocardíaco pode ser restabelecido com a co-aplicação de neurotransmissores (por exemplo, isoproterenol, um agonista dos receptores β-adrenérgicos; acetilcolina, um agonista dos receptores muscarínicos M2), com o composto sendo avaliado por seus potenciais efeitos sobre a contratilidade dos cardiomiócitos. Além disso, os transientes de contratilidade são registrados sem medidas simultâneas dos potenciais de ação e transientes de Ca 2+, que também são essenciais na avaliação dos efeitos de drogas no eletrocardiograma e no manuseio de Ca2+. Embora essa omissão possa ser considerada uma limitação do sistema, ela não é muito crítica, uma vez que os registros de sinais de potencial de ação (com o método corrente-pinça ou corantes sensíveis à voltagem) e transientes de Ca 2+ (com indicadores/corantes de Ca2+) podem estar associados à citotoxicidade. Tais efeitos citotóxicos podem impactar na avaliação de novas drogas para modular a contratilidade cardíaca. Pelo contrário, o uso de um método óptico não invasivo que preserve a saúde, a fisiologia e a farmacologia dos cardiomiócitos, como o sistema de registro descrito neste protocolo, não apenas garantiria a obtenção da mais alta qualidade de dados de contratilidade, mas também forneceria dados capazes de prever bem os efeitos contráteis de novas drogas em humanos.
Divulgações
Todos os autores são funcionários da AnaBios Corporation e declaram não haver interesses concorrentes.
Agradecimentos
Este trabalho foi apoiado pela AnaBios Corporation e uma bolsa NIH Small Business Innovation Research (SBIR) (1R44TR003162-01).
Materiais
| Name | Company | Catalog Number | Comments |
| 100–1000 µL Filtered, Wide Orifice, Sterile tips | Pipette | UF-1000W | |
| 100 mL, Duran pressure plus bottles | DWK Life Sciences | 218102406 | |
| 1 L, 0.22 µm Vacuum Filter system | VWR | 567-0020 | |
| 290 mmol/kg Osmolarity Standard | Wescor | OA-029 | |
| Benchtop pH Meter | Mettler Toledo | https://www.mt.com/us/en/home/products/Laboratory_Analytics_Browse/pH-meter/pH-meters.html | |
| Calcium Chloride dihydrate (CaCl2) | Sigma-Aldrich | C3881 | |
| Camera | Optronis GmbH | Cyclone-25-150-M | https://optronis.com/en/products/cyclone-25-150/ |
| Corning 25 mm x25 mm Square #1 Cover Glass | Corning | 2845-25 | |
| Cyclone-25-150 | Optronis | https://optronis.com/en/products/cyclone-25-150/ | |
| D-(+)-Glucose | Sigma-Aldrich | G8270 | |
| Digital Timer/Stopwatch | Fisher Scientific | 14-649-17 | |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | D8418 | |
| Eight-well rectangular polystyrene sterile culture plate | Thermo Fisher Scientific | 73521-426 | https://us.vwr.com/store/product/4679368/nunclontm-delta-rectangular-dishes-polystyrene-sterile-thermo-scientific |
| FHD Microscope Chamber System | IonOptix | ||
| Flow EZ, Modular pressure-based flow controller with a computer driven program version 1.1.0.0. | Fluigent OxyGEN | ||
| Heavy Duty Vacuum Bottles | VWR | 16211-080 | |
| HEPES | Sigma-Aldrich | H3375 | |
| Human Recombinant Laminin 521 | BioLamina | LM521-05 | |
| Idex Chromatography Tubing, Natural FEP, 1/16" OD x 0.030" ID | Cole-Palmer | 1520L | |
| Kimberly-Clark Professional Kimtech Science Kimwipes | Fisher Scientific | 06-666 | |
| L-(-)-Malic acid | Sigma-Aldrich | 112577 | |
| Lactobionic acid | Sigma-Aldrich | 153516 | |
| L-Glutamic acid | Sigma-Aldrich | 49449 | |
| L-Histidine | Sigma-Aldrich | H8000 | |
| Magnesium Chloride hexahydrate (MgCl2) | Sigma-Aldrich | M9272 | |
| Microscope Temperature Control Stage Warmer | AmScope | TCS-100 | |
| MyoPacer Field Stimulator | IonOptix | ||
| Nunc Rectangular Dishes | Thermo Scientific | 267062 | |
| Olympus IX83P1ZF Ixplore Standard microscope | Olympus | https://www.olympus-lifescience.com/en/microscopes/inverted/ixplore-standard/?campaignid=657680540&adgroupid =116963199831&keyword=ix73%20 microscope&gclid=EAIaIQobChMIl qjyiMWP-AIVVx-tBh2JoQ85EAA YASAAEgLp3fD_BwE | |
| pH 4.01, 7.00, and 10.01 Standards | Oakton | WD-05942-10 | |
| Potassium Chloride (KCl) | Sigma-Aldrich | 746436 | |
| Potassium Hydroxide (KOH) | Sigma-Aldrich | P4494 | |
| Potassium phosphate monobasic (KH2PO4) | Sigma-Aldrich | 795488 | |
| Prism Software | GraphPad Software - Dotmatics | https://www.graphpad.com/ | |
| RBS 25 Liquid Detergent | Sigma-Aldrich | 83460 | |
| Sharps Container | Uline | S-15307 | |
| SigmaPlot analysis software | Systat Software Inc. | https://systatsoftware.com/ | |
| Sodium Chloride (NaCl) | Sigma-Aldrich | S3014 | |
| Sodium Hydroxide (NaOH) | Sigma-Aldrich | 221465 | |
| Student Dumont #5 Forceps | Fine Science Tools | 91150-20 | |
| Sucrose | Sigma-Aldrich | S7903 | |
| Taurine | Sigma-Aldrich | T0625 | |
| Temperature Control Box | Warner Insturments | TC-324C | |
| Vapor Pressure Osmometer | ELITechGroup | Model 5600 | |
| Wheaton 20 mL Vials | DWK Life Sciences | 225288 |
Referências
- Abi-Gerges, N., Miller, P. E., Ghetti, A. Human heart cardiomyocytes in drug discovery and research: new opportunities in translational sciences. Current Pharmaceutical Biotechnology. 21 (9), 787806 (2020).
- Cook, D., et al. Lessons learned from the fate of AstraZeneca's drug pipeline: A five dimensional framework. Nature Reviews Drug Discovery. 13 (6), 419-431 (2014).
- Van Meer, B. J., Tertoolen, L. G. J., Mummery, C. L. Measuring physiological responses of human pluripotent stem cell derived cardiomyocytes to drugs and disease. Stem Cell. 34 (8), 2008-2015 (2016).
- Piccini, J. P., et al. Current challenges in the evaluation of cardiac safety during drug development: translational medicine meets the critical path initiative. American Heart Journal. 158 (3), 317-326 (2009).
- Pang, L., et al. Workshop report: FDA workshop on improving cardiotoxicity assessment with human-relevant platforms. Circulation Research. 125 (9), 855-867 (2019).
- Page, G., et al. Human ex-vivo action potential model for pro-arrhythmia risk assessment. Journal of Pharmacological and Toxicological Methods. 81, 183-195 (2016).
- Britton, O. J., et al. Quantitative comparison of effects of dofetilide, sotalol, quinidine, and verapamil between human ex vivo trabeculae and in silico ventricular models incorporating inter-individual action potential variability. Frontiers in Physiology. 8, 597 (2017).
- Qu, Y., et al. Action potential recording and pro-arrhythmia risk analysis in human ventricular trabeculae. Frontiers in Physiology. 8, 1109 (2017).
- Trovato, C., et al. Human Purkinje in silico model enables mechanistic investigations into automaticity and pro-arrhythmic abnormalities. Journal of Molecular and Cellular Cardiology. 142, 24-38 (2020).
- Otsomaa, L., et al. Discovery and characterization of ORM-11372, a novel inhibitor of the sodium-calcium exchanger with positive inotropic activity. British Journal of Pharmacology. 177 (24), 5534-5554 (2020).
- Nguyen, N., et al. Adult human primary cardiomyocyte-based model for the simultaneous prediction of drug-induced inotropic and pro-arrhythmia risk. Frontiers in Physiology. 8, 1073 (2017).
- Abi-Gerges, N., et al. Multiparametric mechanistic profiling of inotropic drugs in adult human primary cardiomyocytes. Scientific Reports. 10, 7692 (2020).
- Jordaan, P., et al. Cardiotoxic potential of hydroxychloroquine, chloroquine and azithromycin in adult human primary cardiomyocytes. Toxicological Sciences. 180 (2), 356-368 (2021).
- Ton, A. T., et al. Arrhythmogenic and antiarrhythmic actions of late sustained sodium current in the adult human heart. Scientific Reports. 11, 12014 (2021).
- Schmid, C., Abi-Gerges, N., Leither, M. G., Zellner, D., Rast, G. Ion channel expression and electrophysiology of singular human (primary and induced pluripotent stem cell-derived) cardiomyocytes. Cells. 10 (12), 3370 (2021).
- Guha, R. On exploring structure activity relationships. Methods in Molecular Biology. 993, 81-94 (2013).
- Tannenbaum, J., Bennett, B. T. Russell and Burch's 3Ra then and now: The need for clarity in definition and purpose. Journal of the American Association for Laboratory Animal Science. 54 (2), 120-132 (2015).
- Ruiz-Meana, M., Martinson, E. A., Garcia-Dorado, D., Piper, H. M. Animal ethics in cardiovascular research. Cardiovascular Research. 93 (1), 1-3 (2012).
- Rienks, M., Papageorgiou, A. P., Frangogiannis, N. G., Heymans, S. Myocardial extracellular matrix. Circulation Research. 114 (5), 872-888 (2014).
- Zaglia, T., Mongillo, M. Cardiac sympathetic innervation, from a different point of (re)view. Journal of Physiology. 595 (12), 3919-3930 (2017).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados