Method Article
Messung der Herzkontraktilität in isolierten adulten humanen primären Kardiomyozyten
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt, wie die Kontraktilität in adulten humanen primären Kardiomyozyten aus Spenderherzen mit dem MyoBLAZER-System gemessen werden kann, einer zuverlässigen Plattform zur Beurteilung arzneimittelinduzierter Veränderungen der Kontraktilität während der präklinischen Entwicklung.
Zusammenfassung
Die Bewertung von Veränderungen der Herzkontraktilität ist während der präklinischen Entwicklung für neue kardiale und nicht-kardiale Wirkstoffe von entscheidender Bedeutung. In dieser Arbeit wird ein Protokoll zur Beurteilung von Veränderungen der Kontraktilität in adulten humanen primärventrikulären Kardiomyozyten unter Verwendung des MyoBLAZER beschrieben, einer nicht-invasiven optischen Methode, die die normale Physiologie und Pharmakologie der Zellen bewahrt. Diese optische Aufzeichnungsmethode misst kontinuierlich Kontraktilitätstransienten von mehreren Zellen parallel und liefert sowohl den mittleren Durchsatz als auch wertvolle Informationen für jede einzelne Zelle im Sichtfeld, was die Echtzeitverfolgung von Arzneimittelwirkungen ermöglicht. Die Kardiomyozytenkontraktionen werden durch getaktete elektrische Feldstimulation induziert, und die aufgenommenen Hellfeldbilder werden in eine Bildverarbeitungssoftware eingespeist, die die Verkürzung des Sarkomers über mehrere Kardiomyozyten hinweg misst. Diese Methode generiert schnell verschiedene Endpunkte in Bezug auf die Kinetik von Kontraktions- und Relaxationsphasen, und die resultierenden Daten können dann in Bezug auf verschiedene Konzentrationen eines Testobjekts interpretiert werden. Diese Methode wird auch in den späten Stadien der präklinischen Entwicklung eingesetzt, um mechanistische Folgestudien durchzuführen, um laufende klinische Studien zu unterstützen. Somit hat das adulte humane primäre Kardiomyozyten-basierte Modell in Kombination mit dem optischen System zur kontinuierlichen Kontraktilitätsüberwachung das Potenzial, zu einer neuen Ära der in-vitro-Übertragung kardialer Daten in der präklinischen medizinischen Therapieentwicklung beizutragen.
Einleitung
Die myokardiale Kontraktilität (Inotropie), die die natürliche Kontraktionsfähigkeit des Herzmuskels darstellt, ist eine Schlüsseleigenschaft der Herzfunktion und hängt von der Dynamik der elektromechanischen Kopplung ab. Arzneimittelinduzierte Veränderungen der myokardialen Kontraktilität sind zur Behandlung von Herzerkrankungen (z. B. Herzinsuffizienz) erwünscht und im Zusammenhang mit Kardiotoxizität unerwünscht (z. B. Verringerung der linksventrikulären Ejektionsfraktion). Daher müssen präklinische Kontraktilitätsmodelle mit einer genauen Vorhersage verbunden sein, um sicherzustellen, dass neuartige Medikamente während der klinischen Entwicklung erfolgreich sein können. Derzeitige präklinische Strategien, die sich auf reduktionistische künstliche Zellmodelle (z. B. gentechnisch veränderte immortalisierte Zelllinien, die bestimmte Herzziele von Interesse überexprimieren) und nicht-menschliche Tiermodelle stützen, haben jedoch erhebliche Einschränkungen gezeigt und sind mit hohen Arzneimittelabnutzungsraten verbunden (d. h. einer hohen Rate falscher Signale)1,2,3,4 . Dementsprechend ist es unerlässlich, neue und zuverlässige Modelle für die Kontraktilität des menschlichen zellulären Herzens zu etablieren, die mit einer hohen Leistung (d. h. einer hohen Rate an echten Signalen) verbunden sind, um Arzneimittelergebnisse beim Menschen vorherzusagen und somit dazu beizutragen, die Einführung neuer Therapien zu beschleunigen5.
Die bahnbrechenden Methoden, die kürzlich für die Gewinnung menschlicher Spenderherzen fürdie Forschung 6,7,8,9,10 und in Kardiomyozyten-Isolierungstechniken11,12,13,14,15 etabliert wurden, haben eine einzigartige Gelegenheit für die Durchführung von Studien am Menschen während der präklinischen Entwicklung geboten. Zu diesem Zweck haben erwachsene humane primäre Kardiomyozyten bereits einen Nutzen bei der Beurteilung arzneimittelinduzierter Veränderungen der menschlichen Herzkontraktilität gezeigt11,12,13,14. Der vorliegende Artikel beschreibt das Protokoll zur Untersuchung der Kontraktilitätseffekte neuartiger Verbindungen in adulten menschlichen Kardiomyozyten.
Protokoll
Alle Methoden wurden in Übereinstimmung mit den einschlägigen Richtlinien und Vorschriften durchgeführt. Alle menschlichen Herzen, die für die Studien verwendet wurden, waren nicht transplantierbar und wurden nach Aufklärung (erste Person oder nächste Angehörige) von Leichenorganspendern in den Vereinigten Staaten (USA) nach Aufklärung gewonnen. Die Genesungsprotokolle und In-vitro-Experimente wurden von Institutional Review Boards (IRBs) in Transplantationszentren innerhalb des US Organ Procurement Transplant Network (OPTN) vorab genehmigt. Darüber hinaus sind alle Transfers der Spenderherzen vollständig rückverfolgbar und werden regelmäßig von den US-Bundesbehörden überprüft.
HINWEIS: Wenden Sie während der Ausführung dieses Protokolls alle erforderlichen Sicherheitsmaßnahmen an, einschließlich des Tragens geeigneter persönlicher Schutzausrüstung (z. B. Laborkittel, Schutzbrille, Handschuhe).
1. Isolierung von Kardiomyozyten (1 Tag vor Messung der Kontraktilität)
- Die Spenderherzen werden sofort nach der Ankunft im Labor mit eiskalter, proprietärer kardioplegikerischer Lösung6 erneut perfundiert und enzymatisch adulte humane primäre Myozyten aus den Ventrikeln11, 12, 13, 14, 15 isoliert.
- Dann werden die Kardiomyozyten in Suspension gehalten und mit 10 ml Lösung A (110 mM Saccharose, 0,005 mM CaCl2, 3 mM MgCl2, 70 mM KOH, 60 mM Lactobionsäure, 10 mMKH2PO4, 20 mM Taurin, 20 mM L-Histidin, 20 mM HEPES, 2 mM L-Glutaminsäure, 2 mM L-(-)-Brillensäure, pH 7,4 mit KOH) in 20 ml Wheaton-Fläschchen (Materialtabelle) bei gekühlter Temperatur, bis sie experimentell befragt werden.
HINWEIS: Lagern Sie 200.000 Zellen pro Durchstechflasche.
2. Vorbereitung der Lamininbeschichtung (1 Tag vor der Messung der Kontraktilität)
- Legen Sie ein einzelnes Deckglas (25 mm x 25 mm quadratisch, Materialtabelle) in jede Vertiefung einer Acht-Well-Kulturplatte (Materialtabelle).
- Beschichten Sie dann die Deckgläser mit Laminin in einer Konzentration von 5 μg/ml. Dazu werden 800 μl des humanen rekombinanten Laminin 521-Stamm (Materialtabelle, gelagert bei −20 °C) zu 7,2 ml Lösung B (145 mM NaCl, 4 mM KCl, 2,5 mM CaCl 2, 1 mM MgCl2, 11,1 mM Glukose und 10 mM HEPES, pH 7,4 mit NaOH) gegeben und gut gemischt.
- Geben Sie 200 μl der verdünnten Lamininlösung in die Mitte jedes Deckglases. Dann den Teller abdecken und im 4 °C warmen Kühlschrank stapeln.
HINWEIS: Bereiten Sie mehrere Acht-Well-Kulturplatten vor, um sicherzustellen, dass genügend lamininbeschichtete Deckgläser vorhanden sind.
3. Herstellung von Ca2+-toleranten Kardiomyozyten (am Tag der Messung der Kontraktilität)
- Nehmen Sie eine Durchstechflasche mit Zellen aus dem Kühlschrank, saugen Sie Lösung A aus der Durchstechflasche und fügen Sie 10 ml Lösung B hinzu.
HINWEIS: Stellen Sie sicher, dass die Zellen nicht abgesaugt werden, und dispergieren Sie Lösung B in der Durchstechflasche, indem Sie die Pipette auf die Innenseite der Oberseite der Durchstechflasche legen. - Verschließen Sie die Durchstechflasche mit den Zellen und schwenken Sie sie dann vorsichtig, um sicherzustellen, dass die Zellen in Lösung B verteilt sind. Zum Schluss lassen Sie die Zellen 1 h bei Raumtemperatur (RT) ruhen.
4. Vorbereitung des Aufzeichnungssystems (am Tag der Messung der Kontraktilität)
HINWEIS: Das Aufzeichnungssystem umfasst eine Temperaturkontrollbox, einen Stimulator, eine computergesteuerte druckgesteuerte Perfusion, druckgesteuerte Perfusionsflaschen, eine hauseigene Erfassungssoftware, die die Auswahl von Regions of Interest (ROIs) und die Anzeige von Kontraktilitätstransienten ermöglicht, ein inverses Mikroskop, eine Zellkammer und eine Kamera (Abbildung 1).
- Schalten Sie das Saugvakuumsystem ein. Entfernen Sie dann die Mikroskopabdeckung, schalten Sie sie ein, schließen Sie die Kamera an (Materialtabelle, Abbildung 1) und vergewissern Sie sich schließlich, dass der Lüfter eingeschaltet ist, um sicherzustellen, dass die Kamera nicht überhitzt.
- Schalten Sie dann die Heizplatte des Mikroskops (Materialtabelle) und die Temperaturkontrollbox (Materialtabelle, Abbildung 1) ein und stellen Sie sie auf die richtige Betriebstemperatur ein. Schalten Sie dann den Feldstimulator (Materialtabelle, Abbildung 1) und das Drucksystem ein. Verbinden Sie abschließend den Schlauch der Lösung (Materialtabelle) mit der Aufzeichnungskammer (Materialtabelle, Abbildung 1).
5. Herstellung der Testverbindungen (am Tag der Messung der Kontraktilität)
- Verdünntes Dimethylsulfoxid (DMSO; Material-Tabelle) 1.000-fach in Lösung C (145 mM NaCl, 4 mM KCl, 1,8 mM CaCl2, 1 mM MgCl2, 11,1 mM Glukose und 10 mM HEPES, pH 7,4 mit NaOH), um eine0,1%ige DMSO-Vehikellösung herzustellen.
- Um eine Verbindung mit dem 1-fachen, 10-fachen, 100-fachen und 1000-fachen ihrer therapeutischen Exposition von 0,001 μM zu testen, löst man die Testverbindung in DMSO in einer Konzentration von 1 mM auf.
- Verdünnen Sie diese Lösung seriell mit DMSO, um drei weitere DMSO-Stammstoffe herzustellen (z. B. 0,001 mM, 0,01 mM und 0,1 mM). Zum Schluss wird jede Testverbindung 1.000-fach in 100 ml Lösung C verdünnt, um die endgültigen Testkonzentrationen (0,001 μM, 0,01 μM, 0,1 μM und 1 μM) zu erhalten.
- Geben Sie die Vehikellösung und die Lösungen der mikromolaren Endkonzentrationen der Verbindung in 100-ml-Glasflaschen (Materialtabelle, Abbildung 1) und schließen Sie die Flaschen dann an das druckgesteuerte Perfusionssystem an (Materialtabelle, Abbildung 1).
- Anschließend wird das Perfusionssystem mit einem computergesteuerten Programm (Materialtabelle) mit einem Druck von 200-300 mbar vorbereitet, um einen konstanten Perfusionsfluss mit einer Rate von 1,8 ml/min zu erzielen.
HINWEIS: Führen Sie das Experiment nicht durch, wenn festgestellt wird, dass die Testverbindung mit einem Problem mit der Löslichkeit verbunden ist. Formulieren Sie außerdem die zusammengesetzten Testlösungen aus Stammlösungen innerhalb von 30 Minuten vor der experimentellen Anwendung auf die Zellen.
6. Beschichtung der Kardiomyozyten (am Tag der Messung der Kontraktilität)
- Nehmen Sie eine Acht-Well-Platte mit lamininbeschichteten Deckgläsern aus dem 4 °C-Kühlschrank und legen Sie ein Deckglas vorsichtig in eine sehr gut gereinigte Aufzeichnungskammer (Abbildung 1). Dann die Acht-Well-Platte bis zum nächsten Anrichten wieder in den 4 °C heißen Kühlschrank stellen.
HINWEIS: Verwenden Sie ein fusselfreies Tuch (Materialtabelle), um das beschichtete Deckglas abzuwischen, während das Deckglas mit einer dünnen Schicht Laminin beschichtet bleibt. Stellen Sie außerdem sicher, dass Sie gebrauchte Deckgläser in einem Behälter für scharfe Gegenstände entsorgen. - Nehmen Sie dann eine eskalierte Durchstechflasche mit Zellen (Schritt 3.2) und saugen Sie Lösung B aus der Durchstechflasche ab, um ein möglichst kleines Volumen zu erreichen, ohne Zellen zu verlieren (~200 μl). Als nächstes werden die 200 μl Zellen in die Aufzeichnungsmikroskopkammer gegeben, die auf dem Tisch eines inversen Mikroskops montiert ist (Materialtabelle).
- Lassen Sie die Zellen 5 Minuten lang auf dem Deckglas ruhen. Während Sie darauf warten, dass sich die Zellen vollständig eingependelt haben, öffnen Sie das Sichtfeld des Mikroskops und stellen Sie fest, ob die Zelldichte ausreichend ist (~70%), damit der Versuchslauf beginnen kann.
HINWEIS: Stellen Sie sicher, dass nicht alle Zellen abgesaugt werden, wenn mehr als 200 μl abgegeben werden.
7. Erfassung der Kardiomyozyten-Kontraktilität
- Nach Abschluss der Beschichtung werden die Zellen 5 Minuten lang ins Gleichgewicht gebracht, indem sie kontinuierlich mit Lösung C unter Verwendung des druckgesteuerten Perfusionssystems perfundiert werden (Materialtabelle). Stellen Sie die Absaugung richtig ein, schalten Sie sowohl den Temperaturregler als auch die Heizplatte ein und stellen Sie sie auf ~35 °C ein.
- Dann werden die Zellen mit einer überschwelligen Spannung bei einer Schrittfrequenz von 1 Hz (bipolarer Impuls von 3 ms Dauer) auf einem Feldstimulator mit einem Paar Platindrähte stimuliert, die auf gegenüberliegenden Seiten der Kammer platziert sind und mit einem Feldstimulator verbunden sind.
- Stellen Sie die Amplitude des stimulierenden Impulses auf 1 V ein und erhöhen Sie sie dann, bis die Kardiomyozyten beginnen, Kontraktions-Entspannungs-Zyklen zu erzeugen. Verwenden Sie während des gesamten Experiments einen Wert von 1,5x Schwellenwert.
HINWEIS: Wählen Sie gesunde Zellen mit stäbchenförmiger Morphologie und deutlichen Streifen aus. Passen Sie dann das Sichtfeld an und konzentrieren Sie sich darauf, so viele kontrahierende Zellen wie möglich in die Ansicht zu bringen (Abbildung 2A). - Als nächstes zeigen Sie die digitalisierten Bilder der Zellen in der Erfassungssoftware des optischen Kontraktilitätsaufzeichnungssystems an. Diese Software verwendet eine hochauflösende Kamera mit hoher Bildrate und einer Rate von 150 FPS (Materialtabelle, Abbildung 1), um einen Videostream aufzuzeichnen, der mehrere Myozyten im selben Bild enthält.
HINWEIS: Dies bietet eine ausreichende zeitliche und räumliche Auflösung, um die Sarkomerdynamik mehrerer gesunder Myozyten gleichzeitig zu erfassen und zu messen. Moderne High-Core-Count-Prozessoren werden genutzt, um die parallele Berechnung von Änderungen der Sarkomerlänge aus dem Videostream in Echtzeit zu ermöglichen (optische Dichtedaten werden von benutzerdefinierten Regionen von Interesse [ROI] gesammelt, die über den Bildern gesunder Kardiomyozyten und parallel zur Kontraktionsachse platziert werden, Abbildung 2B). Die optischen Intensitätsdaten zeigen helle und dunkle Bänder, die den Z-Linien der Kardiomyozyten entsprechen (Abbildung 1, Abbildung 2C). Abschließend werden diese Daten dem Benutzer zu Überwachungszwecken angezeigt und zur späteren Analyse auf einer Festplatte gespeichert (Abbildung 2C).- Vermeiden Sie Bereiche der Zellen, die nicht scharf sind. Positionieren Sie die ROIs auch nicht in der Nähe des Zellrands, da die Veränderungen in der Kontraktion der Zellen während der Anwendung von Medikamenten dazu führen können, dass die ROIs nicht in der Lage sind, die Kontraktion der Zellen zu lesen.
- Wenn die Auswahl der ROIs abgeschlossen ist und die Kontraktionen die erforderlichen Standards für die Verwendung erfüllen (z. B. Sarkomerverkürzung >1%; rhythmische Kontraktion bei Anwendung einer 1 Hz-Schrittfrequenz, Abwesenheit von arrhythmischen Ereignissen), starten Sie das Experiment, um die Auswirkungen einer Verbindung zu bewerten. Das Stimulationsprotokoll und die Reihenfolge der Anwendung der Testkonzentrationen durch die Verbindung sind in Tabelle 1 dargestellt. Die Erfassungssoftware verwaltet automatisiert die Erfassung und Anzeige von Daten sowie die Markierung von Testkonzentrationen und Behandlungszeiten.
ANMERKUNG: Die Prüfkonzentrationen sind anzuwenden, wenn die Kontraktion während des gesamten Basiszeitraums des Fahrzeugs in einer stabilen Amplitude bleibt. Disqualifizieren Sie Zellen, die entweder einen Anlauf oder einen Ablauf anzeigen. Stellen Sie außerdem sicher, dass die Perfusion während des gesamten Experiments auf die verschiedenen Testkonzentrationen umgeschaltet wird.
- Schalten Sie nach Beendigung des Experiments und der Datenspeicherung auf dem Server die Perfusion und die Heizung aus, stoppen Sie die Stimulation, reinigen Sie die Mikroskopkammer mit destilliertem Wasser, entfernen Sie dann das Deckglas und trocknen Sie die Kammer gründlich ab.
HINWEIS: Reinigen Sie die Kammer gründlich, da dies entscheidend ist, um zu vermeiden, dass die nächste Gruppe von Zellen vorzeitig einer Verbindung ausgesetzt wird, wodurch alle gesammelten Daten ungültig werden. - Führen Sie als Nächstes eine neue Plattierung von Kardiomyozyten durch und führen Sie ein zusätzliches Experiment durch, um genügend Daten zu erhalten, um die Prüfung der Verbindung abzuschließen oder eine neue Verbindung zu testen.
8. Ausschalten des optischen Kontraktilitätsaufzeichnungssystems
- Wenn die tägliche Prüfung der Verbindung(en) abgeschlossen ist, schalten Sie zunächst alle Geräte aus, die nicht zur Reinigung des Systems erforderlich sind, und kopieren Sie die Daten für die Offline-Analyse.
- Als nächstes werden die 100-ml-Glasflaschen (Materialtabelle) mit den Lösungen der endgültigen Testkonzentrationen entfernt und durch Glasflaschen ersetzt, die zur Hälfte mit RBS 25-Konzentratlösung gefüllt sind (Materialtabelle). RBS-Lösung 5 Minuten lang durch die Mikroskopkammer perfundieren, dann den Perfusionsschlauch von der Kammer trennen, mit destilliertem Wasser reinigen und schließlich gründlich trocknen.
HINWEIS: Stellen Sie sicher, dass der Staubsauger gut funktioniert, um eine mögliche Überschwemmung zu vermeiden. - Als nächstes verbinden Sie den Perfusionsschlauch mit dem Drainageschlauch. Lassen Sie die RBS-Lösung mit der Software des druckgesteuerten Perfusionssystems (Materialtabelle) 10 Minuten lang laufen und stellen Sie sicher, dass der Druck und die Durchflussrate ausreichend eingestellt sind. Dann 1% DMSO für 5 Minuten und dann destilliertes Wasser für 15-20 Minuten perfundieren, um die Reinigung des Perfusionssystems abzuschließen.
- Schalten Sie das Licht des Mikroskops aus und setzen Sie die Abdeckung auf. Ziehen Sie dann die Kamerakabel aus der Box an der Seite des Mikroskops und schalten Sie den Lüfter aus. Stellen Sie sicher, dass alle gebrauchten Flaschen zur Reinigung und zum Autoklaven geschickt werden. Stellen Sie schließlich sicher, dass alle Drainageeimer zu 1/4 oder weniger gefüllt sind.
HINWEIS: Stellen Sie sicher, dass genügend lamininbeschichtete Deckgläser für die Verwendung am nächsten Tag vorhanden sind. - Kopieren Sie abschließend die Dateien im Erfassungsordner aller Experimente, die auf jedem Aufzeichnungssystem durchgeführt wurden, und fügen Sie sie für eine zusätzliche Offline-Analyse in einen sicheren Backup-Server ein. Löschen Sie als Nächstes alle Datendateien aus dem Akquisitionsordner.
9. Analyse von Kontraktilitätsdaten
- Führen Sie eine Offline-Analyse mit der Analysesoftware und einem benutzerdefinierten Makro durch, um den Durchschnitt der Daten zu bilden. Die Analysesoftware berechnet und meldet verschiedene Metriken aus den von der Erfassungssoftware erzeugten Sarkomerdynamikdaten. Eine detaillierte Liste dieser Parameter ist in Abbildung 2D dargestellt.
HINWEIS: Durch die Anwendung von Low-Level-Softwaretechniken können viele Aufzeichnungsläufe in 5 Sekunden analysiert werden. Der wichtigste Parameter zur Beurteilung arzneimittelinduzierter Veränderungen der Kontraktilität ist die Kontraktilitätsamplitude (Sarkomerverkürzung % = Änderung der Sarkomerlänge). Sie wird als Sarkomerlänge bei maximaler Kontraktions-/Ruhesarkomerlänge berechnet und über die letzten 20 Kontraktilitätstransienten für jede Testkonzentration gemittelt. - Quantifizieren Sie die Auswirkungen der Testverbindung auf die durchschnittliche Kontraktilitätsamplitude im Verhältnis zu den spezifischen Ausgangsbedingungen der Fahrzeugkontrolle jedes Kardiomyozyten.
- Die durchschnittlichen Ergebnisse werden als Mittelwert ± REM ausgedrückt und ein Diagramm erstellt, das den Konzentrationseffekt der Testverbindung auf die Kontraktilitätsamplitude darstellt. Als Nächstes wird die Konzentrations-Wirkungs-Kurve mit Hilfe der Analysesoftware (Materialtabelle) an die Hill-Gleichung angepasst, um die Werte IC50 (Konzentration, die eine 50%ige Hemmung der Kontraktilitätsamplitude erzeugt) und EC50 (Konzentration, die eine 50%ige Erhöhung der Kontraktilitätsamplitude bewirkt) abzuleiten.
- Neben der Kontraktilitätsamplitude können Sie auch andere Parameter berechnen:
- Nachkontraktion: Identifizieren Sie die Nachkontraktion als spontane sekundäre Kontraktionstransiente des Kardiomyozyten, die vor der nächsten regulären Kontraktion auftritt und eine abnormale und unsynchronisierte Kontraktion hervorruft.
- Kontraktionsfehler: Identifizieren Sie Kontraktionsversagen als die Unfähigkeit des elektrischen Stimulus, eine Kontraktion zu induzieren.
- Kurzzeitvariabilität (STV) und Alternativen: Visualisieren Sie diese beiden Parameter in Poincaré-Diagrammen der Kontraktionsamplitudenvariabilität.
- Berechnen Sie den STV (∑|CAn + 1 − CAn| (20 × √2) −1) mit den letzten 20 Transienten jeder Kontroll- und Prüflingskonzentrationsperiode. Identifizieren Sie Alternane als sich wiederholende, abwechselnd kurze und lange Kontraktilitätsamplitudentransienten.
- Um die Inzidenz von Proarrhythmien zu berechnen, normalisieren Sie die STV-Werte auf den Vehikelkontrollwert jeder Zelle, zeichnen Sie Nachkontraktion, Kontraktionsfehler, STV und Alternane auf und drücken Sie sie als Prozentsatz der Inzidenz der Zellen aus, die jedes der Signale aufweisen.
- Vervollständigen Sie die multiparametrische mechanistische Profilerstellung mit der Berechnung der Zeit Ato peak, des Zerfalls auf 30 % Relaxation (Zerfall 30), des Zerfalls auf 90 % Relaxation (Zerfall 90), der Zeit bis 90 % Relaxation (TR90) (Abbildung 2D), der Basislänge des Sarkomers, der Zeit bis 50 % des Peaks, der Peakhöhe, der Sarkomerlänge bei maximaler Kontraktilität, der maximalen Kontraktionsgeschwindigkeit und der maximalen Relaxationsgeschwindigkeit12. Drücken Sie diese Parameter wie die Kontraktilitätsamplitude relativ zur spezifischen Ausgangskontrollbedingung jedes Kardiomyozyten aus und stellen Sie sie in Konzentrations-Wirkungs-Diagrammen dar.
Ergebnisse
In diesem Protokoll wird ein Verfahren zur Messung der Kontraktilität in isolierten adulten humanen primären Kardiomyozyten von Organspendern und zur Bewertung akuter Veränderungen der Kontraktilitätsparameter, die durch eine Testverbindung induziert werden, beschrieben. Die Messung der transienten Kontraktilität erfolgt mit einem videobasierten Zellgeometriesystem, dem MyoBLAZER, das die Sarkomerdynamik misst, und die Herzerkrankung des Erwachsenen wird durch Induktion der Kontraktilität mit elektrischer Stimulation bei der physiologischen Schrittfrequenz (1 Hz) nachgebildet. Die funktionelle Lebensfähigkeit der Kardiomyozyten wird durch die Bewertung ihrer Erregungs-Kontraktions-Kopplung bestätigt (d.h. die zelluläre Verarbeitung, die die elektrische Erregung [das sarkolemale Aktionspotential] mit der Kontraktion verbindet). Es gibt keine spontanen Kontraktilitätstransienten in menschlichen Kardiomyozyten, und die Kardiomyozyten reagieren auf externe elektrische Stimulation mit Kontraktilitäts-/Relaxationszyklen (Abbildung 2C, E) sowie auf Isoproterenol, einen β-adrenergen Agonisten (Abbildung 2F,G). Isoproterenol bewirkt eine konzentrationsabhängige Erhöhung der Kontraktilität (Abbildung 2G), und seine Auswirkungen auf die Kinetik der transienten Kontraktilität können ebenfalls charakterisiert werden (Abbildung 2D)12.

Abbildung 1: Versuchsaufbau des optischen Kontraktilitätsaufzeichnungssystems. Hellfeld-Kontraktilitätsaufzeichnungen werden von adulten humanen primären Kardiomyozyten durchgeführt, wie zuvor beschrieben11,12,13,14. Der Aufbau umfasst eine (A) Temperaturkontrollbox, (B) Feldstimulator, (C,D) druckgesteuertes Perfusionssystem, (E) druckgesteuertes Computerprogramm, (F) Druck-Plus-Flaschen, (G) Erfassungssoftware, (H) Auswahl von ROIs mit Erfassungssoftware, (I) Anzeige von Kontraktilitätstransienten mit Erfassungssoftware, (J) inverses Mikroskop, (K) Mikroskopkammer und ( L) Kamera. Alle Merkmale der Ausrüstung sind in der Materialtabelle angegeben. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
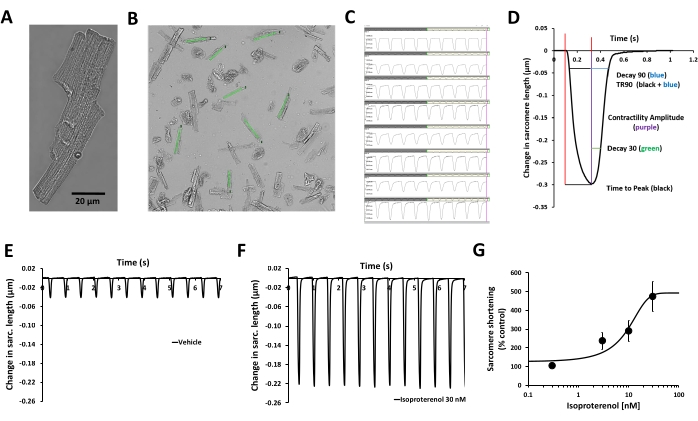
Abbildung 2: Validierung der Messung der Kontraktilität humaner Kardiomyozyten und der Wirkung der β-adrenergen Stimulation. (A) Phasenkontrastmikroskopische Aufnahme eines repräsentativen erwachsenen humanen primären Kardiomyozyten, (B) benutzerdefinierte Regionen von Interesse (ROI), die über den Bildern gesunder Kardiomyozyten und parallel zur Kontraktionsachse platziert wurden, (C) Anzeige von Kontraktilitätstransienten, die aus den gleichen ROIs in (B) mit der Erfassungssoftware, (D) Parameter, die sich auf die mit der Erfassungssoftware gemessene Transiente der Kontraktilität beziehen: Amplitude der Kontraktilität, Zeit bis zum Peak, Decay 30, Decay 90, TR90. Es können auch zusätzliche Parameter gemessen werden: Basislänge des Sarkomers, Zeit bis 50 % Peak, Peakhöhe, Sarkomerlänge bei maximaler Kontraktilität, maximale Kontraktionsgeschwindigkeit und maximale Relaxationsgeschwindigkeit. (E) Typische transiente Kontraktilität, die von einem erwachsenen humanen primärventrikulären Myozyten bei einer Schrittfrequenz von 1 Hz in Gegenwart einer Vehikelkontrolle (F) und nach Exposition bei 30 nM Isoproterenol, einem nicht-selektiven β-adrenergen Agonisten, aufgezeichnet wurden. Die in den Panels E und F gezeigten Transienten der Kontraktilität wurden von demselben Kardiomyozyten gesammelt. Isoproterenol aus menschlichen Kardiomyozyten, die mit einer Schrittfrequenz von 1 Hz durchgeführt wurden, wurde verwendet, um die Potenzinformationen zu generieren. (G) Typische kumulative Konzentrations-Wirkungs-Kurve, die durch Messung der Kontraktilität menschlicher Kardiomyozyten mit Isoproterenol (n = 8 Zellen) erzeugt wurde. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Perfusions-Sequenz | Fahrzeug-Lösung | Konzentration 1 (μM) | Konzentration 2 (μM) | Konzentration 3 (μM) | Konzentration 4 (μM) | Waschen |
| Behandlungszeit | 120 Sek. | 300 Sek. | 300 Sek. | 300 Sek. | 300 Sek. | 300 Sek. |
| Stimulations-Frequenz | 1 Hz | 1 Hz | 1 Hz | 1 Hz | 1 Hz | 1 Hz |
Tabelle 1: Stimulationsprotokoll und Anwendungssequenz der Testverbindung. Die Stabilität der Kontraktilitätstransienten wird durch kontinuierliche Aufzeichnung über 120 s in Lösung C beurteilt, wodurch die Fahrzeugsteuerung (typischerweise in 0,1 % DMSO) festgelegt wird. Anschließend wird die Prüflingskonzentration für mindestens 300 s oder bis zum Erreichen eines stationären Effekts angewendet. Es werden vier aufsteigende Prüfkörperkonzentrationen verwendet, die kumulative Konzentrations-Wirkungs-Kurven (C-E) liefern. Am Ende der kumulativen Zugaben des Prüflings kann eine Auswaschperiode von 300 s implementiert werden.
Diskussion
Dieses Manuskript enthält ein detailliertes Protokoll für das auf Kontraktilität basierende optische System für adulte humane Kardiomyozyten für eine vereinfachte Medium-Throughput-Methode, die es ermöglicht, die akute Wirksamkeit und Kardiotoxizität neuartiger Verbindungen zu testen. Dieses optische Kontraktilitätsaufzeichnungssystem ist einfach zu bedienen, ermöglicht Aufnahmen von mehreren Zellen parallel, ermöglicht die gleichzeitige Beurteilung von Zellgesundheit, Physiologie und Pharmakologie, verfügt über eine automatisierte und schnelle Datenanalyse (ein Lauf mehrerer Zellen wird in 5 s analysiert) und ermöglicht eine schnelle Datenerfassung (Konzentrations-Reaktions-Kurve alle 30 Minuten/Verbindung/Gerät). Unter Berücksichtigung dieser Eigenschaften kann das Aufzeichnungssystem nicht nur verwendet werden, um die Auswirkungen von Medikamenten auf die Kontraktilität von Kardiomyozyten zu erkennen, sondern auch, um Struktur-Wirkungs-Beziehungsdaten zur Unterstützung der Bemühungen der medizinischen Chemie in den frühen Phasen der Arzneimittelforschung bereitzustellen16. Da Dutzende Millionen von Zellen aus einem Kardiomyozyten-Isolationsprotokoll gewonnen werden können, wird derzeit die Anwendung des optischen Kontraktilitätsaufzeichnungssystems-Kardiomyozyten-Plattform untersucht, um eine erhöhte Testkapazität (unter Verwendung von gut basierten Platten) bei reduzierten Kosten zu erreichen. Darüber hinaus kann die Bewertung der Arzneimittelwirkungen auf die systolischen und Relaxationsparameter, die mit dem Aufzeichnungssystem gemessen werden, ein multiparametrisches mechanistisches Profil von inotropen Arzneimitteln liefern12. Darüber hinaus können Daten zur Kontraktilität von Kardiomyozyten verwendet werden, um neue Medikamente von der höchsten bis zur geringsten kardiotoxischen (z. B. Sicherheitsmarge) und von der geringsten bis zur wirksamsten (z. B. Potenzmarge) zu bewerten. Follow-up-Studien zur Kontraktilität von Kardiomyozyten können auch durchgeführt werden, um Entwicklungsprogramme zu unterstützen, die mit einer klinischen Abnahme der myokardialen Kontraktilität in Verbindung gebracht wurden12.
Ein weiterer wesentlicher Vorteil der Verwendung des optischen Aufzeichnungssystems für die Kontraktilität menschlicher Kardiomyozyten ist seine Ausrichtung auf das 3R-Konzept (Replacement, Reduction, and Refinement)17 , da es als alternative Methode angesehen werden kann, die die Verwendung von Tieren zur Datengenerierung in der pharmazeutischen Industrie vermeidet oder ersetzt. Dieser 3R-Nutzen kann auch auf die akademische Herzforschung ausgeweitet werden. Das gesamte derzeitige Wissen über die Physiologie und Pharmakologie von Kardiomyozyten stammt aus akademischen Forschungsstudien, die mit Zellen durchgeführt wurden, die aus Tierherzen isoliert wurden18. Somit eröffnet das optische Kontraktilitätsmodell der humanen Kardiomyozyten die Möglichkeit, kritische translationale Studien durchzuführen. Um diese Studien durchführen zu können, müssen Protokolle für die Konservierung und den Versand menschlicher adulter Kardiomyozyten entwickelt werden (die derzeit im Labor von AnaBios evaluiert werden), und das Kontraktilitätssystem muss in der Lage sein, Änderungen der Sarkomerlänge von nicht-menschlichen Kardiomyozyten aufzuzeichnen (dies ist beim optischen Kontraktilitätsaufzeichnungssystem der Fall, da Sarkomere zwischen den Arten gut konserviert sind).
Das menschliche Kardiomyozyten-Kontraktilitätssystem kann verschiedene physiologische Bedingungen nachahmen (z. B. elektromechanische Kopplung, Schrittfrequenz, die Herzfrequenz und Körpertemperatur nachahmt, die Integration aller menschlichen Herzziele) und hat einen translationalen Wert als Schlüsselkomponente in der Arzneimittelforschung nachgewiesen11,12,13,14, obwohl es die Veränderungen der mechanischen Belastung und der Scherspannung, die während des kontraktilen Herzzyklus beobachtet werden, nicht nachahmen kann. Die Struktur und Funktion von kardialen extrazellulären Matrizen ist inzwischen besser verstanden19, die Entwicklung solcher Matrizen kann möglicherweise dazu beitragen, die mechanische Belastungsbegrenzung zu überwinden, und Matrizen mit unterschiedlichen herzähnlichen Steifigkeiten werden derzeit im Labor von AnaBios untersucht. Eine weitere Einschränkung des optischen Kontraktionssystems der menschlichen Kardiomyozyten ist das Fehlen des Nervennetzes, das das Herz versorgt (z. B. sympathische und parasympathische Fasern)20. Dieser neurokardiale Kontakt kann durch die gleichzeitige Anwendung von Neurotransmittern (z. B. Isoproterenol, ein Agonist von β-Adrenozeptor-Rezeptoren; Acetylcholin, ein Agonist von M2-Muskarinrezeptoren) wiederhergestellt werden, wobei die Verbindung auf ihre potenziellen Auswirkungen auf die Kontraktilität von Kardiomyozyten untersucht wird. Darüber hinaus werden die Kontraktilitätstransienten ohne gleichzeitige Messung von Aktionspotentialen und Ca 2+ Transienten aufgezeichnet, die auch für die Bewertung von Arzneimittelwirkungen auf das Elektrokardiogramm und die Ca2+ Handhabung unerlässlich sind. Obwohl dieses Versäumnis als Einschränkung des Systems angesehen werden kann, ist es nicht allzu kritisch, da die Aufzeichnungen von Aktionspotentialsignalen (mit der Stromzangenmethode oder spannungsempfindlichen Farbstoffen) und Ca 2+ Transienten (mit Ca2+ Indikatoren/Farbstoffen) mit Zytotoxizität in Verbindung gebracht werden können. Solche zytotoxischen Wirkungen können sich auf die Bewertung neuartiger Medikamente zur Modulation der Herzkontraktilität auswirken. Im Gegenteil, die Verwendung einer nicht-invasiven optischen Methode, die die Gesundheit, Physiologie und Pharmakologie der Kardiomyozyten bewahrt, wie das in diesem Protokoll beschriebene Aufzeichnungssystem, würde nicht nur sicherstellen, dass die höchste Qualität der Kontraktilitätsdaten erhalten wird, sondern auch Daten liefern, die die kontraktilen Wirkungen neuartiger Medikamente beim Menschen gut vorhersagen können.
Offenlegungen
Alle Autoren sind Mitarbeiter der AnaBios Corporation und erklären keine konkurrierenden Interessen.
Danksagungen
Diese Arbeit wurde von der AnaBios Corporation und einem NIH Small Business Innovation Research (SBIR) Grant (1R44TR003162-01) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 100–1000 µL Filtered, Wide Orifice, Sterile tips | Pipette | UF-1000W | |
| 100 mL, Duran pressure plus bottles | DWK Life Sciences | 218102406 | |
| 1 L, 0.22 µm Vacuum Filter system | VWR | 567-0020 | |
| 290 mmol/kg Osmolarity Standard | Wescor | OA-029 | |
| Benchtop pH Meter | Mettler Toledo | https://www.mt.com/us/en/home/products/Laboratory_Analytics_Browse/pH-meter/pH-meters.html | |
| Calcium Chloride dihydrate (CaCl2) | Sigma-Aldrich | C3881 | |
| Camera | Optronis GmbH | Cyclone-25-150-M | https://optronis.com/en/products/cyclone-25-150/ |
| Corning 25 mm x25 mm Square #1 Cover Glass | Corning | 2845-25 | |
| Cyclone-25-150 | Optronis | https://optronis.com/en/products/cyclone-25-150/ | |
| D-(+)-Glucose | Sigma-Aldrich | G8270 | |
| Digital Timer/Stopwatch | Fisher Scientific | 14-649-17 | |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | D8418 | |
| Eight-well rectangular polystyrene sterile culture plate | Thermo Fisher Scientific | 73521-426 | https://us.vwr.com/store/product/4679368/nunclontm-delta-rectangular-dishes-polystyrene-sterile-thermo-scientific |
| FHD Microscope Chamber System | IonOptix | ||
| Flow EZ, Modular pressure-based flow controller with a computer driven program version 1.1.0.0. | Fluigent OxyGEN | ||
| Heavy Duty Vacuum Bottles | VWR | 16211-080 | |
| HEPES | Sigma-Aldrich | H3375 | |
| Human Recombinant Laminin 521 | BioLamina | LM521-05 | |
| Idex Chromatography Tubing, Natural FEP, 1/16" OD x 0.030" ID | Cole-Palmer | 1520L | |
| Kimberly-Clark Professional Kimtech Science Kimwipes | Fisher Scientific | 06-666 | |
| L-(-)-Malic acid | Sigma-Aldrich | 112577 | |
| Lactobionic acid | Sigma-Aldrich | 153516 | |
| L-Glutamic acid | Sigma-Aldrich | 49449 | |
| L-Histidine | Sigma-Aldrich | H8000 | |
| Magnesium Chloride hexahydrate (MgCl2) | Sigma-Aldrich | M9272 | |
| Microscope Temperature Control Stage Warmer | AmScope | TCS-100 | |
| MyoPacer Field Stimulator | IonOptix | ||
| Nunc Rectangular Dishes | Thermo Scientific | 267062 | |
| Olympus IX83P1ZF Ixplore Standard microscope | Olympus | https://www.olympus-lifescience.com/en/microscopes/inverted/ixplore-standard/?campaignid=657680540&adgroupid =116963199831&keyword=ix73%20 microscope&gclid=EAIaIQobChMIl qjyiMWP-AIVVx-tBh2JoQ85EAA YASAAEgLp3fD_BwE | |
| pH 4.01, 7.00, and 10.01 Standards | Oakton | WD-05942-10 | |
| Potassium Chloride (KCl) | Sigma-Aldrich | 746436 | |
| Potassium Hydroxide (KOH) | Sigma-Aldrich | P4494 | |
| Potassium phosphate monobasic (KH2PO4) | Sigma-Aldrich | 795488 | |
| Prism Software | GraphPad Software - Dotmatics | https://www.graphpad.com/ | |
| RBS 25 Liquid Detergent | Sigma-Aldrich | 83460 | |
| Sharps Container | Uline | S-15307 | |
| SigmaPlot analysis software | Systat Software Inc. | https://systatsoftware.com/ | |
| Sodium Chloride (NaCl) | Sigma-Aldrich | S3014 | |
| Sodium Hydroxide (NaOH) | Sigma-Aldrich | 221465 | |
| Student Dumont #5 Forceps | Fine Science Tools | 91150-20 | |
| Sucrose | Sigma-Aldrich | S7903 | |
| Taurine | Sigma-Aldrich | T0625 | |
| Temperature Control Box | Warner Insturments | TC-324C | |
| Vapor Pressure Osmometer | ELITechGroup | Model 5600 | |
| Wheaton 20 mL Vials | DWK Life Sciences | 225288 |
Referenzen
- Abi-Gerges, N., Miller, P. E., Ghetti, A. Human heart cardiomyocytes in drug discovery and research: new opportunities in translational sciences. Current Pharmaceutical Biotechnology. 21 (9), 787806(2020).
- Cook, D., et al. Lessons learned from the fate of AstraZeneca's drug pipeline: A five dimensional framework. Nature Reviews Drug Discovery. 13 (6), 419-431 (2014).
- Van Meer, B. J., Tertoolen, L. G. J., Mummery, C. L. Measuring physiological responses of human pluripotent stem cell derived cardiomyocytes to drugs and disease. Stem Cell. 34 (8), 2008-2015 (2016).
- Piccini, J. P., et al. Current challenges in the evaluation of cardiac safety during drug development: translational medicine meets the critical path initiative. American Heart Journal. 158 (3), 317-326 (2009).
- Pang, L., et al. Workshop report: FDA workshop on improving cardiotoxicity assessment with human-relevant platforms. Circulation Research. 125 (9), 855-867 (2019).
- Page, G., et al. Human ex-vivo action potential model for pro-arrhythmia risk assessment. Journal of Pharmacological and Toxicological Methods. 81, 183-195 (2016).
- Britton, O. J., et al. Quantitative comparison of effects of dofetilide, sotalol, quinidine, and verapamil between human ex vivo trabeculae and in silico ventricular models incorporating inter-individual action potential variability. Frontiers in Physiology. 8, 597(2017).
- Qu, Y., et al. Action potential recording and pro-arrhythmia risk analysis in human ventricular trabeculae. Frontiers in Physiology. 8, 1109(2017).
- Trovato, C., et al. Human Purkinje in silico model enables mechanistic investigations into automaticity and pro-arrhythmic abnormalities. Journal of Molecular and Cellular Cardiology. 142, 24-38 (2020).
- Otsomaa, L., et al. Discovery and characterization of ORM-11372, a novel inhibitor of the sodium-calcium exchanger with positive inotropic activity. British Journal of Pharmacology. 177 (24), 5534-5554 (2020).
- Nguyen, N., et al. Adult human primary cardiomyocyte-based model for the simultaneous prediction of drug-induced inotropic and pro-arrhythmia risk. Frontiers in Physiology. 8, 1073(2017).
- Abi-Gerges, N., et al. Multiparametric mechanistic profiling of inotropic drugs in adult human primary cardiomyocytes. Scientific Reports. 10, 7692(2020).
- Jordaan, P., et al. Cardiotoxic potential of hydroxychloroquine, chloroquine and azithromycin in adult human primary cardiomyocytes. Toxicological Sciences. 180 (2), 356-368 (2021).
- Ton, A. T., et al. Arrhythmogenic and antiarrhythmic actions of late sustained sodium current in the adult human heart. Scientific Reports. 11, 12014(2021).
- Schmid, C., Abi-Gerges, N., Leither, M. G., Zellner, D., Rast, G. Ion channel expression and electrophysiology of singular human (primary and induced pluripotent stem cell-derived) cardiomyocytes. Cells. 10 (12), 3370(2021).
- Guha, R. On exploring structure activity relationships. Methods in Molecular Biology. 993, 81-94 (2013).
- Tannenbaum, J., Bennett, B. T. Russell and Burch's 3Ra then and now: The need for clarity in definition and purpose. Journal of the American Association for Laboratory Animal Science. 54 (2), 120-132 (2015).
- Ruiz-Meana, M., Martinson, E. A., Garcia-Dorado, D., Piper, H. M. Animal ethics in cardiovascular research. Cardiovascular Research. 93 (1), 1-3 (2012).
- Rienks, M., Papageorgiou, A. P., Frangogiannis, N. G., Heymans, S. Myocardial extracellular matrix. Circulation Research. 114 (5), 872-888 (2014).
- Zaglia, T., Mongillo, M. Cardiac sympathetic innervation, from a different point of (re)view. Journal of Physiology. 595 (12), 3919-3930 (2017).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten