Method Article
Evaluación in vitro e in vivo de compuestos biológicamente activos fotocontrolados: posibles candidatos a fármacos para la fotofarmacología del cáncer
* Estos autores han contribuido por igual
En este artículo
Resumen
Este protocolo presenta un conjunto de experimentos adoptados para la evaluación de péptidos anticancerígenos fotoconmutables, que pueden ser utilizados en el cribado preclínico de dichos compuestos. Esto incluye la evaluación de citotoxicidad en cultivos celulares 2D y 3D, la evaluación de la eficiencia de fotoisomerización ex vivo (tejido modelo) y la eficacia in vivo .
Resumen
Los compuestos fotocontrolados y biológicamente activos son una clase emergente de candidatos a fármacos "inteligentes". Proporcionan seguridad adicional en la quimioterapia sistémica debido a su activación espaciotemporal precisa al dirigir una luz benigna no ionizable a una ubicación específica dentro del cuerpo del paciente. Este artículo presenta un conjunto de métodos para evaluar la potencia in vitro y la eficiencia ex vivo de la fotoactivación de compuestos fotocontrolados biológicamente activos, así como la eficacia in vivo en las primeras etapas del desarrollo de fármacos. La metodología se aplica a péptidos citotóxicos anticancerosos, a saber, los análogos que contienen diarileteno de un antibiótico conocido, la gramicidina S. Los experimentos se realizan utilizando cultivos celulares 2D (células adherentes) y 3D (esferoides) de una línea celular de cáncer (carcinoma de pulmón de Lewis, LLC), sustitutos de tejido vivo (carne picada de cerdo) y un modelo de cáncer de aloinjerto (LLC subcutánea) en ratones inmunocompetentes. La selección de los compuestos más efectivos y la estimación de ventanas fototerapéuticas realistas se realizan mediante microscopía de fluorescencia automatizada. La eficiencia de fotoactivación en diferentes regímenes de iluminación se determina a diferentes profundidades en un tejido modelo, y la dosis óptima de luz se aplica en el experimento terapéutico final in vivo .
Introducción
Los compuestos biológicamente activos fotocontrolados han surgido en las últimas décadas como un componente prometedor de quimioterapias seguras para enfermedades humanas y para erradicar específicamente tumores sólidos malignos1. Estos compuestos contienen fragmentos reversiblemente fotoisorizables (fotointerruptores moleculares) y pueden alternar entre fotoisómeros inactivos y activos tras la irradiación con luz de diferentes longitudes de onda.
En comparación con sus análogos no fotocontrolables, los medicamentos fotocontrolados pueden ser más seguros porque pueden introducirse sistémicamente en el cuerpo del paciente en formas menos activas y esencialmente no tóxicas, y luego se activan con luz solo cuando es necesario, como en tumores, úlceras y heridas. Aunque se pueden encontrar múltiples demostraciones emocionantes de tales prototipos de fármacos moleculares en documentos académicos recientes 2,3,4,5,6,7, el campo de la fotofarmacología clínica, una aplicación de combinaciones aprobadas de medicamentos / dispositivos médicos / enfermedades, no existe. La fotofarmacología aún se encuentra en la etapa de descubrimiento de fármacos, y se desconocen los estudios preclínicos sistemáticos.
Recientemente demostramos la ventaja de seguridad in vivo para algunos péptidos anticancerígenos fotocontrolados, a saber, los análogos del antibiótico peptídico gramicidina S8. Estos derivados fotocontrolados contienen un fotointerruptor de diarileteno (DAE), que sufre transformaciones fotoinducidas reversibles entre las llamadas fotoformas "anillo abierto" generadas por luz roja y "anillo cerrado" generadas por UV (ilustrado en la Figura 1 para uno de los derivados, el compuesto LMB002).
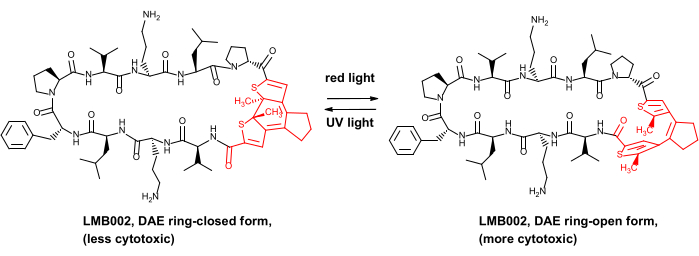
Figura 1: Péptido citotóxico fotocontrolado LMB002 y su fotoisomerización. El fragmento de diarileteno se muestra en rojo. Abreviatura: DAE = diarylethene. Haga clic aquí para ver una versión más grande de esta figura.
La búsqueda de aciertos y la realización de la optimización de hit-to-lead a menudo requieren un cribado in vitro e in vivo de bibliotecas de compuestos apropiadas 9,10. Aquí, demostramos una metodología adecuada para el cribado sistemático de alto rendimiento de la citotoxicidad de compuestos fotocontrolados. También determinamos la eficiencia de fotoisomerización, estimamos la dosis de luz en tejidos modelo y evaluamos la eficacia in vivo de los candidatos de mejor rendimiento. El enfoque cumple con las consideraciones de bioética y cuidado de los animales.
En este trabajo, los métodos preclínicos tradicionales se modifican para evitar la fotoisomerización no controlada de los compuestos probados. El objetivo general de aplicar estos métodos modificados en este documento es desarrollar una estrategia general que sea directa y rápida y que produzca datos estadísticamente significativos para comparar de manera confiable las actividades in vitro y racionalizar las pruebas de eficacia in vivo de compuestos fotoconmutables para la identificación y el desarrollo posterior.
La estrategia consta de tres pasos consecutivos. El primer paso implica la determinación de IC 50 (viabilidad celular aparente del50 %) en diluciones seriadas para las fotoformas activas e inactivas de compuestos biológicamente activos fotocontrolados seleccionados utilizando cultivos celulares bidimensionales (2D, monocapa) y tridimensionales (3D, esferoides) y microscopía de fluorescencia automatizada confocal de alto rendimiento. Las ventanas fototerapéuticas se comparan con respecto a la diferencia IC50 entre las dos fotoformas, y se seleccionan los candidatos con mejor rendimiento. No existe ninguna ventaja específica en la evaluación de la toxicidad por microscopía automatizada y otras plataformas de cribado de citotoxicidad (ensayos)11; Los modelos tumorales basados en células más complejos12 podrían implementarse fácilmente en esta etapa.
Para los compuestos seleccionados en el paso 1, el segundo paso es estimar de manera realista su eficiencia de fotoconmutación dentro de los tejidos en función de la profundidad de la superficie del tejido irradiado cuantificando la eficiencia de fotoconmutación de las fotoformas menos activas en un sustituto tisular utilizando cromatografía líquida de alta resolución (HPLC) detectada por UV de extractos de muestras irradiadas. In vivo , se podría estudiar la eficiencia del fotocambio, pero proponemos utilizar un sustituto de tejido simple: carne de cerdo picada. Hemos probado la validez de este enfoque. Medimos la conversión de nuestros compuestos fotoconmutables in vivo en un modelo de cáncer de ratones y observamos aproximadamente la misma fotoconversión a una profundidad medida en experimentos previos con ratones8. Se podría utilizar cualquier tejido artificial alternativo adecuado13, tejido/órgano bioimpreso en 3D14, materiales de biopsia u otro material animal exento. Sin embargo, esta configuración es un buen compromiso, ya que es económica, rápida y ética.
El tercer paso es la determinación de la eficacia anticancerígena in vivo en un modelo de cáncer murino. Para este experimento se seleccionan los compuestos que demuestran características superiores en los experimentos in vitro y fotoconmutación eficiente a una profundidad de al menos 1-1.5 cm en los tejidos modelo.
Este protocolo se puede aplicar a compuestos que poseen diferentes tipos de fotointerruptores, siempre que sus fotoformas (o sus estados fotoestacionarios, PSS) sean estables durante un tiempo razonable (unos pocos días o más). A modo de ilustración, se utiliza un LMB002 derivado de DAE descrito anteriormente15. Las fotoformas LMB002 son térmicamente estables y pueden almacenarse a -20 °C durante al menos un año sin una degradación sustancial. Las células de carcinoma de pulmón de Lewis (LLC) se eligen para esta demostración in vitro e in vivo, pero no se imponen restricciones en el tipo de célula. Las células LLC son adherentes, fácilmente cultivables en 3D y utilizadas para generar tumoroides (como se describe en la referencia16). In vivo Las células LLC se utilizan para modelar procesos metastásicos y pueden generar fácilmente tumores sólidos en ratones inmunocompetentes después de la inyección subcutánea. Esta metodología in vivo puede ser aplicada universalmente a otros modelos de cáncer17,18. A continuación se describe la aplicación detallada de esta estrategia.
Protocolo
El cuidado de los animales y los procedimientos experimentales se realizaron siguiendo las regulaciones locales e internacionales para la realización de proyectos de investigación con animales de laboratorio (Ley de Ucrania "Sobre la protección de los animales contra la crueldad", Convenio europeo para la protección de los animales vertebrados utilizados para experimentación y otros fines científicos (Convenio europeo, Estrasburgo, 1986), Directiva 2010/63 / UE sobre la protección de los animales utilizados para fines científicos). Este estudio está aprobado por la Comisión de Bioética de la empresa Bienta. En estos experimentos se utilizaron ratones C57BL / 6NCrl (hembras adultas que pesan aproximadamente 20 g cada una). Los materiales, reactivos y equipos específicos se enumeran en la Tabla de materiales.
1. Evaluación IC50 para LMB002 (formas "anillo cerrado" y "anillo abierto") utilizando cultivos celulares LLC 2D y 3D
- Preparación de tampones y soluciones madre de los compuestos
NOTA: Prepare búferes utilizando procedimientos estándar. Alternativamente, utilice soluciones disponibles comercialmente.- Prepare 10x solución salina tamponada con fosfato (PBS) agregando 14.2 g de Na 2 HPO 4, 2.4 g de KH 2 PO4, 80 g de NaCl y2g de KCl a 1 L de agua destilada. Autoclave preparado 10x PBS y diluirlo a 1x solución agregando 100 mL de solución 10x a 900 mL de agua destilada. A continuación, conservar la solución a 4 °C.
- Prepare el PBS de Dulbecco (DPBS) agregando 4,78 g de polvo de DPBS a 1 L de agua destilada. Revuelva la solución hasta que todo el sólido se disuelva, verifique el pH con un medidor de pH y ajústelo agregando 1 M NaOH o 1 M HCl (pH 7.3-7.4). Después de alcanzar el nivel de pH deseado, filtrar el medio a través de un filtro de vacío de 0,22 μm en un gabinete estéril. Conservar a 4 °C.
- Preparar 1 M de solución tampón de ácido 4-(2-hidroxietil)-1-piperazinaetanosulfónico (HEPES) añadiendo 238,3 g de HEPES a 1 L de agua destilada. Ajustar el pH de la solución con NaOH 1 M hasta pH 7,5. Filtrar a través de un filtro de vacío de 0,22 μm en un armario estéril. Conservar a 4 °C.
- Prepare 1x solución de tripsina-EDTA (EDTA = ácido etilendiaminotetraacético) diluyendo 10x solución. Para hacerlo, agregue 5 ml de 10x tripsina-EDTA a 45 ml 1x solución de PBS en un tubo estéril de 50 ml. Conservar a 4 °C.
- Prepare el Modified Eagle Medium (DMEM) básico de Dulbecco agregando 13.4 g de polvo de glucosa alta en DMEM y 3.7 g de Na2CO3 a 1 L de agua destilada en un cilindro de medición con una varilla de agitación magnética colocada en una placa de agitación. Revuelva la solución hasta que todo el sólido se disuelva, verifique el pH con un medidor de pH y ajústelo agregando 1 M NaOH o 1 M HCl (pH 7.3-7.4). Después de alcanzar el pH deseado, filtrar el medio a través de un filtro de vacío de 0,22 μm en un armario estéril y almacenar a 4 °C.
- Prepare el medio completo DMEM agregando 100 ml de suero bovino fetal (FBS), 10 ml de solución de penicilina-estreptomicina, 10 ml de solución de L-glutamina y 10 ml de tampón HEPES 1 M a 900 ml de DMEM básico. Conservar a 4 °C.
- Preparar soluciones madre para los compuestos de prueba.
- Para cada compuesto, pesar dos lotes de 5,12 mg (por ejemplo, LMB002) en la fotoforma cerrada con anillo en dos tubos de microcentrífuga de 1,5 ml (uno con paredes transparentes y otro negro no transparente). Pesar 2,28 mg de control positivo (por ejemplo, gramicidina S) en un tubo de pared extra transparente. Añadir 100 μL de DMSO puro a cada muestra y vórtice durante 30 s.
- Fotoisomerizar la solución madre (LMB002) en el tubo de pared transparente desde la forma "anillo cerrado" hasta la forma "anillo abierto" irradiando la solución con láser de 660 nm (densidad de potencia lumínica 0,6 W/cm2) con vórtice para garantizar una mezcla completa. Continúe hasta que el color cambie visiblemente de púrpura oscuro a marrón claro. Proteger de la luz usando papel de aluminio.
- Experimento de cultivo celular 2D: siembra de las células (día 1)
- Transfiera 10 ml del medio completo DMEM del matraz T-75 con un cultivo celular LLC a un tubo estéril de 15 ml. Aspire el medio sobrante con una bomba de vacío.
- Lave el cultivo celular con 5 ml de 1x DPBS y aspire la solución con una bomba de vacío.
- Cubrir las células con 3 ml de solución 1x tripsina-EDTA e incubar el matraz durante 2-3 min a 37 °C en una atmósfera deCO2 al 5%.
- Detener la acción de la tripsina añadiendo 6 ml del medio DMEM (previamente transferido a un tubo estéril) al matraz de cultivo celular que contiene 1x solución de tripsina-EDTA y pipeteando la suspensión varias veces para lavar las células de las paredes del matraz de cultivo celular.
- Transfiera la suspensión a un tubo de 15 ml y centrifugar a 200 × g durante 4 min. Después de la centrifugación, aspire el sobrenadante con una bomba de vacío. Evite tocar el pellet de la celda en el fondo del tubo.
- Resuspender las células añadiendo 2 ml de medio completo DMEM fresco y pipeteando varias veces.
- Contar las células muestreando aproximadamente 15 μL de la suspensión en un tubo de 0,5 ml, añadiendo 15 μL de azul de tripano al 0,4% y transfiriendo la mezcla obtenida a una cámara de conteo celular.
- Después de contar, prepare 25 ml de la suspensión celular por punto de tiempo. Semilla de 5,000-10,000 (8,000 en promedio) células LLC / pocillo en 200 μL de DMEM en los 60 pocillos centrales de una placa de 96 pocillos con fondo transparente y paredes negras no transparentes. Llene los 36 pozos restantes con DMEM puro.
- Coloque las placas en una incubadora de cultivo celular durante la noche a 37 °C y 5% de CO2. Use tapas de plástico debajo para evitar el calentamiento desigual de la placa inferior.
- Experimento de cultivo celular 2D - adición de los compuestos (día 2)
- Monitoree las células mediante microscopía óptica en las placas hasta que las células hayan alcanzado una confluencia del 70% al 80%.
- Aspire el medio de los pozos con una bomba de vacío en un gabinete estéril. Añadir 100 μL del medio DMEM precalentado fresco y colocar las placas en una incubadora de cultivo celular.
- Preparar diluciones seriadas de los compuestos de ensayo y control positivo en placas transparentes en autoclave de polipropileno. Realice las siguientes soluciones para mediciones de puntos de tiempo individuales:
NOTA: Comience con las existencias en DMSO y diluya con DMEM, pero no exceda el 1% v / v de DMSO en la concentración final más alta.- Para obtener una solución de 128 μM de gramicidina S, añadir 1,3 μL de solución madre de 20 mM a 198,7 μL de DMEM.
- Para obtener una solución de 256 μM de LMB002, en forma de "anillo abierto", agregue 1,3 μL de solución de 40 mM a 198,7 μL de DMEM.
- Para obtener una solución de 512 μM de LMB002, en forma de "anillo cerrado", añadir 2,6 μL de solución madre de 40 mM a 197,4 μL de DMEM.
- Realice tres repeticiones adicionales para obtener cuatro series de cada punto de concentración. Preparar una serie de dilución doble aspirando 100 μL de cada pocillo de partida, transfiriendo a un pocillo con 100 μL de DMEM y mezclando bien.
NOTA: Trabajar con compuestos fotoconmutables requiere un ajuste de iluminación para evitar la fotoisomerización posterior. Se recomienda apagar la luz en armarios estériles. - Obtener las concentraciones finales de los compuestos en pozos (5-150 μM) transfiriendo 100 μL de las soluciones preparadas cada vez en 56 pocillos con 100 μL de DMEM previamente añadido. Agregue 100 μL de DMEM cada vez en cuatro pocillos para que sirva como control negativo.
- Cubra las placas con papel de aluminio o cubierta protectora no transparente de plástico para evitar el fotocambio incontrolado. Colocar las placas en una incubadora de cultivo celular a 37 °C (utilizando debajo tapas de placas de plástico adicionales) durante el tiempo de incubación elegido (10 min, 60 min, 24 h o 72 h).
- Experimento de cultivo celular 2D - tinción e imágenes (días 2-5)
- Después de la incubación con compuestos durante diferentes períodos, agregue 50 μL de la solución de tinción por pocillo a las placas que se incubaron con compuestos durante 10 y 60 min. Incubar las placas a 37 °C durante 20 min.
NOTA: Prepare soluciones de tinción madre por punto de tiempo agregando 8 μL de solución Hoechst 33342 de 20 mM (la concentración final es de 5 μM), 32.5 μL de solución de yoduro de propidio (PI) de 1 mM (la concentración final es de 1 μM) y 650 μL de FBS no estéril a 5,810 μL de PBS no estéril. Precaliente FBS y PBS en un baño de agua a 37 ° C para evitar que las células experimenten un choque de temperatura. - Realice imágenes de fluorescencia automatizadas utilizando una lente de objetivo 20x.
- Repita el mismo procedimiento de tinción e imagen (pasos 1.4.1 -1.4.2) para las placas que se incubaron con compuestos durante 24 (día 3) y 72 (día 5) h.
NOTA: Los mapas de placas 2D típicos se muestran en la Figura 2.
- Después de la incubación con compuestos durante diferentes períodos, agregue 50 μL de la solución de tinción por pocillo a las placas que se incubaron con compuestos durante 10 y 60 min. Incubar las placas a 37 °C durante 20 min.
- Experimento de cultivo celular 3D - sembrando las células (día 1)
NOTA: Los pasos para esta sección son idénticos a los descritos para el experimento 2D de preparación del cultivo celular, incubación con los compuestos probados e imágenes (pasos 1.1-1.4). Sin embargo, en este caso, las células se preparan como esferoides maduros compactos en una placa de fondo en U de adhesión ultra baja de 384 pocillos con paredes negras no transparentes. El uso de una placa de este tamaño permite comparar dos compuestos en un experimento.- Repita los pasos 1.2.1-1.2.9 del protocolo de experimento 2D con un cultivo celular LLC.
- Después de contar las células, prepare 25 ml de la suspensión celular. Sembrar 1.000 células por pocillo en todos los pocillos en 50 μL de DMEM en una placa de fondo en U de 384 pocillos de baja unión.
- Centrifugar a 40 × g durante 30 s y agitar con un agitador de placas a 250 rpm durante 1 min para sacudir las células de las paredes de los pocillos hasta el fondo.
- Coloque las placas en una incubadora a 37 °C y 5% deCO2 encima de las tapas de las placas de plástico adicionales para evitar el calentamiento desigual del fondo de la placa durante 48 h.
- Experimento de cultivo celular 3D - adición de los compuestos (día 3)
- Controle las células en las placas mediante microscopía para asegurarse de que se hayan formado esferoides maduros compactos.
- Preparar una dilución en serie de compuestos estudiados en placas transparentes de polipropileno esterilizado en autoclave. En este caso, incluya un compuesto adicional. Realice las siguientes soluciones para mediciones de puntos de tiempo individuales:
- Para obtener soluciones de gramicidina S de 175 μM y 350 μM, añadir 1,8 μL de solución madre de 20 mM a 198,2 μL de DMEM y añadir 3,6 μL de cepa a 196,4 μL de DMEM correspondientemente.
- Para obtener soluciones de 175 μM y 350 μM de LMB002, en forma de anillo abierto, agregue 1 μL de solución madre de 40 mM a 199 μL de DMEM y agregue 1.8 μL de stock a 198.2 μL de DMEM correspondientemente.
- Para obtener soluciones de 350 μΜ y 1.750 μM de LMB002, en forma de "anillo cerrado", añadir 1,8 μL de solución madre de 40 mM a 198,2 μL de DMEM y añadir 8,8 μL de material a 191,2 μL de DMEM correspondientemente.
- Realice tres réplicas adicionales para obtener cuatro conjuntos de cada punto de concentración. Adquiera diluciones seriadas retirando 20 μL de cada pocillo de arranque, transfiriéndolo al pozo, con 180 μL de DMEM, y mezclando bien.
NOTA: Trabajar con compuestos fotoconmutables requiere un ajuste de iluminación para evitar la fotoisomerización posterior. Se recomienda apagar las luces en gabinetes estériles. - Obtener las concentraciones finales de compuestos en pozos transfiriendo 20 μL de las soluciones preparadas cada vez en 128 pocillos que contienen 50 μL de DMEM. Agregue 20 μL de DMEM cada vez en tres pocillos para que sirvan como control. Cubra las placas con papel de aluminio o cubierta protectora de plástico para evitar el fotocambio o la evaporación.
- Coloque las placas en una incubadora de cultivo celular en tapas de placas de plástico durante el tiempo de incubación elegido.
- Experimento de cultivo celular 3D - tinción e imágenes (días 3-6)
- Preparar la solución de tinción por punto de tiempo añadiendo 13 μL de solución AM de calceína 1 mM (la concentración final es de 1 μM), 22 μL de solución Hoechst 33342 de 20 mM (la concentración final es de 33 μM), 40 μL de solución PI de 1 mM (la concentración final es de 3 μM), 300 μL de FBS no estéril a 2.625 μL de 1x PBS no estéril. Precaliente FBS y PBS en un baño de agua a 37 ° C para evitar que las células experimenten un choque de temperatura.
- Después de la incubación durante diferentes períodos con los compuestos, agregue 20 μL de la solución de tinción por pocillo a los pocillos que se incubaron con compuestos durante 10 min. Incubar a 37 °C durante 2 h.
- Realice imágenes confocales de fluorescencia utilizando una lente de objetivo 20x.
- Repita el mismo procedimiento de tinción e imagen para pozos que se incubaron con compuestos durante 24 (día 4) y 72 (día 6) h.
NOTA: En este experimento, la calceína AM se utiliza como un tercer componente de la solución de tinción multicolor. Las imágenes obtenidas de experimentos 2D y 3D se analizan utilizando el software automatizado de análisis de imágenes del instrumento. Las células teñidas conjuntamente con colorantes de yoduro de Hoechst y propidio se consideran necróticamente muertas, y su fracción en función de la concentración se utiliza para calcular el valor de IC50 .
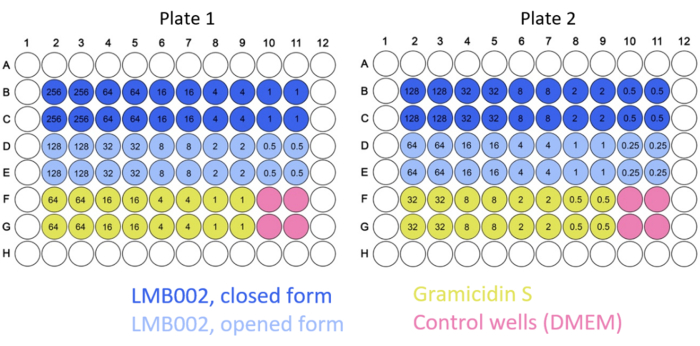
Figura 2: Ejemplo de mapas de placas típicos para los experimentos de cultivo 2D. Se indican los códigos de color para los compuestos y el control. Las concentraciones de los compuestos probados (números dentro de los pocillos) se dan en μM. Haga clic aquí para ver una versión más grande de esta figura.
2. Determinación de la eficiencia de fotoconmutación en un sustituto tisular
- Ensamble el tren óptico para la irradiación de la muestra como se muestra en la Figura 3 (que consiste en un cable óptico de la fuente de luz láser, una lente con distancia focal variable, una jeringa con una cubierta no transparente y un extremo cortado plano).
- Al cambiar la distancia focal y la apertura de la lente, obtenga un haz de luz plano con un diámetro que es 1-1.5 mm más grande que el diámetro interior de la jeringa usada, pero aún así, en la medida de lo posible, dentro de la apertura.
- Use una jeringa de 5 ml con un extremo cortado y un diámetro interior de 12,4 mm y esté cubierta con una cubierta de plástico no transparente. A una potencia de salida láser de 200 mW, ajuste la densidad de potencia a la salida del sistema óptico en ~103 mW/cm2 medida con un fotómetro.
NOTA: Todas las operaciones posteriores deben realizarse en una habitación oscura con la iluminación mínima posible en el lugar de trabajo. - Preparar 3 ml de LMB002 (forma "anillo cerrado") solución madre en PBS con una concentración de 1 mg/ml.
- Preparar una muestra de tejido modelo cargada con la fotoforma inactiva de LMB002 en un recipiente de plástico. En una carrera típica, 5 g de carne de cerdo fresca picada se mezclan mecánicamente con 277 μL de solución madre LMB002 y 260 μL de PBS para alcanzar la concentración final de 50 mg / kg en la muestra, y la relación tejido / PBS de ~ 9/1 (v / v).
- Llene la jeringa con la muestra preparada, asegurándose de que no haya burbujas de aire en el interior, y forme una superficie plana en el extremo de exposición (corte).
NOTA: El cilindro de la muestra en la jeringa debe ocupar ~40 mm a lo largo del eje. - Irradiar la muestra en el tren óptico como se muestra en la Figura 3 durante 9 min 44 s, correspondiente a ~60 J/cm2 de exposición.
- Prepare rodajas de 4 mm de espesor de la muestra después de la exposición empujándola fuera de la jeringa con el pistón y cortándola con un bisturí. Pesar y colocar las rodajas en tubos de ensayo separados y márquelas por la distancia media (mm) de la superficie irradiada.
- Preparar dos muestras de control (cantidad óptima, 0,5-0,7 g) en tubos de ensayo: en uno, carne picada mezclada con 10% (volumen) de PBS (54 μL), y en el otro, la muestra de tejido modelo obtenida en el paso 2.4 irradiada por luz láser de 500 mW durante 10 min para garantizar que todas las moléculas LMB002 "cerradas con anillo" se conviertan a la forma "anillo-abierto".
- Añadir la mezcla de acetonitrilo-agua (70%/30% v/v, suplementada con ácido trifluoroacético (TFA) al 0,01%, 1,4 mL/g) a cada rodaja y a las muestras de control. Mezcle bien el contenido con una varilla de vidrio.
- Incubar a temperatura ambiente durante al menos 10 min y centrifugar las mezclas a 5220 x g durante 20 min o centrifugar a 20 x g durante 30 min dos veces para eliminar el material insoluble y recoger el sobrenadante.
- Recoja cuidadosamente los sobrenadantes (~0.7 ml) y centrifuércelos nuevamente a 16,000 x g durante 30 min.
- Recoja los sobrenadantes (~0,5 ml cada uno) y analícelos mediante cromatografía líquida de alta resolución en fase inversa (RP HPLC) con una columna analítica C18, gradiente lineal A:B de 3,46% B/min, caudal de 2,0 ml/min y 100 μL de volumen inyectado. Registre los cromatogramas detectados UV a 570 nm (detección de la forma "anillo cerrado") y 270 nm (detección de la forma "anillo abierto"). Utilice las muestras no irradiadas (paso 2.4) y de control irradiadas (paso 2.8) para determinar los tiempos de retención específicos de ambas fotoformas (eluyente A: acuoso 0,1% TFA; eluyente B: 90% acetonitrilo-agua, 0,1% TFA) y calibrar el método.
- Determinar las cantidades reales de fotoformas LMB002 en las muestras analizadas utilizando las curvas de calibración obtenidas tomando y analizando los cromatogramas de soluciones LMB002 de concentraciones conocidas. Para la calibración, preparar las soluciones LMB002 "cerradas con anillo" diluyendo la solución madre (paso 2.3) con una mezcla de acetonitrilo-agua (70%/30% v/v suplementada con 0,01% de TFA) para obtener 0,36, 0,9 y 3,6 μg por 100 μL (el volumen inyectado); El gradiente de eluyente y el caudal son los mismos que en el paso 2.12.
- Repita el experimento (pasos 2.4-2.12) tres veces y trace el porcentaje normalizado de cada fotoforma en la gráfica (porcentaje) frente a la distancia (desde la superficie del tejido irradiado). Calcule las estadísticas (es decir, la desviación estándar en cada punto de concentración).
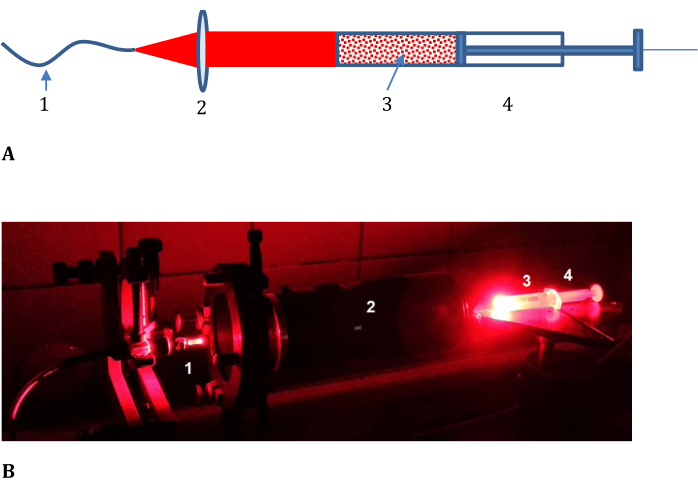
Figura 3: Configuración experimental para determinar la eficiencia de la fotoconversión en tejido modelo. (A) Esquemática y (B) fotografía; 1, cable óptico de la fuente de luz láser; 2, lente con distancia focal variable; y 3, mezcla salina tamponada con carne picada LMB002-fosfato colocada en 4, una jeringa con una cubierta no transparente y una parte frontal cortada (que se muestra en (B) sin la cubierta). Haga clic aquí para ver una versión más grande de esta figura.
3. Determinación de la eficacia anticancerígena in vivo
NOTA: La programación del experimento y los puntos finales se muestran en la figura 4. Los estándares de cuidado de los animales en el período posterior al tratamiento deben cumplir con las reglas de las 3R: el alojamiento debe incluir la densidad adecuada de la jaula y la disponibilidad de recursos. Siempre que sea posible, adhiérase a métodos de manejo de animales no aversivos, como túnel o ventosas.
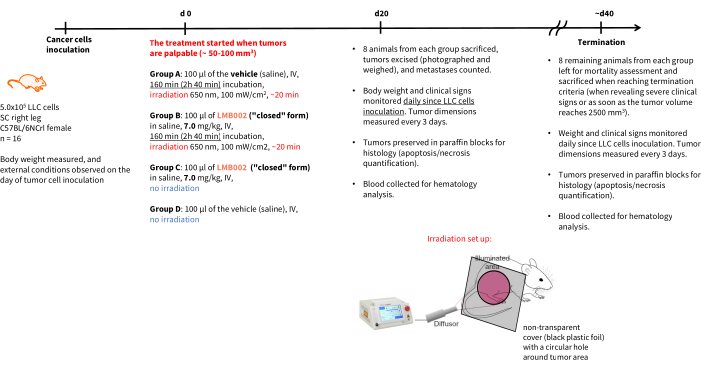
Figura 4: Calendario del experimento terapéutico in vivo . Designación de los grupos experimentales, detalles de la terapia, criterios de valoración y programas de análisis post mortem . Abreviaturas: LLC = carcinoma de pulmón de Lewis; IV = intravenosa; SC = subcutánea. Haga clic aquí para ver una versión más grande de esta figura.
- Preparación de las células cancerosas para la inoculación subcutánea (día 0).
- Paso de las células LLC en DMEM (4,5 g/L de glucosa) con 10% FBS, 100 U/mL de penicilina y 100 μg/mL de estreptomicina a 37 °C y 5% deCO2.
- Recolecte las células usando una solución de tripsina-EDTA al 0.05%, centrifugar y suspender en DMEM sin suero.
- Contar las células y determinar su viabilidad utilizando un hemocitómetro y una prueba de exclusión de azul de tripano.
- Preparar la suspensión celular final con concentración 10 × 106 células/ml en la mezcla DMEM y Matrigel (1:1). Mantenga la suspensión en hielo antes de la inyección.
- Inoculación celular LLC (día 0)
- Coloque el ratón hembra adulto C57BL/6NCrl (con un peso de ~20 g) en la cámara de inducción de la máquina de anestesia con isoflurano. Realizar sedación al 5% de isoflurano y esperar hasta que el animal esté completamente inconsciente.
- Retire el pelaje del área de inoculación celular afeitándose.
- Inocular 5 × 105 células LLC en ~100 μL de DMEM: Matrigel (1:1) mezcla en la extremidad posterior derecha.
NOTA: Siempre que sea posible, siga la práctica de uso de una sola aguja.
- Administración de compuestos y fotoirradiación
NOTA: En 5-8 días después de la inoculación, los animales están listos para el tratamiento cuando sus tumores son palpables y han alcanzado ~ 50-100 mm3 volumen. Realizar todas las operaciones posteriores con LMB002 y ratones tratados con este compuesto en condiciones de semioscuridad (una lámpara LED de 4 W al menos a 5 m del lugar de trabajo).- Disolver LMB002 (forma "anillo cerrado") en solución salina fisiológica estéril a una concentración de 1 mg/ml para la dosis de 5 mg/kg (IV) para obtener soluciones homogéneas azul oscuro.
- Antes de la irradiación, reúna al azar cuatro grupos de ocho animales y retire el pelaje del tumor y las áreas cercanas afeitándose.
- Coloque un ratón en el soporte para inyecciones intravenosas y precaliente la cola del animal en un baño de agua a 37 ° C para que la vena de la cola sea visible.
NOTA: Considere la analgesia preoperatoria. - Inyecte el compuesto a 5 ml/kg en la vena de la cola. Para los dos grupos control, inyectar 100 μL de solución salina (por vía intravenosa) por animal (20 g de peso corporal). Asegúrese de que los animales de los dos grupos experimentales reciban el compuesto probado en la fotoforma inactiva (1 mg/ml en solución salina).
NOTA: Siempre que sea posible, siga la práctica de uso de una sola aguja. - Luego, 2 h 45 min después de la inyección del compuesto, coloque al ratón bajo anestesia. Inducir sedación con isoflurano al 3% -4% en oxígeno. Mantener la anestesia durante 15 min con 0,5%-1% de isoflurano en oxígeno.
- Cubra el ratón con una máscara negra que posea un agujero que exponga solo el área del tumor a la luz.
- Encienda el módulo de diodo láser con un láser de 650 nm y ajuste la potencia del láser rojo a 200 mW y el láser guía azul/UV a 2 mW.
NOTA: Use gafas protectoras azules cuando el dispositivo láser esté encendido. - Mida el flujo de luz del láser rojo (lejos de los ratones) con un fotómetro y determine la distancia desde el cable óptico donde el flujo de luz es de 100 mW / cm2. Fije el cable en un soporte para asegurarse de que la fuente de luz esté a la distancia determinada del tumor y que la luz cubra toda el área del tumor. Use luz láser guía azul/UV durante este procedimiento.
- Encienda el láser rojo para irradiar el área del tumor durante 20 minutos.
- Después de la irradiación, cierre el flujo de isoflurano, devuelva al animal a su jaula y observe cuidadosamente su condición durante los próximos 30 minutos.
NOTA: Después de la administración del compuesto, mantenga los ratones en la oscuridad durante 2 días. Sólo el ciclo del día luz debe ser alterado; Todas las demás condiciones de vivienda deben permanecer sin cambios.
- Observaciones posteriores al tratamiento
- Observar a los animales diariamente y medir el peso y las dimensiones de sus tumores. Mida el volumen del tumor y observe la progresión de la necrosis.
NOTA: Los estándares de cuidado de los animales en el período posterior al tratamiento deben cumplir con las reglas 3R: el alojamiento debe incluir la densidad adecuada de la jaula y la disponibilidad de recursos. - Utilice los datos recopilados en el paso anterior para evaluar la mortalidad. Determinar la tasa de supervivencia mediante el procedimiento estándar.
NOTA: Los animales deben ser sacrificados y contados como muertos cuando revelen signos clínicos graves (pérdida de peso corporal de más del 15%, ulceración tumoral no cicatriza en 7 días y vocalización) o tan pronto como el volumen tumoral alcance los 2.500mm3.
- Observar a los animales diariamente y medir el peso y las dimensiones de sus tumores. Mida el volumen del tumor y observe la progresión de la necrosis.
Resultados
En este trabajo, se realizaron experimentos de células 2D y 3D para determinar el IC50 para las formas de LMB002 "anillo cerrado" y "anillo abierto" (ver Figura 1) en diferentes momentos de incubación. Estos valores se compararon con los obtenidos para el péptido prototipo, gramicidina S (utilizado como control positivo). En la Figura 5 se muestra un conjunto típico de imágenes de la incubación en cultivo de LLC cultivado en 2D después de la tinción. La cotinción con Hoechst 33342 (azul) y yoduro de propidio (rojo) que resulta en diferentes tonos de púrpura en una fracción mayor de células en el caso del tratamiento con forma "anillo abierto" en comparación con "anillo cerrado" indica una diferencia notable en la citotoxicidad entre dos formas que pueden cuantificarse fácilmente. El ejemplo demostrado de un experimento exitoso se basa en los datos recopilados utilizando el formato de placa de 96 pocillos, donde se agregaron las variantes peptídicas a concentraciones variables, como se muestra en la Figura 2. Se pueden adquirir datos similares con placas de 384 pocillos y de alta densidad. Sin embargo, dado que se reducen los volúmenes por pozo, los errores técnicos y sistemáticos y, como resultado, la precisión de la determinación IC50 disminuirán con el aumento de la densidad del pozo.
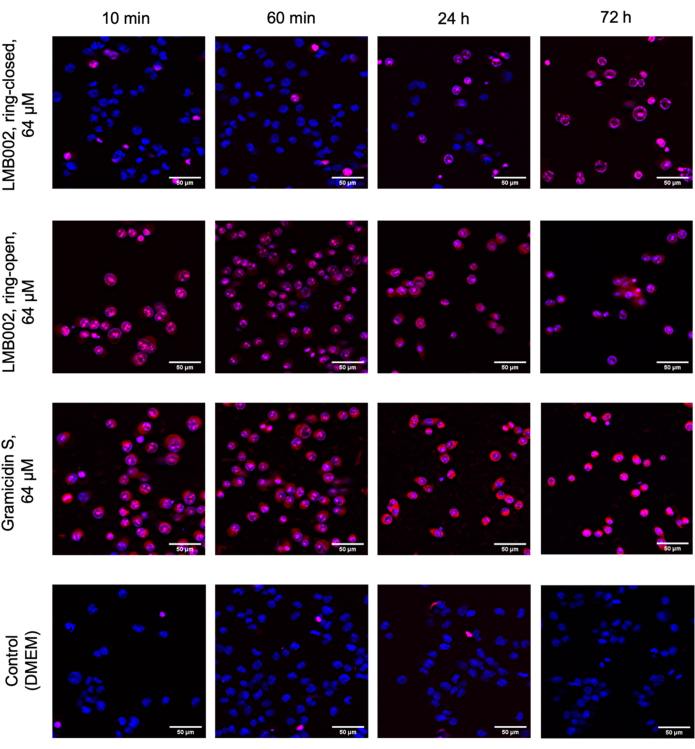
Figura 5: Imágenes representativas del ensayo de citotoxicidad en el LLC monocapa. Las células se tiñeron con Hoechst 33342 (azul) y yoduro de propidio (rojo). Los tiempos mostrados: 10 min, 60 min, 24 h y 72 h son tiempos de incubación con compuestos. Barras de escala = 50 μm. Haga clic aquí para ver una versión más grande de esta figura.
La fotoconversión de LMB002 por irradiación de luz láser en un tejido modelo - carne picada fresca de cerdo - se determinó utilizando una muestra compuesta de carne picada mezclada con LMB002 forma "anillo cerrado" (inactivo) disuelta en PBS y midiendo la conversión de esta forma inactiva a la forma LMB002 "anillo abierto" (activado) en la dirección de propagación de la radiación. La muestra se colocó en una jeringa y se irradió desde un lado con un haz plano de radiación láser durante el tiempo de exposición de ~ 10 min (generalmente utilizado en experimentos in vivo ), como se muestra en la Figura 3. Después de la exposición, el cilindro de muestra se dividió en partes presionando el pistón de la jeringa y cortando las rodajas de la misma altura con un bisturí. La concentración de LMB002 "anillo abierto" en los extractos de los cortes se determinó mediante RP HPLC.
La Figura 6 ilustra las curvas dosis-efecto que la Figura 6A-D obtuvo del análisis de datos. Para identificar el porcentaje de células muertas con co-tinción nuclear de colorantes Hoechst 33342 y PI, utilizamos una herramienta clasificadora incorporada que establece umbrales numéricos en parámetros medidos seleccionados para dividir todos los recuentos de células en varias categorías. Por ejemplo, cuando la señal del canal rojo (yoduro de propidio) en el control estaba en el umbral (aproximadamente 110-130 unidades), las células podrían clasificarse como PI-positivas, consideradas como muertas, o PI-negativas, consideradas como no afectadas por los compuestos. Para LMB002, se pueden observar dependencias sigmoidales del porcentaje de células positivas para yoduro de propidio en la concentración del compuesto. A partir de estos datos, se pueden determinar los valores de IC50.
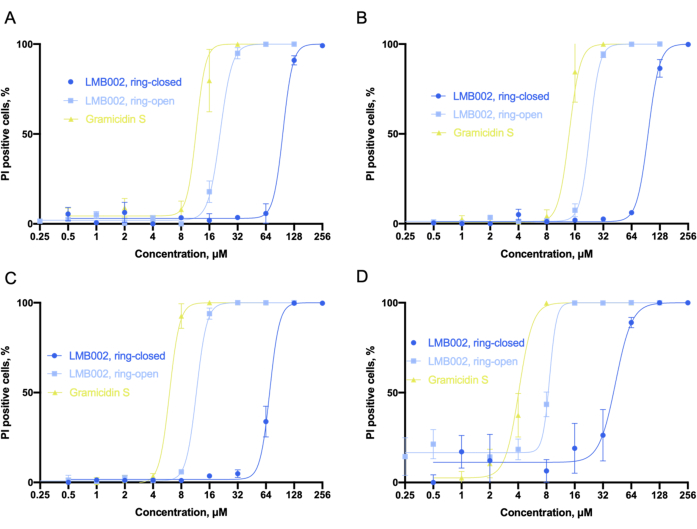
Figura 6: Análisis de citotoxicidad en cultivo 2D. Los ajustes sigmoides se obtuvieron en el cultivo LLC para (A) 10 min, (B) 60 min, (C) 24 h y (D) intervalos de tiempo de 72 h tomados para la incubación con compuestos. El ajuste permite la determinación precisa de los valores de IC50 (no se muestra). Las barras de error son SEM. Abreviaturas: LLC = carcinoma de pulmón de Lewis; IP = yoduro de propidio. Haga clic aquí para ver una versión más grande de esta figura.
Teniendo en cuenta los valores obtenidos deIC 50 , podemos concluir que la toxicidad de los tres compuestos aumentó con el tiempo de incubación. Nuestro experimento reveló que la forma "anillo-abierta" de LMB002 es aproximadamente un paso de dilución menos tóxica que el péptido prototipo, gramicidina S. Mientras que la forma "anillo cerrado" demuestra tres o cuatro pasos de dilución menor toxicidad, que aumenta con el tiempo de incubación. La diferencia entre los dos pasos de dilución no se ve afectada por el aumento en el tiempo de incubación y puede usarse numéricamente como una ventana fototerapéutica determinada experimentalmente6 para la comparación con otros compuestos en un posible cribado de biblioteca. El valor de IC50 para la gramicidina S se estableció como punto de referencia para corregir errores experimentales o salidas diferenciales en réplicas biológicas.
Los experimentos de células 3D produjeron el mismo tipo de datos sin procesar: las imágenes esferoides de una sola célula resueltas por pozo. La inclusión de calceína como tercer colorante de tinción permite la cuantificación de la fracción de células metabólicamente activas (observada en el canal verde). Mediante el uso de placas de 384 pocillos, el aumento del número de réplicas técnicas, la exclusión de los puntos de tiempo de coincubación redundantes y el cambio del pliegue de dilución, pudimos comparar directamente varios compuestos en una sola ejecución de prueba (utilizando una sola placa) como se ilustra en el mapa de placas de la Figura 7.
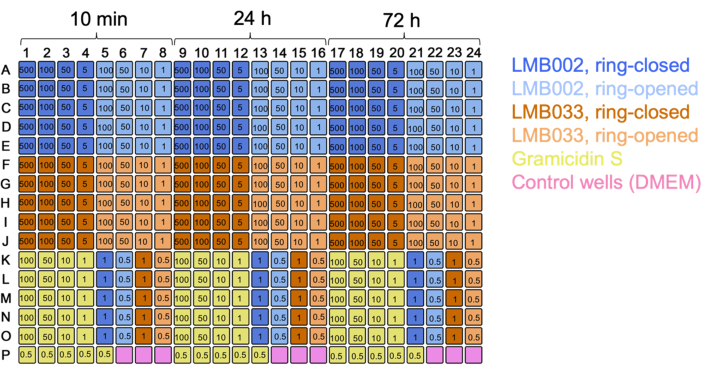
Figura 7: Mapa de placas para el experimento de cultivo 3D con dos compuestos. Se indican los códigos de color para los compuestos y el control. Los números en los pozos son concentraciones en μM. 10 min, 24 h y 72 h son tiempos de incubación. Haga clic aquí para ver una versión más grande de esta figura.
La Figura 8 muestra las imágenes de réplicas técnicas seleccionadas de esferoides LLC cultivados a una densidad de 1 esferoide/pocillo en presencia de compuestos probados y esferoides de control capturados después de la tinción.
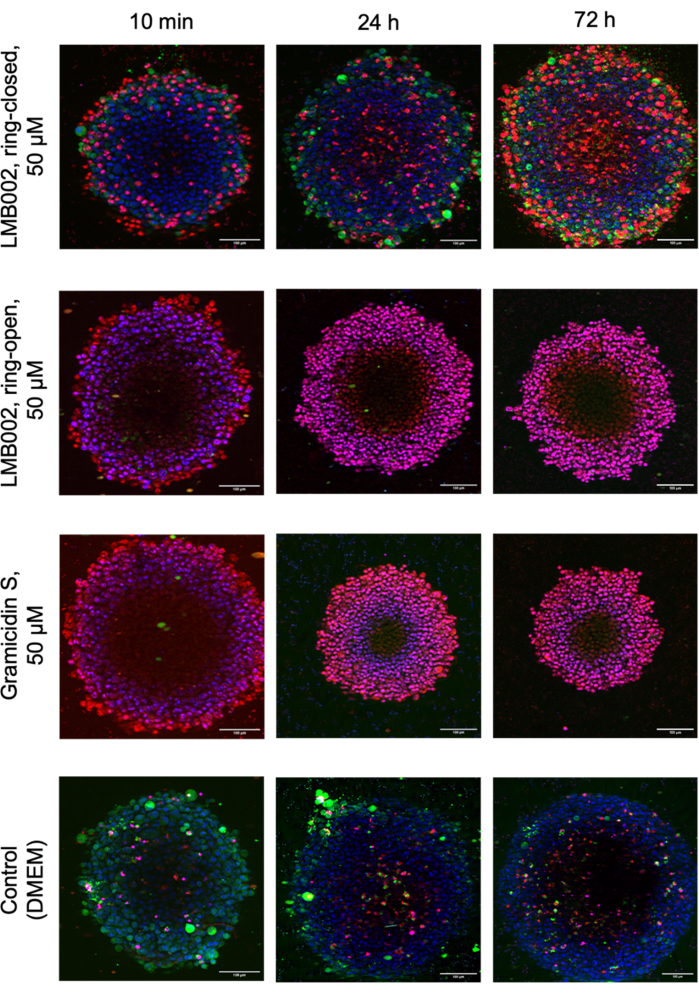
Figura 8: Imágenes representativas del ensayo de citotoxicidad de cultivo 3D. Las imágenes muestran esferoides LLC de 48 h de edad teñidos con Hoechst 33342 (azul), calceína AM (verde) y yoduro de propidio (rojo) después de 10 min, 24 h y 72 h de co-incubación con fotoformas LMB002 y gramicidina S. Barras de escala = 100 μm. Haga clic aquí para ver una versión más grande de esta figura.
Usando el software del instrumento, las curvas dosis-efecto, como las del experimento 2D, se obtuvieron de las pilas de imágenes apiladas en z (Figura 9A). Además, los esferoides compactos y no deformados en los cultivos 3D podrían caracterizarse por el diámetro total del esferoide (Figura 9B). También se observó que el diámetro total del esferoide varía con la concentración del compuesto.
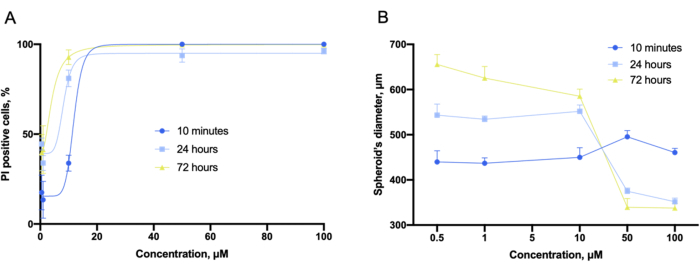
Figura 9: Evaluación de citotoxicidad con cultivos 3D. (A) Curvas de ajuste de citotoxicidad dependientes de la concentración y (B) diagramas de diámetro de esferoide dependientes de la concentración obtenidas en los cultivos 3D de LLC co-incubados con gramicidina S durante 10 min, 24 h y 72 h y capturados antes de la tinción. Las barras de error son SEM. Haga clic aquí para ver una versión más grande de esta figura.
El experimento para el Paso 2 permite la determinación de las concentraciones de LMB002 en ambas fotoformas mediante el uso de cromatografía líquida de alta resolución detectada por UV. La eficiencia de la fotoconversión en tejidos modelo se evaluó y cuantificó fácilmente utilizando esta configuración (Figura 3). Los datos se obtuvieron del análisis cuantitativo de los cromatogramas de los extractos de la muestra. En estos experimentos de prueba, los cromatogramas LMB002 se detectaron espectroscópicamente a 270 nm y 570 nm. A 270 nm, se observaron muchas señales adicionales y se atribuyeron a los compuestos co-extraídos del tejido modelo (verificado a partir del extracto de control sin el compuesto). Ambas fotoformas fueron suficientemente diferentes en tiempos de retención y absorbancia. Sin embargo, la señal LMB002 "anillo abierto" estaba separada de estas señales de fondo (ver un cromatograma representativo en la Figura 10A). Por lo tanto, esta señal se puede integrar sin problemas. A 570 nm, los cromatogramas contenían sólo la señal de forma LMB002 "anillo cerrado" (Figura 10B). Aquí, realizamos la determinación de la concentración utilizando RP HPLC. Sin embargo, se podría lograr una precisión aún mayor y límites de detección más bajos utilizando LC / MS como método analítico.
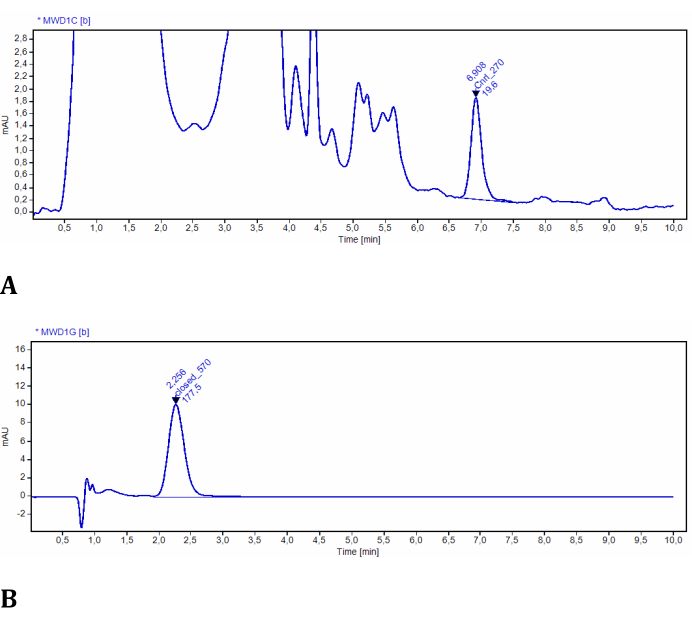
Figura 10: Cromatogramas representativos de LMB002 extraídos de tejidos modelo. (A) Muestra a 2 mm de la superficie irradiada, registrada a 270 nm (la forma LMB002 "anillo abierto" está integrada); (B) muestra a 38 mm de la superficie irradiada, registrada a 570 nm (el pico de LMB002 "anillo cerrado" está integrado). Los valores de tiempo de retención (indicados) confirmaron adicionalmente la identidad del compuesto. Haga clic aquí para ver una versión más grande de esta figura.
Los datos obtenidos después de integrar las señales correspondientes de todas las muestras recogidas se utilizaron para construir los gráficos de concentración-profundidad, como se muestra en la Figura 11. Sobre la base de estos gráficos, se evaluó fácilmente la eficiencia de la fotoconversión a diferentes profundidades del tejido modelo. Confirma que nuestra fuente de luz roja induce la fotoconversión LMB002 "cerrada con anillo" a una profundidad de hasta 1 c, en el sustituto del tejido, carne picada (a aproximadamente 103 mW / cm2).
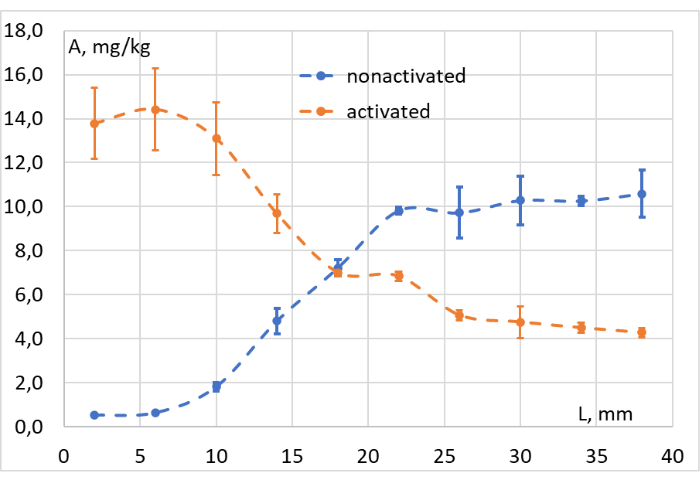
Figura 11: Evaluación de la eficiencia de fotoconversión. Concentración (A, mg/kg) de LMB002 "anillo cerrado" (no activado, puntos azules) y formas "anillo abierto" (activado, puntos naranjas) a diferentes distancias de la superficie irradiada del tejido modelo (L, mm). Haga clic aquí para ver una versión más grande de esta figura.
Los resultados del experimento in vivo - Paso 3 de nuestra metodología realizada de acuerdo con el esquema presentado en la Figura 4 - fueron representados por gráficos que muestran el crecimiento tumoral en función del tiempo (Figura 12) y las curvas de supervivencia de Kaplan-Meier (Figura 13).
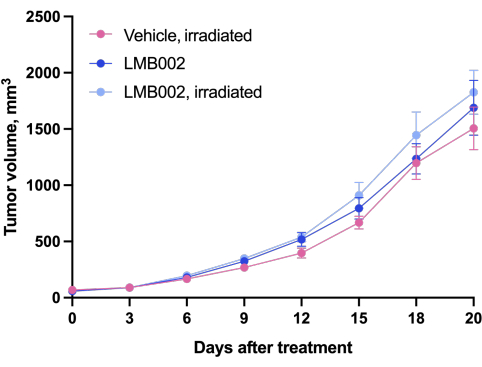
Figura 12: Dinámica de crecimiento tumoral en animales. Animales tratados con LMB002 en comparación con los animales tratados con vehículo (modelo de aloinjerto LLC subcutáneo en ratones C57BL/6NCrl, dosis compuesta 7 mg/kg, IV, incubación de 2 h 40 min, luego irradiación a 650 nm, 100 mW/cm2, 20 min). Haga clic aquí para ver una versión más grande de esta figura.
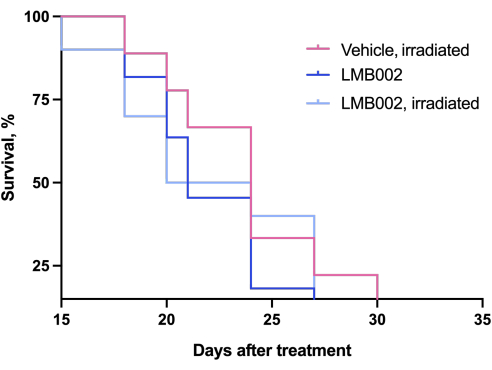
Figura 13: Curvas de mortalidad de los animales. Animales tratados con LMB002 en comparación con los animales tratados con vehículo (modelo de aloinjerto LLC subcutáneo en ratones C57BL/6NCrl, dosis compuesta 7 mg/kg, IV, incubación de 2 h 40 min, luego irradiación a 650 nm, 100 mW/cm2, 20 min). Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Los compuestos fotocontrolados no tienen precedentes en el desarrollo de fármacos; sin embargo, no se han establecido métodos para su evaluación preclínica y clínica. El análogo de monoterapia más cercano, la terapia fotodinámica (TFD), es la modalidad de tratamiento de uso clínico adoptada por muchos países contra el cáncer y está en desarrollo para otras indicaciones19,20. Similar a la fotofarmacología, la TFD también se basa en el uso de la luz para activar la sustancia bioactiva (oxígeno singlete). Por lo tanto, algunos métodos experimentales utilizados para estudios preclínicos y clínicos en TFD pueden adoptarse para la fotofarmacología. Por ejemplo, las fuentes de luz, los enfoques de suministro de luz y los dispositivos médicos están bien desarrollados y aprobados para PDT; Se pueden utilizar directamente para la evaluación de fármacos fotocontrolados. Sin embargo, la TFD y la fotofarmacología tienen muchas distinciones entre sí4, lo que justifica la necesidad de establecer métodos específicos para esta última.
En primer lugar, la sustancia no activada en la TFD (oxígeno) siempre está presente en los tejidos vivos en concentraciones no tóxicas. Por el contrario, los compuestos biológicamente activos fotocontrolados no activados pueden tener actividad residual y toxicidad no deseada. Por lo tanto, los fármacos fotofarmacología ideales deben haber minimizado la actividad biológica en su forma administrada y deben ser altamente activos en su forma generada por la luz, la "ventana fototerapéutica"21 debe ser lo más grande posible. Encontrar el golpe y realizar la optimización de golpe a plomo requiere la identificación de compuestos adecuados y la selección de bibliotecas relativamente grandes, ya en las primeras etapas del desarrollo de fármacos. Aquí, propusimos una microscopía fluorescente confocal automatizada de alto rendimiento para identificar compuestos de fotoconmutación eficientes.
El método elegido de evaluación de citotoxicidad permite una fácil implementación del requisito más crítico: el mantenimiento del PSS o la estabilidad del fotoisómero sensible a la luz visible. Esto se debe a que, tras su implementación, la exposición a la luz se minimiza. Por lo tanto, si se seleccionan métodos alternativos, se deben preferir los automatizados. Este enfoque es confiable e informativo. El uso de cultivos celulares 3D (esferoides) en esta etapa proporciona una comprensión holística de la respuesta de la célula al tratamiento en un microambiente similar a un tejido más realista. Además, se pueden obtener valiosos conocimientos sobre el mecanismo de acción de los compuestos utilizando la microscopía como método directo. La microscopía fluorescente confocal con protocolo de tinción adecuado permite la evaluación visual de la morfología de las células y esferoides; También se pueden detectar detalles importantes sobre la muerte celular y los cambios dentro de las células.
En segundo lugar, la aplicación de luz requiere una elección cuidadosa de la dosis de luz. En la TFD, la sobredosis leve es extremadamente dañina para los tejidos22. La terapia fotofarmacológica puede ser ventajosa bajo irradiación excesiva de luz. El límite superior del principio activado se define por la dosis administrada del principio no activado y su farmacocinética. Sin embargo, la dosis de luz sigue siendo un problema en fotofarmacología. Se debe tener cuidado para garantizar que la densidad de potencia de irradiación y el tiempo de exposición no sean inferiores a los requisitos para la terapia. En principio, la generación de la sustancia activada puede controlarse in vivo. Sin embargo, por razones bioéticas, propusimos un experimento con un tejido modelo (carne picada fresca) mezclado con el compuesto no activado15. Este experimento es simple y se puede modificar para usar diferentes fuentes de luz. También se puede adaptar para la estimación fotofísica de la dosis de luz y la medición de influencias térmicas. Una vez más, mediante el uso de tejidos modelo, la exposición a la luz es posible minimizar, en comparación, por ejemplo, con la determinación más precisa de la eficiencia de fotoconmutación en las condiciones in vivo , una alternativa que siempre puede ser interesante considerar.
Finalmente, los compuestos que demuestran características superiores en las pantallas de toxicidad in vitro y están fotoconmutando eficientemente al menos 1-1.5 cm de profundidad en el tejido modelo se pueden seleccionar para estudios in vivo costosos, laboriosos y largos. En este protocolo, utilizamos la misma línea celular (LLC) que en la evaluación in vitro para generar el modelo de cáncer de aloinjerto. La dinámica del crecimiento tumoral, la mortalidad y el recuento de metástasis son los parámetros más adecuados para evaluar la eficacia anticancerosa. En comparación con la quimioterapia convencional, se aplica un factor adicional en el tratamiento fotofarmacológico: la luz. Por lo tanto, se necesitan dos grupos de animales de control: uno que reciba solo el vehículo y el otro que reciba el vehículo y la irradiación. Esta configuración permite la evaluación del impacto de la luz en los parámetros medidos. En nuestro experimento, los animales de los dos grupos experimentales recibieron el compuesto no activado, y los tumores de los ratones en un grupo fueron irradiados. El régimen de irradiación fue idéntico para los grupos control y tratamiento. La comparación con la quimioterapia de referencia no es necesaria en esta etapa porque el objetivo principal del experimento es demostrar el efecto combinado de la aplicación de luz y compuesto. Los compuestos de mejor rendimiento que exhiben este efecto pueden seleccionarse para un estudio adicional sobre su toxicidad in vivo y la comparación con puntos de referencia para tomar decisiones importantes sobre su desarrollo. Técnicamente, el experimento in vivo que describimos se puede adaptar fácilmente a estudios farmacocinéticos o farmacodinámicos, por ejemplo, de un compuesto que ya está seleccionado como líder del fármaco.
Divulgaciones
IVK, OB, SA y ASU son inventores de la familia de patentes emitidas: "Peptidomimetics possessing photocontrolled biological activity" (WO2014127919 [A1], EP2958934 [B1], US9481712 [B2], UA113685 [C2]) con licencia de Lumobiotics GmbH. IVK, OB, TS y SA son fundadores y accionistas de Lumobiotics GmbH. IVK es asesor científico, HK, TM, IP y PB son empleados de Enamine LLC. Los autores no tienen otras afiliaciones relevantes o participación financiera con ninguna organización o entidad con un interés financiero o conflicto financiero con el tema o los materiales discutidos en la publicación, aparte de los divulgados.
Agradecimientos
Los autores reconocen la financiación de la UE por parte del programa H2020-MSCA-RISE a través de los proyectos PELICO (#690973) y ALISE (#101007256). Este trabajo fue apoyado por el DFG-GRK 2039 (SA, TS y ASU), el programa NACIP de la Sociedad Helmholtz (SA y ASU) y el VIP + de la BMBF (OB y ASU). Reconocemos al Dr. Serhii Koniev, del Instituto de Tecnología de Karlsruhe, quien sintetizó el compuesto LMB002, lo purificó y amablemente proporcionó el compuesto para el estudio. Los autores también agradecieron a Chupryna Maksym, quien filmó y compiló el video en Ucrania, y a todos los valientes defensores de Ucrania que hicieron posible el trabajo experimental, la escritura y la filmación de esta publicación.
Materiales
| Name | Company | Catalog Number | Comments |
| Agilent 1100 Series capillary LC system | ALSI-Chrom (Agilent distributor) | - | |
| ATCC CRL-1642, LL/2 (LLC1) Lewis lung carcinoma cell line | ECACC | 90020104 | |
| C57BL/6NCrl mice, female, inbred | Charles River | Strain code: 027 | |
| CelCulture, CO2 incubator | Esco Micro | CCL-170B | |
| Corning Matrigel Basement membrane matrix | Merck | CLS354234 | |
| Corning, 384- well spheroid microplates | Merck | CLS3830 | |
| Fetal bovine serum | Merck | F7524 | |
| Gibco, DPBS | Thermo Fisher Scientific | 21600044 | |
| Gramicidin S | Lumobiotics | Custom synthesis | |
| HyClone, DMEM/high glucose | Cytiva | SH30003.04 | |
| IN Cell Analyzer 6500HS, imaging system | Cytiva | 29240358 | |
| Invitrogen, Calcein AM | Thermo Fisher Scientific | C1430 | |
| Isoflurane anesthesia machine | ASA | S/N ASA 1305 | |
| L-glutamine, 200 mM solution | Merck | G7513 | |
| LIKA-surgeon, diode surgery laser | Fotonika plus | - | |
| LMB002 | Lumobiotics | Custom synthesis | |
| Penicillin–Streptomycin, solution stabilized | Merck | P4333 | |
| PhenoPlate, 96-well plates | PerkinElmer | 6055302 | |
| Photometer PCE-LED 20 | PCE Instruments | PCE-LED 20 | |
| Thermo Scientific, Hoechst 33342 | Thermo Fisher Scientific | 62249 | |
| Thermo Scientific, Propidium iodide | Thermo Fisher Scientific | J66764-MC | |
| Trypan blue, 0.4% solution | Merck | T8154 | |
| Trypsin–EDTA, 10 x solution | Merck | T4174 | |
| UltraCruz Cell culture flasks with vented caps, 75 cm2 | Santa Cruz Biotechnology | sc-200263 | |
| UltraCruz, bottle top filters, PES, 0.22 μm | Santa Cruz Biotechnology | sc-360882 | |
| Vydac 218TP, C18 HPLC column (4.6 mm × 250 mm, 5 µm) | Altmann Analytik (Avantor distributor) | GR5103827 |
Referencias
- Fuchter, M. J. On the promise of photopharmacology using photoswitches: a medicinal chemist's perspective. Journal of Medicinal Chemistry. 63 (20), 11436-11447 (2020).
- Volarić, J., Szymanski, W., Simeth, N. A., Feringa, B. L. Molecular photoswitches in aqueous environments. Chemical Society Reviews. 50, 12377-12449 (2021).
- Paoletti, P., Ellis-Davies, G. C. R., Mourot, A. Optical control of neuronal ion channels and receptors. Nature Reviews Neuroscience. 20, 514-532 (2019).
- Hüll, K., Morstein, J., Trauner, D. In Vivo Photopharmacology. Chemical Reviews. 118 (21), 10710-10747 (2018).
- Ma, X., et al. In vivo photopharmacology with a caged mu opioid receptor agonist drives rapid changes in behavior. Nature Methods. 20, 682-685 (2023).
- Sarabando, S. N., Palmeira, A., Sousa, M. E., Faustino, M. A. F., Monteiro, C. J. P. Photomodulation Approaches to Overcome Antimicrobial Resistance. Pharmaceuticals. 16 (5), 682 (2023).
- Kolarski, D., Szymanski, W., Feringa, B. L., Hirota, T., Hatori, M., Panda, S. Chronophotopharmacology: Methodology for high spatiotemporal control over the circadian rhythm with light. Neuromethods. 186, (2022).
- Babii, O., et al. Peptide drugs for photopharmacology: how much of a safety advantage can be gained by photocontrol. Future Drug Discovery. 2 (1), FDD28 (2020).
- Davis, A. M., Keeling, D. J., Steele, J., Tomkinson, N. P., Tinker, A. C. Components of successful lead generation. Current Topics in Medicinal Chemistry. 5 (4), 421-439 (2005).
- Balani, S. K., Miwa, G. T., Gan, L., Wu, J., Lee, F. W. Strategy of utilizing in vitro and in vivo adme tools for lead optimization and drug candidate selection. Current Topics in Medicinal Chemistry. 5 (11), 1033-1038 (2005).
- Kleijn, A., et al. A Systematic comparison identifies an ATP-based viability assay as most suitable read-out for drug screening in glioma stem-like cells. Stem Cells International. 2016, (2016).
- Rodrigues, J., Heinrich, M. A., Teixeira, L. M., Prakash, J. 3D in vitro model revolution: unveiling tumor-stroma interactions. Trends in Cancer. 7 (3), 249-264 (2021).
- Sittinger, M., et al. Tissue engineering and autologous transplant formation: practical approaches with resorbable biomaterials and new cell culture techniques. Biomaterials. 17 (3), 237-242 (1996).
- Matai, I., Kaur, G., Seyedsalehi, A., McClinton, A., Laurencin, C. T. Progress in 3D bioprinting technology for tissue/organ regenerative engineering. Biomaterials. 226, 119536 (2020).
- Babii, O., et al. Direct photocontrol of peptidomimetics: an alternative to oxygen-dependent photodynamic cancer therapy. Angewandte Chemie International Edition. 55 (18), 5493-5496 (2016).
- De Ridder, K., et al. Novel 3D lung tumor spheroids for oncoimmunological assays. Advanced NanoBiomed Research. 2 (4), 2100124 (2022).
- Pauli, C., et al. Personalized in vitro and in vivo cancer models to guide precision medicine. Cancer Discovery. 7 (5), 462-477 (2017).
- Van Straten, D., Mashayekhi, V., De Bruijn, H. S., Oliveira, S., Robinson, D. J. Oncologic photodynamic therapy: basic principles, current clinical status and future directions. Cancers. 9 (2), 19 (2017).
- Li, X., Kwon, N., Guo, T., Liu, Z., Yoon, J. Innovative strategies for hypoxic-tumor photodynamic therapy. Angewandte Chemie International Edition. 57 (36), 11522-11531 (2018).
- Hull, K., Morstein, J., Trauner, D. In vivo photopharmacology. Chemical Reviews. 118 (21), 10710-10747 (2018).
- Babii, O., et al. Structure-activity relationships of photoswitchable diarylethene-based β-hairpin peptides as membranolytic antimicrobial and anticancer agents. Journal of Medicinal Chemistry. 61 (23), 10793-10813 (2018).
- Heckl, C., Aumiller, M., Rühm, A., Sroka, R., Stepp, H. Fluorescence and treatment light monitoring for interstitial photodynamic therapy. Photochemistry and Photobiology. 96 (2), 388-396 (2020).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados