Method Article
Оценка in vitro и in vivo фотоконтролируемых биологически активных соединений - потенциальных кандидатов на лекарства для фотофармакологии рака
* Эти авторы внесли равный вклад
В этой статье
Резюме
Этот протокол представляет собой набор экспериментов, принятых для оценки фотопереключаемых противоопухолевых пептидов, которые могут быть использованы в доклиническом скрининге таких соединений. Это включает в себя оценку цитотоксичности в 2D и 3D клеточных культурах, оценку эффективности фотоизомеризации ex vivo (модельной ткани) и эффективности in vivo .
Аннотация
Фотоконтролируемые, биологически активные соединения являются новым классом «умных» кандидатов на лекарства. Они обеспечивают дополнительную безопасность при системной химиотерапии благодаря их точной пространственно-временной активации, направляя доброкачественный, неионизируемый свет в определенное место в организме пациента. В данной работе представлен комплекс методов оценки in vitro потенции и эффективности ex vivo фотоактивации фотоконтролируемых биологически активных соединений, а также эффективности in vivo на ранних стадиях разработки лекарственных средств. Методика применяется к противоопухолевым цитотоксическим пептидам, а именно к диарилетеносодержащим аналогам известного антибиотика грамицидина С. Эксперименты проводятся с использованием 2D (адгезивные клетки) и 3D (сфероиды) клеточных культур линии раковых клеток (карцинома легкого Льюиса, LLC), суррогатов живых тканей (фарш из свинины) и модели рака аллотрансплантата (подкожная LLC) у иммунокомпетентных мышей. Выбор наиболее эффективных соединений и оценка реалистичных фототерапевтических окон выполняются с помощью автоматизированной флуоресцентной микроскопии. Эффективность фотоактивации при различных режимах освещения определяется на разной глубине в модельной ткани, а оптимальная дозировка света применяется в заключительном терапевтическом эксперименте in vivo.
Введение
Фотоконтролируемые биологически активные соединения появились в последние десятилетия в качестве перспективного компонента безопасной химиотерапии заболеваний человека и специфического искоренения злокачественных солидных опухолей1. Эти соединения содержат обратимо фотоизомеризуемые фрагменты (молекулярные фотопереключатели) и могут переключаться между неактивными и активными фотоизомерами при облучении светом разных длин волн.
По сравнению со своими нефотоконтролируемыми аналогами, фотоконтролируемые препараты могут быть более безопасными, поскольку они могут систематически вводиться в организм пациента в менее активных и по существу нетоксичных формах, а затем активируются светом только там, где это необходимо, например, в опухолях, язвах и ранах. Несмотря на то, что в недавних научных работах 2,3,4,5,6,7 можно найти множество захватывающих демонстраций таких молекулярных прототипов лекарств, области клинической фотофармакологии - применения одобренных комбинаций лекарств / медицинских устройств / заболеваний - не существует. Фотофармакология все еще находится на стадии открытия лекарств, и систематические доклинические исследования неизвестны.
Совсем недавно мы продемонстрировали преимущество безопасности in vivo для некоторых фотоконтролируемых противоопухолевых пептидов, а именно аналогов пептидного антибиотика грамицидина S8. Эти фотоуправляемые производные содержат фотопереключатель с диарилетеном (DAE), который претерпевает обратимые фотоиндуцированные преобразования между так называемыми фотоформами, генерируемыми красным светом, и фотоформами, генерируемыми УФ-излучением, «замкнутыми кольцами» (проиллюстрировано на рисунке 1 для одного из производных, соединения LMB002).
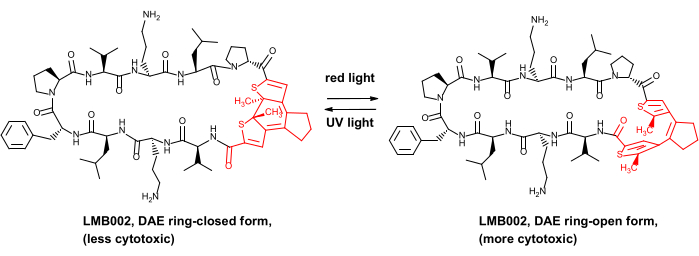
Рисунок 1: Фотоуправляемый цитотоксический пептид LMB002 и его фотоизомеризация. Фрагмент дневника показан красным цветом. Аббревиатура: DAE = diarylethene. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Для нахождения попаданий и оптимизации попадания в лид часто требуется in vitro и in vivo скрининг соответствующих библиотек соединений 9,10. Здесь мы демонстрируем методологию, подходящую для систематического высокопроизводительного скрининга цитотоксичности фотоконтролируемых соединений. Мы также определяем эффективность фотоизомеризации, оцениваем дозу света в модельных тканях и оцениваем эффективность in vivo наиболее эффективных кандидатов. Этот подход соответствует соображениям биоэтики и ухода за животными.
В этой работе традиционные доклинические методы модифицируются, чтобы избежать неконтролируемой фотоизомеризации испытуемых соединений. Общая цель применения этих модифицированных методов состоит в том, чтобы разработать общую стратегию, которая является простой и быстрой и дает статистически значимые данные для надежного сравнения активности in vitro и рационализации тестирования эффективности фотопереключаемых соединений in vivo для идентификации свинца и дальнейшей разработки.
Стратегия состоит из трех последовательных шагов. Первый этап включает определение IC 50 (кажущаяся50% жизнеспособность клеток) в серийных разведениях для активных и неактивных фотоформ выбранных фотоконтролируемых биологически активных соединений с использованием двумерных (2D, монослойных) и трехмерных (3D, сфероидных) клеточных культур и конфокальной высокопроизводительной автоматизированной флуоресцентной микроскопии. Фототерапевтические окна сравниваются с разницей IC50 между двумя фотоформами, и отбираются наиболее эффективные кандидаты. Нет особых преимуществ в оценке токсичности с помощью автоматизированной микроскопии и других платформ (анализов) скрининга цитотоксичности11; Более сложные клеточные моделиопухолей 12 могут быть легко реализованы на этом этапе.
Для соединений, выбранных на этапе 1, второй этап заключается в реалистичной оценке их эффективности фотопереключения внутри тканей в зависимости от глубины от облученной поверхности ткани путем количественной оценки эффективности фотопереключения менее активных фотоформ в тканевом суррогате с использованием высокоэффективной жидкостной хроматографии (ВЭЖХ) облученных образцов с УФ-детектированием. In vivo эффективность фотопереключения можно было бы изучить, но мы предлагаем использовать простой суррогат ткани – фарш из свинины. Мы проверили обоснованность такого подхода. Мы измерили конверсию наших фотопереключаемых соединений in vivo на модели рака мышей и наблюдали примерно такую же фотоконверсию на глубине, измеренной в предыдущих экспериментах с мышами8. Может быть использована любая подходящая альтернативная искусственная ткань13, 3D-биопечатная ткань/орган14, биопсийные материалы или другой освобожденный материал животного происхождения. Тем не менее, эта установка является хорошим компромиссом, поскольку она экономична, быстра и этична.
Третьим шагом является определение противоопухолевой эффективности in vivo в модели рака мышей. Для эксперимента отобраны соединения, демонстрирующие превосходные характеристики в экспериментах in vitro и эффективно фотопереключающиеся на глубине не менее 1-1,5 см в модельных тканях.
Этот протокол может быть применен к соединениям, обладающим различными типами фотопереключателей, при условии, что их фотоформы (или их фотостационарные состояния, PSS) стабильны в течение разумного времени (несколько дней или дольше). В качестве иллюстрации используется ранее описанный производный от DAE LMB00215. Фотоформы LMB002 термически стабильны и могут храниться при температуре -20 °C не менее года без существенной деградации. Для демонстрации in vitro и in vivo выбираются клетки карциномы легкого Льюиса (LLC), но никаких ограничений на тип клеток не накладывается. Клетки LLC являются адгезивными, легко культивируемыми в 3D и используются для получения опухолей (как описано в ссылке16). В естественных условиях Клетки LLC используются для моделирования метастатических процессов и могут легко генерировать солидные опухоли у иммунокомпетентных мышей после подкожной инъекции. Эта методология in vivo может быть универсально применена к другим моделям рака17,18. Ниже приводится подробное описание осуществления этой стратегии.
протокол
Уход за животными и экспериментальные процедуры проводились в соответствии с местными и международными правилами проведения исследовательских проектов с участием лабораторных животных (Закон Украины «О защите животных от жестокого обращения», Европейская конвенция о защите позвоночных животных, используемых в экспериментальных и других научных целях (Европейская конвенция, Страсбург, 1986 г.), Директива 2010/63/ЕС о защите животных, используемых в научных целях). Данное исследование одобрено Комиссией по биоэтике компании Bienta. В этих экспериментах использовались мыши C57BL/6NCrl (взрослые самки весом около 20 г каждая). Конкретные материалы, реагенты и оборудование перечислены в таблице материалов.
1. Оценка IC50 для LMB002 («кольцево-замкнутая» и «кольцево-открытая» формы) с использованием 2D и 3D клеточных культур LLC
- Приготовление буферов и исходных растворов компаундов
ПРИМЕЧАНИЕ: Подготовьте буферы, используя стандартные процедуры. В качестве альтернативы можно использовать коммерчески доступные решения.- Приготовьте 10-кратный фосфатно-буферный физиологический раствор (PBS), добавив 14,2 г Na 2 HPO 4, 2,4 г KH 2 PO4, 80 г NaCl и2г KCl в 1 л дистиллированной воды. В автоклаве готовят 10x PBS и разбавляют его до 1x раствора, добавляя 100 мл 10-кратного раствора к 900 мл дистиллированной воды. Затем храните раствор при температуре 4 °C.
- Приготовьте PBS Dulbecco (DPBS), добавив 4,78 г порошка DPBS в 1 л дистиллированной воды. Перемешайте раствор до тех пор, пока все твердое вещество не растворится, проверьте рН с помощью рН-метра и отрегулируйте его, добавив 1 М NaOH или 1 М HCl (рН 7,3-7,4). После достижения желаемого уровня pH отфильтруйте среду через вакуумный фильтр 0,22 мкм в стерильном шкафу. Хранить при температуре 4 °C.
- Приготовьте 1 М буферного раствора 4-(2-гидроксиэтил)-1-пиперазинэтансульфоновой кислоты (HEPES), добавив 238,3 г HEPES в 1 л дистиллированной воды. Отрегулируйте рН раствора 1 М NaOH до рН 7,5. Фильтруйте через вакуумный фильтр 0,22 мкм в стерильном шкафу. Хранить при температуре 4 °C.
- Приготовьте 1x раствор трипсина-ЭДТА (ЭДТА = этилендиаминтетрауксусная кислота), разбавив 10-кратный раствор. Для этого добавьте 5 мл 10x трипсина-ЭДТА к 45 мл 1x раствора PBS в стерильной пробирке объемом 50 мл. Хранить при температуре 4 °C.
- Приготовьте основную среду Modified Eagle Medium (DMEM) от Dulbecco, добавив 13,4 г порошка с высоким содержанием глюкозы DMEM и 3,7 г Na2CO3 до 1 л дистиллированной воды в мерном цилиндре с магнитным перемешивающим стержнем, помещенным на мешалку. Перемешайте раствор до тех пор, пока все твердое вещество не растворится, проверьте рН с помощью рН-метра и отрегулируйте его, добавив 1 М NaOH или 1 М HCl (рН 7,3-7,4). После достижения желаемого рН среду фильтруют через вакуумный фильтр 0,22 мкм в стерильном шкафу и хранят при температуре 4 °C.
- Приготовьте полную среду DMEM, добавив 100 мл фетальной бычьей сыворотки (FBS), 10 мл раствора пенициллина-стрептомицина, 10 мл раствора L-глутамина и 10 мл 1 М буфера HEPES к 900 мл основного DMEM. Хранить при температуре 4 °C.
- Приготовьте исходные растворы для исследуемых соединений.
- Для каждого соединения взвесьте две партии по 5,12 мг (например, LMB002) в фотоформе, закрытой кольцом, в две микроцентрифужные пробирки по 1,5 мл (одну с прозрачными, а другую с черными непрозрачными стенками). Весите 2,28 мг положительного контроля (например,.грамицидин S) в сверхпрозрачной стенной трубке. Добавьте 100 мкл чистого ДМСО к каждому образцу и перемешивайте в течение 30 с.
- Фотоизомеризуют исходный раствор (LMB002) в трубке с прозрачной стенкой из «замкнутого кольца» в «кольцево-открытую» форму, облучая раствор лазером с длиной волны 660 нм (плотность мощности света 0,6 Вт/см2) с вихревым перемешиванием для обеспечения тщательного перемешивания. Продолжайте до тех пор, пока цвет заметно не изменится с темно-фиолетового на светло-коричневый. Защищайте от света с помощью алюминиевой фольги.
- Эксперимент с 2D-культурой клеток - посев клеток (день 1)
- Перенесите 10 мл полной среды DMEM из колбы Т-75 с культурой клеток LLC в стерильную пробирку объемом 15 мл. Аспирируйте оставшуюся среду с помощью вакуумного насоса.
- Промойте клеточную культуру 5 мл 1x DPBS и аспирируйте раствор с помощью вакуумного насоса.
- Накройте клетки 3 мл 1x раствора трипсина-ЭДТА и инкубируйте колбу в течение 2-3 мин при 37 ° C в атмосфере 5% CO2 .
- Остановите действие трипсина, добавив 6 мл среды DMEM (предварительно перенесенной в стерильную пробирку) в колбу клеточной культуры, содержащую 1x раствор трипсина-ЭДТА, и несколько раз пипетируя суспензию, чтобы смыть клетки со стенок колбы для клеточной культуры.
- Суспензию переносят в пробирку объемом 15 мл и центрифугу при дозе 200 × г в течение 4 мин. После центрифугирования аспирируйте надосадочную жидкость с помощью вакуумного насоса. Не прикасайтесь к грануле ячейки на дне трубки.
- Ресуспендируйте клетки, добавив 2 мл свежей полной среды DMEM и несколько раз пипетируя.
- Подсчитайте клетки, отбирая около 15 мкл суспензии в пробирку объемом 0,5 мл, добавляя 15 мкл 0,4% трипанового синего и перенося полученную смесь в камеру для подсчета клеток.
- После подсчета приготовьте 25 мл клеточной суспензии за определенный момент времени. Засейте 5 000-10 000 (в среднем 8 000) клеток LLC/лунку в 200 мкл DMEM в центральных 60 лунках 96-луночной пластины с чистым дном и черными непрозрачными стенками. Заполните оставшиеся 36 скважин чистым ДМЭМ.
- Поместите планшеты в инкубатор для клеточных культур на ночь при температуре 37 °C и 5% CO2. Используйте пластиковые крышки под ними, чтобы предотвратить неравномерный нагрев нижней пластины.
- 2D эксперимент по культуре клеток - добавление соединений (день 2)
- Контролируйте клетки с помощью световой микроскопии в планшетах до тех пор, пока клетки не достигнут слияния 70-80%.
- Аспирируйте среду из лунок с помощью вакуумного насоса в стерильном шкафу. Добавьте 100 мкл свежей предварительно разогретой среды DMEM и поместите планшеты в инкубатор клеточных культур.
- Приготовьте серийные разведения исследуемых составов и положительный контроль в полипропиленовых автоклавных прозрачных пластинах. Используйте следующие решения для индивидуальных измерений временных точек:
ПРИМЕЧАНИЕ: Начните с запасов в ДМСО и разбавьте ДМЭМ, но не превышайте 1% об. / об. ДМСО в конечной максимальной концентрации.- Чтобы получить раствор грамицидина S 128 мкМ, добавьте 1,3 мкл исходного раствора 20 мМ к 198,7 мкл DMEM.
- Для получения 256 мкМ раствора LMB002, «кольцево-открытой» формы, добавьте 1,3 мкл раствора 40 мМ к 198,7 мкл DMEM.
- Чтобы получить раствор LMB002 с массой 512 мкМ в форме «замкнутого кольца», добавьте 2,6 мкл исходного раствора 40 мМ к 197,4 мкл ДМЭМ.
- Выполните три дополнительных повторения, чтобы получить четыре подхода каждой точки концентрации. Приготовьте серию двойного разбавления, отсасывая 100 мкл из каждой стартовой лунки, переливая в скважину со 100 мкл DMEM и тщательно перемешивая.
ПРИМЕЧАНИЕ: Работа с фотопереключаемыми соединениями требует регулировки освещения для предотвращения обратной фотоизомеризации. Рекомендуется выключать свет в стерильных шкафах. - Конечные концентрации соединений в лунках (5-150 мкМ) получают путем переноса 100 мкл приготовленных растворов каждый раз в 56 лунок со 100 мкл ранее добавленного ДМЭМ. Добавляйте 100 мкл DMEM каждый раз в четыре лунки, чтобы служить отрицательным контролем.
- Накладки с алюминиевой фольгой или пластиковой защитной непрозрачной крышкой для предотвращения неконтролируемого фотопереключения. Поместите планшеты в инкубатор для клеточных культур при температуре 37 °C (используя дополнительные пластиковые крышки) на выбранное время инкубации (10 мин, 60 мин, 24 ч или 72 ч).
- Эксперимент с 2D-культурой клеток - окрашивание и визуализация (2-5 дни)
- После инкубации с составами в течение разных периодов добавляют по 50 мкл окрашивающего раствора на лунку в пластины, которые инкубировали с составами в течение 10 и 60 мин. Выдерживают пластины при 37 °C в течение 20 мин.
ПРИМЕЧАНИЕ: Готовьте исходные растворы для окрашивания в определенный момент времени, добавляя 8 мкл 20 мМ раствора Hoechst 33342 (конечная концентрация 5 мкМ), 32,5 мкл 1 мМ раствора йодида пропидия (PI) (конечная концентрация составляет 1 мкМ) и 650 мкл нестерильного FBS к 5,810 мкл нестерильного 1x PBS. Предварительно разогрейте FBS и PBS на водяной бане при температуре 37 °C, чтобы предотвратить температурный шок в клетках. - Выполняйте автоматическую флуоресцентную визуализацию с помощью 20-кратного объектива.
- Повторите ту же процедуру окрашивания и визуализации (этапы 1.4.1 -1.4.2) для планшетов, которые инкубировали с соединениями, в течение 24 (3-й день) и 72 (5-й день) ч.
ПРИМЕЧАНИЕ: Типичные 2D-карты плит показаны на рисунке 2.
- После инкубации с составами в течение разных периодов добавляют по 50 мкл окрашивающего раствора на лунку в пластины, которые инкубировали с составами в течение 10 и 60 мин. Выдерживают пластины при 37 °C в течение 20 мин.
- 3D эксперимент с культивированием клеток - посев клеток (день 1)
ПРИМЕЧАНИЕ: Этапы этого раздела идентичны описанным для 2D-эксперимента - подготовка клеточной культуры, инкубация с испытуемыми соединениями и визуализация (этапы 1.1-1.4). Однако в этом случае клетки получают в виде компактных зрелых сфероидов в 384-луночной U-образной пластине со сверхнизкой адгезией и черными непрозрачными стенками. Использование пластины такого размера позволяет сравнивать два соединения в одном эксперименте.- Повторите шаги 1.2.1-1.2.9 из протокола 2D-эксперимента с клеточной культурой LLC.
- После подсчета клеток приготовьте 25 мл клеточной суспензии. Засейте 1,000 клеток на лунку во всех лунках в 50 мкл DMEM в 384-луночной, низкосвязывающей U-образной пластине.
- Центрифугу при 40 × г в течение 30 с и встряхивают пластинчатым шейкером при 250 об/мин в течение 1 мин, чтобы стряхнуть ячейки со стенок лунок на дно.
- Поместите планшеты в инкубатор при температуре 37 °C и 5% CO2 поверх дополнительных пластиковых крышек пластин, чтобы предотвратить неравномерный нагрев дна тарелки в течение 48 часов.
- Эксперимент с 3D-культурой клеток - добавление соединений (день 3)
- Контролируйте клетки в планшетах с помощью микроскопии, чтобы убедиться, что сформировались компактные зрелые сфероиды.
- Приготовьте серийное разведение исследуемых соединений в полипропиленовых автоклавных прозрачных пластинах. В этом случае включите дополнительное соединение. Используйте следующие решения для индивидуальных измерений временных точек:
- Для получения 175 мкМ и 350 мкМ растворов грамицидина S добавляют 1,8 мкл исходного раствора 20 мМ к 198,2 мкл ДМЭМ и добавляют 3,6 мкл сырья к 196,4 мкл ДМЭМ соответственно.
- Для получения 175 мкМ и 350 мкМ растворов LMB002 в форме «кольца-открытия» добавляют 1 мкл исходного раствора 40 мМ к 199 мкл ДМЭМ и добавляют 1,8 мкл исходного раствора к 198,2 мкл ДМЭМ соответственно.
- Для получения 350 мкΜ и 1,750 мкМ растворов LMB002 в «кольцевой закрытой» форме добавляют 1,8 мкл исходного раствора 40 мМ к 198,2 мкл ДМЭМ и добавляют 8,8 мкл исходного материала к 191,2 мкл ДМЭМ соответственно.
- Выполните три дополнительных повторения, чтобы получить четыре набора каждой точки концентрации. Получают последовательные разбавления, извлекая 20 мкл из каждой стартовой лунки, перенося ее в лунку со 180 мкл DMEM и тщательно перемешивая.
ПРИМЕЧАНИЕ: Работа с фотопереключаемыми соединениями требует регулировки освещения для предотвращения обратной фотоизомеризации. Рекомендуется выключать свет в стерильных шкафах. - Получение конечных концентраций соединений в лунках путем переноса 20 мкл приготовленных растворов каждый раз в 128 лунок, содержащих 50 мкл ДМЭМ. Добавляйте 20 мкл DMEM каждый раз в три лунки, чтобы служить контролем. Накройте пластины алюминиевой фольгой или пластиковым защитным покрытием, чтобы предотвратить фотопереключение или испарение.
- Поместите планшеты в инкубатор клеточных культур на пластиковых крышках на выбранное время инкубации.
- Эксперимент с 3D-культурой клеток - окрашивание и визуализация (3-6 дни)
- Готовят окрашивающий раствор за определенный момент времени, добавляя 13 мкл 1 мМ раствора кальцеина AM (конечная концентрация составляет 1 мкМ), 22 мкл 20 мМ раствора Hoechst 33342 (конечная концентрация 33 мкМ), 40 мкл 1 мМ раствора PI (конечная концентрация 3 мкМ), 300 мкл нестерильного FBS к 2,625 мкл нестерильного 1x PBS. Предварительно разогрейте FBS и PBS на водяной бане при температуре 37 °C, чтобы предотвратить температурный шок в клетках.
- После инкубации в течение разных периодов с соединениями добавляют 20 мкл окрашивающего раствора на лунку в лунки, которые инкубировали с соединениями в течение 10 мин. Инкубировать при 37 °C в течение 2 ч.
- Выполните флуоресцентную конфокальную визуализацию с использованием 20-кратного объектива.
- Повторите ту же процедуру окрашивания и визуализации для лунок, которые были инкубированы с соединениями, в течение 24 (4-й день) и 72 (6-й день) ч.
ПРИМЕЧАНИЕ: В этом эксперименте кальцеин AM используется в качестве третьего компонента многоцветного окрашивающего раствора. Изображения, полученные в результате 2D- и 3D-экспериментов, анализируются с помощью программного обеспечения для автоматизированного анализа изображений прибора. Клетки, окрашенные совместно с красителями Хёхста и йодида пропидия, считаются некротически мертвыми, и их фракция в зависимости от концентрации используется для расчета значения IC50 .
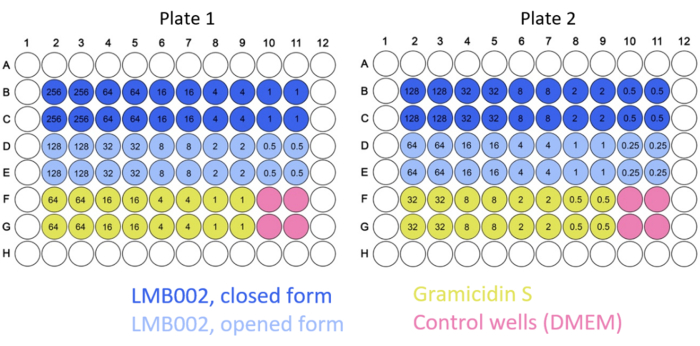
Рисунок 2: Пример типичных карт тарелок для экспериментов с 2D-культивированием. Указаны цветовые коды соединений и контроля. Концентрации испытуемых соединений (числа внутри лунок) указаны в мкМ. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
2. Определение эффективности фотопереключения в тканевом суррогате
- Соберите оптический шлейф для облучения образца, как показано на рисунке 3 (состоящий из оптического кабеля от лазерного источника света, линзы с переменным фокусным расстоянием, шприца с непрозрачной крышкой и плоского отрезанного конца).
- Изменяя фокусное расстояние и апертуру объектива, получают плоский луч света диаметром на 1-1,5 мм больше внутреннего диаметра используемого шприца, но все еще находится в пределах диафрагмы, насколько это возможно.
- Используйте шприц объемом 5 мл со срезанным концом и внутренним диаметром 12,4 мм, закрытый непрозрачной пластиковой крышкой. При выходной мощности лазера 200 мВт установите плотность мощности на выходе оптической системы на уровне ~103 мВт/см2 , измеренную фотометром.
ПРИМЕЧАНИЕ: Все последующие операции необходимо выполнять в затемненном помещении с минимально возможной освещенностью рабочего места. - Приготовьте 3 мл исходного раствора LMB002 (закрытая кольцом) в PBS с концентрацией 1 мг / мл.
- Подготовьте модельный образец ткани, загруженный неактивной фотоформой LMB002 в пластиковый контейнер. В типичном прогоне 5 г свежего свиного фарша механически смешивают с 277 мкл бульонного раствора LMB002 и 260 мкл PBS для достижения конечной концентрации 50 мг/кг в образце и соотношения ткань/ПБС ~9/1 (об./об.).
- Наполните шприц подготовленным образцом, убедившись, что внутри нет пузырьков воздуха, и сформируйте плоскую поверхность на конце экспозиции (среза).
ПРИМЕЧАНИЕ: Цилиндр образца в шприце должен занимать ~40 мм вдоль оси. - Облучают образец в оптическом шлейфе, как показано на рисунке 3 , в течение 9 мин 44 с, что соответствует ~ 60 Дж/см2 экспозиции.
- После воздействия подготовьте срезы образца толщиной 4 мм, оттолкнув его от шприца с помощью поршня и разрезав скальпелем. Взвесьте и поместите срезы в отдельные пробирки и отметьте их по среднему расстоянию (мм) от облучаемой поверхности.
- Приготовьте два контрольных образца (оптимальное количество, 0,5-0,7 г) в пробирках: в одном - мясной фарш, смешанный с 10% (объемом) PBS (54 мкл), а в другом - модельный образец ткани, полученный на этапе 2,4, облучают лазерным светом мощностью 500 мВт в течение 10 мин, чтобы убедиться, что все молекулы LMB002 «замкнуты в кольце» и преобразованы в форму «с открытым кольцом».
- Добавьте смесь ацетонитрила и воды (70% / 30% об. / об., дополненную 0,01% трифторуксусной кислотой (TFA), 1,4 мл / г) к каждому ломтику и контрольным образцам. Тщательно перемешайте содержимое с помощью стеклянной палочки.
- Инкубируют при комнатной температуре в течение не менее 10 мин и центрифугируют смеси при 5220 х г в течение 20 мин или центрифугируют при 20 х г в течение 30 мин два раза для удаления нерастворимого материала и сбора надосадочной жидкости.
- Тщательно соберите надосадочные жидкости (~ 0,7 мл) и снова центрифугируйте их при 16 000 x g в течение 30 мин.
- Соберите надосадочные жидкости (~ 0,5 мл каждый) и проанализируйте их с помощью обращенно-фазовой высокоэффективной жидкостной хроматографии (RP HPLC) с аналитической колонкой C18, линейным градиентом A: B 3,46% B / мин, расходом 2,0 мл / мин и 100 мкл введенного объема. Запишите хроматограммы, обнаруженные УФ-излучением, на длине волны 570 нм (обнаружение формы «кольцо закрыто») и 270 нм (обнаружение формы «кольцо открыто»). Используйте необлученные (этап 2.4) и облученные контрольные (этап 2.8) образцы для определения удельного времени удержания обеих фотоформ (элюент А: водный 0,1% ТФК; элюент В: 90% ацетонитрил-вода, 0,1% ТФК) и калибровка метода.
- Определяют фактические количества фотоформ LMB002 в анализируемых образцах с помощью калибровочных кривых, полученных путем взятия и анализа хроматограмм растворов LMB002 известных концентраций. Для калибровки приготовьте растворы LMB002 с закрытым кольцом, разбавив исходный раствор (этап 2.3) смесью ацетонитрила и воды (70%/30% об./об., дополненные 0,01% ТЖК) для получения 0,36, 0,9 и 3,6 мкг на 100 мкл (вводимый объем); Градиент элюента и скорость потока такие же, как и на шаге 2.12.
- Повторите эксперимент (шаги 2.4-2.12) три раза и нанесите нормализованный процент каждой фотоформы на график (процент) по отношению к расстоянию (от поверхности облученной ткани). Рассчитайте статистику (т.е. стандартное отклонение в каждой точке концентрации).
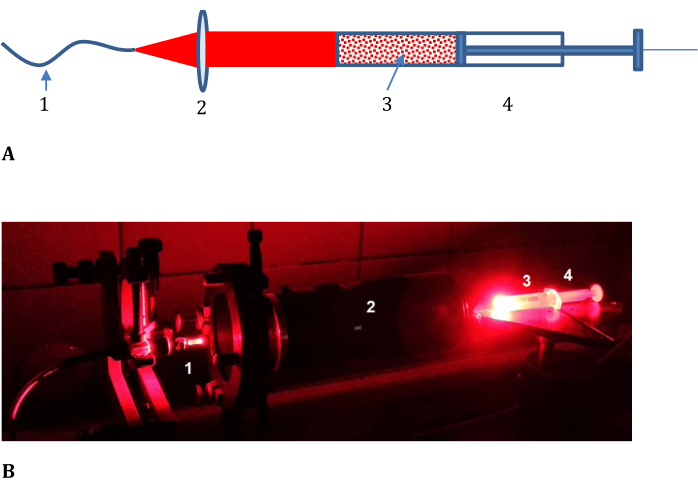
Рисунок 3: Экспериментальная установка для определения эффективности фотоконверсии в модельной ткани. а) схематическая и б) фотография; 1, оптический кабель от лазерного источника света; 2, объектив с переменным фокусным расстоянием; и 3, солевая смесь с мясным фаршем и фосфатом LMB002, помещенная в 4, шприц с непрозрачной крышкой и разрезанным передним концом (показан в (B) без крышки). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
3. Определение противоопухолевой эффективности in vivo
ПРИМЕЧАНИЕ: График эксперимента и конечные точки показаны на рисунке 4. Стандарты ухода за животными в период последующей обработки должны соответствовать правилам 3R - содержание должно включать надлежащую плотность клеток и наличие ресурсов. По возможности придерживайтесь неагрессивных методов обращения с животными, таких как туннель или банки.
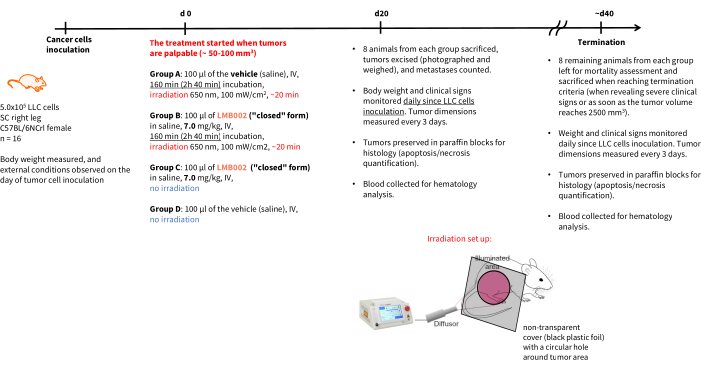
Рисунок 4: График терапевтического эксперимента in vivo . Назначение экспериментальных групп, детали терапии, конечные точки и графики патологоанатомического анализа. Сокращения: LLC = карцинома легкого Льюиса; IV = внутривенно; SC = подкожно. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Подготовка раковых клеток к подкожной инокуляции (0-й день).
- Прохождение клеток LLC в DMEM (4,5 г / л глюкозы) с 10% FBS, 100 ЕД / мл пенициллина и 100 мкг / мл стрептомицина при 37 ° C и 5% CO2.
- Собирают клетки, используя 0,05% раствор трипсина-ЭДТА, центрифугу и суспензию в ДМЭМ без сыворотки.
- Подсчитайте клетки и определите их жизнеспособность с помощью гемоцитометра и теста на исключение трипанового синего.
- Приготовьте конечную клеточную суспензию с концентрацией 10 ×10,6 клеток/мл в смеси DMEM и Matrigel (1:1). Держите суспензию на льду перед инъекцией.
- Инокуляция клеток LLC (день 0)
- Поместите взрослую самку мыши C57BL/6NCrl (весом ~ 20 г) в индукционную камеру аппарата для изофлурановой анестезии. Проведите седацию на 5% изофлурана и подождите, пока животное полностью не потеряет сознание.
- Удалите мех из области прививки клеток путем бритья.
- Инокулируйте 5 × 10клеток 5 LLC в ~ 100 мкл смеси DMEM: Matrigel (1:1) в правую заднюю конечность.
ПРИМЕЧАНИЕ: По возможности придерживайтесь практики использования одной иглы.
- Введение соединений и фотооблучение
ПРИМЕЧАНИЕ: Через 5-8 дней после прививки животные готовы к лечению, когда их опухоли пальпируются и достигают объема ~50-100мм3 . Все последующие операции с ЛМБ002 и мышами, обработанными этим составом, выполняйте в полутемных условиях (одна светодиодная лампа мощностью 4 Вт на расстоянии не менее 5 м от рабочего места).- Растворяют LMB002 (форма с закрытым кольцом) в стерильном физиологическом растворе в концентрации 1 мг/мл в дозе 5 мг/кг (в/в) до получения однородных растворов темно-синего цвета.
- Перед облучением хаотично соберите четыре группы по восемь животных и удалите шерсть с опухоли и близлежащих участков путем бритья.
- Поместите мышь в держатель для внутривенных инъекций и предварительно разогрейте хвост животного на водяной бане при температуре 37 ° C, чтобы была видна хвостовая вена.
ПРИМЕЧАНИЕ: Рассмотрите возможность предоперационной анальгезии. - Введите соединение в дозе 5 мл / кг в хвостовую вену. Для двух контрольных групп вводят 100 мкл физиологического раствора (внутривенно) на животное (20 г массы тела). Убедитесь, что животные в двух экспериментальных группах получают испытуемое соединение в неактивной фотоформе (1 мг / мл в физиологическом растворе).
ПРИМЕЧАНИЕ: По возможности придерживайтесь практики использования одной иглы. - Затем, через 2 ч 45 мин после инъекции соединения, поместите мышь под наркоз. Индуцировать седацию 3%-4% изофлураном в кислороде. Поддерживайте анестезию в течение 15 мин с 0,5%-1% изофлураном в кислороде.
- Накройте мышь черной маской, имеющей отверстие, подвергающее свету только область опухоли.
- Включите лазерный диодный модуль с помощью лазера с длиной волны 650 нм и установите мощность красного лазера на 200 мВт, а синего/УФ-направляющего лазера на 2 мВт.
ПРИМЕЧАНИЕ: Используйте синие защитные очки, когда лазерное устройство включено. - Измерьте световой поток от красного лазера (вдали от мышей) с помощью фотометра и определите расстояние от оптического кабеля, где световой поток составляет 100 мВт/см2. Закрепите кабель на подставке, чтобы убедиться, что источник света находится на определенном расстоянии от опухоли, а свет покрывает всю область опухоли. Во время этой процедуры используйте синий/ультрафиолетовый направляющий лазерный луч.
- Включите красный лазер, чтобы облучать область опухоли в течение 20 минут.
- После облучения выключите поток изофлурана, верните животное в клетку и внимательно наблюдайте за его состоянием в течение следующих 30 мин.
ПРИМЕЧАНИЕ: После введения соединения держите мышей в темноте в течение 2 дней. Должен быть изменен только цикл светового дня; Все остальные жилищные условия должны остаться неизменными.
- Наблюдения за последующей обработкой
- Ежедневно наблюдайте за животными и измеряйте вес и размеры их опухолей. Измерьте объем опухоли и отметьте прогрессирование некроза.
ПРИМЕЧАНИЕ: Стандарты ухода за животными в период последующей обработки должны соответствовать правилам 3R - содержание должно включать надлежащую плотность клеток и наличие ресурсов. - Используйте данные, собранные на предыдущем шаге, для оценки смертности. Определяют выживаемость с помощью стандартной процедуры.
ПРИМЕЧАНИЕ: Животные должны быть принесены в жертву и считаться мертвыми при выявлении тяжелых клинических признаков (потеря массы тела более 15%, изъязвление опухоли не заживает в течение 7 дней и вокализация) или как только объем опухоли достигнет 2,500мм3.
- Ежедневно наблюдайте за животными и измеряйте вес и размеры их опухолей. Измерьте объем опухоли и отметьте прогрессирование некроза.
Результаты
В этой работе были проведены эксперименты с 2D и 3D клетками для определения IC50 для «кольцево-замкнутых» и «кольцево-открытых» форм LMB002 (см. рис. 1) в разное время инкубации. Эти значения сравнивали с значениями, полученными для прототипа пептида грамицидина S (используемого в качестве положительного контроля). Типичный набор изображений инкубации в 2D-выращенной культуре LLC после окрашивания показан на рисунке 5. Совместное окрашивание с Hoechst 33342 (синий) и йодидом пропидия (красный), приводящее к различным оттенкам фиолетового в большей части клеток в случае обработки «кольцево-открытой» формой по сравнению с «кольцево-закрытой», указывает на заметную разницу в цитотоксичности между двумя формами, которая может быть легко количественно определена. Продемонстрированный пример успешного эксперимента основан на данных, собранных с использованием формата 96-луночного планшета, куда были добавлены варианты пептидов в различных концентрациях, как показано на рисунке 2. Аналогичные данные могут быть получены с помощью 384-луночных и высокоплотных пластин. Однако, поскольку объемы на скважину уменьшаются, технические и систематические погрешности и, как следствие, точность определения IC50 будут снижаться с увеличением плотности скважины.
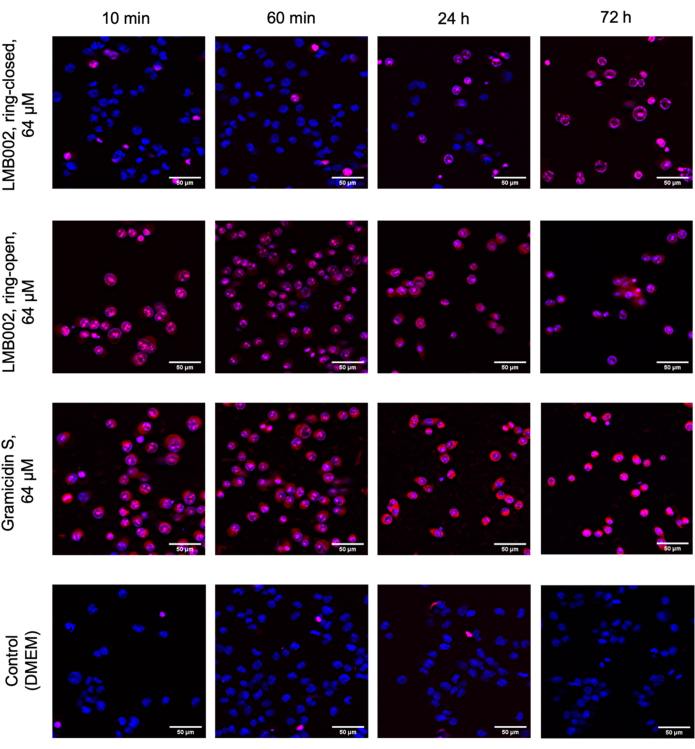
Рисунок 5: Репрезентативные изображения из анализа цитотоксичности в ООО, выращенном в монослое. Клетки окрашивали препаратами Hoechst 33342 (синий) и йодид пропидия (красный). Указанное время: 10 мин, 60 мин, 24 ч и 72 ч - время инкубации соединений. Масштабные линейки = 50 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Фотоконверсию LMB002 лазерным световым облучением в модельной ткани – свежем свином фарше – определяли с помощью образца, составленного из фарша, смешанного с растворенной в PBS «кольцево-закрытой» (неактивной) формой LMB002, и измеряли превращение этой неактивной формы в «кольцевую» (активированную) форму LMB002 в направлении распространения излучения. Образец помещали в шприц и облучали с одной стороны плоским пучком лазерного излучения в течение времени экспозиции ~10 мин (обычно используется в экспериментах in vivo ), как показано на рисунке 3. После экспонирования цилиндр образца делили на части, нажимая на поршень шприца и скальпелем разрезая срезы одинаковой высоты. Концентрацию LMB002 «разомкнутое кольцо» в экстрактах из срезов определяли с помощью РП ВЭЖХ.
На рисунке 6 показаны кривые доза-эффект (рисунок 6A-D), полученные в результате анализа данных. Чтобы определить процент мертвых клеток с ядерным совместным окрашиванием красителей Hoechst 33342 и PI, мы использовали встроенный классификатор, который устанавливает числовые пороги по выбранным измеряемым параметрам, чтобы разделить все количество клеток на несколько категорий. Например, когда сигнал красного канала (йодид пропидия) в контроле был на пороге (приблизительно 110-130 единиц), клетки можно было классифицировать как PI-положительные, считающиеся мертвыми, или PI-отрицательные, считающиеся не затронутыми соединениями. Для LMB002 можно увидеть сигмоидальные зависимости процентного содержания йодид-положительных клеток пропидия от концентрации соединения. По этим данным можно определить значения IC50.
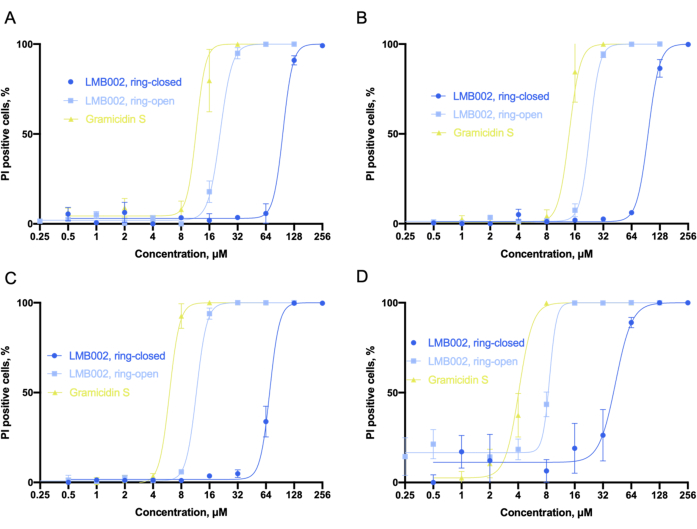
Рисунок 6: Анализ цитотоксичности в 2D-культуре. Сигмовидные фити, полученные в культуре LLC, в течение (A) 10 мин, (B) 60 мин, (C) 24 ч и (D) 72 ч - интервалов времени, взятых для инкубации с соединениями. Фитинг позволяет точно определять значения IC50 (не показаны). Полосы погрешностей - SEM. Аббревиатуры: LLC = карцинома легкого Льюиса; PI = йодид пропидия. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Рассматривая полученные значения IC50 , можно сделать вывод, что токсичность всех трех соединений увеличивалась со временем инкубации. Наш эксперимент показал, что «кольцевая» форма LMB002 примерно на одну стадию разведения менее токсична, чем прототип пептида, грамицидин S. Тогда как «кольцево-закрытая» форма демонстрирует на три-четыре стадии разведения более низкую токсичность, которая увеличивается со временем инкубации. Разница между двумя стадиями разведения не зависит от увеличения времени инкубации и может быть использована численно в качестве экспериментально определенного фототерапевтического окна6 для сравнения с другими соединениями в потенциальном библиотечном скрининге. Значение IC50 для грамицидина S было установлено в качестве контрольной точки для исправления экспериментальных ошибок или дифференциальных выходов в биологических репликах.
Эксперименты с 3D-клетками дали тот же тип исходных данных - одноразовые изображения сфероида с разрешением одной ячейки. Включение кальцеина в качестве третьего окрашивающего красителя позволяет количественно определить фракцию метаболически активных клеток (наблюдаемую в зеленом канале). Используя 384-луночные планшеты, увеличивая количество технических повторений, исключая избыточные временные точки совместной инкубации и изменяя складку разбавления, мы смогли напрямую сравнить несколько соединений в одном тестовом прогоне (с использованием одной пластины), как показано на карте пластин на рисунке 7.
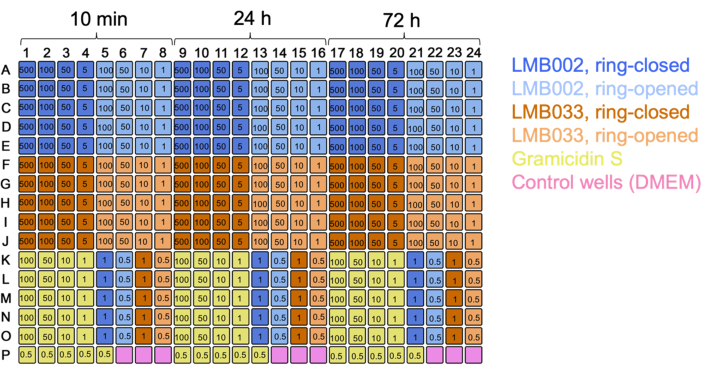
Рисунок 7: Карта планшетов для эксперимента с 3D-культурой с двумя соединениями. Указаны цветовые коды соединений и контроля. Числа в лунках представляют собой концентрации в мкМ. 10 мин, 24 ч и 72 ч - время инкубации. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
На рисунке 8 представлены изображения выбранных технических реплик сфероидов LLC, выращенных при плотности 1 сфероид/лунка в присутствии испытуемых соединений и контрольных сфероидов, захваченных после окрашивания.
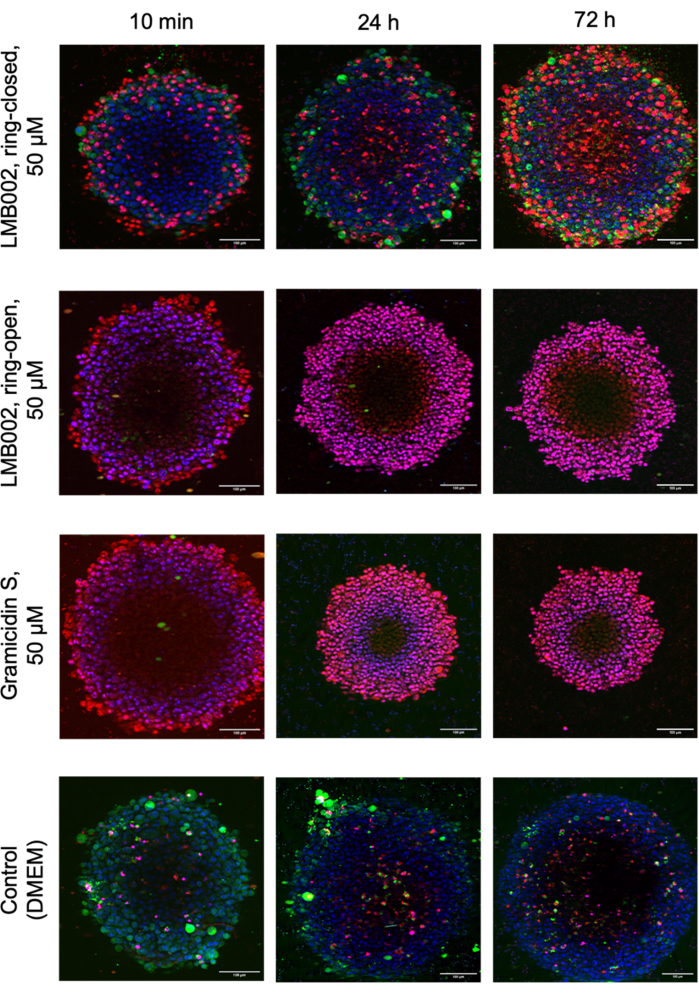
Рисунок 8: Репрезентативные изображения из анализа цитотоксичности 3D-культуры. На изображениях показаны 48-часовые сфероиды LLC, окрашенные Hoechst 33342 (синий), кальцеин AM (зеленый) и йодид пропидия (красный) после 10-минутной, 24-часовой и 72-часовой совместной инкубации с фотоформами LMB002 и грамицидином S. Масштабные линейки = 100 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
С помощью программного обеспечения прибора кривые доза-эффект, как и в 2D-эксперименте, были получены из z-сложенных стопок изображений (рис. 9A). Кроме того, компактные и недеформированные сфероиды в 3D-культурах могут быть охарактеризованы диаметром цельного сфероида (рис. 9B). Было также отмечено, что общий диаметр сфероида изменяется в зависимости от концентрации соединения.
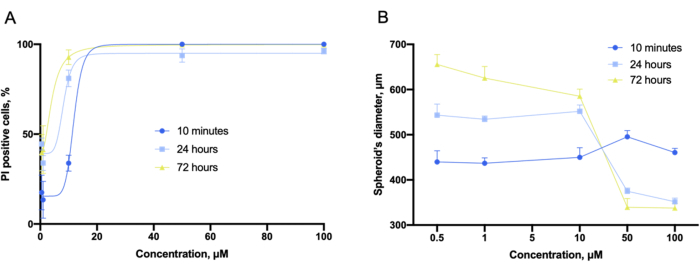
Рисунок 9: Оценка цитотоксичности с помощью 3D-культур. (A) Концентрационно-зависимые кривые цитотоксичности и (B) концентрационно-зависимые графики диаметра сфероида, полученные в 3D-культурах LLC, инкубированных совместно с грамицидином S в течение 10 мин, 24 ч и 72 ч и захваченных перед окрашиванием. Полосы погрешностей - это SEM. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Эксперимент на этапе 2 позволяет определить концентрации LMB002 в обеих фотоформах с помощью высокоэффективной жидкостной хроматографии с УФ-детектированием. Эффективность фотоконверсии в модельных тканях была легко оценена и количественно определена с использованием этой установки (рис. 3). Данные были получены в результате количественного анализа хроматограмм экстрактов образцов. В этих тестовых экспериментах хроматограммы LMB002 были обнаружены спектроскопически на длине волны 270 нм и 570 нм. При длине волны 270 нм наблюдалось много дополнительных сигналов, которые приписывались соединениям, совместно извлеченным из модельной ткани (проверено по контрольному экстракту без соединения). Обе фотоформы были достаточно разными по времени удержания и поглощению. Однако сигнал LMB002 «разомкнутое кольцо» был отделен от этих фоновых сигналов базовой линией (см. репрезентативную хроматограмму на рисунке 10A). Поэтому этот сигнал может быть интегрирован без проблем. При длине волны 570 нм хроматограммы содержали только сигнал LMB002 в форме «замкнутого кольца» (рис. 10B). Здесь мы выполнили определение концентрации с помощью RP ВЭЖХ. Тем не менее, еще более высокая точность и более низкие пределы обнаружения могут быть достигнуты с помощью LC/MS в качестве аналитического метода.
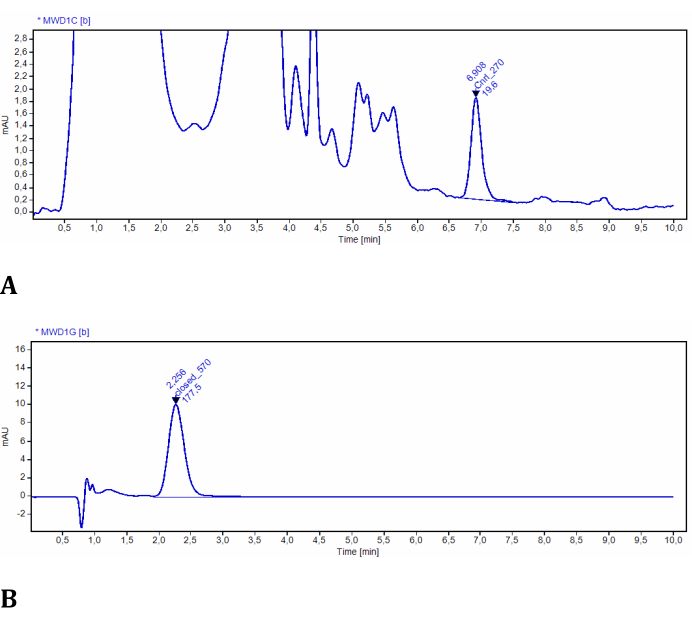
Рисунок 10: Репрезентативные хроматограммы LMB002, выделенные из модельных тканей. (A) Образец на расстоянии 2 мм от облученной поверхности, зарегистрированный на длине волны 270 нм (интегрирована «кольцевая» форма LMB002); (B) образец на расстоянии 38 мм от облучаемой поверхности, зарегистрированный на длине волны 570 нм (интегрирован пик LMB002 «замкнутого кольца»). Значения времени удержания (указанные) дополнительно подтвердили идентичность соединения. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Данные, полученные после интегрирования соответствующих сигналов всех собранных образцов, были использованы для построения графиков «концентрация-глубина», как показано на рисунке 11. На основе этих графиков была легко оценена эффективность фотоконверсии на разных глубинах модельной ткани. Это подтверждает, что наш источник красного света индуцирует фотоконверсию LMB002 с «замкнутым кольцом» на глубине до 1 с, в тканевом суррогате, мясном фарше (примерно 103 мВт/см2).
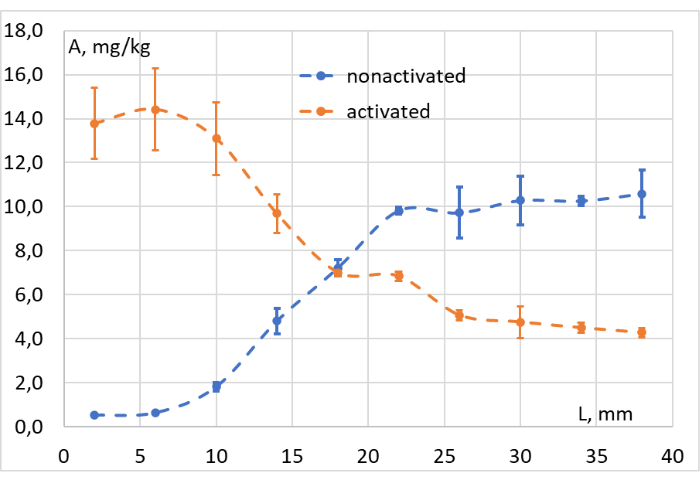
Рисунок 11: Оценка эффективности фотоконверсии. Концентрация (А, мг/кг) ЛКМ002 «кольцево-замкнутых» (неактивированные, синие точки) и «кольцево-открытых» форм (активированные, оранжевые точки) на разном расстоянии от облучаемой поверхности модельной ткани (L, мм). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Результаты эксперимента in vivo - шага 3 нашей методики, выполненного по графику, представленному на рисунке 4, - были представлены графиками, показывающими рост опухоли в зависимости от времени (рис. 12) и кривыми выживаемости Каплана-Мейера (рис. 13).
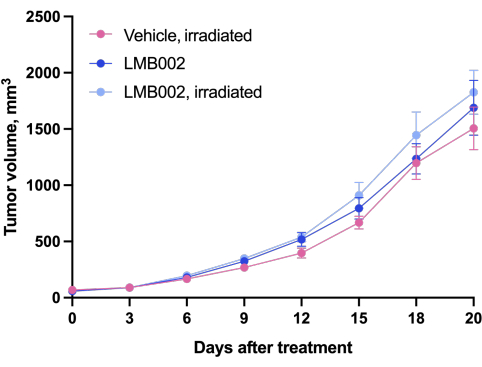
Рисунок 12: Динамика роста опухоли у животных. Животные, получавшие LMB002, по сравнению с животными, получавшими транспортное средство (подкожная модель аллотрансплантата LLC у мышей C57BL/6NCrl, составная доза 7 мг/кг, внутривенно, инкубация 2 ч 40 мин, затем облучение при 650 нм, 100 мВт/см2, 20 мин). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
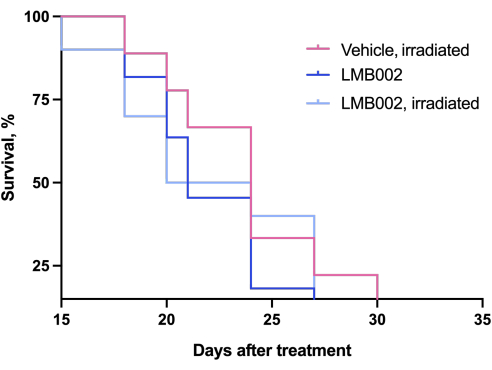
Рисунок 13: Кривые смертности животных. Животные, получавшие LMB002, по сравнению с животными, получавшими транспортное средство (подкожная модель аллотрансплантата LLC у мышей C57BL/6NCrl, составная доза 7 мг/кг, внутривенно, инкубация 2 ч 40 мин, затем облучение при 650 нм, 100 мВт/см2, 20 мин). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Фотоконтролируемые соединения являются беспрецедентными в разработке лекарств; Однако не было установлено никаких методов для их доклинической и клинической оценки. Ближайший аналог монотерапии, фотодинамическая терапия (ФДТ), является методом лечения для клинического применения, принятым во многих странах против рака, и находится в разработке для других показаний19,20. Подобно фотофармакологии, ФДТ также основана на использовании света для активации биологически активного вещества (синглетного кислорода). Таким образом, некоторые экспериментальные методы, используемые для доклинических и клинических исследований при ФДТ, могут быть приняты для фотофармакологии. Например, источники света, подходы к подаче света и медицинские устройства хорошо разработаны и одобрены для ФДТ; Они могут быть непосредственно использованы для оценки фотоконтролируемых препаратов. Однако ФДТ и фотофармакология имеют много отличий друг от друга4, что обосновывает необходимость установления специфических методов для последней.
Во-первых, неактивированное вещество в ФДТ (кислороде) всегда присутствует в живых тканях в нетоксичных концентрациях. Напротив, неактивированные фотоконтролируемые биологически активные соединения могут иметь остаточную активность и нежелательную токсичность. Следовательно, идеальные фотофармакологические препараты должны иметь минимизированную биологическую активность в вводимой форме и должны быть высокоактивными в своей светогенерируемой форме, «фототерапевтическое окно»21 должно быть как можно больше. Поиск попадания и выполнение оптимизации «попадание в свинец» требует идентификации подходящих соединений и скрининга относительно больших библиотек уже на ранних стадиях разработки лекарств. Здесь мы предложили автоматизированную высокопроизводительную конфокальную флуоресцентную микроскопию для идентификации эффективных фотокоммутационных соединений.
Выбранный метод оценки цитотоксичности позволяет легко реализовать наиболее критическое требование - поддержание PSS или стабильности видимого светочувствительного фотоизомера. Это связано с тем, что при его реализации воздействие света сводится к минимуму. Следовательно, при выборе альтернативных методов следует отдавать предпочтение автоматизированным. Такой подход надежен и информативен. Использование 3D-клеточных культур (сфероидов) на этом этапе обеспечивает целостное понимание реакции клетки на лечение в более реалистичном тканеподобном микроокружении. Кроме того, ценная информация о механизме действия соединений может быть получена с помощью микроскопии в качестве прямого метода. Конфокальная флуоресцентная микроскопия с надлежащим протоколом окрашивания позволяет визуально оценить морфологию клеток и сфероидов; Также могут быть обнаружены важные детали гибели клеток и изменений внутри клеток.
Во-вторых, легкое нанесение требует тщательного подбора легкой дозировки. При ФДТ передозировка света чрезвычайно вредна для тканей22. Фотофармакологическая терапия может быть полезна при чрезмерном облучении светом. Верхний предел действия активированного вещества определяется введенной дозой неактивированного вещества и его фармакокинетикой. Тем не менее, легкая дозировка по-прежнему является проблемой в фотофармакологии. Следует позаботиться о том, чтобы плотность мощности облучения и время воздействия были не меньше , чем требуется для терапии. В принципе, генерацию активированного вещества можно контролировать in vivo. Однако из соображений биоэтики мы предложили эксперимент с модельной тканью (свежим фаршем), смешанной с неактивированным соединением15. Этот эксперимент прост и может быть модифицирован для использования различных источников света. Он также может быть адаптирован для фотофизической оценки дозировки света и измерения тепловых воздействий. Опять же, используя модельные ткани, можно свести к минимуму воздействие света, по сравнению, например, с более точным определением эффективности фотопереключения в условиях in vivo , альтернативой, которую всегда может быть интересно рассмотреть.
Наконец, соединения, которые демонстрируют превосходные характеристики в скринингах токсичности in vitro и эффективно переключаются на глубину не менее 1-1,5 см в модельной ткани, могут быть выбраны для дорогостоящих, трудоемких и длительных исследований in vivo . В этом протоколе мы использовали ту же клеточную линию (LLC), что и в оценке in vitro , для создания модели рака аллотрансплантата. Динамика роста опухоли, смертность и количество метастазов являются параметрами, наиболее подходящими для оценки противоопухолевой эффективности. По сравнению с обычной химиотерапией, в фотофармакологическом лечении применяется дополнительный фактор – свет. Следовательно, необходимы две группы контрольных животных: одна, которая получает только транспортное средство, и другая, которая получает транспортное средство и облучение. Эта установка позволяет оценить влияние света на измеряемые параметры. В нашем эксперименте животные двух экспериментальных групп получали неактивированное соединение, а опухоли мышей в одной группе облучали. Режим облучения был идентичен для контрольной и лечебной групп. Сравнение с эталонной химиотерапией на данном этапе не требуется, поскольку основная цель эксперимента - продемонстрировать комбинированный эффект применения света и соединения. Наиболее эффективные соединения, демонстрирующие этот эффект, затем могут быть выбраны для дальнейшего изучения их токсичности in vivo и сравнения с контрольными показателями для принятия важных решений по их разработке. Технически эксперимент in vivo , который мы описываем, может быть легко адаптирован к фармакокинетическим или фармакодинамическим исследованиям, например, соединения, которое уже выбрано в качестве лекарственного средства.
Раскрытие информации
IVK, OB, SA и ASU являются изобретателями по семейству выданных патентов: «Пептидомиметики, обладающие фотоконтролируемой биологической активностью» (WO2014127919 [A1], EP2958934 [B1], US9481712 [B2], UA113685 [C2]) с лицензией Lumobiotics GmbH. IVK, OB, TS и SA являются учредителями и акционерами Lumobiotics GmbH. IVK является научным консультантом, HK, TM, IP и PB являются сотрудниками ООО «Энамин». Авторы не имеют никаких других соответствующих связей или финансового участия в какой-либо организации или организации, имеющей финансовую заинтересованность или финансовый конфликт с предметом или материалами, обсуждаемыми в публикации, кроме раскрытых.
Благодарности
Авторы признают финансирование ЕС программой H2020-MSCA-RISE через проекты PELICO (#690973) и ALISE (#101007256). Эта работа была поддержана DFG-GRK 2039 (SA, TS и ASU), программой NACIP Общества им. Гельмгольца (SA и ASU) и VIP+ BMBF (OB и ASU). Мы благодарим доктора Сергея Конева из Технологического института Карлсруэ, который синтезировал соединение LMB002, очистил его и любезно предоставил соединение для исследования. Авторы также благодарят Чуприну Максима, который снял и собрал видео в Украине, и всех отважных защитников Украины, которые сделали возможной экспериментальную работу, написание и съемку этой публикации.
Материалы
| Name | Company | Catalog Number | Comments |
| Agilent 1100 Series capillary LC system | ALSI-Chrom (Agilent distributor) | - | |
| ATCC CRL-1642, LL/2 (LLC1) Lewis lung carcinoma cell line | ECACC | 90020104 | |
| C57BL/6NCrl mice, female, inbred | Charles River | Strain code: 027 | |
| CelCulture, CO2 incubator | Esco Micro | CCL-170B | |
| Corning Matrigel Basement membrane matrix | Merck | CLS354234 | |
| Corning, 384- well spheroid microplates | Merck | CLS3830 | |
| Fetal bovine serum | Merck | F7524 | |
| Gibco, DPBS | Thermo Fisher Scientific | 21600044 | |
| Gramicidin S | Lumobiotics | Custom synthesis | |
| HyClone, DMEM/high glucose | Cytiva | SH30003.04 | |
| IN Cell Analyzer 6500HS, imaging system | Cytiva | 29240358 | |
| Invitrogen, Calcein AM | Thermo Fisher Scientific | C1430 | |
| Isoflurane anesthesia machine | ASA | S/N ASA 1305 | |
| L-glutamine, 200 mM solution | Merck | G7513 | |
| LIKA-surgeon, diode surgery laser | Fotonika plus | - | |
| LMB002 | Lumobiotics | Custom synthesis | |
| Penicillin–Streptomycin, solution stabilized | Merck | P4333 | |
| PhenoPlate, 96-well plates | PerkinElmer | 6055302 | |
| Photometer PCE-LED 20 | PCE Instruments | PCE-LED 20 | |
| Thermo Scientific, Hoechst 33342 | Thermo Fisher Scientific | 62249 | |
| Thermo Scientific, Propidium iodide | Thermo Fisher Scientific | J66764-MC | |
| Trypan blue, 0.4% solution | Merck | T8154 | |
| Trypsin–EDTA, 10 x solution | Merck | T4174 | |
| UltraCruz Cell culture flasks with vented caps, 75 cm2 | Santa Cruz Biotechnology | sc-200263 | |
| UltraCruz, bottle top filters, PES, 0.22 μm | Santa Cruz Biotechnology | sc-360882 | |
| Vydac 218TP, C18 HPLC column (4.6 mm × 250 mm, 5 µm) | Altmann Analytik (Avantor distributor) | GR5103827 |
Ссылки
- Fuchter, M. J. On the promise of photopharmacology using photoswitches: a medicinal chemist's perspective. Journal of Medicinal Chemistry. 63 (20), 11436-11447 (2020).
- Volarić, J., Szymanski, W., Simeth, N. A., Feringa, B. L. Molecular photoswitches in aqueous environments. Chemical Society Reviews. 50, 12377-12449 (2021).
- Paoletti, P., Ellis-Davies, G. C. R., Mourot, A. Optical control of neuronal ion channels and receptors. Nature Reviews Neuroscience. 20, 514-532 (2019).
- Hüll, K., Morstein, J., Trauner, D. In Vivo Photopharmacology. Chemical Reviews. 118 (21), 10710-10747 (2018).
- Ma, X., et al. In vivo photopharmacology with a caged mu opioid receptor agonist drives rapid changes in behavior. Nature Methods. 20, 682-685 (2023).
- Sarabando, S. N., Palmeira, A., Sousa, M. E., Faustino, M. A. F., Monteiro, C. J. P. Photomodulation Approaches to Overcome Antimicrobial Resistance. Pharmaceuticals. 16 (5), 682(2023).
- Kolarski, D., Szymanski, W., Feringa, B. L. Chronophotopharmacology: Methodology for high spatiotemporal control over the circadian rhythm with light. Neuromethods. Hirota, T., Hatori, M., Panda, S. 186, Humana, New York, NY. (2022).
- Babii, O., et al. Peptide drugs for photopharmacology: how much of a safety advantage can be gained by photocontrol. Future Drug Discovery. 2 (1), FDD28(2020).
- Davis, A. M., Keeling, D. J., Steele, J., Tomkinson, N. P., Tinker, A. C. Components of successful lead generation. Current Topics in Medicinal Chemistry. 5 (4), 421-439 (2005).
- Balani, S. K., Miwa, G. T., Gan, L., Wu, J., Lee, F. W. Strategy of utilizing in vitro and in vivo adme tools for lead optimization and drug candidate selection. Current Topics in Medicinal Chemistry. 5 (11), 1033-1038 (2005).
- Kleijn, A., et al. A Systematic comparison identifies an ATP-based viability assay as most suitable read-out for drug screening in glioma stem-like cells. Stem Cells International. 2016, (2016).
- Rodrigues, J., Heinrich, M. A., Teixeira, L. M., Prakash, J. 3D in vitro model revolution: unveiling tumor-stroma interactions. Trends in Cancer. 7 (3), 249-264 (2021).
- Sittinger, M., et al. Tissue engineering and autologous transplant formation: practical approaches with resorbable biomaterials and new cell culture techniques. Biomaterials. 17 (3), 237-242 (1996).
- Matai, I., Kaur, G., Seyedsalehi, A., McClinton, A., Laurencin, C. T. Progress in 3D bioprinting technology for tissue/organ regenerative engineering. Biomaterials. 226, 119536(2020).
- Babii, O., et al. Direct photocontrol of peptidomimetics: an alternative to oxygen-dependent photodynamic cancer therapy. Angewandte Chemie International Edition. 55 (18), 5493-5496 (2016).
- De Ridder, K., et al. Novel 3D lung tumor spheroids for oncoimmunological assays. Advanced NanoBiomed Research. 2 (4), 2100124(2022).
- Pauli, C., et al. Personalized in vitro and in vivo cancer models to guide precision medicine. Cancer Discovery. 7 (5), 462-477 (2017).
- Van Straten, D., Mashayekhi, V., De Bruijn, H. S., Oliveira, S., Robinson, D. J. Oncologic photodynamic therapy: basic principles, current clinical status and future directions. Cancers. 9 (2), 19(2017).
- Li, X., Kwon, N., Guo, T., Liu, Z., Yoon, J. Innovative strategies for hypoxic-tumor photodynamic therapy. Angewandte Chemie International Edition. 57 (36), 11522-11531 (2018).
- Hull, K., Morstein, J., Trauner, D. In vivo photopharmacology. Chemical Reviews. 118 (21), 10710-10747 (2018).
- Babii, O., et al. Structure-activity relationships of photoswitchable diarylethene-based β-hairpin peptides as membranolytic antimicrobial and anticancer agents. Journal of Medicinal Chemistry. 61 (23), 10793-10813 (2018).
- Heckl, C., Aumiller, M., Rühm, A., Sroka, R., Stepp, H. Fluorescence and treatment light monitoring for interstitial photodynamic therapy. Photochemistry and Photobiology. 96 (2), 388-396 (2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены