Method Article
In-vitro - und In-vivo-Evaluierung photokontrollierter biologisch aktiver Substanzen - potenzielle Wirkstoffkandidaten für die Krebspharmakologie
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Dieses Protokoll stellt eine Reihe von Experimenten vor, die für die Evaluierung von photoschaltbaren Antikrebspeptiden verwendet wurden, die für das präklinische Screening solcher Verbindungen verwendet werden können. Dazu gehören die Bewertung der Zytotoxizität in 2D- und 3D-Zellkulturen, die Bewertung der Ex-vivo-Photoisomerisierungseffizienz (Modellgewebe) und der In-vivo-Wirksamkeit.
Zusammenfassung
Photokontrollierte, biologisch aktive Verbindungen sind eine aufstrebende Klasse von "intelligenten" Wirkstoffkandidaten. Zusätzliche Sicherheit in der systemischen Chemotherapie bieten sie durch ihre präzise raumzeitliche Aktivierung, indem sie ein gutartiges, nicht ionisierbares Licht auf eine bestimmte Stelle im Körper des Patienten lenken. In dieser Arbeit wird eine Reihe von Methoden vorgestellt, um die in vitro Potenz und ex vivo Effizienz der Photoaktivierung von photokontrollierten, biologisch aktiven Verbindungen sowie die in vivo Wirksamkeit in frühen Stadien der Arzneimittelentwicklung zu bewerten. Die Methodik wird auf zytotoxische Peptide gegen Krebs angewendet, nämlich auf die Diarylethen-haltigen Analoga eines bekannten Antibiotikums, Gramicidin S. Die Experimente werden mit 2D- (adhärente Zellen) und 3D-Zellkulturen (Sphäroide) einer Krebszelllinie (Lewis-Lungenkarzinom, LLC), Lebendgewebe-Surrogate (Schweinefleischhack) und einem Allotransplantat-Krebsmodell (subkutane LLC) in immunkompetenten Mäusen durchgeführt. Die Auswahl der wirksamsten Verbindungen und die Abschätzung realistischer phototherapeutischer Fenster erfolgen mittels automatisierter Fluoreszenzmikroskopie. Die Photoaktivierungseffizienz bei unterschiedlichen Beleuchtungsregimen wird in unterschiedlichen Tiefen in einem Modellgewebe bestimmt, und die optimale Lichtdosis wird im abschließenden therapeutischen In-vivo-Experiment angewendet.
Einleitung
Photokontrollierte biologisch aktive Verbindungen haben sich in den letzten Jahrzehnten als vielversprechender Bestandteil sicherer Chemotherapien für menschliche Krankheiten und zur gezielten Eradikation bösartiger solider Tumore herausgestellt1. Diese Verbindungen enthalten reversibel photoisomerisierbare Fragmente (molekulare Photoschalter) und können bei Bestrahlung mit Licht unterschiedlicher Wellenlängen zwischen inaktiven und aktiven Photoisomeren umschalten.
Im Vergleich zu ihren nicht photokontrollierbaren Analoga können photogesteuerte Medikamente sicherer sein, da sie in weniger aktiver und im Wesentlichen ungiftiger Form systemisch in den Körper des Patienten eingeführt werden können und dann nur bei Bedarf durch Licht aktiviert werden, z. B. bei Tumoren, Geschwüren und Wunden. Obwohl in neueren wissenschaftlichen Arbeiten 2,3,4,5,6,7 mehrere spannende Demonstrationen solcher molekularen Wirkstoffprototypen zu finden sind, existiert das Gebiet der klinischen Photopharmakologie - eine Anwendung von zugelassenen Kombinationen aus Arzneimitteln/Medizinprodukten/Krankheiten - nicht. Die Photopharmakologie befindet sich noch in der Phase der Wirkstoffforschung, und systematische präklinische Studien sind nicht bekannt.
Erst kürzlich konnten wir den in vivo Sicherheitsvorteil für einige photokontrollierte Antikrebspeptide nachweisen, nämlich die Analoga des Peptidantibiotikums Gramicidin S8. Diese photokontrollierten Derivate enthalten einen Diarylethen-Photoschalter (DAE), der reversible photoinduzierte Transformationen zwischen den sogenannten rotlichterzeugten "ringoffenen" und UV-erzeugten "ringgeschlossenen" Photoformen durchläuft (dargestellt in Abbildung 1 für eines der Derivate, Verbindung LMB002).
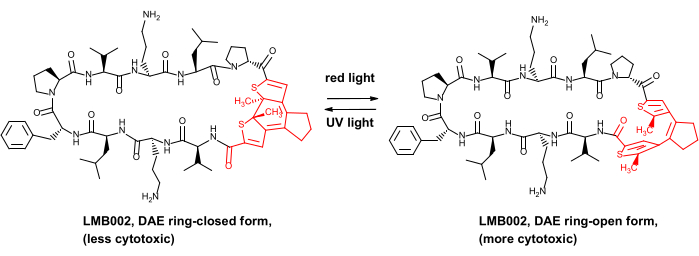
Abbildung 1: Photokontrolliertes zytotoxisches Peptid LMB002 und seine Photoisomerisierung. Das Diarylethen-Fragment ist rot dargestellt. Abkürzung: DAE = Diarylethen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Das Auffinden von Treffern und die Durchführung einer Hit-to-Lead-Optimierung erfordern häufig ein In-vitro- und In-vivo-Screening geeigneter Substanzbibliotheken 9,10. Hier demonstrieren wir eine Methodik, die für das systematische Hochdurchsatz-Screening der Zytotoxizität photokontrollierter Verbindungen geeignet ist. Wir bestimmen auch die Photoisomerisierungseffizienz, schätzen die Lichtdosis in Modellgeweben ab und bewerten die In-vivo-Wirksamkeit der leistungsstärksten Kandidaten. Der Ansatz steht im Einklang mit bioethischen und tierpflegerischen Überlegungen.
In dieser Arbeit werden traditionelle präklinische Methoden modifiziert, um die unkontrollierte Photoisomerisierung der getesteten Substanzen zu vermeiden. Das übergeordnete Ziel der Anwendung dieser modifizierten Methoden besteht darin, eine allgemeine Strategie zu entwickeln, die unkompliziert und schnell ist und statistisch signifikante Daten liefert, um In-vitro-Aktivitäten zuverlässig zu vergleichen und die In-vivo-Wirksamkeitstests von photoschaltbaren Verbindungen für die Identifizierung und Weiterentwicklung von Leitstrukturen zu rationalisieren.
Die Strategie besteht aus drei aufeinander aufbauenden Schritten. Der erste Schritt umfasst die Bestimmung von IC 50 (apparent50 % cell viability) in seriellen Verdünnungen für die aktiven und inaktiven Photoformen ausgewählter photokontrollierter biologisch aktiver Verbindungen unter Verwendung von zweidimensionalen (2D, Monolayer) und dreidimensionalen (3D, sphäroid) Zellkulturen und konfokaler automatisierter Hochdurchsatz-Fluoreszenzmikroskopie. Phototherapeutische Fenster werden in Bezug auf die IC50-Differenz zwischen den beiden Photoformen verglichen und die leistungsstärksten Kandidaten ausgewählt. Es gibt keinen spezifischen Vorteil bei der Toxizitätsbewertung durch automatisierte Mikroskopie und andere Zytotoxizitäts-Screening-Plattformen (Assays)11; Komplexere zellbasierte Tumormodelle12 könnten in diesem Stadium leicht implementiert werden.
Für die in Schritt 1 ausgewählten Verbindungen besteht der zweite Schritt darin, ihre Photoschalteffizienz innerhalb des Gewebes in Abhängigkeit von der Tiefe von der bestrahlten Gewebeoberfläche aus realistisch abzuschätzen, indem die Photoschalteffizienz der weniger aktiven Photoformen in einem Gewebesurrogat mittels UV-detektierter Hochleistungsflüssigkeitschromatographie (HPLC) von bestrahlten Probenextrakten quantifiziert wird. In vivo konnte die Effizienz der Photoschaltung untersucht werden, aber wir schlagen vor, ein einfaches Gewebesurrogat zu verwenden - Schweinehackfleisch. Wir haben die Validität dieses Ansatzes getestet. Wir haben die Umwandlung unserer photoschaltbaren Verbindungen in vivo an einem Krebsmodell einer Maus gemessen und ungefähr die gleiche Photokonversion in einer Tiefe beobachtet, die in früheren Experimenten mit Mäusen8 gemessen wurde. Jedes geeignete alternative künstliche Gewebe13, 3D-biogedrucktes Gewebe/Organ14, Biopsiematerialien oder ein anderes ausgenommenes tierisches Material könnte verwendet werden. Dieses Setup ist jedoch ein guter Kompromiss, da es wirtschaftlich, schnell und ethisch vertretbar ist.
Der dritte Schritt ist die Bestimmung der in vivo Krebswirksamkeit in einem murinen Krebsmodell. Für dieses Experiment werden die Verbindungen ausgewählt, die in den In-vitro-Experimenten überlegene Eigenschaften aufweisen und in einer Tiefe von mindestens 1-1,5 cm in den Modellgeweben effizient photoschalten.
Dieses Protokoll kann auf Verbindungen angewendet werden, die verschiedene Arten von Photoschaltern besitzen, vorausgesetzt, ihre Photoformen (oder ihre photostationären Zustände, PSS) sind für eine angemessene Zeit (einige Tage oder länger) stabil. Zur Veranschaulichung wird ein zuvor beschriebener DAE-abgeleiteter LMB00215 verwendet. Die LMB002-Fotoformen sind thermisch stabil und können bei −20 °C mindestens ein Jahr lang gelagert werden, ohne dass es zu einer wesentlichen Verschlechterung kommt. Lewis-Lungenkarzinom-Zellen (LLC) werden für diese In-vitro- und In-vivo-Demonstration ausgewählt, wobei dem Zelltyp keine Einschränkungen auferlegt werden. LLC-Zellen sind adhärent, leicht in 3D kultivierbar und werden zur Erzeugung von Tumoroiden verwendet (wie in Referenz16 beschrieben). Im lebenden Organismus LLC-Zellen werden zur Modellierung von Metastasierungsprozessen verwendet und können nach subkutaner Injektion leicht solide Tumore in immunkompetenten Mäusen erzeugen. Diese In-vivo-Methodik kann universell auf andere Krebsmodelle angewendet werden17,18. Die detaillierte Umsetzung dieser Strategie wird im Folgenden beschrieben.
Protokoll
Die Tierpflege- und Versuchsverfahren wurden nach den lokalen und internationalen Vorschriften für die Durchführung von Forschungsprojekten mit Versuchstieren durchgeführt (Gesetz der Ukraine "Über den Schutz von Tieren vor Grausamkeit", Europäische Konvention zum Schutz von Wirbeltieren, die für experimentelle und andere wissenschaftliche Zwecke verwendet werden (Europäische Konvention, Straßburg, 1986), Richtlinie 2010/63/EU zum Schutz von Tieren, die für wissenschaftliche Zwecke verwendet werden). Diese Studie wurde von der Bioethikkommission der Firma Bienta genehmigt. Für diese Experimente wurden C57BL/6NCrl-Mäuse (erwachsene Weibchen mit einem Gewicht von jeweils ca. 20 g) verwendet. Bestimmte Materialien, Reagenzien und Geräte sind in der Materialtabelle aufgeführt.
1. IC50 Evaluierung für LMB002 ("ringgeschlossene" und "ringoffene" Formen) unter Verwendung von 2D- und 3D-LLC-Zellkulturen
- Herstellung von Puffern und Stammlösungen der Verbindungen
HINWEIS: Bereiten Sie Puffer mit Standardverfahren vor. Alternativ können Sie auch handelsübliche Lösungen verwenden.- Bereiten Sie 10x phosphatgepufferte Kochsalzlösung (PBS) zu, indem Sie 14,2 g Na 2 HPO 4, 2,4 g KH 2 PO4, 80 g NaCl und2g KCl zu 1 l destilliertem Wasser hinzufügen. Autoklav bereitete 10x PBS her und verdünnte es zu 1x Lösung, indem 100 ml 10x Lösung zu 900 ml destilliertem Wasser hinzugefügt wurden. Anschließend wird die Lösung bei 4 °C gelagert.
- Bereiten Sie Dulbeccos PBS (DPBS) zu, indem Sie 4,78 g DPBS-Pulver zu 1 l destilliertem Wasser hinzufügen. Rühren Sie die Lösung, bis sich der gesamte Feststoff aufgelöst hat, überprüfen Sie den pH-Wert mit einem pH-Messgerät und stellen Sie ihn durch Zugabe von 1 M NaOH oder 1 M HCl (pH 7,3-7,4) ein. Nach Erreichen des gewünschten pH-Wertes wird das Medium durch einen 0,22 μm Vakuumfilter in einem sterilen Schrank filtriert. Bei 4 °C lagern.
- 1 M 4-(2-hydroxyethyl)-1-piperazineethansulfonsäure (HEPES)-Pufferlösung durch Zugabe von 238,3 g HEPES zu 1 l destilliertem Wasser herstellen. Stellen Sie den pH-Wert der Lösung mit 1 M NaOH bis pH 7,5 ein. Filtern Sie durch einen 0,22 μm Vakuumfilter in einem sterilen Schrank. Bei 4 °C lagern.
- Bereiten Sie 1x Trypsin-EDTA-Lösung (EDTA = Ethylendiamintetraessigsäure) vor, indem Sie 10-fache Lösung verdünnen. Geben Sie dazu 5 ml 10x Trypsin-EDTA in 45 ml 1x PBS-Lösung in ein steriles 50-ml-Röhrchen. Bei 4 °C lagern.
- Bereiten Sie Dulbeccos Modified Eagle Medium (DMEM) basic zu, indem Sie 13,4 g DMEM-Pulver mit hohem Glukosegehalt und 3,7 g Na2CO3 auf 1 l destilliertes Wasser in einen Messzylinder mit einem Magnetrührstab auf einer Rührplatte geben. Rühren Sie die Lösung, bis sich der gesamte Feststoff aufgelöst hat, überprüfen Sie den pH-Wert mit einem pH-Messgerät und stellen Sie ihn durch Zugabe von 1 M NaOH oder 1 M HCl (pH 7,3-7,4) ein. Nach Erreichen des gewünschten pH-Wertes wird das Medium durch einen 0,22 μm Vakuumfilter in einem sterilen Schrank filtriert und bei 4 °C gelagert.
- Bereiten Sie das DMEM-Komplettmedium vor, indem Sie 100 ml fötales Kälberserum (FBS), 10 ml Penicillin-Streptomycin-Lösung, 10 ml L-Glutaminlösung und 10 ml 1 M HEPES-Puffer zu 900 ml DMEM basic hinzufügen. Bei 4 °C lagern.
- Bereiten Sie Stammlösungen für die Testmischungen vor.
- Wiegen Sie für jede Verbindung zwei Chargen von 5,12 mg (z. B. LMB002) in der ringgeschlossenen Fotoform in zwei 1,5-ml-Mikrozentrifugenröhrchen (eines mit durchsichtigen und das andere mit schwarzen, undurchsichtigen Wänden). Wiegen Sie 2,28 mg Positivkontrolle (z. B. Gramicidin S) in einem extra durchsichtigen Röhrchen. Fügen Sie jeder Probe 100 μl reines DMSO hinzu und wirbeln Sie 30 s lang.
- Photoisomerisieren Sie die Stammlösung (LMB002) im Klarwandröhrchen von der "ringgeschlossenen" in die "ringoffene" Form, indem Sie die Lösung mit einem 660-nm-Laser (Lichtleistungsdichte 0,6 W/cm2) mit Vortexing bestrahlen, um eine gründliche Durchmischung zu gewährleisten. Fahren Sie fort, bis sich die Farbe sichtbar von dunkelviolett zu hellbraun ändert. Mit Alufolie vor Licht schützen.
- 2D-Zellkulturexperiment - Aussaat der Zellen (Tag 1)
- Übertragen Sie 10 ml des DMEM-Komplettmediums aus dem T-75-Kolben mit einer LLC-Zellkultur in ein steriles 15-ml-Röhrchen. Saugen Sie das übrig gebliebene Medium mit einer Vakuumpumpe an.
- Waschen Sie die Zellkultur mit 5 ml 1x DPBS und saugen Sie die Lösung mit einer Vakuumpumpe ab.
- Bedecken Sie die Zellen mit 3 ml 1x Trypsin-EDTA-Lösung und inkubieren Sie den Kolben für 2-3 min bei 37 °C in einer 5%igen CO2 -Atmosphäre.
- Stoppen Sie die Trypsinwirkung, indem Sie 6 ml des DMEM-Mediums (zuvor in ein steriles Röhrchen überführt) in den Zellkulturkolben mit 1x Trypsin-EDTA-Lösung geben und die Suspension mehrmals pipettieren, um die Zellen von den Wänden des Zellkulturkolbens zu waschen.
- Die Suspension wird in ein 15-ml-Röhrchen überführt und 4 Minuten lang bei 200 × g zentrifugiert. Nach der Zentrifugation wird der Überstand mit einer Vakuumpumpe angesaugt. Vermeiden Sie es, das Zellpellet am Boden des Röhrchens zu berühren.
- Resuspendieren Sie die Zellen, indem Sie 2 ml frisches DMEM-Komplettmedium hinzufügen und mehrmals pipettieren.
- Zählen Sie die Zellen, indem Sie etwa 15 μl der Suspension in ein 0,5-ml-Röhrchen geben, 15 μl 0,4%iges Trypanblau hinzufügen und die erhaltene Mischung in eine Zellzählkammer überführen.
- Bereiten Sie nach dem Zählen 25 ml der Zellsuspension pro Zeitpunkt vor. Säen Sie 5.000-10.000 (durchschnittlich 8.000) LLC-Zellen/Wells in 200 μl DMEM in die zentralen 60 Wells einer 96-Well-Platte mit durchsichtigem Boden und schwarzen, undurchsichtigen Wänden. Füllen Sie die restlichen 36 Vertiefungen mit reinem DMEM.
- Legen Sie die Platten über Nacht bei 37 °C und 5 % CO2 in einen Zellkultur-Inkubator. Verwenden Sie darunter Plattendeckel aus Kunststoff, um eine ungleichmäßige Erwärmung der Bodenplatte zu vermeiden.
- 2D-Zellkulturexperiment - Zugabe der Verbindungen (Tag 2)
- Überwachen Sie die Zellen durch Lichtmikroskopie in den Platten, bis die Zellen eine Konfluenz von 70%-80% erreicht haben.
- Saugen Sie das Medium mit einer Vakuumpumpe in einem sterilen Schrank aus den Vertiefungen ab. Fügen Sie 100 μl des frischen, vorgewärmten DMEM-Mediums hinzu und legen Sie die Platten in einen Zellkultur-Inkubator.
- Vorbereiten von Reihenverdünnungen der Testverbindungen und der Positivkontrolle in autoklavierten Polypropylen-Klarsichtplatten. Stellen Sie die folgenden Lösungen für individuelle Zeitpunktmessungen her:
Anmerkungen: Beginnen Sie mit den Vorräten in DMSO und verdünnen Sie sie mit DMEM, aber überschreiten Sie nicht 1 % v/v DMSO in der endgültigen höchsten Konzentration.- Um eine 128 μM Lösung von Gramicidin S zu erhalten, werden 1,3 μl 20 mM Stammlösung zu 198,7 μl DMEM gegeben.
- Um eine 256 μM Lösung von LMB002 in "ringoffener" Form zu erhalten, werden 1,3 μl 40 mM Lösung zu 198,7 μl DMEM gegeben.
- Um eine 512-μM-Lösung von LMB002 in "ringgeschlossener" Form zu erhalten, werden 2,6 μl 40-mM-Stammlösung zu 197,4 μl DMEM hinzugefügt.
- Führen Sie drei weitere Wiederholungen durch, um vier Sätze von jedem Konzentrationspunkt zu erhalten. Bereiten Sie eine Doppelverdünnungsreihe vor, indem Sie 100 μl aus jeder Startvertiefung absaugen, in eine Vertiefung mit 100 μl DMEM überführen und gründlich mischen.
Anmerkungen: Die Arbeit mit photoschaltbaren Verbindungen erfordert eine Anpassung der Beleuchtung, um eine rückseitige Photoisomerisierung zu verhindern. Es wird empfohlen, das Licht in sterilen Schränken auszuschalten. - Die Endkonzentrationen der Verbindungen werden in Vertiefungen (5-150 μM) erhalten, indem jeweils 100 μl der hergestellten Lösungen in 56 Vertiefungen mit 100 μl zuvor zugesetztem DMEM überführt werden. Geben Sie jedes Mal 100 μl DMEM in vier Vertiefungen, um als Negativkontrolle zu dienen.
- Abdeckplatten mit Aluminiumfolie oder undurchsichtiger Schutzabdeckung aus Kunststoff, um ein unkontrolliertes Fotoschalten zu verhindern. Legen Sie die Platten für die gewählte Inkubationszeit (10 min, 60 min, 24 h oder 72 h) bei 37 °C in einen Zellkultur-Inkubator (unter Verwendung zusätzlicher Kunststoffplattendeckel).
- 2D-Zellkulturexperiment - Färbung und Bildgebung (Tage 2-5)
- Nach der Inkubation mit Verbindungen für unterschiedliche Zeiträume werden 50 μl der Färbelösung pro Vertiefung zu den Platten gegeben, die 10 und 60 Minuten lang mit Verbindungen inkubiert wurden. Die Platten bei 37 °C 20 min inkubieren.
Anmerkungen: Bereiten Sie Standardfärbelösungen pro Zeitpunkt vor, indem Sie 8 μl 20 mM Hoechst 33342-Lösung (Endkonzentration 5 μM), 32,5 μl 1 mM Propidiumiodid-Lösung (Endkonzentration 1 μM) und 650 μl unsteriles FBS zu 5.810 μl unsterilem 1x PBS hinzufügen. FBS und PBS werden in einem Wasserbad bei 37 °C vorgewärmt, um einen Temperaturschock zu vermeiden. - Führen Sie eine automatisierte Fluoreszenzbildgebung mit einer 20-fach-Objektivlinse durch.
- Wiederholen Sie das gleiche Färbe- und Bildgebungsverfahren (Schritte 1.4.1 - 1.4.2) für die Platten, die 24 (Tag 3) und 72 (Tag 5) h mit Verbindungen inkubiert wurden.
HINWEIS: Typische 2D-Plattenkarten sind in Abbildung 2 dargestellt.
- Nach der Inkubation mit Verbindungen für unterschiedliche Zeiträume werden 50 μl der Färbelösung pro Vertiefung zu den Platten gegeben, die 10 und 60 Minuten lang mit Verbindungen inkubiert wurden. Die Platten bei 37 °C 20 min inkubieren.
- 3D-Zellkulturexperiment - Aussaat der Zellen (Tag 1)
HINWEIS: Die Schritte für diesen Abschnitt sind identisch mit denen, die für die 2D-Versuchsvorbereitung der Zellkultur, die Inkubation mit den getesteten Verbindungen und die Bildgebung (Schritte 1.1-1.4) beschrieben sind. In diesem Fall werden die Zellen jedoch als kompakte, reife Sphäroide in einer 384-Well-U-Bodenplatte mit extrem geringer Adhäsion und schwarzen, undurchsichtigen Wänden hergestellt. Die Verwendung einer Platte dieser Größe ermöglicht es, zwei Verbindungen in einem Experiment zu vergleichen.- Wiederholen Sie die Schritte 1.2.1-1.2.9 aus dem 2D-Experimentprotokoll mit einer LLC-Zellkultur.
- Nachdem Sie die Zellen gezählt haben, bereiten Sie 25 ml der Zellsuspension vor. Säen Sie 1.000 Zellen pro Well in allen Wells in 50 μl DMEM in einer 384-Well-Platte mit geringer Bindung und U-Boden.
- 30 s lang bei 40 × g zentrifugieren und mit einem Plattenschüttler bei 250 U/min 1 min schütteln, um die Zellen von den Wänden der Vertiefungen bis zum Boden zu schütteln.
- Stellen Sie die Platten in einen Inkubator bei 37 °C und 5 % CO2 auf zusätzliche Kunststoffplattendeckel, um eine ungleichmäßige Erwärmung des Plattenbodens für 48 h zu verhindern.
- 3D-Zellkulturexperiment - Zugabe der Verbindungen (Tag 3)
- Überwachen Sie die Zellen in den Platten durch Mikroskopie, um sicherzustellen, dass sich kompakte, reife Sphäroide gebildet haben.
- Bereiten Sie eine serielle Verdünnung der untersuchten Verbindungen in autoklavierten Polypropylen-Klarsichtplatten vor. Fügen Sie in diesem Fall eine zusätzliche Verbindung hinzu. Stellen Sie die folgenden Lösungen für individuelle Zeitpunktmessungen her:
- Um 175 μM und 350 μM Lösungen von Gramicidin S zu erhalten, werden 1,8 μl 20 mM Stammlösung zu 198,2 μl DMEM und 3,6 μl Stamm zu 196,4 μl DMEM entsprechend hinzugefügt.
- Um 175 μM und 350 μM Lösungen von LMB002 in "ringoffener" Form zu erhalten, werden 1 μl 40 mM Stammlösung zu 199 μl DMEM und 1,8 μl Stamm zu 198,2 μl DMEM entsprechend hinzugefügt.
- Um 350 μΜ und 1.750 μM Lösungen von LMB002 in "ringgeschlossener" Form zu erhalten, werden 1,8 μl 40 mM Stammlösung zu 198,2 μl DMEM und 8,8 μl Stamm zu 191,2 μl DMEM entsprechend hinzugefügt.
- Führen Sie drei weitere Wiederholungen durch, um vier Sätze jedes Konzentrationspunkts zu erhalten. Erzeugen Sie serielle Verdünnungen, indem Sie 20 μl aus jeder Startvertiefung entnehmen, mit 180 μl DMEM in die Vertiefung überführen und gründlich mischen.
Anmerkungen: Die Arbeit mit photoschaltbaren Verbindungen erfordert eine Anpassung der Beleuchtung, um eine rückseitige Photoisomerisierung zu verhindern. Es wird empfohlen, das Licht in sterilen Schränken auszuschalten. - Die Endkonzentrationen der Verbindungen in Vertiefungen werden durch jeweiliges Überführen von 20 μl der hergestellten Lösungen in 128 Vertiefungen mit 50 μl DMEM erreicht. Fügen Sie jedes Mal 20 μl DMEM in drei Vertiefungen hinzu, um als Kontrolle zu dienen. Decken Sie die Platten mit Aluminiumfolie oder Kunststoffschutzabdeckung ab, um Fotoumschaltungen oder Verdunstungen zu verhindern.
- Legen Sie die Platten für die gewählte Inkubationszeit in einen Zellkultur-Inkubator auf Plastikplattendeckel.
- 3D-Zellkulturexperiment - Färbung und Bildgebung (Tage 3-6)
- Bereiten Sie die Färbelösung pro Zeitpunkt vor, indem Sie 13 μl 1 mM Calcein AM-Lösung (Endkonzentration 1 μM), 22 μl 20 mM Hoechst 33342-Lösung (Endkonzentration 33 μM), 40 μl 1 mM PI-Lösung (Endkonzentration 3 μM), 300 μl unsteriles FBS zu 2.625 μl unsterilem 1x PBS hinzufügen. FBS und PBS werden in einem Wasserbad bei 37 °C vorgewärmt, um einen Temperaturschock zu vermeiden.
- Nach unterschiedlicher Inkubation mit den Verbindungen werden 20 μl der Färbelösung pro Vertiefung in die Vertiefungen gegeben, die 10 Minuten lang mit Verbindungen inkubiert wurden. Bei 37 °C 2 h inkubieren.
- Führen Sie konfokale Fluoreszenzbildgebung mit einem 20-fach-Objektiv durch.
- Wiederholen Sie das gleiche Färbe- und Bildgebungsverfahren für Vertiefungen, die 24 (Tag 4) und 72 (Tag 6) h mit Verbindungen inkubiert wurden.
HINWEIS: In diesem Experiment wird Calcein AM als dritte Komponente der mehrfarbigen Färbelösung verwendet. Bilder aus 2D- und 3D-Experimenten werden mit der automatisierten Bildanalysesoftware des Geräts analysiert. Zellen, die gleichzeitig mit Hoechst- und Propidiumiodid-Farbstoffen gefärbt wurden, gelten als nekrotisch tot, und ihr Anteil in Abhängigkeit von der Konzentration wird zur Berechnung des IC50-Wertes verwendet.
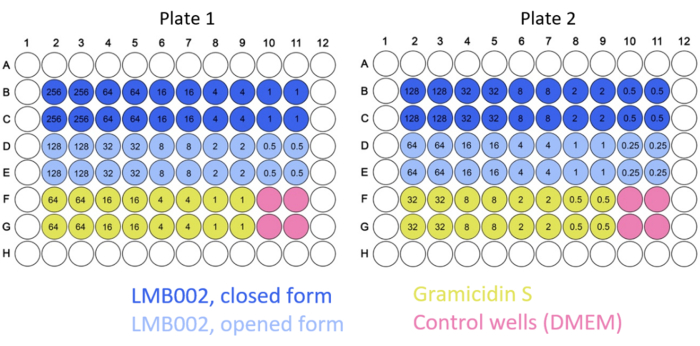
Abbildung 2: Beispiel typischer Plattenkarten für die 2D-Kulturexperimente. Farbcodes für die Mischungen und die Kontrolle sind angegeben. Die Konzentrationen der getesteten Verbindungen (Zahlen in den Vertiefungen) werden in μM angegeben. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
2. Bestimmung der Photoschalteffizienz in einem Gewebesurrogat
- Montieren Sie den optischen Zug für die Probenbestrahlung wie in Abbildung 3 gezeigt (bestehend aus einem optischen Kabel von der Laserlichtquelle, einer Linse mit variabler Brennweite, einer Spritze mit einer undurchsichtigen Abdeckung und einem flachen abgeschnittenen Ende).
- Durch Ändern der Brennweite und der Blende des Objektivs erhalten Sie einen flachen Lichtstrahl mit einem Durchmesser, der 1-1,5 mm größer ist als der Innendurchmesser der verwendeten Spritze, aber immer noch so weit wie möglich innerhalb der Blende liegt.
- Verwenden Sie eine 5-ml-Spritze mit abgeschnittenem Ende und einem Innendurchmesser von 12,4 mm, die mit einer undurchsichtigen Kunststoffabdeckung abgedeckt ist. Stellen Sie bei einer Laserleistung von 200 mW die Leistungsdichte am Ausgang des optischen Systems auf ~103 mW/cm2 ein, gemessen mit einem Photometer.
HINWEIS: Alle nachfolgenden Arbeiten müssen in einem abgedunkelten Raum mit möglichst geringer Arbeitsplatzbeleuchtung durchgeführt werden. - Bereiten Sie 3 ml LMB002 ("ringgeschlossene" Form) Stammlösung in PBS mit einer Konzentration von 1 mg/ml vor.
- Bereiten Sie eine Modellgewebeprobe vor, die mit der inaktiven Fotoform von LMB002 in einem Kunststoffbehälter beladen ist. In einem typischen Durchlauf werden 5 g frisches Schweinehackfleisch mechanisch mit 277 μl LMB002-Stammlösung und 260 μl PBS gemischt, um die Endkonzentration von 50 mg/kg in der Probe und das Verhältnis Gewebe/PBS von ~9/1 (v/v) zu erreichen.
- Füllen Sie die Spritze mit der vorbereiteten Probe, stellen Sie sicher, dass sich keine Luftblasen im Inneren befinden, und bilden Sie eine ebene Oberfläche am Belichtungsende (Schnitt).
Anmerkungen: Der Zylinder der Probe in der Spritze muss ~40 mm entlang der Achse einnehmen. - Bestrahlen Sie die Probe im optischen Zug wie in Abbildung 3 gezeigt für 9 min 44 s, was einer Belichtung von ~60 J/cm2 entspricht.
- Bereiten Sie nach der Belichtung 4 mm dicke Scheiben der Probe vor, indem Sie sie mit dem Kolben von der Spritze drücken und mit einem Skalpell schneiden. Wiegen und legen Sie die Scheiben in separate Reagenzgläser und markieren Sie sie mit dem mittleren Abstand (mm) von der bestrahlten Oberfläche.
- Bereiten Sie zwei Kontrollproben (optimale Menge, 0,5-0,7 g) in Reagenzgläsern vor: in der einen Hackfleischmischung mit 10 Volumenprozent PBS (54 μl) und in der anderen die in Schritt 2.4 gewonnene Modellgewebeprobe, die 10 Minuten lang mit 500 mW Laserlicht bestrahlt wird, um sicherzustellen, dass alle "ringgeschlossenen" LMB002-Moleküle in die "ringoffene" Form umgewandelt werden.
- Acetonitril-Wasser-Gemisch (70 %/30 % v/v, ergänzt mit 0,01 % Trifluoressigsäure (TFA), 1,4 ml/g) zu jeder Scheibe und den Kontrollproben. Mischen Sie den Inhalt gründlich mit einem Glasstab.
- Bei Raumtemperatur mindestens 10 min inkubieren und die Mischungen 20 min bei 5220 x g zentrifugieren oder zweimal bei 20 x g 30 min zentrifugieren, um das unlösliche Material zu entfernen und den Überstand aufzufangen.
- Sammeln Sie die Überstände vorsichtig (~0,7 ml) und zentrifugieren Sie sie erneut bei 16.000 x g für 30 min.
- Sammeln Sie die Überstände (jeweils ~0,5 ml) und analysieren Sie sie mittels Umkehrphasen-Hochleistungsflüssigkeitschromatographie (RP HPLC) mit einer analytischen C18-Säule, einem linearen A:B-Gradienten von 3,46 % B/min, einer Flussrate von 2,0 ml/min und 100 μl injiziertem Volumen. Zeichnen Sie die UV-detektierten Chromatogramme bei 570 nm (Detektion der "ringgeschlossenen" Form) und 270 nm (Detektion der "ringoffenen" Form) auf. Verwenden Sie die unbestrahlten (Schritt 2.4) und bestrahlten Kontrollproben (Schritt 2.8), um die spezifischen Retentionszeiten beider Photoformen (Eluent A: wässrig 0,1 % TFA; Laufmittel B: 90 % Acetonitril-Wasser, 0,1 % TFA) zu bestimmen und die Methode zu kalibrieren.
- Bestimmung der tatsächlichen Mengen an LMB002-Photoformen in den analysierten Proben unter Verwendung der Kalibrierkurven, die durch die Entnahme und Analyse der Chromatogramme von LMB002-Lösungen bekannter Konzentrationen erhalten wurden. Für die Kalibrierung werden die "ringgeschlossenen" Lösungen LMB002 hergestellt, indem die Stammlösung (Schritt 2.3) mit einem Acetonitril-Wasser-Gemisch (70 %/30 % v/v, ergänzt mit 0,01 % TFA) verdünnt wird, um 0,36, 0,9 und 3,6 μg pro 100 μl (das injizierte Volumen) zu erhalten. Der Eluentengradient und die Flussrate sind die gleichen wie in Schritt 2.12.
- Wiederholen Sie das Experiment (Schritte 2.4-2.12) dreimal und tragen Sie den normalisierten Prozentsatz jeder Fotoform auf dem Diagramm (Prozentsatz) im Vergleich zur Entfernung (von der bestrahlten Gewebeoberfläche) auf. Berechnen Sie die Statistik (d. h. die Standardabweichung an jedem Konzentrationspunkt).
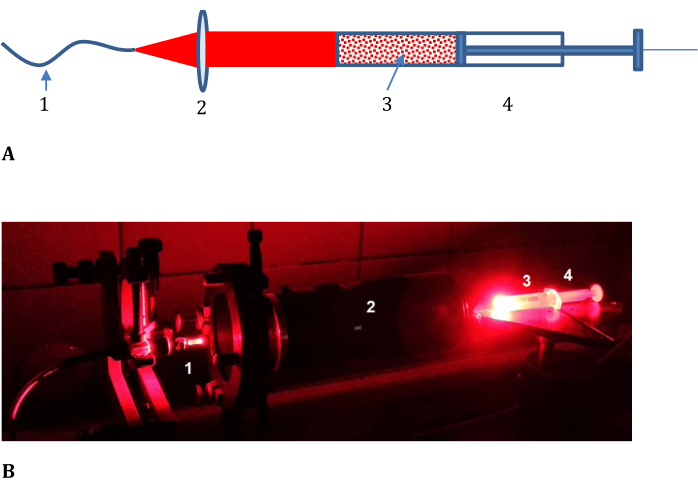
Abbildung 3: Versuchsaufbau zur Bestimmung der Effizienz der Photokonversion im Modellgewebe. (A) Schaltplan und (B) Foto; 1, optisches Kabel von der Laserlichtquelle; 2, Objektiv mit variabler Brennweite; und 3 eine Fleischhackfleisch-LMB002-phosphatgepufferte Kochsalzmischung, die in 4 eine Spritze mit einem undurchsichtigen Deckel und einem geschnittenen Vorderteil (siehe (B) ohne Deckel) gegeben ist). Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
3. Bestimmung der Wirksamkeit von Krebsmedikamenten in vivo
HINWEIS: Der Zeitplan für das Experiment und die Endpunkte sind in Abbildung 4 dargestellt. Die Tierpflegestandards in der Nachbehandlungszeit sollten den 3R-Regeln entsprechen – die Unterbringung sollte eine angemessene Käfigdichte und Ressourcenverfügbarkeit beinhalten. Halten Sie sich, wann immer möglich, an nicht-aversive Methoden zur Handhabung von Tieren, wie z. B. Tunneln oder Schröpfen.
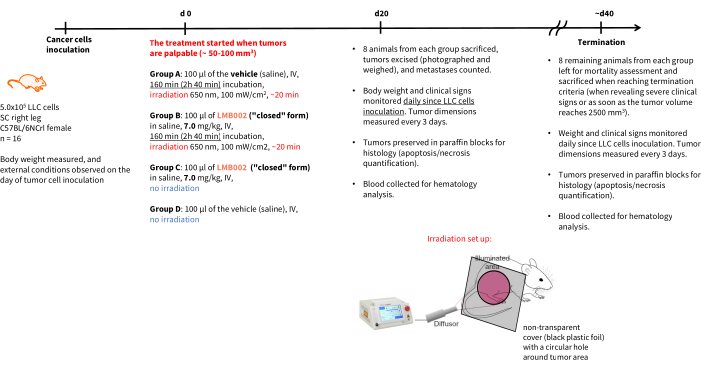
Abbildung 4: Zeitplan für das therapeutische In-vivo-Experiment . Benennung der Versuchsgruppen, Therapiedetails, Endpunkte und Zeitpläne für die Post-Mortem-Analyse . Abkürzungen: LLC = Lewis-Lungenkarzinom; IV = intravenös; SC = subkutan. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
- Vorbereitung der Krebszellen für die subkutane Inokulation (Tag 0).
- Passage der LLC-Zellen in DMEM (4,5 g/l Glukose) mit 10 % FBS, 100 U/ml Penicillin und 100 μg/ml Streptomycin bei 37 °C und 5 % CO2.
- Ernten Sie die Zellen mit einer 0,05%igen Trypsin-EDTA-Lösung, zentrifugieren Sie sie und suspendieren Sie sie in serumfreiem DMEM.
- Zählen Sie die Zellen und bestimmen Sie ihre Lebensfähigkeit mit einem Hämozytometer und einem Trypanblau-Ausschlusstest.
- Bereiten Sie die endgültige Zellsuspension mit einer Konzentration von 10 × 106 Zellen/ml in DMEM und Matrigel-Mischung (1:1) vor. Bewahren Sie die Suspension vor der Injektion auf Eis auf.
- LLC-Zellinokulation (Tag 0)
- Legen Sie die erwachsene weibliche C57BL/6NCrl-Maus (mit einem Gewicht von ~20 g) in die Induktionskammer des Isofluran-Anästhesiegeräts. Führen Sie eine Sedierung mit 5 % Isofluran durch und warten Sie, bis das Tier vollständig bewusstlos ist.
- Entfernen Sie das Fell durch Rasieren aus dem Bereich der Zellinokulation.
- Inokulieren Sie 5 × 105 LLC-Zellen in ~100 μl DMEM: Matrigel (1:1)-Mischung in die rechte Hintergliedmaße.
Anmerkungen: Halten Sie sich, wann immer möglich, an die Praxis der Verwendung mit einer Nadel.
- Verabreichung von Präparaten und Photobestrahlung
HINWEIS: In 5-8 Tagen nach der Inokulation sind die Tiere bereit für die Behandlung, wenn ihre Tumore tastbar sind und ein Volumen von ~50-100 mm3 erreicht haben. Alle nachfolgenden Vorgänge mit LMB002 und Mäusen, die mit dieser Verbindung behandelt wurden, sind bei Halbdunkelheit durchzuführen (eine 4-W-LED-Lampe mindestens 5 m vom Arbeitsplatz entfernt).- LMB002 ("ringgeschlossene" Form) wird in steriler physiologischer Kochsalzlösung in einer Konzentration von 1 mg/ml für die Dosis von 5 mg/kg (i.v.) gelöst, um dunkelblaue, homogene Lösungen zu erhalten.
- Stellen Sie vor der Bestrahlung nach dem Zufallsprinzip vier Gruppen zu je acht Tieren zusammen und entfernen Sie das Fell durch Rasur vom Tumor und den umliegenden Bereichen.
- Legen Sie eine Maus für Infusionsinjektionen in die Halterung und wärmen Sie den Schwanz des Tieres in einem Wasserbad bei 37 °C vor, um die Schwanzvene sichtbar zu machen.
HINWEIS: Ziehen Sie eine präoperative Analgesie in Betracht. - Injizieren Sie die Verbindung in einer Dosis von 5 ml/kg in die Schwanzvene. Für die beiden Kontrollgruppen injizieren Sie 100 μl Kochsalzlösung (intravenös) pro Tier (20 g Körpergewicht). Stellen Sie sicher, dass die Tiere in den beiden Versuchsgruppen die getestete Verbindung in der inaktiven Photoform (1 mg/ml in Kochsalzlösung) erhalten.
Anmerkungen: Halten Sie sich, wann immer möglich, an die Praxis der Verwendung mit einer Nadel. - Dann, 2 h 45 min nach der Injektion des Präparats, setzen Sie die Maus unter Narkose. Sedierung mit 3%-4% Isofluran in Sauerstoff induzieren. Halten Sie die Anästhesie 15 Minuten lang mit 0,5%-1% Isofluran in Sauerstoff aufrecht.
- Bedecken Sie die Maus mit einer schwarzen Maske, die ein Loch besitzt, das nur den Tumorbereich dem Licht aussetzt.
- Schalten Sie das Laserdiodenmodul mit einem 650-nm-Laser ein und stellen Sie die Leistung des roten Lasers auf 200 mW und die des blauen/UV-Leitlasers auf 2 mW ein.
Anmerkungen: Verwenden Sie eine blaue Schutzbrille, wenn das Lasergerät eingeschaltet ist. - Messen Sie den Lichtstrom des roten Lasers (weg von den Mäusen) mit einem Photometer und bestimmen Sie den Abstand zum optischen Kabel, wo der Lichtstrom 100 mW/cm2 beträgt. Befestigen Sie das Kabel auf einem Stativ, um sicherzustellen, dass sich die Lichtquelle im festgelegten Abstand zum Tumor befindet und das Licht den gesamten Tumorbereich abdeckt. Verwenden Sie während dieses Verfahrens blaues/UV-Guide-Laserlicht.
- Schalten Sie den roten Laser ein, um den Tumorbereich 20 Minuten lang zu bestrahlen.
- Schalten Sie nach der Bestrahlung den Isofluranfluss aus, bringen Sie das Tier in seinen Käfig zurück und beobachten Sie seinen Zustand in den nächsten 30 Minuten sorgfältig.
Anmerkungen: Halten Sie die Mäuse nach der Verabreichung des Präparats 2 Tage lang im Dunkeln. Nur der Licht-Tag-Zyklus muss verändert werden; Alle anderen Wohnverhältnisse sollen unverändert bleiben.
- Beobachtungen nach der Behandlung
- Beobachten Sie die Tiere täglich und messen Sie das Gewicht und die Größe ihrer Tumore. Messen Sie das Tumorvolumen und notieren Sie das Fortschreiten der Nekrose.
HINWEIS: Die Tierpflegestandards in der Nachbehandlungszeit sollten den 3R-Regeln entsprechen - die Unterbringung sollte eine angemessene Käfigdichte und Ressourcenverfügbarkeit beinhalten. - Verwenden Sie die im vorherigen Schritt gesammelten Daten, um die Sterblichkeit zu bewerten. Bestimmen Sie die Überlebensrate mit dem Standardverfahren.
HINWEIS: Tiere sollten geschlachtet und als tot gezählt werden, wenn schwere klinische Symptome auftreten (Körpergewichtsverlust von mehr als 15 %, Tumorgeschwüre heilen nicht innerhalb von 7 Tagen und Lautäußerung) oder sobald das Tumorvolumen 2.500 mm erreicht3.
- Beobachten Sie die Tiere täglich und messen Sie das Gewicht und die Größe ihrer Tumore. Messen Sie das Tumorvolumen und notieren Sie das Fortschreiten der Nekrose.
Ergebnisse
In dieser Arbeit wurden 2D- und 3D-Zellexperimente durchgeführt, um den IC50 für "ringgeschlossene" und "ringoffene" Formen von LMB002 (siehe Abbildung 1) zu unterschiedlichen Inkubationszeiten zu bestimmen. Diese Werte wurden mit denen verglichen, die für das prototypische Peptid Gramicidin S (als Positivkontrolle verwendet) ermittelt wurden. Ein typischer Satz von Bildern der Inkubation in 2D-gezüchteter LLC-Kultur nach der Färbung ist in Abbildung 5 dargestellt. Die Co-Färbung mit Hoechst 33342 (blau) und Propidiumiodid (rot), die bei der Behandlung mit "ringoffener" Form im Vergleich zu "ringgeschlossenen" Formen zu unterschiedlichen violetten Farbtönen bei einem größeren Anteil der Zellen führt, deutet auf einen deutlichen Unterschied in der Zytotoxizität zwischen zwei Formen hin, der leicht quantifiziert werden kann. Das demonstrierte Beispiel eines erfolgreichen Experiments basiert auf den Daten, die mit dem 96-Well-Plattenformat gesammelt wurden, bei dem die Peptidvarianten in unterschiedlichen Konzentrationen hinzugefügt wurden, wie in Abbildung 2 dargestellt. Ähnliche Daten können mit 384-Well- und High-Density-Platten erfasst werden. Da jedoch die Volumina pro Bohrung reduziert werden, nehmen technische und systematische Fehler und damit die Genauigkeit der IC50-Bestimmung mit zunehmender Bohrlochdichte ab.
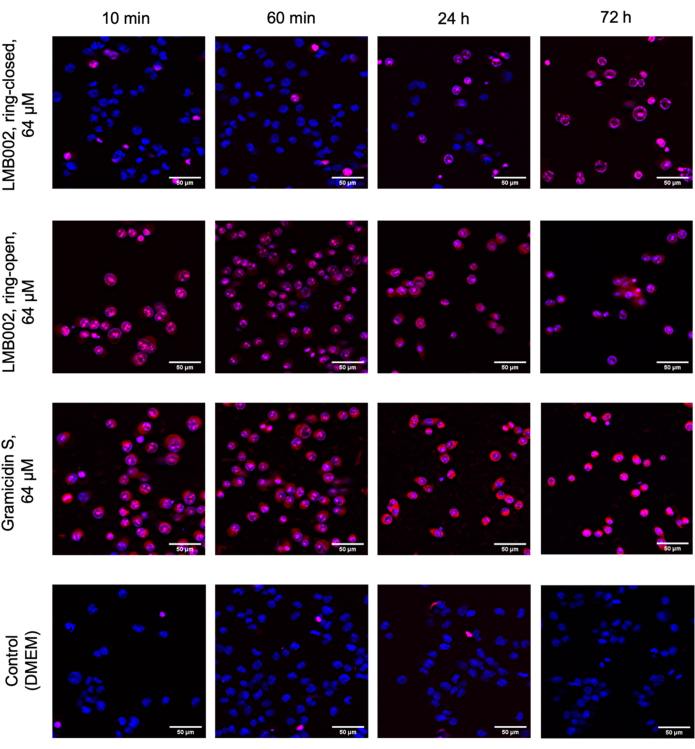
Abbildung 5: Repräsentative Bilder des Zytotoxizitätstests in der einlagig gewachsenen LLC. Die Zellen wurden mit Hoechst 33342 (blau) und Propidiumiodid (rot) gefärbt. Die angegebenen Zeiten: 10 min, 60 min, 24 h und 72 h sind Inkubationszeiten mit Verbindungen. Maßstabsbalken = 50 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Die Photokonversion von LMB002 durch Laserbestrahlung in einem Modellgewebe - frischem Schweinehackfleisch - wurde anhand einer Probe bestimmt, die aus Hackfleisch gemischt mit LMB002 "ring-geschlossene" (inaktive) Form, die in PBS gelöst war, vermischt war, und die Messung der Umwandlung dieser inaktiven Form in die LMB002 "ring-offene" (aktivierte) Form in Richtung der Strahlenausbreitung. Die Probe wurde in eine Spritze gegeben und von einer Seite mit einem flachen Laserstrahl für die Belichtungszeit von ~10 min (normalerweise in In-vivo-Experimenten verwendet) bestrahlt, wie in Abbildung 3 gezeigt. Nach der Belichtung wurde der Probenzylinder durch Drücken des Spritzenkolbens und Schneiden der gleich hohen Scheiben mit einem Skalpell in Teile geteilt. Die Konzentration von LMB002 "ringoffen" in den Extrakten aus den Schichten wurde mittels RP-HPLC bestimmt.
Abbildung 6 zeigt die Dosis-Wirkungs-Kurven Abbildung 6A-D, die aus der Datenanalyse gewonnen wurden. Um den Prozentsatz der toten Zellen mit nukleärer Co-Färbung von Hoechst 33342 und PI-Farbstoffen zu identifizieren, haben wir ein integriertes Klassifikatorwerkzeug verwendet, das numerische Schwellenwerte für ausgewählte Messparameter festlegt, um alle Zellzahlen in mehrere Kategorien aufzuteilen. Wenn beispielsweise das Signal des roten Kanals (Propidiumiodid) in der Kontrolle den Schwellenwert (ca. 110-130 Einheiten) erreichte, konnten die Zellen als PI-positiv klassifiziert werden, d. h. als tot betrachtet, oder als PI-negativ, d. h. als von den Verbindungen nicht beeinflusst. Für LMB002 sind sigmoidale Abhängigkeiten des Prozentsatzes von Propidiumiodid-positiven Zellen von der Substanzkonzentration zu sehen. Aus diesen Daten können die IC50 Werte ermittelt werden.
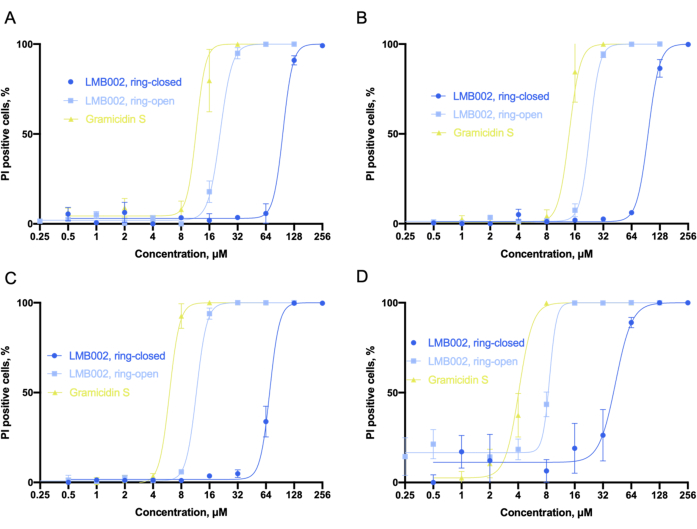
Abbildung 6: Analyse der Zytotoxizität in 2D-Kultur. Sigmoid-Anpassungen, wie sie in der LLC-Kultur für (A) 10 min, (B) 60 min, (C) 24 h und (D) 72 h-Zeitintervalle für die Inkubation mit Verbindungen erhalten wurden. Die Anpassung ermöglicht die genaue Bestimmung von IC50-Werten (nicht abgebildet). Fehlerbalken sind SEM. Abkürzungen: LLC = Lewis-Lungenkarzinom; PI = Propidiumiodid. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Unter Berücksichtigung der erhaltenen IC50-Werte können wir schlussfolgern, dass die Toxizität aller drei Verbindungen mit der Inkubationszeit zunahm. Unser Experiment zeigte, dass die "ringoffene" Form von LMB002 etwa einen Verdünnungsschritt weniger toxisch ist als der Prototyp des Peptids Gramicidin S. Während die "ringgeschlossene" Form eine um drei bis vier Verdünnungsschritte geringere Toxizität aufweist, die mit der Inkubationszeit zunimmt. Die Differenz zwischen den beiden Verdünnungsschritten wird durch die Verlängerung der Inkubationszeit nicht beeinflusst und kann numerisch als experimentell bestimmtes phototherapeutisches Fenster6 zum Vergleich mit anderen Verbindungen in einem potentiellen Bibliotheksscreening verwendet werden. Der IC50-Wert für Gramicidin S wurde als Referenzpunkt festgelegt, um experimentelle Fehler oder differentielle Ergebnisse in biologischen Replikaten zu korrigieren.
Die 3D-Zellexperimente lieferten die gleiche Art von Rohdaten - die einzelzellaufgelösten Eins-pro-Well-Sphäroidbilder. Die Zugabe von Calcein als drittem Färbefarbstoff ermöglicht die Quantifizierung des Anteils metabolisch aktiver Zellen (beobachtet im grünen Kanal). Durch die Verwendung von 384-Well-Platten, die Erhöhung der Anzahl der technischen Replikate, den Ausschluss redundanter Co-Inkubationszeitpunkte und die Änderung der Verdünnungsfalte konnten wir mehrere Verbindungen in einem einzigen Testlauf (unter Verwendung einer einzelnen Platte) direkt vergleichen, wie in der Plattenkarte in Abbildung 7 dargestellt.
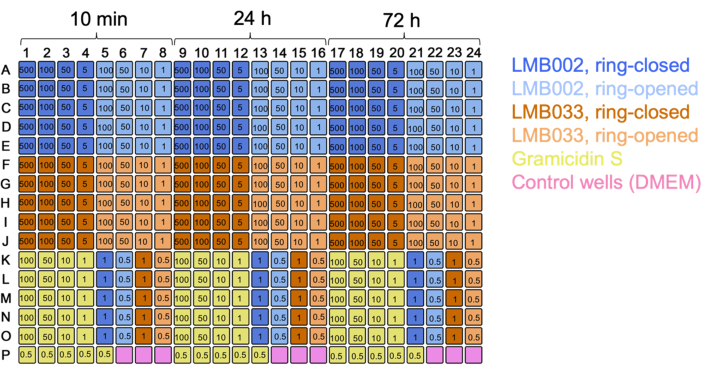
Abbildung 7: Plattenkarte für das 3D-Kulturexperiment mit zwei Verbindungen. Farbcodes für die Mischungen und die Kontrolle sind angegeben. Zahlen in Wells sind Konzentrationen in μM. 10 min, 24 h und 72 h sind Inkubationszeiten. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Abbildung 8 zeigt die Bilder ausgewählter technischer Replikate von LLC-Sphäroiden, die mit einer Dichte von 1 Sphäroide/Vertiefung in Gegenwart von getesteten Verbindungen und Kontrollsphäroiden gezüchtet wurden, die nach der Färbung aufgenommen wurden.
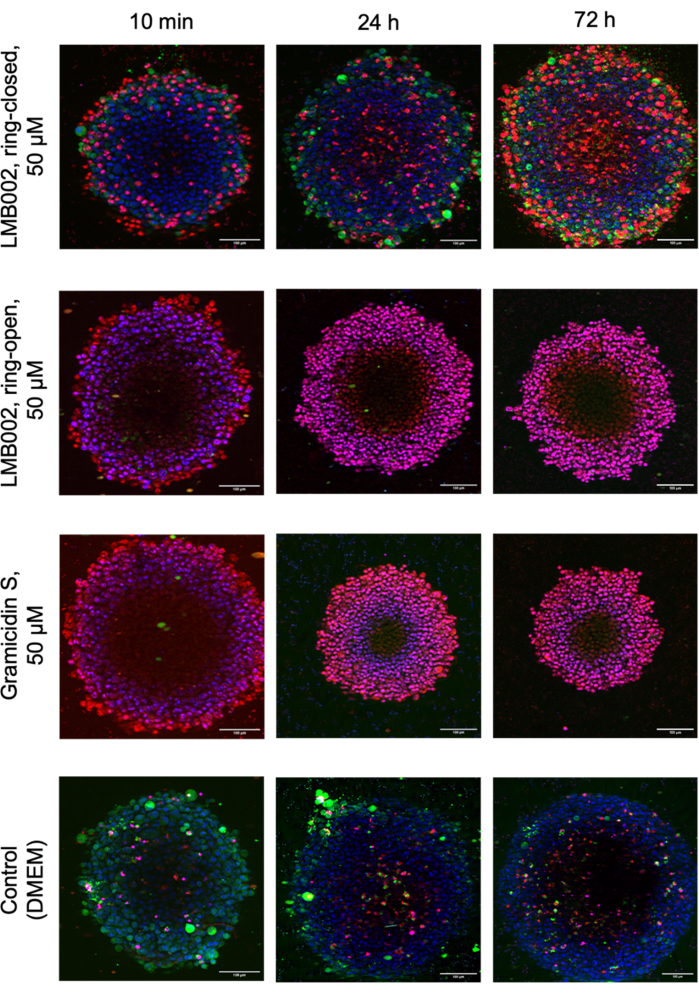
Abbildung 8: Repräsentative Bilder aus dem 3D-Kultur-Zytotoxizitätsassay. Die Bilder zeigen 48 h alte LLC-Sphäroide, die mit Hoechst 33342 (blau), Calcein AM (grün) und Propidiumiodid (rot) gefärbt wurden, nach 10 min, 24 h und 72 h Co-Inkubation mit LMB002-Photoformen und Gramicidin S. Maßstabsbalken = 100 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Mit Hilfe der Gerätesoftware wurden die Dosis-Wirkungs-Kurven, wie im 2D-Experiment, aus den z-gestapelten Bildstapeln gewonnen (Abbildung 9A). Darüber hinaus konnten kompakte und undeformierte Sphäroide in den 3D-Kulturen durch den gesamten Sphäroiddurchmesser charakterisiert werden (Abbildung 9B). Es wurde auch festgestellt, dass der Gesamtdurchmesser des Sphäroids mit der Verbindungskonzentration variiert.
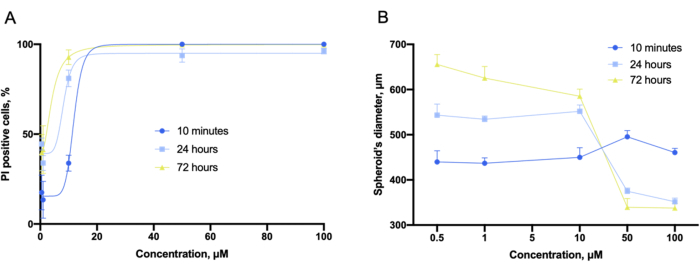
Abbildung 9: Bewertung der Zytotoxizität mit 3D-Kulturen. (A) Konzentrationsabhängige Zytotoxizitätsanpassungskurven und (B) konzentrationsabhängige Sphäroid-Durchmesserdiagramme, die in den 3D-Kulturen von LLC erhalten wurden, die mit Gramicidin S für 10 min, 24 h und 72 h co-inkubiert und vor der Färbung erfasst wurden. Fehlerbalken sind SEM. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Das Experiment für Schritt 2 ermöglicht die Bestimmung der LMB002-Konzentrationen in beiden Photoformen mittels UV-detektierter Hochleistungsflüssigkeitschromatographie. Die Effizienz der Photokonversion in Modellgeweben konnte mit diesem Aufbau leicht bewertet und quantifiziert werden (Abbildung 3). Die Daten wurden aus der quantitativen Analyse der Chromatogramme der Probenextrakte gewonnen. In diesen Testexperimenten wurden LMB002-Chromatogramme spektroskopisch bei 270 nm und 570 nm detektiert. Bei 270 nm wurden viele zusätzliche Signale beobachtet und den Verbindungen zugeschrieben, die aus dem Modellgewebe co-extrahiert wurden (verifiziert durch den Kontrollextrakt ohne die Verbindung). Beide Fotoformen unterschieden sich hinreichend in Retentionszeiten und Resorption. Das "Ring-Open"-Signal LMB002 war jedoch von diesen Hintergrundsignalen getrennt (siehe ein repräsentatives Chromatogramm in Abbildung 10A). Daher kann dieses Signal problemlos integriert werden. Bei 570 nm enthielten die Chromatogramme nur das "ringgeschlossene" Formsignal LMB002 (Abbildung 10B). Hier haben wir die Konzentrationsbestimmung mittels RP HPLC durchgeführt. Dennoch konnten mit LC/MS als Analysemethode noch höhere Genauigkeit und niedrigere Nachweisgrenzen erreicht werden.
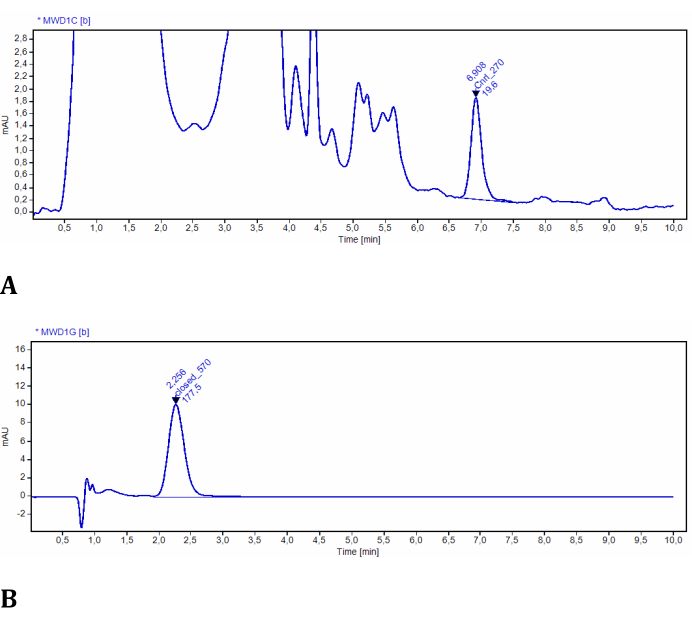
Abbildung 10: Repräsentative Chromatogramme von LMB002, extrahiert aus Modellgeweben. (A) Probe in einem Abstand von 2 mm von der bestrahlten Oberfläche, aufgezeichnet bei 270 nm (LMB002 "ringoffene" Form ist integriert); (B) Probe in einem Abstand von 38 mm von der bestrahlten Oberfläche, aufgezeichnet bei 570 nm (der Peak von LMB002 "ringgeschlossen" ist integriert). Die angegebenen Werte für die Retentionszeit bestätigten zusätzlich die Identität der Verbindung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Die Daten, die nach der Integration der entsprechenden Signale aller gesammelten Proben gewonnen wurden, wurden verwendet, um die Konzentrations-Tiefen-Diagramme zu erstellen, wie in Abbildung 11 dargestellt. Anhand dieser Diagramme konnte die Effizienz der Photokonversion in verschiedenen Tiefen des Modellgewebes leicht bewertet werden. Es bestätigt, dass unsere Rotlichtquelle die "ringgeschlossene" LMB002-Photokonversion in einer Tiefe von bis zu 1 c im Gewebesurrogat Hackfleisch (bei ca. 103 mW/cm2) induziert.
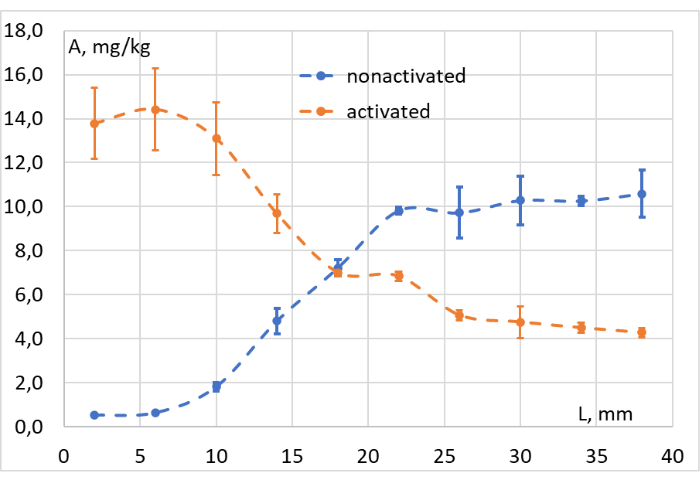
Abbildung 11: Bewertung der Photokonversionseffizienz. Konzentration (A, mg/kg) von LMB002 "ringgeschlossene" (nicht aktivierte, blaue Punkte) und "ringoffene" Formen (aktiviert, orangefarbene Punkte) in unterschiedlichen Abständen von der bestrahlten Oberfläche des Modellgewebes (L, mm). Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Die Ergebnisse des In-vivo-Experiments - Schritt 3 unserer Methodik, der nach dem in Abbildung 4 dargestellten Zeitplan durchgeführt wurde - wurden durch Diagramme dargestellt, die das Tumorwachstum in Abhängigkeit von der Zeit (Abbildung 12) und Kaplan-Meier-Überlebenskurven (Abbildung 13) zeigten.
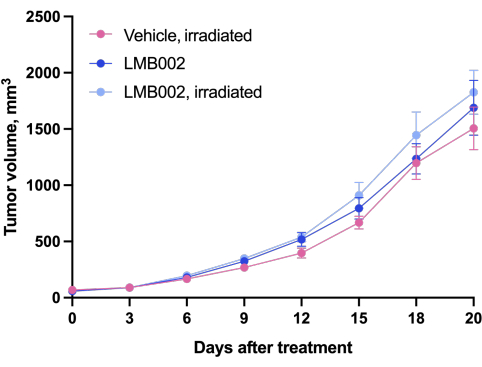
Abbildung 12: Tumorwachstumsdynamik bei Tieren. Tiere, die mit LMB002 behandelt wurden, verglichen mit den mit Vehikel behandelten Tieren (subkutanes LLC-Allotransplantatmodell in C57BL/6NCrl-Mäusen, zusammengesetzte Dosis 7 mg/kg, i.v., 2 h 40 min Inkubation, dann Bestrahlung bei 650 nm, 100 mW/cm 2,20 min). Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
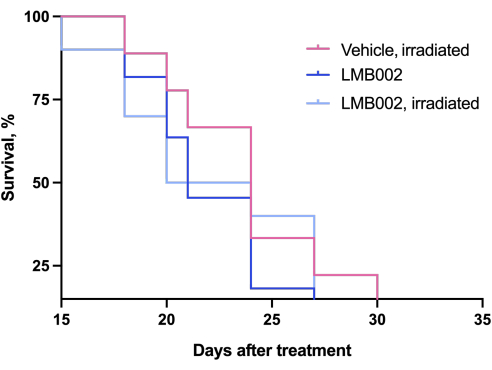
Abbildung 13: Sterblichkeitskurven für Tiere. Tiere, die mit LMB002 behandelt wurden, verglichen mit den mit Vehikel behandelten Tieren (subkutanes LLC-Allotransplantatmodell in C57BL/6NCrl-Mäusen, zusammengesetzte Dosis 7 mg/kg, i.v., 2 h 40 min Inkubation, dann Bestrahlung bei 650 nm, 100 mW/cm 2,20 min). Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Diskussion
Photokontrollierte Verbindungen sind beispiellos in der Arzneimittelentwicklung; Es wurden jedoch keine Methoden für deren präklinische und klinische Bewertung etabliert. Das nächste Monotherapie-Analogon, die photodynamische Therapie (PDT), ist die Behandlungsmodalität für den klinischen Einsatz, die von vielen Ländern gegen Krebs eingesetzt wird und sich in der Entwicklung für andere Indikationen befindet19,20. Ähnlich wie bei der Photopharmakologie basiert auch die PDT auf der Verwendung von Licht zur Aktivierung der bioaktiven Substanz (Singulettsauerstoff). Daher können einige experimentelle Methoden, die für präklinische und klinische Studien in der PDT verwendet werden, für die Photopharmakologie übernommen werden. So sind beispielsweise Lichtquellen, Lichtverabreichungsansätze und Medizinprodukte für die PDT gut entwickelt und zugelassen. Sie können direkt für die Bewertung von photokontrollierten Medikamenten verwendet werden. PDT und Photopharmakologie unterscheiden sich jedoch stark voneinander4, was die Notwendigkeit rechtfertigt, spezifische Methoden für letztere zu etablieren.
Erstens ist die nicht aktivierte Substanz in PDT (Sauerstoff) in lebenden Geweben immer in ungiftigen Konzentrationen vorhanden. Im Gegensatz dazu können nicht aktivierte photokontrollierte biologisch aktive Verbindungen eine Restaktivität und unerwünschte Toxizität aufweisen. Daher sollten ideale photopharmakologische Arzneimittel in ihrer verabreichten Form eine minimierte biologische Aktivität aufweisen und in ihrer lichterzeugten Form hochaktiv sein, das "phototherapeutische Fenster"21 muss so groß wie möglich sein. Die Suche nach dem Hit und die Durchführung der Hit-to-Lead-Optimierung erfordern die Identifizierung geeigneter Verbindungen und das Screening relativ großer Bibliotheken bereits in frühen Stadien der Arzneimittelentwicklung. Hier schlugen wir eine automatisierte konfokale Hochdurchsatz-Fluoreszenzmikroskopie vor, um effiziente photoschaltende Verbindungen zu identifizieren.
Die gewählte Methode zur Bewertung der Zytotoxizität ermöglicht eine einfache Umsetzung der wichtigsten Anforderung - der Aufrechterhaltung des PSS oder der Stabilität des sichtbar-lichtempfindlichen Photoisomers. Dies liegt daran, dass bei der Implementierung die Lichteinwirkung minimiert wird. Daher sollten bei der Auswahl alternativer Methoden automatisierte Methoden bevorzugt werden. Dieser Ansatz ist zuverlässig und informativ. Die Verwendung von 3D-Zellkulturen (Sphäroide) in diesem Stadium ermöglicht ein ganzheitliches Verständnis der Reaktion der Zelle auf die Behandlung in einer realistischeren gewebeähnlichen Mikroumgebung. Darüber hinaus können mit der Mikroskopie als direkte Methode wertvolle Einblicke in den Wirkmechanismus der Verbindungen gewonnen werden. Die konfokale Fluoreszenzmikroskopie mit geeignetem Färbeprotokoll ermöglicht die visuelle Beurteilung der Morphologie der Zellen und Sphäroide. Auch wichtige Details zum Zelltod und Veränderungen im Inneren der Zellen können detektiert werden.
Zweitens erfordert eine leichte Anwendung eine sorgfältige Auswahl der Lichtdosierung. Bei der PDT ist eine leichte Überdosierung extrem schädlich für das Gewebe22. Eine photopharmakologische Therapie kann bei übermäßiger Lichtbestrahlung vorteilhaft sein. Die Obergrenze der aktivierten Substanz wird durch die verabreichte Dosis der nicht aktivierten Substanz und deren Pharmakokinetik definiert. Die Lichtdosierung ist jedoch immer noch ein Problem in der Photopharmakologie. Es sollte darauf geachtet werden, dass die Bestrahlungsleistungsdichte und die Einwirkzeit nicht geringer sind als die Anforderung an die Therapie. Prinzipiell kann die Bildung der aktivierten Substanz in vivo überwacht werden. Aus bioethischen Gründen schlugen wir jedoch ein Experiment mit einem Modellgewebe (frisches Hackfleisch) vor, das mit der nicht aktivierten Verbindung15 gemischt wurde. Dieses Experiment ist einfach und kann modifiziert werden, um verschiedene Lichtquellen zu verwenden. Es kann auch für die photophysikalische Abschätzung der Lichtdosis und die Messung thermischer Einflüsse angepasst werden. Auch hier ist es durch die Verwendung von Modellgeweben möglich, die Lichtexposition zu minimieren, z. B. im Vergleich zur genaueren Bestimmung der Photoschalteffizienz unter den In-vivo-Bedingungen , eine Alternative, die immer interessant sein kann.
Schließlich können die Verbindungen, die in den In-vitro-Toxizitätsscreens überlegene Eigenschaften aufweisen und mindestens 1-1,5 cm tief im Modellgewebe effizient photoschalten, für kostspielige, mühsame und langwierige In-vivo-Studien ausgewählt werden. In diesem Protokoll haben wir die gleiche Zelllinie (LLC) wie in der In-vitro-Bewertung verwendet, um das Allotransplantat-Krebsmodell zu generieren. Die Tumorwachstumsdynamik, die Mortalität und die Anzahl der Metastasen sind die Parameter, die am besten geeignet sind, um die Wirksamkeit gegen Krebs zu beurteilen. Im Vergleich zur konventionellen Chemotherapie wird bei der photopharmakologischen Behandlung ein zusätzlicher Faktor eingesetzt - das Licht. Daher werden zwei Kontrolltiergruppen benötigt: eine, die nur das Fahrzeug erhält, und die andere, die das Fahrzeug und die Bestrahlung erhält. Dieser Aufbau ermöglicht die Bewertung des Einflusses von Licht auf die gemessenen Parameter. In unserem Experiment erhielten die Tiere der beiden Versuchsgruppen die nicht aktivierte Verbindung, und die Tumore der Mäuse in einer Gruppe wurden bestrahlt. Das Bestrahlungsregime war für die Kontroll- und Behandlungsgruppe identisch. Ein Vergleich mit einer Benchmark-Chemotherapie ist zum jetzigen Zeitpunkt nicht erforderlich, da der Hauptzweck des Experiments darin besteht, die kombinierte Wirkung von Licht- und Wirkstoffanwendung zu demonstrieren. Die leistungsstärksten Verbindungen, die diesen Effekt aufweisen, können dann für weitere Studien auf ihre In-vivo-Toxizität und den Vergleich mit Benchmarks ausgewählt werden, um wichtige Entscheidungen über ihre Entwicklung zu treffen. Technisch kann das von uns beschriebene In-vivo-Experiment leicht an pharmakokinetische oder pharmakodynamische Studien angepasst werden, z. B. an einer Verbindung, die bereits als Leitstoff ausgewählt ist.
Offenlegungen
IVK, OB, SA und ASU sind Erfinder der erteilten Patentfamilie: "Peptidomimetics possessing photocontrolled biological activity" (WO2014127919 [A1], EP2958934 [B1], US9481712 [B2], UA113685 [C2]), lizenziert an Lumobiotics GmbH. IVK, OB, TS und SA sind Gründer und Gesellschafter der Lumobiotics GmbH. IVK ist wissenschaftlicher Berater, HK, TM, IP und PB sind Mitarbeiter von Enamine LLC. Die Autoren haben keine anderen relevanten Verbindungen oder finanziellen Beteiligungen an Organisationen oder Organisationen, die ein finanzielles Interesse an oder einen finanziellen Konflikt mit dem in der Veröffentlichung behandelten Thema oder den in der Veröffentlichung behandelten Materialien haben, abgesehen von den offengelegten.
Danksagungen
Die Autoren würdigen die EU-Finanzierung durch das H2020-MSCA-RISE-Programm durch die Projekte PELICO (#690973) und ALISE (#101007256). Diese Arbeit wurde durch das DFG-GRK 2039 (SA, TS und ASU), das NACIP-Programm der Helmholtz-Gemeinschaft (SA und ASU) und das VIP+ des BMBF (OB und ASU) unterstützt. Wir danken Dr. Serhii Koniev vom Karlsruher Institut für Technologie, der die Verbindung LMB002 synthetisiert, gereinigt und freundlicherweise für die Studie zur Verfügung gestellt hat. Die Autoren danken auch Chupryna Maksym, die das Video in der Ukraine gedreht und zusammengestellt hat, und allen mutigen Verteidigern der Ukraine, die die experimentelle Arbeit, das Schreiben und das Filmen dieser Publikation ermöglicht haben.
Materialien
| Name | Company | Catalog Number | Comments |
| Agilent 1100 Series capillary LC system | ALSI-Chrom (Agilent distributor) | - | |
| ATCC CRL-1642, LL/2 (LLC1) Lewis lung carcinoma cell line | ECACC | 90020104 | |
| C57BL/6NCrl mice, female, inbred | Charles River | Strain code: 027 | |
| CelCulture, CO2 incubator | Esco Micro | CCL-170B | |
| Corning Matrigel Basement membrane matrix | Merck | CLS354234 | |
| Corning, 384- well spheroid microplates | Merck | CLS3830 | |
| Fetal bovine serum | Merck | F7524 | |
| Gibco, DPBS | Thermo Fisher Scientific | 21600044 | |
| Gramicidin S | Lumobiotics | Custom synthesis | |
| HyClone, DMEM/high glucose | Cytiva | SH30003.04 | |
| IN Cell Analyzer 6500HS, imaging system | Cytiva | 29240358 | |
| Invitrogen, Calcein AM | Thermo Fisher Scientific | C1430 | |
| Isoflurane anesthesia machine | ASA | S/N ASA 1305 | |
| L-glutamine, 200 mM solution | Merck | G7513 | |
| LIKA-surgeon, diode surgery laser | Fotonika plus | - | |
| LMB002 | Lumobiotics | Custom synthesis | |
| Penicillin–Streptomycin, solution stabilized | Merck | P4333 | |
| PhenoPlate, 96-well plates | PerkinElmer | 6055302 | |
| Photometer PCE-LED 20 | PCE Instruments | PCE-LED 20 | |
| Thermo Scientific, Hoechst 33342 | Thermo Fisher Scientific | 62249 | |
| Thermo Scientific, Propidium iodide | Thermo Fisher Scientific | J66764-MC | |
| Trypan blue, 0.4% solution | Merck | T8154 | |
| Trypsin–EDTA, 10 x solution | Merck | T4174 | |
| UltraCruz Cell culture flasks with vented caps, 75 cm2 | Santa Cruz Biotechnology | sc-200263 | |
| UltraCruz, bottle top filters, PES, 0.22 μm | Santa Cruz Biotechnology | sc-360882 | |
| Vydac 218TP, C18 HPLC column (4.6 mm × 250 mm, 5 µm) | Altmann Analytik (Avantor distributor) | GR5103827 |
Referenzen
- Fuchter, M. J. On the promise of photopharmacology using photoswitches: a medicinal chemist's perspective. Journal of Medicinal Chemistry. 63 (20), 11436-11447 (2020).
- Volarić, J., Szymanski, W., Simeth, N. A., Feringa, B. L. Molecular photoswitches in aqueous environments. Chemical Society Reviews. 50, 12377-12449 (2021).
- Paoletti, P., Ellis-Davies, G. C. R., Mourot, A. Optical control of neuronal ion channels and receptors. Nature Reviews Neuroscience. 20, 514-532 (2019).
- Hüll, K., Morstein, J., Trauner, D. In Vivo Photopharmacology. Chemical Reviews. 118 (21), 10710-10747 (2018).
- Ma, X., et al. In vivo photopharmacology with a caged mu opioid receptor agonist drives rapid changes in behavior. Nature Methods. 20, 682-685 (2023).
- Sarabando, S. N., Palmeira, A., Sousa, M. E., Faustino, M. A. F., Monteiro, C. J. P. Photomodulation Approaches to Overcome Antimicrobial Resistance. Pharmaceuticals. 16 (5), 682 (2023).
- Kolarski, D., Szymanski, W., Feringa, B. L., Hirota, T., Hatori, M., Panda, S. Chronophotopharmacology: Methodology for high spatiotemporal control over the circadian rhythm with light. Neuromethods. 186, (2022).
- Babii, O., et al. Peptide drugs for photopharmacology: how much of a safety advantage can be gained by photocontrol. Future Drug Discovery. 2 (1), FDD28 (2020).
- Davis, A. M., Keeling, D. J., Steele, J., Tomkinson, N. P., Tinker, A. C. Components of successful lead generation. Current Topics in Medicinal Chemistry. 5 (4), 421-439 (2005).
- Balani, S. K., Miwa, G. T., Gan, L., Wu, J., Lee, F. W. Strategy of utilizing in vitro and in vivo adme tools for lead optimization and drug candidate selection. Current Topics in Medicinal Chemistry. 5 (11), 1033-1038 (2005).
- Kleijn, A., et al. A Systematic comparison identifies an ATP-based viability assay as most suitable read-out for drug screening in glioma stem-like cells. Stem Cells International. 2016, (2016).
- Rodrigues, J., Heinrich, M. A., Teixeira, L. M., Prakash, J. 3D in vitro model revolution: unveiling tumor-stroma interactions. Trends in Cancer. 7 (3), 249-264 (2021).
- Sittinger, M., et al. Tissue engineering and autologous transplant formation: practical approaches with resorbable biomaterials and new cell culture techniques. Biomaterials. 17 (3), 237-242 (1996).
- Matai, I., Kaur, G., Seyedsalehi, A., McClinton, A., Laurencin, C. T. Progress in 3D bioprinting technology for tissue/organ regenerative engineering. Biomaterials. 226, 119536 (2020).
- Babii, O., et al. Direct photocontrol of peptidomimetics: an alternative to oxygen-dependent photodynamic cancer therapy. Angewandte Chemie International Edition. 55 (18), 5493-5496 (2016).
- De Ridder, K., et al. Novel 3D lung tumor spheroids for oncoimmunological assays. Advanced NanoBiomed Research. 2 (4), 2100124 (2022).
- Pauli, C., et al. Personalized in vitro and in vivo cancer models to guide precision medicine. Cancer Discovery. 7 (5), 462-477 (2017).
- Van Straten, D., Mashayekhi, V., De Bruijn, H. S., Oliveira, S., Robinson, D. J. Oncologic photodynamic therapy: basic principles, current clinical status and future directions. Cancers. 9 (2), 19 (2017).
- Li, X., Kwon, N., Guo, T., Liu, Z., Yoon, J. Innovative strategies for hypoxic-tumor photodynamic therapy. Angewandte Chemie International Edition. 57 (36), 11522-11531 (2018).
- Hull, K., Morstein, J., Trauner, D. In vivo photopharmacology. Chemical Reviews. 118 (21), 10710-10747 (2018).
- Babii, O., et al. Structure-activity relationships of photoswitchable diarylethene-based β-hairpin peptides as membranolytic antimicrobial and anticancer agents. Journal of Medicinal Chemistry. 61 (23), 10793-10813 (2018).
- Heckl, C., Aumiller, M., Rühm, A., Sroka, R., Stepp, H. Fluorescence and treatment light monitoring for interstitial photodynamic therapy. Photochemistry and Photobiology. 96 (2), 388-396 (2020).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten