Method Article
Valutazione in vitro e in vivo di composti biologicamente attivi fotocontrollati - potenziali farmaci candidati per la fotofarmacologia del cancro
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Questo protocollo presenta una serie di esperimenti adottati per la valutazione di peptidi antitumorali fotocommutabili, che possono essere utilizzati nello screening preclinico di tali composti. Ciò include la valutazione della citotossicità in colture cellulari 2D e 3D, la valutazione dell'efficienza di fotoisomerizzazione ex vivo (tessuto modello) e l'efficacia in vivo .
Abstract
I composti fotocontrollati e biologicamente attivi sono una classe emergente di candidati farmaci "intelligenti". Forniscono ulteriore sicurezza nella chemioterapia sistemica grazie alla loro precisa attivazione spaziotemporale dirigendo una luce benigna e non ionizzabile in una posizione specifica all'interno del corpo del paziente. Questo articolo presenta una serie di metodi per valutare la potenza in vitro e l'efficienza ex vivo della fotoattivazione di composti fotocontrollati e biologicamente attivi, nonché l'efficacia in vivo nelle prime fasi dello sviluppo di farmaci. La metodologia viene applicata ai peptidi citotossici antitumorali, vale a dire gli analoghi contenenti diariletene di un noto antibiotico, la gramicidina S. Gli esperimenti vengono eseguiti utilizzando colture cellulari 2D (cellule aderenti) e 3D (sferoidi) di una linea cellulare tumorale (carcinoma polmonare di Lewis, LLC), surrogati di tessuto vivo (carne di maiale macinata) e un modello di cancro allogenico (LLC sottocutaneo) in topi immunocompetenti. La selezione dei composti più efficaci e la stima di finestre fototerapeutiche realistiche vengono eseguite tramite microscopia a fluorescenza automatizzata. L'efficienza di fotoattivazione a diversi regimi di illuminazione viene determinata a diverse profondità in un tessuto modello e il dosaggio ottimale della luce viene applicato nell'esperimento terapeutico finale in vivo .
Introduzione
I composti biologicamente attivi fotocontrollati sono emersi negli ultimi decenni come componente promettente delle chemioterapie sicure per le malattie umane e per sradicare specificamente i tumori solidi maligni1. Questi composti contengono frammenti reversibilmente fotoisomerizzabili (fotointerruttori molecolari) e possono alternare tra fotoisomeri inattivi e attivi dopo irradiazione con luce di diverse lunghezze d'onda.
Rispetto ai loro analoghi non fotocontrollabili, i farmaci fotocontrollati possono essere più sicuri perché possono essere introdotti sistemicamente nel corpo del paziente in forme meno attive ed essenzialmente non tossiche, e sono quindi attivati dalla luce solo dove necessario, come nei tumori, nelle ulcere e nelle ferite. Sebbene molteplici dimostrazioni entusiasmanti di tali prototipi di farmaci molecolari possano essere trovate in recenti articoli accademici 2,3,4,5,6,7, il campo della fotofarmacologia clinica - un'applicazione di combinazioni di farmaci / dispositivi medici / malattie approvate - non esiste. La fotofarmacologia è ancora in fase di scoperta di farmaci e gli studi preclinici sistematici sono sconosciuti.
Solo recentemente abbiamo dimostrato il vantaggio di sicurezza in vivo per alcuni peptidi antitumorali fotocontrollati, vale a dire, gli analoghi del peptide antibiotico gramicidina S8. Questi derivati fotocontrollati contengono un fotointerruttore diariletene (DAE), che subisce trasformazioni fotoindotte reversibili tra le cosiddette fotoforme "anulari" generate dalla luce rossa e "ad anello" generate dai raggi UV (illustrate nella Figura 1 per uno dei derivati, composto LMB002).
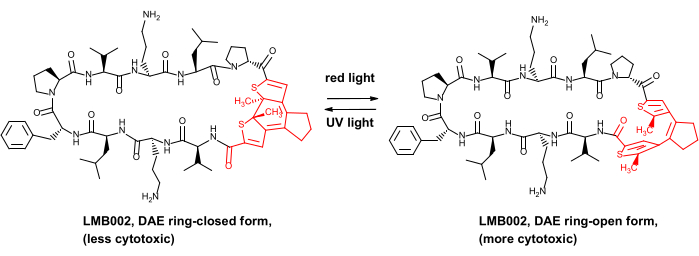
Figura 1: Peptide citotossico fotocontrollato LMB002 e sua fotoisomerizzazione. Il frammento di diariletene è mostrato in rosso. Abbreviazione: DAE = diariletene. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Trovare hit ed eseguire l'ottimizzazione hit-to-lead spesso richiede lo screening in vitro e in vivo di librerie di composti appropriate 9,10. Qui, dimostriamo una metodologia adatta per lo screening sistematico ad alto rendimento della citotossicità di composti fotocontrollati. Determiniamo anche l'efficienza della fotoisomerizzazione, stimiamo la dose di luce nei tessuti modello e valutiamo l'efficacia in vivo dei candidati con le migliori prestazioni. L'approccio è conforme alle considerazioni di bioetica e cura degli animali.
In questo lavoro, i metodi preclinici tradizionali sono modificati per evitare la fotoisomerizzazione non controllata dei composti testati. L'obiettivo generale dell'applicazione di questi metodi modificati nel presente documento è quello di sviluppare una strategia generale che sia semplice e veloce e produca dati statisticamente significativi per confrontare in modo affidabile le attività in vitro e razionalizzare i test di efficacia in vivo dei composti fotocommutabili per l'identificazione del piombo e l'ulteriore sviluppo.
La strategia consiste in tre fasi consecutive. Il primo passo prevede la determinazione di IC 50 (vitalità cellulare apparente del50 %) in diluizioni seriali per le fotoforme attive e inattive di composti biologicamente attivi fotocontrollati selezionati utilizzando colture cellulari bidimensionali (2D, monostrato) e tridimensionali (3D, sferoidi) e microscopia a fluorescenza confocale ad alta produttività. Le finestre fototerapeutiche vengono confrontate rispetto alla differenza IC50 tra le due fotoforme e vengono selezionati i candidati più performanti. Non vi è alcun vantaggio specifico nella valutazione della tossicità mediante microscopia automatizzata e altre piattaforme di screening della citotossicità (saggi)11; Modelli tumorali più complessi basati su cellule12 potrebbero essere facilmente implementati in questa fase.
Per i composti selezionati nella fase 1, il secondo passo consiste nel stimare realisticamente la loro efficienza di fotocommutazione all'interno dei tessuti in funzione della profondità dalla superficie del tessuto irradiato quantificando l'efficienza di fotocommutazione delle fotoforme meno attive in un surrogato tissutale utilizzando la cromatografia liquida ad alte prestazioni (HPLC) rilevata dai raggi UV di estratti di campioni irradiati. In vivo , l'efficienza della fotocommutazione potrebbe essere studiata, ma proponiamo di utilizzare un semplice surrogato tissutale: carne di maiale macinata. Abbiamo testato la validità di questo approccio. Abbiamo misurato la conversione dei nostri composti fotocommutabili in vivo su un modello di cancro di topi e osservato approssimativamente la stessa fotoconversione a una profondità misurata in precedenti esperimenti con topi8. È possibile utilizzare qualsiasi tessuto artificiale alternativo adatto13, tessuto / organo biostampato 3D14, materiali bioptici o altro materiale animale esente. Tuttavia, questa configurazione è un buon compromesso in quanto è economica, veloce ed etica.
Il terzo passo è la determinazione dell'efficacia antitumorale in vivo in un modello di cancro murino. I composti che dimostrano caratteristiche superiori negli esperimenti in vitro e la commutazione fotografica efficiente a una profondità di almeno 1-1,5 cm nei tessuti modello sono selezionati per questo esperimento.
Questo protocollo può essere applicato a composti che possiedono diversi tipi di fotointerruttori, a condizione che le loro fotoforme (o i loro stati fotostazionari, PSS) siano stabili per un tempo ragionevole (alcuni giorni o più). A titolo illustrativo, viene utilizzato un LMB002 derivato da DAE descritto in precedenza15. Le fotoforme LMB002 sono termicamente stabili e possono essere conservate a -20 °C per almeno un anno senza degradazione sostanziale. Le cellule del carcinoma polmonare di Lewis (LLC) sono scelte per questa dimostrazione in vitro e in vivo, ma non sono imposte restrizioni sul tipo di cellula. Le cellule LLC sono aderenti, facilmente coltivabili in 3D e utilizzate per generare tumoroidi (come descritto nel riferimento16). In vivo Le cellule LLC sono utilizzate per modellare i processi metastatici e possono facilmente generare tumori solidi in topi immunocompetenti dopo iniezione sottocutanea. Questa metodologia in vivo può essere universalmente applicata ad altri modelli di cancro17,18. L'attuazione dettagliata di questa strategia è descritta di seguito.
Protocollo
La cura degli animali e le procedure sperimentali sono state eseguite seguendo le normative locali e internazionali per la conduzione di progetti di ricerca che coinvolgono animali da laboratorio (Legge dell'Ucraina "Sulla protezione degli animali dalla crudeltà", Convenzione europea per la protezione degli animali vertebrati utilizzati a fini sperimentali e altri scopi scientifici (Convenzione europea, Strasburgo, 1986), Direttiva 2010/63 / UE sulla protezione degli animali utilizzati a fini scientifici). Questo studio è approvato dalla Commissione di Bioetica della società Bienta. In questi esperimenti sono stati utilizzati topi C57BL/6NCrl (femmine adulte del peso di circa 20 g ciascuna). I materiali, i reagenti e le attrezzature specifici sono elencati nella tabella dei materiali.
1. Valutazione IC50 per LMB002 (forme "ring-closed" e "ring-open") utilizzando colture cellulari 2D e 3D LLC
- Preparazione di tamponi e soluzioni madre dei composti
Nota : preparare i buffer utilizzando le procedure standard. In alternativa, utilizzare soluzioni disponibili in commercio.- Preparare 10x soluzione salina tamponata fosfato (PBS) aggiungendo 14,2 g di Na 2 HPO 4, 2,4 g di KH 2 PO4, 80 g di NaCl e2g di KCl a 1 L di acqua distillata. Autoclave preparato 10x PBS e diluirlo in 1x soluzione aggiungendo 100 mL di soluzione 10x a 900 mL di acqua distillata. Quindi, conservare la soluzione a 4 °C.
- Preparare il PBS di Dulbecco (DPBS) aggiungendo 4,78 g di polvere DPBS a 1 L di acqua distillata. Mescolare la soluzione fino a quando tutto il solido si dissolve, controllare il pH utilizzando un pHmetro e regolarlo aggiungendo 1 M NaOH o 1 M HCl (pH 7,3-7,4). Dopo aver raggiunto il livello di pH desiderato, filtrare il fluido attraverso un filtro a vuoto da 0,22 μm in un armadio sterile. Conservare a 4 °C.
- Preparare 1 M soluzione tampone di acido 4-(2-idrossietil)-1-piperazineetanosolfonico (HEPES) aggiungendo 238,3 g di HEPES a 1 L di acqua distillata. Regolare il pH della soluzione con 1 M NaOH fino a pH 7,5. Filtrare attraverso un filtro sottovuoto da 0,22 μm in un armadio sterile. Conservare a 4 °C.
- Preparare 1x soluzione di tripsina-EDTA (EDTA = acido etilendiamminotetraacetico) diluendo la soluzione 10x. Per fare ciò, aggiungere 5 ml di 10x Trypsin-EDTA a 45 mL di soluzione 1x PBS in un tubo sterile da 50 ml. Conservare a 4 °C.
- Preparare il Modified Eagle Medium (DMEM) di Dulbecco aggiungendo 13,4 g di DMEM ad alto glucosio in polvere e 3,7 g di Na2CO3 a 1 L di acqua distillata in un cilindro graduato con un'asta di agitazione magnetica posta su una piastra di agitazione. Mescolare la soluzione fino a quando tutto il solido si dissolve, controllare il pH utilizzando un pHmetro e regolarlo aggiungendo 1 M NaOH o 1 M HCl (pH 7,3-7,4). Dopo aver raggiunto il pH desiderato, filtrare il fluido attraverso un filtro sottovuoto da 0,22 μm in un armadio sterile e conservare a 4 °C.
- Preparare il terreno completo DMEM aggiungendo 100 ml di siero bovino fetale (FBS), 10 ml di soluzione di penicillina-streptomicina, 10 ml di soluzione di L-glutammina e 10 ml di tampone HEPES 1 M a 900 ml di DMEM basico. Conservare a 4 °C.
- Preparare le soluzioni stock per i composti di prova.
- Per ciascun composto, pesare due lotti di 5,12 mg (ad esempio, LMB002) nella fotoforma chiusa ad anello in due tubi di microcentrifuga da 1,5 ml (uno con pareti trasparenti e l'altro nero non trasparente). Pesare 2,28 mg di controllo positivo (ad esempio, gramicidina S) in un tubo a parete extra-chiaro. Aggiungere 100 μL di DMSO puro a ciascun campione e vortice per 30 s.
- Fotoisomerizzare la soluzione madre (LMB002) nel tubo a parete trasparente dalla forma "ring-closed" a quella "ring-open" irradiando la soluzione con laser 660 nm (densità di potenza luminosa 0,6 W/cm2) con vortice per garantire una miscelazione accurata. Continua fino a quando il colore cambia visibilmente dal viola scuro al marrone chiaro. Proteggere dalla luce usando un foglio di alluminio.
- Esperimento di coltura cellulare 2D-semina delle cellule (giorno 1)
- Trasferire 10 mL del mezzo completo DMEM dal pallone T-75 con una coltura cellulare LLC a un tubo sterile da 15 ml. Aspirare il mezzo rimanente con una pompa per vuoto.
- Lavare la coltura cellulare con 5 ml di 1x DPBS e aspirare la soluzione con una pompa per vuoto.
- Coprire le cellule con 3 mL di soluzione 1x tripsina-EDTA e incubare il matraccio per 2-3 minuti a 37 °C in atmosfera al 5% di CO2 .
- Interrompere l'azione della tripsina aggiungendo 6 mL del mezzo DMEM (precedentemente trasferito in un tubo sterile) al pallone di coltura cellulare contenente 1x soluzione di tripsina-EDTA e pipettando più volte la sospensione per lavare le cellule dalle pareti del pallone di coltura cellulare.
- Trasferire la sospensione in un tubo da 15 ml e centrifugare a 200 × g per 4 minuti. Dopo la centrifugazione, aspirare il surnatante con una pompa per vuoto. Evitare di toccare il pellet cellulare sul fondo del tubo.
- Risospendere le cellule aggiungendo 2 ml di terreno completo DMEM fresco e pipettaggio più volte.
- Contare le cellule campionando circa 15 μL della sospensione in una provetta da 0,5 ml, aggiungendo 15 μL di blu tripano allo 0,4% e trasferendo la miscela ottenuta in una camera di conteggio delle cellule.
- Dopo il conteggio, preparare 25 ml della sospensione cellulare per punto temporale. Semina 5.000-10.000 (8.000 in media) cellule LLC / pozzetto in 200 μL di DMEM nei 60 pozzetti centrali di una piastra a 96 pozzetti con fondo chiaro e pareti nere non trasparenti. Riempire i restanti 36 pozzetti con DMEM puro.
- Posizionare le piastre in un incubatore per colture cellulari per una notte a 37 °C e al 5% di CO2. Utilizzare coperchi di piastre di plastica sotto per evitare il riscaldamento irregolare della piastra inferiore.
- Esperimento di coltura cellulare 2D - aggiunta dei composti (giorno 2)
- Monitorare le cellule mediante microscopia ottica nelle piastre fino a quando le cellule hanno raggiunto il 70% -80% di confluenza.
- Aspirare il mezzo dai pozzetti con una pompa per vuoto in un armadio sterile. Aggiungere 100 μL del mezzo DMEM fresco preriscaldato e posizionare le piastre in un incubatore di coltura cellulare.
- Preparare diluizioni seriali dei composti in esame e controllo positivo in piastre trasparenti autoclavate in polipropilene. Effettuare le seguenti soluzioni per le misurazioni dei singoli punti temporali:
NOTA: Iniziare con le scorte di DMSO e diluire con DMEM, ma non superare l'1% v/v di DMSO nella concentrazione finale più elevata.- Per ottenere una soluzione 128 μM di gramicidina S, aggiungere 1,3 μL di 20 mM di soluzione madre a 198,7 μL di DMEM.
- Per ottenere una soluzione da 256 μM di LMB002, in forma "ring-open", aggiungere 1,3 μL di soluzione 40 mM a 198,7 μL di DMEM.
- Per ottenere una soluzione da 512 μM di LMB002, in forma "ring-closed", aggiungere 2,6 μL di soluzione madre da 40 mM a 197,4 μL di DMEM.
- Eseguire tre ripetizioni aggiuntive per ottenere quattro serie di ciascun punto di concentrazione. Preparare una serie di doppia diluizione aspirando 100 μL da ciascun pozzetto di partenza, trasferendo in un pozzetto con 100 μL di DMEM e mescolando accuratamente.
NOTA: lavorare con composti fotocommutabili richiede la regolazione dell'illuminazione per evitare la fotoisomerizzazione posteriore. Si consiglia di spegnere la luce in armadi sterili. - Ottenere le concentrazioni finali dei composti nei pozzetti (5-150 μM) trasferendo 100 μL delle soluzioni preparate ogni volta in 56 pozzetti con 100 μL di DMEM precedentemente aggiunto. Aggiungere 100 μL di DMEM ogni volta in quattro pozzetti per fungere da controllo negativo.
- Piastre di copertura con foglio di alluminio o coperchio protettivo in plastica non trasparente per impedire la commutazione incontrollata della foto. Posizionare le piastre in un incubatore per colture cellulari a 37 °C (utilizzando sotto i coperchi delle piastre di plastica supplementari) per il tempo di incubazione scelto (10 min, 60 min, 24 h o 72 h).
- Esperimento di coltura cellulare 2D - colorazione e imaging (giorni 2-5)
- Dopo l'incubazione con composti per periodi diversi, aggiungere 50 μL della soluzione colorante per pozzetto alle piastre che sono state incubate con composti per 10 e 60 minuti. Incubare le piastre a 37 °C per 20 min.
NOTA: Preparare le soluzioni di colorazione per punto temporale aggiungendo 8 μL di soluzione Hoechst 33342 da 20 mM (la concentrazione finale è 5 μM), 32,5 μL di soluzione di ioduro di propidio (PI) da 1 mM (concentrazione finale è 1 μM) e 650 μL di FBS non sterile a 5.810 μL di 1x PBS non sterile. Preriscaldare FBS e PBS a bagnomaria a 37 °C per evitare che le cellule subiscano uno shock termico. - Eseguite l'imaging a fluorescenza automatizzato utilizzando un obiettivo 20x.
- Ripetere la stessa procedura di colorazione e imaging (fasi 1.4.1 -1.4.2) per le piastre che sono state incubate con composti per 24 (giorno 3) e 72 (giorno 5) h.
NOTA: le tipiche mappe 2D delle lastre sono illustrate nella Figura 2.
- Dopo l'incubazione con composti per periodi diversi, aggiungere 50 μL della soluzione colorante per pozzetto alle piastre che sono state incubate con composti per 10 e 60 minuti. Incubare le piastre a 37 °C per 20 min.
- Esperimento di coltura cellulare 3D - seminare le cellule (giorno 1)
NOTA: i passaggi di questa sezione sono identici a quelli descritti per la preparazione dell'esperimento 2D della coltura cellulare, l'incubazione con i composti testati e l'imaging (passaggi 1.1-1.4). Tuttavia, in questo caso, le cellule vengono preparate come sferoidi maturi compatti in una piastra inferiore a U a bassissima adesione a 384 pozzetti con pareti nere e non trasparenti. L'uso di una piastra di queste dimensioni consente di confrontare due composti in un esperimento.- Ripetere i passaggi 1.2.1-1.2.9 del protocollo dell'esperimento 2D con una coltura cellulare LLC.
- Dopo aver contato le cellule, preparare 25 ml della sospensione cellulare. Seminare 1.000 cellule per pozzetto in tutti i pozzetti in 50 μL di DMEM in una piastra con fondo a U a 384 pozzetti, a basso legame.
- Centrifugare a 40 × g per 30 s e agitare con uno scuotitore a piastre a 250 giri / min per 1 minuto per scuotere le cellule dalle pareti dei pozzetti verso il basso.
- Posizionare le piastre in un incubatore a 37 °C e al 5% di CO2 sopra i coperchi delle piastre di plastica supplementari per evitare il riscaldamento irregolare del fondo della piastra per 48 ore.
- Esperimento di coltura cellulare 3D - aggiunta dei composti (giorno 3)
- Monitorare le cellule nelle piastre al microscopio per assicurarsi che si siano formati sferoidi maturi compatti.
- Preparare una diluizione seriale dei composti studiati in lastre trasparenti autoclavate in polipropilene. In questo caso, includere un composto aggiuntivo. Effettuare le seguenti soluzioni per le misurazioni dei singoli punti temporali:
- Per ottenere soluzioni da 175 μM e 350 μM di gramicidina S, aggiungere 1,8 μL di soluzione madre da 20 mM a 198,2 μL di DMEM e aggiungere 3,6 μL di stock a 196,4 μL di DMEM per corrispondenza.
- Per ottenere soluzioni da 175 μM e 350 μM di LMB002, in forma "ring-open", aggiungere 1 μL di soluzione madre da 40 mM a 199 μL di DMEM e aggiungere 1,8 μL di stock a 198,2 μL di DMEM corrispondentemente.
- Per ottenere soluzioni da 350 μΜ e 1.750 μM di LMB002, in forma "ad anello chiuso", aggiungere 1,8 μL di soluzione madre da 40 mM a 198,2 μL di DMEM e aggiungere 8,8 μL di stock a 191,2 μL di DMEM per corrispondenza.
- Eseguire tre repliche aggiuntive per ottenere quattro serie di ciascun punto di concentrazione. Acquisire diluizioni seriali prelevando 20 μL da ciascun pozzetto di partenza, trasferendolo nel pozzetto, con 180 μL di DMEM, e mescolando accuratamente.
NOTA: lavorare con composti fotocommutabili richiede la regolazione dell'illuminazione per evitare la fotoisomerizzazione posteriore. Si consiglia di spegnere le luci negli armadi sterili. - Ottenere le concentrazioni finali di composti nei pozzetti trasferendo 20 μL delle soluzioni preparate ogni volta in 128 pozzetti contenenti 50 μL di DMEM. Aggiungere 20 μL di DMEM ogni volta in tre pozzetti per fungere da controllo. Coprire le piastre con un foglio di alluminio o una copertura protettiva in plastica per evitare la fotocommutazione o l'evaporazione.
- Posizionare le piastre in un incubatore di coltura cellulare su coperchi di piastre di plastica per il tempo di incubazione scelto.
- Esperimento di coltura cellulare 3D - colorazione e imaging (giorni 3-6)
- Preparare la soluzione colorante per punto temporale aggiungendo 13 μL di soluzione 1 mM di calceina AM (la concentrazione finale è 1 μM), 22 μL di soluzione 20 mM Hoechst 33342 (la concentrazione finale è 33 μM), 40 μL di 1 mM di soluzione PI (concentrazione finale è 3 μM), 300 μL di FBS non sterile a 2.625 μL di 1x PBS non sterile. Preriscaldare FBS e PBS a bagnomaria a 37 °C per evitare che le cellule subiscano uno shock termico.
- Dopo l'incubazione per diversi periodi con i composti, aggiungere 20 μL della soluzione colorante per pozzetto ai pozzetti che sono stati incubati con composti per 10 minuti. Incubare a 37 °C per 2 ore.
- Eseguire l'imaging confocale a fluorescenza utilizzando un obiettivo 20x.
- Ripetere la stessa procedura di colorazione e imaging per i pozzi che sono stati incubati con composti per 24 (giorno 4) e 72 (giorno 6) h.
NOTA: In questo esperimento, calceina AM viene utilizzata come terzo componente della soluzione di colorazione multicolore. Le immagini ottenute da esperimenti 2D e 3D vengono analizzate utilizzando il software di analisi automatica delle immagini dello strumento. Le cellule co-colorate con coloranti Hoechst e ioduro di propidio sono considerate necroticamente morte e la loro frazione in funzione della concentrazione viene utilizzata per calcolare il valore IC50 .
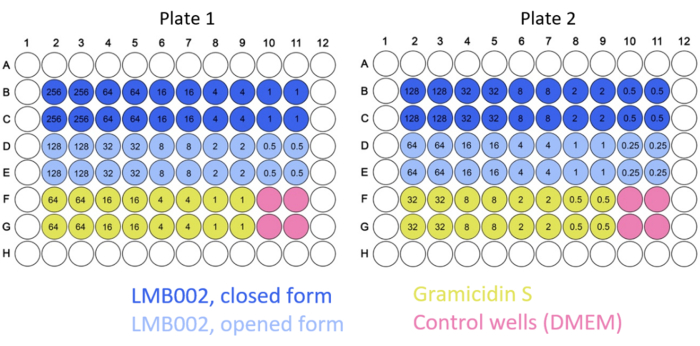
Figura 2: Esempio di mappe tipiche delle lastre per gli esperimenti di coltura 2D. Sono indicati i codici colore per i composti e il controllo. Le concentrazioni dei composti testati (numeri all'interno dei pozzetti) sono indicate in μM. Fare clic qui per visualizzare una versione ingrandita di questa figura.
2. Determinazione dell'efficienza di fotocommutazione in un surrogato tissutale
- Assemblare il treno ottico per l'irradiazione del campione come mostrato nella figura 3 (costituito da un cavo ottico dalla sorgente di luce laser, una lente con lunghezza focale variabile, una siringa con un coperchio non trasparente e un'estremità a taglio piatto).
- Modificando la lunghezza focale e l'apertura della lente, ottenere un fascio di luce piatto con un diametro maggiore di 1-1,5 mm rispetto al diametro interno della siringa utilizzata ma che sia ancora, per quanto possibile, all'interno dell'apertura.
- Utilizzare una siringa da 5 mL con un'estremità tagliata e un diametro interno di 12,4 mm ed è coperta da un coperchio di plastica non trasparente. Con una potenza di uscita laser di 200 mW, impostare la densità di potenza all'uscita del sistema ottico su ~103 mW/cm2 misurata con un fotometro.
NOTA: Tutte le operazioni successive devono essere eseguite in una stanza buia con la minima illuminazione possibile del posto di lavoro. - Preparare 3 mL di LMB002 (forma "ring-closed") soluzione madre in PBS con una concentrazione di 1 mg/ml.
- Preparare un campione di tessuto modello caricato con la fotoforma inattiva di LMB002 in un contenitore di plastica. In una corsa tipica, 5 g di carne di maiale macinata fresca vengono miscelati meccanicamente con 277 μL di soluzione madre LMB002 e 260 μL di PBS per raggiungere la concentrazione finale di 50 mg / kg nel campione e il rapporto tessuto/PBS di ~ 9/1 (v / v).
- Riempire la siringa con il campione preparato, assicurandosi che non ci siano bolle d'aria all'interno e formare una superficie piana all'estremità dell'esposizione (taglio).
NOTA: Il cilindro del campione nella siringa deve occupare ~40 mm lungo l'asse. - Irradiare il campione nel treno ottico come mostrato nella figura 3 per 9 min 44 s, corrispondente a ~60 J/cm2 di esposizione.
- Preparare fette di campione spesse 4 mm dopo l'esposizione spingendolo fuori dalla siringa usando il pistone e tagliandolo con un bisturi. Pesare e collocare le fette in provette separate e contrassegnarle in base alla distanza media (mm) dalla superficie irradiata.
- Preparare due campioni di controllo (quantità ottimale, 0,5-0,7 g) in provette: in uno, carne macinata mescolata con il 10% (volume) di PBS (54 μL), e nell'altro, il campione di tessuto modello ottenuto nella fase 2.4 irradiato da 500 mW di luce laser per 10 minuti per garantire che tutte le molecole LMB002 "ring-closed" siano convertite nella forma "ring-open".
- Aggiungere la miscela acetonitrile-acqua (70%/30% v/v, integrata con acido trifluoroacetico (TFA) allo 0,01%, 1,4 ml/g) a ciascuna fetta e ai campioni di controllo. Mescolare accuratamente il contenuto usando una bacchetta di vetro.
- Incubare a temperatura ambiente per almeno 10 minuti e centrifugare le miscele a 5220 x g per 20 minuti o centrifugare a 20 x g per 30 minuti due volte per rimuovere il materiale insolubile e raccogliere il surnatante.
- Raccogliere con cura i surnatanti (~0,7 ml) e centrifugarli nuovamente a 16.000 x g per 30 minuti.
- Raccogliere i surnatanti (~0,5 ml ciascuno) e analizzarli mediante cromatografia liquida ad alte prestazioni a fase inversa (RP HPLC) con colonna analitica C18, gradiente lineare A:B del 3,46% B/min, portata 2,0 ml/min e 100 μL di volume iniettato. Registrare i cromatogrammi rilevati UV a 570 nm (rilevamento della forma "ring-closed") e 270 nm (rilevamento della forma "ring-open"). Utilizzare i campioni non irradiati (fase 2.4) e di controllo irradiati (fase 2.8) per determinare i tempi specifici di ritenzione di entrambe le fotoforme (eluente A: acquoso 0,1% TFA; eluente B: 90% acetonitrile-acqua, 0,1% TFA) e calibrare il metodo.
- Determinare le quantità effettive di fotoforme LMB002 nei campioni analizzati utilizzando le curve di calibrazione ottenute prelevando e analizzando i cromatogrammi delle soluzioni LMB002 di concentrazioni note. Per la taratura, preparare le soluzioni "ring-closed" LMB002 diluendo la soluzione madre (fase 2.3) con miscela acetonitrile-acqua (70%/30% v/v integrata con 0,01% TFA) per ottenere 0,36, 0,9 e 3,6 μg per 100 μL (il volume iniettato); Il gradiente dell'eluente e la portata sono gli stessi del punto 2.12.
- Ripetere l'esperimento (punti 2.4-2.12) tre volte e tracciare la percentuale normalizzata di ciascuna fotoforma sul grafico (percentuale) rispetto alla distanza (dalla superficie del tessuto irradiato). Calcolare le statistiche (cioè la deviazione standard in ogni punto di concentrazione).
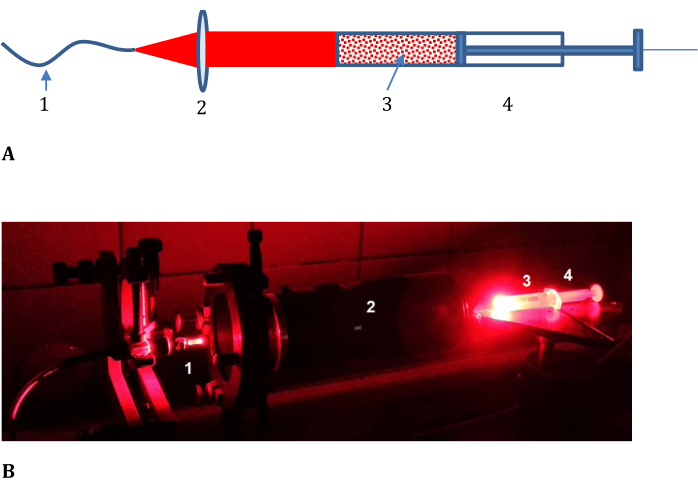
Figura 3: Configurazione sperimentale per determinare l'efficienza della fotoconversione nel tessuto modello. (A) Schema e (B) fotografia; 1, cavo ottico dalla sorgente di luce laser; 2, obiettivo con lunghezza focale variabile; e 3, miscela salina tritata-LMB002-fosfato-tampone posto in 4, una siringa con un coperchio non trasparente e frontend tagliato (mostrato in (B) senza coperchio). Fare clic qui per visualizzare una versione ingrandita di questa figura.
3. Determinazione dell'efficacia antitumorale in vivo
NOTA: la pianificazione e gli endpoint dell'esperimento sono illustrati nella Figura 4. Gli standard di cura degli animali nel periodo successivo al trattamento dovrebbero essere conformi alle regole 3R: l'alloggiamento dovrebbe includere un'adeguata densità della gabbia e la disponibilità di risorse. Quando possibile, attenersi a metodi di manipolazione degli animali non avversivi come tunnel o coppettazione.
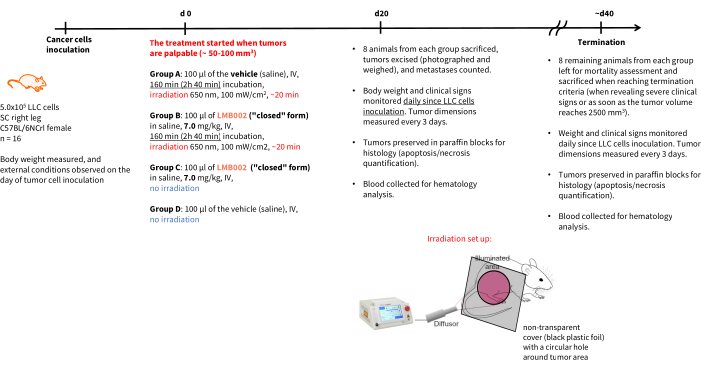
Figura 4: Calendario per l'esperimento terapeutico in vivo . Designazione dei gruppi sperimentali, dettagli della terapia, endpoint e programmi di analisi post mortem . Abbreviazioni: LLC = carcinoma polmonare di Lewis; IV = endovenosa; SC = sottocutaneo. Fare clic qui per visualizzare una versione ingrandita di questa figura.
- Preparazione delle cellule tumorali per l'inoculazione sottocutanea (giorno 0).
- Far passare le cellule LLC in DMEM (4,5 g / L glucosio) con 10% FBS, 100 U / mL penicillina e 100 μg / mL streptomicina a 37 ° C e 5% CO2.
- Raccogliere le cellule utilizzando una soluzione di tripsina-EDTA allo 0,05%, centrifugare e sospendere in DMEM senza siero.
- Contare le cellule e determinare la loro vitalità utilizzando un emocitometro e un test di esclusione del blu di tripano.
- Preparare la sospensione cellulare finale con concentrazione 10 × 106 cellule/ml in DMEM e Matrigel mix (1:1). Mantenere la sospensione sul ghiaccio prima dell'iniezione.
- Inoculazione cellulare LLC (giorno 0)
- Posizionare il topo femmina adulto C57BL/6NCrl (del peso di ~20 g) nella camera di induzione della macchina per anestesia isoflurano. Eseguire la sedazione al 5% di isoflurano e attendere che l'animale sia completamente incosciente.
- Rimuovere la pelliccia dall'area di inoculazione cellulare con la rasatura.
- Inoculare 5 × 105 cellule LLC in ~100 μL di DMEM: Matrigel (1:1) miscela nell'arto posteriore destro.
NOTA: Quando possibile, attenersi alla pratica dell'uso di un singolo ago.
- Somministrazione di composti e fotoirradiazione
NOTA: In 5-8 giorni dopo l'inoculazione, gli animali sono pronti per il trattamento quando i loro tumori sono palpabili e hanno raggiunto ~ 50-100 mm3 volume. Eseguire tutte le operazioni successive con LMB002 e topi trattati con questo composto in condizioni di semi-buio (una lampada LED da 4 W ad almeno 5 m dal posto di lavoro).- Sciogliere LMB002 (forma "ring-closed") in soluzione fisiologica sterile ad una concentrazione di 1 mg/ml per la dose di 5 mg/kg (IV) per ottenere soluzioni omogenee blu scuro.
- Prima dell'irradiazione, assemblare casualmente quattro gruppi di otto animali e rimuovere la pelliccia dal tumore e dalle aree vicine radendosi.
- Inserire un topo nel supporto per iniezioni endovenose e preriscaldare la coda dell'animale a bagnomaria a 37 °C per rendere visibile la vena caudale.
NOTA: Considerare l'analgesia preoperatoria. - Iniettare il composto a 5 ml/kg nella vena caudale. Per i due gruppi di controllo, iniettare 100 μL di soluzione salina (per via endovenosa) per animale (20 g di peso corporeo). Assicurarsi che gli animali nei due gruppi sperimentali ricevano il composto testato nella fotoforma inattiva (1 mg / ml in soluzione salina).
NOTA: Quando possibile, attenersi alla pratica dell'uso di un singolo ago. - Quindi, 2 h 45 minuti dopo l'iniezione del composto, posizionare il topo in anestesia. Indurre sedazione con isoflurano al 3%-4% in ossigeno. Mantenere l'anestesia per 15 minuti con isoflurano 0,5% -1% in ossigeno.
- Coprire il topo con una maschera nera che possiede un foro che espone solo l'area del tumore alla luce.
- Accendere il modulo diodo laser con un laser da 650 nm e impostare la potenza del laser rosso su 200 mW e del laser a guida blu/UV su 2 mW.
NOTA: Utilizzare occhiali protettivi blu quando il dispositivo laser è acceso. - Misurare il flusso luminoso dal laser rosso (lontano dai mouse) con un fotometro e determinare la distanza dal cavo ottico in cui il flusso luminoso è di 100 mW/cm2. Fissare il cavo su un supporto per assicurarsi che la sorgente luminosa sia alla distanza determinata dal tumore e che la luce copra l'intera area tumorale. Utilizzare la luce laser a guida blu / UV durante questa procedura.
- Accendere il laser rosso per irradiare l'area tumorale per 20 minuti.
- Dopo l'irradiazione, spegnere il flusso di isoflurano, riportare l'animale nella sua gabbia e osservare attentamente le sue condizioni nei successivi 30 minuti.
NOTA: Dopo la somministrazione composta, tenere i topi al buio per 2 giorni. Solo il ciclo luce-giorno deve essere modificato; Tutte le altre condizioni abitative dovrebbero rimanere invariate.
- Osservazioni post-trattamento
- Osserva quotidianamente gli animali e misura il peso e le dimensioni dei loro tumori. Misurare il volume del tumore e notare la progressione della necrosi.
NOTA: Gli standard di cura degli animali nel periodo post-trattamento devono essere conformi alle regole 3R: l'alloggiamento dovrebbe includere un'adeguata densità della gabbia e la disponibilità di risorse. - Utilizzare i dati raccolti nel passaggio precedente per valutare la mortalità. Determinare il tasso di sopravvivenza utilizzando la procedura standard.
NOTA: Gli animali devono essere sacrificati e contati come morti quando rivelano gravi segni clinici (perdita di peso corporeo superiore al 15%, ulcerazione tumorale non guarisce in 7 giorni e vocalizzazione) o non appena il volume del tumore raggiunge 2.500 mm3.
- Osserva quotidianamente gli animali e misura il peso e le dimensioni dei loro tumori. Misurare il volume del tumore e notare la progressione della necrosi.
Risultati
In questo lavoro, sono stati condotti esperimenti su cellule 2D e 3D per determinare l'IC50 per le forme "ring-closed" e "ring-open" di LMB002 (vedi Figura 1) in diversi tempi di incubazione. Questi valori sono stati confrontati con quelli ottenuti per il prototipo di peptide, la gramicidina S (utilizzata come controllo positivo). Un tipico insieme di immagini dell'incubazione nella coltura LLC coltivata in 2D dopo la colorazione è mostrato nella Figura 5. La co-colorazione con Hoechst 33342 (blu) e ioduro di propidio (rosso) con conseguente diverse tonalità di viola in una frazione maggiore di cellule nel caso del trattamento con forma "ring-open" rispetto a "ring-closed" indica una notevole differenza di citotossicità tra due forme che può essere facilmente quantificata. L'esempio dimostrato di un esperimento riuscito si basa sui dati raccolti utilizzando il formato a piastra a 96 pozzetti, in cui sono state aggiunte le varianti peptidiche a concentrazioni variabili, come mostrato nella Figura 2. Dati simili possono essere acquisiti con pozzetti a 384 pozzetti e piastre ad alta densità. Tuttavia, poiché i volumi per pozzo sono ridotti, gli errori tecnici e sistematici e, di conseguenza, l'accuratezza della determinazione IC50 diminuiranno con l'aumentare della densità del pozzo.
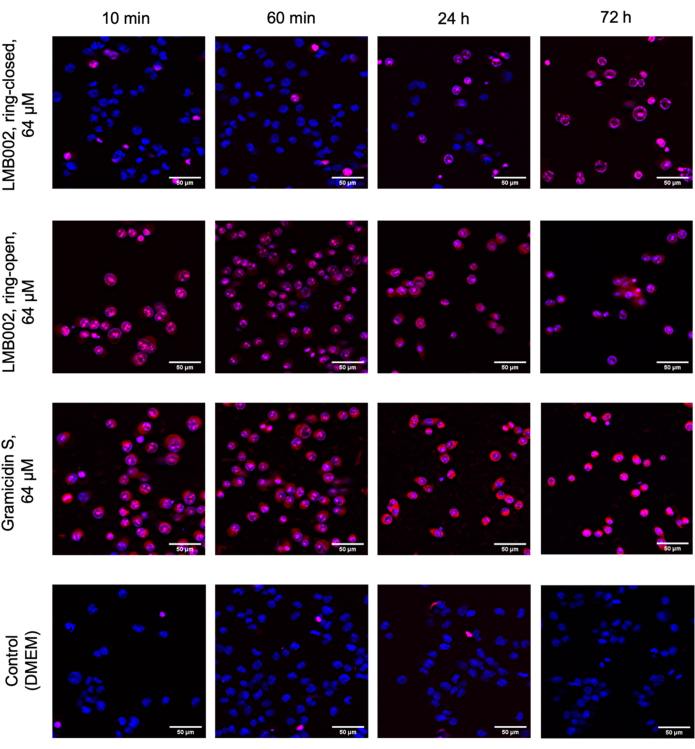
Figura 5: Immagini rappresentative del saggio di citotossicità nella LLC coltivata a monostrato. Le cellule sono state colorate con Hoechst 33342 (blu) e ioduro di propidio (rosso). I tempi indicati: 10 min, 60 min, 24 h e 72 h sono tempi di incubazione con composti. Barre di scala = 50 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
La fotoconversione di LMB002 mediante irradiazione di luce laser in un tessuto modello - carne di maiale fresca macinata - è stata determinata utilizzando un campione composto da carne macinata mescolata con LMB002 "ring-closed" (inattiva) forma disciolta in PBS e misurando la conversione di questa forma inattiva nella forma LMB002 "ring-open" (attivata) nella direzione della propagazione della radiazione. Il campione è stato posto in una siringa e irradiato da un lato con un fascio piatto di radiazione laser per il tempo di esposizione di ~ 10 minuti (solitamente utilizzato negli esperimenti in vivo ), come mostrato nella Figura 3. Dopo l'esposizione, il cilindro del campione è stato diviso in parti premendo il pistone della siringa e tagliando le fette della stessa altezza con un bisturi. La concentrazione di LMB002 "ring-open" negli estratti delle fette è stata determinata utilizzando RP HPLC.
La figura 6 illustra le curve dose-effetto ottenute dalla figura 6A-D dall'analisi dei dati. Per identificare la percentuale di cellule morte con co-colorazione nucleare di Hoechst 33342 e coloranti PI, abbiamo utilizzato uno strumento di classificazione integrato che imposta soglie numeriche a parametri misurati selezionati per dividere tutti i conteggi delle celle in diverse categorie. Ad esempio, quando il segnale del canale rosso (ioduro di propidio) nel controllo era alla soglia (circa 110-130 unità), le cellule potrebbero essere classificate come PI-positive, considerate come morte, o PI-negative, considerate come non influenzate dai composti. Per LMB002, si possono osservare dipendenze sigmoidali della percentuale di cellule positive allo ioduro di propidio sulla concentrazione del composto. Da questi dati è possibile determinare i valori IC50.
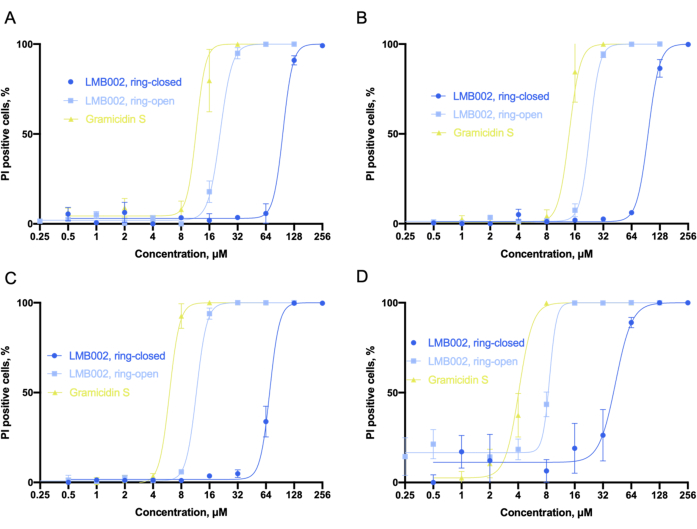
Figura 6: Analisi della citotossicità in coltura 2D. I sigmoidi si adattano come sono stati ottenuti nella coltura LLC per (A) 10 min, (B) 60 min, (C) 24 h e (D) 72 h-intervalli di tempo presi per l'incubazione con composti. Il raccordo consente la determinazione accurata dei valori IC50 (non mostrati). Le barre di errore sono SEM. Abbreviazioni: LLC = carcinoma polmonare di Lewis; PI = ioduro di propidio. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Considerando i valori IC50 ottenuti, possiamo concludere che la tossicità di tutti e tre i composti è aumentata con il tempo di incubazione. Il nostro esperimento ha rivelato che la forma "ad anello" di LMB002 è circa una fase di diluizione meno tossica del peptide prototipo, la gramicidina S. Mentre la forma "ad anello chiuso" dimostra da tre a quattro fasi di diluizione una tossicità inferiore, che aumenta con il tempo di incubazione. La differenza tra le due fasi di diluizione non è influenzata dall'aumento del tempo di incubazione e può essere utilizzata numericamente come finestra fototerapeutica 6 determinata sperimentalmenteper il confronto con altri composti in un potenziale screening di libreria. Il valore IC50 per la gramicidina S è stato fissato come punto di riferimento per correggere errori sperimentali o output differenziali in repliche biologiche.
Gli esperimenti sulle cellule 3D hanno prodotto lo stesso tipo di dati grezzi: le immagini sferoidi risolte a singola cellula una per pozzetto. L'inclusione della calceina come terzo colorante colorante consente la quantificazione della frazione di cellule metabolicamente attive (osservate nel canale verde). Utilizzando piastre a 384 pozzetti, aumentando il numero di repliche tecniche, escludendo i punti temporali di co-incubazione ridondanti e modificando la piega di diluizione, siamo stati in grado di confrontare direttamente diversi composti in un singolo test (utilizzando una singola piastra) come illustrato nella mappa delle piastre nella Figura 7.
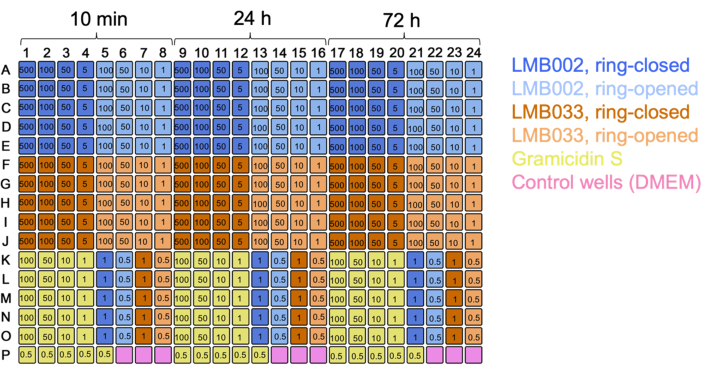
Figura 7: Mappa delle lastre per l'esperimento di coltura 3D con due composti. Sono indicati i codici colore per i composti e il controllo. I numeri nei pozzi sono concentrazioni in μM. 10 min, 24 h e 72 h sono tempi di incubazione. Fare clic qui per visualizzare una versione ingrandita di questa figura.
La Figura 8 mostra le immagini di repliche tecniche selezionate di sferoidi LLC cresciuti a una densità di 1 sferoide/pozzetto in presenza di composti testati e sferoidi di controllo catturati dopo la colorazione.
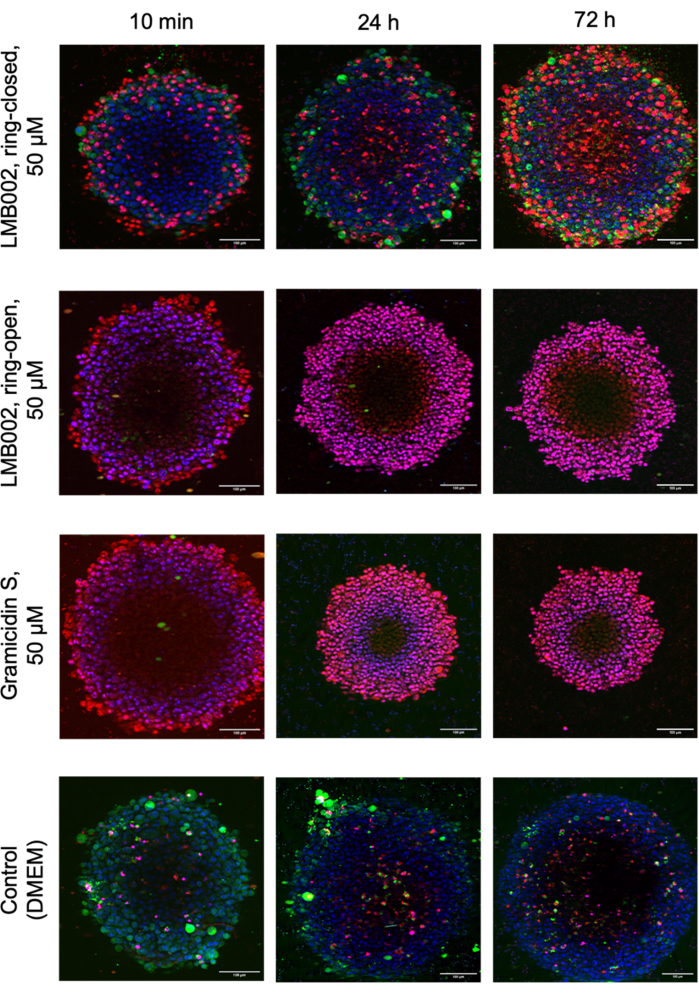
Figura 8: Immagini rappresentative dal saggio di citotossicità della coltura 3D. Le immagini mostrano sferoidi LLC di 48 ore colorati con Hoechst 33342 (blu), calceina AM (verde) e ioduro di propidio (rosso) dopo 10 min, 24 h e 72 h di co-incubazione con fotoforme LMB002 e gramicidina S. Barre di scala = 100 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
Utilizzando il software dello strumento, le curve dose-effetto, come quelle dell'esperimento 2D, sono state ottenute dalle pile di immagini impilate a z (Figura 9A). Inoltre, gli sferoidi compatti e non deformati nelle colture 3D potrebbero essere caratterizzati dal diametro dell'intero sferoide (Figura 9B). È stato anche notato che il diametro sferoide complessivo varia con la concentrazione composta.
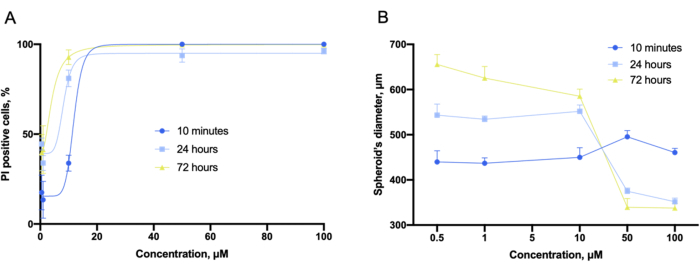
Figura 9: Valutazione della citotossicità con colture 3D. (A) Curve di adattamento della citotossicità concentrazione-dipendenti e (B) grafici di diametro dello sferoide dipendenti dalla concentrazione ottenuti nelle colture 3D di LLC co-incubate con gramicidina S per 10 minuti, 24 ore e 72 ore e catturate prima della colorazione. Le barre di errore sono SEM. Fare clic qui per visualizzare una versione ingrandita di questa figura.
L'esperimento per la fase 2 consente di determinare le concentrazioni di LMB002 in entrambe le fotoforme utilizzando la cromatografia liquida ad alte prestazioni rilevata dai raggi UV. L'efficienza della fotoconversione nei tessuti modello è stata facilmente valutata e quantificata utilizzando questa configurazione (Figura 3). I dati sono stati ottenuti dall'analisi quantitativa dei cromatogrammi degli estratti campione. In questi esperimenti di prova, i cromatogrammi LMB002 sono stati rilevati spettroscopicamente a 270 nm e 570 nm. A 270 nm, molti segnali aggiuntivi sono stati osservati e attribuiti ai composti co-estratti dal tessuto modello (verificati dall'estratto di controllo senza il composto). Entrambe le fotoforme erano sufficientemente diverse nei tempi di ritenzione e assorbanza. Tuttavia, il segnale "ring-open" LMB002 era separato dalla linea di base da questi segnali di fondo (vedere un cromatogramma rappresentativo in Figura 10A). Pertanto, questo segnale può essere integrato senza problemi. A 570 nm, i cromatogrammi contenevano solo il segnale di forma "ring-closed" LMB002 (Figura 10B). Qui, abbiamo eseguito la determinazione della concentrazione utilizzando RP HPLC. Tuttavia, è possibile ottenere un'accuratezza ancora più elevata e limiti di rilevamento inferiori utilizzando LC/MS come metodo analitico.
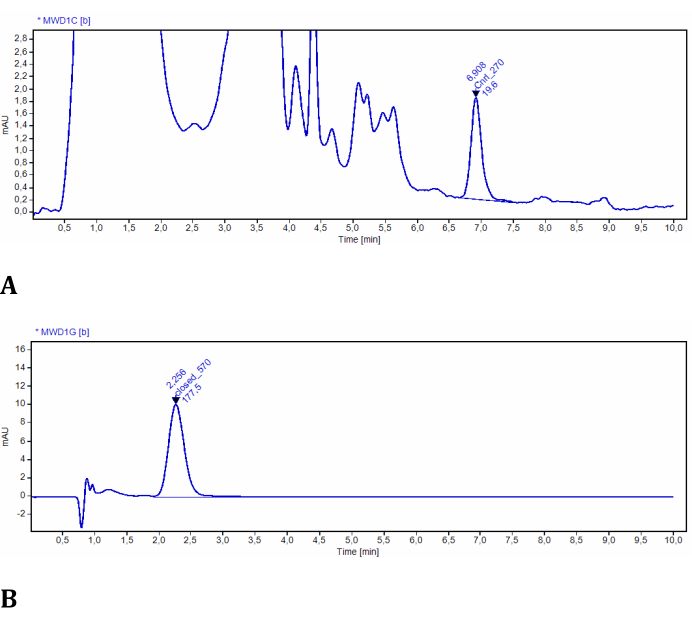
Figura 10: Cromatogrammi rappresentativi di LMB002 estratti da tessuti modello. (A) campione a 2 mm dalla superficie irradiata, registrato a 270 nm (LMB002 forma "ring-open" è integrato); (B) campione a 38 mm dalla superficie irradiata, registrato a 570 nm (il picco di LMB002 "ring-closed" è integrato). I valori del tempo di ritenzione (indicati) hanno inoltre confermato l'identità del composto. Fare clic qui per visualizzare una versione ingrandita di questa figura.
I dati ottenuti dopo aver integrato i segnali corrispondenti di tutti i campioni raccolti sono stati utilizzati per costruire i grafici concentrazione-profondità, come mostrato nella Figura 11. Sulla base di questi grafici, l'efficienza della fotoconversione a diverse profondità del tessuto modello è stata facilmente valutata. Conferma che la nostra sorgente di luce rossa induce la fotoconversione LMB002 "ad anello" a una profondità fino a 1 c, nella carne macinata surrogata del tessuto (a circa 103 mW / cm2).
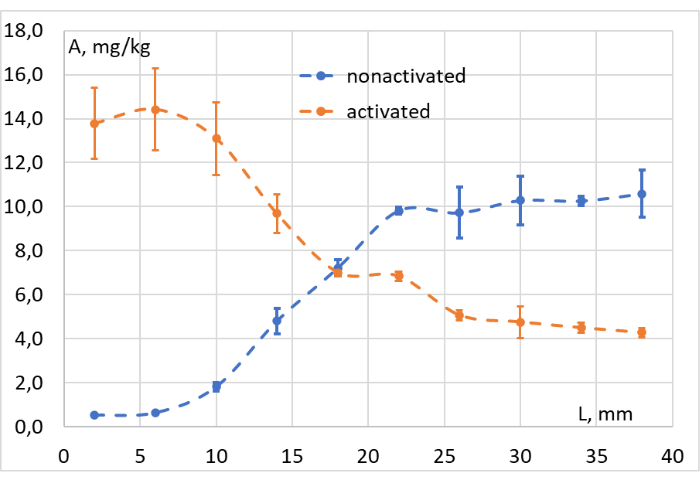
Figura 11: Valutazione dell'efficienza di fotoconversione. Concentrazione (A, mg/kg) di LMB002 forme "ring-closed" (non attivate, punti blu) e "ring-open" (attivate, punti arancioni) a diverse distanze dalla superficie irradiata del tessuto modello (L, mm). Fare clic qui per visualizzare una versione ingrandita di questa figura.
I risultati dell'esperimento in vivo - Fase 3 della nostra metodologia eseguita secondo lo schema presentato in Figura 4 - sono stati rappresentati da grafici che mostrano la crescita tumorale in funzione del tempo (Figura 12) e delle curve di sopravvivenza di Kaplan-Meier (Figura 13).
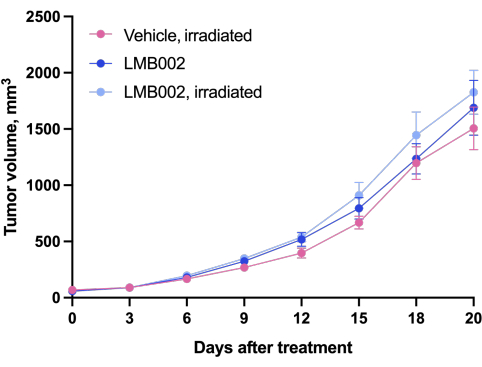
Figura 12: Dinamica di crescita tumorale negli animali. Animali trattati con LMB002 rispetto agli animali trattati con veicolo (modello di allotrapianto LLC sottocutaneo in topi C57BL/6NCrl, dose composta 7 mg/kg, IV, 2 h 40 min di incubazione, quindi irradiazione a 650 nm, 100 mW/cm2, 20 min). Fare clic qui per visualizzare una versione ingrandita di questa figura.
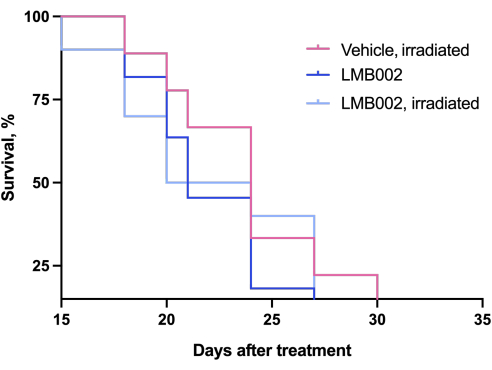
Figura 13: Curve di mortalità per gli animali. Animali trattati con LMB002 rispetto agli animali trattati con veicolo (modello di allotrapianto LLC sottocutaneo in topi C57BL/6NCrl, dose composta 7 mg/kg, IV, 2 h 40 min di incubazione, quindi irradiazione a 650 nm, 100 mW/cm2, 20 min). Fare clic qui per visualizzare una versione ingrandita di questa figura.
Discussione
I composti fotocontrollati sono senza precedenti nello sviluppo di farmaci; tuttavia, non sono stati stabiliti metodi per la loro valutazione preclinica e clinica. L'analogo monoterapia più vicino, la terapia fotodinamica (PDT), è la modalità di trattamento per uso clinico adottata da molti paesi contro il cancro ed è in fase di sviluppo per altre indicazioni19,20. Analogamente alla fotofarmacologia, anche la PDT si basa sull'uso della luce per attivare la sostanza bioattiva (ossigeno singoletto). Pertanto, alcuni metodi sperimentali utilizzati per studi preclinici e clinici in PDT possono essere adottati per la fotofarmacologia. Ad esempio, le sorgenti luminose, gli approcci di erogazione della luce e i dispositivi medici sono ben sviluppati e approvati per la PDT; Possono essere utilizzati direttamente per la valutazione di farmaci fotocontrollati. Tuttavia, PDT e fotofarmacologia hanno molte distinzioni l'una dall'altra4, il che giustifica la necessità di stabilire metodi specifici per quest'ultima.
In primo luogo, la sostanza non attivata nella PDT (ossigeno) è sempre presente nei tessuti viventi a concentrazioni non tossiche. Al contrario, i composti biologicamente attivi fotocontrollati non attivati possono avere attività residua e tossicità indesiderata. Pertanto, i farmaci fotofarmacologici ideali dovrebbero aver minimizzato l'attività biologica nella loro forma somministrata e devono essere altamente attivi nella loro forma generata dalla luce, la "finestra fototerapeutica"21 deve essere la più ampia possibile. Trovare il colpo ed eseguire l'ottimizzazione hit-to-lead richiede l'identificazione di composti adatti e lo screening di librerie relativamente grandi, già nelle prime fasi dello sviluppo del farmaco. Qui, abbiamo proposto una microscopia fluorescente confocale automatizzata ad alta produttività per identificare composti fotocommutatori efficienti.
Il metodo scelto per la valutazione della citotossicità consente una facile implementazione del requisito più critico: mantenimento del PSS o stabilità del fotoisomero sensibile alla luce visibile. Questo perché, al momento della sua implementazione, l'esposizione alla luce è ridotta al minimo. Quindi, se si selezionano metodi alternativi, dovrebbero essere preferiti quelli automatizzati. Questo approccio è affidabile e informativo. L'uso di colture cellulari 3D (sferoidi) in questa fase fornisce una comprensione olistica della risposta della cellula al trattamento in un microambiente simile a un tessuto più realistico. Inoltre, è possibile ottenere preziose informazioni sul meccanismo d'azione dei composti utilizzando la microscopia come metodo diretto. La microscopia fluorescente confocale con adeguato protocollo di colorazione consente la valutazione visiva della morfologia delle cellule e degli sferoidi; È inoltre possibile rilevare dettagli importanti sulla morte cellulare e sui cambiamenti all'interno delle cellule.
In secondo luogo, l'applicazione leggera richiede un'attenta scelta del dosaggio della luce. Nella PDT, il sovradosaggio leggero è estremamente dannoso per i tessuti22. La terapia fotofarmacologica può essere vantaggiosa in caso di irradiazione luminosa eccessiva. Il limite superiore della sostanza attivata è definito dalla dose somministrata della sostanza non attivata e dalla sua farmacocinetica. Tuttavia, il dosaggio leggero è ancora un problema in fotofarmacologia. Si deve prestare attenzione affinché la densità di potenza irradiante e il tempo di esposizione non siano inferiori ai requisiti per la terapia. In linea di principio, la generazione della sostanza attivata può essere monitorata in vivo. Tuttavia, per ragioni bioetiche, abbiamo proposto un esperimento con un tessuto modello (carne macinata fresca) mescolato con il composto non attivato15. Questo esperimento è semplice e può essere modificato per utilizzare diverse fonti di luce. Può anche essere adattato per la stima fotofisica del dosaggio della luce e la misurazione delle influenze termiche. Anche in questo caso, utilizzando tessuti modello, l'esposizione alla luce è possibile minimizzare, rispetto, ad esempio, alla più accurata determinazione dell'efficienza di fotocommutazione nelle condizioni in vivo , un'alternativa che può essere sempre interessante da considerare.
Infine, i composti che dimostrano caratteristiche superiori negli schermi di tossicità in vitro e sono efficientemente fotocommutati ad almeno 1-1,5 cm di profondità nel tessuto modello possono essere selezionati per studi in vivo costosi, laboriosi e lunghi. In questo protocollo, abbiamo utilizzato la stessa linea cellulare (LLC) della valutazione in vitro per generare il modello di cancro allotrapianto. La dinamica di crescita del tumore, la mortalità e la conta delle metastasi sono i parametri più adatti per valutare l'efficacia antitumorale. Rispetto alla chemioterapia convenzionale, un fattore aggiuntivo viene applicato nel trattamento fotofarmacologico: la luce. Pertanto, sono necessari due gruppi di animali di controllo: uno che riceve solo il veicolo e l'altro che riceve il veicolo e l'irradiazione. Questa configurazione consente di valutare l'impatto della luce sui parametri misurati. Nel nostro esperimento, gli animali dei due gruppi sperimentali hanno ricevuto il composto non attivato e i tumori dei topi in un gruppo sono stati irradiati. Il regime di irradiazione era identico per i gruppi di controllo e di trattamento. Il confronto con la chemioterapia di riferimento non è necessario in questa fase perché lo scopo principale dell'esperimento è dimostrare l'effetto combinato dell'applicazione leggera e composta. I composti più performanti che presentano questo effetto possono quindi essere selezionati per ulteriori studi sulla loro tossicità in vivo e confronto con parametri di riferimento per prendere importanti decisioni go-no-go sul loro sviluppo. Tecnicamente, l'esperimento in vivo che descriviamo può essere facilmente adattato a studi di farmacocinetica o farmacodinamica, ad esempio, di un composto che è già selezionato come farmaco principale.
Divulgazioni
IVK, OB, SA e ASU sono inventori della famiglia di brevetti rilasciata: "Peptidomimetici che possiedono attività biologica fotocontrollata" (WO2014127919 [A1], EP2958934 [B1], US9481712 [B2], UA113685 [C2]) concessi in licenza a Lumobiotics GmbH. IVK, OB, TS e SA sono fondatori e azionisti di Lumobiotics GmbH. IVK è un consulente scientifico, HK, TM, IP e PB sono dipendenti di Enamine LLC. Gli autori non hanno altre affiliazioni rilevanti o coinvolgimento finanziario con qualsiasi organizzazione o entità con un interesse finanziario o un conflitto finanziario con l'argomento o i materiali discussi nella pubblicazione oltre a quelli divulgati.
Riconoscimenti
Gli autori riconoscono il finanziamento dell'UE da parte del programma H2020-MSCA-RISE attraverso i progetti PELICO (#690973) e ALISE (#101007256). Questo lavoro è stato supportato dal DFG-GRK 2039 (SA, TS e ASU), dal programma NACIP della Helmholtz Society (SA e ASU) e dal VIP + del BMBF (OB e ASU). Riconosciamo il Dr. Serhii Koniev, Karlsruhe Institute of Technology, che ha sintetizzato il composto LMB002, lo ha purificato e ha gentilmente fornito il composto per lo studio. Gli autori sono anche grati a Chupryna Maksym che ha filmato e compilato il video in Ucraina, e a tutti i coraggiosi difensori dell'Ucraina che hanno reso possibile il lavoro sperimentale, la scrittura e le riprese di questa pubblicazione.
Materiali
| Name | Company | Catalog Number | Comments |
| Agilent 1100 Series capillary LC system | ALSI-Chrom (Agilent distributor) | - | |
| ATCC CRL-1642, LL/2 (LLC1) Lewis lung carcinoma cell line | ECACC | 90020104 | |
| C57BL/6NCrl mice, female, inbred | Charles River | Strain code: 027 | |
| CelCulture, CO2 incubator | Esco Micro | CCL-170B | |
| Corning Matrigel Basement membrane matrix | Merck | CLS354234 | |
| Corning, 384- well spheroid microplates | Merck | CLS3830 | |
| Fetal bovine serum | Merck | F7524 | |
| Gibco, DPBS | Thermo Fisher Scientific | 21600044 | |
| Gramicidin S | Lumobiotics | Custom synthesis | |
| HyClone, DMEM/high glucose | Cytiva | SH30003.04 | |
| IN Cell Analyzer 6500HS, imaging system | Cytiva | 29240358 | |
| Invitrogen, Calcein AM | Thermo Fisher Scientific | C1430 | |
| Isoflurane anesthesia machine | ASA | S/N ASA 1305 | |
| L-glutamine, 200 mM solution | Merck | G7513 | |
| LIKA-surgeon, diode surgery laser | Fotonika plus | - | |
| LMB002 | Lumobiotics | Custom synthesis | |
| Penicillin–Streptomycin, solution stabilized | Merck | P4333 | |
| PhenoPlate, 96-well plates | PerkinElmer | 6055302 | |
| Photometer PCE-LED 20 | PCE Instruments | PCE-LED 20 | |
| Thermo Scientific, Hoechst 33342 | Thermo Fisher Scientific | 62249 | |
| Thermo Scientific, Propidium iodide | Thermo Fisher Scientific | J66764-MC | |
| Trypan blue, 0.4% solution | Merck | T8154 | |
| Trypsin–EDTA, 10 x solution | Merck | T4174 | |
| UltraCruz Cell culture flasks with vented caps, 75 cm2 | Santa Cruz Biotechnology | sc-200263 | |
| UltraCruz, bottle top filters, PES, 0.22 μm | Santa Cruz Biotechnology | sc-360882 | |
| Vydac 218TP, C18 HPLC column (4.6 mm × 250 mm, 5 µm) | Altmann Analytik (Avantor distributor) | GR5103827 |
Riferimenti
- Fuchter, M. J. On the promise of photopharmacology using photoswitches: a medicinal chemist's perspective. Journal of Medicinal Chemistry. 63 (20), 11436-11447 (2020).
- Volarić, J., Szymanski, W., Simeth, N. A., Feringa, B. L. Molecular photoswitches in aqueous environments. Chemical Society Reviews. 50, 12377-12449 (2021).
- Paoletti, P., Ellis-Davies, G. C. R., Mourot, A. Optical control of neuronal ion channels and receptors. Nature Reviews Neuroscience. 20, 514-532 (2019).
- Hüll, K., Morstein, J., Trauner, D. In Vivo Photopharmacology. Chemical Reviews. 118 (21), 10710-10747 (2018).
- Ma, X., et al. In vivo photopharmacology with a caged mu opioid receptor agonist drives rapid changes in behavior. Nature Methods. 20, 682-685 (2023).
- Sarabando, S. N., Palmeira, A., Sousa, M. E., Faustino, M. A. F., Monteiro, C. J. P. Photomodulation Approaches to Overcome Antimicrobial Resistance. Pharmaceuticals. 16 (5), 682 (2023).
- Kolarski, D., Szymanski, W., Feringa, B. L., Hirota, T., Hatori, M., Panda, S. Chronophotopharmacology: Methodology for high spatiotemporal control over the circadian rhythm with light. Neuromethods. 186, (2022).
- Babii, O., et al. Peptide drugs for photopharmacology: how much of a safety advantage can be gained by photocontrol. Future Drug Discovery. 2 (1), FDD28 (2020).
- Davis, A. M., Keeling, D. J., Steele, J., Tomkinson, N. P., Tinker, A. C. Components of successful lead generation. Current Topics in Medicinal Chemistry. 5 (4), 421-439 (2005).
- Balani, S. K., Miwa, G. T., Gan, L., Wu, J., Lee, F. W. Strategy of utilizing in vitro and in vivo adme tools for lead optimization and drug candidate selection. Current Topics in Medicinal Chemistry. 5 (11), 1033-1038 (2005).
- Kleijn, A., et al. A Systematic comparison identifies an ATP-based viability assay as most suitable read-out for drug screening in glioma stem-like cells. Stem Cells International. 2016, (2016).
- Rodrigues, J., Heinrich, M. A., Teixeira, L. M., Prakash, J. 3D in vitro model revolution: unveiling tumor-stroma interactions. Trends in Cancer. 7 (3), 249-264 (2021).
- Sittinger, M., et al. Tissue engineering and autologous transplant formation: practical approaches with resorbable biomaterials and new cell culture techniques. Biomaterials. 17 (3), 237-242 (1996).
- Matai, I., Kaur, G., Seyedsalehi, A., McClinton, A., Laurencin, C. T. Progress in 3D bioprinting technology for tissue/organ regenerative engineering. Biomaterials. 226, 119536 (2020).
- Babii, O., et al. Direct photocontrol of peptidomimetics: an alternative to oxygen-dependent photodynamic cancer therapy. Angewandte Chemie International Edition. 55 (18), 5493-5496 (2016).
- De Ridder, K., et al. Novel 3D lung tumor spheroids for oncoimmunological assays. Advanced NanoBiomed Research. 2 (4), 2100124 (2022).
- Pauli, C., et al. Personalized in vitro and in vivo cancer models to guide precision medicine. Cancer Discovery. 7 (5), 462-477 (2017).
- Van Straten, D., Mashayekhi, V., De Bruijn, H. S., Oliveira, S., Robinson, D. J. Oncologic photodynamic therapy: basic principles, current clinical status and future directions. Cancers. 9 (2), 19 (2017).
- Li, X., Kwon, N., Guo, T., Liu, Z., Yoon, J. Innovative strategies for hypoxic-tumor photodynamic therapy. Angewandte Chemie International Edition. 57 (36), 11522-11531 (2018).
- Hull, K., Morstein, J., Trauner, D. In vivo photopharmacology. Chemical Reviews. 118 (21), 10710-10747 (2018).
- Babii, O., et al. Structure-activity relationships of photoswitchable diarylethene-based β-hairpin peptides as membranolytic antimicrobial and anticancer agents. Journal of Medicinal Chemistry. 61 (23), 10793-10813 (2018).
- Heckl, C., Aumiller, M., Rühm, A., Sroka, R., Stepp, H. Fluorescence and treatment light monitoring for interstitial photodynamic therapy. Photochemistry and Photobiology. 96 (2), 388-396 (2020).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon