Method Article
Exploración de los efectos independientes de la hormona folículo estimulante in vivo en un modelo de ratón
En este artículo
Resumen
La hormona folículo estimulante (FSH) en varios tejidos y órganos extragonadales se asocia con la patogénesis de múltiples enfermedades. El modelo de ratón ovariectomizado y tratado con FSH (OVF) se puede utilizar para explorar las acciones extragonadales de la FSH.
Resumen
Durante la transición de una fase reproductiva a una no reproductiva (menopausia), muchas mujeres experimentan cambios fisiológicos y patológicos significativos, incluida la disminución de la masa ósea, el aumento de los lípidos en la sangre y el aumento de la adiposidad visceral. Los niveles de la hormona folículo estimulante (FSH, por sus siglas en inglés) aumentan durante la transición a la menopausia. Muchos estudios han demostrado que la FSH en varios tejidos y órganos extragonadales se asocia con la patogénesis de múltiples enfermedades. Por lo tanto, la construcción de un modelo animal que pueda ayudar a estudiar los efectos independientes de la FSH in vivo es particularmente importante. En este estudio, ratones hembra C57BL/6 fueron ovariectomizados y suplementados con valerato de estradiol (OVX + E2) para eliminar el efecto del eje hipotálamo-hipófisis-gonadal. Los ratones OVX + E2 recibieron disolvente (N.S.) o diferentes dosis de FSH recombinante a través de inyección intraperitoneal para crear un modelo de ratón (OVF) caracterizado por niveles relativamente estables de estrógeno y FSH en aumento. Por lo tanto, generamos con éxito un modelo experimental de ratón para imitar la etapa temprana de la transición a la menopausia, caracterizada por niveles séricos elevados de FSH. El modelo OVF tiene las ventajas de ser estable, de bajo costo y fácil de operar, lo que es adecuado para estudios que exploren las acciones extragonadales de FSH. A continuación, describimos protocolos detallados para el modelo OVF de ratón.
Introducción
Los niveles de la hormona folículo estimulante (FSH) aumentan durante la transición a la menopausia (el término transición menopáusica se definió en 2011 en el taller de etapas de envejecimiento reproductivo (STRAW) + sistema 10)1. Es durante la transición a la menopausia, un período caracterizado por el aumento de los niveles de FSH yestrógenos relativamente estables, que las mujeres experimentan cambios en el ciclo menstrual y cambios fisiológicos significativos que involucran varias células y tejidos. Estos cambios pueden afectar seriamente la calidad de vida y la salud de las mujeres. Explorar los efectos de la FSH puede mejorar la calidad de vida y la salud de las mujeres.
La FSH es secretada por las células gonadotrópicas en la hipófisis anterior y es fundamental en el control de la función gonadal y la reproducción2. La función de la FSH está mediada por el receptor de la FSH (FSHR), que pertenece al receptor acoplado a la proteína G (GPCR)3. La FSHR se expresa generalmente en gónadas, es decir, el ovario y los testículos. Se ha demostrado que la FSHR se expresa universalmente en múltiples células y tejidos extragonadales, incluyendo el hígado4, el hipocampo5, los osteoclastos6, los adipocitos7 y las células endoteliales8. Estudios emergentes han revelado acciones extragonadales de la FSH y su potencial relevancia clínica en la dislipidemia4, la enfermedad de Alzheimer5, la osteoporosis 9,10, la aterosclerosis11, la obesidad9 y el cáncer12. Por lo tanto, la construcción de un modelo animal que pueda ayudar a estudiar los efectos independientes de la FSH in vivo es particularmente importante para explorar las acciones de la FSH sola.
En el protocolo, introdujimos el procedimiento para establecer un modelo de ratón con estrógenos relativamente estables y niveles de FSH en aumento13. El modelo de ratón imita la transición a la menopausia mediante cirugía ovariectomizada y luego se complementa con valerato de estradiol y FSH recombinante. A medida que los ratones ovariectomizados fueron suplementados con estrógeno exógeno para mantener niveles de estrógeno similares a los de los ratones operados simuladamente, los niveles de FSH endógena se mantuvieron estables debido a la retroalimentación de estrógeno en la glándula pituitaria. En esta condición, podría controlar los niveles de FSH mediante la administración de FSH exógena sin alterar los niveles de estrógenos. Por lo tanto, el modelo de ratón OVF puede excluir la influencia del estrógeno y observar los efectos fisiológicos y patológicos extragonadales de la FSH. Creemos que el procedimiento detallado y visualizado es útil para que los investigadores establezcan el modelo de ratón OVF en su laboratorio y lo apliquen para investigar los cambios fisiológicos y patológicos durante la transición a la menopausia, según sea necesario.
Protocolo
El siguiente protocolo cumplió con todas las directrices éticas institucionales sobre el uso de animales de investigación y fue aprobado por el Comité de Ética Animal del Hospital Provincial de Shandong, China. Todas las manipulaciones quirúrgicas se realizaron bajo anestesia profunda y los animales no experimentaron dolor en ninguna etapa del procedimiento.
1. Preparación previa a la operación
- Esterilización de instrumentos
- Esterilizar los instrumentos quirúrgicos con vapor en un autoclave (121 °C durante 15 min) antes de la cirugía. Prepare suficientes suturas y agujas desechables.
- Configuración de la plataforma quirúrgica
- Realice la cirugía en una sala dedicada a los procedimientos quirúrgicos. Asigne un área de banco de al menos 60 cm x 60 cm para la operación. Limpie la superficie del área con alcohol al 75% y cúbrala con una toalla médica desechable, y luego desinféctela con radiación ultravioleta con 30 minutos de anticipación (Figura 1A).
- Preparación de los animales
- Aloje a todos los animales en una habitación con temperatura controlada (20-25 °C) con un ciclo de luz de 12 h y 12 h de oscuridad. Aclimatar ratones hembra C57BL/6 de 8 semanas de edad al alojamiento durante 1 semana antes de la cirugía.
- Pesar a los ratones antes de la cirugía. Administrar anestesia general a todos los ratones hembra de 9 semanas de edad mediante inyección intraperitoneal de tribromoetanol (280 mg/kg), para lograr la ausencia de dolor en cualquier etapa del procedimiento. Inyectar meloxicam (2 mg/kg) por vía subcutánea, aproximadamente 1 h antes de una operación para aliviar el dolor.
- Aplique ungüento para los ojos para prevenir la sequedad de la córnea durante la cirugía.
- Aplique la loción depilatoria en la espalda con un hisopo de algodón limpio. Deje reposar la loción en un ratón durante 3-5 minutos, luego retire el vello con una gasa y bastoncillos de algodón. Repita este paso hasta que se haya eliminado todo el vello de la parte posterior del mouse.
- Use gasas y bastoncillos de algodón para limpiar la piel con alcohol al 75%. Fije el ratón en la plataforma quirúrgica con una tira de goma o una cuerda de algodón (Figura 1B) y aplique una solución de yodóforo para limpiar la espalda.
NOTA: Confirme la profundidad de la anestesia mediante un pellizco en el dedo del pie antes de la ovariectomía.
2. Ovariectomía
NOTA: El tribromoetanol se puede mantener durante aproximadamente 30 minutos, asegurando que la cirugía se complete tanto como sea posible.
- Realice una incisión dorsal de ~1,0 cm longitudinalmente desde la base del muslo hacia arriba con un bisturí desechable, asegurándose de que solo la piel y la fascia subcutánea estén incisas y evitando cortar el peritoneo posterior en este momento.
- Tire de la incisión hacia la izquierda y se puede ver una almohadilla de grasa blanca. Corte ~0,5 cm a lo largo de la almohadilla de grasa blanca para exponer la cavidad intraperitoneal con micropinzas y tijeras.
- Después de cortar el peritoneo posterior, retire lenta y suavemente la almohadilla de grasa blanca de la cavidad intraperitoneal con micropinzas. Humedecer inmediatamente el tejido graso blanco con solución salina estéril al 0,9% fuera de la gasa empapada. Mantenga el tejido expuesto siempre humedecido mientras esté fuera de la cavidad abdominal.
- Una sustancia granular rosada, a saber, el ovario, está unida a la parte inferior de la almohadilla de grasa blanca (Figura 2A). Los ovarios están conectados a un conducto delgado, a saber, el útero. Utilice suturas absorbibles 5-0 para ligar el extremo ovárico del útero y extirpar el ovario izquierdo (Figura 2B).
- Al extirpar un ovario, conserve el tejido graso circundante tanto como sea posible. Evitar el contacto directo entre los instrumentos quirúrgicos y los ovarios y evitar la implantación intraperitoneal de tejido ovárico.
- Vuelva a colocar con cuidado la almohadilla de grasa blanca en la cavidad intraperitoneal. Realizar una sutura intermitente simple en el peritoneo posterior con una sutura reabsorbible 5-0 (Figura 2C). Una vez completada la sutura, limpie cualquier sangrado con una gasa estéril empapada en solución salina al 0,9 %.
- Tire de la incisión en la piel hacia la derecha y extirpe el ovario derecho con el mismo método.
- Realizar una sutura intermitente con suturas 4-0 no absorbibles y limpiar cualquier sangrado con gasa estéril empapada en solución salina al 0,9% (Figura 2D).
- Limpie la herida con una solución de yodóforo después de completar ambas suturas. Inyectar antibióticos de amplio espectro por vía intraperitoneal.
3. Observación postoperatoria
- Mueva los ratones a una manta de temperatura constante a 37 °C después de la cirugía. Hasta que los ratones puedan moverse libremente, mantén a los animales en su jaula individual. No deje al animal desatendido hasta que haya recuperado la conciencia suficiente para mantener la decúbito esternal.
- Inyectar meloxicam (2 mg/kg) por vía subcutánea 24 h después de la operación para aliviar el dolor.
- Monitoree a los ratones diariamente para asegurarse de que la herida quirúrgica esté cicatrizando correctamente sin ningún signo de complicaciones (dehiscencia).
4. Suplementación con estradiol
- Prepare el alimento suplementado con valerato de estradiol. Utilizar 2,6 mg de beta-estradiol-17-valerato suplementado por 1 kg de alimento.
- A los 3 días de la finalización de la cirugía, alimentar a los ratones con valerato de estradiol.
5. Inyección de FSH
- Prepare una solución humana recombinante de FSH. Disolver el polvo recombinante de FSH humana para inyección con solución salina estéril al 0,9% a 100 UI/ml.
- Agrupar ratones de acuerdo con los planes experimentales y administrar disolvente o diferentes dosis de FSH recombinante mediante inyección intraperitoneal durante 2 semanas. De acuerdo con la actividad biológica de la FSH recombinante, use la dosis inyectable de FSH en ratones equivalente al nivel sérico de FSH en mujeres durante el período de transición a la menopausia.
NOTA: Sobre la base de diferentes tratamientos, los ratones ovariectomizados suplementados con estrógeno se dividieron aleatoriamente en tres grupos: el grupo con disolvente (N.S.) que recibió 100 μL/día de disolvente, el grupo con dosis bajas de FSH (L-FSH) que recibió 15 UI/kg de peso corporal al día y el grupo con dosis altas de FSH (H-FSH) que recibió 30 UI/kg de peso corporal al día.
Resultados
El modelo de ratón OVF imita la etapa temprana de la transición a la menopausia con estrógenos relativamente estables y niveles crecientes de FSH13. En primer lugar, para la cirugía de extirpación de ovarios, se administró anestesia general a ratones hembra C57BL/6 de 9 semanas de edad y se les sometió a una operación simulada (Sham) o a una ovariectomía bilateral (OVX). Como las imágenes de frotis de las células teñidas con Papanicolaou identificaron claramente las etapas de proestro, estro, metestro y diestro del ciclo estral, los ratones OVX perdieron el ciclo estral (Figura 3A), y el método ELISA mostró una disminución significativa en los niveles séricos de estradiol (E2) (Figura 3B). En segundo lugar, los ratones OVX fueron suplementados con beta-estradiol-17-valerato (OVX + E2) para mantener el estrógeno sérico al mismo nivel que el grupo Sham. En tercer lugar, los ratones OVX + E2 recibieron disolvente (N.S.) o diferentes dosis de FSH recombinante a través de inyección intraperitoneal para crear un modelo de ratón (OVF) caracterizado por niveles relativamente estables de estrógeno y FSH en aumento (Figura 4).
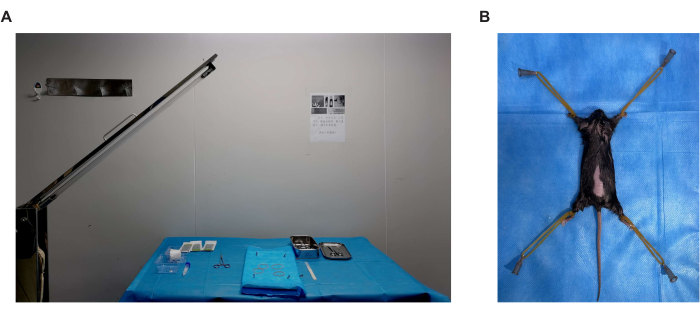
Figura 1. Entorno quirúrgico y postura del ratón. (A) Un área de banco de al menos 60 cm x 60 cm para la operación. Limpie la superficie del área con alcohol al 75% y cúbrala con una toalla médica desechable, y luego desinfecte con radiación ultravioleta con 30 minutos de anticipación. (B) Fije el mouse en la plataforma de cirugía con una tira de goma o una cuerda de algodón. Haga clic aquí para ver una versión más grande de esta figura.
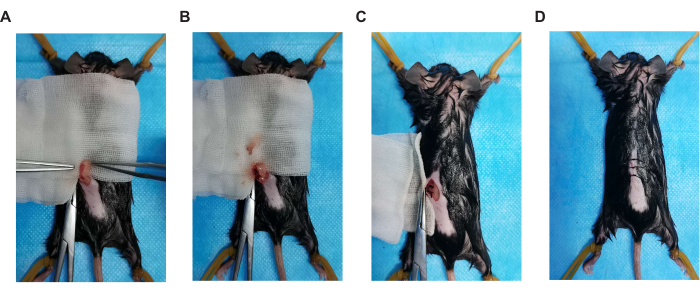
Figura 2. Pasos clave de la operación quirúrgica. (A) Posición ovárica, (B) ovariectomía, (C) sutura del peritoneo y (D) incisión en la piel de sutura. Haga clic aquí para ver una versión más grande de esta figura.
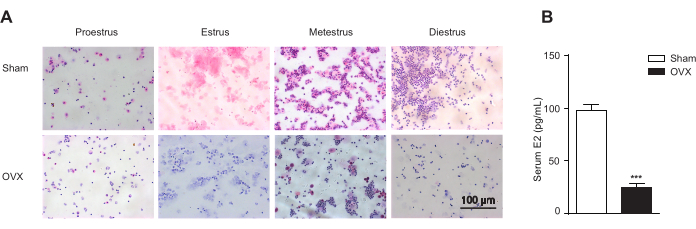
Figura 3. Citología vaginal. La citología vaginal representa las etapas del ciclo estral y el estrógeno endógeno en los ratones ovariectomizados (OVX) y en los operados simuladamente (Sham; n = 12 para el grupo Sham; n = 10 para los grupos OVX). (A) La citología vaginal representa las etapas del ciclo estral de acuerdo con la presencia relativa de leucocitos, células epiteliales córneas y células epiteliales nucleadas. Las etapas del celo incluyen el proestro, el predominio de células epiteliales nucleadas; el celo, el predominio de células cornificadas enucleadas; metestrus, la presencia de leucocitos y células epiteliales cornificadas y nucleadas; diestro, el predominio de los leucocitos. Barra de escala = 100 μm. (B) Estrógeno endógeno en los ratones ovariectomizados (OVX) y en los operados simuladamente (Sham). Los datos se muestran como la media ± SEM. Para el análisis estadístico se utiliza la prueba t de Student. p< 0,001. Haga clic aquí para ver una versión más grande de esta figura.
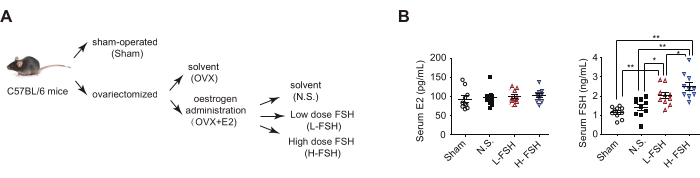
Figura 4. Modelo de OVF y niveles hormonales séricos. (A) Modelo de diagrama de flujo OVF. (B) Análisis ELISA de las concentraciones séricas de estrógeno (E2) y FSH. Los datos se representan como la media ± SEM. Para el análisis estadístico se utilizó ANOVA de un factor. * p< 0,05 y ** p< 0,01. Esta cifra ha sido modificada de4. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Durante la transición de una fase reproductiva a una no reproductiva (menopausia), muchas mujeres experimentan cambios fisiológicos y patológicos significativos. Los niveles de FSH aumentan durante la transición a la menopausia1. Estudios emergentes han revelado que la FSH en varios tejidos y órganos extragonadales es crítica en la patogénesis de múltiples enfermedades, incluyendo la dislipidemia4, la enfermedad de Alzheimer5, la osteoporosis 9,10, la aterosclerosis11, la obesidad9 y el cáncer12. Por lo tanto, la construcción de un modelo animal que pueda ayudar a estudiar los efectos independientes de la FSH in vivo es particularmente importante. El modelo de ratón OVF imita la etapa temprana de la transición a la menopausia con niveles relativamente estables de estrógeno y FSH en aumento, y es particularmente adecuado para estudios que exploren las acciones extragonadales de FSH.
En este método, la ovariectomía se realizó mediante una única incisión dorsal en la espalda, aproximadamente 1 cm desde la base del muslo hacia arriba (Figura 1B). La piel se cortó casi junto con los músculos dorsales con unas tijeras de disección afiladas, y así se accedió a la cavidad peritoneal. Después de la operación, la incisión muscular no requirió sutura y la herida cutánea se cerró bilateralmente con una sutura de catgut (Figura 2). La operación es técnicamente más fácil, requiere menos tiempo y es menos dañina para los ratones hembra en comparación con otros métodos utilizados.
Algunos detalles que se deben atender durante el procedimiento quirúrgico. En primer lugar, todos los procedimientos quirúrgicos deben mantenerse limpios y lo más estériles posible para reducir el riesgo de infección postoperatoria. En segundo lugar, debido a que el tejido ovárico es muy frágil, los instrumentos quirúrgicos no pueden entrar en contacto directo con los ovarios durante la ovariectomía, para evitar la implantación intraperitoneal. En tercer lugar, después de la cirugía, los ratones fueron trasladados a una manta de temperatura constante a 37 °C durante la recuperación para evitar la hipotermia postoperatoria que condujo a la muerte.
Un estudio previo ha demostrado que el estrógeno endógeno se sintetiza en las células de la teca ovárica de mujeres premenopáusicas o en las células del estroma adiposo de la mama de mujeres postmenopáusicas y en menor cantidad en el tejido periférico14. El estrógeno sérico disminuyó bruscamente en los ratones ovariectomizados, pero no se puede eliminar (Figura 3B). Sin embargo, el estrógeno endógeno sintetizado en el tejido extragonadal no afecta a la estabilidad de los niveles de estrógeno en el modelo de OVF (Figura 4B).
Existen algunas limitaciones en el modelo OVF. Una vez que la operación quirúrgica no es cuidadosa y conduce a la implantación intraperitoneal ovárica, puede conducir al fracaso del modelo. En este caso, el estrógeno sérico no cae bruscamente y fluctúa durante las diferentes etapas del ciclo estral. Después de la administración exógena de estrógeno y FSH, el cuerpo tarda aproximadamente 1 semana en alcanzar el equilibrio. Por lo tanto, los cambios patológicos del modelo de OVF que ocurren dentro de 1 semana no pueden indicar los efectos de FSH.
En conclusión, el modelo OVF tiene las ventajas de ser estable, de bajo costo y fácil de operar. Los efectos sistémicos de la FSH de alto nivel se pueden observar después de la inyección intraperitoneal de FSH; es decir, el modelo OVF es adecuado para estudios que exploran las acciones extragonadales de la FSH. Sin embargo, los requisitos para la cirugía modelo y los procedimientos de inyección intraperitoneal son bastante altos. Si la financiación es suficiente, los modelos de eliminación selectiva específicos son la mejor opción.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Queremos agradecer al laboratorio de animales del Hospital Provincial de Shandong por su apoyo técnico. Este trabajo contó con el apoyo de la Fundación Nacional de Ciencias Naturales de China (NSFC 82101645), la Fundación de Ciencias Naturales de la Provincia de Shandong, China (ZR2020QH088) y el Plan de Apoyo a la Ciencia y la Tecnología para la Innovación Juvenil de las Universidades de la Provincia de Shandong (2021KJ051).
Materiales
| Name | Company | Catalog Number | Comments |
| beta-estradiol 17-valerate | Macklin | E829824 | |
| Estradiol sensitive ELISA | Demeditec | DE4399 | |
| Hematoxylin Staining Solution | Beyotime | C0107 | |
| Meloxicam | Aladdin | M129228 | |
| recombinant human Follicle-stimulating hormone | Merck Serono | N19Z8803G | |
| Tribromoethanol | Sigma | T48402 | Aliphatic name: 2,2,2-Tribromoethanol |
Referencias
- Harlow, S. D., et al. Executive summary of the Stages of Reproductive Aging Workshop + 10: addressing the unfinished agenda of staging reproductive aging. Journal of Clinical Endocrinology & Metabolism. 97 (4), 1159-1168 (2012).
- Ulloa-Aguirre, A., Zariñán, T. The Follitropin Receptor: Matching Structure and Function. Molecular Pharmacology. 90 (5), 596-608 (2016).
- Franks, S., Stark, J., Hardy, K. Follicle dynamics and anovulation in polycystic ovary syndrome. Human Reproduction Update. 14 (4), 367-378 (2008).
- Guo, Y., et al. Blocking FSH inhibits hepatic cholesterol biosynthesis and reduces serum cholesterol. Cell Research. 29 (2), 151-166 (2019).
- Xiong, J., et al. FSH blockade improves cognition in mice with Alzheimer's disease. Nature. 603 (7901), 470-476 (2022).
- Sun, L., et al. FSH Directly Regulates Bone Mass. Cell. 125 (2), 247-260 (2006).
- Liu, X. M., et al. FSH regulates fat accumulation and redistribution in aging through the Gαi/Ca(2+)/CREB pathway. Aging Cell. 14 (3), 409-420 (2015).
- Maclellan, R. A., et al. Expression of Follicle-Stimulating Hormone Receptor in Vascular Anomalies. Plastic and Reconstructive Surgery. 133 (3), 344e-351en (2014).
- Liu, P., et al. Blocking FSH induces thermogenic adipose tissue and reduces body fat. Nature. 546 (7656), 107-112 (2017).
- Ji, Y., et al. Epitope-specific monoclonal antibodies to FSHβ increase bone mass. Proceedings of the National Academy of Sciences of the United States of America. 115 (9), 2192-2197 (2018).
- El Khoudary, S. R., et al. Trajectories of estradiol and follicle-stimulating hormone over the menopause transition and early markers of atherosclerosis after menopause. European Journal of Preventive Cardiology. 23 (7), 694-703 (2016).
- Radu, A., et al. Expression of Follicle-Stimulating Hormone Receptor in Tumor Blood Vessels. The New England Journal of Medicine. 363 (17), 1621-1630 (2010).
- Sowers, M. R., et al. Endogenous hormones and bone turnover markers in pre- and perimenopausal women: SWAN. Osteoporosis International. 14 (3), 191-197 (2003).
- Kristensen, V. N., Kure, E. H., Erikstein, B., Harada, N., Børresen-Dale, A. L. Genetic susceptibility and environmental estrogen-like compounds. Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis. 482 (1), 77-82 (2001).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados