Method Article
Explorando os efeitos independentes do hormônio folículo-estimulante in vivo em um modelo de camundongo
Neste Artigo
Resumo
O hormônio folículo-estimulante (FSH) em vários tecidos e órgãos extragonadais está associado à patogênese de múltiplas doenças. O modelo de camundongos ovariectomizados e tratados com FSH (OVF) pode ser usado para explorar as ações extragonadais do FSH.
Resumo
Durante a transição de uma fase reprodutiva para uma não reprodutiva (menopausa), muitas mulheres experimentam alterações fisiológicas e patológicas significativas, incluindo diminuição da massa óssea, aumento dos lipídios sanguíneos e aumento da adiposidade visceral. Os níveis de hormônio folículo-estimulante (FSH) aumentam durante a transição menopausal. Muitos estudos têm demonstrado que o FSH em vários tecidos e órgãos extragonadais está associado à patogênese de múltiplas doenças. Assim, a construção de um modelo animal que possa ajudar a estudar os efeitos independentes do FSH in vivo é particularmente importante. Neste estudo, camundongos C57BL/6 fêmeas foram ovariectomizadas e suplementadas com valerato de estradiol (OVX + E2) para eliminar o efeito do eixo hipotálamo-hipófise-gonadal. Os camundongos OVX + E2 receberam solvente (N.S.) ou diferentes doses de FSH recombinante via injeção intraperitoneal para criar um modelo de camundongo (OVF) caracterizado por estrogênio relativamente estável e níveis crescentes de FSH. Assim, geramos com sucesso um modelo experimental em camundongos para mimetizar o estágio inicial da transição menopausal, caracterizado por níveis séricos elevados de FSH. O modelo OVF tem as vantagens de ser estável, de baixo custo e fácil operação, o que é adequado para estudos que explorem as ações extragonadais do FSH. Aqui, descrevemos protocolos detalhados para o modelo de OVF de camundongo.
Introdução
Os níveis de hormônio folículo-estimulante (FSH) aumentam durante a transição menopausal (o termo transição menopausal foi definido em 2011 nas fases do sistema STRAW) + 10 do envelhecimento reprodutivo)1. É durante a transição menopáusica, período caracterizado pelo aumento dos níveis de FSH e estrogênio relativamente estável1, que as mulheres experimentam mudanças no ciclo menstrual e alterações fisiológicas significativas envolvendo várias células e tecidos. Essas mudanças podem afetar seriamente a qualidade de vida e a saúde das mulheres. Explorar os efeitos do FSH pode melhorar a qualidade de vida e a saúde das mulheres.
O FSH é secretado pelas células gonadotróficas da hipófise anterior e é fundamental no controle da função e reprodução gonadal2. A função do FSH é mediada pelo receptor de FSH (FSHR), que pertence ao receptor acoplado à proteína G (GPCR)3. A FSHR é geralmente expressa nas gônadas, ou seja, no ovário e testículo. Foi comprovado que a FSHR é universalmente expressa em múltiplas células e tecidos extragonadais, incluindo fígado4, hipocampo5, osteoclastos6, adipócitos7 e células endoteliais8. Estudos emergentes têm revelado ações extragonadais do FSH e sua potencial relevância clínica na dislipidemia4, doença de Alzheimer5, osteoporose 9,10, aterosclerose11, obesidade9 e câncer12. Assim, a construção de um modelo animal que possa ajudar a estudar os efeitos independentes do FSH in vivo é particularmente importante para explorar as ações do FSH isoladamente.
No protocolo, introduzimos o procedimento para estabelecer um modelo de camundongo com estrógeno relativamente estável e níveis elevados de FSH13. O modelo de camundongo mimetiza a transição menopausal por cirurgia ovariectomizada e, em seguida, suplementado com valerato de estradiol e FSH recombinante. Como os camundongos ovariectomizados foram suplementados com estrogênio exógeno para manter níveis semelhantes de estrogênio com os camundongos sham-operados, os níveis de FSH endógeno foram estáveis devido ao feedback estrogênico na glândula pituitária. Nessa condição, poderia controlar os níveis de FSH administrando FSH exógeno sem alterar os níveis de estrogênio. Assim, o modelo de OVF em camundongos pode excluir a influência do estrógeno e observar os efeitos fisiológicos e patológicos extragonadais do FSH. Acreditamos que o procedimento detalhado e visualizado é útil para os pesquisadores estabelecerem o modelo de camundongo OVF em seu laboratório e aplicá-lo para investigar alterações fisiológicas e patológicas durante a transição menopausal, conforme necessário.
Protocolo
O protocolo a seguir respeitou todas as diretrizes éticas institucionais em relação ao uso de animais de pesquisa e foi aprovado pelo Comitê de Ética Animal do Hospital Provincial de Shandong, China. Todas as manipulações cirúrgicas foram realizadas sob anestesia profunda, e os animais não apresentaram dor em nenhum momento do procedimento.
1. Preparação pré-operação
- Esterilização de instrumentos
- Esterilizar os instrumentais cirúrgicos a vapor em autoclave (121°C por 15 min) antes da cirurgia. Prepare suturas e agulhas descartáveis suficientes.
- Configuração da plataforma cirúrgica
- Realizar a cirurgia em uma sala dedicada aos procedimentos cirúrgicos. Atribua uma área de bancada de pelo menos 60 cm x 60 cm para a operação. Limpar a superfície da área com álcool 75% e cobrir com uma toalha médica descartável e, em seguida, desinfetá-la com radiação ultravioleta com 30 min de antecedência (Figura 1A).
- Preparo animal
- Alojar todos os animais numa sala com temperatura controlada (20-25 °C) com um ciclo de 12 h de luz e 12 h de escuridão. Aclimatar camundongos fêmeas C57BL/6 de 8 semanas de idade ao alojamento por 1 semana antes da cirurgia.
- Pesar ratos antes da cirurgia. Administrar a todos os camundongos fêmeas de 9 semanas de idade anestesia geral por injeção intraperitoneal de Tribromoetanol (280 mg/kg), para obter indolor em qualquer fase durante o procedimento. Injetar meloxicam (2 mg/kg) por via subcutânea, cerca de 1 h antes de uma operação para aliviar a dor.
- Aplique pomada ocular para evitar o ressecamento da córnea durante a cirurgia.
- Aplique loção depilatória nas costas usando um cotonete limpo. Deixe a loção descansar em um mouse por 3-5 min, em seguida, remova o cabelo usando gaze e cotonetes. Repita este passo até que todo o cabelo tenha sido removido da parte de trás do rato.
- Use gaze e cotonetes para limpar a pele com álcool 75%. Fixe o mouse na plataforma cirúrgica usando uma tira de borracha ou corda de algodão (Figura 1B) e aplique solução de iodóforo para limpar as costas.
NOTA: Confirme a profundidade da anestesia através de uma pinça nos dedos dos pés antes da Ovariectomia.
2. Ovariectomia
NOTA: O tribromoetanol pode ser mantido por aproximadamente 30 min, garantindo que a cirurgia seja concluída o máximo possível.
- Faça uma incisão dorsal de ~1,0 cm longitudinalmente da base da coxa para cima usando um bisturi descartável, garantindo que apenas a pele e a fáscia subcutânea sejam incisadas e evitando cortar o peritônio posterior neste momento.
- Puxe a incisão para a esquerda, e uma almofada de gordura branca pode ser vista. Corte ~0,5 cm ao longo do coxim de gordura branca para expor a cavidade intraperitoneal usando micropinça e tesoura.
- Após o corte do peritônio posterior, remova lenta e suavemente o coxim gorduroso branco da cavidade intraperitoneal com micropinças. Umedeça imediatamente o tecido adiposo branco com soro fisiológico estéril a 0,9% fora da gaze embebida. Mantenha o tecido exposto sempre umedecido enquanto estiver fora da cavidade abdominal.
- Uma substância granular rósea, ou seja, o ovário, está aderida à parte inferior do coxim gorduroso branco (Figura 2A). Os ovários estão conectados a um ducto delgado, ou seja, o útero. Utilizar suturas absorvíveis 5-0 para ligar a extremidade ovariana do útero e remover o ovário esquerdo (Figura 2B).
- Ao remover um ovário, preserve o tecido adiposo circundante tanto quanto possível. Evitar o contato direto entre os instrumentos cirúrgicos e os ovários e prevenir a implantação intraperitoneal de tecido ovariano.
- Coloque cuidadosamente o coxim de gordura branca de volta na cavidade intraperitoneal. Realizar sutura simples intermitente no peritônio posterior com fio absorvível 5-0 (Figura 2C). Após o término da sutura, limpar qualquer sangramento com gaze de soro fisiológico 0,9% estéril.
- Puxe a incisão da pele para a direita e remova o ovário direito usando o mesmo método.
- Realizar sutura intermitente com pontos inabsorvíveis 4-0 e limpar qualquer sangramento com gaze estéril embebida em soro fisiológico 0,9% (Figura 2D).
- Limpar a ferida com uma solução de iodóforo após completar ambas as suturas. Injetar antibióticos de amplo espectro por via intraperitoneal.
3. Observação pós-operação
- Mover os ratos para uma manta de temperatura constante de 37 °C após a cirurgia. Até que os ratos possam se mover livremente, mantenha os animais em sua gaiola individual. Não deixe o animal sozinho até que ele tenha recuperado a consciência suficiente para manter a decúbito esternal.
- Injetar meloxicam (2 mg/kg) por via subcutânea 24 h após a operação para aliviar a dor.
- Monitore os ratos diariamente para garantir que a ferida cirúrgica esteja cicatrizando adequadamente sem quaisquer sinais de complicações (deiscências) presentes.
4. Suplementação de estradiol
- Preparar ração suplementada com valerato de estradiol. Use 2,6 mg de beta-estradiol 17-valerato suplementado por 1 kg de ração.
- Aos 3 dias após a conclusão da cirurgia, alimentar os camundongos com valerato de estradiol.
5. Injeção de FSH
- Preparar solução recombinante de FSH humano. Dissolver o pó de FSH humano recombinante injetável com solução salina estéril a 0,9% a 100 UI/mL.
- Agrupar camundongos de acordo com os planos experimentais e administrar solvente ou doses diferentes de FSH recombinante via injeção intraperitoneal por 2 semanas. De acordo com a atividade biológica do FSH recombinante, utilizar a dose de injeção de FSH em camundongos equivalente ao nível sérico de FSH em mulheres durante o período de transição menopausal.
NOTA: Com base em diferentes tratamentos, camundongos suplementados com estrogênio ovariectomizado foram divididos aleatoriamente em três grupos, grupo solvente (N.S.) recebendo 100 μL/dia de solvente, grupo FSH DE BAIXA DOSE (L-FSH) recebendo 15 UI/kg de peso corporal por dia e grupo de alta dose de FSH (H-FSH) recebendo 30 UI/kg de peso corporal por dia.
Resultados
O modelo de camundongo OVF mimetiza o estágio inicial da transição menopausal com estrogênio relativamente estável e níveis crescentes de FSH13. Primeiro, para a cirurgia de remoção do ovário, camundongos C57BL/6 fêmeas com 9 semanas de idade receberam anestesia geral e foram submetidos a uma operação simulada (Sham) ou ooforectomia bilateral (OVX). Como as baciloscopias das células coradas por Papanicolaou identificaram claramente os estágios de proestro, estro, metestro e diestro do ciclo estral, os camundongos OVX perderam o ciclo estral (Figura 3A), e o método ELISA mostrou uma diminuição significativa nos níveis séricos de estradiol (E2) (Figura 3B). Em segundo lugar, os camundongos OVX foram suplementados com beta-estradiol 17-valerato (OVX + E2) para manter o estrogênio sérico no mesmo nível do grupo Sham. Terceiro, os camundongos OVX + E2 receberam solvente (N.S.) ou diferentes doses de FSH recombinante via injeção intraperitoneal para criar um modelo de camundongo (OVF) caracterizado por estrógeno relativamente estável e níveis crescentes de FSH (Figura 4).
Gráfico 1. Ambiente cirúrgico e postura do rato. (A) Uma área de bancada de pelo menos 60 cm x 60 cm para a operação. Limpe a superfície da área com álcool 75% e cubra-a com uma toalha médica descartável e, em seguida, desinfete com radiação ultravioleta com 30 minutos de antecedência. (B) Fixe o mouse na plataforma cirúrgica usando uma tira de borracha ou corda de algodão. Clique aqui para ver uma versão maior desta figura.
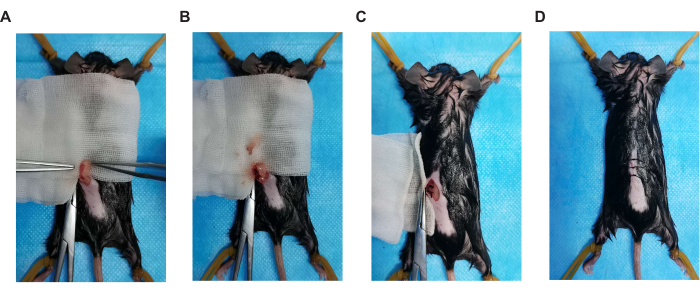
Gráfico 2. Principais etapas da operação cirúrgica. (A) posição ovariana, (B) ooforectomia, (C) sutura peritoneal e (D) sutura da pele incisão. Clique aqui para ver uma versão maior desta figura.
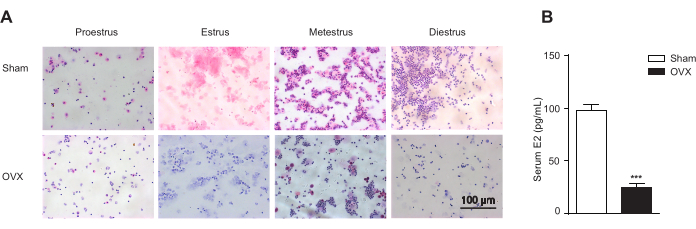
Gráfico 3. Citologia vaginal. A citologia vaginal representa os estágios do ciclo estral e estrógeno endógeno nos camundongos ovariectomizados (OVX) e sham-operados (Sham; n = 12 para o grupo Sham; n = 10 para os grupos OVX). (A) A citologia vaginal representa estágios do ciclo estral de acordo com a presença relativa de leucócitos, células epiteliais cornificadas e células epiteliais nucleadas. Os estágios do estro incluem o proestro, o predomínio de células epiteliais nucleadas; estro, predominância de células cornificadas enucleadas; metestro, presença de leucócitos e células epiteliais cornificadas e nucleadas; diestro, a predominância de leucócitos. Barra de escala = 100 μm. (B) Estrogênio endógeno nos camundongos ovariectomizados (OVX) e nos sham-operados (Sham). Os dados são apresentados como média ± EPM. O teste t de Student é utilizado para análise estatística. pág< 0,001. Clique aqui para ver uma versão maior desta figura.
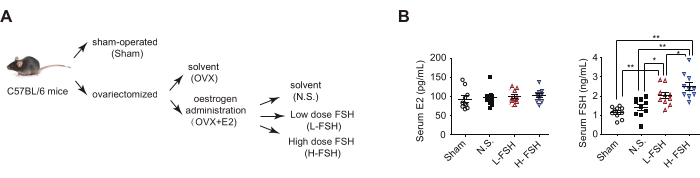
Gráfico 4. Modelo de OVF e níveis hormonais séricos. (A) Modelo OVF de fluxograma. (B) Análise ELISA das concentrações séricas de estrogênio (E2) e FSH. Os dados são representados como a média ± EPM. * p< 0,05 e ** p< 0,01. Este valor foi modificado de4. Clique aqui para ver uma versão maior desta figura.
Discussão
Durante a transição de uma fase reprodutiva para uma não reprodutiva (menopausa), muitas mulheres experimentam alterações fisiológicas e patológicas significativas. Os níveis de FSH aumentam durante a transição menopausal1. Estudos emergentes têm revelado que o FSH em vários tecidos e órgãos extragonadais é crítico na patogênese de múltiplas doenças, incluindo dislipidemia4, doença de Alzheimer5, osteoporose 9,10, aterosclerose11, obesidade9 e câncer12. Assim, a construção de um modelo animal que possa ajudar a estudar os efeitos independentes do FSH in vivo é particularmente importante. O modelo de camundongo OVF imita o estágio inicial da transição menopausal com estrogênio relativamente estável e níveis crescentes de FSH e é particularmente adequado para estudos que explorem as ações extragonadais do FSH.
Nesse método, a ooforectomia foi realizada com incisão dorsal única, a aproximadamente 1 cm da base da coxa para cima (Figura 1B). A pele foi cortada quase em conjunto com a musculatura dorsal com tesoura dissecante afiada, sendo assim acessada a cavidade peritoneal. No pós-operatório, a incisão muscular não necessitou de sutura, e a ferida cutânea foi fechada bilateralmente com um fio de categute (Figura 2). A operação é tecnicamente mais fácil, menos demorada e menos prejudicial para camundongos fêmeas em comparação com outros métodos usados.
Alguns detalhes que devem ser observados durante o procedimento cirúrgico. Primeiro, todos os procedimentos cirúrgicos devem ser mantidos limpos e o mais estéril possível para reduzir o risco de infecção pós-operatória. Segundo, como o tecido ovariano é muito frágil, os instrumentos cirúrgicos não podem entrar em contato direto com os ovários durante a ooforectomia, para evitar a implantação intraperitoneal. Terceiro, após a cirurgia, os camundongos foram movidos para uma manta de temperatura constante de 37 °C durante a recuperação para evitar hipotermia pós-operatória levando à morte.
Estudo prévio comprovou que o estrógeno endógeno é sintetizado nas células da teca ovariana de mulheres na pré-menopausa ou células do estroma adiposo da mama de mulheres na pós-menopausa e em menor quantidade no tecido periférico14. O estrógeno sérico caiu acentuadamente em camundongos ovariectomizados, mas não pode ser eliminado (Figura 3B). Entretanto, o estrógeno endógeno sintetizado no tecido extragonadal não afeta a estabilidade dos níveis de estrogênio no modelo de OVF (Figura 4B).
Existem algumas limitações no modelo OVF. Uma vez que a operação cirúrgica não é cuidadosa e leva ao implante intraperitoneal ovariano, pode levar à falha do modelo. Neste caso, o estrogênio sérico não cai acentuadamente e flutua durante diferentes estágios do ciclo estral. Após a administração exógena de estrogênio e FSH, leva aproximadamente 1 semana para o corpo atingir o equilíbrio. Assim, alterações patológicas do modelo de OVF que ocorrem dentro de 1 semana não podem indicar os efeitos do FSH.
Em conclusão, o modelo OVF tem as vantagens de ser estável, de baixo custo e fácil operação. Os efeitos sistêmicos do FSH de alto nível podem ser observados após a injeção intraperitoneal de FSH; ou seja, o modelo OVF é adequado para estudos que explorem as ações extragonadais do FSH. No entanto, as exigências para cirurgia modelo e procedimentos de injeção intraperitoneal são bastante altas. Se o financiamento for suficiente, modelos de nocaute específicos são a melhor escolha.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Queremos agradecer ao laboratório de animais do Hospital Provincial de Shandong pelo apoio técnico. Este trabalho foi apoiado pela Fundação Nacional de Ciências Naturais da China (NSFC 82101645), pela Fundação de Ciências Naturais da Província de Shandong, China (ZR2020QH088), e pelo Plano de Apoio à Ciência e Tecnologia para a Inovação Juvenil das Faculdades da Província de Shandong (2021KJ051).
Materiais
| Name | Company | Catalog Number | Comments |
| beta-estradiol 17-valerate | Macklin | E829824 | |
| Estradiol sensitive ELISA | Demeditec | DE4399 | |
| Hematoxylin Staining Solution | Beyotime | C0107 | |
| Meloxicam | Aladdin | M129228 | |
| recombinant human Follicle-stimulating hormone | Merck Serono | N19Z8803G | |
| Tribromoethanol | Sigma | T48402 | Aliphatic name: 2,2,2-Tribromoethanol |
Referências
- Harlow, S. D., et al. Executive summary of the Stages of Reproductive Aging Workshop + 10: addressing the unfinished agenda of staging reproductive aging. Journal of Clinical Endocrinology & Metabolism. 97 (4), 1159-1168 (2012).
- Ulloa-Aguirre, A., Zariñán, T. The Follitropin Receptor: Matching Structure and Function. Molecular Pharmacology. 90 (5), 596-608 (2016).
- Franks, S., Stark, J., Hardy, K. Follicle dynamics and anovulation in polycystic ovary syndrome. Human Reproduction Update. 14 (4), 367-378 (2008).
- Guo, Y., et al. Blocking FSH inhibits hepatic cholesterol biosynthesis and reduces serum cholesterol. Cell Research. 29 (2), 151-166 (2019).
- Xiong, J., et al. FSH blockade improves cognition in mice with Alzheimer's disease. Nature. 603 (7901), 470-476 (2022).
- Sun, L., et al. FSH Directly Regulates Bone Mass. Cell. 125 (2), 247-260 (2006).
- Liu, X. M., et al. FSH regulates fat accumulation and redistribution in aging through the Gαi/Ca(2+)/CREB pathway. Aging Cell. 14 (3), 409-420 (2015).
- Maclellan, R. A., et al. Expression of Follicle-Stimulating Hormone Receptor in Vascular Anomalies. Plastic and Reconstructive Surgery. 133 (3), 344e-351en (2014).
- Liu, P., et al. Blocking FSH induces thermogenic adipose tissue and reduces body fat. Nature. 546 (7656), 107-112 (2017).
- Ji, Y., et al. Epitope-specific monoclonal antibodies to FSHβ increase bone mass. Proceedings of the National Academy of Sciences of the United States of America. 115 (9), 2192-2197 (2018).
- El Khoudary, S. R., et al. Trajectories of estradiol and follicle-stimulating hormone over the menopause transition and early markers of atherosclerosis after menopause. European Journal of Preventive Cardiology. 23 (7), 694-703 (2016).
- Radu, A., et al. Expression of Follicle-Stimulating Hormone Receptor in Tumor Blood Vessels. The New England Journal of Medicine. 363 (17), 1621-1630 (2010).
- Sowers, M. R., et al. Endogenous hormones and bone turnover markers in pre- and perimenopausal women: SWAN. Osteoporosis International. 14 (3), 191-197 (2003).
- Kristensen, V. N., Kure, E. H., Erikstein, B., Harada, N., Børresen-Dale, A. L. Genetic susceptibility and environmental estrogen-like compounds. Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis. 482 (1), 77-82 (2001).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados