Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Establecimiento de un modelo mínimamente invasivo de embolia pulmonar en ratas mediante coágulos sanguíneos autólogos
En este artículo
Resumen
Se describe una metodología detallada para establecer un modelo mínimamente invasivo de embolia pulmonar en ratas utilizando coágulos sanguíneos autólogos. También se proporcionan métodos adicionales para cuantificar el área infartada y visualizar el árbol arterial pulmonar.
Resumen
La embolia pulmonar (EP) es una de las principales causas de muerte cardiovascular, lo que supone una importante carga socioeconómica. Aunque los tratamientos actuales se centran principalmente en la anticoagulación y la trombólisis, existe una necesidad urgente de una mejor comprensión de su fisiopatología y el desarrollo de nuevas estrategias de tratamiento. Los modelos animales desempeñan un papel crucial en la comprensión de la EP y en el desarrollo de nuevas terapias para la enfermedad, y los roedores se utilizan habitualmente por consideraciones éticas y económicas. Sin embargo, los modelos existentes de EP en roedores están limitados por la falta de procedimientos estandarizados, lo que dificulta la reproducibilidad y las comparaciones entre estudios. Este estudio tiene como objetivo establecer un modelo mínimamente invasivo de EP en ratas utilizando coágulos sanguíneos autólogos. El modelo cuenta con una técnica de muestreo de sangre mínimamente invasiva, un procedimiento estandarizado de generación de trombos y un acceso venoso mínimamente invasivo. Además, se proporcionan protocolos para cuantificar las áreas infartadas y visualizar el árbol arterial pulmonar. Estos procedimientos tienen como objetivo mejorar la fiabilidad de los modelos de roedores para estudiar la progresión de la EP y facilitar el desarrollo de nuevos tratamientos.
Introducción
La embolia pulmonar (EP) es una de las principales causas de muerte intrahospitalaria y la tercera causa más frecuente de muerte cardiovascular. A pesar de su alta incidencia, la prevención y el diagnóstico precoz siguen siendo un reto 1,2. Las terapias anticoagulantes y trombolíticas son fundamentales en el tratamiento de la EP, pero una comprensión más profunda de la progresión de la enfermedad y nuevos enfoques terapéuticos son esenciales para mejorar el manejo de la enfermedad3.
En la investigación biomédica moderna, los modelos animales desempeñan un papel fundamental en la elucidación de los mecanismos de las enfermedades humanas y en el desarrollo de nuevas terapias 4,5. Los ratones, ratas, hámsters y conejos se utilizan con frecuencia en el modelado de PE debido a consideraciones éticas y de rentabilidad 6,7,8,9,10. Los enfoques de modelado de PE generalmente se dividen en tres categorías: formación de trombos in vivo, inyección de coágulos sanguíneos in vitro y administración de partículas no trombóticas. La elección de la especie animal y la técnica de modelado está determinada por los objetivos específicos de la investigación, ya que ningún modelo único se adapta a todos los propósitos. Por ejemplo, los estudios centrados en explorar nuevas terapias trombolíticas a menudo emplean modelos que involucran coágulos de sangre autólogos en lugar de partículas no trombóticas.
Los métodos actuales para modelar la EP en roedores enfrentan desafíos debido a la falta de metodologías detalladas y estandarizadas. Esto afecta a procesos clave como la toma de muestras de sangre, la formación de coágulos sanguíneos y la posterior embolización, todos ellos cruciales para garantizar resultados reproducibles en todos los estudios. Además, existe una brecha significativa en la capacidad de cuantificar el área embolizada y mapear con precisión la distribución de los émbolos después de la embolización. Abordar estas deficiencias es esencial para avanzar en la fiabilidad y la utilidad de los modelos de roedores en la investigación de la EP.
En este estudio, se describen protocolos detallados para establecer un modelo de EP en ratas utilizando coágulos sanguíneos autólogos. Este modelo cuenta con una técnica de muestreo de sangre mínimamente invasiva, un procedimiento estandarizado de generación de trombos y un acceso venoso mínimamente invasivo. Además, se proporcionan protocolos para cuantificar las áreas infartadas en los pulmones y visualizar el árbol arterial pulmonar, lo que puede facilitar futuros descubrimientos de investigación.
Protocolo
Todos los experimentos con animales se llevaron a cabo con la aprobación del Comité de Cuidado y Uso de Animales de la Academia China de Ciencias Médicas y el Colegio Médico de la Unión de Pekín (número de aprobación: IRM/2-1ACUC-2311-015). En este estudio se utilizaron ratas macho Sprague-Dawley, de 6 semanas de edad y con un peso aproximado de 250 g. Los animales fueron alojados en un ambiente específico libre de patógenos con acceso ad libitum a una dieta equilibrada de comida y agua. Se mantuvieron bajo un ciclo de luz/oscuridad de 12 horas a una temperatura ambiente de 22 °C ± 2 °C. Se permitió que los animales se adaptaran al entorno durante 1 semana antes de someterse a cualquier procedimiento quirúrgico. Los detalles de los reactivos y equipos utilizados en este estudio se enumeran en la Tabla de Materiales.
1. Equipos y materiales
- Equipo de anestesia: Utilice una máquina de anestesia con gas para animales pequeños e isoflurano.
- Material quirúrgico: Prepare hisopos de algodón, desinfectante de yodofor, un microscopio estereoscópico, una afeitadora, cinta médica, una jeringa de 1 mL con aguja de 27 G, una jeringa de 5 mL, una jeringa de 10 mL, solución salina normal, gasa, 8-0 Hilos de nylon, hilo de nylon 6-0 con aguja de sutura, pinzas micro hemostáticas, micro pinzas y tijeras finas.
- Otros materiales: Obtenga agujas dispensadoras de 19 G y 18 G compatibles con jeringas médicas, un tubo de silicona con un diámetro interior de 1,2 mm y una longitud de 10 cm, un tubo de infusión con un diámetro interior de 3,0 mm y una longitud de 20 cm, un tubo de centrífuga de 1,5 mL, una pipeta y puntas de pipeta.
- Generador de trombos e inyector de coágulos sanguíneos de fabricación propia (Figura 1): Conecte el tubo de silicona a la aguja dispensadora de 19 G conectada a una jeringa de 1 ml para crear el generador de trombos. Conecte un extremo del tubo de infusión a la aguja dispensadora de 18 g y conecte el otro extremo a una jeringa de 5 ml para crear el inyector de coágulo.
2. Preparación de coágulos sanguíneos autólogos
- Anestesia
- Colocar al animal dentro de la cámara de inducción de anestesia y administrar una mezcla de isoflurano al 4% con aire ambiente a un caudal de 2 L/min durante 2-3 min (siguiendo los protocolos aprobados institucionalmente).
- Coloque al animal en la plataforma de operaciones en posición supina. Mantener la anestesia administrando isoflurano al 2,5% a un caudal de 0,4 L/min. Pruebe el reflejo del pedal para asegurarse de que se logra una anestesia adecuada.
- Extienda ambas extremidades anteriores horizontalmente desde el cuerpo y extienda las extremidades traseras para exponer adecuadamente el área de la ingle. Asegure al animal en esta posición con cinta médica (Figura 2A).
- Toma de muestras de sangre a través de la vena cava craneal (CVC)
- Elimine el vello alrededor del manubrio con una afeitadora y una crema depilatoria. Desinfectar la piel con yodóforo.
- Inserte la aguja de 27 G unida a la jeringa de 1 ml verticalmente a una profundidad de 8 mm para perforar el CVC izquierdo o derecho, como se muestra en la figura 2A.
NOTA: La proyección de la superficie corporal del CVC es de 5 mm lateral al manubrio. Se pueden utilizar ambos lados y la elección no afecta a los siguientes pasos. - Sostenga la jeringa y tire suavemente del émbolo hacia atrás para crear una presión negativa dentro del cilindro. Retire gradualmente la aguja hasta que la sangre fluya, luego mantenga esa posición hasta que se recojan 0,3 mL de sangre (Figura 2B).
- Preparación de coágulos de sangre
- Empuje la sangre recolectada en un tubo centrífugo de 1,5 ml, teniendo cuidado de no producir burbujas.
- Extraiga la sangre hacia el tubo de silicona del generador de trombos de fabricación propia hasta que la columna de sangre tenga 10 cm de longitud.
NOTA: Realice estos dos pasos rápidamente, ya que la coagulación se iniciará y propagará en el tubo de centrífuga, disminuyendo la calidad de los coágulos de sangre recolectados. - Espere 30 minutos hasta que la sangre esté completamente trombosada. Durante este tiempo, prepare las columnas de sangre para otros animales de la misma manera.
- Enjuague la columna de sangre trombosada en una placa de Petri que contenga solución salina normal y lave la columna de trombo con solución salina normal tres veces (Figura 2C).
- Utilice unas tijeras finas para cortar la columna de trombo en coágulos de sangre uniformes, de 4 mm de longitud cada uno (Figura 2D). Extraiga de 10 a 20 coágulos en el inyector de fabricación propia precargado con 2 ml de solución salina normal.
NOTA: La longitud de los coágulos de sangre no debe exceder 1 cm, o quedarán atrapados en el ventrículo derecho.
3. Preparación del acceso a las venas
- Exposición de los vasos epigástricos superficiales
- Anestesiar y fijar al animal como se describe en el paso 2.1.
- Afeita el vello que rodea la zona izquierda de la ingle. Aplique la crema depilatoria en estas áreas, espere 1 minuto y luego limpie la crema con una gasa. Desinfectar la piel con yodóforo.
- Realizar una incisión cutánea de 5 mm por encima del origen de los vasos epigástricos superficiales en la zona de la ingle. Por lo general, el origen de los vasos epigástricos superficiales se puede rastrear observando una pequeña pulsación en el área de la ingle.
- Con un microscopio estereoscópico de 10 aumentos, separe una capa delgada de grasa subcutánea para exponer los vasos epigástricos superficiales (Figura 3A).
- Aislamiento de la vena epigástrica superficial
- Aísle cuidadosamente la vena epigástrica superficial de la arteria, el nervio y el tejido graso. Se realiza tanto proximalmente, hasta el punto en que drena en la vena femoral, como distalmente, hasta la bifurcación de la primera vena.
- Ligar el lado distal con 8-0 Enrosque y sujete la rosca con una microabrazadera. Controla el lado proximal con un 8-0 bucle de rosca unido a otra microabrazadera (Figura 3B).
- Haga una pequeña incisión transversal en el lado distal de la vena aislada. Controle el lado proximal para evitar el sangrado. Enjuague la sangre restante en la luz de la vena con solución salina normal. Una vez que la vena esté limpia, use micropinzas para agrandar la incisión venosa.
4. Embolización
- Canulación venosa
- Inserte suavemente la aguja del inyector de fabricación propia en la vena a través de la incisión de la vena. Asegure la aguja con una tercera pinza para evitar que se salga de la vena.
- Procedimiento de embolización
- Empuje lentamente el émbolo para administrar una pequeña cantidad de solución salina normal. La plenitud de la vena sin resistencia indica un acceso sin obstrucciones a la vena (Figura 3D).
- Continúe empujando el émbolo para administrar los coágulos en la vena femoral a través del acceso superficial de la vena epigástrica. Controlar la velocidad de embolización a 5 émbolos por minuto. Controlar la respiración del animal; La disnea emergente y exacerbada indica una embolización exitosa.
- Después de inyectar la cantidad predefinida de coágulos de sangre, retire la aguja y lige el lado proximal de la vena epigástrica superficial.
- Suturar la incisión y colocar al animal en una caja tibia. Transfiere al animal a su jaula una vez que haya despertado.
5. Cuantificación del área infartada
- Eutanasia y perfusión cardíaca
- Agregue 25,000 U de heparina sódica a 250 mL de solución salina normal y mezcle bien. Conecte el frasco a un dispositivo de infusión y cuélguelo boca abajo a una altura de 80 cm. Cierre la válvula del dispositivo de infusión.
- Eutanasia de los animales con una sobredosis de isoflurano (siguiendo protocolos aprobados institucionalmente).
- Corta las costillas con unas tijeras grandes y abre el pecho, evitando dañar los pulmones y los vasos grandes.
- Inserte la aguja del dispositivo de infusión en el ventrículo izquierdo. Abra la válvula del dispositivo de infusión para permitir la infusión de solución salina heparinizada. Utilice unas tijeras para cortar la vena cava inferior y el apéndice izquierdo para permitir el drenaje. Controlar la velocidad de perfusión a 50 mL/min.
NOTA: Durante este procedimiento, el tejido pulmonar normal se volverá blanco, mientras que la zona embolizada permanece oxidada. - Después de completar la perfusión con solución salina heparinizada, punción del tronco de la arteria pulmonar a través del ventrículo derecho con una jeringa de 10 ml llena de una solución de paraformaldehído al 4%. Fije el tejido pulmonar realizando una perfusión de paraformaldehído al 4% a través de los pulmones para un volumen total de 30 mL.
- Introducción de un índice llamado Índice de Infarto
- Después de la fijación, extirpe los pulmones, el corazón, la tráquea, el esófago, el timo y los vasos grandes en su totalidad de la columna vertebral y el diafragma11.
- Extirpe con cuidado el esófago, el timo y el tejido graso de la masa inicial, dejando solo el corazón, los pulmones y los vasos sanguíneos grandes.
- Sumerja la parte restante en un volumen adecuado de solución de paraformaldehído al 4% durante al menos 48 h.
- Use una balanza analítica para pesar todos los pulmones. Utilice unas tijeras finas para separar la parte infartada de los pulmones y pesar el tejido infartado con la misma balanza. Calcule la razón de infarto usando la siguiente ecuación:
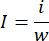
i es el peso del tejido infartado, w es el peso de todos los pulmones, i representa la relación de infarto. - Después de cuantificar el área infartada, recorte el tejido pulmonar fijado con paraformaldehído para la inclusión en parafina11.
6. Visualización del árbol arterial pulmonar
- Escayola de la arteria pulmonar
- Sacrificar al animal y realizar la perfusión cardíaca como se describe en el paso 5.1.
- Agregue una cantidad igual (en peso) de diluyente al compuesto de fundición de silicona, mezcle la mezcla y luego agregue un 5% (en peso o volumen) del agente de curado. Vuelve a licuar la mezcla.
- Extraiga 1 mL de la mezcla en una jeringa de 1 mL, expulse el aire e inserte la aguja en el tronco de la arteria pulmonar a través del ventrículo derecho. Asegure la aguja a la arteria pulmonar para evitar el deslizamiento y el reflujo.
- Presione suavemente el émbolo para permitir que la mezcla de fundición de silicona llene el árbol arterial pulmonar. Las áreas pulmonares normales se teñirán con la mezcla de yeso, mientras que las áreas infartadas permanecerán de color rojo oxidado.
NOTA: El yeso de la arteria pulmonar solo debe aplicarse al tejido pulmonar intacto. Por lo general, 0,6-0,8 ml de la mezcla de yeso es suficiente para llenar el árbol arterial pulmonar. La inyección excesiva de la mezcla de yeso puede provocar el yeso de las venas pulmonares, lo que afecta a la visualización del árbol arterial pulmonar. La mezcla de fundición debe usarse dentro de los 20 minutos posteriores a la adición del agente de curado, ya que cristalizará más allá de este tiempo. - Extraiga la jeringa después de enyesar la perfusión, ligar el tronco de la arteria pulmonar y extraer los pulmones, el corazón y los vasos grandes como se describe en el paso 5.2. Coloque toda la masa en una placa de Petri y guárdela en un refrigerador a 4 °C durante la noche para permitir que la mezcla de fundición se cristalice.
- Limpieza y visualización
- Retire el corazón y los vasos grandes de los pulmones con unas tijeras, luego limpie los restos de la mezcla de curado de la superficie pulmonar.
- Sumerja los pulmones secuencialmente en soluciones de alcohol etílico al 25%, 50%, 75%, 95% y 100%, cada una durante 24 horas. Este procedimiento deshidratará completamente los pulmones.
- Sumerja los pulmones deshidratados en salicilato de metilo durante 24 h. Después de este proceso de limpieza, el árbol arterial pulmonar será visible, y también se pueden ver los émbolos, ya que el salicilato de metilo no elimina la hemoglobina (Figura 4B, D).
Resultados
Síntomas y patología del modelo de EP
Durante la embolización, las ratas experimentaron dificultad para respirar y el tórax mostró fluctuaciones ensanchadas. Casi todos los animales sobrevivieron al episodio de embolia pulmonar cuando se administraron menos de 10 cm de coágulos de sangre (14 de 15 animales modelados). Después de ser devueltos a sus jaulas, los animales se acurrucaron en las esquinas y mostraron un menor interés en la comida y el agua. Sin emba...
Discusión
En este estudio, se estableció con éxito un modelo de rata mínimamente invasivo de EP que utiliza coágulos de sangre autólogos. Una vez dominado, este procedimiento de modelado se puede completar en 30 minutos. El modelo capta eficazmente las características clave de la EP clínica, confirmadas por los exámenes patológicos. En consecuencia, ofrece una herramienta valiosa para dilucidar los cambios hemodinámicos y la patogenia de las complicaciones posteriores a la EP, desarrolla...
Divulgaciones
Los autores declaran no tener ningún conflicto de intereses.
Agradecimientos
Este estudio cuenta con el apoyo de una subvención de la Fundación Médica Wu Jieping (320.6750.19089-36).
Materiales
| Name | Company | Catalog Number | Comments |
| Analytical balance | METTLER TOLEDO | MA55/A | None |
| Dispensing needle | Jinrong electronics | None | 19 G and 18 G |
| Fine scissors | Stronger | XGJ1300 | None |
| Heparin sodium salt | Solarbio | 01-08-9041 | 140U/mg |
| Isoflurane | RWD | R510-22-10 | None |
| Methyl salicylate | Macklin | M813577 | AR, 99% |
| Micro clamp | JZ | W40160 | None |
| Micro tweezers | Stronger | XGN1310 | None |
| Silicone casting compound | Flow Tech | MV-130 | None |
| Sprague-Dawley rats | Vital River | SD-IGS | None |
| Stereo microscope | Murzider | MSD204 | None |
Referencias
- Götzinger, F., et al. Interventional therapies for pulmonary embolism. Nat Rev Cardiol. 20 (10), 670-684 (2023).
- Falster, C., et al. Comparison of international guideline recommendations for the diagnosis of pulmonary embolism. Lancet Haematol. 10 (11), e922-e935 (2023).
- Konstantinides, S. V., et al. ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 41 (4), 543-603 (2020).
- Domínguez-Oliva, A., et al. The importance of animal models in biomedical research: Current insights and applications. Animals (Basel). 13 (7), 1223 (2023).
- Mukherjee, P., Roy, S., Ghosh, D., Nandi, S. K. Role of animal models in biomedical research: A review. Lab Anim Res. 38 (1), 18 (2022).
- Tang, Z., et al. Gene expression profiling of pulmonary artery in a rabbit model of pulmonary thromboembolism. PLoS One. 11 (10), e0164530 (2016).
- Deng, C., et al. Expression of tissue factor and forkhead box transcription factor o-1 in a rat model for chronic thromboembolic pulmonary hypertension. J Thromb Thrombolysis. 42 (4), 520-528 (2016).
- Runyon, M. S., Gellar, M. A., Sanapareddy, N., Kline, J. A., Watts, J. A. Development and comparison of a minimally-invasive model of autologous clot pulmonary embolism in Sprague-Dawley and Copenhagen rats. Thromb J. 8, 3 (2010).
- Li, S. Q., et al. Comparative proteomic study of acute pulmonary embolism in a rat model. Proteomics. 7 (13), 2287-2299 (2007).
- Deng, C., et al. Role of FOXO1 and apoptosis in pulmonary vascular remolding in a rat model of chronic thromboembolic pulmonary hypertension. Sci Rep. 7 (1), 2270 (2017).
- Morton, J., Snider, T. A. Guidelines for collection and processing of lungs from aged mice for histological studies. Pathobiol Aging Age Relat Dis. 7 (1), 1313676 (2017).
- Karpov, A. A., Vaulina, D. D., Smirnov, S. S., Moiseeva, O. M., Galagudza, M. M. Rodent models of pulmonary embolism and chronic thromboembolic pulmonary hypertension. Heliyon. 8 (3), e09014 (2022).
- Picazo, M. G., Benito, P. J., García-Olmo, D. C. Efficiency and safety of a technique for drawing blood from the hamster cranial vena cava. Lab Anim (NY). 38 (6), 211-216 (2009).
- Szabó, K. The cranial venous system in the rat: Anatomical pattern and ontogenetic development. Ii. Dorsal drainage. Ann Anat. 177 (4), 313-322 (1995).
- Li, C. Y., et al. The effects and mechanism of ginsenoside rg1 on myocardial remodeling in an animal model of chronic thromboembolic pulmonary hypertension. Eur J Med Res. 18 (1), 16 (2013).
- Sullivan, D. M., Watts, J. A., Kline, J. A. Biventricular cardiac dysfunction after acute massive pulmonary embolism in the rat. J Appl Physiol (1985). 90 (5), 1648-1656 (2001).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados