このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
自家血栓を用いた肺塞栓症の低侵襲ラットモデルの確立
要約
自家血栓を使用した肺塞栓症の低侵襲ラットモデルを確立するための詳細な方法論について説明します。梗塞領域を定量化し、肺動脈樹を視覚化するための追加の方法も提供されています。
要約
肺塞栓症(PE)は、心血管死の主な原因の1つであり、重大な社会経済的負担をもたらします。現在の治療法は主に抗凝固療法と血栓溶解療法に焦点を当てていますが、その病態生理学の理解を深め、新しい治療戦略の開発が急務となっています。動物モデルは、PEを理解し、この疾患の新しい治療法を開発する上で重要な役割を果たしており、倫理的およびコスト上の考慮事項からげっ歯類が一般的に使用されています。しかし、PEの既存のげっ歯類モデルは、標準化された手順がないために限られており、再現性や研究間の比較が妨げられています。この研究は、自家血栓を使用したPEの低侵襲ラットモデルを確立することを目的としています。このモデルは、低侵襲採血技術、標準化された血栓生成手順、および低侵襲静脈アクセスを特徴としています。さらに、梗塞領域を定量化し、肺動脈樹を視覚化するためのプロトコルが提供されます。これらの手順は、PEの進行を研究するためのげっ歯類モデルの信頼性を向上させ、新しい治療法の開発を促進することを目的としています。
概要
肺塞栓症(PE)は、院内死亡の主な原因であり、心血管死の3番目に多い原因です。その高い発生率にもかかわらず、予防と迅速な診断は依然として困難です1,2。PEの治療には抗凝固療法と血栓溶解療法が重要ですが、疾患の進行と新しい治療アプローチをより深く理解することは、疾患管理を改善するために不可欠です3。
現代の生物医学研究では、動物モデルはヒトの疾患のメカニズムを解明し、新しい治療法を開発する上で極めて重要な役割を果たしています4,5。マウス、ラット、ハムスター、およびウサギは、倫理的配慮と費用対効果のために、PEモデリングで頻繁に使用されます6,7,8,9,10。PEモデリングアプローチは、一般に、in vivo血栓形成、in vitro血栓注射、および非血栓性粒子の投与の3つのカテゴリに分類されます。動物種とモデリング技術の選択は、特定の研究目的によって決定され、単一のモデルがすべての目的に適しているわけではありません。例えば、新しい血栓溶解療法の探求に焦点を当てた研究では、非血栓性粒子の代わりに自家血栓を含むモデルがよく採用されています。
げっ歯類のPEをモデル化する現在の方法は、詳細で標準化された方法論が不足しているため、課題に直面しています。これは、採血、血栓形成、その後の塞栓術などの主要なプロセスに影響を及ぼし、これらはすべて、研究間で再現性のある結果を確保するために重要です。さらに、塞栓された領域を定量化し、塞栓後の塞栓の分布を正確にマッピングする能力には大きなギャップがあります。これらの欠点に対処することは、PE研究におけるげっ歯類モデルの信頼性と有用性を向上させるために不可欠です。
この研究では、自家血栓を使用してPEのラットモデルを確立するための詳細なプロトコルについて説明します。このモデルは、低侵襲採血技術、標準化された血栓生成手順、および低侵襲静脈アクセスを特徴としています。さらに、肺の梗塞領域を定量化し、肺動脈樹を視覚化するためのプロトコルが提供されており、さらなる研究発見を促進する可能性があります。
プロトコル
すべての動物実験は、中国医学院および北京連合医科大学の動物管理および使用委員会の承認を得て行われました(承認番号:IRM/2-1ACUC-2311-015)。この研究では、生後6週間、体重約250gの雄のSprague-Dawleyラットを使用しました。動物は、バランスの取れた食事と水を自由に利用できる特定の病原菌を含まない環境で飼育されました。室温22°C±2°Cで12時間の明暗サイクルで保管しました。 動物は、外科的処置を受ける前に1週間環境に適応することが許されました。本試験で使用した試薬および装置の詳細は、 材料表に記載されています。
1. 設備・資材
- 麻酔器具:小動物やイソフルラン用のガス麻酔器を使用してください。
- 手術材料:綿棒、ヨードフォア消毒剤、実体顕微鏡、シェーバー、医療用テープ、27G針付き1mLシリンジ、5mLシリンジ、10mLシリンジ、生理食塩水、ガーゼ、8-0を準備しますナイロン糸、縫合針付き6-0ナイロン糸、マイクロ止血クランプ、マイクロピンセット、細いハサミ。
- その他の材料:医療用注射器と互換性のある19Gおよび18Gの分注針、内径1.2mm、長さ10cmのシリコンチューブ、内径3.0mm、長さ20cmの輸液チューブ、1.5mLの遠心チューブ、ピペット、ピペットチップを入手してください。
- 自作の血栓発生器と血栓注入器(図1):1mLシリンジに取り付けられた19Gの分注針にシリコンチューブを接続して、血栓発生器を作成します。輸液チューブの一方の端を18Gの分注針に接続し、もう一方の端を5mLシリンジに取り付けて血栓インジェクターを作成します。
2. 自家血栓製剤
- 麻酔
- 動物を麻酔導入チャンバー内に置き、4%イソフルランと室内空気の混合物を2 L /分の流量で2〜3分間投与します(施設で承認されたプロトコルに従います)。
- 動物を手術台に仰臥位で置きます。2.5%イソフルランを0.4 L / minの流量で投与することにより、麻酔を維持します。ペダル反射をテストして、適切な麻酔が達成されていることを確認します。
- 両前肢を体から水平に伸ばし、後肢を伸ばして鼠径部を十分に露出させます。医療用テープを使用して動物をこの位置に固定します(図2A)。
- 頭蓋大静脈(CVC)による採血
- マヌブリウムの周りの毛をシェーバーと脱毛クリームで取り除きます。ヨードフォアで皮膚を消毒します。
- 図 2A に示すように、1 mL シリンジに取り付けられた 27 G 針を垂直に 8 mm の深さまで挿入し、左右の CVC に穴を開けます。
注:CVCの体表面の突起は、原稿に対して5mm横です。両側を使用でき、選択は次の手順に影響を与えません。 - シリンジを持ち、プランジャーをゆっくりと引き戻して、バレル内に負圧を作り出します。血液が流れ込むまで針を徐々に引き抜き、0.3 mLの血液が採取されるまでその位置を維持します(図2B)。
- 血栓の準備
- 採取した血液を1.5mLの遠心チューブに押し込み、気泡が出ないように注意します。
- 自作の血栓発生器のシリコンチューブに血液を吸い込み、血液柱の長さが10cmになるまで待ちます。
注:凝固が遠心分離管内で開始および伝播し、採取された血栓の品質が低下するため、これらの2つの手順を迅速に実行してください。 - 血液が完全に血栓になるまで30分待ちます。この間、同じように他の動物の血液柱を準備します。
- 血栓を含んだ血液カラムを生理食塩水が入ったシャーレに洗い流し、血栓カラムを生理食塩水で3回洗浄します(図2C)。
- 細いハサミを使用して、血栓カラムを長さ4mmの均一な血栓に切断します(図2D)。10〜20個の血栓を、2mLの生理食塩水で事前に充填した自作インジェクターに引き込みます。
注:血栓の長さは1cmを超えないようにし、そうしないと右心室に閉じ込められます。
3. 静脈アクセスの準備
- 表在性上腹部血管の露出
- ステップ2.1で説明されているように、動物に麻酔をかけ、固定します。
- 左の鼠径部の周りの毛を剃ります。これらの部分に脱毛クリームを塗り、1分ほど待ってからガーゼでクリームを拭き取ります。ヨードフォアで皮膚を消毒します。
- 鼠径部の表在性上腹部血管の起点より5mmの皮膚切開を行います。通常、表在性上腹部血管の起源は、鼠径部の小さな脈動を観察することで追跡できます。
- 10倍倍率の実体顕微鏡を使用して、皮下脂肪の薄い層を分離して、表在性上腹部血管を露出させます(図3A)。
- 表在性上腹部静脈の分離
- 動脈、神経、脂肪組織から表在性上腹部静脈を慎重に分離します。これを、大腿静脈に流れ込むまで近位で、および遠位で最初の静脈分岐部まで実行します。
- 遠位側を8-0で結紮します糸を通し、マイクロクランプで糸をクランプします。8-0で近位側をコントロールします別のマイクロクランプに取り付けられたスレッドループ(図3B)。
- 孤立した静脈の遠位側に小さな横切開を行います。出血を避けるために近位側を制御します。静脈内腔に残っている血液を通常の生理食塩水で洗い流します。静脈がきれいになったら、マイクロピンセットを使用して静脈切開を拡大します。
4.塞栓術
- 静脈カニューレ挿入
- 自作インジェクターの針を静脈切開部から静脈にそっと挿入します。針が静脈から滑り落ちないように、3番目のclで針を固定します。
- 塞栓術の手順
- プランジャーをゆっくりと押して、少量の通常の生理食塩水を投与します。抵抗のない静脈の満ち足りた状態は、静脈へのアクセスが妨げられていないことを示しています(図3D)。
- プランジャーを押し続けて、表在性上腹部静脈へのアクセスを通じて大腿静脈に血栓を投与します。塞栓速度を毎分5塞栓に制御します。動物の呼吸を監視します。新たに発症し悪化する呼吸困難は、塞栓術が成功したことを示しています。
- 事前定義された量の血栓を注入した後、針を抜いて表在性上腹部静脈の近位側を結紮します。
- 切開部を縫合し、動物を温かい箱に入れます。動物が目覚めたら、動物をケージに移します。
5. 梗塞領域の定量化
- 安楽死と心臓灌流
- 25,000 Uのヘパリンナトリウムを250 mLの生理食塩水に加えて、よく混合します。.ボトルを輸液装置に接続し、ボトルを逆さまに80cmの高さで吊るします。輸液装置のバルブを閉じます。
- イソフルランの過剰摂取で動物を安楽死させます(施設で承認されたプロトコルに従います)。
- 大きなハサミで肋骨を切って胸を開き、肺や大きな血管への損傷を防ぎます。
- 輸液装置の針を左心室に挿入します。輸液装置のバルブを開いて、ヘパリン化生理食塩水の注入を可能にします。はさみを使用して下大静脈を切断し、左付属器を切断して排水できるようにします。灌流速度を50mL/minに制御します。
注:この手順では、正常な肺組織が白くなりますが、塞栓されたゾーンは錆びたままになります。 - ヘパリン化生理食塩水による灌流を完了した後、4%パラホルムアルデヒド溶液で満たされた10mLシリンジを使用して、右心室から肺動脈幹を穿刺します。肺を通じて4%パラホルムアルデヒド灌流を行い、総量30mLで肺組織を固定します。
- 梗塞率という指標を導入
- 固定後、脊椎と横隔膜11から肺、心臓、気管、食道、胸腺、および大きな血管全体を切除します。
- 最初の腫瘤から食道、胸腺、脂肪組織を慎重に取り除き、心臓、肺、大きな血管だけを残します。
- 残りの部分を適切な量の4%パラホルムアルデヒド溶液に少なくとも48時間浸します。
- 分析天びんを使用して、肺全体の重量を量ります。細いハサミを使って肺の梗塞部分を分離し、梗塞組織の重さを同じ天秤で量ります。梗塞比は、次の式を使用して計算します。
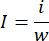
iは梗塞組織の重量、 wは肺全体の重量、 i は梗塞率を表します。 - 梗塞領域を定量した後、パラホルムアルデヒド固定肺組織をパラフィン包埋11のためにトリミングします。
6. 肺動脈樹の可視化
- 肺動脈キャスティング
- 動物を安楽死させ、ステップ5.1に記載されているように心臓灌流を行います。
- シリコーンキャスティングコンパウンドに等量(重量)の希釈剤を添加し、混合物をブレンドしてから、硬化剤の5%(重量または容量)を添加します。混合物を再度ブレンドします。
- 混合物1mLを1mLシリンジに引き込み、空気を排出し、針を右心室から肺動脈幹に挿入します。針を肺動脈に固定して、滑りや逆流を防ぎます。
- プランジャーを静かに押して、シリコンキャスティング混合物が肺動脈樹に充填されるようにします。正常な肺領域はキャスティング混合物によって染色されますが、梗塞領域は錆びた赤のままです。
注:肺動脈ギプスは、無傷の肺組織にのみ適用する必要があります。典型的には、0.6〜0.8mLのキャスティング混合物は、肺動脈樹を満たすのに十分である。キャスティング混合物の過剰注入は、肺静脈キャスティングにつながる可能性があり、肺動脈樹の視覚化に影響を与えます。キャスティング混合物は、硬化剤を添加してから20分以内に使用する必要があります。 - 灌流をキャストした後、シリンジを引き出し、肺動脈幹を結紮し、ステップ5.2で説明したように肺、心臓、および大きな血管を採取します。全体の塊をペトリ皿に入れ、4°Cの冷蔵庫で一晩保管して、キャスティング混合物を結晶化させます。
- クリアリングと視覚化
- ハサミで肺から心臓と大きな血管を取り除き、肺表面から硬化混合物の破片を取り除きます。
- 肺を25%、50%、75%、95%、および100%エチルアルコール溶液にそれぞれ24時間順に浸します。この手順は肺を完全に脱水します。
- 脱水した肺をサリチル酸メチルに24時間浸します。このクリアリングプロセスの後、肺動脈樹が見え、サリチル酸メチルはヘモグロビンをクリアしないため、塞栓も見ることができます(図4B、D)。
結果
PEモデルの症状と病理
塞栓術中、ラットは息切れを経験し、胸部は変動が拡大しました。肺塞栓症のエピソードでは、投与された血栓が10cm未満であったため、ほぼすべての動物が生存した(モデル化された動物15匹中14匹)。ケージに戻された後、動物たちは隅で丸くなり、食べ物や水への興味が薄れました。しかし、これらの症状はすぐに治まり、数時...
ディスカッション
この研究では、自家血栓を使用したPEの低侵襲ラットモデルを確立することに成功しました。このモデリング手順をマスターすれば、30分以内に完了することができます。このモデルは、病理学的検査によって確認されたように、臨床PEの主要な特徴を効果的に捉えています。その結果、PE後の合併症の血行動態変化と病因を解明し、新しい診断バイオマーカーと治療?...
開示事項
著者は、利益相反を宣言しません。
謝辞
この研究は、Wu Jieping Medical Foundation(320.6750.19089-36)からの助成金によってサポートされています。
資料
| Name | Company | Catalog Number | Comments |
| Analytical balance | METTLER TOLEDO | MA55/A | None |
| Dispensing needle | Jinrong electronics | None | 19 G and 18 G |
| Fine scissors | Stronger | XGJ1300 | None |
| Heparin sodium salt | Solarbio | 01-08-9041 | 140U/mg |
| Isoflurane | RWD | R510-22-10 | None |
| Methyl salicylate | Macklin | M813577 | AR, 99% |
| Micro clamp | JZ | W40160 | None |
| Micro tweezers | Stronger | XGN1310 | None |
| Silicone casting compound | Flow Tech | MV-130 | None |
| Sprague-Dawley rats | Vital River | SD-IGS | None |
| Stereo microscope | Murzider | MSD204 | None |
参考文献
- Götzinger, F., et al. Interventional therapies for pulmonary embolism. Nat Rev Cardiol. 20 (10), 670-684 (2023).
- Falster, C., et al. Comparison of international guideline recommendations for the diagnosis of pulmonary embolism. Lancet Haematol. 10 (11), e922-e935 (2023).
- Konstantinides, S. V., et al. ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 41 (4), 543-603 (2020).
- Domínguez-Oliva, A., et al. The importance of animal models in biomedical research: Current insights and applications. Animals (Basel). 13 (7), 1223 (2023).
- Mukherjee, P., Roy, S., Ghosh, D., Nandi, S. K. Role of animal models in biomedical research: A review. Lab Anim Res. 38 (1), 18 (2022).
- Tang, Z., et al. Gene expression profiling of pulmonary artery in a rabbit model of pulmonary thromboembolism. PLoS One. 11 (10), e0164530 (2016).
- Deng, C., et al. Expression of tissue factor and forkhead box transcription factor o-1 in a rat model for chronic thromboembolic pulmonary hypertension. J Thromb Thrombolysis. 42 (4), 520-528 (2016).
- Runyon, M. S., Gellar, M. A., Sanapareddy, N., Kline, J. A., Watts, J. A. Development and comparison of a minimally-invasive model of autologous clot pulmonary embolism in Sprague-Dawley and Copenhagen rats. Thromb J. 8, 3 (2010).
- Li, S. Q., et al. Comparative proteomic study of acute pulmonary embolism in a rat model. Proteomics. 7 (13), 2287-2299 (2007).
- Deng, C., et al. Role of FOXO1 and apoptosis in pulmonary vascular remolding in a rat model of chronic thromboembolic pulmonary hypertension. Sci Rep. 7 (1), 2270 (2017).
- Morton, J., Snider, T. A. Guidelines for collection and processing of lungs from aged mice for histological studies. Pathobiol Aging Age Relat Dis. 7 (1), 1313676 (2017).
- Karpov, A. A., Vaulina, D. D., Smirnov, S. S., Moiseeva, O. M., Galagudza, M. M. Rodent models of pulmonary embolism and chronic thromboembolic pulmonary hypertension. Heliyon. 8 (3), e09014 (2022).
- Picazo, M. G., Benito, P. J., García-Olmo, D. C. Efficiency and safety of a technique for drawing blood from the hamster cranial vena cava. Lab Anim (NY). 38 (6), 211-216 (2009).
- Szabó, K. The cranial venous system in the rat: Anatomical pattern and ontogenetic development. Ii. Dorsal drainage. Ann Anat. 177 (4), 313-322 (1995).
- Li, C. Y., et al. The effects and mechanism of ginsenoside rg1 on myocardial remodeling in an animal model of chronic thromboembolic pulmonary hypertension. Eur J Med Res. 18 (1), 16 (2013).
- Sullivan, D. M., Watts, J. A., Kline, J. A. Biventricular cardiac dysfunction after acute massive pulmonary embolism in the rat. J Appl Physiol (1985). 90 (5), 1648-1656 (2001).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved