Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Создание минимально инвазивной модели тромбоэмболии легочной артерии на крысах с использованием аутологичных тромбов
В этой статье
Резюме
Описана подробная методология создания малоинвазивной модели тромбоэмболии легочной артерии крыс с использованием аутологичных тромбов. Также предусмотрены дополнительные методы количественной оценки площади инфаркта и визуализации легочного артериального дерева.
Аннотация
Тромбоэмболия легочной артерии (ТЭЛА) является одной из ведущих причин сердечно-сосудистой смертности, что приводит к значительному социально-экономическому бремени. Несмотря на то, что современные методы лечения в первую очередь сосредоточены на антикоагулянтах и тромболизисе, существует острая необходимость в лучшем понимании его патофизиологии и разработке новых стратегий лечения. Животные модели играют решающую роль в понимании ТЭЛА и разработке новых методов лечения этого заболевания, при этом грызуны обычно используются по этическим и финансовым соображениям. Тем не менее, существующие модели для ТЭЛА грызунов ограничены отсутствием стандартизированных процедур, что затрудняет воспроизводимость и перекрестные сравнения исследований. Это исследование направлено на создание минимально инвазивной модели ТЭЛА у крыс с использованием аутологичных тромбов. Модель включает в себя минимально инвазивную технику забора крови, стандартизированную процедуру генерации тромба и минимально инвазивный доступ к венам. Кроме того, предоставляются протоколы количественной оценки участков инфаркта и визуализации легочного артериального дерева. Эти процедуры направлены на повышение надежности моделей грызунов для изучения прогрессирования ТЭЛА и содействие разработке новых методов лечения.
Введение
Тромбоэмболия легочной артерии (ТЭЛА) является основной причиной внутрибольничной смерти и третьей по частоте причиной смерти от сердечно-сосудистых заболеваний. Несмотря на высокую заболеваемость, профилактика и своевременная диагностика остаются сложными 1,2. Антикоагулянтная и тромболитическая терапия имеют решающее значение в лечении ТЭЛА, однако более глубокое понимание прогрессирования заболевания и новые терапевтические подходы имеют важное значение для улучшения ведения болезни3.
В современных биомедицинских исследованиях животные модели играют ключевую роль в выяснении механизмов развития заболеваний человека и разработке новых методов лечения 4,5. Мыши, крысы, хомяки и кролики часто используются в моделировании ПЭ по этическим соображениям и экономической эффективности 6,7,8,9,10. Подходы к моделированию ТЭЛА обычно делятся на три категории: образование тромбов in vivo, инъекция тромба in vitro и введение нетромботических частиц. Выбор вида животных и метода моделирования определяется конкретными целями исследования, так как ни одна модель не подходит для всех целей. Например, в исследованиях, направленных на изучение новых тромболитических методов лечения, часто используются модели, включающие аутологичные сгустки крови вместо нетромботических частиц.
Современные методы моделирования ТЭЛА у грызунов сталкиваются с проблемами из-за отсутствия подробных, стандартизированных методологий. Это влияет на ключевые процессы, такие как забор крови, образование тромбов и последующая эмболизация, которые имеют решающее значение для обеспечения воспроизводимых результатов в исследованиях. Кроме того, существует значительный пробел в возможности количественной оценки эмболизированной области и точного картирования распределения эмболов после эмболизации. Устранение этих недостатков имеет важное значение для повышения надежности и полезности моделей грызунов в исследованиях ПЭ.
В данном исследовании описаны подробные протоколы создания модели ТЭЛА у крыс с использованием аутологичных тромбов. Эта модель отличается минимально инвазивной техникой забора крови, стандартизированной процедурой генерации тромба и минимально инвазивным доступом к венам. Кроме того, предоставляются протоколы для количественной оценки инфарктных участков в легких и визуализации легочного артериального дерева, что может способствовать дальнейшим научным открытиям.
Access restricted. Please log in or start a trial to view this content.
протокол
Все эксперименты на животных проводились с одобрения Комитета по уходу за животными и их использованию Китайской академии медицинских наук и Пекинского объединенного медицинского колледжа (номер утверждения: IRM/2-1ACUC-2311-015). В этом исследовании использовались самцы крыс Sprague-Dawley в возрасте 6 недель и весом около 250 г. Животные были размещены в определенной среде, свободной от патогенов, с ограниченным доступом к сбалансированной диете и воде. Их выдерживали в течение 12-часового цикла свет/темнота при комнатной температуре 22 °C ± 2 °C. Животным было позволено адаптироваться к окружающей среде в течение 1 недели перед проведением каких-либо хирургических процедур. Подробная информация о реагентах и оборудовании, использованных в этом исследовании, приведена в Таблице материалов.
1. Оборудование и материалы
- Оборудование для анестезии: Используйте аппарат для газовой анестезии для мелких животных и изофлуран.
- Хирургические материалы: Подготовьте ватные палочки, дезинфицирующее средство йодофором, стереомикроскоп, бритву, медицинскую ленту, шприц 1 мл с иглой 27 G, шприц 5 мл, шприц 10 мл, обычный физиологический раствор, марлю, 8-0 Нейлоновые нити, нейлоновые нити 6-0 со шовной иглой, микрокровоостанавливающие зажимы, микропинцет и тонкие ножницы.
- Другие материалы: Приобретите дозирующие иглы 19 G и 18 G, совместимые с медицинскими шприцами, силиконовую трубку с внутренним диаметром 1,2 мм и длиной 10 см, инфузионную трубку с внутренним диаметром 3,0 мм и длиной 20 см, центрифужную пробирку объемом 1,5 мл, пипетку и наконечники для пипеток.
- Самодельный генератор тромба и инъектор для сгустков крови (Рисунок 1): Подсоедините силиконовую трубку к дозирующей игле 19 G, прикрепленной к шприцу объемом 1 мл, чтобы создать генератор тромба. Подсоедините один конец инфузионной трубки к дозирующей игле 18 G, а другой конец прикрепите к шприцу объемом 5 мл, чтобы создать инъектор сгустка.
2. Подготовка аутологичного тромба
- Анестезия
- Поместите животное в индукционную камеру для анестезии и вводите смесь 4% изофлурана с комнатным воздухом со скоростью потока 2 л/мин в течение 2-3 минут (в соответствии с утвержденными в учреждении протоколами).
- Расположите животное на рабочей платформе в положении лежа на спине. Поддерживайте анестезию, вводя 2,5% изофлуран со скоростью потока 0,4 л/мин. Проверьте рефлекс педали, чтобы убедиться в достижении адекватной анестезии.
- Вытяните обе передние конечности горизонтально от туловища, а задние конечности вытяните, чтобы адекватно обнажить паховую область. Закрепите животное в таком положении с помощью медицинской ленты (рисунок 2А).
- Забор крови через черепную полую вену (СВК)
- Удалите волосы вокруг манубриума с помощью бритвы и крема для эпиляции. Продезинфицируйте кожу йодофором.
- Вставьте иглу 27 G, прикрепленную к шприцу объемом 1 мл, вертикально на глубину 8 мм, чтобы проколоть левый или правый ЦВК, как показано на рисунке 2A.
ПРИМЕЧАНИЕ: Проекция поверхности тела CVC расположена на 5 мм в сторону манубриума. Можно использовать обе стороны, и выбор не влияет на следующие шаги. - Удерживайте шприц и осторожно оттяните поршень назад, чтобы создать отрицательное давление внутри цилиндра. Постепенно извлекайте иглу, пока кровь не потечет внутрь, затем сохраняйте это положение до тех пор, пока не будет собрано 0,3 мл крови (Рисунок 2B).
- Подготовка сгустков крови
- Надавите собранную кровь в центрифужную пробирку объемом 1,5 мл, стараясь не образовывать пузырьки.
- Набирайте кровь в силиконовую трубку самодельного тромбогенератора до тех пор, пока столб крови не станет 10 см в длину.
ПРИМЕЧАНИЕ: Выполните эти два шага быстро, так как коагуляция начнется и распространится в центрифужной пробирке, снижая качество собранных тромбов. - Подождите 30 минут, пока кровь полностью не тромбируется. За это время аналогичным образом подготовьте кровяные столбы для других животных.
- Промойте тромбированный столб крови в чашке Петри, содержащем нормальный физиологический раствор, и промойте тромбический столб физиологическим раствором три раза (рисунок 2C).
- С помощью тонких ножниц разрежьте столб тромба на однородные сгустки крови, каждый длиной 4 мм (Рисунок 2D). Наберите 10-20 сгустков в самодельный инжектор, предварительно заполненный 2 мл обычного физиологического раствора.
ПРИМЕЧАНИЕ: Длина сгустков крови не должна превышать 1 см, иначе они застрянут в правом желудочке.
3. Подготовка венозного доступа
- Обнажение поверхностных эпигастральных сосудов
- Обезболите и зафиксируйте животное, как описано в шаге 2.1.
- Сбрейте волосы вокруг левой паховой области. Нанесите крем для удаления волос на эти участки, подождите 1 минуту, а затем сотрите крем марлей. Продезинфицируйте кожу йодофором.
- Сделайте разрез кожи на 5 мм над началом поверхностных эпигастральных сосудов в области паха. Обычно происхождение поверхностных эпигастральных сосудов можно проследить, наблюдая крошечную пульсацию в области паха.
- С помощью стереомикроскопа с 10-кратным увеличением отделите тонкий слой подкожного жира, чтобы обнажить поверхностные эпигастральные сосуды (рис. 3A).
- Изоляция поверхностной эпигастральной вены
- Тщательно изолируйте поверхностную эпигастральную вену от артерии, нерва и жировой ткани. Выполняйте это как проксимально, до места, где она впадает в бедренную вену, так и дистально, вплоть до первой бифуркации вены.
- Лигируйте дистальную сторону со счетом 8-0 Проденьте и зажмите резьбу микрозажимом. Контролируйте проксимальную сторону с помощью 8-0 петля с резьбой, прикрепленная к другому микрозажиму (Рисунок 3B).
- Сделайте крошечный поперечный разрез на дистальной стороне изолированной вены. Контролируйте проксимальную сторону, чтобы избежать кровотечения. Промойте оставшуюся кровь в просвете вены обычным физиологическим раствором. Как только вена станет чистой, используйте микропинцет для увеличения венозного разреза.
4. Эмболизация
- Канюляция вен
- Аккуратно введите иглу самодельного инъектора в вену через разрез вены. Закрепите иглу третьим зажимом, чтобы предотвратить ее выскальзывание из вены.
- Процедура эмболизации
- Медленно нажмите на поршень, чтобы ввести небольшое количество обычного физиологического раствора. Полнота вены без сопротивления указывает на беспрепятственный доступ к вене (рисунок 3D).
- Продолжайте нажимать на поршень, чтобы ввести тромбы в бедренную вену через доступ к поверхностной эпигастральной вене. Контролируйте скорость эмболизации на уровне 5 эмболов в минуту. Следить за дыханием животного; Возникающая и обостряющаяся одышка свидетельствует об успешной эмболизации.
- После введения заданного количества тромбов извлеките иглу и перевязайте проксимальную сторону поверхностной эпигастральной вены.
- Зашите разрез и поместите животное в теплую коробку. Перенесите животное в клетку, как только оно проснется.
5. Количественная оценка площади инфаркта
- Эвтаназия и перфузия сердца
- Добавьте 25 000 ЕД гепарина натрия к 250 мл обычного физиологического раствора и тщательно перемешайте. Подключите флакон к инфузионному устройству и подвесьте флакон вверх ногами на высоте 80 см. Закройте клапан инфузионного аппарата.
- Усыпляйте животных с помощью передозировки изофлурана (в соответствии с утвержденными в учреждении протоколами).
- Срежьте ребра большими ножницами и вскройте грудную клетку, не допуская повреждения легких и крупных сосудов.
- Введите иглу инфузионного аппарата в левый желудочек. Откройте клапан инфузионного устройства, чтобы обеспечить инфузию гепаринизированного физиологического раствора. С помощью ножниц разрежьте нижнюю полую вену и левый придаток, чтобы обеспечить дренаж. Регулируйте скорость перфузии на уровне 50 мл/мин.
ПРИМЕЧАНИЕ: Во время этой процедуры нормальная легочная ткань станет белой, в то время как эмболизированная зона останется ржавой. - После завершения перфузии гепаринизированным физиологическим раствором необходимо проколотить ствол легочной артерии через правый желудочек с помощью шприца объемом 10 мл, заполненного 4% раствором параформальдегида. Зафиксировать легочную ткань путем проведения 4% перфузии параформальдегида через легкие общим объемом 30 мл.
- Введение индекса под названием Infarction Ratio
- После фиксации иссекают легкие, сердце, трахею, пищевод, тимус и крупные сосуды в целом от позвоночника и диафрагмы11.
- Аккуратно удалите пищевод, тимус и жировую ткань из исходной массы, оставив только сердце, легкие и крупные сосуды.
- Оставшуюся часть погрузить в достаточный объем 4% раствора параформальдегида не менее чем на 48 ч.
- Используйте аналитические весы, чтобы взвесить все легкие. С помощью тонких ножниц отделите инфарктную часть легких и взвесьте инфарктную ткань с такими же весами. Рассчитайте коэффициент инфаркта с помощью следующего уравнения:
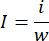
i — вес инфарктной ткани, w — вес всего легкого, I — коэффициент инфаркта. - После количественного определения области инфаркта обрежьте фиксируемую параформальдегидом легочную ткань для заделки парафина11.
6. Визуализация легочной артерии
- Гипс легочной артерии
- Усыпьте животное и выполните перфузию сердца, как описано в шаге 5.1.
- Добавьте равное количество (по весу) разбавителя в силиконовый литейный состав, смешайте смесь, а затем добавьте 5% (по весу или объему) отвердителя. Снова взбейте смесь.
- Наберите 1 мл смеси в шприц объемом 1 мл, выпустите воздух и введите иглу в ствол легочной артерии через правый желудочек. Закрепите иглу в легочной артерии, чтобы предотвратить соскальзывание и обратный поток.
- Осторожно нажмите на поршень, чтобы силиконовая смесь заполнила легочную артерию. Нормальные участки легких будут окрашены литейной смесью, в то время как инфарктные участки останутся ржаво-красными.
ПРИМЕЧАНИЕ: Гипс легочной артерии следует накладывать только на неповрежденную легочную ткань. Как правило, 0,6-0,8 мл литейной смеси достаточно для наполнения легочной артерии. Чрезмерное введение гипсовой смеси может привести к гипсированию легочной вены, что влияет на визуализацию легочной артерии. Литейную смесь следует использовать в течение 20 минут после добавления отвердителя, так как по истечении этого времени она кристаллизуется. - Извлеките шприц после наложения перфузии, перевяжите ствол легочной артерии и извлеките легкие, сердце и крупные сосуды, как описано в шаге 5.2. Поместите всю массу в чашку Петри и храните ее в холодильнике при температуре 4 °C в течение ночи, чтобы смесь для отливки кристаллизовалась.
- Очистка и визуализация
- Удалите сердце и крупные сосуды из легких ножницами, затем очистите поверхность легких от остатков лечебной смеси.
- Погружайте легкие последовательно в растворы этилового спирта 25%, 50%, 75%, 95% и 100% на 24 ч. Эта процедура позволит полностью обезвоживать легкие.
- Погрузите обезвоженные легкие в метилсалицилат на 24 ч. После этого процесса очищения будет видно легочное артериальное дерево, а также эмболы, так как метилсалицилат не очищает гемоглобин (рис. 4B, D).
Access restricted. Please log in or start a trial to view this content.
Результаты
Симптомы и патология модели ТЭЛА
Во время эмболизации крысы испытывали одышку, а в грудной клетке наблюдались расширенные колебания. Почти все животные выжили после эпизода тромбоэмболии легочной артерии, когда было введено менее 10 см тромбов (14 из 15 модел?...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
В этом исследовании была успешно создана минимально инвазивная модель ТЭЛА на крысах с использованием аутологичных тромбов. После освоения эта процедура моделирования может быть завершена в течение 30 минут. Модель эффективно фиксирует ключевые особенности клиниче?...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Авторы заявляют об отсутствии конфликта интересов.
Благодарности
Это исследование поддержано грантом Медицинского фонда Ву Цзепина (320.6750.19089-36).
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| Analytical balance | METTLER TOLEDO | MA55/A | None |
| Dispensing needle | Jinrong electronics | None | 19 G and 18 G |
| Fine scissors | Stronger | XGJ1300 | None |
| Heparin sodium salt | Solarbio | 01-08-9041 | 140U/mg |
| Isoflurane | RWD | R510-22-10 | None |
| Methyl salicylate | Macklin | M813577 | AR, 99% |
| Micro clamp | JZ | W40160 | None |
| Micro tweezers | Stronger | XGN1310 | None |
| Silicone casting compound | Flow Tech | MV-130 | None |
| Sprague-Dawley rats | Vital River | SD-IGS | None |
| Stereo microscope | Murzider | MSD204 | None |
Ссылки
- Götzinger, F., et al. Interventional therapies for pulmonary embolism. Nat Rev Cardiol. 20 (10), 670-684 (2023).
- Falster, C., et al. Comparison of international guideline recommendations for the diagnosis of pulmonary embolism. Lancet Haematol. 10 (11), e922-e935 (2023).
- Konstantinides, S. V., et al. ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 41 (4), 543-603 (2020).
- Domínguez-Oliva, A., et al. The importance of animal models in biomedical research: Current insights and applications. Animals (Basel). 13 (7), 1223(2023).
- Mukherjee, P., Roy, S., Ghosh, D., Nandi, S. K. Role of animal models in biomedical research: A review. Lab Anim Res. 38 (1), 18(2022).
- Tang, Z., et al. Gene expression profiling of pulmonary artery in a rabbit model of pulmonary thromboembolism. PLoS One. 11 (10), e0164530(2016).
- Deng, C., et al. Expression of tissue factor and forkhead box transcription factor o-1 in a rat model for chronic thromboembolic pulmonary hypertension. J Thromb Thrombolysis. 42 (4), 520-528 (2016).
- Runyon, M. S., Gellar, M. A., Sanapareddy, N., Kline, J. A., Watts, J. A. Development and comparison of a minimally-invasive model of autologous clot pulmonary embolism in Sprague-Dawley and Copenhagen rats. Thromb J. 8, 3(2010).
- Li, S. Q., et al. Comparative proteomic study of acute pulmonary embolism in a rat model. Proteomics. 7 (13), 2287-2299 (2007).
- Deng, C., et al. Role of FOXO1 and apoptosis in pulmonary vascular remolding in a rat model of chronic thromboembolic pulmonary hypertension. Sci Rep. 7 (1), 2270(2017).
- Morton, J., Snider, T. A. Guidelines for collection and processing of lungs from aged mice for histological studies. Pathobiol Aging Age Relat Dis. 7 (1), 1313676(2017).
- Karpov, A. A., Vaulina, D. D., Smirnov, S. S., Moiseeva, O. M., Galagudza, M. M. Rodent models of pulmonary embolism and chronic thromboembolic pulmonary hypertension. Heliyon. 8 (3), e09014(2022).
- Picazo, M. G., Benito, P. J., García-Olmo, D. C. Efficiency and safety of a technique for drawing blood from the hamster cranial vena cava. Lab Anim (NY). 38 (6), 211-216 (2009).
- Szabó, K. The cranial venous system in the rat: Anatomical pattern and ontogenetic development. Ii. Dorsal drainage. Ann Anat. 177 (4), 313-322 (1995).
- Li, C. Y., et al. The effects and mechanism of ginsenoside rg1 on myocardial remodeling in an animal model of chronic thromboembolic pulmonary hypertension. Eur J Med Res. 18 (1), 16(2013).
- Sullivan, D. M., Watts, J. A., Kline, J. A. Biventricular cardiac dysfunction after acute massive pulmonary embolism in the rat. J Appl Physiol (1985). 90 (5), 1648-1656 (2001).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены