Method Article
El implante DREAM: un sistema de implantes ligero, modular y rentable para la electrofisiología crónica en ratones de cabeza fija y de comportamiento libre
* Estos autores han contribuido por igual
En este artículo
Resumen
Aquí, presentamos un sistema de implante de sonda liviano y rentable para electrofisiología crónica en roedores optimizado para la facilidad de uso, la recuperación de la sonda, la versatilidad experimental y la compatibilidad con el comportamiento.
Resumen
Los registros electrofisiológicos crónicos en roedores han mejorado significativamente nuestra comprensión de la dinámica neuronal y su relevancia conductual. Sin embargo, los métodos actuales para implantar sondas de forma crónica presentan grandes compensaciones entre el costo, la facilidad de uso, el tamaño, la adaptabilidad y la estabilidad a largo plazo.
Este protocolo introduce un novedoso sistema de implante de sonda crónica para ratones llamado DREAM (Dinámico, Recuperable, Económico, Adaptable y Modular), diseñado para superar las compensaciones asociadas con las opciones disponibles actualmente. El sistema proporciona una solución ligera, modular y rentable con elementos de hardware estandarizados que pueden combinarse e implantarse en pasos sencillos y explantarse de forma segura para la recuperación y la reutilización múltiple de sondas, lo que reduce significativamente los costes experimentales.
El sistema de implantes DREAM integra tres módulos de hardware: (1) un microdrive que puede transportar todas las sondas de silicona estándar, lo que permite a los experimentadores ajustar la profundidad de grabación a lo largo de una distancia de recorrido de hasta 7 mm; (2) un diseño tridimensional (3D) imprimible en código abierto para una jaula de Faraday portátil cubierta con malla de cobre para blindaje eléctrico, protección contra impactos y colocación de conectores, y (3) un sistema de fijación de la cabeza miniaturizado para mejorar el bienestar animal y la facilidad de uso. El protocolo quirúrgico correspondiente se optimizó para la velocidad (duración total: 2 h), la seguridad de la sonda y el bienestar animal.
Los implantes tuvieron un impacto mínimo en el repertorio conductual de los animales, fueron fácilmente aplicables en contextos de movimiento libre y con la cabeza fija, y proporcionaron formas de onda de pico claramente identificables y respuestas neuronales saludables durante semanas de recopilación de datos posteriores al implante. Las infecciones y otras complicaciones quirúrgicas fueron extremadamente raras.
Como tal, el sistema de implantes DREAM es una solución versátil y rentable para la electrofisiología crónica en ratones, que mejora el bienestar animal y permite experimentos más sólidos desde el punto de vista etológico. Su diseño simplifica los procedimientos experimentales en diversas necesidades de investigación, aumentando la accesibilidad de la electrofisiología crónica en roedores a una amplia gama de laboratorios de investigación.
Introducción
La electrofisiología con sondas de silicio implantadas crónicamente se ha convertido en una poderosa técnica para investigar la actividad neuronal y la conectividad en animales que se comportan, particularmente en ratones, debido a su manejabilidad genética y experimental1. Las sondas laminares de silicio, en particular, han demostrado ser una herramienta invaluable para identificar relaciones funcionales dentro de las columnas corticales2 y para relacionar la dinámica de grandes poblaciones neuronales con el comportamiento de una manera que antes era imposible3.
Dos enfoques complementarios son los estándares de oro actuales para registrar la actividad neuronal in vivo: la microscopía de dos fotones 4,5 y la electrofisiología extracelular6. La elección de la metodología de registro restringe la naturaleza de las lecturas que se pueden obtener: la microscopía de dos fotones es particularmente adecuada para estudios longitudinales de neuronas identificables individualmente en grandes poblaciones a lo largo del tiempo, pero sufre altos costos de equipo y se limita a capas superficiales de la corteza en cerebros intactos. Además, la resolución temporal típica de ~30 Hz limita su capacidad para capturar la dinámica neuronal en curso 7,8.
Por el contrario, los registros electrofisiológicos ofrecen una alta resolución temporal (hasta 40 kHz) para rastrear la actividad neuronal momento a momento, se pueden aplicar ampliamente a todas las especies, así como a través de profundidades corticales, y tienen configuraciones de costo relativamente bajo en comparación con la microscopía de dos fotones. Sin embargo, la identificación de neuronas individuales, así como el seguimiento longitudinal de las poblaciones neuronales, son difíciles de lograr. Esto se aplica especialmente a los electrodos de hilo, por ejemplo, tetrodos, y a las inserciones agudas de electrodos. Además de carecer de la capacidad de rastrear las neuronas a lo largo de las sesiones de grabación9, las inserciones agudas repetidas causan un trauma local10 que monta una respuesta inmune11, aumentando la posibilidad de infección y gliosis. En última instancia, esto reduce la estabilidad de la actividad neuronal registrada y la esperanza de vida de los animales de experimentación, limitando el alcance de los estudios longitudinales con registros electrofisiológicos agudos a solo unos pocos días12.
Las grabaciones crónicas de sondas de silicio de alta densidad tienen como objetivo combinar algunos de los mejores atributos de la electrofisiología aguda y las imágenes de dos fotones. Pueden rastrear la dinámica de la población neuronal a lo largo de las sesiones, con solo una capacidad algo menor para identificar neuronas individuales en comparación conlas imágenes de dos fotones. Estas grabaciones proporcionan una gran flexibilidad en la ubicación espacial y una resolución temporal precisa de las señales registradas, así como una mayor longevidad y bienestar de los animales de experimentación en comparación con las grabaciones agudas14. Además, a diferencia de los registros agudos, la electrofisiología crónica requiere un solo evento de implantación, lo que reduce eficazmente el riesgo de infección y daño tisular y minimiza el estrés en los animales15. En conjunto, estas ventajas hacen que la electrofisiología crónica sea una herramienta poderosa para investigar la organización y función del sistema nervioso.
Sin embargo, las técnicas de implantación crónica comúnmente utilizadas para ratones obligan a los investigadores a hacer concesiones significativas entre la compatibilidad con los registros de comportamiento, el peso del implante, la replicabilidad de los implantes, los costos financieros y la facilidad general de uso. Muchos protocolos de implantes no están diseñados para facilitar la reutilización de las sondas16, lo que aumenta considerablemente el costo efectivo de los experimentos individuales y, por lo tanto, dificulta financieramente que algunos laboratorios utilicen la electrofisiología crónica. También suelen requerir un extenso trabajo interno de creación de prototipos y diseño, para el que es posible que no se disponga de la experiencia y los recursos.
Por otro lado, los sistemas de implantes integrados17 ofrecen una solución más accesible para la electrofisiología crónica en roedores. Estos sistemas están diseñados para integrar un microdrive que sostiene la sonda con el resto del implante para simplificar el manejo del implante y los procedimientos quirúrgicos. Sin embargo, una vez implantados, estos sistemas pueden ser pesados en la parte superior y limitar la capacidad del experimentador para adaptar de forma flexible un experimento a diferentes coordenadas objetivo. A menudo, su peso impide los implantes en animales más pequeños, potencialmente perjudica el movimiento de los animales e induce estrés18. Esto puede afectar de manera desproporcionada la investigación en cohortes juveniles y femeninas, ya que es más probable que las limitaciones de peso afecten a estos grupos.
Además, no todos los sistemas integrados permiten el ajuste de las posiciones de los electrodos después de la implantación. Esto es relevante, ya que la gliosis o cicatrización debida a la inserción de la sonda19, especialmente en las primeras 48 h después de la implantación20, puede reducir la calidad de la actividad neuronal registrada. Los microajustes en la profundidad de inserción de la sonda pueden limitar estos efectos negativos en la integridad de la señal. Por lo tanto, los mecanismos de microposicionamiento, comúnmente llamados microdrives, pueden ser beneficiosos incluso en sondas con un gran número de electrodos distribuidos a lo largo de su longitud.
Para superar estas compensaciones, presentamos un novedoso sistema de implantes de electrofisiología crónica para ratones que aborda las limitaciones de los diseños anteriores al ofrecer una solución ligera, rentable y modular. El sistema de implante DREAM está diseñado para pesar menos del 10% (~2,1 g) del peso corporal típico de un ratón, lo que garantiza el bienestar animal y un impacto mínimo en el comportamiento. La validación del diseño del implante DREAM muestra un impacto mínimo en las métricas clave del comportamiento, como la locomoción, que puede verse significativamente afectada en los roedores cuando se colocan cargas en el cráneo. Esto puede beneficiar a los paradigmas experimentales que utilizan animales que se mueven libremente, así como animales con la cabeza fija, al aumentar el bienestar animal y permitir experimentos más sólidos desde el punto de vista etológico.
El sistema incluye un microaccionamiento para un ajuste flexible de la profundidad de registro de hasta 7 mm y se puede adaptar a diferentes tipos de sondas y dispositivos de registro, proporcionando a los investigadores una herramienta rentable y versátil para diversas aplicaciones experimentales. El sistema se combina de forma rutinaria con un microdrivemetálico 21, que ofrece una recuperación constante de la sonda en comparación con otros sistemas (tasa de recuperación media esperada: aprox. tres reutilizaciones fiables por sonda) y reduce drásticamente el coste de los experimentos individuales.
El diseño cuenta con una jaula protectora de Faraday impresa en 3D, lo que permite una protección barata pero robusta contra el ruido electrofisiológico, los impactos mecánicos y los materiales infecciosos, lo que permite grabaciones estables y sin ruido que sufren tasas de infección mínimas. Esta jaula implantable consta de la llamada "corona", diseñada para la protección contra impactos y para proporcionar estructura para el recubrimiento de malla metálica conductora de la jaula de Faraday, y el anillo de corona, que sirve como soporte para un amplificador implantable y/o un conector de sonda (ver Figura 1).
Por último, las placas de cabeza incluidas en el sistema de implante modular están diseñadas para ser compatibles con un sistema de fijación de cabeza novedoso y eficiente sin añadir volumen adicional al implante. A diferencia de otros sistemas existentes, no requiere apretar pequeños tornillos cerca del implante, lo que acelera la fijación de los ratones en la configuración experimental y mejora la relación experimentador-animal, así como la adherencia al comportamiento. Al mismo tiempo, la placa de cabeza se utiliza como base sobre la que construir los otros módulos del sistema de electrofisiología crónica DREAM.
Los archivos de diseño para el implante DREAM se publican como hardware de código abierto en https://github.com/zero-noise-lab/dream-implant/. En las siguientes secciones, se describirá el diseño y la fabricación del sistema de implantes DREAM, se demostrará su implementación exitosa en un modelo de ratón y se discutirán sus posibles aplicaciones y ventajas en comparación con los sistemas existentes.
Protocolo
Todos los procedimientos experimentales se llevaron a cabo de acuerdo con las directrices institucionales de la Sociedad Max Planck y fueron aprobados por el comité de ética del gobierno local (Beratende Ethikkommission nach §15 Tierschutzgesetz, Regierungspräsidium Hessen, Código de aprobación del proyecto: F149-2000).
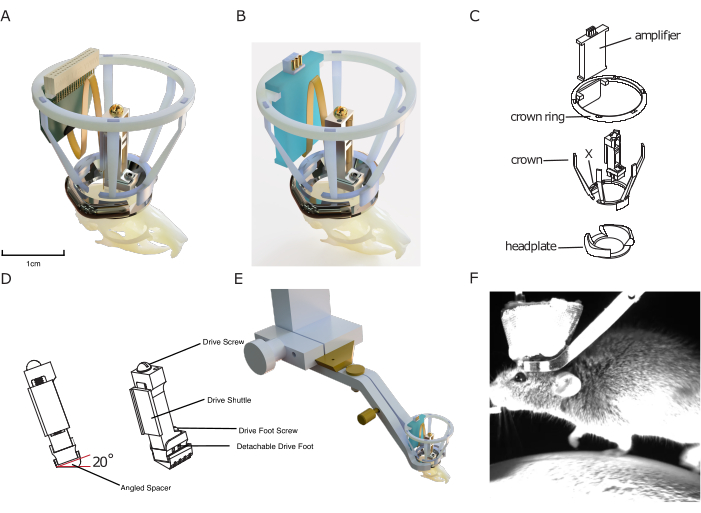
Figura 1: Diseño del implante. (A) Representación en 3D del implante superpuesto en el cráneo de un ratón con una sonda de silicona conectada a un conector de sonda. La apertura central de la placa frontal es de aproximadamente 10 mm para la escala. La altura de la unidad es de aproximadamente 17 mm. La malla de cobre que forma el exterior de la corona de Faraday, así como los cables de tierra/referencia, no se muestran. (B) Igual que (A) con una conexión a una placa amplificadora en lugar de un conector de sonda. (C) Dibujo técnico despiece del implante, mostrando sus componentes. (D) Renderizado de un espaciador en ángulo que se puede implantar debajo de un microdrive, lo que permite implantar consistentemente el microdrive en un ángulo predefinido (aquí: 20°). (E) Representación del mecanismo de fijación de la cabeza integrado, que muestra la placa de la cabeza implantada con la corona de Faraday con la abrazadera de fijación de la cabeza circundante y la conexión de la cola de milano a la configuración. (F) Imagen de la cabeza del ratón fijada en una cinta de correr utilizando el mecanismo de fijación de la cabeza integrado en el implante. Haga clic aquí para ver una versión más grande de esta figura.
NOTA: En las secciones 1 y 2 se analizan los preparativos prequirúrgicos
1. Preparación de la sonda de silicio
- En caso de reutilización de la sonda, limpie la sonda de silicona de acuerdo con las recomendaciones del proveedor de la sonda. Remoje la sonda en un limpiador enzimático (consulte la tabla de materiales) durante 5-10 minutos, luego enjuáguela con agua desmineralizada. Haga esto lo más rápido posible después de la explantación. Un día antes de la (re)implantación, remoje la sonda en etanol al 70% durante al menos 30 minutos para la desinfección.
- Mida las impedancias de los canales para asegurarse de que están dentro de las especificaciones de la señal grabada. Siga el protocolo para probar los niveles de ruido del manual del usuario de Neuropixels22, mida la impedancia a través del software de grabación deseado (por ejemplo, https://open-ephys.github.io/gui-docs/User-Manual/Plugins/Acquisition-Board.html#impedance-testing) y siga las impedancias del canal objetivo del fabricante de la sonda de silicona o de la hoja de datos. Si las impedancias son demasiado altas, considere recubrir los sitios de los electrodos23.
- Suelde un zócalo de cola de soldadura de 0.05" (consulte la Tabla de materiales) al cable de tierra (GND) de la sonda. Conecte el enchufe a la clavija GND (siguiente paso) durante la cirugía.
NOTA: En este protocolo, no se utiliza un pin de referencia (REF) separado, ya que GND y REF están cortocircuitados en la etapa principal utilizada. Por lo tanto, solo se mencionará el pin GND en el resto del protocolo. Si se utiliza una REF independiente, repita el siguiente paso para el pin REF. - Para preparar el pin GND, inserte repetidamente el lado del pin de un zócalo de cola de soldadura de 0.05" (consulte la Tabla de materiales) en el zócalo de cola de soldadura GND de 0.05" hasta que la inserción sea prácticamente sin esfuerzo. El uso de alfileres chapados en oro puede reducir la necesidad de este paso de alisado. Esto asegura que el pin y el zócalo GND se puedan conectar fácilmente durante la cirugía sin necesidad de aplicar una presión excesiva, lo que reduce el riesgo de lesiones para el animal y daños en la sonda.
- Si se utiliza un preamplificador implantable para la sonda de silicona, prepárelos para la implantación crónica siguiendo los procedimientos del proveedor. A continuación, fije el amplificador/conector al anillo de la jaula de Faraday utilizando yeso de silicona para pegarlo en la zona del anillo de Faraday diseñada para sujetar el amplificador (véase la Figura 1).
NOTA: La preparación del preamplificador implantable para la sonda de silicio para la implantación crónica siguiendo los procedimientos del proveedor puede incluir recubrirlos con silicona o epoxi para evitar que la humedad dañe la electrónica, así como acoplar repetidamente el conector del amplificador para reducir la fuerza de acoplamiento al conectar el amplificador al sistema de grabación durante las grabaciones. Esto es especialmente útil para los usuarios de Omnetics.
2. Preparación del microdrive y del arnés
- Gire el tornillo del cuerpo del microaccionamiento de modo que la lanzadera del microaccionamiento quede casi completamente retraída hacia arriba.
- Opcionalmente, fije un espaciador en ángulo (consulte la figura 1D) a la parte inferior del microaccionamiento con pegamento de cianoacrilato o cemento dental, que se puede usar para permitir que se use un grado específico de inclinación, por ejemplo, cuando se registra a través de capas corticales en una región dentro del surco central, o dentro de estructuras profundas que pueden requerir un enfoque no perpendicular (para espaciador en ángulo, ver Tabla de Materiales).
- Coloque el microdrive horizontalmente sobre el soporte del microdrive (Figura complementaria 1).
- Coloque un pequeño trozo de masilla adhesiva (consulte la tabla de materiales) en el soporte del microaccionamiento a una distancia por encima del microaccionamiento en el que se colocará el conector de la etapa principal. Esta distancia depende de la longitud del cable flexible que conecta la sonda de silicona al conector de la cabecera.
- Coloque una pequeña gota de yeso de silicona (consulte la tabla de materiales) en la lanzadera.
- Saque la sonda de silicona de su embalaje con la ayuda de unas pinzas romas de punta blanda. Hágalos recubriendo pinzas de punta de aguja estándar con un tubo termorretráctil de 3 mm de diámetro (consulte la tabla de materiales). Coloque la sonda con el cable flexible primero en la lanzadera del microaccionamiento de modo que el borde inferior del cable flexible cuelgue ligeramente sobre el borde inferior de la lanzadera del microaccionamiento.
- Tire suavemente del cable flexible hacia la parte superior del microdrive hasta que el borde inferior del cable flexible se encuentre con el borde inferior de la lanzadera del microdrive. Asegúrese de empujar el cable flexible contra el borde izquierdo de la lanzadera de microdrive durante este paso para que quede exactamente vertical en el microdrive en el extremo. En este punto, asegúrese de que los vástagos de la sonda de silicona no sobresalgan (o solo mínimamente) más allá del borde inferior del micromotor (dependiendo de la longitud exacta de los vástagos de la sonda y la profundidad del área cerebral objetivo).
- Coloque el conector de la etapa principal de la sonda en la masilla adhesiva en la parte superior del soporte para proteger la sonda y evitar que se caiga.
- Utilice una aguja de jeringa de 27 G para aplicar una pequeña gota de pegamento de cianoacrilato (consulte la tabla de materiales) entre el cable flexible y la lanzadera para asegurar la sonda en su lugar. Asegúrese de que el pegamento no se escurra en el microdrive o a lo largo del cable flexible más allá de la lanzadera (esto es muy importante)
- Una vez que el cable flexible esté pegado en su posición, fije el amplificador al anillo de la corona (consulte la tabla de materiales) con yeso de silicona. A continuación, conecte el cable flexible al amplificador y cubra la conexión y el cable con una fina capa de yeso de silicona.
- Después de 5 minutos, cuando el yeso esté listo, guarde el microdrive y la sonda de forma segura hasta su uso posterior.
- Corte pedazos de malla de cobre (ver Tabla de Materiales) en forma de rosquilla abierta (vea el patrón de corte en la Figura Suplementaria 2) para cubrir la jaula de Faraday.
- Fije el recorte de malla de cobre a la jaula de Faraday con pequeñas gotas de resina epoxi (consulte la tabla de materiales). Para este paso, también se puede reemplazar el epoxi con cemento dental.
NOTA: La jaula de Faraday contiene un espacio para albergar un conector de sonda o amplificador. Este espacio está marcado con una X en el archivo de diseño, y contiene una base de soporte para el amplificador/conector, así como una mayor distancia entre los dos radios adyacentes de la jaula. Para crear suficiente espacio alrededor del amplificador/conector, fije una pequeña cantidad de malla adicional entre los dos radios adyacentes, creando una protuberancia. Esto garantiza que el amplificador/conector pueda colocarse posteriormente en este "bolsillo" sin tocar la jaula de Faraday. Para garantizar una adherencia segura con una deformación mínima, utilice el anillo de corona colocado directamente sobre la corona para mantener la forma y apoyar los radios finos de la corona. Además, utilice manos amigas para soldar para asegurar la corona y la malla durante el secado. Si uno tiene dificultades para mantener la forma de la corona cuando se somete al procedimiento, intente aplicar epoxi solo dos de los brazos de la corona a la vez para evitar que se deformen. - Si se desea una conexión a tierra separada de la jaula de Faraday, suelde un pequeño pin de cabecera en un cable de conexión a tierra de 30 mm (consulte la Tabla de materiales), luego use epoxi conductor para adherir el cable al corte de la malla de cobre.
NOTA: Este paso no se cumple en el laboratorio. - En este punto, almacene las piezas preparadas de forma segura y realice la cirugía en una etapa posterior.
NOTA: En las secciones 3 a 6 se analiza la implantación del microaccionamiento y el arnés.
3. Cirugía: Preparación de la sonda y del espacio de trabajo
- Esterilice y coloque los instrumentos quirúrgicos en el espacio de trabajo quirúrgico después de un procedimiento aprobado.
NOTA: Esto puede incluir el uso de un esterilizador de perlas, instrumentos de autoclave o enjuague con peróxido al 30% o etanol al 90%, según el protocolo experimental aprobado. - Coloque el plato de cerámica utilizado para preparar el cemento dental en una caja de hielo, refrigerador o congelador, siguiendo las instrucciones del kit de cemento dental (consulte la Tabla de materiales). Use el plato de cerámica enfriado durante la mezcla de cemento para aumentar el tiempo que el cemento es maleable. Utilice un plato enfriado siempre que se requieran pasos de cementación más largos.
- Si se desea la verificación histológica de la colocación de la sonda al final del experimento, extienda la sonda de silicona justo antes de la cirugía girando el tornillo del micromotor en sentido contrario a las agujas del reloj y aplique un tinte lipofílico (consulte la Tabla de materiales) a la sonda sumergiéndola en una pequeña gota del tinte. Prepare el colorante lipofílico a partir de una solución madre diluida de dimetilsulfóxido (DMSO) o etanol (EtOH) comprada comercialmente (consulte la Tabla de materiales) diluyéndola en un tampón adecuado, como PBS, a una concentración de 1-5 μM.
4. Cirugía: Preparación del animal
- Siga un protocolo de anestesia aprobado para una cirugía con roedores de 2 a 4 h en condiciones asépticas. Esto puede incluir anestesia general y local, analgesia, aplicación de ungüentos para los ojos e inyecciones de solución salina. En este caso, utilice anestesia inyectable (ketamina 100 [mg/kg]/medetomidina 0,5 [mg/kg]) junto con crema analgésica local y ungüento para los ojos (ver Tabla de materiales), y coloque al animal sobre una almohadilla térmica para regular la temperatura corporal.
- Cuando el animal esté completamente anestesiado, muévalo a un área de afeitado separada y no estéril.
- Asegúrese de que el animal esté lo suficientemente caliente; Por ejemplo, colócalo sobre una almohadilla térmica. Quita el vello de la parte superior del cráneo. Hazlo con una afeitadora eléctrica o una crema depilatoria (ver Tabla de Materiales) o afeitando repetidamente la parte superior de la cabeza con un bisturí cubierto con etanol al 70%.
- Retire con cuidado los pelos sueltos para asegurarse de que no entren en contacto con el tejido expuesto más adelante. Para eliminar el vello, utilice, por ejemplo, pañuelos humedecidos con etanol al 70% y/o una bomba de bola exprimible. Si usa crema depilatoria, asegúrese de eliminarla bien con hisopos de algodón y solución salina.
- Desinfecte el área afeitada varias veces con un desinfectante a base de yodo (consulte la Tabla de materiales) y alcohol con hisopos de algodón, moviéndose desde el centro de la cabeza hacia los lados para cepillar los pelos sueltos restantes del sitio de la incisión.
- Desinfecte el pelaje de la cabeza y alrededor de ella con betadine. Esto garantiza un área de trabajo estéril y protege los instrumentos y materiales quirúrgicos para que no entren en contacto con pieles no estériles.
- Coloque al animal en un marco estereotáctico usando barras para los oídos y soporte para la nariz (ver Tabla de Materiales).
- Con unas tijeras quirúrgicas pequeñas (ver Tabla de Materiales), corte una abertura en forma de almendra en la piel de la parte superior del cráneo, que llegue desde la parte posterior de la sutura lambda hasta entre los ojos.
- Retire la membrana subcutánea y el periostio cortando mientras aún están húmedos, luego rasque el cráneo con una hoja de bisturí para eliminar el tejido blando de la membrana en la superficie del cráneo que pueda impedir la adhesión del cemento dental.
- Opcional: Una vez que el cráneo se haya limpiado de tejido de membrana, aplique brevemente una capa delgada de peróxido al 0.5% y lávela con desinfectante de yodo a base de agua (por ejemplo, Betadine) antes de raspar la superficie del cráneo para mejorar la adherencia del cebador al cráneo.
- Raspa con cuidado la superficie del cráneo rascando un patrón entrecruzado con la punta del bisturí al revés. Esto ayuda a que el cemento dental se adhiera al cráneo más tarde.
NOTA: No rasque con demasiada fuerza la parte superior de las suturas, ya que esto puede hacer que las suturas se rompan y pierdan líquido intracraneal, lo que perjudica la adherencia del cemento dental. - Alterne entre la hoja de bisturí y los bastoncillos de algodón estériles para rascar/empujar suavemente los músculos del cuello unidos a los lados de la sutura lambda hasta que los músculos hayan sido empujados hacia atrás hasta el "borde" del cráneo en la parte superior del cerebelo. Esto ayuda a minimizar el ruido muscular en las grabaciones neuronales.
- Llene una jeringa de 1 ml con una aguja de 27 g (ver Tabla de Materiales) con pequeñas cantidades de pegamento de cianoacrilato quirúrgico (ver Tabla de Materiales). Luego, pega la piel a los bordes del cráneo con la jeringa para untar pequeñas gotas de superpegamento sobre ella. Pegue el tejido lo más plano posible al cráneo para dejar espacio para los implantes. Este procedimiento asegura que la piel y los músculos no entren en contacto directo con partes del implante, lo que evita el ruido muscular en las grabaciones y mejora la adherencia del cemento dental.
- Aplique imprimación de cemento dental en el cráneo para una mayor adherencia y endurezca con luz ultravioleta (consulte la tabla de materiales). Esto mejora la adherencia del cemento dental y evita que las suturas craneales se filtren y debiliten la unión cráneo-cemento con el tiempo.
- Encuentre la ubicación objetivo para el implante de la sonda en relación con bregma o lambda y delinee la craneotomía a su alrededor con un marcador quirúrgico. Coloque la placa de la cabeza en el cráneo de modo que la craneotomía quede dentro de él, con espacio para el micromotor a un lado de la craneotomía, así como para 1-2 clavijas de conexión a tierra.
- Implante la placa de cabeza con cemento dental. Mezcle el cemento dental en el plato de cerámica enfriado designado (consulte el paso 3.2). Asegúrese de que la placa de la cabeza se adhiera al cráneo por todos los lados, formando un "pozo" hermético.
- Con un taladro dental (tamaño US 1/2 HP), perfore un pequeño orificio de fresa del ancho de los pasadores de cabecera preparados en el paso 1.4 sobre las áreas del cerebro que se utilizarán como GND / REF. Si desea conectar a tierra la jaula de Faraday, perfore otro pequeño orificio cerca del borde de la jaula de Faraday para el pin del cabezal de Faraday-GND.
NOTA: Para los pines del cabezal GND/REF, coloque la craneotomía a una distancia suficiente del borde de la jaula para que el propio pin del cabezal pueda colocarse dentro de él más tarde sin tocar la jaula de Faraday. - Limpie la craneotomía goteando suavemente solución salina estéril sobre ella con una jeringa y retirándola con toallitas que no se desprendan (consulte la Tabla de materiales). Repita hasta que se elimine toda la sangre y el tejido suelto.
- Prepare una solución de agar al 0,7% (ver Tabla de Materiales) en solución salina, enfríela ligeramente e introdúzcala en la craneotomía con una aguja de 27 G en una jeringa de 1 mL.
- Inserte suavemente un clavo GND (consulte el paso 1.3) en cada craneotomía perforada en el paso anterior. Los alfileres estarán rodeados de agar en todos los lados (ver paso 4.17). Aplique cemento alrededor de los pasadores del cabezal para asegurarlos y proporcionar aislamiento eléctrico.
- Limpie el plato de cerámica y vuelva a colocarlo en el refrigerador / congelador.
- Con un taladro dental, perfora el contorno de una craneotomía más grande (circular o cuadrada) moviéndote alrededor del borde con movimientos constantes. Asegúrese de que la craneotomía sea de 1 mm x 1 mm a 2 mm x 2 mm para permitir pequeños ajustes en la colocación de la sonda para evitar los vasos sanguíneos sin exponer demasiado la corteza. Si es posible, evite colocar craneotomías sobre las suturas. Perfore en rondas de 20-30 s y enfríe el cráneo con solución salina entre rondas de perforación.
NOTA: Al comenzar a perforar, es útil marcar el borde de ataque del microaccionamiento con un marcador, asegurándose así de que al perforar, se pueda formar un borde recto en paralelo al borde de ataque del microaccionamiento. Esto mejora las posibilidades de evitar el cemento en la craneotomía al fijar el microdrive en su lugar, así como mejorar la adherencia, evitando el sobrevolamiento del microdrive sobre la craneotomía y permitiendo una mayor maniobrabilidad lateral al colocar el microdrive en relación con la posición final del sitio de registro. - Después de algunas rondas iniciales de perforación, pruebe la resistencia de la porción perforada del hueso empujándola suavemente con pinzas finas (tamaño 5 o más fino; consulte la tabla de materiales).
- Siga probando entre rondas de perforación hasta que el hueso comience a "rebotar" debajo de las pinzas cuando se empuje. Cuando este sea el caso, agregue una gota de solución salina sobre la craneotomía para ablandar el hueso, luego use las pinzas para quitar suavemente la pieza de hueso perforada.
- Si el hueso no se puede quitar suavemente, haga otra ronda de perforación, concentrándose en los puntos donde el hueso aún está unido con más fuerza. En general, trate de extraer el cráneo con una presión suave de las pinzas antes de que se haya perforado por completo, ya que esto generalmente minimiza el daño tisular.
NOTA: Asegúrese de que la superficie de la duramadre se humedezca regularmente, tanto durante la perforación para reducir las temperaturas como después de la extracción del colgajo óseo. Esto mejora las posibilidades de una fácil inserción de la sonda al evitar que la duramadre se seque y se vuelva más difícil de penetrar. Si la duramadre resulta ser demasiado dura para penetrar, o si se utilizan sondas romas o de múltiples vástagos, se realiza una durotomía levantando la duramadre con una aguja de 27 G y realizando una pequeña incisión bajo inmersión salina para evitar que la duramadre se pegue a la superficie del cerebro.
- Cubra la craneotomía con una esponja hemostática (consulte la Tabla de materiales) empapada en solución salina fría y estéril para proteger la duramadre y el cerebro.
5. Cirugía: Implantación de la sonda
- Coloque el soporte de microdrive personalizado (consulte la tabla de materiales) en el brazo del aparato estereotáctico. Si el microdrive se retiró del soporte del microdrive después de la preparación de la sonda, coloque el microdrive con la sonda de silicona adjunta en el soporte del microdrive. Incline el brazo estereotástico según sea necesario para alcanzar el área cerebral objetivo deseada. Coloque el anillo de corona con el amplificador conectado en las tres clavijas verticales en la parte posterior del soporte del microaccionamiento (consulte la Figura complementaria 1).
- Baje el microdrive hasta ~0,5 mm de la craneotomía, luego use pinzas para conectar los pines del cabezal GND/REF conectados a la sonda con los pines GND/REF correspondientes implantados en el cráneo (consulte los pasos 4.14-4.15). Consulte la Figura complementaria 3 y la Figura complementaria 4 para ver ejemplos de impulsión, craneotomía y colocación de clavijas GND/REF.
- Una vez en su lugar, opcionalmente asegure las clavijas con una gota de epoxi de plata conductor (consulte la Tabla de materiales) para una conexión más robusta. Una vez que el epoxi de plata esté curado, cubra los clavos conectados con una pequeña cantidad de cemento dental (consulte la Tabla de materiales) para asegurarse de que la conexión permanezca estable durante largos períodos y que no haya conexión eléctrica con los tejidos circundantes y/o los elementos del implante.
- Retire la esponja hemostática de la craneotomía (ver paso 4.22).
- Coloque el brazo estereotáctico con el microimpulsor sobre la craneotomía.
NOTA: Si la sonda está retraída, asegúrese de que el micromotor esté colocado de manera que la sonda toque una parte de la craneotomía que no contenga vasos sanguíneos grandes. - Baje el microdrive, si es necesario, ajustando la ubicación y el ángulo hasta que el vástago de la sonda toque la duramadre o la superficie del cerebro (consulte el paso 4.21) en el área objetivo.
- Mezcle el cemento dental en la placa de cerámica designada (consulte el paso 3.2) y cemente la base del micromotor en su lugar, concentrándose en los tres lados de la base del micromotor que no están orientados hacia el electrodo. Asegúrese de que el cemento no toque el microaccionamiento por encima de la "base" extraíble (ver Figura 1D).
- Asegúrese de que cualquier espacio entre la base y el cráneo esté completamente cubierto con cemento dental. Limpie el plato de cerámica y vuelva a colocarlo en el refrigerador / congelador. Espere a que el cemento se cure, aproximadamente 10-15 min.
NOTA: Se deja un pequeño espacio entre la base del micromotor y el cráneo, y el cemento se utiliza en su forma más fluida para rellenarlo. Una vez que el cemento se ha espesado ligeramente, se acumula el cemento entre las paredes de la base del micromotor y el cráneo. Siempre se utilizan cantidades muy pequeñas de cemento, ya que el flujo de la sustancia puede ser impredecible y volúmenes más grandes pueden fluir hacia regiones no deseadas. Se pueden usar pequeñas cantidades de esponja hemostática sumergida en solución salina para cubrir partes de la craneotomía. Si el cemento fluye accidentalmente sobre la craneotomía, retírelo con pinzas una vez que adquiera una consistencia similar a una película.
- Asegúrese de que cualquier espacio entre la base y el cráneo esté completamente cubierto con cemento dental. Limpie el plato de cerámica y vuelva a colocarlo en el refrigerador / congelador. Espere a que el cemento se cure, aproximadamente 10-15 min.
- Baje la sonda de silicona sobre el cerebro, monitoreando cuidadosamente la posición de la sonda a través de un microscopio. Cuando los vástagos de la sonda toquen el cerebro, baje la sonda rápidamente en ~ 250 μm (una vuelta completa del tornillo es 282 μm) para asegurarse de que la sonda rompa la resistencia de la superficie duramadre / cortical.
- Compruébalo visualmente. Si la sonda no ha entrado en la corteza, espere 5 minutos, luego intente grabar a través de la duramadre con la punta del vástago subiendo y bajando repetidamente la sonda unas pocas decenas de micrómetros mientras la duramadre/corteza está bajo tensión desde la punta de la sonda.
- Una vez que la sonda haya atravesado la superficie de la corteza, bájela gradualmente a un ritmo más lento (100-200 μm / min) hasta que se alcancen las coordenadas objetivo o la sonda se haya movido más de 1000 μm. Si el objetivo requiere que la sonda se mueva más de 1000 μm, avance la sonda en pasos de un máximo de 1000 μm/sesión durante las siguientes sesiones de grabación hasta que se alcancen las coordenadas del objetivo.
NOTA: Omita este paso si prefiere monitorear las señales neuronales mientras baja la sonda de silicona. Los pasos para esto se describen en la sección 7. - Prepare el elastómero de silicona de acuerdo con las instrucciones (consulte la Tabla de materiales) y dispense una pequeña gota en la craneotomía con una jeringa de 1 ml (consulte la Tabla de materiales).
- Una vez seco, cubra el elastómero de silicona con una mezcla 50/50 de cera de hueso y aceite mineral. Este paso protege aún más la sonda y evita la acumulación de residuos y plasma seco sobre la craneotomía, lo que hace que la extracción sea más sencilla y segura. Tenga cuidado, ya que trabajar alrededor de la sonda mientras está bajada puede provocar roturas.
6. Cirugía: Implantación de la jaula de Faraday
- Cuando el cemento dental se haya solidificado por completo, afloje el soporte del microaccionamiento aflojando el tornillo lateral que fija el accionamiento con una llave Allen (consulte la figura complementaria 1). Retraiga suavemente el soporte ~1 cm para que el microdrive quede independiente, pero el amplificador/conector de la sonda permanezca fijo al soporte del implante sin estirar el cable flexible.
- Coloque la corona prefabricada y la malla de Faraday alrededor de la placa principal estirando la jaula en la abertura y colocándola horizontalmente sobre el microdrive y el cable flexible, luego fíjela a la placa principal con cemento dental.
NOTA: Asegúrese de cerrar todos los espacios entre la jaula de Faraday y el cráneo con cemento dental para proteger el implante de la contaminación. - Coloque el anillo de la corona de Faraday (consulte la tabla de materiales) con el conector de la sonda/cabezal sobre la corona, alineando el soporte integrado para el amplificador/conector de la sonda con el área marcada con una 'X' sangrada en la corona de Faraday (consulte el paso 2.13).
- Asegure el anillo a la jaula de Faraday con una pequeña gota de pegamento de cianoacrilato o cemento dental en cada unión del anillo de radios.
- Una vez que el anillo de Faraday con amplificador/conector de sonda integrado esté asegurado en su lugar, retraiga completamente el brazo estereotáctico con el soporte de microdrive. Consulte la Figura complementaria 3 para obtener una guía paso a paso sobre el ensamblaje de estos componentes.
7. Registro de pruebas postoperatorias
- Conecte el amplificador/conector de la sonda al hardware de grabación e inicie una grabación.
- Si la sonda aún no ha alcanzado su ubicación objetivo durante la inserción inicial (consulte el paso 5.9), gire lentamente el tornillo del microaccionamiento en sentido contrario a las agujas del reloj para bajar la sonda mientras monitorea las señales neuronales.
NOTA: Las señales deben cambiar a) cuando los electrodos tocan la capa de elastómero de silicona por encima de la craneotomía, y b) cuando los electrodos comienzan a moverse hacia el cerebro (ver paso 7.2). La actividad neuronal de alta frecuencia será registrada por electrodos que están completamente insertados en el cerebro, mientras que los electrodos que están en contacto con el LCR en la superficie del cerebro generalmente mostrarán una señal de población neuronal filtrada de paso bajo sin actividad de pico (similar a un rastro de EEG), y los sitios de registro en el aire registrarán un aumento del ruido eléctrico. Es posible verificar adicionalmente la profundidad de inserción de la sonda midiendo la impedancia de los canales individuales después de la grabación de la prueba. Los canales en contacto con el aire deben mostrar alta impedancia (lo que indica un circuito abierto) e impedancias similares a las medidas antes de la cirugía para los canales que tocan el líquido cefalorraquídeo o que ya están en el cerebro. Avance la sonda de silicio una distancia total máxima de aproximadamente 1000 μm por sesión, con una velocidad máxima de aproximadamente 75 μm/min (consulte el paso 5.5). - Cuando los potenciales de campo local neuronal sean visibles a través de la sonda y/o la sonda avance un máximo de 1000 μm, finalice la grabación de la prueba y desconecte el conector de la etapa principal.
8. Recuperación
- Cubra la jaula de Faraday con una envoltura veterinaria autoadhesiva (consulte la tabla de materiales).
- Finalice la anestesia y deje que el animal se recupere durante unos días siguiendo las pautas experimentales aprobadas.
- Si los electrodos de la sonda de silicona aún no están en la ubicación objetivo deseada, gire el tornillo del micromotor en pequeños pasos con un máximo de cuatro vueltas completas (o ~1000 μm) por sesión. Si es necesario, repita este procedimiento durante varios días hasta alcanzar el objetivo. Se recomienda combinar el movimiento de la sonda con registros simultáneos para evaluar la actividad electrofisiológica en las áreas atravesadas.
9. Experimentos conductuales y registros crónicos
- Para registros crónicos de la cabeza fijada durante la realización de la tarea, fije la placa de cabeza en la base de la jaula de Faraday a la abrazadera de fijación de la cabeza abriendo manualmente la abrazadera y sujetando la placa de cabeza implantada (consulte la Figura 1C, E, F).
NOTA: Si no es necesaria la fijación de la cabeza, este sistema de implante también se puede utilizar para grabaciones de movimiento libre. Para las grabaciones que se mueven libremente, omita los pasos 9.1 y 9.7. - Retire la envoltura veterinaria autoadhesiva del implante.
NOTA: Para minimizar la incomodidad para el animal, se sugiere que se inicie una tarea conductual simple y gratificante antes de este paso como distracción mientras el experimentador trabaja con el implante. - Conecte el amplificador/conector al equipo de grabación.
- Realizar grabaciones neuronales a medida que el animal realiza la tarea.
NOTA: Si el objetivo es maximizar el número de unidades extracelulares registradas, mueva la lanzadera unas pocas decenas de micrómetros cada vez que disminuya el rendimiento neuronal en un lugar. Tenga en cuenta que después de mover la sonda, la señal puede tardar minutos u horas en estabilizarse. Por lo tanto, podría ser beneficioso mover la sonda al final de una sesión para que la señal pueda recuperarse hasta el inicio de la siguiente sesión. - Desconecte el equipo de registro y cubra el implante con una nueva envoltura veterinaria al final del registro de comportamiento.
- Abra la abrazadera de fijación de la cabeza para separar al animal de la fijación de la cabeza.
10. Recuperación de la sonda
- Al final de la grabación final, retraiga la sonda de silicona tanto como sea posible en el microdrive girando el tornillo en el sentido de las agujas del reloj. Haga esto mientras el animal está fijo en la cabeza y se comporta bien o con el animal anestesiado en la configuración quirúrgica. Trace la salida de la sonda del cerebro monitoreando las señales neuronales simultáneamente y verificando la firma de los electrodos que están sumergidos en el cerebro, tocando la superficie del cerebro o en contacto con el aire (ver paso 7.3).
NOTA: Dependiendo del protocolo histológico y de la sonda, se realizan lesiones electrolíticas antes de retraer la sonda para determinar la ubicación exacta de algunos electrodos en la sonda. Si no es necesario controlar la salida de la sonda a través del registro neuronal, también es posible retraer la sonda una vez que el animal ha sido terminado. - Terminar con el animal siguiendo las pautas aprobadas (esto incluye la perfusión del animal si se planea fijar el cerebro para la histología posterior).
- Espere ~ 10 minutos después de que el animal haya muerto. A continuación, fije la cabeza del animal en la estereotaxia, asegurándose de que la cabeza del animal no pueda moverse durante el explante para evitar la rotura de la sonda.
- Aplique una gota de solución salina sobre la craneotomía y déjela en remojo durante unos minutos para ablandar el tejido biológico seco en el vástago de la sonda y reducir la posibilidad de rotura del vástago.
- Coloque el soporte estereotáctico aproximadamente 0,5 cm por encima del microdrive. A continuación, corte el extremo superior de los radios de la jaula de Faraday con unas tijeras quirúrgicas pequeñas (véase la Tabla de materiales) para liberar el anillo de Faraday que sujeta el amplificador/conector y transfiera el anillo de nuevo a las clavijas verticales en la parte superior del soporte estereotáctico (véase el paso 5.1 y la Figura complementaria 1).
- Corta con cuidado la malla de cobre con las mismas tijeras quirúrgicas cortando áreas de malla en forma de U entre los radios de la corona de Faraday. Luego, corta los radios de plástico de la corona en la base.
NOTA: Evite doblar los radios de plástico impresos mientras se cortan, ya que pueden romperse y enviar residuos de plástico volando hacia la sonda. - Baje el soporte estereotáctico hasta que el microdrive pueda fijarse en el soporte con el tornillo lateral del soporte, fije el microdrive y, a continuación, afloje el tornillo T1 que conecta el cuerpo del microdrive a la base del microdrive.
- Retraiga lentamente el brazo estereotáctico con el soporte del implante para levantar el micromotor de su base. Asegúrese de que el microdrive se separe de la base en un ángulo perpendicular (es decir, "verticalmente" desde la base).
NOTA: Si el cuerpo y la base del microaccionamiento no se separan fácilmente, verifique que el movimiento del brazo estereotáctico no esté en ángulo con respecto a la orientación del microaccionamiento. Si es necesario, el soporte y el micromotor se vuelven a alinear entre sí aflojando ligeramente la fijación de la cabeza del animal y reposicionándola en consecuencia. La alineación correcta es uno de los aspectos cruciales para una fácil recuperación del microdrive. Además, compruebe si hay algún residuo de cemento dental que conecte el microdrive y la base del microdrive (consulte el paso 5.5). Si es así, el cemento se raspa cuidadosamente con un bisturí y/o un taladro dental, dependiendo de la cantidad de cemento utilizado. - Levante el brazo estereotáctico con la sonda adjunta para crear suficiente espacio debajo de él.
- Retire al animal de la estereotasa y prepare el cerebro siguiendo un protocolo de histología aprobado si lo desea. Recuperar la base de microdrive implantada y limpiarla sumergiéndola en acetona durante varias horas para su posterior reutilización.
- Coloque una base de microdrive limpia sobre masilla adhesiva (consulte la tabla de materiales), luego baje el microdrive sobre la base y apriete el tornillo. Para evitar roturas, controle la posición de la sonda bajo un microscopio durante todo el proceso. Este paso se puede completar en un momento posterior si primero es necesario limpiar la base de microdrive implantada para su reutilización.
NOTA: Este protocolo requiere el uso de masilla adhesiva como plataforma para la base, lo cual es vital ya que asegura la base y al mismo tiempo tiene un grado de elasticidad, asegurando que la base no se deslice y choque con la sonda. La masilla debe tener la forma de una "cara de acantilado" vertical en el lado de la base del micromotor donde se bajará la sonda. Esto asegura que si la sonda se baja más allá de la base, no haga contacto con la masilla que se encuentra debajo. La "torre" de masilla también debe ser lo suficientemente alta como para que, si se baja más allá de la base del microaccionamiento, la sonda no haga contacto con la superficie de la mesa en la que se coloca la masilla. Por último, asegura bien la masilla a la superficie para evitar que resbale o se caiga. Al bajar el microdrive sobre la base del microdrive sostenido por la masilla, asegúrese de tener una vista lateral del perfil desde el microscopio para monitorear el progreso de modo que, a medida que se baja la sonda, no choque con la base ni con la masilla. - Limpie y esterilice la sonda siguiendo las instrucciones del fabricante. En el caso de las sondas más comúnmente disponibles, sumérjalas en un limpiador enzimático (consulte la tabla de materiales) durante 12 h, luego enjuague con agua desmineralizada y desinfecte con alcohol. Para ello, coloque la sonda en un vaso de precipitados grande que contenga el limpiador enzimático mientras sigue conectado al soporte del microaccionamiento en el brazo estereotáctico.
NOTA: Si lo desea, mida las impedancias de los electrodos en la sonda después de la limpieza para monitorear la degradación potencial de los electrodos individuales. - Guarde el microdrive con la sonda limpia de forma segura hasta el próximo experimento.
Resultados
Este protocolo presenta un sistema de implantación crónica que permite a los investigadores implementar registros de electrofisiología crónica ligeros, rentables y seguros en ratones que se comportan (Figura 1). Los principales factores que determinan la aplicación exitosa de este enfoque incluyen: cobertura completa de cemento del cráneo, una craneotomía mínimamente invasiva y debidamente protegida, la fijación segura del micromotor y el cableado al cráneo y la continuidad completa del material protector de Faraday. Cuando se tienen en cuenta estos puntos, se pueden alcanzar grabaciones de alta calidad de manera consistente. Aquí se muestran resultados representativos relacionados con los siguientes aspectos principales del éxito quirúrgico:
1) ¿El implante interfiere con el comportamiento o el bienestar de los animales?
2) ¿La calidad de la señal es alta y se pueden mantener durante períodos prolongados de tiempo?
3) ¿Se pueden combinar fácilmente las grabaciones con el rendimiento de las tareas?
Para evaluar el impacto del implante en el comportamiento animal, analizamos los patrones de locomoción rastreados en cinco animales implantados. La Figura 2A muestra un ejemplo de un animal que se mueve libremente dentro de una jaula de juego durante 10 minutos antes y 1 semana después del implante. Uno puede ver que los patrones de movimiento no han cambiado. Esta observación se confirma con la Figura 2B, C , que muestra las distribuciones de las velocidades de movimiento y las direcciones de la cabeza entre los animales. Tanto la velocidad de carrera como las direcciones de la cabeza se mantuvieron prácticamente sin cambios antes y después de la implantación y, en todo caso, las velocidades de carrera parecían estar ligeramente elevadas después de la cirugía. El video complementario 1 muestra una breve grabación de video de un animal 6 días después de la cirugía de implantación. Los comportamientos típicos de la jaula en el hogar, como la locomoción, el acicalamiento, la crianza y la búsqueda de alimento en el entorno del hogar, son visibles e indican una recuperación exitosa de la cirugía, así como la salud general. Lo más probable es que el bajo impacto conductual del implante se deba a su bajo peso y altura manejable.
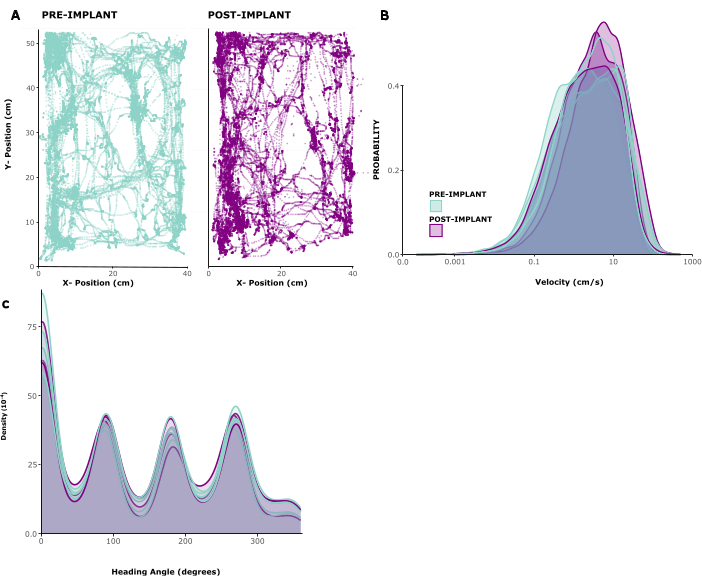
Figura 2: Locomoción antes y después de la cirugía. (A) Ejemplo de locomoción de un animal antes (panel izquierdo) y después (panel derecho) de la implantación. Las coordenadas x/y están en centímetros, los puntos muestran la posición del animal en cada punto de tiempo durante un período de 10 min. (B) Distribución de las velocidades de movimiento en cm/s durante 5 sesiones antes y 3 sesiones después de la implantación en 5 animales. (C) Densidad del kernel para probabilidad de movimiento en diferentes direcciones, para las mismas sesiones analizadas en (B). Haga clic aquí para ver una versión más grande de esta figura.
A continuación, se evalúa la calidad de la señal en el potencial de campo local (LFP) y la actividad de aumento en los sitios de grabación. Aquí, mostramos datos representativos de registros corticales en la corteza visual primaria (V1). Para la validación, se extrajo la actividad putativa de una sola unidad de las señales neuronales de banda ancha registradas en V1 de un ratón despierto utilizando Kilosort 3 (ver Figura 3). La Figura 3A muestra la ubicación de las unidades individuales extraídas en el vástago de la sonda, la Figura 3B muestra las formas de onda de pico correspondientes y la Figura 3C muestra las respuestas de pico de las mismas neuronas a un protocolo de densidad de fuente de corriente (CSD). En este paradigma, los destellos de campo amplio se presentaron con una duración de 300 ms a una frecuencia de 1 Hz (es decir, 300 ms encendidos, 700 ms apagados) durante 200 ensayos. Finalmente, la Figura 3D muestra las respuestas de las mismas unidades a un protocolo de mapeo de campo receptivo visual, que consta de 2000 fotogramas de cuadrados blancos y negros seleccionados al azar sobre un fondo gris, y cada uno presentado durante 16,6 ms. Los cuadrados cubrían 12 grados de ángulo visual cada uno y se seleccionaron de un campo de 15 x 5 ubicaciones posibles, de modo que el paradigma de mapeo cubrió un espacio visual de -90 a +90 grados de acimut y de -30 a +40 grados de elevación en total. Las respuestas de la velocidad de disparo a cada marco de estímulo se extrajeron analizando la velocidad máxima de disparo en una ventana de 16,6 ms, sujeta a un retraso de entre 40 y 140 ms, identificada como óptima por canal en función de la actividad máxima en cada ventana. Este tipo de registro se puede utilizar para guiar el ajuste de la profundidad de inserción de cada electrodo y para evaluar la calidad de la señal después de la cirugía de implante.
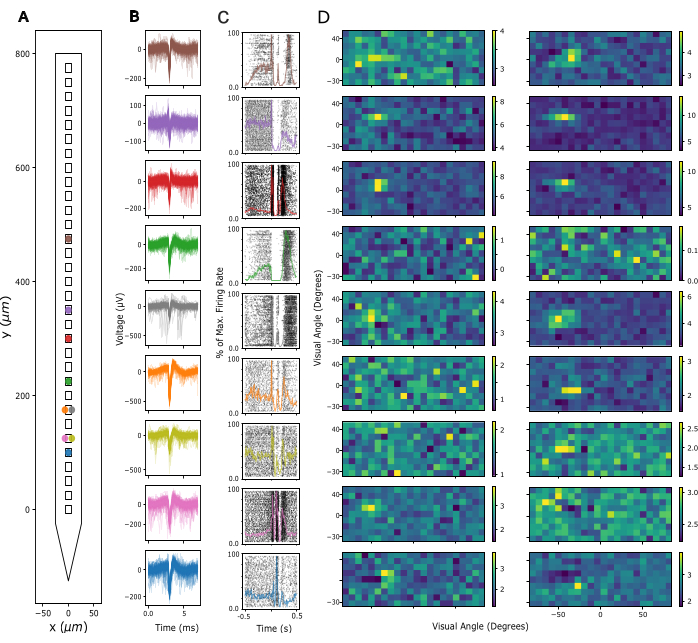
Figura 3: Señales neuronales registradas. (A) Ubicación inferida de unidades individuales clasificadas por el paquete de clasificación de picos Kilosort 3 a lo largo de los contactos de electrodos de la sonda. (B) Formas de onda de pico para las mismas unidades que se muestran en A a lo largo de 5 ms de tiempo. Líneas finas: Formas de onda de pico individuales. Líneas gruesas: Forma de onda de pico promedio. (C) Diagrama ráster de picos en respuesta a un paradigma de densidad de fuente de corriente (CSD) que presenta destellos de campo amplio de 300 ms seguidos de una pantalla negra de 700 ms. Las respuestas se muestran para las mismas unidades que en A y B. Las líneas de colores superpuestas representan histogramas de tiempo peri-estímulo (PSTH) de las mismas respuestas. Las velocidades de disparo de los PSTH se calcularon en intervalos de 10 ms y luego se normalizaron mediante la velocidad de disparo máxima en todo el PSTH. El tiempo 0 se centra en el estímulo del flash de campo amplio. (D) Campos receptivos estimados de las mismas unidades que en A-C, medidos por un paradigma de Mapeo de Campo Receptivo de Ruido Disperso. Cada gráfico muestra la actividad media de la tasa de disparo durante una ventana de análisis de 16,6 ms en respuesta al inicio (panel izquierdo) o al desplazamiento (panel derecho) de los estímulos cuadrados blancos y negros. Los estímulos se presentaron durante 16,6 ms, ubicados aleatoriamente en una cuadrícula cuadrada de 5 x 15 que abarcaba 180 grados de ángulo visual horizontalmente y 70 grados de ángulo visual vertical. La actividad de la velocidad de disparo se puntuó z en toda la cuadrícula de campo receptivo (ver barra de colores). Haga clic aquí para ver una versión más grande de esta figura.
La calidad de la grabación se mantuvo alta en las grabaciones repetidas durante semanas o meses. La Figura 4A muestra los registros longitudinales de LFP de un animal durante 15 semanas. Las LFP se registraron en respuesta al paradigma de CSD descrito anteriormente (véase la Figura 3A-C). La Fig. 4A muestra las respuestas medias de la LFP 500 ms después del inicio del flash. En este ejemplo, utilizamos una sonda lineal con 32 canales, con una distancia entre electrodos de 25 μm. Tenga en cuenta que el día 18, se ajustó la profundidad de la sonda, desplazando la sonda hacia abajo en 600 μm. Tanto antes como después de este ajuste, las señales de LFP se mantuvieron estables a lo largo de los días de registro.
De acuerdo con esto, las formas de onda de pico de unidades individuales putativas fueron discernibles en muchas grabaciones. La Figura 4B muestra ejemplos representativos de formas de onda de pico de tres sesiones de grabación a lo largo de un mes de grabaciones, lo que demuestra que la actividad de una sola unidad se puede identificar con éxito a lo largo del tiempo. La Figura 4C muestra el número total de unidades individuales putativas extraídas de registros crónicos en seis animales, que abarcan una ventana de hasta 100 días. Las unidades individuales se definieron de acuerdo con los criterios predeterminados de kilosort 3.0 (ver Tabla Suplementaria 1). Como se puede ver, el número de unidades individuales claramente definidas ascendió típicamente a ~40 en la primera semana después de la implantación, y luego disminuyó gradualmente, avanzando hacia una asíntota aparentemente estable de ~20 unidades. Dado que estos registros se realizaron utilizando sondas lineales de 32 canales, esto equivale a un rendimiento esperado de aproximadamente 1,25 unidades individuales por electrodo directamente después de la implantación, disminuyendo a aproximadamente 0,65 unidades individuales por electrodo en registros a largo plazo. La conexión repetida al amplificador/conector del implante durante las sesiones no pareció afectar ni a la calidad de la grabación ni a la estabilidad del implante, ya que la corona de Faraday que sostiene el amplificador/conector puede soportar fuerzas repetidas de más de 10 Newton, un orden de magnitud mayor que incluso las fuerzas de acoplamiento máximas requeridas por los conectores estándar (véase el vídeo complementario 2).
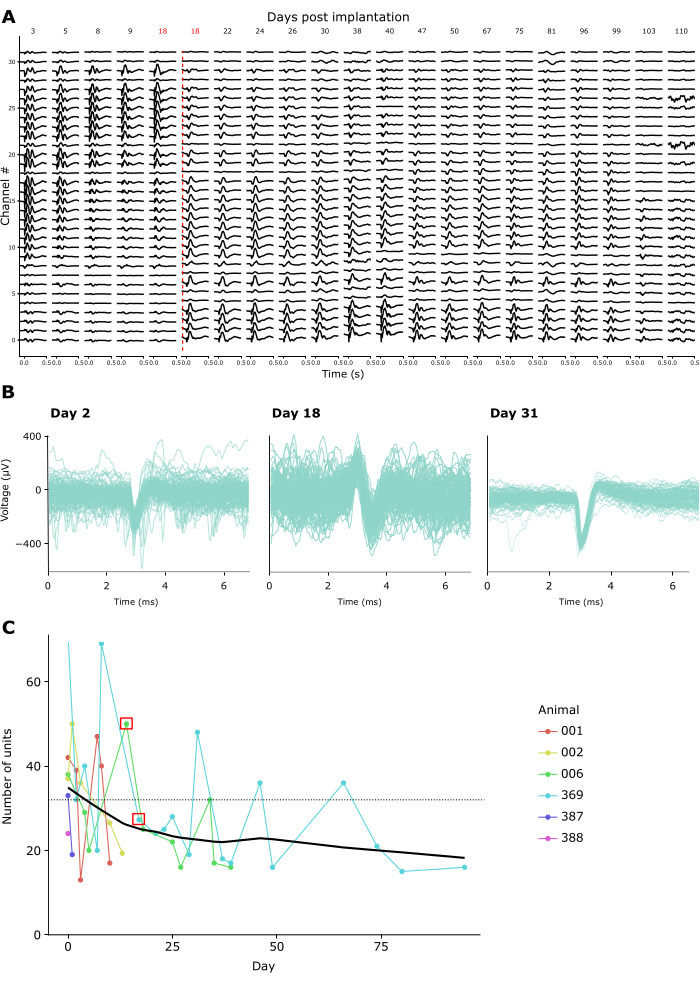
Figura 4: Estabilidad de las grabaciones neuronales a lo largo del tiempo. (A) Actividad media de LFP en respuesta a un estímulo CSD flash de campo amplio, mostrada a través de los 32 canales de una sonda implantada crónicamente de 3 a 110 días después del implante. La línea vertical roja denota que la sonda se baja a una nueva ubicación debido a que los canales 0-8 graban desde el exterior del cerebro el día 18 después de la cirugía. (B) Formas de onda de pico de tres unidades de ejemplo del mismo implante crónico registradas repetidamente a lo largo de cuatro semanas. Líneas finas: Formas de onda de pico individuales. Línea gruesa superpuesta: Forma de onda de pico promedio. (C) El número de unidades individuales putativas detectadas por Kilosort 3 a lo largo de los días de registro para 6 animales (véase la leyenda del recuadro). El cuadrado rojo denota los días en que se movió la sonda. La línea punteada denota el número de electrodos por implante utilizados en estos registros (32). Haga clic aquí para ver una versión más grande de esta figura.
Por último, al proporcionar un sistema modular que incluye un microdrive, así como una jaula de Faraday portátil y una placa de cabeza que funciona como base de implante y dispositivo para la fijación de la cabeza, este protocolo permite la integración de la electrofisiología crónica con el comportamiento de fijación de la cabeza. Aquí, se muestran datos de ejemplo de ratones que atraviesan un entorno virtual en una cinta de correr esférica. La Figura 5A muestra la actividad de picos relacionada con la carrera de 20 unidades en un ejemplo de prueba. La Figura 5B muestra las diversas pero robustas relaciones entre la velocidad de carrera y la actividad de aumento de las unidades individuales clasificadas por picos, así como un promedio poblacional para el mismo efecto en la Figura 5C, lo que confirma el efecto bien establecido de la actividad locomotora sobre la actividad neuronal en el roedor V124.
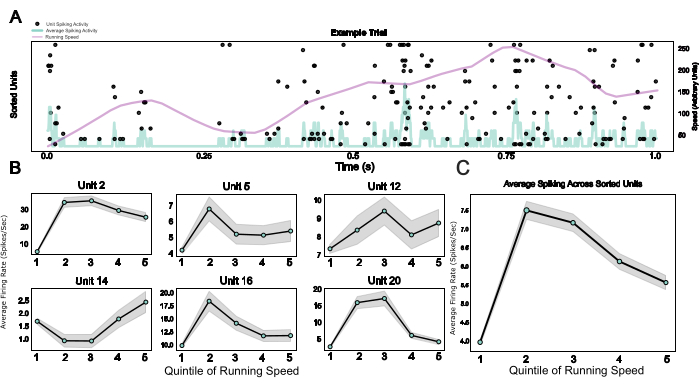
Figura 5: Respuestas neuronales durante el comportamiento con la cabeza fija. (A) Gráfico ráster de respuestas de una sola unidad en un ensayo de ejemplo, con velocidad de carrera (línea morada) y tasas de disparo promedio en todas las unidades individuales (línea azul claro) superpuestas. (B) Actividad de una sola unidad durante diferentes categorías de velocidad de carrera, mostrada para seis unidades de ejemplo. (C) Promedio de la actividad de aumento en todas las unidades individuales en una sesión de ejemplo, trazada a lo largo de los cinco quinítiles de la distribución de velocidad de carrera. Las velocidades de carrera en esta sesión oscilaron entre 0 y 0,88 metros/segundo. Haga clic aquí para ver una versión más grande de esta figura.
Tabla complementaria 1: Tabla que muestra los parámetros predeterminados utilizados por Kilosort 3 al identificar unidades individuales en los registros que se muestran en la Figura 3, la Figura 4 y la Figura 5. Haga clic aquí para descargar este archivo.
Video complementario 1: Video que muestra la actividad locomotora de los animales después del implante. El video tomado después de la fase de recuperación de 5 días es completo, mostrando el comportamiento locomotor normal, así como la adaptación al tamaño y peso del implante. Se puede ver al animal explorando normalmente una jaula de juego que contiene enriquecimiento ambiental. Haga clic aquí para descargar este archivo.
Video complementario 2: Video que muestra la fuerza aplicada sobre la corona de Faraday ensamblada. Las fuerzas soportadas por la corona de Faraday son aproximadamente un orden de magnitud mayores que la fuerza de conexión necesaria para los conectores estándar, como los nanoconectores polarizados de 4 pines. Haga clic aquí para descargar este archivo.
Figura complementaria 1: Figura que muestra imágenes del soporte de la unidad. Los archivos de diseño imprimibles se pueden encontrar en el repositorio de Github correspondiente (https://github.com/zero-noise-lab/dream-implant/). Haga clic aquí para descargar este archivo.
Figura complementaria 2: Plantilla para malla de cobre. Imprime la plantilla con la escala original y utiliza la plantilla para cortar la malla de cobre (paso 2.12). Utilice la barra de escala para verificar y, si es necesario, ajustar la escala de la impresión. Haga clic aquí para descargar este archivo.
Figura complementaria 3: Serie de fotos que muestra los pasos de montaje del implante durante la cirugía. En este caso se instalan dos microaccionamientos, así como dos amplificadores. Haga clic aquí para descargar este archivo.
Figura complementaria 4: Dibujo del cráneo de un ratón con ejemplos de colocación de unidades, craneotomías (en verde) y pin GND/REF (en rojo). Se sugiere la ubicación de los clavos debido a la ubicación en el cerebelo, que es poco probable que interfiera con los registros corticales. Haga clic aquí para descargar este archivo.
Discusión
Este manuscrito presenta un protocolo para la implantación rápida, segura y estandarizada de sondas, que también permite la recuperación y reutilización de la sonda al final del experimento. El enfoque hace uso de un sistema modular de componentes del implante, específicamente un microdrive, que es compatible con todas las sondas de silicona y sistemas de registro comunes, una placa de cabeza que se puede usar para experimentos de comportamiento con la cabeza fija y una jaula de Faraday portátil para proteger el implante. Esta constelación permite a los usuarios adaptar de forma flexible su implante a diferentes paradigmas experimentales, como el comportamiento fijo en la cabeza frente al comportamiento de movimiento libre o la miniaturización del implante (sin jaula de Faraday) frente a una mayor robustez de la señal a largo plazo (con la jaula de Faraday), sin tener que sacrificar la estandarización del implante en el proceso.
Este enfoque hace que los registros electrofisiológicos crónicos sean más estandarizados (a través de elementos prefabricados que no requieren ensamblaje a mano), menos costosos (a través de la recuperación de la sonda), menos lentos (al simplificar los pasos quirúrgicos) y más fácilmente compatibles con el bienestar y el comportamiento animal (a través de la disminución del tamaño del implante y la fijación de la cabeza sin estrés). Como tal, este protocolo tiene como objetivo hacer que los implantes electrofisiológicos en roedores que se comportan sean alcanzables para una gama más amplia de investigadores más allá de los laboratorios pioneros a la vanguardia del campo.
Para lograr este objetivo, el protocolo presentado aquí minimiza el equilibrio entre varios aspectos a menudo igualmente cruciales de los implantes de microdrive, a saber, la flexibilidad, la modularidad, la facilidad de implantación, la estabilidad, el costo general, la compatibilidad con el comportamiento y la reutilización de la sonda. En la actualidad, los enfoques disponibles a menudo sobresalen en algunos de estos aspectos, pero a un alto costo para otras características. Por ejemplo, para casos de uso que exigen una estabilidad absoluta del implante durante largos períodos de tiempo, el mejor enfoque de implante puede ser cementar directamente la sonda sobre el cráneo25. Sin embargo, esto también evita la reutilización de la sonda, así como el reposicionamiento de los sitios de grabación en caso de mala calidad de grabación, y es incompatible con la colocación de implantes estandarizados. Del mismo modo, si bien la unidad AMIE proporciona una solución ligera y de bajo coste para la implantación recuperable de sondas, está limitada a sondas individuales y restringida en la ubicación de las coordenadas objetivo17. En el extremo opuesto del espectro, algunos nano-motores disponibles comercialmente (ver Tabla 1 16,17,21,26,27,28,29,30) son extremadamente pequeños, pueden colocarse libremente en el cráneo y maximizar el número de sondas que se pueden implantar en un solo animal 16. Sin embargo, son caros en comparación con otras soluciones, requieren que los experimentadores estén altamente capacitados para realizar cirugías de implantes exitosas y prohíben la reutilización de la sonda. El microdrive desarrollado por Vöröslakos et al.21, cuya versión ligera también forma parte de este protocolo, sacrifica el tamaño pequeño del implante para mejorar la facilidad de uso, el menor precio y la reutilización de la sonda
Tabla 1: Comparación de estrategias populares para implantes de sondas crónicas en roedores. Disponibilidad: si el microdisco es de código abierto (para que los investigadores lo construyan por sí mismos), disponible comercialmente o ambos. Modularidad: Los sistemas integrados constan de uno o pocos componentes que están en una relación fija entre sí, mientras que los sistemas modulares permiten la colocación libre de la sonda/micromotor en relación con la protección (cabezal/jaula de Faraday) después de la producción del implante (por ejemplo, en el momento de la cirugía). La modularidad se determinó a partir de la información publicada o de los protocolos de implantación de los implantes enumerados. Headfix: Sí: El implante tiene mecanismos de fijación de la cabeza integrados en su diseño, X: El implante deja espacio para agregar una placa de cabeza adicional para la fijación sin grandes problemas, No: El diseño del implante probablemente crea problemas de espacio o requiere modificaciones sustanciales en el diseño para su uso con fijación de la cabeza. Colocación de la sonda: Restringida: La ubicación de la sonda es limitada en la etapa de diseño del implante. Flexible: La ubicación de la sonda se puede ajustar incluso durante la cirugía. Número de sondas: el número de sondas que se pueden implantar. Tenga en cuenta que implantar sondas >2 en un ratón plantea un desafío significativo independientemente del sistema de implante elegido. Reutilización de sondas: sí, si las sondas pueden, en teoría, reutilizarse. Peso/tamaño: peso y volumen del implante. Haga clic aquí para descargar esta tabla.
Para crear un sistema que concilie estos diferentes requisitos de forma más fluida, el implante DREAM se diseñó sobre la base del implante Vöröslakos21, pero con varias modificaciones fundamentales. En primer lugar, para reducir el peso total del implante, el microdrive utilizado aquí se fabrica en aluminio mecanizado en lugar de acero inoxidable impreso en 3D, y la corona de Faraday está miniaturizada, logrando una reducción de peso total de 1,2-1,4 g dependiendo de la elección del material de la placa principal (consulte la tabla 2). En segundo lugar, la placa de cabeza que rodea el microdrive fue diseñada para permitir un mecanismo de fijación de la cabeza integrado que permite una fijación rápida y sin estrés, al tiempo que funciona como base para la jaula de Faraday, dando acceso a la mayoría de las áreas objetivo potenciales para las grabaciones neuronales y agregando solo un peso mínimo al implante. La forma plana del mecanismo de fijación y la ausencia de protuberancias también aseguran un deterioro mínimo del campo visual o la locomoción de los animales (ver Figura 2A-C), una clara mejora con respecto a los sistemas anteriores31,32. La corona y el anillo de Faraday que están fijados a la placa principal también se modificaron sustancialmente en comparación con los diseños anteriores. Ahora no requieren ninguna adaptación ad-hoc (por ejemplo, en términos de colocación de conectores) o soldadura durante toda la cirugía, lo que elimina las posibles causas de daño del implante y la variación impredecible en la calidad del implante. En cambio, el implante DREAM proporciona múltiples variaciones estandarizadas del anillo de corona que permiten colocar cada conector en una de las cuatro posiciones predefinidas, minimizando la variabilidad y el esfuerzo durante la cirugía. Por último, al optimizar el sistema de implantes para la recuperación de la sonda, el implante DREAM permite a los experimentadores reducir drásticamente el coste y el tiempo de preparación por implante, ya que el micromotor y la sonda pueden recuperarse, limpiarse y reutilizarse juntos.
Para obtener una visión más exhaustiva de las ventajas y desventajas que plantean los diferentes sistemas de implantes, consulte la Tabla 1. Si bien el enfoque presentado aquí generalmente no proporciona el máximo rendimiento en comparación con todas las demás estrategias, por ejemplo, en términos de tamaño, estabilidad o costo, opera en el rango superior en todos estos parámetros, lo que lo hace más fácilmente aplicable a una amplia gama de experimentos.
Tres aspectos del protocolo son particularmente cruciales para adaptarlo a cada caso de uso específico: la constelación de tierra y referencia, la técnica para cementar el microdrive y la validación del implante a través de la grabación neuronal. En primer lugar, al implantar los pines de tierra y de referencia, el objetivo era identificar el punto óptimo entre la estabilidad mecánica/eléctrica y la invasividad. Si bien, por ejemplo, los alambres de plata flotantes incrustados en agar son menos invasivos que los tornillos óseos33, es probable que sean más propensos a desprenderse con el tiempo. El uso de clavijas, junto con el agar, garantiza una conexión eléctrica estable y, al mismo tiempo, tiene la ventaja de ser más fácil de controlar durante la inserción, evitando traumatismos tisulares. Es poco probable que los clavos de tierra cementados al cráneo se desprendan, y en el caso de que el cable se separe del clavo, la reconexión suele ser sencilla debido a la mayor superficie y la estabilidad del clavo implantado.
Tabla 2: Comparación de los pesos de los componentes entre el implante DREAM y el implante descrito por Vöröslakos et al.21. Haga clic aquí para descargar esta tabla.
En segundo lugar, la cementación del microimpulsor generalmente debe ocurrir antes de la inserción de la sonda en el cerebro. Esto evita el movimiento lateral de la sonda dentro del cerebro si el micromotor no está perfectamente fijado en el soporte estereotáctico durante la inserción. Para comprobar la ubicación de la sonda antes de cementar el micromotor en su lugar, se puede bajar brevemente la punta del vástago de la sonda para determinar dónde entrará en contacto con el cerebro, ya que extrapolar la posición de aterrizaje puede ser difícil dado el cambio de paralaje del microscopio. Una vez establecida la posición del microdrive, se puede proteger opcionalmente la craneotomía con elastómero de silicona antes de cementar el microdrive para garantizar que el cemento no entre accidentalmente en contacto con la craneotomía; Sin embargo, no se recomienda bajar la sonda a través del elastómero de silicona, ya que los residuos de elastómero de silicona pueden entrar en el cerebro y causar inflamación y gliosis.
En tercer lugar, dependiendo del protocolo experimental utilizado, un registro de la prueba directamente después de la cirugía puede ser útil o no. En gran medida, la actividad neuronal registrada justo después de la inserción de la sonda no será directamente representativa de la actividad registrada crónicamente, debido a factores como la hinchazón transitoria del cerebro y el movimiento del tejido alrededor de la sonda, lo que significa que es poco probable que tanto la profundidad de inserción como las formas de onda de los picos se estabilicen directamente. Como tal, las grabaciones inmediatas pueden servir principalmente para determinar la calidad general de la señal y la integridad del implante. Se recomienda utilizar el trineo móvil de microimpulsión en los días posteriores a la cirugía, una vez que el cerebro se haya estabilizado para ajustar la posición. Esto también ayuda a evitar que la sonda se mueva más de 1000 μm por día, lo que minimiza el daño al sitio de registro y, por lo tanto, mejora la longevidad del sitio de registro.
Por último, es posible que los usuarios deseen adaptar el sistema para grabar desde más de una ubicación de destino. Como este sistema es modular, el usuario tiene mucho margen de maniobra sobre cómo ensamblar y colocar los componentes en relación entre sí (ver arriba y la Figura complementaria 3 y la Figura complementaria 4). Esto incluye modificaciones que permitirían montar una lanzadera extendida horizontalmente en el microaccionamiento, lo que permitiría implantar múltiples sondas o grandes sondas de vástago múltiple, así como la implantación de múltiples microaccionamientos individuales (consulte la Figura complementaria 3 y la Figura complementaria 4). Dichas modificaciones solo requieren el uso de un anillo de corona adaptado, con un mayor número de zonas de montaje para conectores/placas de interfaz/cabeceras. Sin embargo, las limitaciones de espacio de este diseño están dictadas por el modelo animal, en este caso, el ratón, lo que hace que el apilamiento de varias sondas en un microdisco sea más atractivo en términos de espacio que la implantación de varios microdiscos de forma independiente entre sí. Los microaccionamientos utilizados aquí pueden soportar sondas apiladas y, por lo tanto, la única limitación real es el número de cabeceras o conectores que pueden ajustarse a las restricciones de espacio y peso definidas por el modelo animal. Los espaciadores también se pueden utilizar para aumentar aún más las rutas de montaje e inserción no verticales.
En conclusión, este protocolo permite la implantación económica, ligera y, lo que es más importante, ajustable de una sonda, con la ventaja añadida de un diseño de microaccionamiento que prioriza la recuperación de la sonda. Esto aborda los problemas del costo prohibitivo de las sondas de un solo uso, la alta barrera de las habilidades quirúrgicas y de implantación, así como el hecho de que las soluciones comerciales para la implantación crónica a menudo son difíciles de adaptar a casos de uso únicos. Estos problemas plantean un punto débil para los laboratorios que ya utilizan electrofisiología aguda y un elemento disuasorio para aquellos que aún no realizan experimentos de electrofisiología. Este sistema tiene como objetivo facilitar la adopción más amplia de la investigación en electrofisiología crónica más allá de estas limitaciones.
Divulgaciones
TS, AN y MNH son cofundadores de 3Dneuro B.V., que fabrica los microdrives de código abierto y las coronas de Faraday utilizados en este protocolo. FB y PT forman parte del consejo asesor científico de 33Dneuro B.V. FB y PT no reciben ninguna compensación económica por este puesto.
Agradecimientos
Este trabajo contó con el apoyo del Consejo Holandés de Investigación (NWO; Programa Crossover 17619 "INTENSE", TS) y ha recibido financiación del Séptimo Programa Marco de la Unión Europea (FP7/2007-2013) en virtud del acuerdo de subvención nº 600925 (Neuroseeker, TS, FB, PT), así como de la Sociedad Max Planck.
Materiales
| Name | Company | Catalog Number | Comments |
| 0.05" Solder Tail Socket | Mill-Max | 853-93-100-10-001000 | |
| 1,1'-dioctadecyl-3,3,3',3'- Reagent tetramethylindocarbocyanine perchlorate ('DiI'; DiIC18(3)) | ThermoFisher | D282 | Lipophilic dye used for easier histological verification of the probe location |
| Adhesive Putty (Blu-Tack) | Bostik | 308590110 | Variations (e.g. by Pritt) should be available in your stationary store |
| Agar | Sigma Aldrich | A1296 | Make with saline for conductivity. |
| Amplifier (Miniamp-64) | Cambridge Neurotech | Miniature and implantable amplifier and digitiser. Alternative Implantable digitiser, or implantable Omnetics connector use possible. | |
| Analgesic Cream (EMLA Cream) | Aspen | 39699/0088 | Analgesic cream used for operative pain containing prilocaine, lidocaine. |
| Angled Spacer | 3DNeuro | Angled spacer for non-perpendicular drive mounting.. Open souce, also available at https://github.com/zero-noise-lab/dream-implant/ | |
| Blue light curing LED | B.A. International | 818223 | Curing light for primer polymerisation. 420-480 nm wavelength |
| Bone wax | SMI | Z046 | Wax to protect craniotomy and probe post surgery. |
| Buprenorphine | Elanco Europe LTD | 401513 | Injectable Buprenorphine solution (0.3 mg/mL) |
| Copper mesh | Dexmet | 3CU6-050FA | Copper mesh used to electrically and physically shield probe and craniotomy. |
| Cyanoacrylate glue (Loctite) | Loctite | 1363589 | Cyanoacrylate gel glue |
| Dental Cement (SuperBond C&B) | Sun Medical | K058E | Dental cement (SuperBond) |
| Depilation Cream (Veet) | Veet | 310000091434 | Hair removal cream for removal of hair around surgical site. |
| Enrofloxacin (Baytril) | Elanco Europe LTD | 00879/4117 | Injectable enrofloxacin solution (25 mg/mL) |
| Faraday crown | 3DNeuro | 3D printed implantable protective cage. Open souce, also available at https://github.com/zero-noise-lab/dream-implant/ | |
| Faraday ring | 3DNeuro | 3D printed implantable protective ring for faraday cage. Open souce, also available at https://github.com/zero-noise-lab/dream-implant/ | |
| Haemostatic Sponge | SMI | ZHG101010 | Absorbable gelatin haemostatic sponge |
| Heat Shrink Tubing | HellermannTyton | TA32-9/3 BK | Heat Shrink tubing for making soft tipped forceps |
| Iodine | Braunol | 9322507 | Aqueous povidone-iodine solution. |
| Metamizole (Novalgin) | Sanofi-Aventis Gmbh | 4527098 | Injectable Metamizole (500mg/mL) |
| Metamizole (Novalgin) | Sanofi-Aventis Gmbh | 1553758 | Metamizole solution |
| Microdrive (R2Drive) | 3DNeuro | Recoverable Metal micro drive with moveable shuttle. Open souce, also available at https://buzsakilab.github.io/ 3d_print_designs/ | |
| Mineral Oil | Sigma-Aldrich | M5310-100ML | Oil used as solvent to create craniotomy protection gel. |
| Non-Shedding Wipes (Kimtech) | Kimtech | 7552 | Non-shedding wipes |
| Primer | Bisco | B-7202P | Universal skull adhesive preventing moisture from deteriorating the cement and providing a solid base to build up cement onto. |
| R2Drive holder | 3DNeuro | Stereotactic attachment for mounting R2Drive. Open souce, also available at https://buzsakilab.github.io/ 3d_print_designs/ | |
| Self-adherent wrap | 3M | VB050 | Protective wrap for implant post surgery |
| Silicon probe (H2) | Cambridge Neurotech | Chronically implantable linear silicon probe with 32 channels. Alternative Probe use possible. | |
| Silicone Elastomer (Duragel) | Cambridge Neurotech | Silicone Elastomer | |
| Silicone Plaster (Kwikcast) | WPI | KWIK-CAST | |
| Silver conductive epoxy | MG Chemicals | 8331D-14G | Silver epoxy |
| Size 5 Dumont forceps | FSTools | 11251-10 | Small forceps for lifting bone flap. |
| Stainless steel wire, Teflon coated | Science Products GmBH | SS-3T | Ground wire |
| Stereotax (RWD) | RWD | 68803 | Stereotax for surgical procedures on mice. |
| Tergazyme | Alconox | 1304 | A possible enzymatic cleaner to clean probe |
| Two Part Fast setting Epoxy Resin | Gorilla | EP3 | Epoxy for permanent bonding of DREAM implant parts. |
| Vannas Spring Scissors Round Handle | FSTools | 15403-08 | 0.075mm straight tipped spring rebound veterinary scissors. |
| Veterinary Cyanoacrylate glue (Vetbond) | 3M | 70-0068-5256-3 | Veterinary cyanoacrylate glue |
Referencias
- Epsztein, J., Brecht, M., Lee, A. K. Intracellular determinants of hippocampal CA1 place and silent cell activity in a novel environment. Neuron. 70 (1), 109-120 (2011).
- Okun, M., et al. Diverse coupling of neurons to populations in sensory cortex. Nature. 521 (7553), 511-515 (2015).
- Jun, J. J., et al. Fully integrated silicon probes for high-density recording of neural activity. Nature. 551 (7679), 232-236 (2017).
- Znamenskiy, P., Kim, M. -. H., Muir, D. R., Iacaruso, M. F., Hofer, S. B., Mrsic-Flogel, T. D. Functional specificity of recurrent inhibition in visual cortex. Neuron. 112 (6), 991-1000 (2024).
- Rowland, J. M., et al. Propagation of activity through the cortical hierarchy and perception are determined by neural variability. Nat Neurosci. 26 (9), 1584-1594 (2023).
- Roth, M. M., Dahmen, J. C., Muir, D. R., Imhof, F., Martini, F. J., Hofer, S. B. Thalamic nuclei convey diverse contextual information to layer 1 of visual cortex. Nat Neurosci. 19 (2), 299-307 (2016).
- Zong, W., et al. Large-scale two-photon calcium imaging in freely moving mice. Cell. 185 (7), 1240-1256 (2022).
- Demas, J., et al. High-speed, cortex-wide volumetric recording of neuroactivity at cellular resolution using light beads microscopy. Nat Methods. 18 (9), 1103-1111 (2021).
- Buzsáki, G., Anastassiou, C. A., Koch, C. The origin of extracellular fields and currents EEG, ECoG, LFP and spikes. Nat Rev Neurosci. 13 (6), 407-420 (2012).
- Polikov, V. S., Tresco, P. A., Reichert, W. M. Response of brain tissue to chronically implanted neural electrodes. J Neurosci Methods. 148 (1), 1-18 (2005).
- Savya, S. P., et al. In vivo spatiotemporal dynamics of astrocyte reactivity following neural electrode implantation. Biomaterials. 289, 121784 (2022).
- Perge, J. A., et al. Intra-day signal instabilities affect decoding performance in an intracortical neural interface system. J Neural Eng. 10 (3), 036004 (2013).
- Pachitariu, M., Steinmetz, N., Kadir, S., Carandini, M., Harris, K. D. Kilosort: realtime spike-sorting for extracellular electrophysiology with hundreds of channels. bioRxiv. , 061481 (2016).
- Buzsáki, G. Large-scale recording of neuronal ensembles. Nat Neurosci. 7 (5), 446-451 (2004).
- Kloosterman, F., et al. Micro-drive array for chronic in vivo recording: Drive fabrication. J Vis Exp. (26), e1094 (2009).
- Jacobs, T., Darch, H., Holtzman, T., De Zeeuw, C. I., Romano, V. Standard operating protocol: Implantation of Cambrige NeuroTech chronic silicon probe and mini-amp-64 digital headstage in mice. Protocol Exchange. , (2023).
- Juavinett, A. L., Bekheet, G., Churchland, A. K. An adaptable, reusable, and light implant for chronic Neuropixels probes. bioRxiv. , (2024).
- Kozai, T. D. Y., Jaquins-Gerstl, A. S., Vazquez, A. L., Michael, A. C., Cui, X. T. Brain tissue responses to neural implants impact signal sensitivity and intervention strategies. ACS Chem Neurosci. 6 (1), 48-67 (2015).
- Nguyen, D. P., et al. Micro-drive array for chronic in vivo recording: tetrode assembly. J Vis Exp. (26), e1098 (2009).
- Biran, R., Martin, D. C., Tresco, P. A. Neuronal cell loss accompanies the brain tissue response to chronically implanted silicon microelectrode arrays. Exp Neurol. 195 (1), 115-126 (2005).
- Vöröslakos, M., Petersen, P. C., Vöröslakos, B., Buzsáki, G. Metal microdrive and head cap system for silicon probe recovery in freely moving rodent. eLife. 10, e65859 (2021).
- . IMEC Neuropixels 1.0 User Manual V1.0.8 Available from: https://www.neuropixels.org/_files/ugd/328966_ca209d53ffb346b3bf98be39b903efa9.pdf (2023)
- Baranauskas, G., et al. Carbon nanotube composite coating of neural microelectrodes preferentially improves the multiunit signal-to-noise ratio. J Neural Eng. 8 (6), 066013 (2011).
- Niell, C. M., Stryker, M. P. Modulation of visual responses by behavioral state in mouse visual cortex. Neuron. 65 (4), 472-479 (2010).
- Okun, M., Carandini, M., Harris, K. D. Long term recordings with immobile silicon probes in the mouse cortex. bioRxiv. , (2015).
- Chung, J., Sharif, F., Jung, D., Kim, S., Royer, S. Micro-drive and headgear for chronic implant and recovery of optoelectronic probes. Sci Rep. 7 (1), 2773 (2017).
- Bimbard, C., et al. An adaptable, reusable, and light implant for chronic Neuropixels probes. bioRxiv. , (2024).
- Jones, E. A. A. Chronic recoverable Neuropixels in mice. protocols.io. , (2023).
- . Neuronexus Products - dDrive Available from: https://www.neuronexus.com/products/accessories/microdrives/ddrive/ (2024)
- van Daal, R. J. J., et al. Implantation of Neuropixels probes for chronic recording of neuronal activity in freely behaving mice and rats. Nat Protoc. 16 (7), 3322-3347 (2021).
- Guo, Z. V., et al. Procedures for behavioral experiments in head-fixed mice. PLoS One. 9 (2), e88678 (2014).
- Groblewski, P. A., et al. A standardized head-fixation system for performing large-scale, in vivo physiological recordings in mice. J Neurosci Methods. 346, 108922 (2020).
- Vasilev, D., Raposo, I., Totah, N. K. Brightness illusions evoke pupil constriction preceded by a primary visual cortex response in rats. Cereb Cortex. 33 (12), 7952-7959 (2023).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados