Method Article
L’implant DREAM : un système d’implant léger, modulaire et économique pour l’électrophysiologie chronique chez les souris fixées à la tête et au comportement libre
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Ici, nous présentons un système d’implant de sonde léger et rentable pour l’électrophysiologie chronique chez les rongeurs, optimisé pour la facilité d’utilisation, la récupération de la sonde, la polyvalence expérimentale et la compatibilité avec le comportement.
Résumé
Les enregistrements électrophysiologiques chroniques chez les rongeurs ont considérablement amélioré notre compréhension de la dynamique neuronale et de leur pertinence comportementale. Cependant, les méthodes actuelles d’implantation chronique de sondes présentent des compromis importants entre le coût, la facilité d’utilisation, la taille, l’adaptabilité et la stabilité à long terme.
Ce protocole introduit un nouveau système d’implantation de sonde chronique pour les souris appelé DREAM (Dynamic, Recoverable, Economical, Adaptable, and Modular), conçu pour surmonter les compromis associés aux options actuellement disponibles. Le système fournit une solution légère, modulaire et rentable avec des éléments matériels standardisés qui peuvent être combinés et implantés en quelques étapes simples et explantés en toute sécurité pour la récupération et la réutilisation multiple des sondes, réduisant ainsi considérablement les coûts expérimentaux.
Le système d’implant DREAM intègre trois modules matériels : (1) un micromoteur capable de transporter toutes les sondes en silicium standard, ce qui permet aux expérimentateurs d’ajuster la profondeur d’enregistrement sur une distance de déplacement allant jusqu’à 7 mm ; (2) une conception tridimensionnelle (3D) imprimable en 3D et open-source pour une cage de Faraday portable recouverte d’un treillis de cuivre pour le blindage électrique, la protection contre les chocs et le placement des connecteurs, et (3) un système de fixation de la tête miniaturisé pour améliorer le bien-être des animaux et la facilité d’utilisation. Le protocole chirurgical correspondant a été optimisé en termes de vitesse (durée totale : 2 h), de sécurité de la sonde et de bien-être animal.
Les implants ont eu un impact minimal sur le répertoire comportemental des animaux, étaient facilement applicables dans des contextes de mouvement libre et de tête fixe, et ont fourni des formes d’onde de pointe clairement identifiables et des réponses neuronales saines pendant des semaines de collecte de données post-implant. Les infections et autres complications chirurgicales étaient extrêmement rares.
En tant que tel, le système d’implant DREAM est une solution polyvalente et rentable pour l’électrophysiologie chronique chez la souris, améliorant le bien-être des animaux et permettant des expériences plus solides sur le plan esthétique. Sa conception simplifie les procédures expérimentales pour répondre à divers besoins de recherche, augmentant ainsi l’accessibilité de l’électrophysiologie chronique chez les rongeurs à un large éventail de laboratoires de recherche.
Introduction
L’électrophysiologie avec des sondes en silicium implantées de manière chronique est apparue comme une technique puissante pour étudier l’activité neuronale et la connectivité chez les animaux, en particulier chez les souris, en raison de leur traçabilité génétique et expérimentale1. Les sondes en silicium laminaire, en particulier, se sont avérées être un outil inestimable pour identifier les relations fonctionnelles au sein des colonnes corticales2 et pour relier la dynamique de grandes populations neuronales au comportement d’une manière qui était impossible auparavant3.
Deux approches complémentaires sont les références actuelles pour l’enregistrement de l’activité neuronale in vivo : la microscopie à deux photons 4,5 et l’électrophysiologie extracellulaire6. Le choix de la méthodologie d’enregistrement limite la nature des lectures qui peuvent être obtenues : la microscopie à deux photons est particulièrement bien adaptée aux études longitudinales de neurones identifiables individuellement dans de grandes populations au fil du temps, mais souffre de coûts d’équipement élevés et se limite aux couches superficielles du cortex dans les cerveaux intacts. De plus, la résolution temporelle typique de ~30 Hz limite sa capacité à capturer la dynamique neuronale en cours 7,8.
En revanche, les enregistrements électrophysiologiques offrent une résolution temporelle élevée (jusqu’à 40 kHz) pour suivre l’activité neuronale à chaque instant, peuvent être largement appliqués à toutes les espèces ainsi qu’à toutes les profondeurs corticales, et ont des configurations relativement peu coûteuses par rapport à la microscopie à deux photons. Cependant, l’identification des neurones individuels, ainsi que le suivi longitudinal des populations neuronales, sont difficiles à réaliser. Cela s’applique en particulier aux fils-électrodes, par exemple les tétrodes, et aux insertions d’électrodes aiguës. En plus de ne pas être capable de suivre les neurones au cours des sessions d’enregistrement9, les insertions aiguës répétées provoquent un traumatisme local10 qui déclenche une réponse immunitaire11, augmentant ainsi le risque d’infection et de gliose. Cela réduit finalement la stabilité de l’activité neuronale enregistrée et l’espérance de vie des animaux de laboratoire, limitant la portée des études longitudinales comportant des enregistrements électrophysiologiques aigus à quelques jours12.
Les enregistrements chroniques de sondes en silicium à haute densité visent à combiner certains des meilleurs attributs de l’électrophysiologie aiguë et de l’imagerie à deux photons. Ils peuvent suivre la dynamique des populations neuronales d’une session à l’autre, avec seulement une capacité quelque peu réduite à identifier des neurones individuels par rapport à l’imagerie à deux photons13. Ces enregistrements offrent une grande flexibilité dans le placement spatial et une résolution temporelle précise des signaux enregistrés, ainsi qu’une longévité et un bien-être améliorés des animaux de laboratoire par rapport aux enregistrements aigus14. De plus, contrairement aux enregistrements aigus, l’électrophysiologie chronique ne nécessite qu’un seul événement d’implantation, ce qui réduit efficacement le risque d’infection et de lésions tissulaires et minimise le stress sur les animaux15. Collectivement, ces avantages font de l’électrophysiologie chronique un outil puissant pour étudier l’organisation et le fonctionnement du système nerveux.
Cependant, les techniques d’implantation chronique couramment utilisées pour les souris contraignent les chercheurs à faire des compromis importants entre la compatibilité avec les enregistrements comportementaux, le poids de l’implant, la reproductibilité des implants, les coûts financiers et la facilité d’utilisation globale. De nombreux protocoles d’implants ne sont pas conçus pour faciliter la réutilisation des sondes16, ce qui augmente considérablement le coût effectif des expériences individuelles et rend ainsi financièrement difficile pour certains laboratoires l’utilisation de l’électrophysiologie chronique. De plus, ils nécessitent souvent un travail de prototypage et de conception interne approfondi, pour lequel l’expertise et les ressources ne sont peut-être pas présentes.
D’autre part, les systèmes d’implants intégrés17 offrent une solution plus largement accessible pour l’électrophysiologie chronique chez les rongeurs. Ces systèmes sont conçus pour intégrer un microvariateur maintenant la sonde avec le reste de l’implant afin de simplifier la manipulation de l’implant et les procédures chirurgicales. Cependant, une fois implantés, ces systèmes peuvent être lourds et limiter la capacité de l’expérimentateur à adapter de manière flexible une expérience à différentes coordonnées cibles. Souvent, leur poids empêche les implants chez les animaux plus petits, altère potentiellement les mouvements des animaux et induit un stress18. Cela peut affecter de manière disproportionnée la recherche sur les cohortes de jeunes et de femmes, car les limitations de poids sont plus susceptibles d’affecter ces groupes.
De plus, tous les systèmes intégrés ne permettent pas d’ajuster les positions des électrodes après l’implantation. Ceci est pertinent, car la gliose ou la cicatrisation due à l’insertion de la sonde19, en particulier dans les 48 premières heures après l’implantation20, peut réduire la qualité de l’activité neuronale enregistrée. Des micro-ajustements de la profondeur d’insertion de la sonde peuvent limiter ces effets négatifs sur l’intégrité du signal. Par conséquent, les mécanismes de micropositionnement, communément appelés micromoteurs, peuvent être bénéfiques même dans les sondes avec un grand nombre d’électrodes réparties sur toute leur longueur.
Pour surmonter ces compromis, nous introduisons un nouveau système d’implant électrophysiologique chronique pour les souris qui répond aux limites des conceptions précédentes en offrant une solution légère, rentable et modulaire. Le système d’implant DREAM est conçu pour peser moins de 10 % (~2,1 g) du poids corporel typique d’une souris, garantissant le bien-être des animaux et un impact minimal sur le comportement. La validation de la conception de l’implant DREAM montre un impact minimal sur les indicateurs clés du comportement tels que la locomotion - qui peuvent être considérablement affectés chez les rongeurs lorsque des charges sont placées sur le crâne. Cela peut profiter aux paradigmes expérimentaux qui utilisent des animaux se déplaçant librement et avec la tête fixe en améliorant le bien-être des animaux et en permettant des expériences plus solides sur le plan esthétique.
Le système comprend un micromoteur pour un réglage flexible de la profondeur d’enregistrement jusqu’à 7 mm et peut être adapté à différents types de sondes et d’appareils d’enregistrement, offrant aux chercheurs un outil rentable et polyvalent pour diverses applications expérimentales. Le système est systématiquement associé à un micro-entraînement métallique21, qui offre une récupération de sonde cohérente par rapport à d’autres systèmes (taux de récupération moyen attendu : environ trois réutilisations fiables par sonde) et réduit considérablement le coût des expériences individuelles.
La conception comprend une cage de protection de Faraday imprimée en 3D, permettant une protection bon marché mais robuste contre le bruit électrophysiologique, les impacts mécaniques et les matériaux infectieux, permettant des enregistrements stables et sans bruit qui souffrent de taux d’infection minimes. Cette cage implantable se compose de ce que l’on appelle la « couronne », conçue pour la protection contre les chocs et pour fournir une structure pour le revêtement en treillis métallique conducteur de la cage de Faraday, et l’anneau de couronne, qui sert de support pour un amplificateur implantable et/ou un connecteur de sonde (voir Figure 1).
Enfin, les plaques de tête incluses dans le système d’implant modulaire sont conçues pour être compatibles avec un système de fixation de tête nouveau et efficace sans ajouter de volume supplémentaire à l’implant. Contrairement à d’autres systèmes existants, il ne nécessite pas de serrer de petites vis à proximité de l’implant, d’accélérer la fixation des souris dans le dispositif expérimental et d’améliorer la relation entre l’expérimentateur et l’animal, ainsi que l’adhésion comportementale. Dans le même temps, la plaque frontale sert de base sur laquelle construire les autres modules du système d’électrophysiologie chronique DREAM.
Les fichiers de conception de l’implant DREAM sont publiés en tant que matériel open source sur https://github.com/zero-noise-lab/dream-implant/. Dans les sections suivantes, la conception et la fabrication du système d’implant DREAM seront décrites, sa mise en œuvre réussie dans un modèle de souris sera démontrée, et ses applications et avantages potentiels par rapport aux systèmes existants seront discutés.
Protocole
Toutes les procédures expérimentales ont été menées conformément aux directives institutionnelles de la Société Max Planck et approuvées par le comité d’éthique du gouvernement local (Beratende Ethikkommission nach §15 Tierschutzgesetz, Regierungspräsidium Hessen, Code d’approbation du projet : F149-2000).
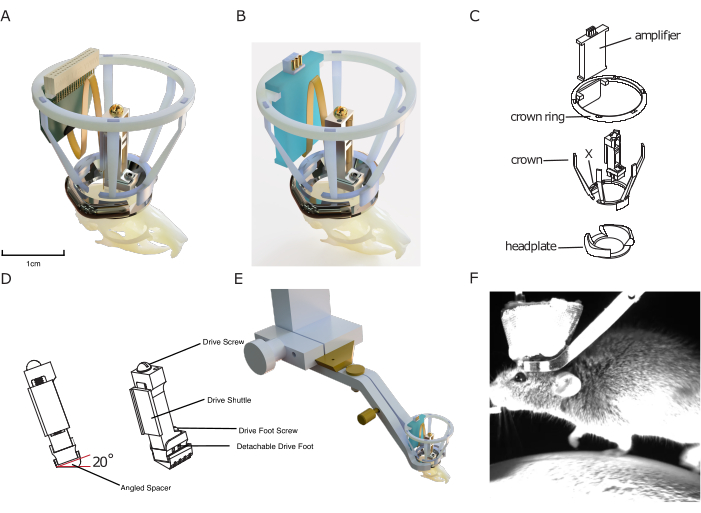
Figure 1 : Conception de l’implant. (A) Rendu 3D de l’implant superposé sur un crâne de souris avec une sonde en silicium connectée à un connecteur de sonde. L’ouverture centrale de la plaque de tête est d’environ 10 mm pour l’échelle. La hauteur de l’entraînement est d’environ 17 mm. Le treillis de cuivre qui forme l’extérieur de la couronne de Faraday, ainsi que les fils de terre/ref, ne sont pas montrés. (B) Identique à (A) avec une connexion à une carte d’amplification au lieu d’un connecteur de sonde. (C) Dessin technique éclaté de l’implant, montrant ses composants. (D) Rendu d’une entretoise coudée qui peut être implantée sous un micromoteur, permettant d’implanter systématiquement le micromoteur à un angle prédéfini (ici : 20°). (E) Rendu du mécanisme de fixation de la tête intégré, montrant la plaque de tête implantée avec la couronne de Faraday avec la pince de fixation de la tête environnante et la connexion en queue d’aronde à installer. (F) Image d’une souris fixée sur un tapis roulant à l’aide du mécanisme de fixation de la tête intégré de l’implant. Veuillez cliquer ici pour voir une version agrandie de cette figure.
REMARQUE : Les sections 1 et 2 traitent des préparations préopératoires
1. Préparation de la sonde en silicium
- En cas de réutilisation de la sonde, nettoyez la sonde en silicone selon les recommandations du fournisseur de la sonde. Trempez la sonde dans un nettoyant enzymatique (voir tableau des matériaux) pendant 5 à 10 min, puis rincez-la à l’eau déminéralisée. Faites-le le plus rapidement possible après l’explantation. Un jour avant la (ré)implantation, faites tremper la sonde dans de l’éthanol à 70 % pendant au moins 30 min pour la désinfection.
- Mesurez les impédances des canaux pour vous assurer qu’elles sont conformes aux spécifications du signal enregistré. Suivez le protocole de test des niveaux de bruit du manuel d’utilisation de Neuropixels22, mesurez l’impédance via le logiciel d’enregistrement souhaité (par exemple, https://open-ephys.github.io/gui-docs/User-Manual/Plugins/Acquisition-Board.html#impedance-testing) et suivez les impédances du canal cible du fabricant de la sonde en silicium ou de la fiche technique. Si les impédances sont trop élevées, envisagez de recouvrir les sites d’électrodes23.
- Soudez une douille de queue de soudure de 0,05" (voir le tableau des matériaux) au fil de terre (GND) de la sonde. Connectez la douille à la goupille GND (étape suivante) pendant l’opération.
REMARQUE : Dans ce protocole, une broche de référence séparée (REF) n’est pas utilisée, car GND et REF sont court-circuitées sur le garde-corps utilisé. Par conséquent, seule la broche GND sera mentionnée dans le reste du protocole. Si une REF distincte est utilisée, répétez l’étape suivante pour la broche REF. - Pour préparer la broche GND, insérez à plusieurs reprises le côté broche d’une douille de queue de soudure de 0,05 » (voir le tableau des matériaux) dans la douille de queue de soudure GND de 0,05 » jusqu’à ce que l’insertion se fasse sans effort. L’utilisation d’épingles plaquées or peut réduire le besoin de cette étape de lissage. Cela garantit que la goupille et la douille GND peuvent être facilement connectées pendant l’opération sans qu’il soit nécessaire d’appliquer une pression excessive, réduisant ainsi le risque de blessures à l’animal et d’endommagement de la sonde.
- Si un préamplificateur implantable pour la sonde en silicium est utilisé, préparez-le à l’implantation chronique en suivant les procédures du fournisseur. Fixez ensuite l’amplificateur/connecteur à l’anneau de la cage de Faraday à l’aide d’un enduit de silicone pour le coller à la zone de l’anneau de Faraday conçue pour maintenir l’amplificateur (voir Figure 1).
REMARQUE : La préparation du préamplificateur implantable pour la sonde en silicium pour une implantation chronique selon les procédures du fournisseur peut inclure un revêtement en silicone ou en époxy pour éviter que l’humidité n’endommage l’électronique, ainsi que l’accouplement répété du connecteur de l’amplificateur pour réduire la force d’accouplement lors de la connexion de l’amplificateur au système d’enregistrement pendant les enregistrements. Ceci est particulièrement utile pour les utilisateurs d’Omnetics.
2. Préparation du micromoteur et du harnais
- Tournez la vis sur le corps du micro-entraînement de sorte que la navette du micro-entraînement soit presque entièrement rétractée vers le haut.
- En option, fixez une entretoise coudée (voir Figure 1D) au bas du micromoteur avec de la colle cyanoacrylate ou du ciment dentaire, qui peut être utilisé pour permettre l’utilisation d’un degré spécifique d’inclinaison, par exemple, lors de l’enregistrement à travers des couches corticales dans une région du sillon central, ou à l’intérieur de structures profondes qui peuvent nécessiter une approche non perpendiculaire (pour l’espaceur coudé, voir la table des matériaux).
- Posez le microdisque horizontalement sur le support du microdisque (Figure supplémentaire 1).
- Placez un petit morceau de mastic adhésif (voir tableau des matériaux) sur le support de microdisque à une distance au-dessus du microdisque où le connecteur de l’étage de tête sera placé. Cette distance dépend de la longueur du câble flexible qui relie la sonde en silicone au connecteur de la tête de toit.
- Placez une petite goutte de pansement en silicone (voir tableau des matériaux) sur la navette.
- Sortez la sonde en silicone de son emballage à l’aide d’une pince à pointe souple et émoussée. Fabriquez-les en recouvrant une pince à bec effilé standard d’une gaine thermorétractable de 3 mm de diamètre (voir le tableau des matériaux). Placez d’abord la sonde avec le câble flexible sur la navette du micromoteur, de sorte que le bord inférieur du câble flexible pende légèrement au-dessus du bord inférieur de la navette du micromoteur.
- Tirez doucement le câble flexible vers le haut du microdisque jusqu’à ce que le bord inférieur du câble flexible rencontre le bord inférieur de la navette du microdisque. Assurez-vous de pousser le câble flexible contre le bord gauche de la navette du microdrive pendant cette étape afin qu’il soit placé exactement verticalement sur le microdrive à la fin. À ce stade, assurez-vous que les tiges de la sonde en silicone ne dépassent pas (ou seulement de manière minimale) le bord inférieur du micromoteur (en fonction de la longueur exacte des tiges de la sonde et de la profondeur de la zone cérébrale ciblée).
- Placez le connecteur de tête de la sonde sur le mastic adhésif en haut du support pour protéger la sonde contre les chutes.
- À l’aide d’une aiguille de seringue de 27 G, appliquez une petite goutte de colle cyanoacrylate (voir le tableau des matériaux) entre le câble flexible et la navette pour fixer la sonde en place. Assurez-vous que la colle ne coule pas sur le microdisque ou le long du câble flexible au-delà de la navette (c’est très important)
- Une fois le câble flexible collé en position, fixez l’amplificateur à l’anneau de la couronne (voir tableau des matériaux) à l’aide d’un enduit silicone. Ensuite, fixez le câble flexible à l’amplificateur et recouvrez la connexion et le câble d’une fine couche de plâtre de silicone.
- Après 5 min, lorsque le pansement est pris, rangez le micro-entraînement et sondez en toute sécurité jusqu’à nouvel ordre.
- Coupez des morceaux de treillis de cuivre (voir le tableau des matériaux) en forme de beignet ouvert (voir le modèle de coupe dans la figure supplémentaire 2) pour couvrir la cage de Faraday.
- Fixez la découpe du treillis de cuivre sur la cage de Faraday avec de petites gouttes de résine époxy (voir le tableau des matériaux). Pour cette étape, on peut également remplacer l’époxy par du ciment dentaire.
REMARQUE : La cage de Faraday contient un espace pour loger un connecteur de sonde ou un amplificateur. Cet espace est marqué d’un X dans le fichier de conception, et il contient une base de support pour l’amplificateur/connecteur, ainsi qu’une plus grande distance entre les deux rayons adjacents de la cage. Pour créer suffisamment d’espace autour de l’amplificateur/connecteur, fixez une petite quantité de maille supplémentaire entre les deux rayons adjacents, créant ainsi une saillie. Cela garantit que l’amplificateur/connecteur peut être positionné ultérieurement dans cette « poche » sans toucher la cage de Faraday. Pour assurer une adhérence sûre avec un minimum de déformation, utilisez l’anneau de couronne placé directement sur la couronne pour maintenir la forme et soutenir les rayons minces de la couronne. De plus, utilisez des mains d’aide à la soudure pour fixer la couronne et le treillis pendant le séchage. Si l’on a du mal à maintenir la forme de la couronne lors de la procédure, essayez de n’époxy que deux des bras de la couronne à la fois pour éviter le gauchissement. - Si une mise à la terre séparée de la cage de Faraday est souhaitée, soudez une petite broche d’en-tête sur un fil de mise à la terre de 30 mm (voir le tableau des matériaux), puis utilisez de l’époxy conducteur pour faire adhérer le fil à la découpe du treillis de cuivre.
REMARQUE : Cette étape n’est pas respectée dans le laboratoire. - À ce stade, conservez les pièces préparées en toute sécurité et effectuez l’opération à un stade ultérieur.
REMARQUE : Les sections 3 à 6 traitent de l’implantation du micromoteur et du harnais.
3. Chirurgie : Préparation de la sonde et de l’espace de travail
- Stérilisez et placez les instruments chirurgicaux dans l’espace de travail chirurgical en suivant une procédure approuvée.
REMARQUE : Cela peut inclure l’utilisation d’un stérilisateur à billes, d’instruments d’autoclave ou d’un rinçage avec du peroxyde à 30 % ou de l’éthanol à 90 %, selon le protocole expérimental approuvé. - Placez le plat en céramique utilisé pour préparer le ciment dentaire dans une glacière, un réfrigérateur ou un congélateur, en suivant les instructions du kit de ciment dentaire (voir le tableau des matériaux). Utilisez le plat en céramique refroidi pendant le mélange du ciment pour augmenter le temps pendant lequel le ciment est malléable. Utilisez un plat refroidi chaque fois que des étapes de cimentation plus longues sont nécessaires.
- Si une vérification histologique de l’emplacement de la sonde à la fin de l’expérience est souhaitée, étendez la sonde en silicium juste avant l’opération en tournant la vis du micromoteur dans le sens inverse des aiguilles d’une montre et appliquez un colorant lipophile (voir le tableau des matériaux) sur la sonde en la trempant dans une petite goutte de colorant. Préparez le colorant lipophile à partir d’une solution mère diluée de diméthylsulfoxyde (DMSO) ou d’éthanol (EtOH) achetée dans le commerce (voir le tableau des matériaux) en le diluant dans un tampon approprié tel que le PBS à une concentration de 1 à 5 μM.
4. Chirurgie : Préparation de l’animal
- Suivez un protocole d’anesthésie approuvé pour une chirurgie des rongeurs de 2 à 4 h dans des conditions aseptiques. Cela peut inclure une anesthésie générale et locale, une analgésie, l’application de pommades oculaires et des injections de solution saline. Ici, utilisez un anesthésique injectable (kétamine 100 [mg/kg]/médétomidine 0,5 [mg/kg]) avec une crème analgésique locale et une pommade oculaire (voir le tableau des matériaux), et placez l’animal sur un coussin chauffant pour réguler la température corporelle.
- Lorsque l’animal est complètement anesthésié, déplacez-le dans une zone de rasage non stérile séparée.
- S’assurer que l’animal est suffisamment réchauffé ; Par exemple, placez-le sur un coussin chauffant. Retirez les poils sur le dessus du crâne. Faites-le avec un rasoir électrique ou une crème épilatoire (voir le tableau des matériaux) ou en rasant à plusieurs reprises le haut de la tête avec un scalpel recouvert d’éthanol à 70 %.
- Enlevez soigneusement les poils lâches pour vous assurer qu’ils n’entrent pas en contact avec les tissus exposés plus tard. Pour épiler, utilisez, par exemple, des mouchoirs mouillés avec de l’éthanol à 70 % et/ou une pompe à bille de compression. Si vous utilisez de la crème dépilatoire, assurez-vous qu’elle est soigneusement éliminée à l’aide de cotons-tiges et d’une solution saline.
- Désinfectez la zone rasée plusieurs fois avec un désinfectant à base d’iode (voir le tableau des matériaux) et de l’alcool à l’aide de cotons-tiges, en vous déplaçant du centre de la tête vers les côtés pour brosser les poils morts restants loin du site d’incision.
- Désinfectez la fourrure sur et autour de la tête à l’aide de bétadine. Cela garantit une zone de travail stérile et protège les instruments et matériaux chirurgicaux contre le contact avec des poils non stériles.
- Placez l’animal dans un cadre stéréotaxique à l’aide de barres d’oreille et d’un porte-nez (voir le tableau des matériaux).
- À l’aide de petits ciseaux chirurgicaux (voir le tableau des matériaux), découpez une ouverture en forme d’amande dans la peau au-dessus du crâne, allant de l’arrière de la suture lambda jusqu’entre les yeux.
- Retirez la membrane sous-cutanée et le périoste en les coupant alors qu’ils sont encore humides, puis grattez le crâne avec une lame de scalpel pour éliminer les tissus mous de la membrane à la surface du crâne qui peuvent entraver l’adhérence du ciment dentaire.
- Facultatif : Une fois que le crâne a été débarrassé du tissu membranaire, appliquez brièvement une fine couche de peroxyde à 0,5 % et lavez-la avec un désinfectant à base d’iode à base d’eau (par exemple, la bétadine) avant de rendre rugueuse la surface du crâne pour améliorer l’adhérence de l’apprêt au crâne.
- Rugueux soigneusement la surface du crâne en grattant un motif entrecroisé avec la pointe du scalpel retournée. Cela aide le ciment dentaire à adhérer au crâne plus tard.
REMARQUE : Ne grattez pas trop vigoureusement sur le dessus des sutures car cela peut provoquer la rupture des sutures et une fuite de liquide intracrânien, ce qui nuit à l’adhérence du ciment dentaire. - Alternez entre la lame du scalpel et les cotons-tiges stériles pour gratter/repousser doucement les muscles du cou attachés aux côtés de la suture lambda jusqu’à ce que les muscles aient été repoussés vers le « bord » du crâne au-dessus du cervelet. Cela aide à minimiser le bruit musculaire dans les enregistrements neuronaux.
- Remplissez une seringue de 1 mL avec une aiguille de 27 g (voir le tableau des matériaux) avec de petites quantités de colle cyanoacrylate chirurgicale (voir le tableau des matériaux). Ensuite, collez la peau sur les bords du crâne à l’aide de la seringue pour étaler de minuscules gouttes de superglue dessus. Collez le tissu aussi plat que possible sur le crâne pour laisser de l’espace pour les implants. Cette procédure garantit que la peau et les muscles n’entrent pas en contact direct avec des parties de l’implant, ce qui évite le bruit musculaire dans les enregistrements et améliore l’adhérence du ciment dentaire.
- Appliquez un apprêt de ciment dentaire sur le crâne pour une adhérence supplémentaire et durcissez à la lumière UV (voir le tableau des matériaux). Cela améliore l’adhérence du ciment dentaire et empêche les sutures crâniennes de fuir et d’affaiblir la liaison crânienne-ciment au fil du temps.
- Trouvez l’emplacement cible pour l’implantation de la sonde par rapport au bregma ou au lambda et tracez le contour de la craniotomie autour de celle-ci avec un marqueur chirurgical. Placez la plaque frontale sur le crâne de manière à ce que la craniotomie se trouve à l’intérieur, avec de l’espace pour le micromoteur d’un côté de la craniotomie, ainsi que pour 1-2 broches de mise à la terre.
- Implantez la plaque frontale à l’aide de ciment dentaire. Mélangez le ciment dentaire dans le plat en céramique refroidi prévu à cet effet (voir étape 3.2). Assurez-vous que la plaque frontale adhère au crâne de tous les côtés, formant un « puits » étanche.
- À l’aide d’une perceuse dentaire (taille US 1/2 HP), percez un petit trou de bavure de la largeur des goupilles d’en-tête préparées à l’étape 1.4 sur la ou les zones cérébrales à utiliser comme GND/REF. Si vous souhaitez mettre à la terre la cage de Faraday, percez un autre petit trou de bavure près du bord de la cage de Faraday pour la goupille d’en-tête Faraday-GND.
REMARQUE : Pour la ou les goupilles d’en-tête GND/REF, placez la craniotomie à une distance suffisante du bord de la cage afin que la goupille d’en-tête elle-même puisse être placée à l’intérieur plus tard sans toucher la cage de Faraday. - Nettoyez la craniotomie en y versant doucement une solution saline stérile à l’aide d’une seringue et en la retirant avec des lingettes anti-mue (voir le tableau des matériaux). Répétez l’opération jusqu’à ce que tout le sang et les tissus lâches soient éliminés.
- Préparez une solution de gélose à 0,7 % (voir le tableau des matières) dans une solution saline, refroidissez-la légèrement et introduisez-la dans la craniotomie à l’aide d’une aiguille de 27 g sur une seringue de 1 ml.
- Insérez doucement une goupille GND (voir étape 1.3) dans chaque craniotomie percée à l’étape précédente. La ou les goupilles seront entourées de gélose de tous les côtés (voir étape 4.17). Appliquez du ciment autour des goupilles de linteau pour les fixer et assurer l’isolation électrique.
- Nettoyez le plat en céramique et remettez-le dans le réfrigérateur/congélateur.
- À l’aide d’une fraise dentaire, percez le contour d’une craniotomie plus grande (circulaire ou carrée) en vous déplaçant autour du bord en mouvements réguliers. Assurez-vous que la craniotomie est de 1 mm x 1 mm à 2 mm x 2 mm pour permettre de petits ajustements à l’emplacement de la sonde afin d’éviter les vaisseaux sanguins sans trop exposer le cortex. Si possible, évitez de placer des craniotomies sur des sutures. Percez en séries de 20 à 30 secondes et refroidissez le crâne avec une solution saline entre les rondes de forage.
REMARQUE : Au début du perçage, il est utile de marquer le bord d’attaque du microdrive avec un marqueur, garantissant ainsi que lors du perçage, une règle droite peut être formée parallèlement au bord d’attaque du microdrive. Cela améliore les chances d’éviter le ciment dans la craniotomie lors de la fixation du micromoteur en place, ainsi que l’amélioration de l’adhérence, évitant le surplomb du micromoteur sur la craniotomie et permettant une plus grande manœuvrabilité latérale lors du placement du micromoteur par rapport à la position finale du site d’enregistrement. - Après quelques premiers cycles de forage, testez la résistance de la partie percée de l’os en appuyant doucement dessus avec des pinces fines (taille 5 ou plus fine ; voir tableau des matériaux).
- Continuez à tester entre les rondes de forage jusqu’à ce que l’os commence à « rebondir » sous la pince lorsqu’il est poussé. Lorsque c’est le cas, ajoutez une goutte de solution saline sur le dessus de la craniotomie pour ramollir l’os, puis utilisez la pince pour retirer délicatement le morceau d’os percé.
- Si l’os ne peut pas être retiré en douceur, effectuez une autre série de forages, en vous concentrant sur les points où l’os est encore plus solidement attaché. En général, essayez de retirer le crâne avec une légère pression de la pince avant qu’il n’ait été entièrement percé, car cela minimise généralement les dommages aux tissus.
REMARQUE : Assurez-vous que la surface de la dure-mère est humidifiée régulièrement, à la fois pendant le forage pour réduire les températures et après le retrait du lambeau osseux. Cela améliore les chances d’insertion facile de la sonde en empêchant la dure-mère de se dessécher et de devenir plus difficile à pénétrer. Si la dure-mère s’avère trop difficile à pénétrer, ou si des sondes émoussées ou à plusieurs tiges sont utilisées, une durotomie est réalisée en soulevant la dure-mère avec une aiguille de 27 G et en effectuant une petite incision sous immersion saline pour éviter que la dure-mère ne colle à la surface du cerveau.
- Couvrez la craniotomie avec une éponge hémostatique (voir le tableau des matériaux) imbibée d’une solution saline fraîche et stérile pour protéger la dure-mère et le cerveau.
5. Chirurgie : implantation de la sonde
- Fixez le support de microdisque personnalisé (voir Tableau des matériaux) au bras de l’appareil stéréotaxique. Si le microdisque a été retiré du support du microdisque après la préparation de la sonde, placez le microdisque avec la sonde en silicium attachée dans le support de microdisque. Inclinez le bras stéréofiscal au besoin pour atteindre la zone cérébrale cible souhaitée. Placez l’anneau de couronne avec l’amplificateur attaché sur les trois broches verticales à l’arrière du support de microdisque (voir Figure supplémentaire 1).
- Abaissez le micromoteur à moins de ~0,5 mm de la craniotomie, puis utilisez une pince pour connecter la ou les broches d’en-tête GND/REF attachées à la sonde à la ou les broches GND/REF correspondantes implantées sur le crâne (voir étapes 4.14-4.15). Voir la figure supplémentaire 3 et la figure supplémentaire 4 pour des exemples d’entraînement, de craniotomie et de placement de broches GND/REF.
- Une fois en place, fixez éventuellement la ou les broches avec une goutte d’époxy d’argent conducteur (voir le tableau des matériaux) pour une connexion plus robuste. Une fois l’époxy d’argent durci, recouvrez les broches connectées d’une petite quantité de ciment dentaire (voir le tableau des matériaux) pour vous assurer que la connexion reste stable sur de longues périodes et qu’il n’y a pas de connexion électrique avec les tissus environnants et/ou les éléments de l’implant.
- Retirez l’éponge hémostatique de la craniotomie (voir étape 4.22).
- Positionnez le bras stéréotaxique avec le micromoteur sur la craniotomie.
REMARQUE : Si la sonde est rétractée, assurez-vous que le microdisque est placé de manière à ce que la sonde touche une partie de la craniotomie qui ne contient pas de gros vaisseaux sanguins. - Abaissez le micromoteur, si nécessaire, en ajustant l’emplacement et l’angle jusqu’à ce que la tige de la sonde touche la dure-mère ou la surface du cerveau (voir étape 4.21) dans la zone cible.
- Mélangez du ciment dentaire dans le plat en céramique désigné (voir étape 3.2) et cimentez la base du micromoteur en place, en vous concentrant sur les trois côtés de la base du micromoteur qui ne font pas face à l’électrode. Assurez-vous que le ciment ne touche pas le micromoteur au-dessus de la « base » amovible (voir Figure 1D).
- Assurez-vous que tout espace entre la base et le crâne est entièrement recouvert de ciment dentaire. Nettoyez le plat en céramique et remettez-le dans le réfrigérateur/congélateur. Attendez que le ciment durcisse, environ 10-15 min.
REMARQUE : Un petit espace est laissé entre la base du micromoteur et le crâne, et le ciment est utilisé sous sa forme la plus fluide pour le remplir. Une fois que le ciment s’est légèrement épaissi, le ciment entre les parois de la base du micro-entraînement et le crâne se développe. De très petites quantités de ciment sont toujours utilisées, car l’écoulement de la substance peut être imprévisible et de plus grands volumes peuvent s’écouler dans des régions indésirables. De petites quantités d’éponge hémostatique trempée dans une solution saline peuvent être utilisées pour couvrir des parties de la craniotomie. Si du ciment devait couler accidentellement sur la craniotomie, retirez le ciment à l’aide d’une pince une fois qu’il entre dans une consistance filmique.
- Assurez-vous que tout espace entre la base et le crâne est entièrement recouvert de ciment dentaire. Nettoyez le plat en céramique et remettez-le dans le réfrigérateur/congélateur. Attendez que le ciment durcisse, environ 10-15 min.
- Abaissez la sonde en silicium sur le cerveau, en surveillant attentivement la position de la sonde à l’aide d’un microscope. Lorsque les tiges de la sonde touchent le cerveau, abaissez rapidement la sonde de ~250 μm (un tour complet de la vis équivaut à 282 μm) pour vous assurer que la sonde perce la résistance de la surface dure-mère/corticale.
- Vérifiez-le visuellement. Si la sonde n’a pas pénétré le cortex, attendez 5 min, puis essayez de graver à travers la dure-mère avec la pointe de la tige en soulevant et en abaissant la sonde à plusieurs reprises de quelques dizaines de micromètres pendant que la dure-mère/le cortex est sous tension à partir de la pointe de la sonde.
- Une fois que la sonde a percé la surface du cortex, abaissez-la progressivement à un rythme plus lent (100-200 μm / min) jusqu’à ce que les coordonnées cibles soient atteintes ou que la sonde se soit déplacée de plus de 1000 μm. Si la cible nécessite que la sonde se déplace de plus de 1000 μm, avancez la sonde par paliers de 1000 μm/session maximum au cours des sessions d’enregistrement suivantes jusqu’à ce que les coordonnées de la cible soient atteintes.
REMARQUE : Sautez cette étape si la surveillance des signaux neuronaux tout en abaissant la sonde en silicium est préférée. Les étapes à suivre pour cela sont décrites à la section 7. - Préparez l’élastomère de silicone selon les instructions (voir le tableau des matériaux) et versez une petite goutte dans la craniotomie à l’aide d’une seringue de 1 mL (voir le tableau des matériaux).
- Une fois sec, recouvrez l’élastomère de silicone d’un mélange 50/50 de cire d’os et d’huile minérale. Cette étape protège davantage la sonde et empêche l’accumulation de débris et de plasma sec sur la craniotomie, ce qui rend l’extraction plus simple et plus sûre. Soyez prudent, car travailler autour de la sonde pendant qu’elle est abaissée peut entraîner une rupture.
6. Chirurgie : Implantation de la cage de Faraday
- Lorsque le ciment dentaire s’est complètement solidifié, desserrez le support du microdisque en desserrant la vis latérale fixant le disque avec une clé Allen (voir la figure supplémentaire 1). Rétractez doucement le support de ~1 cm de sorte que le micromoteur soit autonome, mais que l’amplificateur/connecteur de la sonde reste fixé au support d’implant sans étirer le câble flexible.
- Placez la couronne préfabriquée et le treillis de Faraday autour de la plaque de tête en étirant la cage à l’ouverture et en la fixant horizontalement sur le micromoteur et le câble Flex, puis fixez-la sur la plaque de tête avec du ciment dentaire.
REMARQUE : Assurez-vous de fermer tous les espaces entre la cage de Faraday et le crâne avec du ciment dentaire pour protéger l’implant de la contamination. - Placez l’anneau de couronne Faraday (voir tableau des matériaux) avec le connecteur de sonde/tête sur la couronne, en alignant le support intégré pour l’amplificateur/connecteur de sonde avec la zone marquée d’un « X » dentelé sur la couronne Faraday (voir étape 2.13).
- Fixez l’anneau à la cage de Faraday avec une petite goutte de colle cyanoacrylate ou de ciment dentaire à chaque jonction de l’anneau à rayons.
- Une fois que l’anneau de Faraday avec amplificateur/connecteur de sonde intégré est fixé en place, rétractez complètement le bras stéréotaxique avec le support de microentraînement. Voir la figure supplémentaire 3 pour un guide étape par étape sur l’assemblage de ces composants.
7. Enregistrement des tests post-opératoires
- Connectez l’amplificateur/connecteur de la sonde au matériel d’enregistrement et démarrez un enregistrement.
- Si la sonde n’a pas encore atteint son emplacement cible lors de l’insertion initiale (voir étape 5.9), tournez lentement la vis du micro-entraînement dans le sens inverse des aiguilles d’une montre pour abaisser la sonde tout en surveillant les signaux neuronaux.
REMARQUE : Les signaux doivent changer a) lorsque les électrodes touchent la couche d’élastomère de silicone au-dessus de la craniotomie, et b) lorsque les électrodes commencent à se déplacer dans le cerveau (voir étape 7.2). L’activité neuronale à haute fréquence sera enregistrée par des électrodes qui sont entièrement insérées dans le cerveau, tandis que les électrodes qui sont en contact avec le LCR à la surface du cerveau montreront généralement un signal de population neuronale filtré à faible niveau sans activité de pointe (semblable à une trace EEG), et les sites d’enregistrement dans l’air enregistreront une augmentation du bruit électrique. Il est possible de vérifier en outre la profondeur d’insertion de la sonde en mesurant l’impédance de chaque voie après l’enregistrement du test. Les canaux en contact avec l’air doivent présenter une impédance élevée (indiquant un circuit ouvert) et des impédances similaires à celles mesurées avant la chirurgie pour les canaux touchant le LCR ou déjà dans le cerveau. Faites avancer la sonde en silicium d’une distance totale maximale d’environ 1000 μm par session, avec une vitesse maximale d’environ 75 μm/min (voir étape 5.5). - Lorsque les potentiels de champ local neuronal sont visibles à travers la sonde et/ou que la sonde est avancée d’un maximum de 1000 μm, terminez l’enregistrement du test et débranchez le connecteur de l’étage de tête.
8. Récupération
- Couvrez la cage de Faraday d’un film vétérinaire auto-adhésif (voir le tableau des matériaux).
- Mettez fin à l’anesthésie et laissez l’animal se rétablir pendant quelques jours en suivant les directives expérimentales approuvées.
- Si les électrodes de la sonde en silicium ne sont pas encore à l’endroit cible souhaité, tournez la vis du micro-entraînement par petits pas avec un maximum de quatre tours complets (ou ~1000 μm) par session. Si nécessaire, répétez cette procédure pendant plusieurs jours jusqu’à ce que l’objectif soit atteint. Il est recommandé de combiner le mouvement de la sonde avec des enregistrements simultanés pour évaluer l’activité électrophysiologique dans les zones transversales.
9. Expériences comportementales et enregistrements chroniques
- Pour les enregistrements chroniques fixés sur la tête pendant l’exécution d’une tâche, fixez la plaque de tête à la base de la cage de Faraday à la pince de fixation de la tête en ouvrant manuellement la pince et en serrant la plaque de tête implantée (voir Figure 1C, E, F).
REMARQUE : Si la fixation de la tête n’est pas nécessaire, ce système d’implant peut également être utilisé pour des enregistrements en mouvement libre. Pour des enregistrements en mouvement libre, sautez les étapes 9.1 et 9.7. - Retirez l’enveloppe vétérinaire auto-adhérente de l’implant.
REMARQUE : Pour minimiser l’inconfort pour l’animal, il est suggéré de commencer une tâche comportementale simple et gratifiante avant cette étape comme distraction pendant que l’expérimentateur travaille avec l’implant. - Fixez l’amplificateur/connecteur à l’équipement d’enregistrement.
- Effectuez des enregistrements neuronaux pendant que l’animal effectue la tâche.
REMARQUE : Si l’objectif est de maximiser le nombre d’unités extracellulaires enregistrées, déplacez la navette de quelques dizaines de micromètres chaque fois que le rendement neuronal dans un endroit diminue. Notez qu’après avoir déplacé la sonde, la stabilisation du signal peut prendre de quelques minutes à plusieurs heures. Par conséquent, il peut être avantageux de déplacer la sonde à la fin d’une session afin que le signal puisse récupérer jusqu’au début de la session suivante. - Débranchez l’appareil d’enregistrement et recouvrez l’implant d’un nouvel emballage vétérinaire à la fin de l’enregistrement comportemental.
- Ouvrez la pince de fixation de la tête pour détacher l’animal de la fixation de la tête.
10. Récupération de la sonde
- À la fin de l’enregistrement final, rétractez la sonde en silicium autant que possible sur le micromoteur en tournant la vis dans le sens des aiguilles d’une montre. Faites-le pendant que l’animal a la tête fixe et se comporte ou avec l’animal anesthésié dans la configuration chirurgicale. Tracez la sortie de la sonde du cerveau en surveillant simultanément les signaux neuronaux et en vérifiant la signature des électrodes immergées dans le cerveau, touchant la surface du cerveau ou en contact avec l’air (voir étape 7.3).
REMARQUE : Selon le protocole histologique et la sonde, des lésions électrolytiques sont réalisées avant de rétracter la sonde afin de déterminer l’emplacement exact de certaines électrodes sur la sonde. S’il n’est pas nécessaire de surveiller la sortie de la sonde via l’enregistrement neuronal, il est également possible de rétracter la sonde une fois l’animal terminé. - Éliminez l’animal en suivant les directives approuvées (cela inclut la perfusion de l’animal si la fixation du cerveau pour l’histologie ultérieure est prévue).
- Attendez ~ 10 min après la mort de l’animal. Ensuite, fixez la tête de l’animal dans la stéréotaxe, en vous assurant que la tête de l’animal ne peut pas bouger pendant l’explantation pour éviter la rupture de la sonde.
- Appliquez une goutte de solution saline sur la craniotomie et laissez-la tremper pendant quelques minutes pour ramollir les tissus biologiques séchés sur la tige de la sonde et réduire le risque de rupture de la tige.
- Placez le support stéréotaxique à environ 0,5 cm au-dessus du micromoteur. Ensuite, coupez l’extrémité supérieure des rayons de la cage de Faraday avec de petits ciseaux chirurgicaux (voir le tableau des matériaux) pour libérer l’anneau de Faraday qui maintient l’amplificateur/connecteur et transférez l’anneau sur les broches verticales en haut du support stéréotaxique (voir l’étape 5.1 et la figure supplémentaire 1).
- Coupez soigneusement le treillis de cuivre avec les mêmes ciseaux chirurgicaux en découpant des zones de maille en forme de U entre les rayons de la couronne de Faraday. Ensuite, coupez les rayons en plastique de la couronne à la base.
REMARQUE : Évitez de plier les rayons en plastique imprimés pendant qu’ils sont coupés, car ils pourraient se casser et envoyer des débris de plastique voler vers la sonde. - Abaissez le support stéréotaxique jusqu’à ce que le microdisque puisse être fixé dans le support à l’aide de la vis latérale du support, fixez le microdisque, puis desserrez la vis T1 qui relie le corps du microdisque à la base du microdisque.
- Rétractez lentement le bras stéréotaxique avec le porte-implant pour soulever le micromoteur de sa base. Assurez-vous que le micromoteur se sépare de la base à un angle perpendiculaire (c’est-à-dire « verticalement » par rapport à la base).
REMARQUE : Si le corps et la base du micro-entraînement ne se séparent pas facilement, vérifiez que le mouvement du bras stéréotaxique n’est pas incliné par rapport à l’orientation du micro-entraînement. Si nécessaire, le support et le micromoteur sont réalignés l’un par rapport à l’autre en desserrant légèrement la fixation de la tête de l’animal et en la repositionnant en conséquence. L’alignement correct est l’un des aspects cruciaux pour une récupération facile du micromoteur. Vérifiez également s’il n’y a pas de ciment dentaire résiduel reliant le micromoteur et la base du microentraînement (voir étape 5.5). Si c’est le cas, le ciment est soigneusement gratté à l’aide d’un scalpel et/ou d’une fraise dentaire en fonction de la quantité de ciment utilisée. - Soulevez le bras stéréotaxique avec la sonde attachée pour créer suffisamment d’espace en dessous.
- Retirez l’animal de la stéréotaxe et préparez le cerveau en suivant un protocole d’histologie approuvé si vous le souhaitez. Récupérez la base du microdrive implanté et nettoyez-la en la trempant dans de l’acétone pendant plusieurs heures pour une réutilisation ultérieure.
- Placez une base de micro-entraînement propre sur du mastic adhésif (voir le tableau des matériaux), puis abaissez le micro-entraînement sur la base et serrez la vis. Pour éviter toute casse, surveillez la position de la sonde au microscope tout au long du processus. Cette étape peut être terminée ultérieurement si la base du micromoteur implanté doit d’abord être nettoyée pour être réutilisée.
REMARQUE : Ce protocole appelle à l’utilisation de mastic adhésif comme plate-forme pour la base, ce qui est essentiel car il sécurise à la fois la base tout en ayant un certain degré de souplesse, garantissant que la base ne glisse pas et n’entre pas en collision avec la sonde. Le mastic doit être façonné en une « falaise » verticale sur le côté de la base du micromoteur où la sonde sera abaissée. Cela garantit que si la sonde est abaissée au-delà de la base, elle n’entre pas en contact avec le mastic situé en dessous. La « tour » de mastic doit également être suffisamment haute pour que, si elle est abaissée au-delà de la base du microentraînement, la sonde n’entre pas en contact avec la surface de la table sur laquelle le mastic est placé. Enfin, fixez bien le mastic à la surface pour éviter qu’il ne glisse ou ne tombe. Lorsque vous abaissez le micromoteur sur la base du micromoteur maintenue par le mastic, assurez-vous d’une vue latérale du microscope pour surveiller la progression afin que la sonde n’entre pas en collision avec la base ou le mastic lorsque la sonde est abaissée. - Nettoyez et stérilisez la sonde en suivant les instructions du fabricant. Pour les sondes les plus courantes, trempez-les dans un nettoyant enzymatique (voir tableau des matériaux) pendant 12 h, puis rincez-les à l’eau déminéralisée et désinfectez-les à l’alcool. Pour ce faire, abaissez la sonde dans un grand bécher contenant le nettoyant enzymatique tout en restant attaché au support de microdisque sur le bras stéréotaxique.
REMARQUE : Si vous le souhaitez, mesurez les impédances des électrodes sur la sonde après le nettoyage pour surveiller la dégradation potentielle des électrodes individuelles. - Stockez le microdisque avec la sonde nettoyée en toute sécurité jusqu’à la prochaine expérience.
Résultats
Ce protocole présente un système d’implantation chronique qui permet aux chercheurs de mettre en œuvre des enregistrements électrophysiologiques chroniques légers, rentables et sûrs chez des souris au comportement (Figure 1). Les principaux facteurs qui déterminent le succès de l’application de cette approche comprennent : une couverture complète du crâne en ciment, une craniotomie peu invasive et correctement protégée, une fixation sûre du micromoteur et du câblage au crâne et la continuité complète du matériau de protection de Faraday. Lorsque ces points sont pris en compte, il est possible d’obtenir des enregistrements de haute qualité de manière constante. Ici, des résultats représentatifs relatifs aux principaux aspects suivants du succès de la chirurgie sont présentés :
1) L’implant interfère-t-il avec le comportement ou le bien-être des animaux ?
2) La qualité du signal est-elle élevée et les signaux peuvent-ils être maintenus pendant de longues périodes ?
3) Les enregistrements peuvent-ils être facilement combinés avec l’exécution des tâches ?
Pour évaluer l’impact de l’implant sur le comportement animal, nous avons analysé les schémas de locomotion suivis chez cinq animaux implantés. La figure 2A montre l’exemple d’un animal se déplaçant librement à l’intérieur d’une cage de jeu pendant 10 minutes avant et 1 semaine après l’implantation. On peut voir que les modèles de mouvement sont inchangés. Cette observation est confirmée par la figure 2B, C montrant les distributions des vitesses de déplacement et des directions de la tête chez les animaux. La vitesse de course et les directions de la tête étaient en grande partie inchangées avant et après l’implantation, et au contraire, les vitesses de course semblaient être légèrement élevées après la chirurgie. La vidéo supplémentaire 1 montre un court enregistrement vidéo d’un animal 6 jours après la chirurgie d’implantation. Les comportements typiques de la cage domestique comme la locomotion, le toilettage, l’élevage et la recherche de nourriture dans l’environnement domestique sont tous visibles et indiquent une récupération réussie après une intervention chirurgicale, ainsi qu’une santé générale. Le faible impact comportemental de l’implant est très probablement dû à son faible poids et à sa taille gérable.
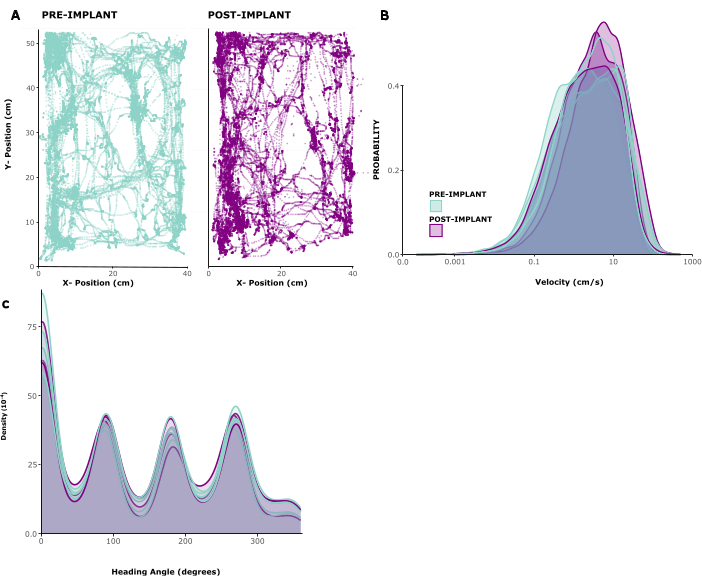
Figure 2 : Locomotion avant et après l’opération. (A) Exemple de locomotion d’un animal avant (panneau de gauche) et après l’implantation (panneau de droite). Les coordonnées x/y sont en centimètres, les points indiquent la position de l’animal à chaque point temporel sur une période de 10 min. (B) Répartition des vitesses de déplacement en cm/s pour 5 séances avant et 3 séances après l’implantation chez 5 animaux. (C) Densité du noyau pour la probabilité de mouvement dans différentes directions, pour les mêmes sessions analysées en (B). Veuillez cliquer ici pour voir une version agrandie de cette figure.
Ensuite, la qualité du signal en potentiel de champ local (LFP) et l’activité de pointe sur les sites d’enregistrement sont évaluées. Ici, nous présentons des données représentatives d’enregistrements corticaux dans le cortex visuel primaire (V1). Pour la validation, une activité unitaire présumée a été extraite des signaux neuronaux à large bande enregistrés dans V1 d’une souris éveillée à l’aide de Kilosort 3 (voir Figure 3). La figure 3A montre l’emplacement des unités individuelles extraites sur la tige de la sonde, la figure 3B montre les formes d’onde de pointe correspondantes et la figure 3C montre les réponses de pointe des mêmes neurones à un protocole de densité de source de courant (CSD). Dans ce paradigme, des flashs à grand champ ont été présentés avec une durée de 300 ms à une fréquence de 1 Hz (c’est-à-dire 300 ms en marche, 700 ms en arrêt) sur 200 essais. Enfin, la figure 3D montre les réponses des mêmes unités à un protocole de cartographie de champ réceptif visuel, composé de 2000 images de carrés noirs et blancs choisis au hasard sur un fond gris, et chacune présentée pendant 16,6 ms. Les carrés couvraient chacun 12 degrés d’angle visuel et ont été sélectionnés à partir d’un champ de 15 x 5 emplacements possibles, de sorte que le paradigme de cartographie couvrait un espace visuel de -90 à +90 degrés d’azimut et de -30 à +40 degrés d’élévation au total. Les réponses de la vitesse de tir à chaque trame de stimulus ont été extraites en analysant la vitesse de décharge maximale sur une fenêtre de 16,6 ms, sous réserve d’un retard compris entre 40 et 140 ms, identifiée comme optimale par canal en fonction de l’activité maximale dans chaque fenêtre. Ce type d’enregistrement peut être utilisé pour guider l’ajustement de la profondeur d’insertion de chaque électrode et pour évaluer la qualité du signal après la chirurgie implantaire.
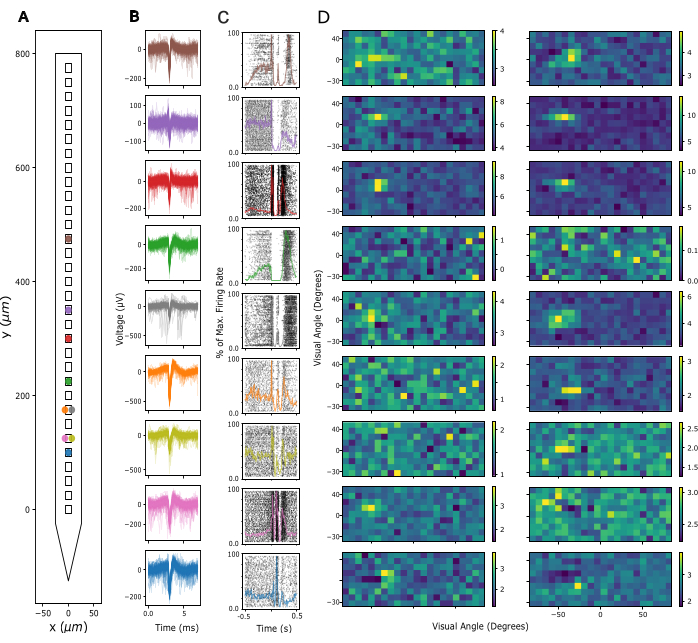
Figure 3 : Signaux neuronaux enregistrés. (A) Emplacement déduit d’unités individuelles triées par paquet de tri de pointes Kilosort 3 le long des contacts des électrodes de la sonde. (B) Formes d’onde de pointe pour les mêmes unités indiquées en A sur 5 ms de temps. Lignes fines : formes d’onde de pointe individuelles. Lignes épaisses : forme d’onde de pointe moyenne. (C) Tracé matriciel des pics en réponse à un paradigme de densité de source de courant (CSD) présentant des flashs à grand champ de 300 ms suivis d’un écran noir de 700 ms. Les réponses sont affichées pour les mêmes unités qu’en A et B. Les lignes colorées superposées représentent les histogrammes temporels péri-stimulus (PSTH) des mêmes réponses. Les cadences de tir des PSTH ont été calculées par tranches de 10 ms, puis normalisées par la cadence de tir maximale sur l’ensemble du PSTH. Le temps 0 est centré autour du stimulus de flash à grand champ. (D) Champs récepteurs estimés des mêmes unités que dans A-C, mesurés par un paradigme de cartographie de champ récepteur de bruit clairsemé. Chaque graphique montre l’activité moyenne de la vitesse de décharge sur une fenêtre d’analyse de 16,6 ms en réponse à l’apparition (panneau de gauche) ou au décalage (panneau de droite) des stimuli carrés blancs et noirs. Les stimuli ont été présentés pendant une durée de 16,6 ms, répartis de manière aléatoire sur une grille carrée de 5 x 15 couvrant 180 degrés d’angle visuel horizontalement et 70 degrés d’angle visuel verticalement. L’activité de la cadence de tir a été notée z sur l’ensemble de la grille de champ récepteur (voir barre de couleur). Veuillez cliquer ici pour voir une version agrandie de cette figure.
La qualité d’enregistrement est restée élevée sur les enregistrements répétés pendant des semaines ou des mois. La figure 4A montre les enregistrements longitudinaux LFP d’un animal sur 15 semaines. Les PFL ont été enregistrées en réponse au paradigme de la SDR décrit ci-dessus (voir la figure 3A-C). La figure 4A montre les réponses LFP moyennes 500 ms après le déclenchement du flash. Dans cet exemple, nous avons utilisé une sonde linéaire à 32 canaux, avec une distance interélectrode de 25 μm. Notez que le jour 18, la profondeur de la sonde a été ajustée, en décalant la sonde vers le bas de 600 μm. Avant et après cet ajustement, les signaux LFP sont restés stables d’un jour à l’autre.
En accord avec cela, des formes d’onde de pointe d’unités uniques présumées étaient discernables sur de nombreux enregistrements. La figure 4B montre des exemples représentatifs de formes d’onde de pointe provenant de trois sessions d’enregistrement au cours d’un mois d’enregistrements, démontrant que l’activité d’une seule unité peut être identifiée avec succès au fil du temps. La figure 4C montre le nombre total d’unités uniques présumées extraites d’enregistrements chroniques chez six animaux, couvrant une fenêtre allant jusqu’à 100 jours. Les unités individuelles ont été définies selon le critère par défaut du kilosort 3,0 (voir le tableau supplémentaire 1). Comme on peut le voir, le nombre d’unités uniques clairement définies s’élevait généralement à ~40 au cours de la première semaine suivant l’implantation, puis diminuait progressivement, évoluant vers une asymptote apparemment stable de ~20 unités. Étant donné que ces enregistrements ont été effectués à l’aide de sondes linéaires à 32 canaux, cela équivaut à un rendement attendu d’environ 1,25 unité unique par électrode directement après l’implantation, diminuant à environ 0,65 unité unique par électrode dans les enregistrements à long terme. La connexion répétée à l’amplificateur/connecteur de l’implant au fil des séances n’a semblé avoir d’impact ni sur la qualité de l’enregistrement ni sur la stabilité de l’implant, car la couronne de Faraday qui maintient l’amplificateur/connecteur peut résister à des forces répétées de plus de 10 Newton, un ordre de grandeur supérieur aux forces d’accouplement maximales requises par les connecteurs standard (voir la vidéo supplémentaire 2).
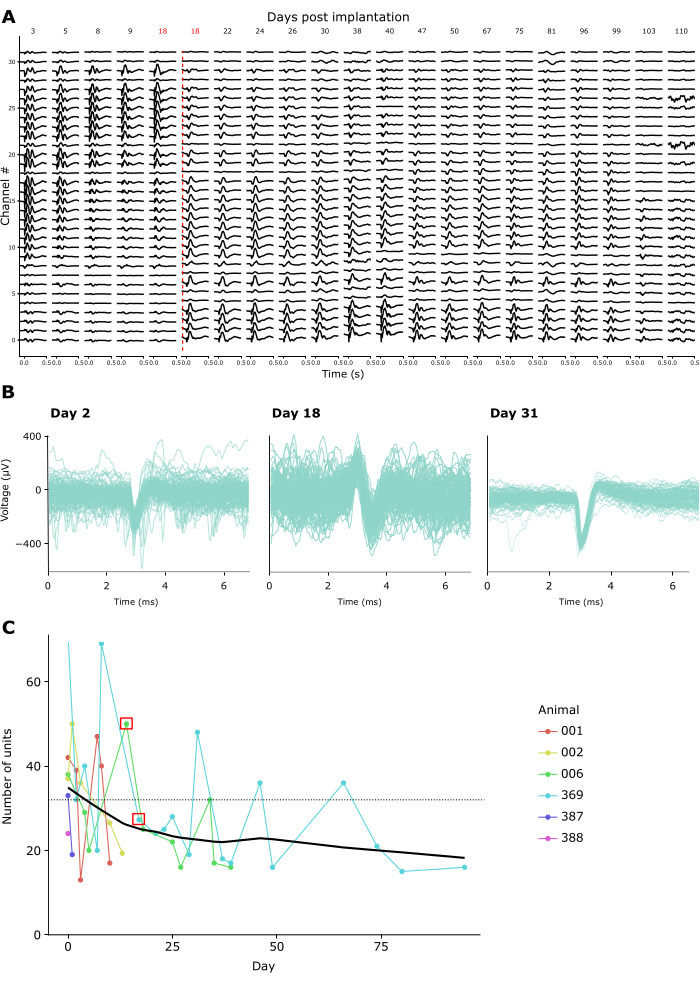
Figure 4 : Stabilité des enregistrements neuronaux dans le temps. (A) Activité moyenne de la LFP en réponse à un stimulus CSD flash à grand champ, montrée sur les 32 canaux d’une sonde implantée de manière chronique de 3 à 110 jours après l’implantation. La ligne verticale rouge indique que la sonde est descendue à un nouvel endroit en raison de l’enregistrement des canaux 0 à 8 de l’extérieur du cerveau au 18e jour après l’opération. (B) Formes d’onde de pointe de trois exemples d’unités du même implant chronique enregistrées de manière répétée pendant quatre semaines. Lignes fines : formes d’onde de pointe individuelles. Ligne superposée épaisse : forme d’onde de pointe moyenne. (C) Le nombre d’unités uniques présumées détectées par Kilosort 3 au cours des jours d’enregistrement pour 6 animaux (voir légende en médaillon). Le carré rouge indique les jours où la sonde a été déplacée. La ligne pointillée indique le nombre d’électrodes par implant utilisé dans ces enregistrements (32). Veuillez cliquer ici pour voir une version agrandie de cette figure.
Enfin, en fournissant un système modulaire comprenant un micromoteur ainsi qu’une cage de Faraday portable et une plaque frontale qui sert à la fois de base d’implant et de dispositif de fixation de la tête, ce protocole permet l’intégration de l’électrophysiologie chronique avec le comportement de la tête fixe. Ici, des exemples de données provenant de souris traversant un environnement virtuel sur un tapis roulant sphérique sont présentés. La figure 5A montre l’activité de pic liée à la course à pied de 20 unités dans un exemple d’essai. La figure 5B montre les relations diverses mais robustes entre la vitesse de course et l’activité de pointe des unités individuelles triées par pointe, ainsi qu’une moyenne de population pour le même effet dans la figure 5C, confirmant l’effet bien établi de l’activité locomotrice sur l’activité neuronale chez le rongeur V124.
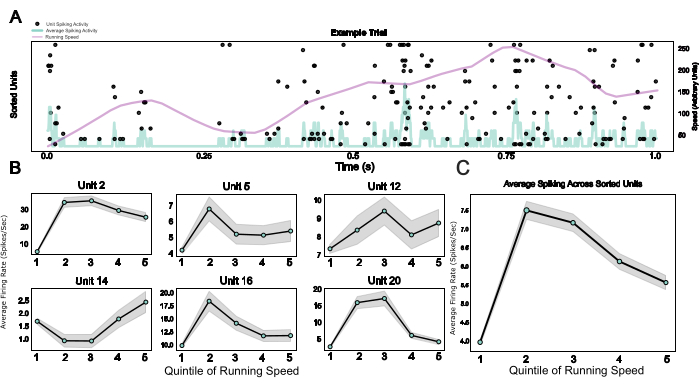
Figure 5 : Réponses neuronales lors d’un comportement tête fixe. (A) Tracé matriciel des réponses unitaires dans un exemple d’essai, avec la vitesse de course (ligne violette) et les taux de tir moyens sur toutes les unités uniques (ligne bleu clair) superposés. (B) Activité unitaire pendant différentes catégories de vitesse de marche, illustrée pour six exemples d’unités. (C) Activité moyenne de pic sur toutes les unités individuelles dans une session d’exemple, tracée sur les cinq quinitiles de la distribution de la vitesse de course. Les vitesses de course de cette session variaient de 0 à 0,88 mètre/seconde. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Tableau supplémentaire 1 : Tableau montrant les paramètres par défaut utilisés par Kilosort 3 lors de l’identification d’unités uniques dans les enregistrements illustrés à la figure 3, à la figure 4 et à la figure 5. Veuillez cliquer ici pour télécharger ce fichier.
Vidéo supplémentaire 1 : Vidéo montrant l’activité locomotrice animale après l’implantation. La vidéo prise après la phase de récupération de 5 jours est terminée, montrant un comportement locomoteur normal, ainsi qu’une adaptation à la taille et au poids de l’implant. On peut voir l’animal explorer normalement une cage de jeu contenant un enrichissement de l’environnement. Veuillez cliquer ici pour télécharger ce fichier.
Vidéo supplémentaire 2 : Vidéo montrant l’application de la force sur la couronne de Faraday assemblée. Les forces supportées par la couronne de Faraday sont environ un ordre de grandeur plus grandes que la force de connexion nécessaire pour les connecteurs standard tels que les nanoconnecteurs polarisés à 4 broches. Veuillez cliquer ici pour télécharger ce fichier.
Figure supplémentaire 1 : Figure montrant des images du support de disque. Les fichiers de conception imprimables se trouvent dans le dépôt Github correspondant (https://github.com/zero-noise-lab/dream-implant/). Veuillez cliquer ici pour télécharger ce fichier.
Figure supplémentaire 2 : Gabarit pour maille de cuivre. Imprimez le modèle avec l’échelle d’origine et utilisez le pochoir pour découper le treillis de cuivre (étape 2.12). Utilisez la barre d’échelle pour vérifier et, si nécessaire, ajuster l’échelle de l’impression. Veuillez cliquer ici pour télécharger ce fichier.
Figure supplémentaire 3 : Série de photos montrant les étapes d’assemblage de l’implant pendant l’opération. Deux micromoteurs, ainsi que deux amplificateurs, sont installés dans ce cas. Veuillez cliquer ici pour télécharger ce fichier.
Figure supplémentaire 4 : Dessin du crâne de souris avec exemple de placement des lecteurs, des craniotomies (en vert) et de la broche GND/REF (en rouge). L’emplacement de la broche est suggéré en raison de son placement dans le cervelet, qui est peu susceptible d’interférer avec les enregistrements corticaux. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
Ce manuscrit présente un protocole pour l’implantation rapide, sûre et standardisée des sondes, qui permet également la récupération et la réutilisation des sondes à la fin de l’expérience. L’approche utilise un système modulaire de composants de l’implant, en particulier un micromoteur, qui est compatible avec toutes les sondes et systèmes d’enregistrement en silicium courants, une plaque frontale qui peut être utilisée pour des expériences comportementales fixées sur la tête et une cage de Faraday portable pour protéger l’implant. Cette constellation permet aux utilisateurs d’adapter de manière flexible leur implant à différents paradigmes expérimentaux, tels que la tête fixe ou le comportement en mouvement libre ou la miniaturisation de l’implant (sans cage de Faraday) par rapport à une robustesse accrue du signal à long terme (avec la cage de Faraday) - sans avoir à sacrifier la standardisation de l’implant dans le processus.
Cette approche rend les enregistrements électrophysiologiques chroniques plus standardisés (grâce à des éléments préfabriqués qui ne nécessitent pas d’assemblage à la main), moins coûteux (grâce à la récupération de la sonde), moins chronophages (en simplifiant les étapes chirurgicales) et plus facilement compatibles avec le bien-être et le comportement des animaux (grâce à une réduction de la taille de l’implant et à une fixation de la tête sans stress). En tant que tel, ce protocole vise à rendre les implants électrophysiologiques chez les rongeurs accessibles à un plus large éventail de chercheurs au-delà des laboratoires pionniers à la pointe du domaine.
Pour atteindre cet objectif, le protocole présenté ici minimise le compromis entre plusieurs aspects souvent tout aussi cruciaux des implants de microentraînement, à savoir la flexibilité, la modularité, la facilité d’implantation, la stabilité, le coût global, la compatibilité avec le comportement et la réutilisation de la sonde. À l’heure actuelle, les approches disponibles excellent souvent dans certains de ces aspects, mais à un coût élevé pour d’autres fonctionnalités. Par exemple, pour les cas d’utilisation qui exigent une stabilité absolue de l’implant sur de longues périodes, la meilleure approche implantaire peut être de cimenter directement la sonde sur le crâne25. Cependant, cela empêche également la réutilisation de la sonde, ainsi que le repositionnement des sites d’enregistrement en cas de mauvaise qualité d’enregistrement, et est incompatible avec la pose standardisée d’implants. De même, alors que le variateur AMIE fournit une solution légère et peu coûteuse pour l’implantation récupérable de sondes, il est limité à des sondes uniques et limité dans le placement des coordonnées cibles17. À l’opposé du spectre, certains nano-moteurs disponibles dans le commerce (voir Tableau 1 16,17,21,26,27,28,29,30) sont extrêmement petits, peuvent être placés librement sur le crâne et maximisent le nombre de sondes pouvant être implantées chez un seul animal16. Cependant, ils sont coûteux par rapport à d’autres solutions, nécessitent que les expérimentateurs soient hautement qualifiés pour réussir les chirurgies implantaires et interdisent la réutilisation des sondes. Le microvariateur développé par Vöröslakos et al.21, dont une version allégée fait également partie de ce protocole, sacrifie la petite taille de l’implant pour une meilleure facilité d’utilisation, un prix inférieur et une réutilisation de la sonde
Tableau 1 : Comparaison des stratégies populaires pour les implants de sondes chroniques chez les rongeurs. Disponibilité : si le microdisque est open source (pour que les chercheurs puissent le construire eux-mêmes), disponible dans le commerce, ou les deux. Modularité : Les systèmes intégrés sont constitués d’un ou de quelques composants qui sont en relation fixe les uns par rapport aux autres, tandis que les systèmes modulaires permettent de placer librement la sonde/le microentraînement par rapport à la protection (casque/cage de Faraday) après la production de l’implant (par exemple, au moment de l’opération). La modularité a été déterminée à partir d’informations publiées ou de protocoles d’implantation des implants répertoriés. Fixation de la tête : Oui : L’implant a des mécanismes de fixation de la tête intégrés dans sa conception, X : L’implant laisse l’espace pour ajouter une plaque de tête supplémentaire pour la fixation sans gros problèmes, Non : La conception de l’implant crée probablement des problèmes d’espace ou nécessite des modifications de conception substantielles pour une utilisation avec la fixation de la tête. Placement de la sonde : Restreint : L’emplacement de la sonde est limité au stade de la conception de l’implant. Flexible : l’emplacement de la sonde peut être ajusté même pendant l’opération. Nombre de sondes : le nombre de sondes qui ont pu être implantées. Notez que l’implantation de sondes >2 sur une souris pose un défi important, quel que soit le système d’implant choisi. Réutilisation des sondes : oui, si les sondes peuvent, en théorie, être réutilisées. Poids/taille : poids et encombrement de l’implant. Veuillez cliquer ici pour télécharger ce tableau.
Pour créer un système qui concilie ces différentes exigences de manière plus transparente, l’implant DREAM a été conçu sur la base de l’implant Vöröslakos21, mais avec plusieurs modifications fondamentales. Tout d’abord, pour réduire le poids total de l’implant, le micromoteur utilisé ici est fabriqué en aluminium usiné plutôt qu’en acier inoxydable imprimé en 3D, et la couronne Faraday est miniaturisée, ce qui permet une réduction de poids globale de 1,2 à 1,4 g selon le choix du matériau de la plaque de tête (voir tableau 2). Deuxièmement, la plaque de tête entourant le micromoteur a été conçue pour permettre un mécanisme de fixation de la tête intégré qui permet une fixation rapide et sans stress de la tête tout en servant de base à la cage de Faraday, donnant accès à la plupart des zones cibles potentielles pour les enregistrements neuronaux et n’ajoutant qu’un poids minimal à l’implant. La forme plate du mécanisme de fixation et l’absence de protubérances assurent également une altération minimale du champ visuel ou de la locomotion des animaux (voir Figure 2A-C), une nette amélioration par rapport aux systèmes précédents31,32. La couronne et l’anneau de Faraday qui sont fixés sur la plaque de tête ont également été considérablement modifiés par rapport aux conceptions précédentes. Ils ne nécessitent désormais aucune adaptation ad hoc (par exemple, en termes de placement de connecteur) ou de soudure tout au long de la chirurgie, ce qui élimine les causes potentielles d’endommagement de l’implant et la variation imprévisible de la qualité de l’implant. Au lieu de cela, l’implant DREAM offre plusieurs variations d’anneau de couronne standardisées qui permettent de placer chaque connecteur dans l’une des quatre positions prédéfinies, minimisant ainsi la variabilité et l’effort pendant la chirurgie. Enfin, en optimisant le système d’implant pour la récupération de la sonde, l’implant DREAM permet aux expérimentateurs de réduire considérablement le coût ainsi que le temps de préparation par implant, car le micromoteur et la sonde peuvent généralement être récupérés, nettoyés et réutilisés ensemble.
Pour un aperçu plus exhaustif des compromis posés par les différents systèmes d’implants, voir le tableau 1. Bien que l’approche présentée ici n’offre généralement pas une performance maximale par rapport à toutes les autres stratégies, par exemple en termes de taille, de stabilité ou de coût, elle fonctionne dans la fourchette supérieure pour tous ces paramètres, ce qui la rend plus facilement applicable à un large éventail d’expériences.
Trois aspects du protocole sont particulièrement cruciaux à adapter à chaque cas d’utilisation spécifique : la constellation du sol et de la référence, la technique de cimentation du micromoteur et la validation de l’implant par enregistrement neuronal. Tout d’abord, lors de l’implantation des broches de terre et de référence, l’objectif était d’identifier le point idéal entre la stabilité mécanique/électrique et l’invasivité. Bien que, par exemple, les fils d’argent flottants incrustés dans la gélose soient moins invasifs que les vis à os33, ils sont probablement plus susceptibles de se déloger avec le temps. L’utilisation de broches, couplées à de l’agar, assure une connexion électrique stable tout en ayant l’avantage d’être plus facile à contrôler lors de l’insertion, évitant ainsi les traumatismes tissulaires. Il est peu probable que les broches de terre cimentées au crâne se délogent, et dans le cas où le fil se sépare de la broche, la remise en place est généralement simple en raison de la plus grande surface et de la stabilité de la broche implantée.
Tableau 2 : Comparaison des poids des composants entre l’implant DREAM et l’implant décrit par Vöröslakos et al.21. Veuillez cliquer ici pour télécharger ce tableau.
Deuxièmement, la cimentation du micromoteur doit généralement avoir lieu avant l’insertion de la sonde dans le cerveau. Cela empêche le mouvement latéral de la sonde à l’intérieur du cerveau si le micromoteur n’est pas parfaitement fixé dans le support stéréotaxique lors de l’insertion. Pour vérifier l’emplacement de la sonde avant de cimenter le micromoteur en place, on peut brièvement abaisser l’extrémité de la tige de la sonde pour déterminer où elle entrera en contact avec le cerveau, car l’extrapolation de la position d’atterrissage peut être difficile compte tenu du décalage de parallaxe du microscope. Une fois la position du micro-entraînement établie, on peut éventuellement protéger la craniotomie avec de l’élastomère de silicone avant de cimenter le micro-entraînement pour s’assurer que le ciment n’entre pas accidentellement en contact avec la craniotomie ; Cependant, il n’est pas recommandé d’abaisser la sonde à travers l’élastomère de silicone, car les résidus d’élastomère de silicone peuvent être aspirés dans le cerveau et provoquer une inflammation et une gliose.
Troisièmement, selon le protocole expérimental utilisé, un enregistrement de test directement après la chirurgie peut être utile ou non. En grande partie, l’activité neuronale enregistrée juste après l’insertion de la sonde ne sera pas directement représentative de l’activité enregistrée de manière chronique, en raison de facteurs tels que le gonflement transitoire du cerveau et le mouvement des tissus autour de la sonde, ce qui signifie qu’il est peu probable que la profondeur d’insertion ainsi que les formes d’onde de pointe se stabilisent directement. En tant que tels, les enregistrements immédiats peuvent principalement servir à vérifier la qualité générale du signal et l’intégrité de l’implant. Il est recommandé d’utiliser le traîneau mobile à micromoteur dans les jours qui suivent l’opération, une fois que le cerveau s’est stabilisé, afin d’affiner la position. Cela permet également d’éviter de déplacer la sonde de plus de 1000 μm par jour, ce qui minimise les dommages au site d’enregistrement et améliore ainsi la longévité du site d’enregistrement.
Enfin, les utilisateurs peuvent souhaiter adapter le système pour enregistrer à partir de plus d’un emplacement cible. Comme ce système est modulaire, l’utilisateur dispose d’une grande marge de manœuvre sur la façon d’assembler et de placer les composants les uns par rapport aux autres (voir ci-dessus et la figure supplémentaire 3 et la figure supplémentaire 4). Cela comprend des modifications qui permettraient de monter sur le microvariateur une navette déployée horizontalement, ce qui permettrait d’implanter plusieurs sondes ou de grandes sondes à plusieurs dents, ainsi que l’implantation de plusieurs microvariateurs individuels (voir la figure supplémentaire 3 et la figure supplémentaire 4). De telles modifications ne nécessitent que l’utilisation d’une bague couronne adaptée, avec un nombre accru de zones de montage pour les connecteurs/cartes d’interface/étages. Cependant, les limites d’espace de cette conception sont dictées par le modèle animal, dans ce cas, la souris, ce qui rend l’empilement de plusieurs sondes sur un seul microdisque plus attrayant en termes d’encombrement que l’implantation de plusieurs microdisques indépendamment les uns des autres. Les microdisques utilisés ici peuvent prendre en charge des sondes empilées, et donc, la seule véritable limitation est le nombre de têtes ou de connecteurs qui peuvent s’adapter aux contraintes d’espace et de poids définies par le modèle animal. Les entretoises peuvent également être utilisées pour augmenter encore les chemins de montage et d’insertion non verticaux.
En conclusion, ce protocole permet l’implantation d’une sonde peu coûteuse, légère et surtout réglable, avec l’avantage supplémentaire d’une conception de micro-entraînement qui privilégie la récupération de la sonde. Cela s’attaque aux problèmes du coût prohibitif des sondes à usage unique, de la barrière élevée des compétences chirurgicales et d’implantation, ainsi que du fait que les solutions commerciales pour l’implantation chronique sont souvent difficiles à adapter à des cas d’utilisation uniques. Ces problèmes posent un point sensible aux laboratoires qui utilisent déjà l’électrophysiologie aiguë et un moyen de dissuasion pour ceux qui n’entreprennent pas encore d’expériences d’électrophysiologie. Ce système vise à faciliter l’adoption plus large de la recherche en électrophysiologie chronique au-delà de ces limites.
Déclarations de divulgation
TS, AN et MNH sont les cofondateurs de 3Dneuro B.V., qui fabrique les microdisques open source et les couronnes de Faraday utilisés dans ce protocole. FB et PT font partie du conseil consultatif scientifique de 33Dneuro B.V. FB et PT ne reçoivent aucune compensation financière pour ce poste.
Remerciements
Ces travaux ont été soutenus par le Conseil néerlandais de la recherche (NWO ; Crossover Program 17619 « INTENSE », TS) et a reçu un financement du septième programme-cadre de l’Union européenne (FP7/2007-2013) dans le cadre de la convention de subvention n° 600925 (Neuroseeker, TS, FB, PT), ainsi que de la Société Max Planck.
matériels
| Name | Company | Catalog Number | Comments |
| 0.05" Solder Tail Socket | Mill-Max | 853-93-100-10-001000 | |
| 1,1'-dioctadecyl-3,3,3',3'- Reagent tetramethylindocarbocyanine perchlorate ('DiI'; DiIC18(3)) | ThermoFisher | D282 | Lipophilic dye used for easier histological verification of the probe location |
| Adhesive Putty (Blu-Tack) | Bostik | 308590110 | Variations (e.g. by Pritt) should be available in your stationary store |
| Agar | Sigma Aldrich | A1296 | Make with saline for conductivity. |
| Amplifier (Miniamp-64) | Cambridge Neurotech | Miniature and implantable amplifier and digitiser. Alternative Implantable digitiser, or implantable Omnetics connector use possible. | |
| Analgesic Cream (EMLA Cream) | Aspen | 39699/0088 | Analgesic cream used for operative pain containing prilocaine, lidocaine. |
| Angled Spacer | 3DNeuro | Angled spacer for non-perpendicular drive mounting.. Open souce, also available at https://github.com/zero-noise-lab/dream-implant/ | |
| Blue light curing LED | B.A. International | 818223 | Curing light for primer polymerisation. 420-480 nm wavelength |
| Bone wax | SMI | Z046 | Wax to protect craniotomy and probe post surgery. |
| Buprenorphine | Elanco Europe LTD | 401513 | Injectable Buprenorphine solution (0.3 mg/mL) |
| Copper mesh | Dexmet | 3CU6-050FA | Copper mesh used to electrically and physically shield probe and craniotomy. |
| Cyanoacrylate glue (Loctite) | Loctite | 1363589 | Cyanoacrylate gel glue |
| Dental Cement (SuperBond C&B) | Sun Medical | K058E | Dental cement (SuperBond) |
| Depilation Cream (Veet) | Veet | 310000091434 | Hair removal cream for removal of hair around surgical site. |
| Enrofloxacin (Baytril) | Elanco Europe LTD | 00879/4117 | Injectable enrofloxacin solution (25 mg/mL) |
| Faraday crown | 3DNeuro | 3D printed implantable protective cage. Open souce, also available at https://github.com/zero-noise-lab/dream-implant/ | |
| Faraday ring | 3DNeuro | 3D printed implantable protective ring for faraday cage. Open souce, also available at https://github.com/zero-noise-lab/dream-implant/ | |
| Haemostatic Sponge | SMI | ZHG101010 | Absorbable gelatin haemostatic sponge |
| Heat Shrink Tubing | HellermannTyton | TA32-9/3 BK | Heat Shrink tubing for making soft tipped forceps |
| Iodine | Braunol | 9322507 | Aqueous povidone-iodine solution. |
| Metamizole (Novalgin) | Sanofi-Aventis Gmbh | 4527098 | Injectable Metamizole (500mg/mL) |
| Metamizole (Novalgin) | Sanofi-Aventis Gmbh | 1553758 | Metamizole solution |
| Microdrive (R2Drive) | 3DNeuro | Recoverable Metal micro drive with moveable shuttle. Open souce, also available at https://buzsakilab.github.io/ 3d_print_designs/ | |
| Mineral Oil | Sigma-Aldrich | M5310-100ML | Oil used as solvent to create craniotomy protection gel. |
| Non-Shedding Wipes (Kimtech) | Kimtech | 7552 | Non-shedding wipes |
| Primer | Bisco | B-7202P | Universal skull adhesive preventing moisture from deteriorating the cement and providing a solid base to build up cement onto. |
| R2Drive holder | 3DNeuro | Stereotactic attachment for mounting R2Drive. Open souce, also available at https://buzsakilab.github.io/ 3d_print_designs/ | |
| Self-adherent wrap | 3M | VB050 | Protective wrap for implant post surgery |
| Silicon probe (H2) | Cambridge Neurotech | Chronically implantable linear silicon probe with 32 channels. Alternative Probe use possible. | |
| Silicone Elastomer (Duragel) | Cambridge Neurotech | Silicone Elastomer | |
| Silicone Plaster (Kwikcast) | WPI | KWIK-CAST | |
| Silver conductive epoxy | MG Chemicals | 8331D-14G | Silver epoxy |
| Size 5 Dumont forceps | FSTools | 11251-10 | Small forceps for lifting bone flap. |
| Stainless steel wire, Teflon coated | Science Products GmBH | SS-3T | Ground wire |
| Stereotax (RWD) | RWD | 68803 | Stereotax for surgical procedures on mice. |
| Tergazyme | Alconox | 1304 | A possible enzymatic cleaner to clean probe |
| Two Part Fast setting Epoxy Resin | Gorilla | EP3 | Epoxy for permanent bonding of DREAM implant parts. |
| Vannas Spring Scissors Round Handle | FSTools | 15403-08 | 0.075mm straight tipped spring rebound veterinary scissors. |
| Veterinary Cyanoacrylate glue (Vetbond) | 3M | 70-0068-5256-3 | Veterinary cyanoacrylate glue |
Références
- Epsztein, J., Brecht, M., Lee, A. K. Intracellular determinants of hippocampal CA1 place and silent cell activity in a novel environment. Neuron. 70 (1), 109-120 (2011).
- Okun, M., et al. Diverse coupling of neurons to populations in sensory cortex. Nature. 521 (7553), 511-515 (2015).
- Jun, J. J., et al. Fully integrated silicon probes for high-density recording of neural activity. Nature. 551 (7679), 232-236 (2017).
- Znamenskiy, P., Kim, M. -. H., Muir, D. R., Iacaruso, M. F., Hofer, S. B., Mrsic-Flogel, T. D. Functional specificity of recurrent inhibition in visual cortex. Neuron. 112 (6), 991-1000 (2024).
- Rowland, J. M., et al. Propagation of activity through the cortical hierarchy and perception are determined by neural variability. Nat Neurosci. 26 (9), 1584-1594 (2023).
- Roth, M. M., Dahmen, J. C., Muir, D. R., Imhof, F., Martini, F. J., Hofer, S. B. Thalamic nuclei convey diverse contextual information to layer 1 of visual cortex. Nat Neurosci. 19 (2), 299-307 (2016).
- Zong, W., et al. Large-scale two-photon calcium imaging in freely moving mice. Cell. 185 (7), 1240-1256 (2022).
- Demas, J., et al. High-speed, cortex-wide volumetric recording of neuroactivity at cellular resolution using light beads microscopy. Nat Methods. 18 (9), 1103-1111 (2021).
- Buzsáki, G., Anastassiou, C. A., Koch, C. The origin of extracellular fields and currents EEG, ECoG, LFP and spikes. Nat Rev Neurosci. 13 (6), 407-420 (2012).
- Polikov, V. S., Tresco, P. A., Reichert, W. M. Response of brain tissue to chronically implanted neural electrodes. J Neurosci Methods. 148 (1), 1-18 (2005).
- Savya, S. P., et al. In vivo spatiotemporal dynamics of astrocyte reactivity following neural electrode implantation. Biomaterials. 289, 121784 (2022).
- Perge, J. A., et al. Intra-day signal instabilities affect decoding performance in an intracortical neural interface system. J Neural Eng. 10 (3), 036004 (2013).
- Pachitariu, M., Steinmetz, N., Kadir, S., Carandini, M., Harris, K. D. Kilosort: realtime spike-sorting for extracellular electrophysiology with hundreds of channels. bioRxiv. , 061481 (2016).
- Buzsáki, G. Large-scale recording of neuronal ensembles. Nat Neurosci. 7 (5), 446-451 (2004).
- Kloosterman, F., et al. Micro-drive array for chronic in vivo recording: Drive fabrication. J Vis Exp. (26), e1094 (2009).
- Jacobs, T., Darch, H., Holtzman, T., De Zeeuw, C. I., Romano, V. Standard operating protocol: Implantation of Cambrige NeuroTech chronic silicon probe and mini-amp-64 digital headstage in mice. Protocol Exchange. , (2023).
- Juavinett, A. L., Bekheet, G., Churchland, A. K. An adaptable, reusable, and light implant for chronic Neuropixels probes. bioRxiv. , (2024).
- Kozai, T. D. Y., Jaquins-Gerstl, A. S., Vazquez, A. L., Michael, A. C., Cui, X. T. Brain tissue responses to neural implants impact signal sensitivity and intervention strategies. ACS Chem Neurosci. 6 (1), 48-67 (2015).
- Nguyen, D. P., et al. Micro-drive array for chronic in vivo recording: tetrode assembly. J Vis Exp. (26), e1098 (2009).
- Biran, R., Martin, D. C., Tresco, P. A. Neuronal cell loss accompanies the brain tissue response to chronically implanted silicon microelectrode arrays. Exp Neurol. 195 (1), 115-126 (2005).
- Vöröslakos, M., Petersen, P. C., Vöröslakos, B., Buzsáki, G. Metal microdrive and head cap system for silicon probe recovery in freely moving rodent. eLife. 10, e65859 (2021).
- . IMEC Neuropixels 1.0 User Manual V1.0.8 Available from: https://www.neuropixels.org/_files/ugd/328966_ca209d53ffb346b3bf98be39b903efa9.pdf (2023)
- Baranauskas, G., et al. Carbon nanotube composite coating of neural microelectrodes preferentially improves the multiunit signal-to-noise ratio. J Neural Eng. 8 (6), 066013 (2011).
- Niell, C. M., Stryker, M. P. Modulation of visual responses by behavioral state in mouse visual cortex. Neuron. 65 (4), 472-479 (2010).
- Okun, M., Carandini, M., Harris, K. D. Long term recordings with immobile silicon probes in the mouse cortex. bioRxiv. , (2015).
- Chung, J., Sharif, F., Jung, D., Kim, S., Royer, S. Micro-drive and headgear for chronic implant and recovery of optoelectronic probes. Sci Rep. 7 (1), 2773 (2017).
- Bimbard, C., et al. An adaptable, reusable, and light implant for chronic Neuropixels probes. bioRxiv. , (2024).
- Jones, E. A. A. Chronic recoverable Neuropixels in mice. protocols.io. , (2023).
- . Neuronexus Products - dDrive Available from: https://www.neuronexus.com/products/accessories/microdrives/ddrive/ (2024)
- van Daal, R. J. J., et al. Implantation of Neuropixels probes for chronic recording of neuronal activity in freely behaving mice and rats. Nat Protoc. 16 (7), 3322-3347 (2021).
- Guo, Z. V., et al. Procedures for behavioral experiments in head-fixed mice. PLoS One. 9 (2), e88678 (2014).
- Groblewski, P. A., et al. A standardized head-fixation system for performing large-scale, in vivo physiological recordings in mice. J Neurosci Methods. 346, 108922 (2020).
- Vasilev, D., Raposo, I., Totah, N. K. Brightness illusions evoke pupil constriction preceded by a primary visual cortex response in rats. Cereb Cortex. 33 (12), 7952-7959 (2023).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon