Method Article
שתל DREAM: מערכת שתלים קלה, מודולרית וחסכונית לאלקטרופיזיולוגיה כרונית בעכברים מקובעים ראש ומתנהגים בחופשיות
* These authors contributed equally
In This Article
Summary
כאן, אנו מציגים מערכת שתלי בדיקה קלת משקל וחסכונית לאלקטרופיזיולוגיה כרונית במכרסמים המותאמת לקלות שימוש, שחזור בדיקה, רב-תכליתיות ניסיונית ותאימות להתנהגות.
Abstract
רישומים אלקטרופיזיולוגיים כרוניים במכרסמים שיפרו באופן משמעותי את הבנתנו את הדינמיקה העצבית ואת הרלוונטיות ההתנהגותית שלה. עם זאת, השיטות הנוכחיות להשתלה כרונית של גשושיות מציגות פשרות תלולות בין עלות, קלות שימוש, גודל, יכולת הסתגלות ויציבות לטווח ארוך.
פרוטוקול זה מציג מערכת חדשנית לשתלי בדיקה כרונית עבור עכברים בשם DREAM (דינמי, ניתן לשחזור, חסכוני, ניתן להתאמה ומודולרית), שנועדה להתגבר על הפשרות הקשורות לאפשרויות הזמינות כיום. המערכת מספקת פתרון קל, מודולרי וחסכוני עם רכיבי חומרה סטנדרטיים הניתנים לשילוב ולהשתלה בשלבים פשוטים ולשתול בבטחה לצורך התאוששות ושימוש חוזר מרובה בבדיקות, ובכך להפחית משמעותית את עלויות הניסוי.
מערכת השתלים DREAM משלבת שלושה מודולי חומרה: (1) מיקרו-כונן שיכול לשאת את כל בדיקות הסיליקון הסטנדרטיות, ומאפשר לנסיינים להתאים את עומק ההקלטה על פני מרחק נסיעה של עד 7 מ"מ; (2) עיצוב תלת-ממדי (תלת-ממדי) בקוד פתוח הניתן להדפסה עבור כלוב פאראדיי לביש המכוסה ברשת נחושת למיגון חשמלי, הגנה מפני פגיעות ומיקום מחברים, ו-(3) מערכת קיבוע ראש ממוזערת לשיפור רווחת בעלי החיים וקלות השימוש. פרוטוקול הניתוח המתאים הותאם למהירות (משך כולל: שעתיים), בטיחות הבדיקה ורווחת בעלי חיים.
לשתלים הייתה השפעה מינימלית על הרפרטואר ההתנהגותי של בעלי החיים, הם היו ישימים בקלות בהקשרים הנעים בחופשיות וקבועים בראשם, וסיפקו צורות גל ספייק ניתנות לזיהוי בבירור ותגובות עצביות בריאות במשך שבועות של איסוף נתונים לאחר ההשתלה. זיהומים וסיבוכי ניתוח אחרים היו נדירים ביותר.
ככזו, מערכת השתלים DREAM היא פתרון רב-תכליתי וחסכוני לאלקטרופיזיולוגיה כרונית בעכברים, המשפרת את רווחת בעלי החיים ומאפשרת ניסויים מבוססים יותר מבחינה אתולוגית. העיצוב שלה מפשט הליכים ניסיוניים על פני צרכי מחקר שונים, הגדלת הנגישות של אלקטרופיזיולוגיה כרונית במכרסמים למגוון רחב של מעבדות מחקר.
Introduction
אלקטרופיזיולוגיה עם גשושיות סיליקון מושתלות כרוניות התפתחה כטכניקה רבת עוצמה לחקר פעילות עצבית וקישוריות בבעלי חיים מתנהגים, במיוחד בעכברים, בשל הגמישות הגנטית והניסויית שלהם1. בדיקות סיליקון למינריות, במיוחד, הוכיחו את עצמן ככלי רב ערך לזיהוי קשרים תפקודיים בתוך עמודות קליפת המוח2 ולקשר את הדינמיקה של אוכלוסיות נוירונים גדולות להתנהגות באופן שלא היה אפשרי בעבר3.
שתי גישות משלימות הן תקני הזהב הנוכחיים לרישום פעילות עצבית in vivo: מיקרוסקופ דו-פוטוני 4,5 ואלקטרופיזיולוגיה חוץ-תאית6. הבחירה במתודולוגיית ההקלטה מגבילה את אופי הקריאות שניתן להשיג: מיקרוסקופיה של שני פוטונים מתאימה במיוחד למחקרי אורך של תאי עצב הניתנים לזיהוי אינדיבידואלי באוכלוסיות גדולות לאורך זמן, אך סובלת מעלויות ציוד גבוהות ומוגבלת לשכבות שטחיות של קליפת המוח במוחות שלמים. בנוסף, הרזולוציה הטמפורלית הטיפוסית של ~30 הרץ מגבילה את יכולתו ללכוד דינמיקה עצבית מתמשכת 7,8.
לעומת זאת, רישומים אלקטרופיזיולוגיים מציעים רזולוציה טמפורלית גבוהה (עד 40 קילוהרץ) כדי לעקוב אחר הפעילות העצבית רגע אחר רגע, ניתן ליישם אותם באופן נרחב על פני מינים כמו גם על פני מעמקי קליפת המוח, ויש להם הגדרות בעלות נמוכה יחסית בהשוואה למיקרוסקופ של שני פוטונים. עם זאת, זיהוי של נוירונים בודדים, כמו גם מעקב אורך של אוכלוסיות נוירונים, קשה להשיג. זה חל במיוחד על אלקטרודות תיל, למשל, טטרודים, ועל החדרת אלקטרודות חריפות. מלבד היעדר היכולת לעקוב אחר נוירונים לאורך הקלטות9, החדרות אקוטיות חוזרות ונשנות גורמות לטראומה מקומית10 המפעילה תגובה חיסונית11, ומגדילות את הסיכוי לזיהום וגליוזיס. זה בסופו של דבר מפחית את היציבות של הפעילות העצבית המתועדת ואת תוחלת החיים של חיות ניסוי, ומגביל את היקף מחקרי האורך הכוללים רישומים אלקטרופיזיולוגיים חריפים לימים ספורים12 בלבד.
הקלטות גשושיות סיליקון כרוניות בצפיפות גבוהה שואפות לשלב כמה מהתכונות הטובות ביותר של אלקטרופיזיולוגיה חריפה והדמיה של שני פוטונים. הם יכולים לעקוב אחר דינמיקה של אוכלוסייה עצבית על פני הפעלות עם יכולת נמוכה רק במקצת לזהות נוירונים בודדים בהשוואה לדימות של שני פוטונים13. הקלטות אלה מספקות גמישות גבוהה במיקום המרחבי וברזולוציה הטמפורלית המדויקת של האותות המוקלטים, כמו גם תוחלת חיים ורווחה משופרת של חיות ניסוי בהשוואה להקלטות אקוטיות14. יתר על כן, בניגוד לרישומים אקוטיים, אלקטרופיזיולוגיה כרונית מחייבת אירוע השתלה אחד בלבד, ובכך מפחיתה למעשה את הסיכון לזיהום ולנזק לרקמות וממזערת את הלחץ על בעלי החיים15 . יחד, יתרונות אלה הופכים את האלקטרופיזיולוגיה הכרונית לכלי רב עוצמה לחקר הארגון והתפקוד של מערכת העצבים.
עם זאת, טכניקות השתלה כרוניות נפוצות עבור עכברים מגבילות את החוקרים לבצע פשרות משמעותיות בין תאימות לרישומים התנהגותיים, משקל השתל, שכפול שתלים, עלויות כספיות וקלות השימוש הכוללת. פרוטוקולי שתלים רבים אינם מתוכננים להקל על שימוש חוזר בגשושיות16, מה שמעלה באופן תלול את העלות האפקטיבית של ניסויים בודדים ובכך מקשה כלכלית על מעבדות מסוימות להשתמש באלקטרופיזיולוגיה כרונית. הם גם דורשים לעתים קרובות אב טיפוס נרחב בתוך הבית ועבודת עיצוב, אשר המומחיות והמשאבים עשויים שלא להיות נוכחים.
מצד שני, מערכות שתלים משולבות17 מציעות פתרון נגיש יותר לאלקטרופיזיולוגיה כרונית במכרסמים. מערכות אלה מתוכננות לשלב מיקרו-כונן המחזיק את הבדיקה עם שאר השתל כדי לפשט את הטיפול בשתלים ואת ההליכים הכירורגיים. עם זאת, לאחר השתלתן, מערכות כאלה יכולות להיות כבדות ביותר ולהגביל את יכולתו של הנסיין להתאים ניסוי באופן גמיש לקואורדינטות מטרה שונות. לעתים קרובות, משקלם מונע השתלה בבעלי חיים קטנים יותר, עלול לפגוע בתנועת בעלי החיים ולגרום ללחץ18. זה יכול להשפיע באופן לא פרופורציונלי על מחקר על קבוצות צעירות ונשים, כמו מגבלות משקל נוטים יותר להשפיע על קבוצות אלה.
בנוסף, לא כל המערכות המשולבות מאפשרות התאמה של מיקומי האלקטרודות לאחר ההשתלה. זה רלוונטי, כמו גליוזיס או הצטלקות עקב החדרת בדיקה19, במיוחד ב 48 שעות הראשונות לאחר ההשתלה20, יכול להפחית את איכות הפעילות העצבית הרשומה. התאמות מיקרו לעומק החדרת הבדיקה יכולות להגביל השפעות שליליות אלה על שלמות האות. לכן, מנגנוני מיקרו-מיקום, הנקראים בדרך כלל מיקרו-כוננים, יכולים להיות מועילים גם בבדיקות עם מספר רב של אלקטרודות המפוזרות לאורכן.
כדי להתגבר על פשרות כאלה, אנו מציגים מערכת שתלים אלקטרופיזיולוגית כרונית חדשנית לעכברים המטפלת במגבלות של עיצובים קודמים על ידי הצעת פתרון קל, חסכוני ומודולרי. מערכת השתלים DREAM מתוכננת לשקול פחות מ-10% (~2.1 גרם) ממשקל הגוף הטיפוסי של עכבר, מה שמבטיח רווחת בעלי חיים והשפעה מינימלית על ההתנהגות. תיקוף של עיצוב שתל DREAM מראה השפעה מינימלית על מדדי מפתח התנהגותיים כגון תנועה - אשר יכולה להיות מושפעת באופן משמעותי במכרסמים כאשר עומסים מופעלים על הגולגולת. זה יכול להועיל לפרדיגמות ניסיוניות המשתמשות בתנועה חופשית, כמו גם בבעלי חיים קבועים מראש, על ידי הגברת רווחתם של בעלי חיים ומתן אפשרות לניסויים מבוססים יותר מבחינה אתולוגית.
המערכת כוללת מיקרו-דרייב לכוונון גמיש של עומק הקלטה עד 7 מ"מ וניתן להתאימה לסוגים שונים של גשושיות והתקני הקלטה, מה שמספק לחוקרים כלי חסכוני ורב-תכליתי ליישומים ניסיוניים שונים. המערכת משולבת באופן שגרתי עם מיקרו-כונן מתכת21, המציע שחזור גשושיות עקבי בהשוואה למערכות אחרות (שיעור התאוששות ממוצע צפוי: כשלושה שימושים חוזרים אמינים לכל גשוש) ומפחית באופן דרסטי את עלות הניסויים הבודדים.
העיצוב כולל כלוב מגן פאראדיי המודפס בתלת-ממד, המאפשר הגנה זולה אך חזקה מפני רעש אלקטרופיזיולוגי, פגיעות מכניות וחומרים זיהומיים, ומאפשר הקלטות יציבות ונטולות רעש הסובלות משיעורי זיהום מינימליים. כלוב מושתל זה מורכב ממה שמכונה "כתר", המיועד להגנה מפני פגיעות ולספק מבנה לציפוי רשת המתכת המוליך של כלוב פאראדיי, וטבעת הכתר, המשמשת כתושבת למגבר מושתל ו/או מחבר בדיקה (ראה איור 1).
לבסוף, לוחות הראש הכלולים במערכת השתלים המודולרית מתוכננים להיות תואמים למערכת קיבוע ראש חדשנית ויעילה מבלי להוסיף נפח נוסף לשתל. בניגוד למערכות קיימות אחרות, היא אינה דורשת הידוק ברגים קטנים בסמוך לשתל, זירוז קיבוע עכברים במערך הניסוי ושיפור יחסי נסיין-חיה, כמו גם היענות התנהגותית. במקביל, לוחית הראש משמשת כבסיס לבניית המודולים האחרים של מערכת האלקטרופיזיולוגיה הכרונית DREAM.
קובצי עיצוב עבור שתל DREAM מתפרסמים כחומרת קוד פתוח ב-https://github.com/zero-noise-lab/dream-implant/. בסעיפים הבאים יתוארו התכנון והייצור של מערכת השתלים DREAM, יודגם יישומה המוצלח במודל עכבר, יידונו היישומים והיתרונות הפוטנציאליים שלה בהשוואה למערכות קיימות.
Protocol
כל הליכי הניסוי נערכו על פי ההנחיות המוסדיות של אגודת מקס פלנק ואושרו על ידי ועדת האתיקה של השלטון המקומי (Beratende Ethikkommission nach §15 Tierschutzgesetz, Regierungspräsidium Hessen, קוד אישור פרויקט: F149-2000).
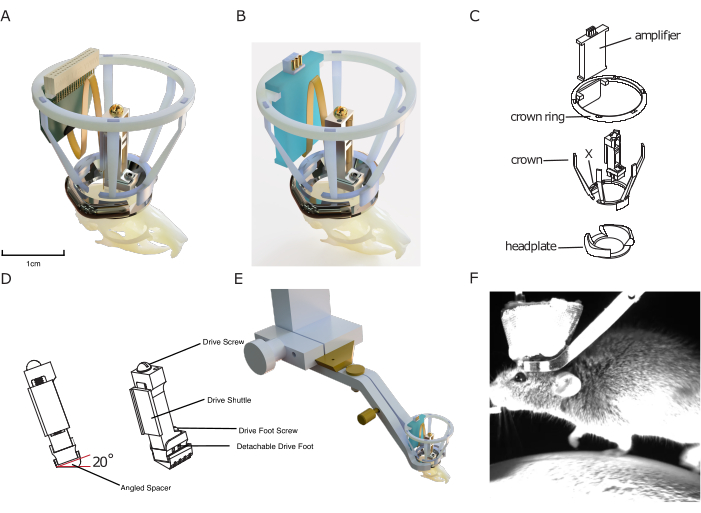
איור 1: תכנון השתל. (A) עיבוד תלת-ממדי של השתל מונח על גולגולת עכבר עם גשושית סיליקון המחוברת למחבר בדיקה. הצמצם המרכזי של לוחית הראש הוא כ-10 מ"מ לקנה מידה. גובה הכונן הוא כ 17 מ"מ. רשת הנחושת היוצרת את החלק החיצוני של כתר פאראדיי, כמו גם חוטי הארקה/ref, אינם מוצגים. (B) זהה ל-(A) עם חיבור ללוח מגבר במקום מחבר בדיקה. (C) שרטוט טכני מפוצץ של השתל, המציג את מרכיביו. (D) רינדור של ספייסר זוויתי שניתן להשתיל מתחת למיקרו-דרייב, המאפשר להשתיל את המיקרו-כונן באופן עקבי בזווית מוגדרת מראש (כאן: 20°). (E) עיבוד של מנגנון קיבוע ראש משולב, המראה לוחית ראש מושתלת עם כתר פאראדיי עם מהדק קיבוע הראש שמסביב וחיבור זנב היונה להתקנה. (F) תמונה של ראש עכבר מקובע על הליכון באמצעות מנגנון קיבוע הראש המשולב של השתל. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
הערה: סעיפים 1 ו-2 דנים בתכשירים הטרום-ניתוחיים
1. הכנת בדיקת הסיליקון
- במקרה של שימוש חוזר בבדיקה, נקו את בדיקת הסיליקון בהתאם להמלצות ספק הבדיקה. השרו את הבדיקה בחומר ניקוי אנזימטי (ראו טבלת חומרים) למשך 5-10 דקות, ולאחר מכן שטפו אותה במים נטולי מינרלים. עשו זאת מהר ככל האפשר לאחר הנטיעה. יום לפני ההשתלה (מחדש), יש להשרות את הבדיקה באתנול 70% למשך 30 דקות לפחות לצורך חיטוי.
- מדוד עכבות ערוצים כדי לוודא שהן עומדות במפרטים עבור האות המוקלט. עקוב אחר הפרוטוקול לבדיקת רמות רעש מהמדריך למשתמש22 של Neuropixels, מדוד עכבה באמצעות תוכנת ההקלטה הרצויה (למשל, https://open-ephys.github.io/gui-docs/User-Manual/Plugins/Acquisition-Board.html#impedance-testing) ועקוב אחר עכבות ערוץ היעד מיצרן בדיקת הסיליקון או גיליון הנתונים. אם העכבות גבוהות מדי, שקול לצפות מחדש את אתרי האלקטרודות23.
- הלחמת שקע זנב הלחמה בקוטר 0.05 אינץ' (ראה טבלת חומרים) לחוט הקרקע (GND) של הגשושית. חבר את השקע לסיכת GND (השלב הבא) במהלך הניתוח.
הערה: בפרוטוקול זה, לא נעשה שימוש בסיכת הפניה נפרדת (REF), מכיוון ש- GND ו- REF מקוצרים על במת הכותרת שבשימוש. לכן, רק סיכת GND תוזכר בהמשך הפרוטוקול. אם נעשה שימוש ב- REF נפרד, חזור על השלב הבא עבור סיכת REF. - כדי להכין את פין ה-GND, הכנס שוב ושוב את צד הסיכה של שקע זנב הלחמה בגודל 0.05 אינץ' (ראה טבלת חומרים) לתוך שקע זנב ההלחמה של GND בגודל 0.05 אינץ' עד להחדרתו ללא מאמץ. שימוש בסיכות מצופות זהב יכול להפחית את הצורך בשלב החלקה זה. זה מוודא כי סיכת GND ושקע יכול בקלות להיות מחובר במהלך הניתוח ללא צורך להפעיל לחץ מוגזם, הפחתת הסיכון של פציעות לבעל החיים נזק בדיקה.
- אם נעשה שימוש בקדם-מגבר מושתל עבור בדיקת הסיליקון, הכינו אותם להשתלה כרונית בהתאם לנוהלי הספק. לאחר מכן חברו את המגבר/מחבר לטבעת של כלוב פאראדיי באמצעות טיח סיליקון כדי להדביק אותו לאזור טבעת פאראדיי שנועד להחזיק את המגבר (ראו איור 1).
הערה: הכנת קדם-המגבר המושתל עבור בדיקת הסיליקון להשתלה כרונית בהתאם לנוהלי הספק עשויה לכלול ציפוי שלהם בסיליקון או אפוקסי כדי למנוע פגיעה בלחות האלקטרונית, כמו גם זיווג חוזר ונשנה של מחבר המגבר כדי להפחית את כוח ההזדווגות בעת חיבור המגבר למערכת ההקלטה במהלך הקלטות. זה שימושי במיוחד עבור משתמשי Omnetics.
2. הכנת המיקרודרייב וכיסוי הראש
- סובב את הבורג על גוף המיקרודרייב כך שמעבורת המיקרודרייב נשלפת כמעט כולה כלפי מעלה.
- לחלופין, חברו ספייסר זוויתי (ראו איור 1D) לתחתית המיקרו-דרייב באמצעות דבק ציאנואקרילט או מלט דנטלי, שניתן להשתמש בו כדי לאפשר מידה מסוימת של הטיה לשימוש, לדוגמה, בעת הקלטה דרך שכבות קליפת המוח באזור בתוך החריץ המרכזי, או בתוך מבנים עמוקים שעשויים לדרוש גישה לא מאונכת (עבור ספייסר זוויתי, ראו טבלת חומרים).
- הניחו את המיקרו-כונן אופקית על מחזיק המיקרו-כונן (איור משלים 1).
- הניחו פיסת מרק דבק קטנה (ראו טבלת חומרים) על מחזיק המיקרו-כונן במרחק מעל המיקרו-כונן שבו ימוקם מחבר הבמה-ראש. מרחק זה תלוי באורך כבל הפלקס המחבר את בדיקת הסיליקון למחבר הראש.
- הניחו טיפה זעירה של טיח סיליקון (ראו טבלת חומרים) על המעבורת.
- הוציאו את גשושית הסיליקון מאריזתה בעזרת מלקחיים קהים ורכים. הכינו אותם על ידי ציפוי מלקחיים סטנדרטיים של אף מחט בצינורות כיווץ חום בקוטר 3 מ"מ (ראו טבלת חומרים). הנח את הגשושית עם כבל ה- flex תחילה על מעבורת המיקרו-כונן כך שהקצה התחתון של כבל ה- flex יהיה תלוי מעט מעל הקצה התחתון של מעבורת ה- microdrive.
- משוך בעדינות את כבל ה- flex לכיוון החלק העליון של ה- microdrive עד שהקצה התחתון של כבל ה- flex פוגש את הקצה התחתון של מעבורת ה- microdrive. הקפד לדחוף את כבל ה- Flex כנגד הקצה השמאלי של מעבורת ה- microdrive במהלך שלב זה, כך שהוא ממוקם בדיוק אנכית על ה- microdrive בקצהו. בשלב זה, יש לוודא כי שוקי גשושית הסיליקון אינם בולטים (או רק באופן מינימלי) מעבר לקצה התחתון של המיקרו-דרייב (תלוי באורך המדויק של שוקי הבדיקה ובעומק אזור המוח הממוקד).
- הניחו את מחבר שלב הראש של הגשושית על מרק הדבק בחלק העליון של המחזיק כדי להגן על הגשושית מפני נפילה.
- השתמש במחט מזרק 27 G כדי למרוח טיפה קטנה של דבק ציאנואקרילט (ראה טבלת חומרים) בין כבל הפלקס למעבורת כדי לאבטח את הבדיקה במקומה. ודא שהדבק אינו רץ אל המיקרו-כונן או לאורך כבל הפלקס מעבר למעבורת (זה חשוב מאוד)
- לאחר הדבקת כבל הפלקס למקומו, חברו את המגבר לטבעת הכתר (ראו טבלת חומרים) באמצעות טיח סיליקון. לאחר מכן, חברו את כבל הפלקס למגבר וכסו את החיבור והכבל בשכבה דקה של טיח סיליקון.
- לאחר 5 דקות, כאשר הטיח מוגדר, לאחסן את microdrive ולבדוק בבטחה עד לשימוש נוסף.
- חתכו חתיכות של רשת נחושת (ראו טבלת חומרים) לצורת סופגנייה פתוחה (ראו תבנית חיתוך באיור משלים 2) כדי לכסות את כלוב פאראדיי.
- הדקו את מגזרת רשת הנחושת לכלוב פאראדיי בעזרת טיפות קטנות של שרף אפוקסי (ראו טבלת חומרים). בשלב זה ניתן גם להחליף אפוקסי במלט דנטלי.
הערה: כלוב פאראדיי מכיל מקום לאכסון מחבר בדיקה או מגבר. רווח זה מסומן ב-X בקובץ העיצוב, והוא מכיל בסיס תומך למגבר/מחבר, וכן מרחק גדול יותר בין שני החישורים הסמוכים של הכלוב. כדי ליצור מספיק מקום סביב המגבר/המחבר, קבע כמות קטנה של רשת נוספת בין שני החישורים הסמוכים, וצור בליטה. זה מבטיח שניתן יהיה למקם את המגבר/מחבר מאוחר יותר ב'כיס' הזה מבלי לגעת בכלוב פאראדיי. כדי להבטיח הדבקה בטוחה עם עיוות מינימלי, השתמש בטבעת הכתר המונחת ישירות על הכתר כדי לשמור על צורתו ולתמוך בחישורים הדקים של הכתר. יתר על כן, השתמשו בהלחמה המסייעת לידיים כדי לאבטח את הכתר והרשת במהלך הייבוש. אם מישהו מתקשה לשמור על צורת הכתר בעת ביצוע ההליך, נסה אפוקסי רק שתי זרועות הכתר בכל פעם כדי למנוע עיוות. - אם יש צורך בהארקה נפרדת של כלוב פאראדיי, הלחמו סיכת ראש קטנה על חוט הארקה בקוטר 30 מ"מ (ראו טבלת חומרים), ולאחר מכן השתמשו באפוקסי מוליך כדי להצמיד את החוט למגרעת רשת הנחושת.
הערה: שלב זה אינו נשמר במעבדה. - בשלב זה, לאחסן את החלקים מוכנים בבטחה, ולבצע ניתוח בשלב מאוחר יותר.
הערה: סעיפים 3-6 דנים בהשתלת המיקרו-דרייב וכיסוי הראש.
3. ניתוח: הכנת בדיקה וסביבת עבודה
- יש לעקר ולמקם את כלי הניתוח בסביבת העבודה הכירורגית לאחר הליך מאושר.
הערה: זה יכול לכלול שימוש במעקר חרוזים, מכשירים אוטומטיים, או שטיפה עם 30% חמצן או 90% אתנול, בהתאם לפרוטוקול הניסוי שאושר. - הניחו את כלי הקרמיקה המשמש להכנת המלט הדנטלי בקופסת קרח, מקרר או מקפיא, בהתאם להוראות בערכת הצמנט הדנטלי (ראו טבלת חומרים). השתמשו בכלי הקרמיקה המקורר במהלך ערבוב המלט כדי להגדיל את זמן המלט הגמיש. השתמשו בכלי מקורר בכל פעם שנדרשים שלבי צמנט ארוכים יותר.
- אם רוצים אימות היסטולוגי של מיקום הגשושית בסוף הניסוי, האריכו את גשושית הסיליקון ממש לפני הניתוח על ידי סיבוב הבורג על המיקרו-כונן נגד כיוון השעון ומרחו צבע ליפופילי (ראו טבלת חומרים) על הגשושית על ידי טבילתו בטיפה קטנה של הצבע. הכינו את הצבע הליפופילי מתמיסת מלאי מדוללת של דימתיל סולפוקסיד (DMSO) או אתנול (EtOH) שנקנתה באופן מסחרי (ראו טבלת חומרים) על ידי דילול במאגר מתאים כגון PBS בריכוז של 1-5 מיקרומטר.
4. ניתוח: הכנת החיה
- בצע פרוטוקול הרדמה מאושר לניתוח מכרסם 2-4 שעות בתנאים אספטיים. זה יכול לכלול הרדמה כללית ומקומית, שיכוך כאבים, יישום של משחות עיניים, וזריקות של מלוחים. כאן, השתמש בהרדמה בהזרקה (קטמין 100 [מ"ג/ק"ג]/מדטומידין 0.5 [מ"ג/ק"ג]) יחד עם קרם משככי כאבים מקומי ומשחת עיניים (ראה טבלת חומרים), והנח את בעל החיים על כרית חימום כדי לווסת את טמפרטורת הגוף.
- כאשר בעל החיים מורדם לחלוטין, העבירו אותו לאזור גילוח נפרד שאינו סטרילי.
- ודא כי החיה מחוממת מספיק; לדוגמה, הניחו אותו על כרית חימום. הסר שיער בחלק העליון של הגולגולת. עשו זאת עם מכונת גילוח חשמלית או קרם אפילציה (ראו טבלת חומרים) או על ידי גילוח חוזר ונשנה של החלק העליון של הראש עם אזמל מכוסה באתנול 70%.
- הסר בזהירות שערות רופפות כדי לוודא שהן לא יבואו במגע עם רקמות חשופות מאוחר יותר. כדי להסיר שערות, יש להשתמש, למשל, ברקמות שהורטבו באתנול 70% ו/או במשאבת כדורי לחיצה. אם אתם משתמשים בקרם דפילציה, הקפידו להסיר אותו היטב באמצעות צמר גפן ומי מלח.
- יש לחטא את האזור המגולח מספר פעמים בחומר חיטוי על בסיס יוד (ראו טבלת חומרים) ובאלכוהול באמצעות צמר גפן, תוך מעבר ממרכז הראש לצדדים כדי להבריש את השערות הרופפות שנותרו הרחק ממקום החתך.
- יש לחטא את הפרווה על הראש ומסביבו באמצעות בטאדין. זה מבטיח אזור עבודה סטרילי ומגן על מכשירים וחומרים כירורגיים מפני מגע עם פרווה לא סטרילית.
- הניחו את בעל החיים במסגרת סטריאוטקטית באמצעות מוטות אוזניים ומחזיק אף (ראו טבלת חומרים).
- בעזרת מספריים כירורגיים קטנים (ראו טבלת חומרים), חותכים פתח בצורת שקד בעור שעל גבי הגולגולת, ומגיעים רק מהצד האחורי של תפר הלמדא אל בין העיניים.
- הסר את הקרום התת עורי ואת periosteum על ידי חיתוך בעודו רטוב, ולאחר מכן לגרד את הגולגולת עם להב אזמל כדי להסיר רקמת קרום רך על פני הגולגולת שעלול לעכב הידבקות של מלט שיניים.
- אופציונלי: לאחר ניקוי הגולגולת מרקמת הממברנה, יש למרוח שכבה דקה של 0.5% מי חמצן ולשטוף אותה בחומר חיטוי על בסיס מים (למשל, בטדין) לפני חספוס פני השטח של הגולגולת כדי לשפר את הידבקות הפריימר לגולגולת.
- בזהירות לחספס את פני הגולגולת על ידי גירוד דפוס crisscross עם קצה אזמל הפוך הפוך. זה עוזר מלט שיניים להיצמד לגולגולת מאוחר יותר.
הערה: אין לגרד חזק מדי על גבי התפרים מכיוון שהדבר עלול לגרום לתפרים להיקרע ולדלוף נוזל תוך גולגולתי, מה שפוגע בהידבקות של הצמנט הדנטלי. - החליפו בין להב אזמל לניצני כותנה סטריליים כדי לגרד/לדחוף בעדינות את שרירי הצוואר המחוברים לצידי תפר הלמדא עד שהשרירים נדחפו חזרה ל"קצה" של הגולגולת על גבי המוח הקטן. זה עוזר למזער את רעש השרירים בהקלטות עצביות.
- מלאו מזרק 1 מ"ל במחט 27 גרם (ראו טבלת חומרים) בכמויות קטנות של דבק ציאנואקרילט כירורגי (ראו טבלת חומרים). לאחר מכן, הדביקו את העור לקצוות הגולגולת באמצעות המזרק כדי למרוח עליו טיפות זעירות של דבק-על. הדביקו רקמה שטוחה ככל האפשר לגולגולת כדי להשאיר מקום לשתלים. הליך זה מבטיח שהעור והשרירים לא יבואו במגע ישיר עם חלקי השתל, מה שמונע רעשי שרירים ברישומים ומשפר את היצמדות הצמנט הדנטלי.
- יש למרוח פריימר צמנטי דנטלי על פני הגולגולת להדבקה נוספת ולהתקשות עם אור UV (ראו טבלת חומרים). הדבר משפר את הידבקות הצמנט הדנטלי ומונע דליפת תפרים גולגולתיים והחלשת הקשר בין הגולגולת לצמנט לאורך זמן.
- מצא את מיקום היעד להשתלת הבדיקה ביחס לברגמה או למדא ותאר את הקרניוטומיה סביבו עם סמן ניתוחי. הניחו את לוחית הראש על הגולגולת כך שהקרניוטומיה נמצאת בתוכה, עם מקום למיקרודרייב בצד אחד של הקרניוטומיה, כמו גם עבור 1-2 פיני הארקה.
- השתילו את לוחית הראש באמצעות מלט דנטלי. מערבבים מלט דנטלי בכלי הקרמיקה המקורר המיועד (ראה שלב 3.2). ודא שלוחית הראש נצמדת לגולגולת מכל הצדדים, ויוצרת 'באר' אטומה למים.
- בעזרת מקדחה דנטלית (גודל US 1/2 HP), קדח חור בור קטן ברוחב פיני הכותרת שהוכנו בשלב 1.4 מעל אזורי המוח שישמשו כ- GND/REF. אם רוצים לקרקע את כלוב פאראדיי, קדח חור בור קטן נוסף קרוב לקצה כלוב פאראדיי עבור סיכת הכותרת Faraday-GND.
הערה: עבור סיכות הכותרת GND/REF, מקם את הקרניוטומיה במרחק מספיק מקצה הכלוב, כך שניתן יהיה למקם את סיכת הכותרת עצמה בתוכה מאוחר יותר מבלי לגעת בכלוב פאראדיי. - נקו את הקרניוטומיה על ידי טפטוף עדין של מי מלח סטריליים עליה עם מזרק והסרתם בעזרת מגבונים שאינם נושרים (ראו טבלת חומרים). חזור על הפעולה עד להסרת כל הדם והרקמה הרופפת.
- הכינו תמיסת אגר 0.7% (ראו טבלת חומרים) במי מלח, קררו אותה מעט והכניסו אותה לקרניוטומיה באמצעות מחט 27 גרם על מזרק 1 מ"ל.
- הכנס בעדינות פין GND (ראה שלב 1.3) לכל קרניוטומיה שנקדחה בשלב הקודם. הסיכות יהיו מוקפות באגר מכל הצדדים (ראה שלב 4.17). מרחו מלט סביב פיני הכותרת כדי לאבטח אותם ולספק בידוד חשמלי.
- נקו את כלי הקרמיקה והחזירו למקרר/מקפיא.
- בעזרת מקדחה דנטלית, קדח את קווי המתאר של קרניוטומיה גדולה יותר (עגולה או מרובעת) על ידי תנועה סביב הקצה בתנועות יציבות. ודא כי craniotomy הוא 1 מ"מ x 1 מ"מ עד 2 מ"מ x 2 מ"מ כדי לאפשר התאמות קטנות למיקום של הבדיקה כדי למנוע כלי דם מבלי לחשוף יותר מדי של קליפת המוח. במידת האפשר, הימנעו מהנחת קרניוטומיות מעל תפרים. קודחים בסבבים של 20-30 שניות, ומקררים את הגולגולת במי מלח בין סבבי הקידוח.
הערה: בתחילת הקידוח, כדאי לסמן את הקצה המוביל של המיקרו-כונן עם סמן, ובכך להבטיח שבעת הקידוח, ניתן יהיה ליצור קצה ישר במקביל לקצה המוביל של המיקרו-דרייב. זה משפר את הסיכויים של הימנעות מלט craniotomy בעת קיבוע microdrive במקום, כמו גם שיפור הידבקות, מניעת microdrive overhang מעל craniotomy ומאפשר תמרון רוחבי גדול יותר בעת הצבת microdrive ביחס למיקום אתר ההקלטה הסופי. - לאחר מספר סבבים ראשוניים של קידוח, בדקו את ההתנגדות של החלק הקדוח של העצם על ידי דחיפה עדינה עליו עם מלקחיים עדינים (גודל 5 או דק יותר; ראו טבלת חומרים).
- המשיכו לבדוק בין סבבי הקידוח עד שהעצם מתחילה "לקפוץ" מתחת למלקחיים כאשר דוחפים אותה. כאשר זה המקרה, להוסיף טיפת מלח על גבי craniotomy כדי לרכך את העצם, ולאחר מכן להשתמש במלקחיים כדי להסיר בעדינות את חתיכת העצם קדוח.
- אם לא ניתן להסיר את העצם בעדינות, בצעו סבב נוסף של קידוח, תוך התמקדות בנקודות בהן העצם עדיין מחוברת חזק יותר. באופן כללי, יש לשאוף להסיר את הגולגולת בלחץ עדין מהמלקחיים לפני שהיא נקדחה לחלוטין, מכיוון שזה בדרך כלל ממזער את הנזק לרקמות.
הערה: יש לוודא שפני השטח של הדורה רטובים באופן קבוע, הן במהלך הקידוח להורדת הטמפרטורות והן לאחר הסרת דש העצם. זה משפר את הסיכויים של החדרה קלה של הבדיקה על ידי מניעת הדורה מלהתייבש ולהיות מאתגר יותר לחדור. אם הדורה מתגלה כקשה מדי לחדירה, או אם משתמשים בבדיקות קהות או מרובות שוקיים, דורוטומיה מבוצעת על ידי הרמת הדורה עם מחט 27 גרם וביצוע חתך קטן מתחת לטבילה במי מלח כדי למנוע מהדורה להידבק לפני השטח של המוח.
- כסו את הקרניוטומיה בספוג המוסטטי (ראו טבלת חומרים) ספוג במי מלח קרירים וסטריליים כדי להגן על הדורה והמוח.
5. ניתוח: השתלת בדיקה
- חבר את מחזיק המיקרו-כונן המותאם אישית (ראה טבלת חומרים) לזרוע של המנגנון הסטריאוטקטי. אם המיקרו-כונן הוסר ממחזיק המיקרו-כונן לאחר הכנת הבדיקה, מקם את המיקרו-כונן עם בדיקת הסיליקון המחוברת לתוך מחזיק המיקרו-כונן. זווית זרוע סטריאוטקסית לפי הצורך כדי להגיע לאזור הרצוי במוח המטרה. הניחו את טבעת הכתר עם המגבר המחובר על שלושת הפינים האנכיים בחלק האחורי של מחזיק המיקרו-כונן (ראו איור משלים 1).
- הנמיכו את המיקרו-כונן למרחק ~0.5 מ"מ מהקרניוטומיה, ולאחר מכן השתמשו במלקחיים כדי לחבר את פיני ראש ה-GND/REF המחוברים לבדיקה לפינים המתאימים של GND/REF שהושתלו על הגולגולת (ראו שלבים 4.14-4.15). ראו איור משלים 3 ואיור משלים 4 לקבלת דוגמאות של כונן, קרניוטומיה ומיקום סיכות GND/REF.
- לאחר שהפינים נמצאים במקומם, יש לאבטח את הפינים בטיפת אפוקסי כסף מוליך (ראו טבלת חומרים) לחיבור חזק יותר. לאחר ריפוי אפוקסי הכסף, כסו את הפינים המחוברים בכמות קטנה של מלט דנטלי (ראו טבלת חומרים) כדי להבטיח שהחיבור יישאר יציב לאורך זמן ושאין חיבור חשמלי לרקמות הסובבות ו/או לאלמנטים של השתל.
- הסר את הספוג ההמוסטטי מהקרניוטומיה (ראה שלב 4.22).
- מקם את הזרוע הסטריאוטקטית עם המיקרו-כונן מעל הקרניוטומיה.
הערה: אם הבדיקה נסוגה, ודא שהמיקרו-כונן ממוקם באופן שהבדיקה תיגע בחלק של הקרניוטומיה שאינו מכיל כלי דם גדולים. - הנמיכו את המיקרו-דרייב, במידת הצורך, על ידי התאמת המיקום והזווית עד ששוק הגשושית ייגע בדורה או במשטח המוח (ראו שלב 4.21) באזור המטרה.
- מערבבים מלט דנטלי בצלחת הקרמית הייעודית (ראה שלב 3.2), ומבססים את בסיס המיקרו-דרייב במקומו, תוך התמקדות בשלושת הצדדים של בסיס המיקרו-דרייב שאינם פונים לאלקטרודה. ודא שהמלט אינו נוגע במיקרו-כונן שמעל ה'בסיס' הנשלף (ראה איור 1D).
- יש לוודא שכל רווח בין הבסיס לגולגולת מכוסה במלואו במלט דנטלי. נקו את כלי הקרמיקה והחזירו למקרר/מקפיא. מחכים שהמלט יתרפא, בערך 10-15 דקות.
הערה: נותר רווח קטן בין בסיס המיקרודרייב לגולגולת, והמלט משמש בצורתו הנוזלית ביותר כדי למלא אותו. לאחר שהמלט התעבה מעט, נבנה המלט בין דפנות בסיס המיקרודרייב לבין הגולגולת. כמויות קטנות מאוד של מלט משמשים תמיד, כמו זרימת החומר יכול להיות בלתי צפוי, נפחים גדולים יותר עשויים לזרום לאזורים לא רצויים. ניתן להשתמש בכמויות קטנות של ספוג המוסטטי טבול במי מלח כדי לכסות חלקים מהקרניוטומיה. אם מלט צריך לזרום בטעות על craniotomy, להסיר את המלט עם מלקחיים ברגע שהוא נכנס מרקם דמוי סרט.
- יש לוודא שכל רווח בין הבסיס לגולגולת מכוסה במלואו במלט דנטלי. נקו את כלי הקרמיקה והחזירו למקרר/מקפיא. מחכים שהמלט יתרפא, בערך 10-15 דקות.
- הורידו את גשושית הסיליקון אל המוח, תוך מעקב קפדני אחר מיקום הגשושית באמצעות מיקרוסקופ. כאשר שוקי הגשושית נוגעים במוח, הנמיכו את הגשושית במהירות ב~250 מיקרומטר (סיבוב מלא אחד של הבורג הוא 282 מיקרומטר) כדי להבטיח שהגשושית תפרוץ את ההתנגדות של משטח הדורא/קליפת המוח.
- אמת זאת באופן חזותי. אם הגשושית לא פרצה לתוך קליפת המוח, המתינו 5 דקות, ואז נסו לחרוט את הדורה עם קצה השוק על ידי העלאה והורדה חוזרת ונשנית של הגשושית בכמה עשרות מיקרומטרים בזמן שהדורה/קליפת המוח נמצאת תחת מתח מקצה הגשושית.
- לאחר שהגשושית פרצה את פני השטח של קליפת המוח, הנמיכו אותה בהדרגה בקצב איטי יותר (100-200 מיקרומטר לדקה) עד שקואורדינטות המטרה יגיעו או שהגשושית תזוז ביותר מ-1000 מיקרומטר. אם המטרה דורשת מהגשושית לנוע ביותר מ-1000 מיקרומטר, קדם את הגשושית בצעדים של מקסימום 1000 מיקרומטר לסשן במהלך סבבי ההקלטה הבאים עד להשגת קואורדינטות המטרה.
הערה: דלג על שלב זה אם ניטור אותות עצביים תוך הורדת בדיקת הסיליקון עדיף. השלבים לכך מתוארים בסעיף 7. - הכינו אלסטומר סיליקון בהתאם להוראות (ראו טבלת חומרים) ושפכו טיפה קטנה לתוך הקרניוטומיה באמצעות מזרק 1 מ"ל (ראו טבלת חומרים).
- לאחר הייבוש, כסו את אלסטומר הסיליקון בתערובת של 50/50 שעוות עצם ושמן מינרלי. צעד זה מגן עוד יותר על הבדיקה ומונע הצטברות של פסולת ופלזמה יבשה על הקרניוטומיה, מה שהופך את החילוץ לפשוט ובטוח יותר. נקטו משנה זהירות, שכן עבודה סביב הגשושית בזמן שהיא מונמכת עלולה להוביל לשבירה.
6. ניתוח: השתלת כלוב פאראדיי
- כאשר הצמנט הדנטלי התמצק במלואו, שחררו את מחזיק המיקרו-כונן על-ידי שחרור הבורג הצידי המקבע את הכונן באמצעות מפתח אלן (ראו איור משלים 1). משוך בעדינות את המחזיק ב~1 ס"מ כך שהמיקרו-כונן עומד בפני עצמו, אך מגבר/מחבר הבדיקה נשאר מקובע למחזיק השתל מבלי למתוח את כבל הפלקס.
- הניחו את הכתר המוכן מראש ואת רשת פאראדיי סביב לוחית הראש על ידי מתיחת הכלוב בפתח וחריץ אותו מעל המיקרו-דרייב וכבל הפלקס אופקית, ולאחר מכן קבעו אותו על לוחית הראש עם מלט דנטלי.
הערה: הקפד לסגור את כל החללים בין כלוב פאראדיי לגולגולת עם מלט דנטלי כדי להגן על השתל מפני זיהום. - הניחו את טבעת הכתר של פאראדיי (ראו טבלת חומרים) עם מחבר/במת ראש מעל הכתר, יישרו את המחזיק המשולב למגבר/מחבר הבדיקה עם האזור המסומן ב-X מוכנס על כתר פאראדיי (ראו שלב 2.13).
- הצמידו את הטבעת לכלוב פאראדיי בעזרת טיפה קטנה של דבק ציאנואקרילט או מלט דנטלי בכל צומת טבעת.
- לאחר שטבעת פאראדיי עם מגבר/מחבר בדיקה משולב מאובטחת במקומה, משוך לחלוטין את הזרוע הסטריאוטקטית עם מחזיק המיקרו-כונן. ראו איור משלים 3 לקבלת מדריך שלב אחר שלב על הרכבה של רכיבים אלה.
7. רישום בדיקה לאחר הניתוח
- חבר את המגבר / מחבר הבדיקה לחומרת ההקלטה והתחל הקלטה.
- אם הגשושית עדיין לא הגיעה למיקום היעד שלה במהלך ההחדרה הראשונית (ראה שלב 5.9), סובב באיטיות את בורג המיקרו-כונן נגד כיוון השעון כדי להוריד את הגשושית תוך ניטור אותות עצביים.
הערה: האותות צריכים להשתנות א) כאשר אלקטרודות נוגעות בשכבת אלסטומר הסיליקון שמעל הקרניוטומיה, וב) כאשר האלקטרודות מתחילות לנוע לתוך המוח (ראה שלב 7.2). פעילות עצבית בתדר גבוה תירשם על ידי אלקטרודות המוחדרות במלואן למוח, בעוד שאלקטרודות שנמצאות במגע עם CSF על פני השטח של המוח יראו בדרך כלל אות אוכלוסייה עצבית מסונן במעבר נמוך ללא פעילות דוקרנת (בדומה למעקב EEG), ואתרי הקלטה באוויר ירשמו רעש חשמלי מוגבר. ניתן גם לאמת את עומק החדרת הבדיקה על ידי מדידת העכבה של ערוצים בודדים לאחר הקלטת הבדיקה. ערוצים הבאים במגע עם האוויר צריכים להראות עכבה גבוהה (המעידה על מעגל פתוח) ועכבות כמו אלה שנמדדו לפני הניתוח עבור התעלות הנוגעות ב- CSF או שכבר נמצאות במוח. קדם את גשושית הסיליקון במרחק כולל מרבי של כ- 1000 מיקרומטר לכל הפעלה, במהירות מרבית של כ- 75 מיקרומטר לדקה (ראה שלב 5.5). - כאשר פוטנציאלי שדה מקומי עצבי נראים על פני הגשושית ו / או הגשושית מתקדמת במקסימום של 1000 מיקרומטר, סיים את הקלטת הבדיקה ונתק את מחבר שלב הראש.
8. התאוששות
- כסו את כלוב פאראדיי בעטיפה וטרינרית עצמאית (ראו טבלת חומרים).
- יש להפסיק את ההרדמה ולאפשר לבעל החיים להתאושש למשך מספר ימים בהתאם להנחיות הניסוי המאושרות.
- אם האלקטרודות על גשושית הסיליקון עדיין לא נמצאות במיקום היעד הרצוי, סובב את בורג המיקרו-כונן בצעדים קטנים עם מקסימום ארבעה סיבובים מלאים (או ~ 1000 מיקרומטר) לכל הפעלה. במידת הצורך, חזור על הליך זה במשך מספר ימים עד להשגת היעד. מומלץ לשלב את תנועת הגשושית עם הקלטות סימולטניות להערכת הפעילות האלקטרופיזיולוגית באזורים הרוחביים.
9. ניסויים התנהגותיים והקלטות כרוניות
- עבור הקלטות כרוניות של קיבוע ראש במהלך ביצוע משימה, חברו את לוחית הראש בבסיס כלוב פאראדיי למהדק קיבוע הראש על-ידי פתיחה ידנית של המהדק והידוק לוחית הראש המושתלת (ראו איור 1C, E, F).
הערה: אם אין צורך בקיבוע ראש, ניתן להשתמש במערכת שתלים זו גם להקלטות הנעות בחופשיות. עבור הקלטות הנעות בחופשיות, דלג על שלבים 9.1 ו- 9.7. - הסירו את העטיפה הווטרינרית הנצמדת מעצמה מהשתל.
הערה: כדי למזער את אי הנוחות עבור החיה, מומלץ להתחיל במשימה התנהגותית פשוטה ומתגמלת לפני שלב זה כהסחת דעת בזמן שהנסיין עובד עם השתל. - חבר מגבר/מחבר לציוד הקלטה.
- בצע הקלטות עצביות בזמן שהחיה מבצעת את המשימה.
הערה: אם המטרה היא למקסם את מספר היחידות החוץ-תאיות שנרשמו, הזיזו את המעבורת בכמה עשרות מיקרומטרים בכל פעם שהתשואה העצבית במיקום מסוים יורדת. שים לב שלאחר הזזת הגשוש, האות יכול לקחת דקות עד שעות כדי להתייצב. לכן, ייתכן שיהיה מועיל להזיז את הגשושית בסוף ההפעלה כך שהאות יוכל להתאושש עד לתחילת ההפעלה הבאה. - נתקו את ציוד ההקלטה וכסו את השתל בעטיפה וטרינרית חדשה בסוף ההקלטה ההתנהגותית.
- פתח את מהדק קיבוע הראש כדי לנתק את בעל החיים מקיבוע הראש.
10. התאוששות הבדיקה
- בסוף ההקלטה הסופית, משוך את גשושית הסיליקון רחוק ככל האפשר אל המיקרו-כונן על ידי סיבוב הבורג בכיוון השעון. עשו זאת בזמן שבעל החיים מקובע לראש ומתנהג או כשהחיה מורדמת במערך הניתוחי. מיפוי היציאה של הגשושית מהמוח על-ידי ניטור אותות עצביים בו זמנית ובדיקת החתימה של אלקטרודות השקועות במוח, נוגעות בפני השטח של המוח או באות במגע עם האוויר (ראו שלב 7.3).
הערה: בהתאם לפרוטוקול ההיסטולוגיה והבדיקה, נגעים אלקטרוליטיים מבוצעים לפני משיכת הבדיקה כדי לקבוע את המיקום המדויק של כמה אלקטרודות על הבדיקה. אם אין צורך במעקב אחר יציאת הגשושית באמצעות הקלטה עצבית, ניתן גם לבטל את הבדיקה לאחר סיום הבדיקה. - להפסיק את בעל החיים בהתאם להנחיות מאושרות (זה כולל לבלבל את החיה אם מתוכנן קיבוע המוח להיסטולוגיה הבאה).
- המתן ~ 10 דקות לאחר שהחיה מתה. לאחר מכן, קבע את הראש של החיה בסטריאוטקס, וודא כי ראשה של החיה אינו יכול לזוז במהלך החציבה כדי למנוע שבירת בדיקה.
- יש למרוח טיפת מלח על גבי הקרניוטומיה ולתת לה להשרות למשך מספר דקות כדי לרכך רקמה ביולוגית מיובשת על שוק הבדיקה ולהקטין את הסיכוי לשבירת השוק.
- מקם את המחזיק הסטריאוטקטי כ-0.5 ס"מ מעל המיקרו-כונן. לאחר מכן חתכו את הקצה העליון של החישורים של כלוב פאראדיי בעזרת מספריים כירורגיים קטנים (ראו טבלת חומרים) כדי לשחרר את טבעת פאראדיי שמחזיקה את המגבר/מחבר והעבירו את הטבעת בחזרה אל הפינים האנכיים בחלק העליון של המחזיק הסטריאוטקטי (ראו שלב 5.1 ואיור משלים 1).
- חותכים בזהירות את רשת הנחושת עם אותם מספריים כירורגיים על ידי חיתוך אזורי רשת בצורת U בין החישורים של כתר פאראדיי. לאחר מכן, חתכו את חישורי הפלסטיק של הכתר בבסיס.
הערה: הימנע מכיפוף חישורי הפלסטיק המודפסים בזמן שהם נחתכים, מכיוון שהם עלולים להיצמד ולשלוח פסולת פלסטיק שעפה לעבר הגשוש. - הנמיכו את המחזיק הסטריאוטקטי עד שניתן יהיה לקבע את המיקרו-כונן במחזיק באמצעות הבורג הרוחבי של המחזיק, קבעו את המיקרו-דרייב, ואז שחררו את בורג ה-T1 המחבר את גוף המיקרו-כונן לבסיס המיקרו-כונן.
- משוך באיטיות את הזרוע הסטריאוטקטית עם מחזיק השתל כדי להרים את המיקרו-כונן מבסיסו. ודא שהמיקרו-כונן נפרד מהבסיס בזווית ניצבת (כלומר, "אנכית" מהבסיס).
הערה: אם גוף המיקרו-כונן ובסיסו אינם נפרדים בקלות, ודא שתנועת הזרוע הסטריאוטקטית אינה בזווית בהשוואה לכיוון המיקרו-כונן. במידת הצורך, המחזיק והמיקרו-כונן מיושרים מחדש זה לזה על ידי שחרור קל של קיבוע ראש החיה ומיקומו מחדש בהתאם. יישור נכון הוא אחד ההיבטים החיוניים לשחזור קל של המיקרו-כונן. כמו כן, בדוק אם יש שאריות של מלט דנטלי המחבר בין בסיס המיקרודרייב והמיקרו-כונן (ראה שלב 5.5). אם כן, המלט מגרד בזהירות בעזרת אזמל ו/או מקדחה דנטלית בהתאם לכמות המלט בה נעשה שימוש. - הרימו את הזרוע הסטריאוטקטית עם הגשושית המחוברת כדי ליצור מספיק מקום מתחתיה.
- הסר את בעל החיים מהסטריאוטקס, והכן את המוח על ידי ביצוע פרוטוקול היסטולוגיה מאושר אם תרצה. שחזרו את בסיס המיקרו-כונן המושתל ונקו אותו על ידי השרייתו באצטון למשך מספר שעות לשימוש חוזר מאוחר יותר.
- הניחו בסיס מיקרו-דרייב נקי על מרק דבק (ראו טבלת חומרים), ואז הורידו את המיקרו-דרייב לבסיס והדקו את הבורג. כדי למנוע שבירה, עקוב אחר מיקום הבדיקה תחת מיקרוסקופ לאורך כל התהליך. שלב זה יכול להסתיים במועד מאוחר יותר אם יש לנקות תחילה את בסיס המיקרו-כונן המושתל לשימוש חוזר.
הערה: פרוטוקול זה קורא לשימוש במרק דבק כפלטפורמה לבסיס, שהוא חיוני מכיוון שהוא גם מאבטח את הבסיס וגם בעל מידה מסוימת של נתינה, ומבטיח שהבסיס לא יחליק ויתנגש עם הגשוש. יש לעצב את המרק כפני צוק אנכיים בצד בסיס המיקרו-דרייב שבו יונמך הגשושית. זה מבטיח שאם הגשושית מונמכת מעבר לבסיס, היא לא יוצרת מגע עם המרק שמתחת. "מגדל" המרק צריך להיות גם גבוה מספיק כדי שאם הוא מונמך מעבר לבסיס המיקרו-כונן, הגשושית לא תיצור מגע עם משטח השולחן שעליו מונח המרק. לבסוף, הדקו היטב את המרק לפני השטח כדי למנוע ממנו להחליק או ליפול. בעת הורדת המיקרו-דרייב לבסיס המיקרו-כונן המוחזק על ידי המרק, ודא מבט פרופיל צדדי מהמיקרוסקופ כדי לעקוב אחר ההתקדמות, כך שכאשר הגשושית מונמכת, היא לא תתנגש לא בבסיס ולא במרק. - נקו וחיקרו את הבדיקה בהתאם להוראות היצרן. עבור הבדיקות הנפוצות ביותר, השרו אותן בחומר ניקוי אנזימטי (ראו טבלת חומרים) למשך 12 שעות, ולאחר מכן שטפו במים נטולי מינרלים וחיטאו באלכוהול. עשו זאת על ידי הורדת הגשושית לתוך גדולה המכילה את השואב האנזימטי בעודה מחוברת למחזיק המיקרו-כונן בזרוע הסטריאוטקטית.
הערה: אם תרצה, מדוד את העכבות של האלקטרודות על הבדיקה לאחר הניקוי כדי לפקח על השפלה פוטנציאלית של אלקטרודות בודדות. - אחסנו את המיקרו-דרייב עם הגשושית שנוקתה בבטחה עד לניסוי הבא.
תוצאות
פרוטוקול זה מציג מערכת השתלה כרונית המאפשרת לחוקרים ליישם רישומי אלקטרופיזיולוגיה כרונית קלי משקל, חסכוניים ובטוחים בעכברים מתנהגים (איור 1). הגורמים העיקריים הקובעים יישום מוצלח של גישה זו כוללים: כיסוי מלטי מלא של הגולגולת, קרניוטומיה זעיר פולשנית ומוגנת כראוי, חיבור מאובטח של microdrive וחיווט לגולגולת והמשכיות מלאה של חומר פאראדיי מגן. כאשר נקודות אלה נלקחות בחשבון, הקלטות באיכות גבוהה ניתן להגיע באופן עקבי. להלן תוצאות מייצגות הנוגעות להיבטים העיקריים הבאים של הצלחת הניתוח:
1) האם השתל מפריע להתנהגות בעלי החיים או לרווחתם?
2) האם איכות האות גבוהה, והאם ניתן לשמור על אותות לאורך זמן?
3) האם ניתן לשלב הקלטות בקלות עם ביצוע משימות?
כדי להעריך את השפעת השתל על התנהגות בעלי החיים, ניתחנו דפוסי תנועה בחמש חיות מושתלות. איור 2A מראה דוגמה של חיה שנעה בחופשיות בתוך כלוב משחקים במשך 10 דקות לפני ההשתלה ושבוע אחריה. ניתן לראות שדפוסי התנועה אינם משתנים. התצפית הזו מאושרת על-ידי איור 2B, C , שמראה את ההתפלגויות של מהירויות התנועה וכיווני הראש בין חיות. גם מהירות הריצה וגם כיווני הראש לא השתנו כמעט לפני ואחרי ההשתלה, ואם כבר, נראה היה שמהירויות הריצה מעט גבוהות לאחר הניתוח. סרטון משלים 1 מציג הקלטת וידאו קצרה של בעל חיים 6 ימים לאחר ניתוח ההשתלה. התנהגויות אופייניות לכלוב ביתי כמו תנועה, טיפוח, גידול וליקוט מזון בסביבה הביתית נראות לעין ומצביעות על התאוששות מוצלחת מניתוח, כמו גם על בריאות כללית. ההשפעה ההתנהגותית הנמוכה של השתל נובעת ככל הנראה ממשקלו הנמוך ומגובהו הניתן לניהול.
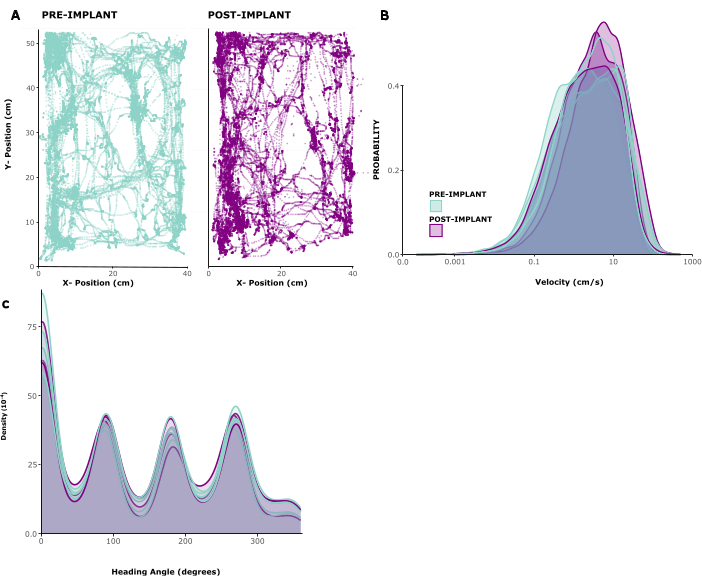
איור 2: תנועה לפני ואחרי ניתוח. (A) תנועה לדוגמה של בעל חיים לפני (פאנל שמאלי) ואחרי (פאנל ימני) השתלה. קואורדינטות x/y הן בסנטימטרים, נקודות מראות את מיקום החיה בכל נקודת זמן על פני פרק זמן של 10 דקות. (B) התפלגות מהירויות התנועה בס"מ לשנייה במשך 5 מפגשים לפני ו-3 מפגשים אחרי ההשתלה ב-5 בעלי חיים. (C) צפיפות ליבה עבור הסתברות לתנועה בכיוונים שונים, עבור אותם מפגשים שנותחו ב-(B). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
לאחר מכן, מוערכת איכות האות בפוטנציאל שדה מקומי (LFP) ופעילות דוקרנים באתרי הקלטה. כאן אנו מראים נתונים מייצגים מרישומים בקליפת המוח בקליפת המוח הראייתית הראשונית (V1). לצורך אימות, פעילות משוערת של יחידה אחת חולצה מאותות עצביים בפס רחב שנרשמו ב-V1 של עכבר ער באמצעות קילוסורט 3 (ראו איור 3). איור 3A מראה את המיקום של יחידות בודדות שחולצו על שוק הגשושית, איור 3B מראה את צורות גל הספייק המתאימות, ואיור 3C מראה את תגובות הדוקרנים של אותם תאי עצב לפרוטוקול צפיפות מקור נוכחית (CSD). בפרדיגמה זו, הוצגו הבזקי שדה רחב עם משך של 300 מילישניות בתדר של 1 הרץ (כלומר, 300 מילישניות מופעל, 700 מילישניות כבוי) במשך 200 ניסויים. לבסוף, איור 3D מראה את התגובות של אותן יחידות לפרוטוקול מיפוי שדה קלט חזותי, המורכב מ-2,000 פריימים של ריבועים שחור-לבן שנבחרו באופן אקראי על רקע אפור, וכל אחד מהם מוצג במשך 16.6 אלפיות השנייה. ריבועים כיסו זווית ראייה של 12 מעלות כל אחד ונבחרו משדה של 15 x 5 מיקומים אפשריים כך שפרדיגמת המיפוי כיסתה מרחב חזותי של -90 עד +90 מעלות אזימוט ו -30 עד +40 מעלות גובה בסך הכל. תגובות קצב הירי לכל מסגרת גירוי חולצו על ידי ניתוח קצב הירי המרבי על פני חלון של 16.6 אלפיות השנייה, בכפוף להשהיה של בין 40-140 מילישניות, שזוהתה כאופטימלית לכל ערוץ בהתבסס על הפעילות המרבית בכל חלון. סוג זה של הקלטה יכול לשמש כדי להנחות את התאמת עומק ההחדרה של כל אלקטרודה ולהעריך את איכות האות לאחר ניתוח השתל.
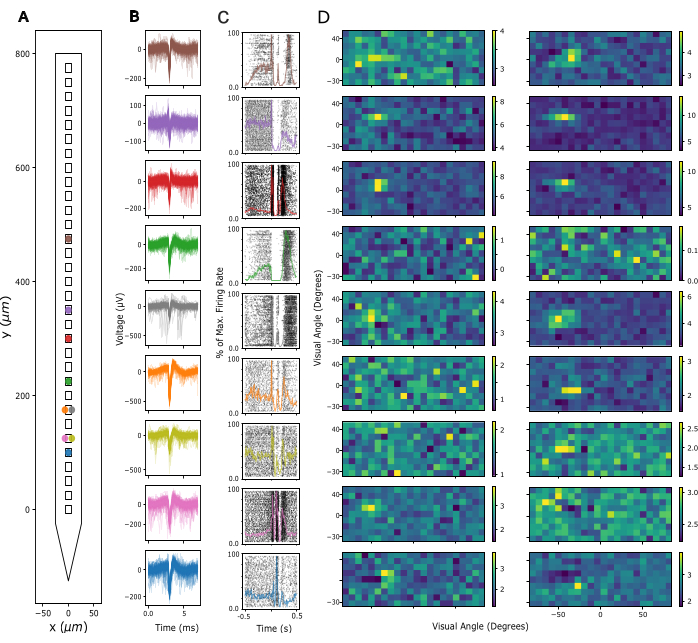
איור 3: אותות עצביים מוקלטים. (A) מיקום מוסק של יחידות בודדות הממוינות לפי חבילת מיון ספייק של קילוסורט 3 לאורך מגעי האלקטרודות של הגשושית. (B) צורות גל ספייק עבור אותן יחידות המוצגות ב-A על פני 5 מילישניות של זמן. קווים דקים: צורות גל ספייק בודדות. קווים עבים: צורת גל ספייק ממוצעת. (C) תרשים רסטר של קוצים בתגובה לפרדיגמת צפיפות מקור נוכחית (CSD) המציגה הבזקי שדה רחב של 300 אלפיות השנייה ואחריה מסך שחור של 700 אלפיות השנייה. תגובות מוצגות עבור אותן יחידות כמו ב- A ו- B. קווים צבעוניים על גבי מייצגים היסטוגרמות זמן peri-stimulus (PSTHs) של אותן תגובות. קצבי הירי עבור ה-PSTH חושבו בפחים של 10 אלפיות השנייה ולאחר מכן נורמלו לפי קצב הירי המרבי על פני כל ה-PSTH. זמן 0 מרוכז סביב גירוי הבזק שדה רחב. (D) שדות קלט משוערים של אותן יחידות כמו ב-A-C, הנמדדים על ידי פרדיגמת מיפוי שדות קלט דלילים. כל תרשים מציג פעילות קצב ירי ממוצעת על פני חלון ניתוח של 16.6ms בתגובה להתחלה (לוח שמאלי) או היסט (לוח ימני) של גירויים ריבועיים לבנים ושחורים. גירויים הוצגו למשך 16.6 מילישניות, הממוקמים באופן אקראי על פני רשת של 5 x 15 ריבוע המשתרעת על פני 180 מעלות של זווית ראייה אופקית ו -70 מעלות של זווית ראייה אנכית. פעילות קצב הירי קיבלה ציון z בכל רשת שדה הקלט (ראו סרגל צבע). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
איכות ההקלטה נשארה גבוהה בהקלטות חוזרות ונשנות במשך שבועות עד חודשים. איור 4A מראה רישומי LFP אורכיים מחיה אחת במשך 15 שבועות. LFPs תועדו בתגובה לפרדיגמת CSD שתוארה לעיל (ראו איור 3A-C). איור 4A מראה ממוצע של תגובות LFP 500 אלפיות השנייה לאחר הופעת ההבזק. בדוגמה זו השתמשנו בגשושית ליניארית עם 32 ערוצים, עם מרחק אינטראלקטרודה של 25 מיקרומטר. שימו לב שביום ה-18 עומק הגשושית הותאם, והסיט את הגשושית כלפי מטה ב-600 מיקרומטר. גם לפני וגם אחרי התאמה זו, אותות LFP נותרו יציבים לאורך ימי ההקלטה.
בהתאם לכך, ניתן היה להבחין בצורות גל ספייק של יחידות בודדות משוערות לאורך הקלטות רבות. איור 4B מציג דוגמאות מייצגות של צורות גל ספייק משלושה מפגשי הקלטה לאורך חודש של הקלטות, מה שמדגים שניתן לזהות בהצלחה פעילות של יחידה אחת לאורך זמן. איור 4C מראה את המספר הכולל של יחידות בודדות לכאורה שחולצו מרישומים כרוניים בשש חיות, לאורך חלון זמן של עד 100 ימים. יחידות בודדות הוגדרו על פי קריטריוני ברירת המחדל של קילוסורט 3.0 (ראה טבלה משלימה 1). כפי שניתן לראות, מספר היחידות הבודדות המוגדרות בבירור הסתכם בדרך כלל ב~40 בשבוע הראשון שלאחר ההשתלה, ואז ירד בהדרגה, נע לעבר אסימפטוטה יציבה לכאורה של ~20 יחידות. בהתחשב בכך שהקלטות אלה בוצעו באמצעות בדיקות ליניאריות בנות 32 ערוצים, זה שווה לתנובה צפויה של כ-1.25 יחידות בודדות לאלקטרודה מיד לאחר ההשתלה, ירידה לכ-0.65 יחידות בודדות לאלקטרודה ברישומים ארוכי טווח. נראה כי חיבור חוזר למגבר/מחבר השתל במהלך הפעלות לא השפיע על איכות ההקלטה או על יציבות השתל מכיוון שכתר פאראדיי המחזיק את המגבר/מחבר יכול לעמוד בכוחות חוזרים ונשנים של מעל 10 ניוטון, סדר גודל גדול יותר אפילו מכוחות ההזדווגות המרביים הנדרשים על ידי מחברים סטנדרטיים (ראה סרטון משלים 2).
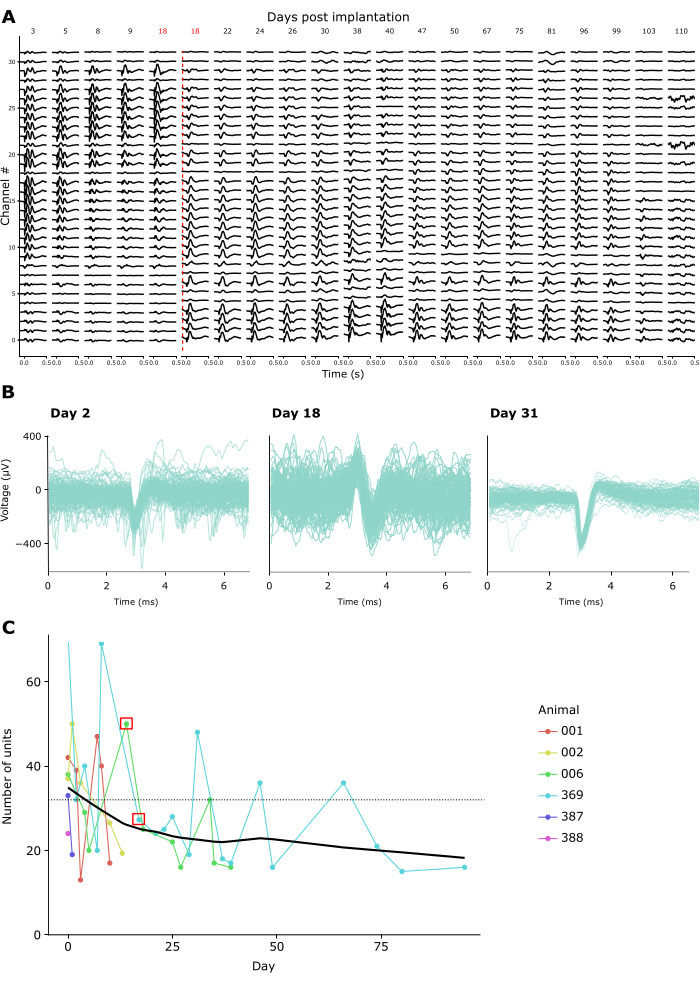
איור 4: יציבות של רישומים עצביים לאורך זמן. (A) פעילות LFP ממוצעת בתגובה לגירוי CSD של הבזק שדה רחב, המוצג בכל 32 הערוצים של בדיקה מושתלת כרונית בין 3 ל-110 ימים לאחר ההשתלה. הקו האנכי האדום מציין את הורדת הגשושית למיקום חדש עקב הקלטה של ערוצים 0-8 מחוץ למוח ביום ה-18 שלאחר הניתוח. (B) צורות גל ספייק של שלוש יחידות לדוגמה מאותו שתל כרוני שתועדו שוב ושוב במשך ארבעה שבועות. קווים דקים: צורות גל ספייק בודדות. קו עבה: צורת גל ספייק ממוצעת. (C) מספר היחידות הבודדות המשוערות שזוהו על ידי קילוסורט 3 לאורך ימי הקלטה עבור 6 בעלי חיים (ראה מקרא משובץ). הריבוע האדום מציין את הימים שבהם הועברה הגשושית. הקו המקווקו מציין את מספר האלקטרודות לכל שתל המשמש ברישומים אלה (32). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
לבסוף, על ידי אספקת מערכת מודולרית הכוללת מיקרו-דרייב, כמו גם כלוב פאראדיי לביש ולוחית ראש המשמשת גם כבסיס שתל וכמכשיר לקיבוע ראש, פרוטוקול זה מאפשר שילוב של אלקטרופיזיולוגיה כרונית עם התנהגות מקובעת ראש. כאן מוצגים נתונים לדוגמה מעכברים שחוצים סביבה וירטואלית על הליכון כדורי. איור 5A מראה פעילות ספייקינג הקשורה לריצה של 20 יחידות בניסוי לדוגמה. איור 5B מראה את הקשרים המגוונים אך החזקים בין מהירות ריצה ופעילות דוקרנים של יחידות בודדות ממוינות דוקרנים, כמו גם ממוצע אוכלוסייה לאותו אפקט באיור 5C, מה שמאשר את ההשפעה המבוססת היטב של פעילות לוקומוטורית על פעילות עצבית במכרסם V124.
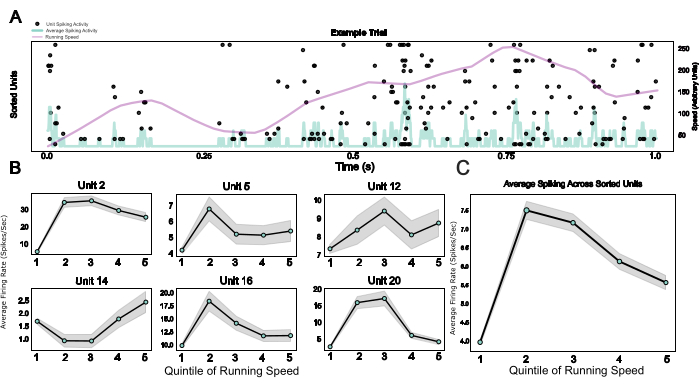
איור 5: תגובות עצביות במהלך התנהגות מקובעת ראש. (A) תרשים רסטר של תגובות יחידה בודדת לאורך ניסוי לדוגמה, עם מהירות ריצה (קו סגול) וקצבי ירי ממוצעים על פני כל היחידות הבודדות (קו כחול בהיר). (B) פעילות יחידה אחת במהלך קטגוריות מהירות ריצה שונות, המוצגת עבור שש יחידות לדוגמה. (ג) פעילות דוקרנים ממוצעת בכל היחידות הבודדות בסשן דוגמה אחד, המתוארת על פני חמש קוויניטליות של התפלגות מהירות הריצה. מהירויות הריצה בסשן זה נעו בין 0 ל-0.88 מטר לשנייה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
טבלה משלימה 1: טבלה המציגה פרמטרי ברירת מחדל המשמשים את קילוסורט 3 בעת זיהוי יחידות בודדות בהקלטות המוצגות באיור 3, איור 4 ואיור 5. אנא לחץ כאן כדי להוריד קובץ זה.
סרטון משלים 1: סרטון המציג פעילות מוטורית של בעלי חיים לאחר השתל. הסרטון שצולם לאחר שלב ההחלמה של 5 ימים הושלם, ומציג התנהגות מוטורית נורמלית, כמו גם התאמה לגודל ולמשקל השתל. ניתן לראות את החיה חוקרת בדרך כלל כלוב משחקים המכיל העשרה סביבתית. אנא לחץ כאן כדי להוריד קובץ זה.
סרטון משלים 2: סרטון המראה הפעלת כוח על כתר פאראדיי שהורכב. הכוחות העומדים בפני כתר פאראדיי גדולים בערך בסדר גודל אחד מכוח החיבור הדרוש למחברים סטנדרטיים כגון מחברי ננו מקוטבים בעלי 4 פינים. אנא לחץ כאן כדי להוריד קובץ זה.
איור משלים 1: איור המציג תמונות של מחזיק הכונן. ניתן למצוא קובצי עיצוב הניתנים להדפסה במאגר Github המתאים (https://github.com/zero-noise-lab/dream-implant/). אנא לחץ כאן כדי להוריד קובץ זה.
איור משלים 2: תבנית לרשת נחושת. הדפס את התבנית עם שינוי קנה המידה המקורי והשתמש בסטנסיל לחיתוך רשת הנחושת (שלב 2.12). השתמש בסרגל קנה המידה כדי לאמת ובמידת הצורך להתאים את קנה המידה של ההדפסה. אנא לחץ כאן כדי להוריד קובץ זה.
איור משלים 3: סדרת תמונות המציגה את שלבי ההרכבה של השתל במהלך הניתוח. שני microdrives, כמו גם שני מגברים, מותקנים במקרה זה. אנא לחץ כאן כדי להוריד קובץ זה.
איור משלים 4: ציור של גולגולת עכבר הכולל מיקום לדוגמה של כוננים, קרניוטומיות (בירוק) וסיכת GND/REF (באדום). מיקום הסיכה מוצע עקב מיקום במוח הקטן, אשר לא סביר להפריע לרישומים קליפת המוח. אנא לחץ כאן כדי להוריד קובץ זה.
Discussion
כתב יד זה מציג פרוטוקול להשתלה מהירה, בטוחה וסטנדרטית של גשושיות, המאפשר גם שחזור גשושית ושימוש חוזר בסוף הניסוי. הגישה עושה שימוש במערכת מודולרית של רכיבי שתלים, במיוחד מיקרו-דרייב, התואמת לכל בדיקות הסיליקון ומערכות ההקלטה הנפוצות, לוחית ראש שניתן להשתמש בה לניסויים התנהגותיים קבועי ראש, וכלוב פאראדיי לביש להגנה על השתל. קונסטלציה זו מאפשרת למשתמשים להתאים את השתל שלהם באופן גמיש לפרדיגמות ניסיוניות שונות, כגון התנהגות מקובעת ראש לעומת תנועה חופשית או מזעור השתל (ללא כלוב פאראדיי) לעומת עמידות אותות מוגברת לטווח ארוך (עם כלוב פאראדיי) - מבלי להקריב את הסטנדרטיזציה של השתל בתהליך.
גישה זו הופכת את הרישומים האלקטרופיזיולוגיים הכרוניים לסטנדרטיים יותר (באמצעות אלמנטים טרומיים שאינם דורשים הרכבה ידנית), פחות יקרים (באמצעות שחזור בדיקה), פחות גוזלים זמן (על ידי פישוט שלבי הניתוח), ומתאימים יותר בקלות לרווחת בעלי החיים ולהתנהגותם (באמצעות הקטנת גודל השתל וקיבוע ראש ללא לחץ). ככזה, פרוטוקול זה נועד להפוך שתלים אלקטרופיזיולוגיים במכרסמים מתנהגים להשגה עבור מגוון רחב יותר של חוקרים מעבר למעבדות החלוציות בחוד החנית של התחום.
כדי להשיג מטרה זו, הפרוטוקול המוצג כאן ממזער את הפשרה בין מספר היבטים חיוניים לעתים קרובות באותה מידה של שתלי מיקרו-דרייב, כלומר גמישות, מודולריות, קלות ההשתלה, יציבות, עלות כוללת, תאימות להתנהגות ושימוש חוזר בבדיקה. נכון לעכשיו, גישות זמינות לעתים קרובות מצטיינות בחלק מההיבטים הללו, אך במחיר גבוה לתכונות אחרות. לדוגמה, עבור מקרי שימוש הדורשים יציבות שתל מוחלטת לאורך תקופות זמן ארוכות, גישת השתל הטובה ביותר עשויה להיות לקבע את הבדיקה ישירות על גולגולת25. עם זאת, זה גם מונע שימוש חוזר בבדיקה, כמו גם מיקום מחדש של אתרי הקלטה במקרה של איכות הקלטה גרועה, וזה לא תואם מיקום שתל סטנדרטי. באופן דומה, בעוד כונן AMIE מספק פתרון קל משקל וזול להשתלה ניתנת לשחזור של גשושיות, הוא מוגבל לגשושיות בודדות ומוגבל במיקום קואורדינטות המטרה17. בקצה השני של הספקטרום, חלק מהננו-כוננים הזמינים מסחרית (ראו טבלה 1 16,17,21,26,27,28,29,30) הם קטנים ביותר, ניתן למקם אותם בחופשיות על הגולגולת, ולמקסם את מספר הגשושיות שניתן להשתיל בחיה אחת 16. עם זאת, הם יקרים בהשוואה לפתרונות אחרים, דורשים מהנסיינים להיות מיומנים מאוד לניתוחי שתלים מוצלחים, ואוסרים על שימוש חוזר בבדיקה. המיקרו-כונן שפותח על ידי Vöröslakos et al.21, גרסה קלת משקל שלו היא גם חלק מפרוטוקול זה, מקריב גודל שתל קטן לטובת קלות שימוש טובה יותר, מחיר נמוך יותר ושימוש חוזר בבדיקה
טבלה 1: השוואה בין אסטרטגיות פופולריות לשתלי בדיקה כרוניים במכרסמים. זמינות: האם המיקרו-כונן הוא קוד פתוח (לחוקרים לבנות את עצמם), זמין מסחרית, או שניהם. מודולריות: מערכות משולבות מורכבות מרכיב אחד או מספר רכיבים הנמצאים ביחס קבוע זה לזה, בעוד מערכות מודולריות מאפשרות מיקום חופשי של הגשוש/מיקרו-כונן ביחס להגנה (הילוך ראש/כלוב פאראדיי) לאחר ייצור השתל (למשל בזמן הניתוח). המודולריות נקבעה ממידע שפורסם או פרוטוקולי השתלה של השתלים הרשומים. תיקון ראש: כן: לשתל יש מנגנונים לקיבוע ראש המשולבים בעיצוב שלו, X: השתל משאיר את החלל כדי להוסיף לוחית ראש נוספת לקיבוע ללא בעיות גדולות, לא: עיצוב השתל ככל הנראה יוצר בעיות חלל או דורש שינויי עיצוב מהותיים לשימוש עם קיבוע ראש. מיקום הבדיקה: מוגבל: מיקום הבדיקה מוגבל בשלב תכנון השתל. גמיש: ניתן להתאים את מיקום הבדיקה גם במהלך הניתוח. מספר הבדיקות: מספר הבדיקות שניתן להשתיל אותן. שימו לב שהשתלת בדיקות >2 על עכבר אכן מהווה אתגר משמעותי ללא תלות במערכת השתלים שנבחרה. שימוש חוזר בבדיקה: כן, אם הגשושיות יכולות, בתיאוריה, לעשות בהן שימוש חוזר. משקל/גודל: משקל ונפח השתל. אנא לחץ כאן כדי להוריד טבלה זו.
כדי ליצור מערכת המיישבת את הדרישות השונות הללו בצורה חלקה יותר, שתל DREAM תוכנן על בסיס שתל Vöröslakos21, אך עם מספר שינויים בסיסיים. ראשית, כדי להפחית את משקל השתל הכולל, המיקרו-דרייב המשמש כאן מיוצר מאלומיניום במכונה ולא מפלדת אל-חלד מודפסת בתלת-ממד, וכתר פאראדיי ממוזער, ומשיג הפחתת משקל כוללת של 1.2-1.4 גרם בהתאם לבחירת חומר לוחית הראש (ראה טבלה 2). שנית, לוחית הראש המקיפה את המיקרו-כונן תוכננה לאפשר מנגנון קיבוע ראש משולב המאפשר קיבוע ראש מהיר וללא לחץ תוך הכפלה כבסיס לכלוב פאראדיי, מתן גישה לרוב אזורי המטרה הפוטנציאליים לרישומים עצביים והוספת משקל מינימלי בלבד לשתל. צורתו השטוחה של מנגנון הקיבוע והיעדר הבליטות מבטיחים גם פגיעה מינימלית בשדה הראייה או בתנועה של בעלי חיים (ראו איור 2A-C), שיפור ברור לעומת מערכות קודמות31,32. גם הכתר והטבעת של פאראדיי המקובעים על לוחית הראש שונו באופן משמעותי בהשוואה לעיצובים קודמים. כעת הם אינם דורשים כל התאמה אד-הוק (למשל, במונחים של מיקום מחברים) או הלחמה לאורך כל הניתוח, מה שמסיר גורמים פוטנציאליים לנזק לשתל ולשונות בלתי צפויה באיכות השתל. במקום זאת, שתל DREAM מספק מספר וריאציות סטנדרטיות של טבעת כתר המאפשרות למקם כל מחבר באחד מארבעה מיקומים מוגדרים מראש, תוך מזעור השונות והמאמץ במהלך הניתוח. לבסוף, על ידי אופטימיזציה של מערכת השתל להתאוששות הגשוש, שתל DREAM מאפשר לנסיינים לקצץ באופן דרסטי את העלות כמו גם את זמן ההכנה לכל שתל מכיוון שבדרך כלל ניתן לשחזר, לנקות ולעשות שימוש חוזר במיקרו-כונן ובבדיקה יחד.
לסקירה ממצה יותר של התמורות שמציבות מערכות שתלים שונות, ראה טבלה 1. בעוד שהגישה המוצגת כאן בדרך כלל אינה מספקת ביצועים מקסימליים בהשוואה לכל האסטרטגיות האחרות, למשל, במונחים של גודל, יציבות או עלות, היא פועלת בטווח העליון בכל הפרמטרים הללו, מה שהופך אותה לקלה יותר ליישום במגוון רחב של ניסויים.
שלושה היבטים של הפרוטוקול חיוניים במיוחד להתאמה לכל מקרה שימוש ספציפי: קונסטלציה של הארקה וייחוס, הטכניקה לביסוס המיקרו-דרייב, ותיקוף השתל באמצעות רישום עצבי. ראשית, בעת השתלת הקרקע וסיכות הייחוס, המטרה הייתה לזהות את הנקודה המתוקה בין יציבות מכנית/חשמלית לבין פולשניות. אמנם, למשל, חוטי כסף צפים המוטבעים באגר הם פחות פולשניים מברגי עצם33, אך סביר להניח שהם נוטים יותר להיעקר עם הזמן. השימוש בסיכות, יחד עם אגר, מבטיח חיבור חשמלי יציב תוך גם יתרון של קל יותר לשלוט במהלך החדרה, הימנעות טראומה רקמות. סיכות הארקה המודבקות לגולגולת אינן צפויות להיעקר ממקומן, ובמקרה שהחוט מופרד מהסיכה, החיבור מחדש הוא בדרך כלל פשוט בשל שטח הפנים הגדול יותר והיציבות של הסיכה המושתלת.
טבלה 2: השוואת משקלי רכיבים בין שתל DREAM לבין השתל המתואר על ידי Vöröslakos et al.21. אנא לחץ כאן כדי להוריד טבלה זו.
שנית, צמנט של microdrive צריך להתרחש בדרך כלל לפני החדרת הבדיקה במוח. זה מונע תנועה לרוחב של הבדיקה בתוך המוח אם המיקרו-כונן אינו מקובע באופן מושלם במחזיק הסטריאוטקטי במהלך ההחדרה. כדי לבדוק את מיקום הגשושית לפני קיבוע המיקרו-דרייב במקומו, ניתן להוריד לזמן קצר את קצה שוק הגשושית כדי לוודא היכן הוא יבוא במגע עם המוח, מאחר שחישוב תנוחת המגע יכול להיות קשה בהתחשב בשינוי הפרלקסה של המיקרוסקופ. לאחר קביעת מיקום המיקרו-דרייב, ניתן להגן על הקרניוטומיה באמצעות אלסטומר סיליקון לפני צמנט המיקרו-כונן כדי להבטיח שהמלט לא יבוא בטעות במגע עם הקרניוטומיה; עם זאת, הורדת הבדיקה דרך אלסטומר הסיליקון אינה מומלצת, מכיוון ששאריות אלסטומר סיליקון יכולות להימשך לתוך המוח ולגרום לדלקת וגליוזיס.
שלישית, בהתאם לפרוטוקול הניסוי בו נעשה שימוש, הקלטת בדיקה מיד לאחר הניתוח עשויה להיות שימושית או לא. באופן כללי, פעילות עצבית שנרשמה מיד לאחר החדרת הגשושית לא תייצג ישירות את הפעילות שנרשמה באופן כרוני, בשל גורמים כגון נפיחות מוחית חולפת ותנועת רקמות סביב הגשושית, כלומר גם עומק ההחדרה וגם צורות גל ספייק לא צפויים להתייצב ישירות. ככזה, הקלטות מיידיות יכולות לשמש בעיקר כדי לוודא את איכות האות הכללית ואת שלמות השתל. מומלץ להשתמש במזחלת המיקרו-כונן הניתנת להזזה בימים שלאחר הניתוח לאחר שהמוח התייצב כדי לכוונן את המיקום. זה גם עוזר להימנע מהזזת הגשושית ביותר מ -1000 מיקרומטר ליום, למזער את הנזק לאתר ההקלטה ובכך לשפר את תוחלת החיים של אתר ההקלטה.
לבסוף, ייתכן שמשתמשים ירצו להתאים את המערכת להקלטה מיותר ממיקום יעד אחד. מכיוון שמערכת זו היא מודולרית, למשתמש יש מרחב תמרון רב כיצד להרכיב ולמקם רכיבים ביחס זה לזה (ראו לעיל איור משלים 3 ואיור משלים 4). זה כולל שינויים שיאפשרו להרכיב מעבורת מורחבת אופקית על המיקרו-דרייב, מה שיאפשר השתלת גשושיות מרובות או גשושיות מרובות שוקיים גדולות, כמו גם השתלה של מיקרו-כוננים נפרדים מרובים (ראו איור משלים 3 ואיור משלים 4). שינויים כאלה דורשים רק שימוש בטבעת כתר מותאמת, עם מספר מוגבר של אזורי הרכבה עבור מחברים/לוחות ממשק/במות. עם זאת, מגבלות המקום של עיצוב זה מוכתבות על ידי מודל החי, במקרה זה, העכבר, מה שהופך ערימה של בדיקות מרובות על מיקרו-כונן אחד אטרקטיבי יותר במונחים של טביעת רגל מאשר השתלת כמה microdrives בנפרד זה מזה. המיקרו-כוננים המשמשים כאן יכולים לתמוך בבדיקות מוערמות, ולכן, המגבלה האמיתית היחידה היא מספר שלבי הראש או המחברים שיכולים להתאים לאילוצי המקום והמשקל שהוגדרו על ידי מודל החיה. ניתן להשתמש בספייסרים גם כדי להגדיל עוד יותר נתיבי הרכבה והכנסה שאינם אנכיים.
לסיכום, פרוטוקול זה מאפשר השתלה זולה, קלת משקל וחשוב מכך מתכווננת של גשושית, עם היתרון הנוסף של תכנון מיקרו-כונן שנותן עדיפות להתאוששות הגשושית. זה מתמודד עם הבעיות של העלות הגבוהה של בדיקות חד פעמיות, את המחסום הגבוה של מיומנויות ניתוח והשתלה, כמו גם את העובדה כי פתרונות מסחריים להשתלה כרונית הם לעתים קרובות קשה להסתגל למקרי שימוש ייחודיים. סוגיות אלה מציבות נקודת כאב למעבדות שכבר משתמשות באלקטרופיזיולוגיה חריפה ומרתיעה את אלה שעדיין לא מבצעות ניסויים באלקטרופיזיולוגיה. מערכת זו נועדה להקל על קליטה רחבה יותר של מחקר אלקטרופיזיולוגי כרוני מעבר למגבלות אלה.
Disclosures
TS, AN, ו-MNH הם מייסדים משותפים של 3Dneuro B.V., המייצרת את המיקרו-כוננים בקוד פתוח ואת כתרי פאראדיי המשמשים בפרוטוקול זה. FB ו-PT הם חלק מהמועצה המדעית המייעצת של 33Dneuro B.V. FB ו- PT אינם מקבלים כל פיצוי כספי עבור תפקיד זה.
Acknowledgements
עבודה זו נתמכה על ידי מועצת המחקר ההולנדית (NWO; תוכנית קרוסאובר 17619 "אינטנסיבית", TS) וקיבלה מימון מתוכנית המסגרת השביעית של האיחוד האירופי (FP7/2007-2013) במסגרת הסכם מענק מס '600925 (Neuroseeker, TS, FB, PT), כמו גם מאגודת מקס פלנק.
Materials
| Name | Company | Catalog Number | Comments |
| 0.05" Solder Tail Socket | Mill-Max | 853-93-100-10-001000 | |
| 1,1'-dioctadecyl-3,3,3',3'- Reagent tetramethylindocarbocyanine perchlorate ('DiI'; DiIC18(3)) | ThermoFisher | D282 | Lipophilic dye used for easier histological verification of the probe location |
| Adhesive Putty (Blu-Tack) | Bostik | 308590110 | Variations (e.g. by Pritt) should be available in your stationary store |
| Agar | Sigma Aldrich | A1296 | Make with saline for conductivity. |
| Amplifier (Miniamp-64) | Cambridge Neurotech | Miniature and implantable amplifier and digitiser. Alternative Implantable digitiser, or implantable Omnetics connector use possible. | |
| Analgesic Cream (EMLA Cream) | Aspen | 39699/0088 | Analgesic cream used for operative pain containing prilocaine, lidocaine. |
| Angled Spacer | 3DNeuro | Angled spacer for non-perpendicular drive mounting.. Open souce, also available at https://github.com/zero-noise-lab/dream-implant/ | |
| Blue light curing LED | B.A. International | 818223 | Curing light for primer polymerisation. 420-480 nm wavelength |
| Bone wax | SMI | Z046 | Wax to protect craniotomy and probe post surgery. |
| Buprenorphine | Elanco Europe LTD | 401513 | Injectable Buprenorphine solution (0.3 mg/mL) |
| Copper mesh | Dexmet | 3CU6-050FA | Copper mesh used to electrically and physically shield probe and craniotomy. |
| Cyanoacrylate glue (Loctite) | Loctite | 1363589 | Cyanoacrylate gel glue |
| Dental Cement (SuperBond C&B) | Sun Medical | K058E | Dental cement (SuperBond) |
| Depilation Cream (Veet) | Veet | 310000091434 | Hair removal cream for removal of hair around surgical site. |
| Enrofloxacin (Baytril) | Elanco Europe LTD | 00879/4117 | Injectable enrofloxacin solution (25 mg/mL) |
| Faraday crown | 3DNeuro | 3D printed implantable protective cage. Open souce, also available at https://github.com/zero-noise-lab/dream-implant/ | |
| Faraday ring | 3DNeuro | 3D printed implantable protective ring for faraday cage. Open souce, also available at https://github.com/zero-noise-lab/dream-implant/ | |
| Haemostatic Sponge | SMI | ZHG101010 | Absorbable gelatin haemostatic sponge |
| Heat Shrink Tubing | HellermannTyton | TA32-9/3 BK | Heat Shrink tubing for making soft tipped forceps |
| Iodine | Braunol | 9322507 | Aqueous povidone-iodine solution. |
| Metamizole (Novalgin) | Sanofi-Aventis Gmbh | 4527098 | Injectable Metamizole (500mg/mL) |
| Metamizole (Novalgin) | Sanofi-Aventis Gmbh | 1553758 | Metamizole solution |
| Microdrive (R2Drive) | 3DNeuro | Recoverable Metal micro drive with moveable shuttle. Open souce, also available at https://buzsakilab.github.io/ 3d_print_designs/ | |
| Mineral Oil | Sigma-Aldrich | M5310-100ML | Oil used as solvent to create craniotomy protection gel. |
| Non-Shedding Wipes (Kimtech) | Kimtech | 7552 | Non-shedding wipes |
| Primer | Bisco | B-7202P | Universal skull adhesive preventing moisture from deteriorating the cement and providing a solid base to build up cement onto. |
| R2Drive holder | 3DNeuro | Stereotactic attachment for mounting R2Drive. Open souce, also available at https://buzsakilab.github.io/ 3d_print_designs/ | |
| Self-adherent wrap | 3M | VB050 | Protective wrap for implant post surgery |
| Silicon probe (H2) | Cambridge Neurotech | Chronically implantable linear silicon probe with 32 channels. Alternative Probe use possible. | |
| Silicone Elastomer (Duragel) | Cambridge Neurotech | Silicone Elastomer | |
| Silicone Plaster (Kwikcast) | WPI | KWIK-CAST | |
| Silver conductive epoxy | MG Chemicals | 8331D-14G | Silver epoxy |
| Size 5 Dumont forceps | FSTools | 11251-10 | Small forceps for lifting bone flap. |
| Stainless steel wire, Teflon coated | Science Products GmBH | SS-3T | Ground wire |
| Stereotax (RWD) | RWD | 68803 | Stereotax for surgical procedures on mice. |
| Tergazyme | Alconox | 1304 | A possible enzymatic cleaner to clean probe |
| Two Part Fast setting Epoxy Resin | Gorilla | EP3 | Epoxy for permanent bonding of DREAM implant parts. |
| Vannas Spring Scissors Round Handle | FSTools | 15403-08 | 0.075mm straight tipped spring rebound veterinary scissors. |
| Veterinary Cyanoacrylate glue (Vetbond) | 3M | 70-0068-5256-3 | Veterinary cyanoacrylate glue |
References
- Epsztein, J., Brecht, M., Lee, A. K. Intracellular determinants of hippocampal CA1 place and silent cell activity in a novel environment. Neuron. 70 (1), 109-120 (2011).
- Okun, M., et al. Diverse coupling of neurons to populations in sensory cortex. Nature. 521 (7553), 511-515 (2015).
- Jun, J. J., et al. Fully integrated silicon probes for high-density recording of neural activity. Nature. 551 (7679), 232-236 (2017).
- Znamenskiy, P., Kim, M. -. H., Muir, D. R., Iacaruso, M. F., Hofer, S. B., Mrsic-Flogel, T. D. Functional specificity of recurrent inhibition in visual cortex. Neuron. 112 (6), 991-1000 (2024).
- Rowland, J. M., et al. Propagation of activity through the cortical hierarchy and perception are determined by neural variability. Nat Neurosci. 26 (9), 1584-1594 (2023).
- Roth, M. M., Dahmen, J. C., Muir, D. R., Imhof, F., Martini, F. J., Hofer, S. B. Thalamic nuclei convey diverse contextual information to layer 1 of visual cortex. Nat Neurosci. 19 (2), 299-307 (2016).
- Zong, W., et al. Large-scale two-photon calcium imaging in freely moving mice. Cell. 185 (7), 1240-1256 (2022).
- Demas, J., et al. High-speed, cortex-wide volumetric recording of neuroactivity at cellular resolution using light beads microscopy. Nat Methods. 18 (9), 1103-1111 (2021).
- Buzsáki, G., Anastassiou, C. A., Koch, C. The origin of extracellular fields and currents EEG, ECoG, LFP and spikes. Nat Rev Neurosci. 13 (6), 407-420 (2012).
- Polikov, V. S., Tresco, P. A., Reichert, W. M. Response of brain tissue to chronically implanted neural electrodes. J Neurosci Methods. 148 (1), 1-18 (2005).
- Savya, S. P., et al. In vivo spatiotemporal dynamics of astrocyte reactivity following neural electrode implantation. Biomaterials. 289, 121784 (2022).
- Perge, J. A., et al. Intra-day signal instabilities affect decoding performance in an intracortical neural interface system. J Neural Eng. 10 (3), 036004 (2013).
- Pachitariu, M., Steinmetz, N., Kadir, S., Carandini, M., Harris, K. D. Kilosort: realtime spike-sorting for extracellular electrophysiology with hundreds of channels. bioRxiv. , 061481 (2016).
- Buzsáki, G. Large-scale recording of neuronal ensembles. Nat Neurosci. 7 (5), 446-451 (2004).
- Kloosterman, F., et al. Micro-drive array for chronic in vivo recording: Drive fabrication. J Vis Exp. (26), e1094 (2009).
- Jacobs, T., Darch, H., Holtzman, T., De Zeeuw, C. I., Romano, V. Standard operating protocol: Implantation of Cambrige NeuroTech chronic silicon probe and mini-amp-64 digital headstage in mice. Protocol Exchange. , (2023).
- Juavinett, A. L., Bekheet, G., Churchland, A. K. An adaptable, reusable, and light implant for chronic Neuropixels probes. bioRxiv. , (2024).
- Kozai, T. D. Y., Jaquins-Gerstl, A. S., Vazquez, A. L., Michael, A. C., Cui, X. T. Brain tissue responses to neural implants impact signal sensitivity and intervention strategies. ACS Chem Neurosci. 6 (1), 48-67 (2015).
- Nguyen, D. P., et al. Micro-drive array for chronic in vivo recording: tetrode assembly. J Vis Exp. (26), e1098 (2009).
- Biran, R., Martin, D. C., Tresco, P. A. Neuronal cell loss accompanies the brain tissue response to chronically implanted silicon microelectrode arrays. Exp Neurol. 195 (1), 115-126 (2005).
- Vöröslakos, M., Petersen, P. C., Vöröslakos, B., Buzsáki, G. Metal microdrive and head cap system for silicon probe recovery in freely moving rodent. eLife. 10, e65859 (2021).
- . IMEC Neuropixels 1.0 User Manual V1.0.8 Available from: https://www.neuropixels.org/_files/ugd/328966_ca209d53ffb346b3bf98be39b903efa9.pdf (2023)
- Baranauskas, G., et al. Carbon nanotube composite coating of neural microelectrodes preferentially improves the multiunit signal-to-noise ratio. J Neural Eng. 8 (6), 066013 (2011).
- Niell, C. M., Stryker, M. P. Modulation of visual responses by behavioral state in mouse visual cortex. Neuron. 65 (4), 472-479 (2010).
- Okun, M., Carandini, M., Harris, K. D. Long term recordings with immobile silicon probes in the mouse cortex. bioRxiv. , (2015).
- Chung, J., Sharif, F., Jung, D., Kim, S., Royer, S. Micro-drive and headgear for chronic implant and recovery of optoelectronic probes. Sci Rep. 7 (1), 2773 (2017).
- Bimbard, C., et al. An adaptable, reusable, and light implant for chronic Neuropixels probes. bioRxiv. , (2024).
- Jones, E. A. A. Chronic recoverable Neuropixels in mice. protocols.io. , (2023).
- . Neuronexus Products - dDrive Available from: https://www.neuronexus.com/products/accessories/microdrives/ddrive/ (2024)
- van Daal, R. J. J., et al. Implantation of Neuropixels probes for chronic recording of neuronal activity in freely behaving mice and rats. Nat Protoc. 16 (7), 3322-3347 (2021).
- Guo, Z. V., et al. Procedures for behavioral experiments in head-fixed mice. PLoS One. 9 (2), e88678 (2014).
- Groblewski, P. A., et al. A standardized head-fixation system for performing large-scale, in vivo physiological recordings in mice. J Neurosci Methods. 346, 108922 (2020).
- Vasilev, D., Raposo, I., Totah, N. K. Brightness illusions evoke pupil constriction preceded by a primary visual cortex response in rats. Cereb Cortex. 33 (12), 7952-7959 (2023).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved