Method Article
Evaluación del hueso cortical mediante ondas guiadas por ultrasonidos: un estudio de reproducibilidad en una población sana
En este artículo
Resumen
Aquí, presentamos en detalle el protocolo de medición del dispositivo ultrasónico de transmisión axial bidireccional (BDAT) y lo probamos en un estudio de reproducibilidad, considerando 14 participantes sanos y 3 operadores. La fiabilidad, medida con los coeficientes de correlación intraclase (CCI), fue de buena a excelente para cuatro parámetros de interés.
Resumen
Las fracturas por fragilidad siguen siendo una carga sanitaria mundial en el contexto del envejecimiento de la población. En particular, se espera que el número mundial de fracturas de cadera se duplique entre 2020 y 2050. Por lo tanto, es fundamental detectar a los pacientes con riesgo de fractura por fragilidad a escala poblacional. El estándar de oro actual es la absorciometría dual de rayos X (DXA), que proporciona la densidad mineral ósea de área (aBMD). Los dispositivos ultrasónicos, generalmente más portátiles y baratos que los dispositivos de rayos X, representan alternativas interesantes a la DXA como herramientas de detección. Sin embargo, la dependencia del operador suele reconocerse como su principal inconveniente. En este estudio, se presenta en detalle el protocolo de medición del dispositivo ultrasónico de transmisión axial bidireccional (BDAT). La sonda ultrasónica específica se coloca en el radio distal de un tercio del antebrazo no dominante mediante un gel de acoplamiento convencional. La interfaz guiada proporciona en tiempo casi real (alrededor de 2 Hz) cuatro parámetros de interés: velocidades de la primera señal que llega (vFAS) y el modo A0 (vA0), espesor cortical (Ct.Th) y porosidad (Ct.Po), así como cuatro parámetros de calidad. El operador mueve la sonda lentamente en el sitio de medición, observando cuidadosamente la retroalimentación proporcionada por la interfaz hasta encontrar una posición estable e iniciar una serie de 10 adquisiciones. Cuando se obtienen al menos cuatro series coherentes, la medición finaliza y se genera un informe automático. La medición suele tardar unos 5 minutos en completarse. Para determinar la robustez de este protocolo, se realizó un estudio de reproducibilidad entre 3 operadores (un experto y dos novatos) y 14 participantes sanos (6 mujeres, 8 hombres, 21-53 años). Los coeficientes de correlación intraclase (CCI) fueron buenos para vA0 (0,76), Ct.Po (0,80) o excelentes para Ct.Th (0,87) y vFAS (0,91). Se encontró que las desviaciones estándar eran inferiores al 10% de los rangos totales en la práctica clínica.
Introducción
La osteoporosis y las fracturas por fragilidad asociadas siguen constituyendo un importante problema de salud pública1. En particular, se espera que el número mundial de fracturas de cadera se duplique hasta 20502. La fragilidad ósea se debe a un proceso lento y silencioso de desmineralización y pérdida ósea sin signos de alerta importantes antes del evento de fractura por fragilidad. El estándar de oro actual para detectar pacientes con riesgo de fractura por fragilidad es la absorciometría dual de rayos X (DXA), que proporciona una imagen de rayos X en 2D de baja resolución con un píxel gris3 calibrado. A partir de esta imagen, es posible extraer la densidad mineral ósea de área (DMO en g.cm-2) en diferentes regiones de interés asociadas a los principales sitios de fractura por fragilidad: columna, muñeca y cadera. El valor de la DMO disminuye a medida que aumenta la tasa de fractura por fragilidad3. Por otra parte, la normalización del T-score, con respecto a una población sana normal, permite la comparación de los pacientes medidos con los dispositivos propuestos por diferentes fabricantes. La Organización Mundial de la Salud ha propuesto el T-score DXA para definir el diagnóstico de osteoporosis en tres etapas: normal (T-score < -1), osteopénica (-1 < T-score < -2,5) y osteoporótica (T-score < -2,5)4.
La DXA presenta varias limitaciones: su tamaño, costo relativamente alto, necesidad de una sala dedicada y su capacidad para discriminar entre fracturado y no fracturado, así como su disponibilidad en numerosos países, como en América Latina, son moderados5. Por lo tanto, existe la necesidad de alternativas a la DXA como herramientas de cribado para la estimación del riesgo de fractura por fragilidad6. Sin embargo, algunas alternativas a la DXA, como la tomografía computarizada cuantitativa y sus derivados7, la resonancia magnética (RM)8, también son voluminosas y no están ampliamente disponibles. El ultrasonido cuantitativo (QUS) presenta el potencial de dispositivos de detección portátiles, robustos y fáciles de usar. Se han desarrollado diferentes dispositivos para la evaluación del hueso cortical, asociados a diferentes frecuencias que van desde unos pocos kHz hasta unos pocos MHz y diferentes posicionamientos de transductores en transmisión, retrodifusión9, eco de pulso10 y transmisión axial donde los transductores están alineados con el eje de un hueso largo como el radio y la tibia. Algunos dispositivos proporcionan sustitutos de aBMD11, mientras que otros proporcionan parámetros ultrasónicos "clásicos" como velocidades12 o coeficientes de atenuación9 e incluso parámetros geométricos y materiales, por ejemplo, el grosor cortical, la porosidad o la distribución del tamaño de los poros9. Sin embargo, hasta el día de hoy, el QUS aún no ha logrado ser ampliamente utilizado en la práctica clínica para la evaluación ósea, en parte debido a la falta de homogeneización entre los dispositivos y a la dependencia del operador13.
Entre las tecnologías QUS propuestas como alternativas a la DXA, la transmisión axial (AT) tiene la ventaja de que la medición se puede realizar en el antebrazo, un sitio (i) de fácil acceso y (ii) cerca de uno de los principales sitios de fracturas por fragilidad, es decir, la muñeca. El primer parámetro AT propuesto depende de la velocidad de propagación ultrasónica en la capa cortical, denotada velocidad del sonido (SOS) o velocidad de la primera señal de llegada (vFAS), dependiendo del procesamiento de la señal y de los dispositivos, siendo algunos comerciales 12,14 y otros prototipos de laboratorio15,16. Este parámetro ha sido capaz de discriminar entre grupos de pacientes con o sin fracturas por fragilidad con rendimientos similares a la DMO en varios estudios clínicos desde finales de la década de 199014,15. También se ha aplicado con éxito en estudios longitudinales multicéntricos, demostrando su aplicación clínica y robustez12. La precisión de la vFAS se ha mejorado combinando las dos direcciones opuestas de propagación con el fin de reducir el sesgo debido al ángulo entre la sonda y la superficie ósea 16,17. Este punto de vista se ha denominado AT bidireccional (BDAT).
Aunque la vFAS ha mostrado interés clínico, su principal inconveniente, al igual que la DMO, es que combina diferentes características clave del hueso cortical, como las propiedades geométricas y materiales, lo que hace que su interpretación clínica no sea sencilla. Es por eso que se ha propuesto el punto de vista de la onda guiada, considerando su potencial debido a la fina sensibilidad de las ondas guiadas a las propiedades de la guía de ondas. Este enfoque debe combinar el procesamiento de señales, el modelado de guías de ondas y problemas inversos y se utiliza en gran medida en ensayos no destructivos considerando, por ejemplo, guías de onda metálicas, como placas o tubos18. Así, desde 2010 se ha desarrollado paso a paso un dispositivo BDAT de segunda generación, desde los maniquíes que imitan los huesos19 hasta la validación ex vivo 20 y las mediciones in vivo 21. El dispositivo ha sido probado con éxito en estudios clínicos en Francia22, Alemania23, Reino Unido24 y Chile25, y ha mostrado mejores resultados en términos de tasa de éxito y discriminación de pacientes.
Este estudio tiene como objetivo explorar la reproducibilidad del dispositivo ultrasónico BDAT actual. En primer lugar, se detallará el dispositivo y el protocolo de medición. Los resultados obtenidos con 14 participantes y 3 operadores serán presentados y discutidos en términos de cribado poblacional para la detección de pacientes en riesgo de fracturas por fragilidad.
Principio de medición: procesamiento de señales, parámetros de interés y parámetros de calidad
El dispositivo de transmisión axial bidireccional (BDAT) se compone de diferentes partes, siendo la principal la sonda ultrasónica, el módulo electrónico y la computadora. La lista completa se detalla en la Tabla de Materiales y se ilustra en la Figura 1. A continuación, se describen los parámetros de interés, los parámetros de calidad de medición y el protocolo de medición.
vFAS
Una vez que las señales muestreadas son recibidas por la computadora, se procesan siguiendo diferentes pasos. El primer paso consiste en el procesamiento de la señal en el dominio del tiempo, detectando el FAS utilizando el protocolo descrito anteriormente16,17. Una vez obtenido el tiempo de llegada para cada receptor, es posible determinar la velocidad FAS, posteriormente denominada vFAS, que es la media armónica de las velocidades obtenidas en ambos sentidos de propagación. Combinando la información de ambas direcciones de propagación, es posible obtener el ángulo de valor entre las direcciones de la sonda y de la superficie ósea y derivar un valor vFAS16 insesgado. Este ángulo bidireccional se denota posteriormente alfa y se utiliza como parámetro de la calidad de la medición. Este procesamiento temporal también permite estimar el espesor del tejido blando entre la superficie ósea y la sonda, denotado ST.Th26.
Imagen de espectro de onda guiada
El segundo paso consiste en el procesamiento de la señal en el dominio de Fourier, considerando las frecuencias temporales y espaciales, denotadas f y k. El enfoque es un método basado en SVD, que permite la transformación de las señales espacio-temporales en la función Norm, también denotada como imagen de espectro de onda guiada (GWSI), como se ilustra en la Figura 2 para un antebrazo in vivo 19. El método combina dos transformadas de Fourier (tiempo y espacio) y una descomposición de valores singulares (SVD), lo que permite visualizar la tasa de presencia en las señales recibidas (en una escala de 0-1) de los modos guiados por la capa ósea cortical. El GWSI puede interpretarse como una mejora de la transformada de Fourier espacio-temporal, con cada píxel asociado a un plano independiente de frecuencia f y número de onda k. Tenga en cuenta que el enfoque se ha mejorado para tener en cuenta el impacto de la atenuación del material27 y la variación del espesor lineal28.
Se prestará especial atención a la parte superior del espectro, asociada al modo A0, y también a la parte inferior, asociada a los valores más altos de velocidad de fase, es decir, superiores a 4 mm·μs-1. Esta parte corresponde a la región de interés 3 (ROI 3)29. El valor medio del ROI 3, que más tarde se denominará lowk, también se utiliza como parámetro de calidad. Un valor grande corresponde a una guía de onda regular, lo que permite reflexiones de onda claras en las interfaces óseas. Si el valor disminuye, podría deberse a una guía de ondas irregular o a una sonda mal colocada.
Modelo de guía de onda
La dispersión de la onda guiada, o la variación de la velocidad de fase de cada modo guiado con respecto a la frecuencia, depende tanto del material como de las propiedades geométricas de la guía de ondas. Por lo tanto, es potencialmente posible recuperar estas propiedades utilizando el procesamiento de señales dedicado, el modelado de guías de onda y los esquemas de problemas inversos. En el caso BDAT, el modelo de guía de onda corresponde a una placa libre isótropa transversal 2D, dependiendo del material de la guía de onda y de un parámetro geométrico, el espesor30. El material óseo cortical se homogeneiza considerando parámetros fijos para la matriz ósea y porosidad variable31. Por lo tanto, el problema inverso depende de dos parámetros, denotados por el grosor cortical (Ct.Th) y la porosidad cortical (Ct.Po). Los efectos de la absorción de material, la curvatura de la guía de ondas y los tejidos blandos circundantes no se tienen en cuenta en el modelo, incluso si afectan a la medición. Sin embargo, no se encontró que su peso en el resultado inverso del problema fuera determinante, lo que significa que los modos en las dos regiones principales de interés (A0 y parte inferior) no se ven alterados significativamente por la curvatura y los tejidos blandos32.
Problema inverso
Inicialmente, el problema inverso se dividió en dos pasos: primero, extraer la dispersión experimental de ondas guiadas, y segundo, comparar con el modelo de guía de ondas. Este punto de vista estaba limitado por el ruido y el etiquetado de modo30,32. Por lo tanto, se propuso un enfoque específico para superar estas limitaciones como una extensión del punto de vista de la función de la norma. En lugar de considerar cada onda plana de forma independiente, solo se tienen en cuenta las posibles ondas guiadas proporcionadas por el modelo de guía de onda20. Esto conduce a la imagen inversa del problema, expresada en el dominio de parámetros del modelo, es decir, el plano Ct.th - Ct.Po (Figura 2 abajo a la derecha). Al modelo que mejor se ajusta se le asigna la posición máxima, mientras que los eventuales picos secundarios (indicados por las imágenes inversas del problema con un punto gris) corresponden a soluciones ambiguas, indicadas en la comparación f-k con modos experimentales con líneas de color gris claro. Al igual que antes, el valor del píxel se normaliza por construcción y refleja, en este caso, la presencia de un modelo de guía de ondas particular en las señales recibidas. El valor máximo (denotado max) y la diferencia con el segundo máximo (denotado diff) también se utilizan como parámetros de calidad.
El problema inverso se propuso originalmente para el cálculo fuera de línea, es decir, una vez que se adquieren las señales, utilizando los valores exactos de los números de onda del modelo. Este enfoque ha sido validado tanto para el radio como para los sitios de la tibia considerando estudios ex vivo20,33 e in vivo 21,34,35. Con el fin de incluir estos cálculos en la interfaz hombre-máquina (HMI), se ha propuesto una versión aproximada, compatible con la aplicación en tiempo real, utilizando un punto de vista matricial disperso36.
vA0
A partir del GWSI, también es posible extraer la velocidad del modo guiado más lento, asociado con el primer modo antisimétrico A0 de la placa libre o modelo de Lamb33,35. La parte superior del espectro de ondas guiadas se puede aproximar linealmente, y la pendiente proporciona el valor de la velocidad vA0 (Figura 2 abajo a la izquierda).
Resumen de parámetros:
Finalmente, se miden cuatro parámetros de interés: (i) vFAS: velocidad de la primera señal que llega (m·s-1); ii) vA0: velocidad del modo guiado más lento (m·s-1); (iii) Ct.Th: espesor cortical (mm); y (iv) Ct.Po: porosidad cortical (%).
Se consideran cuatro parámetros de calidad: (i) alfa: ángulo bidireccional (°); ii) lowk: valor medio de la parte más baja del GWSI (valor normalizado entre 0 y 1); (iii) max: máximo de la función inversa del problema (valor normalizado entre 0 y 1); y (iv) diff: la diferencia entre el primer y el segundo máximo de la función inversa del problema (valor normalizado entre 0 y 100).
Todos estos parámetros, así como las dos imágenes del espectro de onda guiada (una par de direcciones de propagación) y la imagen del problema inverso, se muestran en "tiempo real" por la HMI, con una velocidad de fotogramas de aproximadamente 2 Hz. Un ejemplo típico se ilustra en la Figura 3. En la siguiente sección, se describe en detalle el método de uso de estos parámetros. La idea principal es que el operador mueva la sonda lentamente en el sitio de medición, observando cuidadosamente la retroalimentación proporcionada por las diferentes partes de la interfaz hasta encontrar una posición estable e iniciar una serie de 10 adquisiciones. Cuando se obtienen al menos cuatro series coherentes, la medición finaliza y se genera un informe automático.
Protocolo
El estudio fue aprobado por el Comité de Ética de la Universidad de Valparaíso, Chile, bajo el número de protocolo CEC213-20. Se proporcionó el consentimiento informado por escrito de los participantes. Se realizó una entrevista telefónica para establecer la inclusión/exclusión de los participantes. El estudio ha sido registrado bajo la siguiente referencia: NCT05424536.
1. Configuración del dispositivo
- Coloque las partes principales del dispositivo sobre una mesa grande.
- Coloque una al lado de la otra las siguientes partes: transformador de aislamiento eléctrico, módulo electrónico y computadora portátil sobre una mesa grande. Asegúrese de que haya suficiente espacio frente a estas partes para colocar el antebrazo del participante con facilidad más tarde.
- Finalmente, coloque la computadora portátil directamente sobre el módulo electrónico en caso de espacio limitado, teniendo cuidado de no obstruir las ventanas de ventilación del módulo, que están claramente indicadas.
- Conecte el transformador de aislamiento eléctrico.
- Conecte el transformador de aislamiento eléctrico a la alimentación doméstica de la habitación con un cable dedicado.
- Conecte el módulo electrónico.
- Conecte el módulo electrónico al transformador de aislamiento eléctrico mediante un cable de alimentación dedicado.
- Presione el botón ON-OFF en el transformador para alimentar el módulo.
- Conecte la computadora portátil.
- Conecte el ordenador portátil al módulo mediante el cable de bus serie universal (USB) dedicado para enviar las señales recibidas digitalizadas al ordenador para su posterior procesamiento.
- Si la computadora portátil necesita ser alimentada, conecte su cable de alimentación al transformador de aislamiento electrónico.
- Conecte la sonda ultrasónica.
- Conecte la sonda ultrasónica al módulo con la ranura para cables dedicada situada en la parte frontal del módulo. Hay dos sondas diferentes para los sitios de medición del antebrazo y la pierna. En este estudio, solo se considera el radio (sonda del antebrazo).
- Conecte el interruptor de pedal.
- Coloque el interruptor de pedal en el piso cerca de los pies, teniendo en cuenta la posición del operador mientras mide a un participante. Conecte el interruptor de pedal a la computadora mediante un cable USB. Utilice el pedal para iniciar la serie de adquisición.
2. Instalación del participante
- Coloque al participante.
- Invite al participante a sentarse frente al operador con su antebrazo desnudo apoyado en la mesa frente al dispositivo previamente instalado (véase la Figura 3).
NOTA: Se mide el lado contralateral (es decir, el lado izquierdo para un participante diestro).
- Invite al participante a sentarse frente al operador con su antebrazo desnudo apoyado en la mesa frente al dispositivo previamente instalado (véase la Figura 3).
- Marque el sitio de medición (un tercio del radio distal).
- Mida la longitud del radio con la regla desde la estiloides radial (extremo del hueso cerca de la muñeca) hasta el codo.
- Divide esta longitud por tres.
- Marque el sitio de medición, es decir, un tercio del radio distal, usando el bolígrafo midiendo un tercio de la longitud del radio desde la muñeca.
- Inicie el software HMI.
- Inicie el software HMI haciendo clic en el icono correspondiente en el escritorio de la computadora portátil.
- Añade los datos del participante.
- Añada los datos del participante (identificación anonimizada, lateralidad, sitio medido, identificación del operador, sexo, etc.) mediante la ventana emergente, que se abre automáticamente cuando se inicia el software.
- Añadir gel ecográfico.
- Agregue gel ecográfico en la parte frontal de la sonda y en el sitio de medición, marcado en el antebrazo del participante, para garantizar la propagación de las ondas ultrasónicas.
- Ponga la sonda en contacto con el antebrazo.
- Ponga la sonda en contacto con el antebrazo, con el centro de la sonda colocado en la marca realizada previamente en el paso 2.2.
3. Buscando una posición estable
NOTA: El HMI muestra cuatro parámetros de interés: dos velocidades, vFAS y vA0, y dos valores de problema inversos, espesor cortical (Ct.Th) y porosidad cortical (Ct.Po). La HMI también muestra cuatro parámetros de calidad denotados alpha, lowk, max y diff. Estos parámetros se describen en detalle en la introducción.
- Inicie la visualización en tiempo real .
- Inicie la visualización en tiempo real haciendo clic en el botón de inicio en la parte inferior derecha de la interfaz del software. La duración entre dos visualizaciones de valores sucesivas es de aproximadamente 0,5 s.
- Encuentre un valor vFAS estable.
- Ajuste lentamente la posición de la sonda mientras observa el valor del parámetro vFAS que se muestra en un caso específico de la interfaz. Los valores normales oscilan entre unos 3800 m∙s-1 y unos 4200 m∙s-1.
- Si se encuentra una posición estable, asegúrese de que la variación de vFAS sea inferior a unos 40 m∙s-1 entre dos cálculos sucesivos.
- Ajuste el ángulo bidireccional.
- Ajuste lentamente la posición de la sonda mientras observa el valor bidireccional (parámetro de calidad alfa) que se muestra en un caso específico de la interfaz.
- Ajuste la posición de la sonda agregando suavemente presión en un lado de la sonda hasta que el valor absoluto del ángulo sea inferior a 2° para mejorar el paralelismo entre la sonda y la superficie ósea.
- Encuentre un valor vA0 estable.
- Ajuste lentamente la posición de la sonda mientras observa el valor del parámetro vA0 que se muestra en un caso específico de la interfaz. Los valores normales oscilan entre unos 1500 m∙s-1 y unos 1900 m∙s-1.
- Si se encuentra una posición estable, asegúrese de que la variación vA0 sea inferior a unos 40 m∙s-1 entre dos cálculos sucesivos.
- En caso de dificultad, observe los espectros de imágenes de onda guiada que se muestran en la columna derecha de la interfaz. Asegúrese de que la parte superior del espectro aparezca como una línea continua, cuya pendiente proporcione el valor vA0.
- Observa la imagen inversa del problema.
- Observe la imagen inversa del problema, que aparece automáticamente una vez que se estabilizan los dos valores de velocidades (vFAS y vA0) y ángulos.
- Asegúrese de que la imagen muestre al menos un máximo, indicado con un píxel claro, y finalmente, uno o varios máximos secundarios, indicados con un color diferente. Los tres parámetros de calidad que faltan (máx. diff, lowk) se calculan automáticamente en tiempo real.
- Mejorar la imagen inversa del problema.
- Ajuste lentamente la posición de la sonda mientras observa los máximos de la imagen del problema inverso.
- Encuentre el primer máximo posible y el máximo secundario más bajo posible mientras observa los casos correspondientes de la interfaz (valores max y diff).
- En caso de dificultad, observe la imagen del espectro de onda guiada que se muestra en la columna derecha de la interfaz. Asegúrese de que la parte inferior del espectro aparezca con unas pocas líneas continuas, lo más larga posible, asociada a modos de velocidad de fase alta y la calidad del parámetro lowk, lo más alta posible.
- Busca una posición estable.
- Una vez que se encuentre una imagen de problema inverso aceptable, estabilice la posición de la sonda. Asegúrese de que no se observen cambios significativos en la imagen inversa del problema entre dos cálculos sucesivos.
4. Adquisición de datos
- Comienza una serie de 10 adquisiciones.
- Una vez que se encuentre una posición estable, inicie una serie de 10 adquisiciones presionando el interruptor del pedal con el pie.
- Permanezca lo más estable posible durante las 10 adquisiciones, que duran unos 5 s.
- Controla la calidad de la serie.
- Mire las medias y desviaciones estándar de los parámetros de interés, que se calculan automáticamente y se muestran en ventanas emergentes que aparecen una vez que finaliza la serie.
- Si las desviaciones estándar son inferiores a los umbrales fijos, tenga en cuenta la serie. Por el contrario, rechaza la serie.
- Respuesta a la pregunta formulada en una segunda ventana emergente, preguntando si el operador desea detener o continuar con la serie de adquisición del mismo participante.
- Vuelva a colocar la sonda.
- Comience de nuevo los pasos anteriores (de los pasos 2.1 a 3.2) para encontrar posiciones más estables y adquirir más series de 10 adquisiciones. Eventualmente, si es necesario, deje que el participante descanse entre dos reposicionamientos.
- Al igual que antes, las medias y desviaciones estándar de los parámetros de interés se calculan automáticamente para cada serie.
- Mire la ventana emergente de resultados para verificar si la última serie adquirida se mantiene o se rechaza. La medición del participante finaliza cuando se registran al menos cuatro series consistentes. Las series externas se rechazan automáticamente.
- Obtener los valores finales.
NOTA: Los valores finales de los parámetros de interés se obtienen automáticamente, considerando la media de las medias obtenidas con las series consistentes. - Verifique el informe automático en pdf.
- Verifique que los valores finales se informen en el informe pdf de forma automática e instantánea una vez que se elija la opción stop en la ventana emergente. En la Figura 4 se muestra un ejemplo.
NOTA: El pdf se encuentra en la misma carpeta que los datos sin procesar, que podrían volver a analizarse más tarde sin conexión.
- Verifique que los valores finales se informen en el informe pdf de forma automática e instantánea una vez que se elija la opción stop en la ventana emergente. En la Figura 4 se muestra un ejemplo.
- Verifique el segundo informe preciso.
- Verifique el segundo informe preciso generado utilizando los valores exactos del modelo de guía de ondas para el cálculo del problema inverso en lugar de valores aproximados como en el caso del primer informe automático. La generación del segundo informe tarda menos de 5 minutos. En la Figura 5 y en la Figura 6 se muestran ejemplos.
- Compruebe que el informe automático coincida con el informe preciso. Quite las series que no se eliminaron automáticamente para mantener la serie coherente.
Resultados
Se realizó un estudio de reproducibilidad considerando 3 operadores (un experto, dos novatos) y 14 participantes sanos (6 mujeres, 8 hombres, 21-53 años). Los operadores novatos fueron entrenados durante aproximadamente 3 h para comprender y practicar el protocolo de adquisición. Luego, se midió a los participantes durante 2 semanas en agosto de 2023. Cada medición se realizó de forma independiente. Todos los operadores estaban cegados, es decir, un operador no conocía los resultados obtenidos por los otros dos.
Repetibilidad dentro del operador
La Figura 5 ilustra la repetibilidad intra-operador para un caso consistente: 4 series de 10 adquisiciones adquiridas en un participante y un operador. La primera columna corresponde a las funciones inversas del problema, mientras que la segunda columna muestra la dispersión del modo guiado experimental en comparación con el modelo de mejor ajuste. Cada línea de figura corresponde a una serie exitosa. El número de adquisiciones retenidas se da en el título: 7 de 10 para la primera serie y 10 de 10 para las siguientes. Se proporcionan medias y desviaciones estándar y los cuatro parámetros (vFAS, vA0, Ct.Th y Ct.Po) para cada serie. Además, también se muestran los parámetros de calidad: el ángulo bidireccional (alfa), el máximo de la función inversa del problema (max), la diferencia absoluta con el segundo máximo (diff) y el valor medio de la parte más baja del GWSI (lowk).
Las desviaciones estándar dentro de la serie son bajas, alrededor de 0,02 mm para el grosor cortical, menos del 0,5% para la porosidad cortical y menos de 20 m∙s-1 para las dos velocidades, lo que indica que las posiciones de la sonda de alcance eran estables. Luego, se puede observar que los valores medios obtenidos para cada serie son muy cercanos, particularmente para los valores de espesor que oscilan entre 3,4 mm y 3,5 mm y los valores de vFAS que oscilan entre 4040 m∙s-1 y 4070 m∙s-1. Nótese que una diferencia de 40 m∙s-1 corresponde a una diferencia del 1% para un valor medio de 4000 m∙s-1. Se observan mayores variaciones para la porosidad cortical, que oscila entre el 8% y el 12%, y la velocidad vA0, que oscila entre 1700 m∙s-1 y 1740 m∙s-1. En este caso consistente, casi todas las adquisiciones son consistentes, es decir, cercanas entre sí. Casi no hay ambigüedad en el resultado final de los cuatro parámetros de interés.
Un segundo caso se ilustra en la Figura 6 para un caso menos regular. En este caso, tres parámetros, vFAS, vA0 y Ct.Po son muy estables, con valores respectivamente de alrededor de 4120 m∙s-1, 1700 m∙s-1 y 10%. El caso del grosor cortical es más difícil ya que se observan dos soluciones ambiguas, de 2,6 mm y 3,5 mm, que concuerdan con un pequeño valor de diferencia (diferencia inferior al 0,5%) entre los dos primeros máximos de la función inversa del problema. En el caso ordinario anterior, esta diferencia oscilaba entre el 1% y el 3%. La ambigüedad se elimina mediante el análisis de expertos, en este caso, observando la concordancia entre los modos guiados experimentales y teóricos (columna de la derecha). En el caso del espesor más bajo, la concordancia es mejor en la parte más baja del espectro (dos primeras series). Para las dos últimas series, existe un modo teórico con muy pocos puntos experimentales, en torno a 0,5 MHz, lo que indica una menor concordancia en comparación con las series anteriores. Además, el parámetro diff (0,1%) es menor que los valores de las dos primeras series (0,4% y 0,2%). En este caso, la elección de la solución guardada (2,6 mm) aún no está automatizada y aún se necesita un experto. Sin embargo, los tres operadores se enfrentaron a problemas similares y eligieron soluciones similares, cercanas a los 2,6 mm.
Fiabilidad extra-operador
Todos los resultados de los 4 parámetros de interés obtenidos por los 3 operadores con los 14 participantes se muestran en la Figura 7. Los coeficientes de correlación intraclase (CCI) se calcularon siguiendo la fórmula y el código Matlab publicado previamente 37,38,39. El ICC se utiliza habitualmente para la evaluación de la fiabilidad de las escalas de medición, en particular para aplicaciones biomédicas. Los valores de ICC que oscilan entre 0,75 y 0,9 suelen asociarse a una buena fiabilidad, mientras que los valores de ICC superiores a 0,9 se consideran de excelente fiabilidad. El valor más bajo para ICC (0,76) se obtuvo para el parámetro vA0. La desviación estándar fue igual a 17 m∙s-1, que es aproximadamente el 7% del rango de medición del orden de 250 m∙s-1. Se observaron valores similares para Ct.Po con ICC igual a 0,80 y una desviación estándar de 1,1%, alrededor del 10% del rango. Se obtuvo una excelente fiabilidad (ICC alrededor de 0,9) para los otros dos parámetros, Ct.Th y Ct.Po, con una desviación estándar inferior al 10% del rango.

Figura 1: diferentes partes del dispositivo ultrasónico de transmisión axial bidireccional (BDAT). El prototipo incluye aislamiento electrónico (1), un interruptor de pedal (2), dos sondas (3.1 y 3.2), un módulo electrónico (4), una computadora (5) y una regla (6). Haga clic aquí para ver una versión más grande de esta figura.
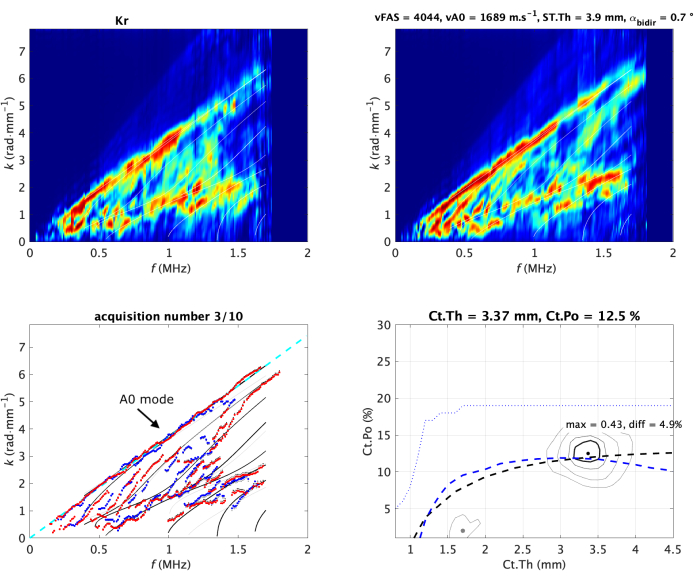
Figura 2: Adquisición típica en antebrazo in vivo. Las dos funciones Norm (una por dirección de propagación) se muestran en la línea superior de la imagen. También se denotan como imagen de espectro de onda guiada (GWSI). A partir de los máximos de estas imágenes, es posible extraer los modos guiados experimentales (puntos azules y rojos) en comparación con el modelo que mejor se ajusta (subimagen inferior izquierda). El modelo de mejor ajuste está parametrizado por dos valores, el espesor cortical (Ct.Th) y la porosidad (Ct.Po), correspondientes a la posición máxima de la función inversa del problema (subimagen inferior derecha). Sus valores se muestran en el título de cada panel. El accesorio vA0 se muestra como una línea discontinua (izquierda). Las imágenes del espectro de onda guiada y la imagen del problema inverso se normalizan (es decir, el valor del píxel oscila entre 0 y 1) por construcción19,20. Los valores de las dos velocidades medidas, vFAS y vA0, se indican en el título de la subimagen superior derecha. Haga clic aquí para ver una versión más grande de esta figura.
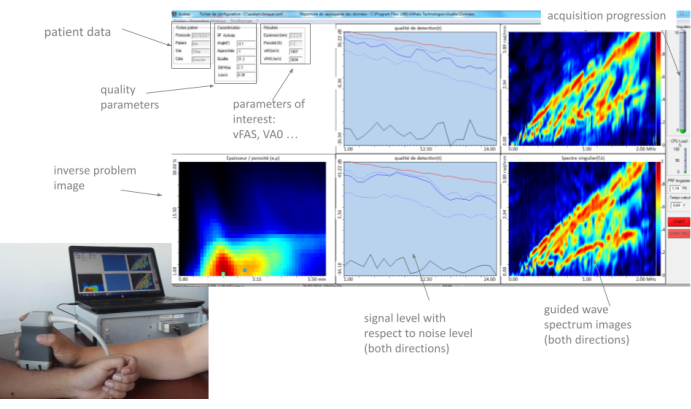
Figura 3: Interfaz hombre-máquina (HMI). La HMI muestra en real los dos GWSI (uno por dirección de propagación), la imagen inversa del problema, los parámetros de interés y los parámetros de calidad. Haga clic aquí para ver una versión más grande de esta figura.
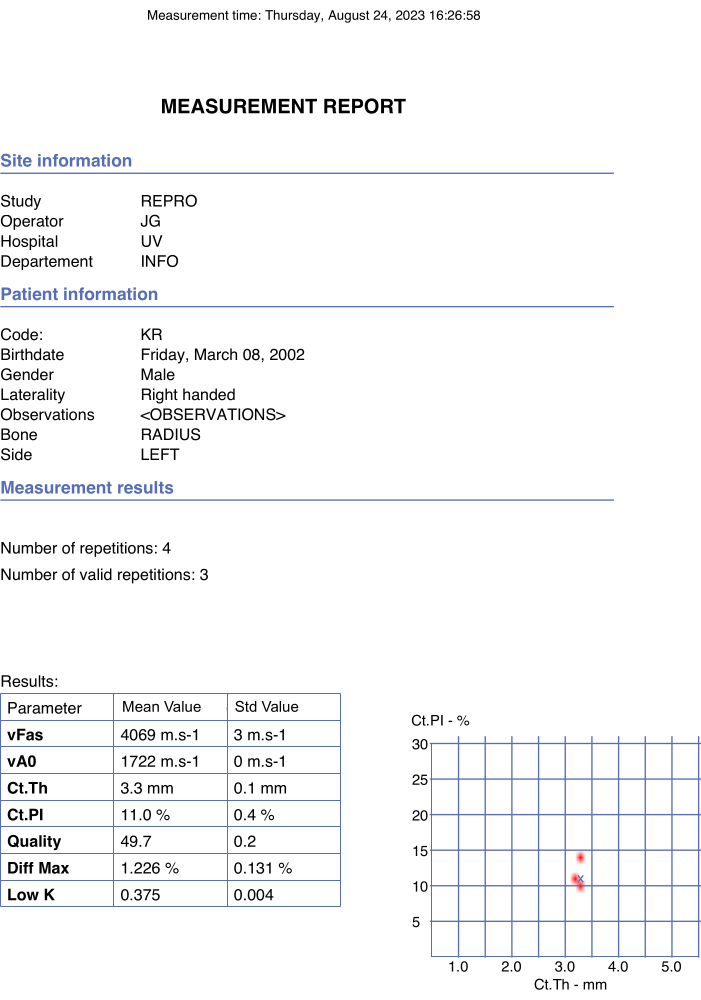
Figura 4: Ejemplo de informe automatizado. El informe indicaba los datos del participante y del operador, así como los valores finales de los parámetros de interés y los parámetros de calidad. Haga clic aquí para ver una versión más grande de esta figura.
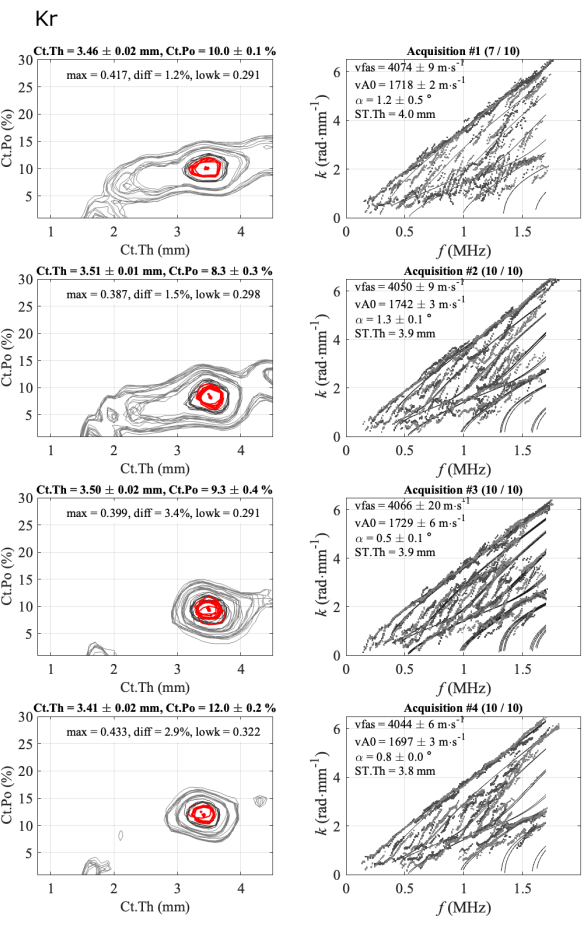
Figura 5: Ejemplo del segundo informe para un caso consistente, igual que el informe automatizado que se muestra en la Figura 4. La figura muestra 4 series de 1 participante y 1 operador: imágenes de problemas inversos (columna izquierda) y números de onda experimentales comparados con el modelo de mejor ajuste (columna derecha). Los valores mostrados corresponden a la media y la desviación estándar de las adquisiciones mantenidas a lo largo de la serie de 10 adquisiciones. El número de adquisiciones conservadas se indica en el título de la columna de la derecha, por ejemplo, (7/10) para la primera serie. Haga clic aquí para ver una versión más grande de esta figura.
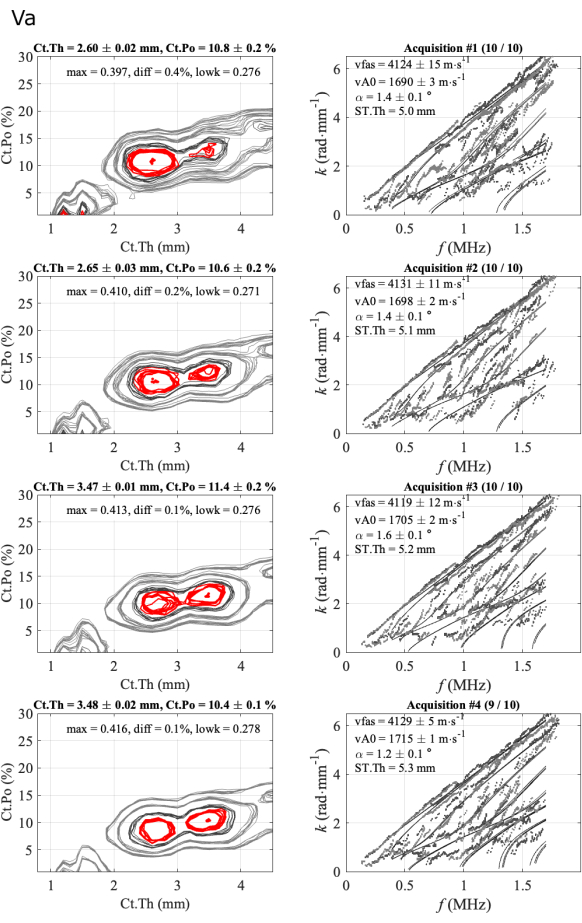
Figura 6: Ejemplo del segundo informe para un caso ambiguo para el grosor cortical. La figura muestra 4 series de 1 participante y 1 operador: imágenes de problemas inversos (columna izquierda) y números de onda experimentales comparados con el modelo de mejor ajuste (columna derecha). Los valores mostrados corresponden a la media y la desviación estándar de las adquisiciones mantenidas a lo largo de la serie de 10 adquisiciones. El número de adquisiciones conservadas se indica en el título de la columna de la derecha, por ejemplo, (10/10) para la primera serie. Haga clic aquí para ver una versión más grande de esta figura.
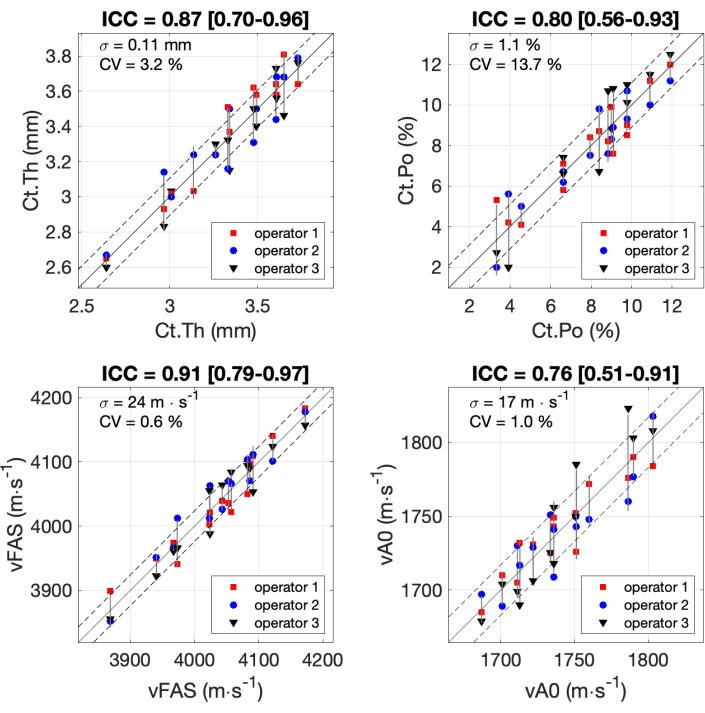
Figura 7: Fiabilidad entre operadores. Se muestran los resultados de los 4 parámetros de interés obtenidos por los 3 operadores con 14 participantes. Los valores obtenidos por los 3 operadores (eje y) se comparan con el valor medio de los 3 operadores (eje x). Los coeficientes de correlación intraclase (CCI) se indican en los títulos. También se indican la desviación estándar σ y el coeficiente de variación CV. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
El punto crítico para el éxito de la medición es la posición correcta de la sonda con respecto al hueso. La posición con respecto a la superficie ósea se resolvió con éxito integrando con la interfaz de guía la corrección bidireccional 16,17. Se demostró que sin esta corrección, se puede alcanzar un pequeño error porcentual para los parámetros vFAS16. Se encontró que esta corrección era crucial para discriminar con precisión entre los pacientes, ya que todo el rango de medición (alrededor de 3800-4200 m∙s-1) es aproximadamente el 10% del valor medio17, aproximadamente 4000 m∙s-1. La reproducibilidad encontrada en este estudio (desviación estándar de 24 m∙s-1) fue similar a la del estudio previo17, indicando una desviación estándar de 20 m∙s-1 y un coeficiente de variación (CV) de alrededor de 0,5%. Se encontró un coeficiente de variación similar (0,5 %) a una frecuencia más baja, es decir, 0,3 MHz40. Nótese que la excelente fiabilidad del parámetro vFAS (ICC = 0,91) fue superior a la obtenida recientemente con otro dispositivo AT en una población mayor (ICC = 0,77)41. Cabe destacar que la población en este caso no solo era de edad avanzada, sino también toda del sexo femenino y algunos sujetos con otros signos clínicos de aumento de la porosidad ósea41.
El segundo reto es también posicionar correctamente la sonda con respecto al eje óseo y a las dos interfaces para obtener los modos guiados, en particular los de alta velocidad de fase o bajo número de onda. Estos modos están cerca de la resonancia y asociados con múltiples rutas de reflexión. Si la alineación no es correcta, las ondas se dispersarán fuera del rango de medición espacial de la sonda. Por el contrario, si la sonda está correctamente posicionada, estos modos de velocidad de fase alta aparecerán como ramas continuas en el ROI3. Para la primera versión de la HMI actual, esta alineación se resolvió observando el GWSI20 en tiempo real. Sin embargo, este enfoque resultó insuficiente para alcanzar una medición robusta: se encontró que la tasa de fracaso era de alrededor del 20% en el estudio clínico piloto20. La inclusión de parámetros de calidad en tiempo real permite que el fracaso disminuya a alrededor del 10% en un segundo estudio clínico23. Luego, la inclusión de la imagen inversa del problema en la HMI "en tiempo real" permite una mejora adicional, con una tasa de falla actual para la medición del radio de aproximadamente el 5%25. Nótese que se encontró que la falla inicial con el primer dispositivo que midió solo vFAS fue de aproximadamente el 15%17.
Se encontró que la confiabilidad en el grosor cortical es similar a la de un estudio previo22. Con una versión anterior del mismo prototipo, también se encontró que el ICC estaba cerca de 0,9, con una desviación estándar de aproximadamente 0,1 mm y un CV de aproximadamente 3%. Sin embargo, se observa una clara mejoría en la porosidad cortical: el ICC aumentó de 0,622 a 0,8, y la desviación estándar disminuyó de 1,5% a 1%. El parámetro más difícil es vA0 debido a la proximidad de su velocidad con la velocidad de los tejidos blandos, alrededor de 1500 m∙s-1. Si la sonda está correctamente alineada, el modo A0 aparece único y continuo. Por el contrario, aparece discontinuo y/o múltiple debido al acoplamiento con los tejidos blandos circundantes. Este efecto es particularmente fuerte para las personas con un grosor de tejido blando pequeño (menos de 4 mm) o grande (más de 10 mm) (denotado ST.Th).
Como se expuso anteriormente, el punto clave es encontrar la posición correcta de la sonda. Sin embargo, la posición no solo debe ser correcta sino también estable para realizar la media y la desviación estándar para una serie de 10 adquisiciones. En la mayoría de los casos, encontrar un establo lleva menos de 1 minuto, y la medición completa de un paciente duraría unos 5 minutos. Incluso si el protocolo estándar descrito en este estudio es adecuado para la mayoría de los pacientes, algunas personas son más difíciles de medir; Es difícil pero posible encontrar las posiciones correctas, pero casi imposible encontrar una estable. En este caso, el operador puede optar por registrar series más largas, hasta 200 adquisiciones. Las mejores adquisiciones se determinan posteriormente fuera de línea utilizando parámetros de calidad. Este filtrado debería aplicarse en tiempo real en el futuro. En la práctica, el operador registra más series y/o adquisiciones que las 4 series de 10 adquisiciones del protocolo de condición ideal. Sin embargo, el tiempo de medición habitual sigue siendo de unos 5 minutos para un sitio, antebrazo o pierna. Si, después de unos minutos, la HMI no detecta ninguna posición correcta, la medición se detiene y se considera un fallo. Con el dispositivo y el protocolo actuales, se ha encontrado que la tasa de fallas es inferior al 5%25.
El dispositivo actual se enfrenta a diferentes limitaciones:
(i)Tamaño y peso: El dispositivo BDAT actual es portátil: cabe en el equipaje estándar y pesa unos 25 kg. Sin embargo, este peso es grande con respecto a los dispositivos ultrasónicos más nuevos. Se puede considerar un nuevo diseño electrónico, en el que la sonda y el procesamiento de la señal sigan siendo los mismos. Sin embargo, es posible mover el dispositivo actual, especialmente para pacientes en cama o en casa con movilidad limitada.
(ii)Velocidad de adquisición: La velocidad de fotogramas actual es de aproximadamente 2-4 Hz, lo que significa que la exploración de la medición es lenta en comparación con la adquisición real en tiempo real, es decir, superior a 25 Hz. Esto podría mejorarse en el futuro, teniendo en cuenta computadoras más rápidas, análisis de datos más rápidos y transmisión entre la electrónica y la computadora. Un aumento en la velocidad de adquisición mejoraría la facilidad de uso de la medición, particularmente la búsqueda del posicionamiento correcto de la sonda.
(iii)Espesor de los tejidos blandos: El enfoque actual está limitado por una gran capa de tejido blando, normalmente superior a 10 mm. En este caso, la primera señal que llega está relacionada con el trayecto del tejido blando y no con el hueso cortical. Por lo tanto, no se pueden utilizar vFAS y el ángulo bidireccional asociado. Del mismo modo, el vA0 es muy difícil de medir para grandes capas de tejidos blandos. Sin estas dos velocidades, no se puede realizar el problema inverso. En el futuro, se podrían aplicar otros métodos de corrección bidireccional utilizando técnicas de imagen, por ejemplo. Los pacientes con grandes capas de tejidos blandos suelen asociarse a obesidad e índice de masa corporal (IMC) superior a 30 kg.m-2.
(iv)Regularidad de la guía de ondas: El enfoque del problema inverso supone una guía de onda regular con múltiples rutas de propagación. Para los pacientes osteoporóticos, la interfaz cortical interna puede ser irregular y, por lo tanto, implica imágenes deficientes del espectro de ondas guiadas, particularmente en la parte inferior. Estos pacientes suelen asociarse a una alta ambigüedad de la solución. Si el tejido blando o el mal posicionamiento no pueden considerarse como el origen de una imagen de espectro deficiente, y si el valor del parámetro lowk es bajo, la guía de ondas es supuestamente irregular y se considera la solución de menor grosor. También se pueden utilizar enfoques basados en el aprendizaje automático, que no necesita modelado físico29.
Como se discutió en la introducción, el estándar de oro actual para la detección de pacientes con riesgo de fractura por fragilidad es la DXA, que enfrenta algunas limitaciones: su gran tamaño, poca disponibilidad en algunas regiones, costo relativamente alto y efectividad relativamente moderada. Las primeras limitaciones podrían mitigarse con dispositivos ultrasónicos, conocidos por su atractiva portabilidad y costes. Sin embargo, la capacidad de detectar eficazmente a los pacientes en riesgo debería ser al menos equivalente a la DXA. En realidad, a veces se espera que sea superior a la DXA para justificar la adaptación de la mayoría de las referencias (decisiones médicas, tratamientos, costes, habitaciones, etc.) vinculadas al patrón oro. Es por eso que algunos dispositivos ultrasónicos proponen sustitutos de la DMO 10,11,42. Sin embargo, un inconveniente de los parámetros clínicos, como la DMO y también los AGVs, es la integración de diferentes propiedades óseas corticales. Es por ello que otros dispositivos ultrasónicos, entre ellos el BDAT, proponen puntos de vista complementarios, proponiendo parámetros que pueden ser interpretados más fácilmente por el médico y el paciente, como la porosidad cortical, el grosor o la distribución del tamaño de los poros9. Estos parámetros reflejan las propiedades geométricas y del material: el hueso cortical puede evaluarse potencialmente en términos de variaciones independientes de cantidad o calidad. Este punto de vista podría ser muy útil para explorar diferentes posibles causas de la fragilidad ósea. Por ejemplo, se supone que las fracturas por fragilidad intra o extracapsular de cadera, es decir, los sitios de fractura del cuello femoral o del trocánter, tienen diferentes orígenes médicos43. Del mismo modo, podría ser posible el seguimiento de diferentes medicamentos dirigidos a diferentes efectos sobre el hueso cortical, así como en términos de cantidad o calidad3.
Hay que tener en cuenta que la precisión obtenida con BDAT para el grosor cortical (0,1 mm) es mejor que la de otros métodos ultrasónicos, normalmente por encima de 0,25 mm44. Esta diferencia se debe en parte al hecho de que el problema inverso de BDAT tiene en cuenta las variaciones geométricas y materiales combinadas. Algunos otros abordajes, como la ecocardiografía de pulso, consideran propiedades únicas del material óseo para todos los pacientes10,44. Este valor de precisión, alrededor de 0,1 mm (CV alrededor del 3%), es crucial para discriminar finamente entre pacientes, ya que el rango de grosor es inferior a 2 mm. La precisión en la porosidad cortical (1%, CV alrededor del 14%) aún no es tan buena como la del grosor. Sin embargo, ya se han observado mejoras significativas con respecto al estudio de reproducibilidad previo22. Se puede esperar que se logren mejoras similares en un futuro próximo gracias a las futuras mejoras de HMI, particularmente en términos de velocidad de fotogramas más cercana al tiempo real.
El BDAT podría utilizarse a gran escala para el cribado poblacional en regiones donde la DXA no está ampliamente disponible. Además, los últimos resultados clínicos mostraron el potencial de que el BDAT podría ser incluso más eficiente que el DXA. Sin embargo, estos resultados deben confirmarse incluyendo a más pacientes. El próximo reto deben ser los estudios multicéntricos y/o longitudinales11,12. Sin embargo, el dispositivo BDAT sigue siendo un prototipo disponible para la colaboración científica, ya que ya se ha hecho en Alemania23 y Reino Unido24. Se necesitan esfuerzos para la industrialización de la próxima generación de dispositivos BDAT, que seguramente serán más rápidos y portátiles.
Divulgaciones
Los autores no declaran conflictos de intereses.
Agradecimientos
Este estudio fue financiado por los proyectos chilenos ANID / Fondecyt / Regular 1201311 y 1241091. Los autores desean agradecer a la empresa BleuSolid por su apoyo durante las últimas mejoras de HMI, y a Geropolis por la sala de filmación.
Materiales
| Name | Company | Catalog Number | Comments |
| Computer | Notebook HP | mod Zbook (16 Go RAM, Inrel Core i7) | to receive the sampled signals and applying the signal processing steps. Results are displayed in quasi real time (up to 4 per second) through a dedicated Human Machine Interface (HMI, BleuSolid, Pomponne, France) allowing the measurement guidance; |
| Electric insulation transformer | REOMED, Solingen, Germany | IEC / EN 60601-1 | to protect the device, the patient and other devices from any electric hazard |
| Electronic module | Althaïs, Tours, France | in-house | send excitation signals (half a period of negative voltage of 170 V) and discretize received signals (1024 time points per receiver at 20 MHz sampling frequency and 12 bit dynamic) before sending them to the computer. Delays and amplification can be adapted using linear laws in order to optimize data sampling within the accessible ranges. |
| Human Machine Interface | BleuSolid, Pomponne, France | N/A | HMI |
| Pedal switch | Scythe, Germany | USB Foot Switch 2 | to start an acquisition series |
| Ruler | Westcott, USA | 10417 | to locate the measurement site |
| Ultrasonic probe radius | Vermon, Tours, France | in-house | 1 MHz central frequency, 24 receivers with 0.8 mm pitch and two blocks of 5 transmitters with 1 mm pitch. |
| Ultrasonic probe tibia | Vermon, Tours, France | in-house | 0.5 MHz central frequency, 24 receivers with 1.2 mm pitch and two block of 5 transmitters with 1.5 mm pitch |
| Ultrasonic probes | designed according to the bidirectional geometry: a single receiver array surrounded by two transmitter arrays. The three arrays are aligned, mechanically and electrically isolated in order to minimize coupling signals. The probes are adapted to two different sites, one third distal radius and mid tibia. |
Referencias
- Curtis, E. M., Moon, R. J., Harvey, N. C., Cooper, C. Reprint of: the impact of fragility fracture and approaches to osteoporosis risk assessment worldwide. Int J Orthop Trauma Nurs. 26, 7-17 (2017).
- Sing, C. W., et al. Global epidemiology of hip fractures: secular trends in incidence rate, post-fracture treatment, and all-cause mortality. J Bone Miner Res. 38 (8), 1064-1075 (2023).
- Choksi, P., Jepsen, K. J., Clines, G. A. The challenges of diagnosing osteoporosis and the limitations of currently available tools. Clin Diabetes Endocrinol. 4, 1-13 (2018).
- El Maghraoui, A., Roux, C. DXA scanning in clinical practice. QJM. 101 (8), 605-617 (2008).
- Maeda, S. S., et al. Challenges and opportunities for quality densitometry in Latin America. Arch Osteoporos. 16, 1-11 (2021).
- Surowiec, R. K., Does, M. D., Nyman, J. S. In vivo assessment of bone quality without x-rays. Curr Osteoporos Rep. 22 (1), 56-68 (2024).
- Whittier, D. E., et al. A fracture risk assessment tool for high resolution peripheral quantitative computed tomography. J Bone Miner Res. 38 (9), 1234-1244 (2023).
- Nyman, J. S., et al. Toward the use of MRI measurements of bound and pore water in fracture risk assessment. Bone. 176, 116863(2023).
- Armbrecht, G., Nguyen Minh, H., Massmann, J., Raum, K. Pore size distribution and frequency-dependent attenuation in human cortical tibia bone discriminate fragility fractures in postmenopausal women with low bone mineral density. J Bone Miner Res Plus. 5 (11), e10536(2021).
- Behrens, M., et al. The Bindex® ultrasound device: reliability of cortical bone thickness measures and their relationship to regional bone mineral density. Physiol Meas. 37 (9), 1528-1540 (2016).
- Cortet, B., et al. Radiofrequency echographic multi-spectrometry (REMS) for the diagnosis of osteoporosis in a European multicenter clinical context. Bone. 143, 115786(2021).
- Olszynski, W. P., et al. Multisite quantitative ultrasound for the prediction of fractures over 5 years of follow-up the Canadian Multicentre Osteoporosis Study. J Bone Miner Res. 28 (9), 2027-2034 (2013).
- Hans, D., Métrailler, A., Gonzalez Rodriguez, E., Lamy, O., Shevroja, E. Quantitative ultrasound (QUS) in the management of osteoporosis and assessment of fracture risk: an update. Adv Exp Med Biol. 1364, 7-34 (2022).
- Weiss, M., Ben-Shlomo, A., Hagag, P., Ish-Shalom, S. Discrimination of proximal hip fracture by quantitative ultrasound measurement at the radius. Osteoporos Int. 11 (5), 411-416 (2000).
- Moilanen, P., et al. Discrimination of fractures by low-frequency axial transmission ultrasound in postmenopausal females. Osteoporos Int. 24, 723-730 (2013).
- Bossy, E., Talmant, M., Defontaine, M., Patat, F., Laugier, P. Bidirectional axial transmission can improve accuracy and precision of ultrasonic velocity measurement in cortical bone: a validation on test materials. IEEE Trans Ultrason Ferroelectr Freq Control. 51 (1), 71-79 (2004).
- Talmant, M., et al. In vivo performance evaluation of bi-directional ultrasonic axial transmission for cortical bone assessment. Ultrasound Med Biol. 35 (6), 912-919 (2009).
- Mitra, M., Gopalakrishnan, S. Guided wave based structural health monitoring: A review. Smart Mater Struct. 25, 053001(2016).
- Minonzio, J. G., Talmant, M., Laugier, P. Guided wave phase velocity measurement using multi-emitter and multi-receiver arrays in the axial transmission configuration. J Acoust Soc Am. 127 (5), 2913-2919 (2010).
- Minonzio, J. G., et al. cortical thickness and porosity assessment using ultrasound guided waves: An ex vivo validation. Bone. 116, 111-119 (2018).
- Vallet, Q., Bochud, N., Chappard, C., Laugier, P., Minonzio, J. G. In vivo characterization of cortical bone using guided waves measured by axial transmission. IEEE Trans Ultrason Ferroelectr Freq Control. 63 (9), 1361-1371 (2016).
- Minonzio, J. G., et al. Ultrasound-based estimates of cortical bone thickness and porosity are associated with nontraumatic fractures in postmenopausal women: a pilot study. J Bone Miner Res. 34 (9), 1585-1596 (2019).
- Minonzio, J. G., et al. Bi-directional axial transmission measurements applied in a clinical environment. PLoS One. 17 (12), e0277831(2022).
- Behforootan, S., et al. Can guided wave ultrasound predict bone mechanical properties at the femoral neck in patients undergoing hip arthroplasty. J Mech Behav Biomed Mater. 136, 105468(2022).
- Rojo, F., et al. Classification of hip fragility fractures in older adults using an ultrasonic device. , IEEE International Ultrasonics Symposium (IUS). Montreal, QC, Canada. (2023).
- Ishimoto, T., et al. Quantitative ultrasound (QUS) axial transmission method reflects anisotropy in micro-arrangement of apatite crystallites in human long bones: A study with 3-MHz-frequency ultrasound. Bone. 127, 82-90 (2019).
- Minonzio, J. G., Foiret, J., Talmant, M., Laugier, P. Impact of attenuation on guided mode wavenumber measurement in axial transmission on bone mimicking plates. J Acoust Soc Am. 130 (6), 3574-3582 (2011).
- Moreau, L., Minonzio, J. G., Talmant, M., Laugier, P. Measuring the wavenumber of guided modes in waveguides with linearly varying thickness. J Acoust Soc Am. 135 (5), 2614-2624 (2014).
- Miranda, D., Olivares, R., Munoz, R., Minonzio, J. G. Improvement of patient classification using feature selection applied to bidirectional axial transmission. IEEE Trans Ultrason Ferroelectr Freq Control. 69 (9), 2663-2671 (2022).
- Foiret, J., Minonzio, J. G., Chappard, C., Talmant, M., Laugier, P. Combined estimation of thickness and velocities using ultrasound guided waves: A pioneering study on in vitro cortical bone samples. IEEE Trans Ultrason Ferroelectr Freq Control. 61 (9), 1478-1488 (2014).
- Granke, M., et al. Change in porosity is the major determinant of the variation of cortical bone elasticity at the millimeter scale in aged women. Bone. 49 (5), 1020-1026 (2011).
- Bochud, N., Vallet, Q., Minonzio, J. G., Laugier, P. Predicting bone strength with ultrasonic guided waves. Sci Rep. 7 (1), 43628(2017).
- Schneider, J., et al. Ex vivo cortical porosity and thickness predictions at the tibia using full-spectrum ultrasonic guided-wave analysis. Arch Osteoporos. 14, 1-11 (2019).
- Ramiandrisoa, D., Fernandez, S., Chappard, C., Cohen-Solal, M., Minonzio, J. G. In vivo estimation of cortical thickness and porosity by axial transmission: Comparison with high resolution computed tomography. , 2018 IEEE International Ultrasonics Symposium (IUS). Kobe, Japan. (2018).
- Schneider, J., et al. In vivo measurements of cortical thickness and porosity at the proximal third of the tibia using guided waves: Comparison with site-matched peripheral quantitative computed tomography and distal high-resolution peripheral quantitative computed tomography. Ultrasound Med Biol. 45 (5), 1234-1242 (2019).
- Araya, C., et al. Real time waveguide parameter estimation using sparse multimode disperse radon transform. IEEE UFFC Latin America Ultrasonics Symposium (LAUS. , Gainesville, FL, USA. (2021).
- Bobak, C. A., Barr, P. J., O'Malley, A. J. Estimation of an inter-rater intra-class correlation coefficient that overcomes common assumption violations in the assessment of health measurement scales. BMC Med Res Methodol. 18 (1), 93(2018).
- Shrout, P. E., Fleiss, J. L. Intraclass correlations: uses in assessing rater reliability. Psychol Bull. 86 (2), 420(1979).
- Zoeller, T. Intraclass correlation coefficient with confidence intervals. , At https://www.mathworks.com/matlabcentral/fileexchange/26885-intraclass-correlation-coefficient-with-confidence-intervals (2010).
- Kilappa, V., et al. Low-frequency axial ultrasound velocity correlates with bone mineral density and cortical thickness in the radius and tibia in pre- and postmenopausal women. Osteoporos Int. 22, 1103-1113 (2011).
- Watson, C. J., de Ruig, M. J., Saunders, K. T. Intrarater and interrater reliability of quantitative ultrasound speed of sound by trained raters at the distal radius in postmenopausal women. J Geriatr Phys Ther. 47 (4), E159-E166 (2024).
- Stein, E. M., et al. Clinical assessment of the 1/3 radius using a new desktop ultrasonic bone densitometer. Ultrasound Med Biol. 39 (3), 388-395 (2013).
- Dinamarca-Montecinos, J. L., Prados-Olleta, N., Rubio-Herrera, R., Del Pino, A. C. S., Carrasco-Buvinic, A. Intra-and extracapsular hip fractures in the elderly: Two different pathologies. Rev Esp Cir Ortop Traumatol. 59 (4), 227-237 (2015).
- Karjalainen, J., Riekkinen, O., Toyras, J., Kroger, H., Jurvelin, J. Ultrasonic assessment of cortical bone thickness in vitro and in vivo. IEEE Trans Ultrason Ferroelectr Freq Control. 55 (10), 2191-2197 (2008).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados