Method Article
超音波ガイド波を用いた皮質骨評価:健常者集団における再現性研究
要約
ここでは、双方向軸方向伝送(BDAT)超音波デバイスの測定プロトコルを詳細に紹介し、14人の健康な参加者と3人のオペレーターを考慮して、再現性研究でテストします。クラス内相関係数(ICC)で測定した信頼性は、関心のある4つのパラメータについて「良好」から「優れ」でした。
要約
脆弱性骨折は、人口の高齢化が進む中でも、依然として世界的な健康上の負担となっています。特に、世界の股関節骨折の数は、2020年から2050年の間に倍増すると予想されています。したがって、脆弱性骨折のリスクがある患者を集団規模で検出することが不可欠です。現在のゴールデンスタンダードは、面骨密度(aBMD)を提供するデュアルX線吸収測定法(DXA)です。超音波装置は、通常、X線装置よりも携帯性が高く、安価であり、スクリーニングツールとして興味深いDXAの代替品を表しています。ただし、通常、オペレーターの依存関係が主な欠点として認識されています。この研究では、双方向軸方向伝送(BDAT)超音波デバイスの測定プロトコルについて詳しく説明します。専用の超音波プローブは、従来のカップリングゲルを使用して、非利き前腕の3分の1遠位半径に配置されます。ガイド付きインターフェースは、準リアルタイム(約2Hz)で、最初に到着する信号の速度(vFAS)とA0モード(vA0)、皮質の厚さ(Ct.Th)、気孔率(Ct.Po)、および4つの品質パラメータの4つの関心のあるパラメータを提供します。オペレーターは、測定現場でプローブをゆっくりと動かし、インターフェースからのフィードバックを注意深く観察して、安定した位置を見つけて一連の10回の収集を開始します。少なくとも 4 つの一貫したシリーズが取得されると、測定は終了し、自動レポートが生成されます。通常、測定が完了するまでに約5分かかります。このプロトコルの堅牢性を判断するために、3人のオペレーター(専門家1人、初心者2人)と健康な参加者14人(女性6人、男性8人、21〜53歳)の間で再現性研究が実施されました。クラス内相関係数(ICC)は、vA0(0.76)、Ct.Po(0.80)、Ct.Th(0.87)、vFAS(0.91)で良好であることがわかりました。標準偏差は、臨床診療における全範囲の 10% 未満であることがわかりました。
概要
骨粗鬆症とそれに伴う脆弱性骨折は、依然として主要な公衆衛生問題を構成しています1。特に、股関節骨折の世界的な数は2050年までに倍増すると予想されています2。骨の脆弱性は、骨折イベントの前に大きな警告サインがない、ゆっくりとした静かな脱灰と骨量減少のプロセスによるものです。脆弱性骨折のリスクがある患者を検出するための現在のゴールドスタンダードは、デュアルX線吸収測定法(DXA)であり、キャリブレーションされた灰色のピクセル3で2Dの低解像度X線画像を提供します。この画像から、脊椎、手首、股関節などの主要な脆弱性骨折部位に関連するさまざまな関心領域における面骨密度(g.cm-2のaBMD)を抽出することができます。aBMD値は、脆弱性骨折率が増加すると減少します3。さらに、正常な健康な集団に対するTスコアの正規化により、異なるメーカーが提案したデバイスと測定した患者の比較が可能になります。DXA Tスコアは、世界保健機関(WHO)によって提案され、骨粗鬆症の診断を正常(Tスコア<-1)、骨減少症(-1 < Tスコア<-2.5)、骨粗鬆症(Tスコア<-2.5)の3つの段階で定義しています4。
DXAにはいくつかの制限があります:そのサイズ、比較的高いコスト、専用の部屋の必要性、骨折した状態と骨折していない状態を区別する能力、およびラテンアメリカなどの多くの国での利用可能性はどちらも中程度です5。したがって、脆弱性骨折リスク推定のためのスクリーニングツールとしてDXAの代替手段が必要です6。しかし、定量的コンピュータ断層撮影法とその派生物7、磁気共鳴画像法(MRI)8など、一部のDXAの代替手段もかさばり、広く利用できない。定量的超音波(QUS)は、ポータブルで堅牢、かつ使いやすいスクリーニングデバイスの可能性を示しています。皮質骨の評価には、数kHzから数MHzの範囲のさまざまな周波数と、透過、レトロ拡散9、パルスエコー10、およびトランスデューサが橈骨や脛骨などの長骨の軸に整列する軸方向伝送におけるさまざまなトランスデューサの位置に関連付けられたさまざまなデバイスが開発されています。一部のデバイスは、aBMDサロゲート11を提供するが、他のデバイスは、速度12 または減衰係数9 などの「古典的な」超音波パラメータ、さらには幾何学的および材料的なパラメータ、例えば、皮質の厚さ、多孔性、または細孔径分布9を提供する。しかし、今日まで、QUS は、デバイス間の均質化の欠如とオペレーターの依存性13 のために、骨評価のための臨床診療で広く使用されることにまだ成功していません。
DXAの代替として提案されているQUS技術の中で、アキシャルトランスミッション(AT)は、(i)容易にアクセスでき、(ii)脆弱性骨折の主要な部位の1つである手首に近い前腕で測定できるという利点があります。最初に提案されたATパラメータは、皮質層内の超音波伝搬速度、音速(SOS)または最初に到着する信号の速度(vFAS)に依存し、信号処理およびデバイスに依存し、一部は商用のもの、12,14のもの、および他の実験室のプロトタイプ15,16である.このパラメータは、1990 年代後半以降のいくつかの臨床研究で BMD と同様のパフォーマンスを示す脆弱性骨折の有無にかかわらず、患者グループを区別することができました14,15。また、多施設縦断研究にも成功裏に適用されており、その臨床応用と堅牢性が実証されています12。vFASの精度は、プローブと骨表面との間の角度によるバイアスを低減するために、2つの反対の伝播方向を組み合わせることによって改善された16,17。この視点は、双方向AT(BDAT)と呼ばれています。
vFASが臨床的に関心を示しているとしても、その主な欠点は、BMDと同様に、幾何学的特性や材料特性などの異なる主要な皮質骨の特徴を組み合わせており、その臨床的解釈を容易には行わないことです。そのため、導波路の特性に対する導波の微細な感度によるその可能性を考慮して、誘導波の視点が提案されています。このアプローチは、信号処理、導波路モデリング、および逆問題を組み合わせる必要があり、たとえば、プレートやチューブなどの金属導波路を考慮した非破壊検査で主に使用されます18。したがって、第2世代のBDATデバイスは、2010年以来、骨模倣ファントム19 から ex vivo 検証20 および in vivo 測定21へと段階的に開発されてきた。このデバイスは、フランス22、ドイツ23、英国24、チリ25の臨床試験で成功裏にテストされており、成功率と患者の識別の点で改善された結果を示しています。
この研究は、現在のBDAT超音波デバイスの再現性を調査することを目的としています。まず、デバイスと測定プロトコルについて詳しく説明します。14人の参加者と3人のオペレーターで得られた結果は、脆弱性骨折のリスクがある患者の検出のための集団スクリーニングの観点から提示され、議論されます。
測定原理:信号処理、対象パラメータ、品質パラメータ
双方向軸方向伝送(BDAT)デバイスは、超音波プローブ、電子モジュール、およびコンピューターを主な部品として構成されています。完全なリストは 、材料の表 に詳しく説明されており、 図 1 に示されています。以下では、対象となるパラメータ、測定品質パラメータ、および測定プロトコルについて説明します。
vFAS の
サンプリングされた信号がコンピューターによって受信されると、それらはさまざまな手順に従って処理されます。最初のステップは、時間領域での信号処理からなり、前述のプロトコルを使用してFASを検出する16,17。各受信機の到着時間が取得されると、FAS速度(後にvFASと呼ばれる)を決定することができます。これは、伝搬の両方向で得られる速度の調和平均です。両方向の伝搬からの情報を組み合わせることにより、プローブと骨表面方向との間の角度の値を取得し、偏りのないvFAS値16を導出することができる。この双方向角度は、後でアルファと呼ばれ、測定品質のパラメータとして使用されます。この時間的処理はまた、骨表面とプローブとの間の軟組織の厚さの推定も可能にする(ST.Th 26)。
ガイド波スペクトル画像
2番目のステップは、fとkで示される時間周波数と空間周波数を考慮したフーリエ領域での信号処理で構成されます。このアプローチはSVDベースの方法であり、in vivo前腕19の図2に示されているように、時空間信号をNorm関数、ガイド波スペクトル画像(GWSI)とも呼ばれるものに変換することを可能にする。この手法は、2つのフーリエ変換(時間と空間)と特異値分解(SVD)を組み合わせたもので、皮質骨層によって導かれるモードの受信信号の存在率(0-1スケール)を視覚化することができます。GWSIは、時空間フーリエ変換の強化として解釈でき、各ピクセルは周波数fと波数kの独立した平面に関連付けられています。このアプローチは、材料の減衰27および線形厚さ変動28の影響を考慮に入れるために改善されたことに留意されたい。
A0モードに関連するスペクトルの上部と、最も高い位相速度値、つまり4mm·μs-1より大きいスペクトルの最も低い部分に特に注意が払われます。この部分は、関心領域 3 (ROI 3)29 に対応します。ROI 3 の平均値 (後で lowk と表記) は、品質パラメーターとしても使用されます。大きな値は通常の導波路に対応し、骨界面での明確な波の反射を可能にします。値が減少する場合は、導波路が不規則であるか、プローブが誤って配置されていることが原因である可能性があります。
導波路モデル
ガイド波の分散、または周波数に対する各ガイドモードの位相速度の変化は、導波路の材料特性と幾何学的特性の両方に依存します。したがって、専用の信号処理、導波路モデリング、および逆問題スキームを使用して、これらの特性を取得できる可能性があります。BDATの場合、導波路モデルは、導波路材料と1つの幾何学的パラメータである厚さ30に応じて、2D横等方性フリープレートに対応します。皮質骨材料は、骨基質および可変多孔性31の固定パラメータを考慮して均質化される。したがって、逆の問題は、皮質の厚さ (Ct.Th) と皮質の空隙率 (Ct.Po) の 2 つのパラメーターに依存します。材料の吸収、導波路の曲率、および周囲の軟組織の影響は、測定に影響を与える場合でも、モデルでは考慮されません。しかし、逆問題の結果に対するそれらの重みは決定要因であるとは見なされず、つまり、関心のある2つの主要な領域(A0と最下部)のモードは、曲率と軟組織32によって有意に変化しないことを意味する。
逆問題
最初に、逆問題は2つのステップに分割されました:最初に、実験的なガイド波分散を抽出し、次に、導波路モデルと比較します。この視点は、ノイズとモードのラベリング30,32によって制限されました。したがって、ノルム関数の視点の拡張として、これらの制限を克服するための専用のアプローチが提案されました。各平面波を独立して考慮する代わりに、導波路モデルによって提供される可能性のあるガイド波のみが考慮されます20。これにより、モデルパラメータ領域、つまり Ct.th-Ct.Po平面(図2右下)で表される逆問題像が得られます。最適なモデルには最大位置が与えられますが、最終的な二次ピーク (灰色の点で示される逆問題画像で示される) は、実験モードとの f-k 比較で薄い灰色の線で示されるあいまいな解に対応します。以前と同様に、ピクセル値は構造によって正規化され、この場合、受信信号に特定の導波路モデルが存在することを反映します。最大値 (最大値) と 2 番目の最大値との差 (diff と表示) も品質パラメータとして使用されます。
逆問題はもともと、オフライン計算、つまり信号が取得された後、モデルの波数の正確な値を使用して計算するために提案されていました。このアプローチは、ex vivo 20,33 および in vivo 21,34,35 の研究を考慮して、橈骨部位と脛骨部位の両方で検証されています。これらの計算をヒューマン・マシン・インターフェース(HMI)に含めるために、スパース行列の視点36を使用して、リアルタイム・アプリケーションと互換性のある近似バージョンが提案されている。
vA0
GWSIから、フリープレートまたはラムモデル33,35の第1の反対称モードA0に関連付けられた最も遅いガイドモードの速度を抽出することも可能である。ガイド波スペクトルの上部は線形に近似でき、傾きは速度vA0の値を提供します(図2左下)。
パラメータの概要:
最後に、関心のある4つのパラメータが測定されます:(i) vFAS:最初に到着する信号の速度(m·s-1)。(ii) vA0:最も遅いガイドモードの速度(m・s-1)。(iii) Ct.Th:皮質の厚さ(mm);(iv) Ct.Po:皮質の多孔性(%)。
4つの品質パラメータが考慮されます:(i) アルファ:双方向角度(°)。(ii) lowk: GWSI の最下位部分の平均値 (0 から 1 の間の正規化された値)。(iii) 最大:逆問題関数の最大値(0から1の間の正規化された値)。(iv) diff: 逆問題関数の 1 番目と 2 番目の最大値の差 (0 から 100 までの正規化された値)。
これらすべてのパラメータと、2つのガイド波スペクトル画像(1つのパー伝搬方向)と逆問題画像は、HMIによって約2Hzのフレームレートで「リアルタイム」に表示されます。典型的な例を 図 3 に示します。次のセクションでは、これらのパラメータの使用方法について詳しく説明します。主な考え方は、オペレーターが測定現場でプローブをゆっくりと動かし、インターフェースのさまざまな部分によって提供されるフィードバックを注意深く観察して、安定した位置を見つけて一連の10回の収集を開始することです。少なくとも 4 つの一貫したシリーズが取得されると、測定は終了し、自動レポートが生成されます。
プロトコル
この研究は、チリのバルパライソ大学の倫理委員会によって、プロトコル番号 CEC213-20 で承認されました。参加者には書面によるインフォームドコンセントが提供されました。参加者の包含/除外を確立するために、電話インタビューが実施されました。この研究は、次の参照に基づいて登録されています: NCT05424536.
1. デバイスのセットアップ
- デバイスの主要部品を大きなテーブルに置きます。
- 電気絶縁変圧器、電子モジュール、ラップトップコンピューターを大きなテーブルに並べて置きます。後で参加者の前腕を簡単に配置できるように、これらのパーツの前に十分なスペースがあることを確認してください。
- 最終的には、スペースが限られている場合は、ラップトップコンピュータを電子モジュールに直接置き、モジュールの換気窓が明確に示されているのを遮らないように注意してください。
- 電気絶縁トランスを接続します。
- 電気絶縁トランスを専用のケーブルを使用して部屋の家庭用電源に差し込みます。
- 電子モジュールを接続します。
- 電子モジュールを電気絶縁トランスに専用の電源ケーブルで接続します。
- トランスの ON-OFF ボタンを押して、モジュールに電力を供給します。
- ラップトップコンピュータを接続します。
- 専用のユニバーサルシリアルバス(USB)ケーブルを使用してラップトップコンピュータをモジュールに接続し、デジタル化された受信信号をコンピュータに送信してさらに処理します。
- ラップトップに電力を供給する必要がある場合は、電源ケーブルを電子絶縁トランスに接続します。
- 超音波プローブを接続します。
- 超音波プローブをモジュールの前面にある専用ケーブルスロットでモジュールに接続します。前腕と脚の測定部位には2つの異なるプローブがあります。この研究では、半径(前腕プローブ)のみを考慮します。
- ペダルスイッチを接続します。
- ペダルスイッチを足に近い床に置き、参加者を測定する際のオペレーターの位置を考慮します。ペダルスイッチをUSBケーブルでコンピューターに接続します。ペダルを使用して、アクイジションシリーズを開始します。
2. 参加者のインストール
- 参加者を配置します。
- 参加者に、オペレーターの前に座るように促し、裸の前腕を以前に設置したデバイスの前のテーブルに乗せます ( 図 3 を参照)。
注:反対側が測定されます(つまり、右利きの参加者の場合は左側)。
- 参加者に、オペレーターの前に座るように促し、裸の前腕を以前に設置したデバイスの前のテーブルに乗せます ( 図 3 を参照)。
- 測定部位(遠位半径3分の1)をマークします。
- 定規を使用して、放射状の茎状突起(手首に近い骨の端)から肘までの半径の長さを測定します。
- この長さを 3 で割ります。
- 手首から半径1/3を測定し、ペンを使用して測定部位、つまり遠位半径3分の1をマークします。
- HMIソフトウェアを起動します。
- ラップトップデスクトップの対応するアイコンをクリックして、HMIソフトウェアを起動します。
- 参加者のデータを追加します。
- ソフトウェアの起動時に自動的に開くポップアップウィンドウを使用して、参加者のデータ(匿名化されたID、横性、測定サイト、オペレーターID、性別など)を追加します。
- エコグラフィックジェルを追加します。
- プローブの前面と測定部位にエコグラフィックジェルを追加し、参加者の前腕にマークを付けて、超音波の伝搬を確保します。
- プローブを前腕に接触させます。
- プローブを前腕に接触させ、プローブの中心を手順2.2で前に行ったマークに置きます。
3. 安定したポジションを探す
注:HMIには、2つの速度、 vFAS と vA0、および2つの逆問題値、皮質の厚さ(Ct.Th)と皮質の空隙率(Ct.Po)の4つの興味深いパラメータが表示されます。HMIには、 alpha、 lowk、 max、 diffで示される4つの品質パラメータも表示されます。これらのパラメータについては、概要で詳しく説明します。
- リアルタイムの視覚化を開始します。
- ソフトウェアインターフェースの右下にあるスタートボタンをクリックして、リアルタイムの視覚化を開始します。2 つの連続する値の表示間の時間は約 0.5 秒です。
- 安定した vFAS 値を見つけます。
- インターフェースの特定のケースに表示されるvFASパラメータ値を観察しながら、プローブの位置をゆっくりと調整します。正常値は約3800m・s-1 から約4200m・s-1の範囲です。
- 安定した位置が見つかった場合は、2 つの連続する計算間で vFAS の変動が約 40 m・s-1 未満であることを確認してください。
- 双方向の角度を調整します。
- インターフェースの特定のケースに表示される双方向の値(品質パラメータアルファ)を観察しながら、プローブの位置をゆっくりと調整します。
- 角度の絶対値が2°未満になるまで、プローブの片側に静かに圧力を加えることでプローブの位置を調整し、プローブと骨表面の間の平行度を改善します。
- 安定した vA0 値を見つけます。
- インターフェースの特定のケースに表示されるvA0パラメータ値を観察しながら、プローブの位置をゆっくりと調整します。通常の値は、約1500 m・s-1 から約1900 m・s-1の範囲です。
- 安定した位置が見つかった場合は、2つの連続する計算間でvA0の変動が約40 m・s-1 未満であることを確認してください。
- 難しい場合は、インターフェースの右側の列に表示されるガイド波画像スペクトルを観察してください。スペクトルの上部が実線として表示され、その傾きが vA0 値を提供することを確認します。
- 逆問題イメージを観察します。
- 2 つの速度 (vFAS と vA0) と角度の値が安定すると自動的に表示される逆問題イメージを観察します。
- 画像に、少なくとも 1 つの最大値が鮮明なピクセルで示され、最終的には 1 つまたは複数のセカンダリ最大値が別の色で示されていることを確認します。欠落している3つの品質パラメータ(max.diff、lowk)は 、リアルタイムで自動的に計算されます。
- 逆問題画像を改善しました。
- 逆問題像の最大値を観察しながら、プローブの位置をゆっくりと調整します。
- インターフェイスの対応するケース (最大値と差分値) を確認しながら、可能な限り高い最初の最大値と可能な最小のセカンダリ最大値を見つけます。
- 難しい場合は、インターフェースの右側の列に表示されているガイド波スペクトル画像を観察してください。スペクトルの下部が、高位相速度モードとパラメーター品質lowkにできるだけ高いものに関連付けられた、できるだけ長く、いくつかの連続した線で表示されていることを確認します。
- 安定したポジションを見つけます。
- 許容できる逆問題画像が見つかったら、プローブの位置を安定させます。2 つの連続する計算の間に逆問題イメージの大きな変化が見られないことを確認します。
4. データ取得
- 10件の買収をシリーズ化します。
- 安定した位置が見つかったら、足でペダルスイッチを押して、一連の10回の収集を開始します。
- 10回の買収中、約5秒間、できるだけ安定して待機します。
- シリーズの品質を制御します。
- 対象のパラメーターの平均と標準偏差を確認します。これらのパラメーターは、系列の終了後に自動的に計算され、ポップアップ ウィンドウに表示されます。
- 標準偏差が固定しきい値よりも低い場合は、系列を考慮に入れます。それどころか、シリーズを拒否します。
- 2 番目のポップアップ ウィンドウで尋ねられた質問に回答し、オペレーターが同じ参加者の一連の取得を停止するか続行するかを尋ねます。
- プローブの位置を変更します。
- 前のステップ(ステップ2.1から3.2まで)をやり直して、より安定したポジションを見つけ、10回の買収をさらに取得します。最終的には、必要に応じて、参加者を2つの再配置の間に休ませます。
- 以前と同様に、関心のあるパラメータの平均と標準偏差は、各系列に対して自動的に計算されます。
- 結果のポップアップウィンドウを見て、最後に取得したシリーズが保持されているか拒否されているかを確認します。参加者の測定は、少なくとも 4 つの一貫したシリーズが登録されると終了します。アウトサイダーシリーズは自動的に拒否されます。
- 最終的な値を取得します。
注:関心のあるパラメータの最終値は、一貫性のあるシリーズで得られた平均の平均を考慮して、自動的に取得されます。 - 自動レポートpdfを確認します。
- ポップアップウィンドウで オプションstop が選択されると、最終値がレポートpdfに自動的に即座に生成されることを確認します。例を 図 4 に示します。
注:PDFは生データと同じフォルダにあり、後でオフラインで再分析できます。
- ポップアップウィンドウで オプションstop が選択されると、最終値がレポートpdfに自動的に即座に生成されることを確認します。例を 図 4 に示します。
- 2 番目の正確なレポートを確認します。
- 最初の自動レポートの場合のように近似値ではなく、逆問題計算の正確な導波路モデル値を使用して生成された 2 番目の正確なレポートを確認します。2 回目のレポート生成には 5 分もかかりません。例を 図 5 と 図 6 に示します。
- 自動レポートが正確なレポートと一致していることを確認します。一貫性のあるシリーズを維持するために、自動的に削除されなかったシリーズを削除します。
結果
再現性研究は、3人のオペレーター(専門家1人、初心者2人)と健康な参加者14人(女性6人、男性8人、21〜53歳)を考慮して実施されました。初心者のオペレーターは、取得プロトコルを理解して実践するために、約3時間のトレーニングを受けました。その後、2023年8月の2週間にわたって参加者を測定しました。各測定は独立して行われました。すべてのオペレーターが盲検化されていた、つまり、1人のオペレーターが他の2人のオペレーターによって得られた結果を知らなかった。
オペレーター内の再現性
図 5 は、一貫したケース (1 人の参加者と 1 人のオペレーターで 10 回のデータ収集を 4 回シリーズ取得した場合) のオペレーター内再現性を示しています。最初の列は逆問題関数に対応し、2 番目の列は、最適適合モデルと比較した実験ガイドモード分散を示しています。各フィギュアラインは、成功したシリーズに対応しています。タイトルには、最初のシリーズが10個中7個、次のシリーズが10個中10個と記載されています。平均値と標準偏差、および 4 つのパラメータ (vFAS、vA0、Ct.Th、Ct.Po) は、各系列ごとに提供されます。さらに、双方向角度 (alpha)、逆問題関数の最大値 (max)、2 番目の最大値との絶対差 (diff)、GWSI の最低部分の平均値 (lowk) などの品質パラメータも表示されます。
直列内の標準偏差は低く、皮質の厚さで約0.02 mm、皮質の空隙率で0.5%未満、2つの速度で20 m・s-1 未満であり、リーチプローブの位置が安定していることを示しています。次に、各シリーズで得られた平均値、特に3.4 mmから3.5 mmの範囲の厚さ値と4040 m・s-1 から4070 m・s-1の範囲のvFAS値で非常に近いことがわかります。40 m・s-1 の差は、平均値4000 m・s-1の1%の差に対応することに注意してください。皮質の多孔性は8%から12%の範囲で、vA0の速度は1700m・s-1 から1740m・s-1の範囲で、より大きな変動が観察されます。この一貫したケースでは、ほとんどすべての取得が一貫している、つまり互いに近接しています。関心のある4つのパラメータの最終結果にはほとんど曖昧さはありません。
図 6 に 2 番目のケースが示されています。これは、あまり規則的ではないケースです。この場合、vFAS、vA0、Ct.Poの3つのパラメータは非常に安定しており、それぞれ約4120m・s-1、1700m・s-1、10%の値です。皮質の厚さの場合、2.6 mm と 3.5 mm の 2 つのあいまいな解決策が、逆問題関数の 2 つの最初の最大値の間の小さな差値 (diff が 0.5% 未満) と一致して観察されるため、より困難になります。以前の通常のケースでは、この差は1%から3%の範囲でした。曖昧さは、専門家による分析、この場合、実験モードと理論ガイドモードの間の一致を調べることによって取り除かれます(右の列)。厚さが最も低い場合、スペクトルの最も低い部分(最初の2つのシリーズ)で一致が良好になります。最後の2つのシリーズには、実験点が非常に少なく、約0.5MHzの理論モードがあり、前のシリーズと比較して一致が不十分であることを示しています。さらに、diff パラメーター (0.1%) は、最初の 2 つの系列の値 (0.4% と 0.2%) よりも小さくなっています。この場合、保持する溶液(2.6 mm)の選択はまだ自動化されておらず、専門家が必要です。しかし、3人のオペレーターは同様の問題に直面し、2.6mmに近い同様の解決策を選択しました。
オペレーターの追加信頼性
図 7 に、3 人のオペレーターと 14 人の参加者によって得られた 4 つの対象パラメータのすべての結果が示されています。クラス内相関係数(ICC)は、式と以前に公開されたMatlabコード37,38,39に従って計算されました。ICCは、測定スケールの信頼性の評価、特に生物医学アプリケーションのために一般的に使用されます。0.75 から 0.9 の範囲の ICC 値は通常、良好な信頼性と関連しており、0.9 を超える ICC 値は優れた信頼性と見なされます。ICCの最小値(0.76)は、パラメータvA0で取得されました。標準偏差は17m・s-1に等しく、これは250m・s-1のオーダーの測定範囲の約7%である。Ct.Poについても同様の値が観察され、ICCは0.80に等しく、標準偏差は1.1%で、範囲の約10%でした。他の2つのパラメータ、Ct.Th とCt.Poについて、優れた信頼性(ICC約0.9)が得られ、標準偏差は範囲の10%未満でした。

図1:双方向軸方向伝送(BDAT)超音波装置のさまざまな部分。 プロトタイプには、電子絶縁体(1)、ペダルスイッチ(2)、2つのプローブ(3.1および3.2)、電子モジュール(4)、コンピューター(5)、および定規(6)が含まれています。 この図の拡大版を表示するには、ここをクリックしてください。
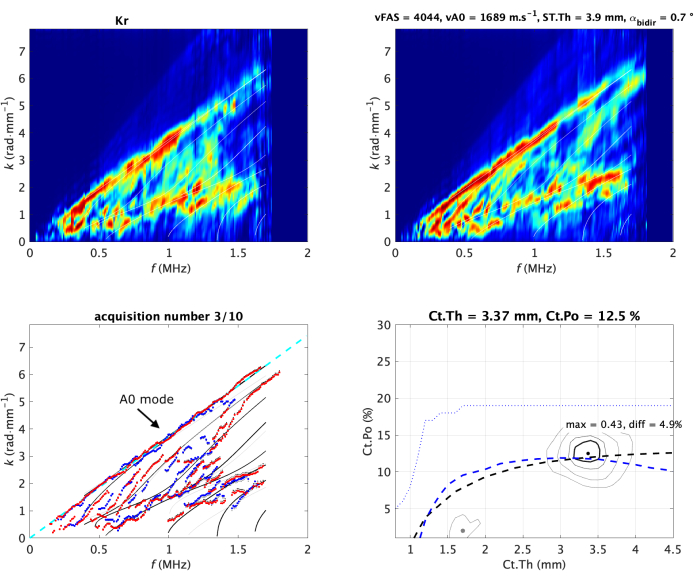
図2:in vivo前腕での典型的な取得。 2 つの Norm 関数 (伝播方向ごとに 1 つ) は、画像の上部行に示されています。また、ガイド波スペクトル画像(GWSI)とも呼ばれます。これらの画像の最大値から、最も適合したモデル(左下のサブ画像)と比較して、実験ガイドモード(青と赤の点)を抽出することができます。最適適合モデルは、逆問題関数の最大位置に対応する皮質の厚さ (Ct.Th) と空隙率 (Ct.Po) の 2 つの値によってパラメータ化されます (右下のサブイメージ)。それらの値は、各パネルのタイトルに表示されます。vA0フィッティングは破線で示されています(左)。ガイド波スペクトル画像と逆問題画像は、構造19,20によって正規化されます(つまり、ピクセル値の範囲は0〜1です)。測定された 2 つの速度 (vFAS と vA0) の値は、右上のサブ画像のタイトルに示されています。この図の拡大版を表示するには、ここをクリックしてください。
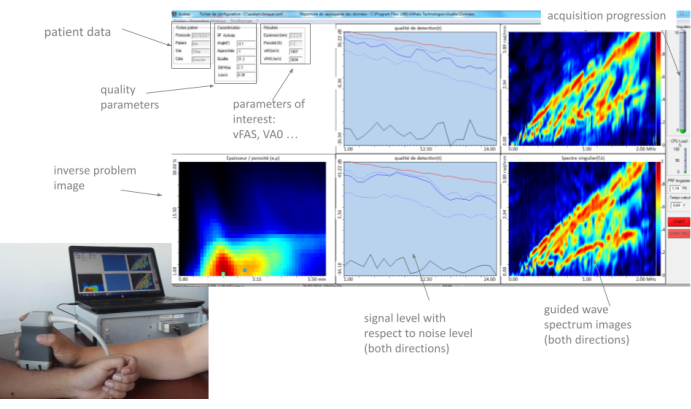
図3:ヒューマンマシンインターフェース(HMI)。 HMI は、2 つの GWSI (伝搬方向ごとに 1 つ)、逆問題イメージ、対象パラメータ、および品質パラメータを実際に表示します。 この図の拡大版を表示するには、ここをクリックしてください。
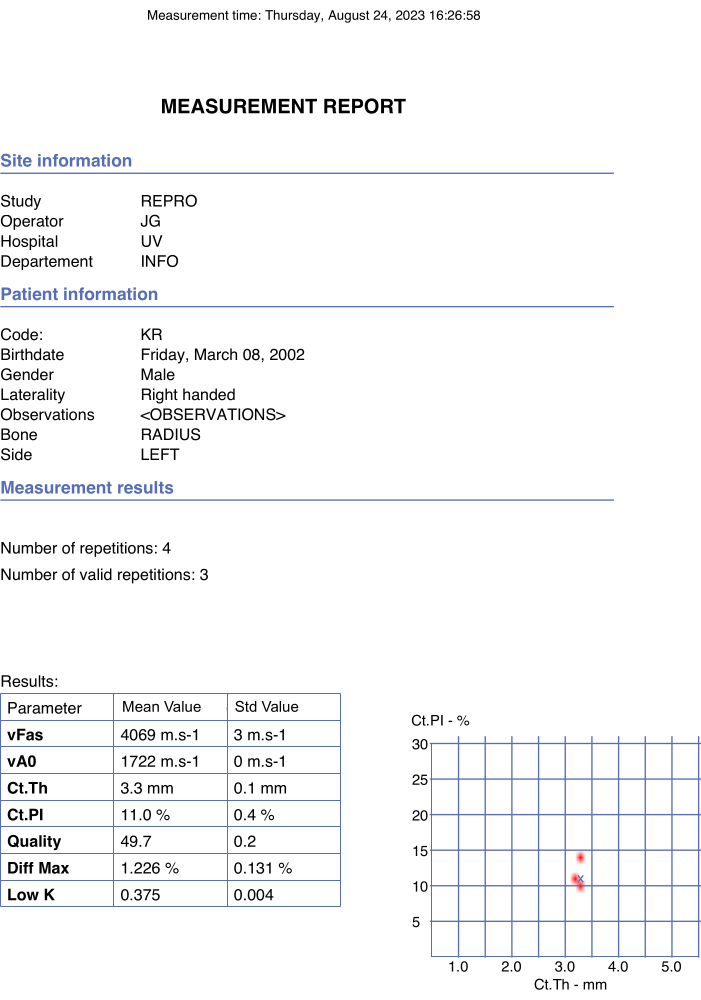
図 4: 自動レポートの例。 このレポートには、参加者とオペレーターのデータ、および関心のあるパラメーターと品質パラメーターの最終値が示されました。 この図の拡大版を表示するには、ここをクリックしてください。
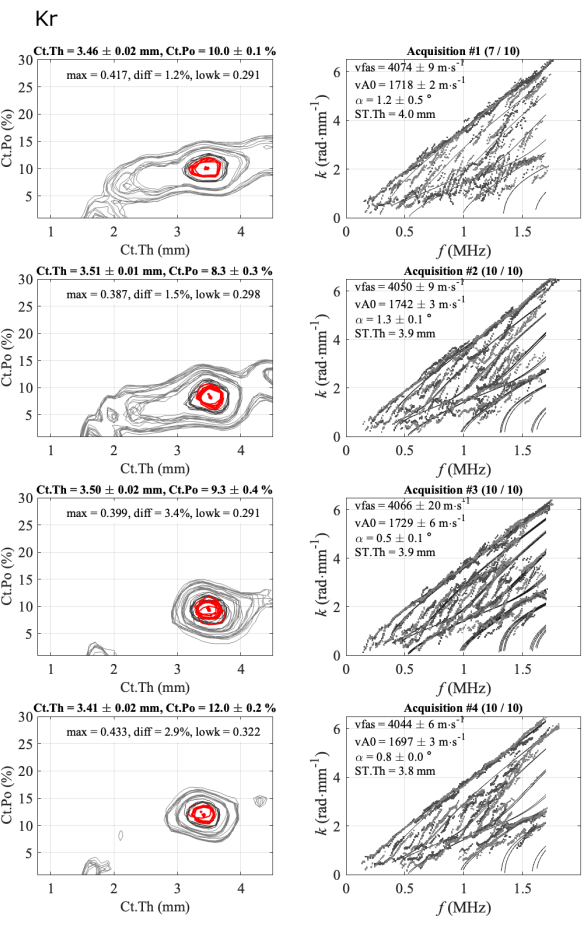
図 5: 一貫性のあるケースの 2 番目のレポートの例 ( 図 4 に示す自動レポートと同じです)。 この図は、1人の参加者と1人のオペレーターの4つのシリーズを示しています:逆問題画像(左の列)と実験的な波数を最適適合モデルと比較(右の列)。表示されている値は、10 個の集録シリーズで保持された集録の平均と標準偏差に対応しています。保持された取得の数は、右側の列のタイトルに示されます (たとえば、最初のシリーズの場合は (7/10)。 この図の拡大版を表示するには、ここをクリックしてください。
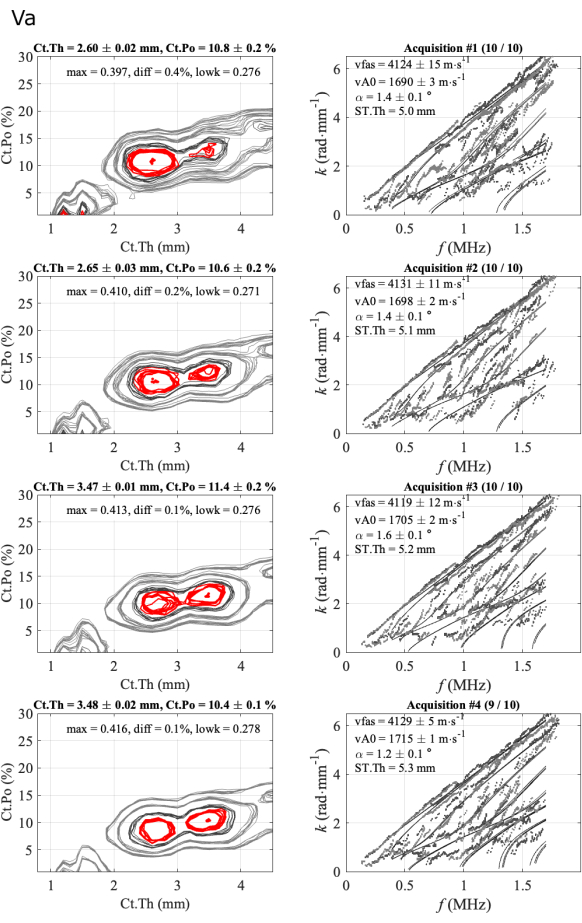
図6:皮質の厚さが曖昧な場合の2番目のレポートの例。 この図は、1人の参加者と1人のオペレーターの4つのシリーズを示しています:逆問題画像(左の列)と実験的な波数を最適適合モデルと比較(右の列)。表示されている値は、10 個の集録シリーズで保持された集録の平均と標準偏差に対応しています。保持された取得の数は、右側の列のタイトルに示されます (たとえば、最初のシリーズの場合は (10/10) )。 この図の拡大版を表示するには、ここをクリックしてください。
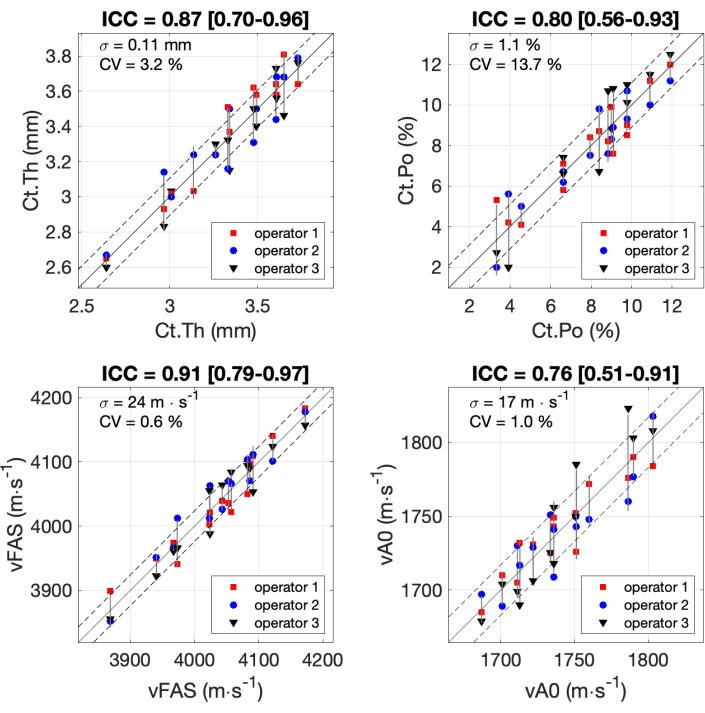
図7:オペレーター間の信頼性。 結果は、14人の参加者を持つ3人のオペレーターによって得られた関心のある4つのパラメータについて示されています。3つの演算子(y軸)によって得られた値は、3つの演算子(x軸)の平均値と比較されます。クラス内相関係数(ICC)はタイトルに示されています。標準偏差σと変動係数CVも示しています。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
測定を成功させるための重要なポイントは、骨に対するプローブの正しい位置です。骨表面に対する位置は、双方向補正16,17をガイドインターフェースと統合することによって首尾よく解決された。この修正を行わないと、vFASパラメータ16について数パーセントの誤差に達する可能性があることが示されました。この補正は、全測定範囲(約3800-4200 m・s-1)が平均値17の約10%、約4000 m・s-1であるため、患者間を正確に識別するために重要であることがわかった。本研究で得られた再現性(標準偏差24m・s-1)は、前回研究17と同様であり、標準偏差20m・s-1、変動係数(CV)が約0.5%であった。同様の変動係数(0.5%)が、より低い周波数、すなわち0.3MHz40で見出された。vFASパラメータ(ICC = 0.91)の優れた信頼性は、高齢者集団の別のATデバイスで最近得られたもの(ICC = 0.77)よりも高いことがわかったことに注意してください41。この場合の人口は、高齢であるだけでなく、すべての女性と、骨多孔性の増加の他の臨床的徴候を持つ一部の被験者もいたことに注意する必要があります41。
2つ目の課題は、ガイドモード、特に高位相速度または低波数のモードを得るために、プローブを骨軸と2つのインターフェースに対して正しく配置することです。これらのモードは共振に近く、複数の反射パスに関連付けられています。アライメントが正しくない場合、波はプローブの空間測定範囲外に散乱します。それどころか、プローブが正しく配置されている場合、これらの高位相速度モードはROI3に連続した分岐として表示されます。現在のHMIの最初のバージョンでは、このアライメントはリアルタイムのGWSI20を見ることで解決されました。しかし、このアプローチは確固たる測定に達するには不十分であることが判明しました:失敗率はパイロット臨床研究で約20%であることがわかりました20。リアルタイムの品質パラメータを含めることで、2回目の臨床試験で失敗を約10%に減少させることができます23。次に、逆問題画像を「リアルタイム」HMIに含めることで、半径測定の電流故障率が約5%25になり、さらなる改善が可能になります。vFAS のみを測定する最初のデバイスでの初期障害は約 15% であることが判明したことに注意してください17。
皮質の厚さに関する信頼性は、以前の研究と類似していることがわかりました22。同じプロトタイプの以前のバージョンでも、ICCは0.9に近く、標準偏差は約0.1mm、CVは約3%であることがわかりました。しかし、皮質の多孔性には明らかな改善が観察されます:ICCは0.622 から0.8に増加し、標準偏差は1.5%から1%に減少しました。最も難しいパラメータはvA0であり、彼の速度が軟組織の速度、約1500m・s-1と近接しているためです。プローブが正しく位置合わせされている場合、A0モードは一意で連続的に見えます。それどころか、周囲の軟組織との結合により、不連続および/または複数に見えます。この効果は、軟部組織の厚さが小さい(4 mm未満)または大きい(10 mm以上)人(ST.Th と表記)に特に強いです。
前に説明したように、重要なポイントは正しいプローブ位置を見つけることです。ただし、一連の10回の集録の平均と標準偏差を実行するためには、位置が正しいだけでなく、安定している必要があります。ほとんどの場合、厩舎を見つけるのに1分もかからず、患者の完全な測定は約5分続きます。この研究で説明されている標準的なプロトコルが大多数の患者に適している場合でも、一部の人々は測定がより困難です。正しい位置を見つけるのは難しいですが、安定した位置を見つけることはほとんど不可能です。この場合、オペレーターは、最大 200 件の集録を含む、より長いシリーズの記録を選択できます。最良の取得は、後で品質パラメータを使用してオフラインで決定されます。このフィルタリングは、将来的にはリアルタイムで適用する必要があります。実際には、オペレーターは、理想的な条件プロトコルの10回の集録のうち4つのシリーズよりも多くのシリーズおよび/または集録を記録します。ただし、通常の測定時間は、前腕または脚の1つの部位で約5分のままです。数分後、HMIが正しい位置を検出しない場合、測定は停止し、失敗と見なされます。現在のデバイスとプロトコルでは、故障率は 5% 未満であることがわかりました25。
現在のデバイスには、さまざまな制限があります。
(イ)サイズと重量:現在のBDATデバイスはポータブルです:標準の荷物に収まり、重量は約25kgです。しかし、この重量は最新の超音波装置に比べて大きいです。プローブと信号処理は同じままで、新しい電子設計が検討される場合があります。ただし、特にベッドにいる患者や移動が制限されている自宅では、現在のデバイスを動かすことは可能です。
(ii)集録速度:現在のフレームレートは約2〜4 Hzで、実際のリアルタイム集録に比べて計測の探索が遅く、つまり25 Hz以上になります。これは、コンピューターの高速化、データ分析の高速化、電子機器とコンピューター間の伝送を考慮して、将来改善される可能性があります。取得速度が速くなると、測定の使いやすさ、特にプローブの正しい位置決めの検索が向上します。
(3)軟組織の厚さ:現在のアプローチは、通常10mmよりも優れた大きな軟組織層によって制限されています。この場合、最初に到着する信号は、皮質骨ではなく軟部組織の経路にリンクされています。したがって、vFAS および関連する双方向角度は使用できません。同様に、vA0は大きな軟組織層の測定が非常に困難です。これら 2 つの速度がないと、逆の問題は実行できません。将来的には、例えばイメージング技術を使用して、他の双方向補正方法を適用することができます。軟部組織層が大きい患者は、通常、肥満とボディマス指数(BMI)が30kg.m-2を超えています。
(4)導波路の規則性: 逆問題アプローチでは、複数の伝搬経路を持つ規則的な導波路を想定しています。骨粗鬆症の患者の場合、内部皮質界面は不規則である可能性があるため、特に下部のガイド波スペクトル画像が不十分であることを意味します。これらの患者は通常、高い解決策のあいまいさに関連しています。軟部組織または不適切な位置決めが不良スペクトル画像の起源と見なすことができず、lowkパラメータ値が低い場合、導波路はおそらく不規則であり、最も低い厚さのソリューションが考慮されます。物理モデリングを必要としない機械学習に基づくアプローチも使用できます29。
冒頭で述べたように、脆弱性骨折のリスクがある患者の検出に関する現在のゴールドスタンダードはDXAであり、その大きなサイズ、一部の地域での利用可能性の低さ、比較的高いコスト、比較的中程度の有効性など、いくつかの制限に直面しています。最初の制限は、その魅力的な携帯性とコストで知られる超音波装置で軽減できます。ただし、リスクのある患者を効果的に検出する能力は、少なくともDXAと同等である必要があります。実際には、ゴールドスタンダードに関連するほとんどの参照(医学的決定、治療、費用、部屋など)の適応を正当化するために、DXAよりも高いと予想される場合があります。そのため、一部の超音波装置はaBMD代理10,11,42を提案しています。ただし、aBMDやvFASなどの臨床パラメータの1つの欠点は、さまざまな皮質骨特性の統合です。そのため、BDATを含む他の超音波装置によって補完的な視点が提案され、皮質の多孔性、厚さ、または細孔径分布9など、医師と患者により容易に解釈できるパラメータが提案されています。これらのパラメータは幾何学的および材料的特性を反映しており、皮質骨は量または質の独立した変動の観点から評価できる可能性があります。この視点は、骨の脆弱性のさまざまな考えられる原因を探るのに非常に役立つ可能性があります。例えば、股関節内または被膜外の股関節の脆弱性骨折、すなわち大腿骨頸部または転子骨折部位は、異なる医学的起源を持つと想定されている43。同様に、皮質骨に対するさまざまな効果、および量または質の点で、さまざまな薬に従うことが可能かもしれません3。
皮質の厚さ(0.1mm)のBDATで得られる精度は、他の超音波法よりも優れており、通常は0.25mmを超える44であることに注意してください。この違いは、BDAT逆問題が幾何学的変動と材料的変動の組み合わせを考慮に入れることに一部起因しています。パルスエコーなどの他のいくつかのアプローチでは、すべての患者10,44に固有の骨材料特性が考慮されます。この精度値は約0.1mm(CV約3%)で、厚さの範囲が2mm未満であるため、患者を細かく区別するために非常に重要です。皮質の多孔性の精度(1%、CV約14%)は、厚さほど良くありません。しかし、以前の再現性研究22に関して、すでに有意な改善が観察されている。近い将来、HMIの改善、特にリアルタイムに近いフレームレートの向上により、同様の改善が達成される可能性があると期待できます。
BDATは、DXAが広く利用できない地域での人口スクリーニングに大規模に使用できる可能性があります。さらに、最新の臨床結果では、BDATがDXAよりもさらに効率的である可能性が示されました。ただし、これらの結果は、より多くの患者を含めることによって確認する必要があります。次の課題は、多施設共同研究および/または縦断的研究であるべきである11,12。しかし、BDATデバイスは、すでにドイツ23と英国24で行われているように、科学協力のためのプロトタイプです。次世代のBDATデバイスの産業化に向けた努力が必要であり、それは確実により速く、よりポータブルになるでしょう。
開示事項
著者は利益相反を宣言していません。
謝辞
この研究は、チリのプロジェクトANID / Fondecyt / Regular 1201311および1241091によって資金提供されました。著者は、最新のHMI改善中にサポートしてくれた企業BleuSolidと、撮影室を提供してくれたGeropolisに感謝したいと思います。
資料
| Name | Company | Catalog Number | Comments |
| Computer | Notebook HP | mod Zbook (16 Go RAM, Inrel Core i7) | to receive the sampled signals and applying the signal processing steps. Results are displayed in quasi real time (up to 4 per second) through a dedicated Human Machine Interface (HMI, BleuSolid, Pomponne, France) allowing the measurement guidance; |
| Electric insulation transformer | REOMED, Solingen, Germany | IEC / EN 60601-1 | to protect the device, the patient and other devices from any electric hazard |
| Electronic module | Althaïs, Tours, France | in-house | send excitation signals (half a period of negative voltage of 170 V) and discretize received signals (1024 time points per receiver at 20 MHz sampling frequency and 12 bit dynamic) before sending them to the computer. Delays and amplification can be adapted using linear laws in order to optimize data sampling within the accessible ranges. |
| Human Machine Interface | BleuSolid, Pomponne, France | N/A | HMI |
| Pedal switch | Scythe, Germany | USB Foot Switch 2 | to start an acquisition series |
| Ruler | Westcott, USA | 10417 | to locate the measurement site |
| Ultrasonic probe radius | Vermon, Tours, France | in-house | 1 MHz central frequency, 24 receivers with 0.8 mm pitch and two blocks of 5 transmitters with 1 mm pitch. |
| Ultrasonic probe tibia | Vermon, Tours, France | in-house | 0.5 MHz central frequency, 24 receivers with 1.2 mm pitch and two block of 5 transmitters with 1.5 mm pitch |
| Ultrasonic probes | designed according to the bidirectional geometry: a single receiver array surrounded by two transmitter arrays. The three arrays are aligned, mechanically and electrically isolated in order to minimize coupling signals. The probes are adapted to two different sites, one third distal radius and mid tibia. |
参考文献
- Curtis, E. M., Moon, R. J., Harvey, N. C., Cooper, C. Reprint of: the impact of fragility fracture and approaches to osteoporosis risk assessment worldwide. Int J Orthop Trauma Nurs. 26, 7-17 (2017).
- Sing, C. W., et al. Global epidemiology of hip fractures: secular trends in incidence rate, post-fracture treatment, and all-cause mortality. J Bone Miner Res. 38 (8), 1064-1075 (2023).
- Choksi, P., Jepsen, K. J., Clines, G. A. The challenges of diagnosing osteoporosis and the limitations of currently available tools. Clin Diabetes Endocrinol. 4, 1-13 (2018).
- El Maghraoui, A., Roux, C. DXA scanning in clinical practice. QJM. 101 (8), 605-617 (2008).
- Maeda, S. S., et al. Challenges and opportunities for quality densitometry in Latin America. Arch Osteoporos. 16, 1-11 (2021).
- Surowiec, R. K., Does, M. D., Nyman, J. S. In vivo assessment of bone quality without x-rays. Curr Osteoporos Rep. 22 (1), 56-68 (2024).
- Whittier, D. E., et al. A fracture risk assessment tool for high resolution peripheral quantitative computed tomography. J Bone Miner Res. 38 (9), 1234-1244 (2023).
- Nyman, J. S., et al. Toward the use of MRI measurements of bound and pore water in fracture risk assessment. Bone. 176, 116863(2023).
- Armbrecht, G., Nguyen Minh, H., Massmann, J., Raum, K. Pore size distribution and frequency-dependent attenuation in human cortical tibia bone discriminate fragility fractures in postmenopausal women with low bone mineral density. J Bone Miner Res Plus. 5 (11), e10536(2021).
- Behrens, M., et al. The Bindex® ultrasound device: reliability of cortical bone thickness measures and their relationship to regional bone mineral density. Physiol Meas. 37 (9), 1528-1540 (2016).
- Cortet, B., et al. Radiofrequency echographic multi-spectrometry (REMS) for the diagnosis of osteoporosis in a European multicenter clinical context. Bone. 143, 115786(2021).
- Olszynski, W. P., et al. Multisite quantitative ultrasound for the prediction of fractures over 5 years of follow-up the Canadian Multicentre Osteoporosis Study. J Bone Miner Res. 28 (9), 2027-2034 (2013).
- Hans, D., Métrailler, A., Gonzalez Rodriguez, E., Lamy, O., Shevroja, E. Quantitative ultrasound (QUS) in the management of osteoporosis and assessment of fracture risk: an update. Adv Exp Med Biol. 1364, 7-34 (2022).
- Weiss, M., Ben-Shlomo, A., Hagag, P., Ish-Shalom, S. Discrimination of proximal hip fracture by quantitative ultrasound measurement at the radius. Osteoporos Int. 11 (5), 411-416 (2000).
- Moilanen, P., et al. Discrimination of fractures by low-frequency axial transmission ultrasound in postmenopausal females. Osteoporos Int. 24, 723-730 (2013).
- Bossy, E., Talmant, M., Defontaine, M., Patat, F., Laugier, P. Bidirectional axial transmission can improve accuracy and precision of ultrasonic velocity measurement in cortical bone: a validation on test materials. IEEE Trans Ultrason Ferroelectr Freq Control. 51 (1), 71-79 (2004).
- Talmant, M., et al. In vivo performance evaluation of bi-directional ultrasonic axial transmission for cortical bone assessment. Ultrasound Med Biol. 35 (6), 912-919 (2009).
- Mitra, M., Gopalakrishnan, S. Guided wave based structural health monitoring: A review. Smart Mater Struct. 25, 053001(2016).
- Minonzio, J. G., Talmant, M., Laugier, P. Guided wave phase velocity measurement using multi-emitter and multi-receiver arrays in the axial transmission configuration. J Acoust Soc Am. 127 (5), 2913-2919 (2010).
- Minonzio, J. G., et al. cortical thickness and porosity assessment using ultrasound guided waves: An ex vivo validation. Bone. 116, 111-119 (2018).
- Vallet, Q., Bochud, N., Chappard, C., Laugier, P., Minonzio, J. G. In vivo characterization of cortical bone using guided waves measured by axial transmission. IEEE Trans Ultrason Ferroelectr Freq Control. 63 (9), 1361-1371 (2016).
- Minonzio, J. G., et al. Ultrasound-based estimates of cortical bone thickness and porosity are associated with nontraumatic fractures in postmenopausal women: a pilot study. J Bone Miner Res. 34 (9), 1585-1596 (2019).
- Minonzio, J. G., et al. Bi-directional axial transmission measurements applied in a clinical environment. PLoS One. 17 (12), e0277831(2022).
- Behforootan, S., et al. Can guided wave ultrasound predict bone mechanical properties at the femoral neck in patients undergoing hip arthroplasty. J Mech Behav Biomed Mater. 136, 105468(2022).
- Rojo, F., et al. Classification of hip fragility fractures in older adults using an ultrasonic device. , IEEE International Ultrasonics Symposium (IUS). Montreal, QC, Canada. (2023).
- Ishimoto, T., et al. Quantitative ultrasound (QUS) axial transmission method reflects anisotropy in micro-arrangement of apatite crystallites in human long bones: A study with 3-MHz-frequency ultrasound. Bone. 127, 82-90 (2019).
- Minonzio, J. G., Foiret, J., Talmant, M., Laugier, P. Impact of attenuation on guided mode wavenumber measurement in axial transmission on bone mimicking plates. J Acoust Soc Am. 130 (6), 3574-3582 (2011).
- Moreau, L., Minonzio, J. G., Talmant, M., Laugier, P. Measuring the wavenumber of guided modes in waveguides with linearly varying thickness. J Acoust Soc Am. 135 (5), 2614-2624 (2014).
- Miranda, D., Olivares, R., Munoz, R., Minonzio, J. G. Improvement of patient classification using feature selection applied to bidirectional axial transmission. IEEE Trans Ultrason Ferroelectr Freq Control. 69 (9), 2663-2671 (2022).
- Foiret, J., Minonzio, J. G., Chappard, C., Talmant, M., Laugier, P. Combined estimation of thickness and velocities using ultrasound guided waves: A pioneering study on in vitro cortical bone samples. IEEE Trans Ultrason Ferroelectr Freq Control. 61 (9), 1478-1488 (2014).
- Granke, M., et al. Change in porosity is the major determinant of the variation of cortical bone elasticity at the millimeter scale in aged women. Bone. 49 (5), 1020-1026 (2011).
- Bochud, N., Vallet, Q., Minonzio, J. G., Laugier, P. Predicting bone strength with ultrasonic guided waves. Sci Rep. 7 (1), 43628(2017).
- Schneider, J., et al. Ex vivo cortical porosity and thickness predictions at the tibia using full-spectrum ultrasonic guided-wave analysis. Arch Osteoporos. 14, 1-11 (2019).
- Ramiandrisoa, D., Fernandez, S., Chappard, C., Cohen-Solal, M., Minonzio, J. G. In vivo estimation of cortical thickness and porosity by axial transmission: Comparison with high resolution computed tomography. , 2018 IEEE International Ultrasonics Symposium (IUS). Kobe, Japan. (2018).
- Schneider, J., et al. In vivo measurements of cortical thickness and porosity at the proximal third of the tibia using guided waves: Comparison with site-matched peripheral quantitative computed tomography and distal high-resolution peripheral quantitative computed tomography. Ultrasound Med Biol. 45 (5), 1234-1242 (2019).
- Araya, C., et al. Real time waveguide parameter estimation using sparse multimode disperse radon transform. IEEE UFFC Latin America Ultrasonics Symposium (LAUS. , Gainesville, FL, USA. (2021).
- Bobak, C. A., Barr, P. J., O'Malley, A. J. Estimation of an inter-rater intra-class correlation coefficient that overcomes common assumption violations in the assessment of health measurement scales. BMC Med Res Methodol. 18 (1), 93(2018).
- Shrout, P. E., Fleiss, J. L. Intraclass correlations: uses in assessing rater reliability. Psychol Bull. 86 (2), 420(1979).
- Zoeller, T. Intraclass correlation coefficient with confidence intervals. , At https://www.mathworks.com/matlabcentral/fileexchange/26885-intraclass-correlation-coefficient-with-confidence-intervals (2010).
- Kilappa, V., et al. Low-frequency axial ultrasound velocity correlates with bone mineral density and cortical thickness in the radius and tibia in pre- and postmenopausal women. Osteoporos Int. 22, 1103-1113 (2011).
- Watson, C. J., de Ruig, M. J., Saunders, K. T. Intrarater and interrater reliability of quantitative ultrasound speed of sound by trained raters at the distal radius in postmenopausal women. J Geriatr Phys Ther. 47 (4), E159-E166 (2024).
- Stein, E. M., et al. Clinical assessment of the 1/3 radius using a new desktop ultrasonic bone densitometer. Ultrasound Med Biol. 39 (3), 388-395 (2013).
- Dinamarca-Montecinos, J. L., Prados-Olleta, N., Rubio-Herrera, R., Del Pino, A. C. S., Carrasco-Buvinic, A. Intra-and extracapsular hip fractures in the elderly: Two different pathologies. Rev Esp Cir Ortop Traumatol. 59 (4), 227-237 (2015).
- Karjalainen, J., Riekkinen, O., Toyras, J., Kroger, H., Jurvelin, J. Ultrasonic assessment of cortical bone thickness in vitro and in vivo. IEEE Trans Ultrason Ferroelectr Freq Control. 55 (10), 2191-2197 (2008).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved