Method Article
Beurteilung des kortikalen Knochens mit ultraschallgeführten Wellen: Eine Reproduzierbarkeitsstudie in einer gesunden Population
In diesem Artikel
Zusammenfassung
Hier stellen wir das Messprotokoll des Ultraschallgeräts mit bidirektionaler Axialübertragung (BDAT) im Detail vor und testen es in einer Reproduzierbarkeitsstudie unter Berücksichtigung von 14 gesunden Teilnehmern und 3 Bedienern. Die Reliabilität, gemessen mit den Intraklassen-Korrelationskoeffizienten (ICC), war für vier interessante Parameter gut bis ausgezeichnet.
Zusammenfassung
Fragilitätsfrakturen sind im Zusammenhang mit der Alterung der Bevölkerung immer noch eine weltweite Gesundheitsbelastung. Insbesondere wird erwartet, dass sich die weltweite Zahl der Hüftfrakturen zwischen 2020 und 2050 verdoppeln wird. Daher ist es wichtig, Patienten mit einem Risiko für Fragilitätsfrakturen auf Populationsebene zu erkennen. Der derzeitige goldene Standard ist die duale Röntgen-Absorptiometrie (DXA), die die flächenhafte Knochenmineraldichte (aBMD) liefert. Ultraschallgeräte, in der Regel tragbarer und billiger als Röntgengeräte, stellen interessante DXA-Alternativen als Screening-Werkzeuge dar. Die Bedienerabhängigkeit wird jedoch in der Regel als Hauptnachteil erkannt. In dieser Studie wird das Messprotokoll des Ultraschallgeräts mit bidirektionaler axialer Transmission (BDAT) im Detail vorgestellt. Die spezielle Ultraschallsonde wird mit herkömmlichem Kopplungsgel in einem Drittel des distalen Radius des nicht-dominanten Unterarms platziert. Die geführte Schnittstelle liefert in Quasi-Echtzeit (ca. 2 Hz) vier interessante Parameter: die Geschwindigkeiten des ersten ankommenden Signals (vFAS) und des A0-Modus (vA0), die kortikale Dicke (Ct.Th) und die Porosität (Ct.Po) sowie vier Qualitätsparameter. Der Bediener bewegt die Sonde langsam an der Messstelle und beobachtet dabei sorgfältig die Rückmeldung der Schnittstelle, bis er eine stabile Position gefunden und eine Reihe von 10 Erfassungen gestartet hat. Wenn mindestens vier konsistente Reihen erhalten werden, endet die Messung und ein automatischer Bericht wird generiert. Die Messung dauert in der Regel ca. 5 Minuten. Um die Robustheit dieses Protokolls zu bestimmen, wurde eine Reproduzierbarkeitsstudie mit 3 Bedienern (einem Experten und zwei Anfängern) und 14 gesunden Teilnehmern (6 Frauen, 8 Männer, 21-53 Jahre alt) durchgeführt. Die Intraklassen-Korrelationskoeffizienten (ICC) wurden für vA0 (0,76), Ct.Po (0,80) oder für Ct.Th (0,87) und vFAS (0,91) als ausgezeichnet befunden. Es wurde festgestellt, dass die Standardabweichungen weniger als 10 % der Gesamtbereiche in der klinischen Praxis betragen.
Einleitung
Osteoporose und die damit verbundenen Fragilitätsfrakturen stellen nach wie vor ein großes Problem für die öffentliche Gesundheitdar 1. Insbesondere wird erwartet, dass sich die weltweite Zahl der Hüftfrakturen bis 2050 verdoppelnwird 2. Knochenbrüchigkeit ist auf einen langsamen und stillen Prozess der Demineralisierung und des Knochenverlusts ohne größere Warnzeichen vor dem Fragilitätsfrakturereignis zurückzuführen. Der derzeitige Goldstandard zur Erkennung von Patienten mit einem Risiko für Fragilitätsfrakturen ist die duale Röntgenabsorptiometrie (DXA), die ein 2D-Röntgenbild mit niedriger Auflösung und einem kalibrierten grauen Pixel3 liefert. Aus diesem Bild ist es möglich, die Flächenknochenmineraldichte (aBMD in g.cm-2) an verschiedenen interessierenden Regionen zu extrahieren, die mit den Hauptstellen der Fragilitätsfrakturen verbunden sind: Wirbelsäule, Handgelenk und Hüfte. Der aBMD-Wert nimmt ab, wenn die Frakturrate der Fragilitätzunimmt 3. Darüber hinaus ermöglicht die T-Score-Normalisierung in Bezug auf eine normale gesunde Population den Vergleich von Patienten, die mit Geräten verschiedener Hersteller gemessen wurden. Der DXA-T-Score wurde von der Weltgesundheitsorganisation vorgeschlagen, um die Osteoporosediagnostik in drei Stufen zu definieren: normal (T-Score < -1), osteopenisch (-1 < T-Score < -2,5) und osteoporotisch (T-Score < -2,5)4.
DXA weist mehrere Einschränkungen auf: Seine Größe, die relativ hohen Kosten, der Bedarf an einem eigenen Raum und seine Fähigkeit, zwischen gebrochenen und nicht fragmentierten zu unterscheiden, sowie seine Verfügbarkeit in zahlreichen Ländern, wie z. B. in Lateinamerika, sind beide moderat5. Daher besteht ein Bedarf an DXA-Alternativen als Screening-Instrumente für die Risikoabschätzung von Fragilitätsfrakturen6. Einige DXA-Alternativen, wie z. B. die quantitative Computertomographie und ihre Derivate7, die Magnetresonanztomographie (MRT)8, sind jedoch ebenfalls sperrig und nicht weit verbreitet. Quantitativer Ultraschall (QUS) stellt das Potenzial für tragbare, robuste und einfach zu bedienende Screening-Geräte dar. Es wurden verschiedene Geräte für die Beurteilung des kortikalen Knochens entwickelt, die mit unterschiedlichen Frequenzen von wenigen kHz bis zu einigen MHz und unterschiedlichen Schallkopfpositionierungen in der Transmission, Retrodiffusion9, Impulsecho10 und axialen Übertragung verbunden sind, wobei die Schallköpfe mit der Achse eines langen Knochens wie Radius und Tibia ausgerichtet sind. Einige Bauelemente weisen aBMD-Surrogate11 auf, während andere "klassische" Ultraschallparameter wie Geschwindigkeiten12 oder Dämpfungskoeffizienten9 und sogar geometrische und Materialparameter, beispielsweise kortikale Dicke, Porosität oder Porengrößenverteilung9, bereitstellen. Bis heute ist es QUS jedoch noch nicht gelungen, in der klinischen Praxis flächendeckend zur Knochenbeurteilung eingesetzt zu werden, was unter anderem auf die fehlende Homogenisierung zwischen den Geräten und die Abhängigkeit des Bedienerszurückzuführen ist 13.
Unter den QUS-Technologien, die als DXA-Alternativen vorgeschlagen werden, hat die axiale Transmission (AT) den Vorteil, dass die Messung am Unterarm durchgeführt werden kann, einer Stelle, die (i) leicht zugänglich ist und (ii) in der Nähe einer der Hauptstellen von Fragilitätsfrakturen, d. h. des Handgelenks, liegt. Der erste vorgeschlagene AT-Parameter hängt von der Ultraschallausbreitungsgeschwindigkeit in der kortikalen Schicht ab, die als Schallgeschwindigkeit (SOS) oder Geschwindigkeit des ersten Ankunftssignals (vFAS) bezeichnet wird, abhängig von der Signalverarbeitung und den Geräten, von denen einige kommerziell sind12,14 und andere Laborprototypen15,16. Dieser Parameter konnte in mehreren klinischen Studien seit Ende der 1990er Jahre zwischen Patientengruppen mit oder ohne Fragilitätsfrakturen mit ähnlichen Leistungen wie bei der BMD unterscheiden14,15. Es wurde auch erfolgreich für multizentrische Längsschnittstudien eingesetzt, was seine klinische Anwendung und Robustheit unter Beweis stellt12. Die vFAS-Präzision wurde durch die Kombination der beiden entgegengesetzten Ausbreitungsrichtungen verbessert, um die Verzerrung aufgrund des Winkels zwischen der Sonde und der Knochenoberfläche16,17 zu reduzieren. Diese Sichtweise wurde als bidirektionale AT (BDAT) bezeichnet.
Auch wenn die vFAS klinisches Interesse gezeigt hat, besteht ihr Hauptnachteil, ähnlich wie bei der BMD, darin, dass sie verschiedene wichtige kortikale Knochenmerkmale wie geometrische und Materialeigenschaften kombiniert, was ihre klinische Interpretation nicht einfach macht. Aus diesem Grund wurde die Sichtweise der geführten Welle vorgeschlagen, da sie aufgrund der feinen Empfindlichkeit der geführten Wellen gegenüber den Wellenleitereigenschaften potenziell ist. Dieser Ansatz sollte Signalverarbeitung, Wellenleitermodellierung und inverse Probleme kombinieren und wird weitgehend in der zerstörungsfreien Prüfung verwendet, z. B. unter Berücksichtigung von metallischen Wellenleitern, wie z. B. Platten oder Rohren18. So wurde seit 2010 Schritt für Schritt ein BDAT-Gerät der zweiten Generation entwickelt, von knochenähnlichen Phantomen19 über die ex vivo-Validierung 20 bis hin zu In-vivo-Messungen 21. Das Gerät wurde erfolgreich in klinischen Studien in Frankreich22, Deutschland23, Großbritannien24 und Chile25 getestet und hat verbesserte Ergebnisse in Bezug auf die Erfolgsrate und die Patientenunterscheidung gezeigt.
Ziel dieser Studie ist es, die Reproduzierbarkeit des aktuellen BDAT-Ultraschallgeräts zu untersuchen. Zunächst werden das Gerät und das Messprotokoll detailliert beschrieben. Die Ergebnisse, die mit 14 Teilnehmern und 3 Operateuren erzielt wurden, werden im Rahmen eines Populationsscreenings zur Erkennung von Patienten mit einem Risiko für Fragilitätsfrakturen vorgestellt und diskutiert.
Messprinzip: Signalverarbeitung, interessierende Parameter und Qualitätsparameter
Das bidirektionale Axialübertragungsgerät (BDAT) besteht aus verschiedenen Teilen, wobei die Hauptteile die Ultraschallsonde, das Elektronikmodul und der Computer sind. Die vollständige Liste ist in der Materialtabelle aufgeführt und in Abbildung 1 dargestellt. Im Folgenden werden die interessierenden Parameter, die Messqualitätsparameter und das Messprotokoll beschrieben.
vFAS
Sobald die abgetasteten Signale vom Computer empfangen werden, werden sie in verschiedenen Schritten verarbeitet. Der erste Schritt besteht in der Signalverarbeitung im Zeitbereich, wobei das FAS unter Verwendung des zuvor beschriebenen Protokolls erfasstwird 16,17. Sobald die Ankunftszeit für jeden Empfänger ermittelt wurde, ist es möglich, die FAS-Geschwindigkeit zu bestimmen, die später als vFAS bezeichnet wird und das harmonische Mittel der Geschwindigkeiten ist, die in beiden Ausbreitungsrichtungen erhalten werden. Durch die Kombination der Informationen aus beiden Ausbreitungsrichtungen ist es möglich, den Wertwinkel zwischen der Sonde und der Knochenoberflächenrichtung zu ermitteln und einen unverzerrten vFAS-Wert16 abzuleiten. Dieser bidirektionale Winkel wird später als Alpha bezeichnet und wird als Parameter für die Messqualität verwendet. Diese zeitliche Verarbeitung ermöglicht auch die Abschätzung der Dicke des Weichgewebes zwischen der Knochenoberfläche und der Sonde, dieST.Th 26 bezeichnet wird.
Geführtes Wellenspektrumbild
Der zweite Schritt besteht in der Signalverarbeitung im Fourier-Bereich unter Berücksichtigung der zeitlichen und räumlichen Frequenzen, die als f und k bezeichnet werden. Bei dem Ansatz handelt es sich um eine SVD-basierte Methode, die die Umwandlung der räumlich-zeitlichen Signale in die Norm-Funktion ermöglicht, die auch als geführtes Wellenspektrumbild (GWSI) bezeichnet wird, wie in Abbildung 2 für einen in vivo Unterarm19 dargestellt. Die Methode kombiniert zwei Fourier-Transformationen (Zeit und Raum) und eine Singulärwertzerlegung (SVD), die es ermöglicht, die Anwesenheitsrate in den empfangenen Signalen (auf einer Skala von 0-1) der Moden zu visualisieren, die von der kortikalen Knochenschicht geleitet werden. Die GWSI kann als eine Erweiterung der räumlich-zeitlichen Fourier-Transformation interpretiert werden, wobei jedes Pixel mit einer unabhängigen Ebene der Frequenz f und der Wellenzahl k assoziiert ist. Es ist zu beachten, dass der Ansatz verbessert wurde, um die Auswirkungen der Materialdämpfung27 und der linearen Dickenvariation28 zu berücksichtigen.
Besonderes Augenmerk wird auf den oberen Teil des Spektrums gelegt, der mit dem A0-Modus verbunden ist, und auch auf den untersten Teil, der mit den höchsten Phasengeschwindigkeitswerten verbunden ist, d.h. größer als 4 mm·μs-1. Dieser Teil entspricht der Region of Interest 3 (ROI 3)29. Als Qualitätsparameter wird auch der Mittelwert von ROI 3 verwendet, der später als lowk bezeichnet wird. Ein großer Wert entspricht einem regulären Wellenleiter, der klare Wellenreflexionen an den Knochengrenzflächen ermöglicht. Wenn der Wert sinkt, könnte dies an einem unregelmäßigen Hohlleiter oder einer falsch platzierten Sonde liegen.
Wellenleiter-Modell
Die geführte Wellendispersion oder die Variation der Phasengeschwindigkeit jeder geführten Mode in Bezug auf die Frequenz hängt sowohl von den Material- als auch von den geometrischen Eigenschaften des Wellenleiters ab. Daher ist es potenziell möglich, diese Eigenschaften mit Hilfe von dedizierter Signalverarbeitung, Wellenleitermodellierung und inversen Problemschemata abzurufen. Im BDAT-Fall entspricht das Wellenleitermodell einer 2D-quer isotropen freien Platte, abhängig vom Wellenleitermaterial und einem geometrischen Parameter, der Dicke30. Das kortikale Knochenmaterial wird unter Berücksichtigung fester Parameter für die Knochenmatrix und variabler Porosität31 homogenisiert. Das inverse Problem hängt also von zwei Parametern ab, die als kortikale Dicke (Ct.Th) und kortikale Porosität (Ct.Po) bezeichnet werden. Die Auswirkungen der Materialabsorption, der Wellenleiterkrümmung und des umgebenden Weichgewebes werden im Modell nicht berücksichtigt, auch wenn sie sich auf die Messung auswirken. Es wurde jedoch nicht festgestellt, dass ihr Gewicht auf das Ergebnis des inversen Problems bestimmend ist, was bedeutet, dass die Moden in den beiden Hauptbereichen von Interesse (A0 und unterster Teil) durch die Krümmung und die Weichteile nicht signifikant verändert werden32.
Inverses Problem
Ursprünglich wurde das inverse Problem in zwei Schritte unterteilt: erstens, Extraktion der experimentellen geführten Wellendispersion, und zweitens, Vergleich mit dem Wellenleitermodell. Diese Sichtweise wurde durch die Beschriftung von Rauschen und Modeneingeschränkt 30,32. Daher wurde ein dedizierter Ansatz vorgeschlagen, um diese Einschränkungen als Erweiterung des Standpunkts der Normfunktion zu überwinden. Anstatt jede ebene Welle unabhängig voneinander zu betrachten, werden nur die möglichen geführten Wellen berücksichtigt, die das Wellenleitermodell liefert20. Dies führt zum inversen Problembild, das im Modellparameterbereich ausgedrückt wird, d.h. in der Ct.th-Ct.Po-Ebene (Abbildung 2 unten rechts). Dem am besten passenden Modell wird die maximale Position gegeben, während eventuelle sekundäre Peaks (gekennzeichnet durch die inversen Problembilder mit einem grauen Punkt) mehrdeutigen Lösungen entsprechen, die im f-k-Vergleich mit experimentellen Moden mit hellgrauen Linien angezeigt werden. Wie zuvor wird der Pixelwert konstruktionsbedingt normalisiert und spiegelt in diesem Fall das Vorhandensein eines bestimmten Wellenleitermodells in den empfangenen Signalen wider. Der Maximalwert (als Max) und die Differenz zum zweiten Maximum (als Diff) werden ebenfalls als Qualitätsparameter verwendet.
Das inverse Problem wurde ursprünglich für die Offline-Berechnung vorgeschlagen, d.h. sobald die Signale erfasst sind, unter Verwendung der genauen Werte der Modellwellennummern. Dieser Ansatz wurde sowohl für Radius- als auch für Tibia-Stellen unter Berücksichtigung von ex vivo20,33 und in vivo 21,34,35 Studien validiert. Um diese Berechnungen in die Mensch-Maschine-Schnittstelle (HMI) einzubeziehen, wurde eine angenäherte Version vorgeschlagen, die mit der Echtzeitanwendung kompatibel ist, wobei ein dünnbesetzter Matrixstandpunkt36 verwendet wird.
vA0
Aus dem GWSI ist es auch möglich, die Geschwindigkeit der langsamsten geführten Mode zu extrahieren, die mit der ersten antisymmetrischen Mode A0 der freien Platte oder des Lamb-Modells33,35 verbunden ist. Der obere Teil des geführten Wellenspektrums kann linear angenähert werden, wobei die Steigung den Wert der Geschwindigkeit vA0 liefert (Abbildung 2 unten links).
Zusammenfassung der Parameter:
Schließlich werden vier interessante Parameter gemessen: (i) vFAS: Geschwindigkeit des ersten ankommenden Signals (m·s-1); ii) vA0: Geschwindigkeit des langsamsten geführten Modus (m·s-1); iii) Ct.Th: Dicke der Rinde (mm); und (iv) Ct.Po: kortikale Porosität (%).
Vier Qualitätsparameter werden berücksichtigt: (i) alpha: bidirektionaler Winkel (°); (ii) lowk: Mittelwert des untersten Teils des GWSI (normierter Wert zwischen 0 und 1); (iii) max: Maximum der inversen Problemfunktion (normalisierter Wert zwischen 0 und 1); und (iv) diff: die Differenz zwischen dem ersten und dem zweiten Maxima der inversen Problemfunktion (normalisierter Wert zwischen 0 und 100).
Alle diese Parameter, sowie auch die beiden geführten Wellenspektrenbilder (eine Par-Ausbreitungsrichtung) und das inverse Problembild, werden vom HMI in "Echtzeit" mit einer Bildrate von ca. 2 Hz angezeigt. Ein typisches Beispiel ist in Abbildung 3 dargestellt. Im folgenden Abschnitt wird die Methode zur Verwendung dieser Parameter ausführlich beschrieben. Die Hauptidee besteht darin, dass der Bediener die Sonde langsam an der Messstelle bewegt und dabei die Rückmeldung der verschiedenen Teile der Schnittstelle sorgfältig beobachtet, bis er eine stabile Position gefunden und eine Reihe von 10 Erfassungen gestartet hat. Wenn mindestens vier konsistente Reihen erhalten werden, endet die Messung und ein automatischer Bericht wird generiert.
Protokoll
Die Studie wurde von der Ethikkommission der Universidad de Valparaiso, Chile, unter der Protokollnummer CEC213-20 genehmigt. Für die Teilnehmer wurde eine schriftliche Einverständniserklärung erteilt. Es wurde ein Telefoninterview durchgeführt, um die Ein-/Exklusion der Teilnehmer festzustellen. Die Studie wurde unter folgender Referenz registriert: NCT05424536.
1. Einrichtung des Geräts
- Legen Sie die Hauptteile des Geräts auf einen großen Tisch.
- Stellen Sie die folgenden Teile nebeneinander: den elektrischen Isolationstransformator, das Elektronikmodul und den Laptop auf einen großen Tisch. Achten Sie darauf, dass vor diesen Teilen ausreichend Platz ist, um den Unterarm des Teilnehmers später problemlos platzieren zu können.
- Stellen Sie den Laptop bei begrenztem Platz schließlich direkt auf das Elektronikmodul und achten Sie darauf, die deutlich gekennzeichneten Lüftungsfenster des Moduls nicht zu blockieren.
- Schließen Sie den elektrischen Isolationstransformator an.
- Schließen Sie den elektrischen Isolationstransformator mit einem speziellen Kabel an die Hausstromversorgung des Raums an.
- Schließen Sie das Elektronikmodul an.
- Verbinden Sie das Elektronikmodul mit einem speziellen Netzkabel mit dem elektrischen Isolationstransformator.
- Drücken Sie die EIN-AUS-Taste am Transformator, um das Modul mit Strom zu versorgen.
- Schließen Sie den Laptop an.
- Verbinden Sie den Laptop-Computer über das dedizierte USB-Kabel (Universal Serial Bus) mit dem Modul, um die digitalisierten empfangenen Signale zur weiteren Verarbeitung an den Computer zu senden.
- Wenn der Laptop mit Strom versorgt werden muss, schließen Sie das Netzkabel an den elektronischen Isolationstransformator an.
- Schließen Sie die Ultraschallsonde an.
- Verbinden Sie die Ultraschallsonde mit dem speziellen Kabelschlitz an der Vorderseite des Moduls mit dem Modul. Es gibt zwei verschiedene Sonden für Unterarm- und Beinmessstellen. In dieser Studie wird nur der Radius (Unterarmsonde) betrachtet.
- Schließen Sie den Pedalschalter an.
- Platzieren Sie den Pedalschalter auf dem Boden in der Nähe der Füße unter Berücksichtigung der Position des Bedieners, während er einen Teilnehmer misst. Verbinden Sie den Pedalschalter über ein USB-Kabel mit dem Computer. Verwenden Sie das Pedal, um die Erfassungsserie zu starten.
2. Installation des Teilnehmers
- Positionieren Sie den Teilnehmer.
- Bitten Sie den Teilnehmer, sich mit dem nackten Unterarm auf den Tisch vor dem zuvor installierten Gerät vor dem Bediener zu setzen (siehe Abbildung 3).
HINWEIS: Es wird die kontralaterale Seite gemessen (d. h. die linke Seite für einen Rechtshänder).
- Bitten Sie den Teilnehmer, sich mit dem nackten Unterarm auf den Tisch vor dem zuvor installierten Gerät vor dem Bediener zu setzen (siehe Abbildung 3).
- Markieren Sie die Messstelle (ein Drittel distaler Radius).
- Messen Sie die Radiuslänge mit dem Lineal vom radialen Griffel (Knochenende in der Nähe des Handgelenks) bis zum Ellbogen.
- Teilen Sie diese Länge durch drei.
- Markieren Sie die Messstelle, d.h. ein Drittel des distalen Radius, mit dem Stift, indem Sie ein Drittel der Radiuslänge vom Handgelenk aus messen.
- Starten Sie die HMI-Software.
- Starten Sie die HMI-Software, indem Sie auf das entsprechende Symbol auf dem Laptop-Desktop klicken.
- Fügen Sie die Daten des Teilnehmers hinzu.
- Fügen Sie die Daten des Teilnehmers (anonymisierte ID, Lateralität, gemessener Standort, Betreiber-ID, Geschlecht usw.) über das Pop-up-Fenster hinzu, das sich beim Start der Software automatisch öffnet.
- Ökologisches Gel hinzufügen.
- Geben Sie ökologisches Gel auf die Vorderseite der Sonde und auf die Messstelle, die auf dem Unterarm des Teilnehmers markiert ist, um die Ausbreitung der Ultraschallwelle zu gewährleisten.
- Bringen Sie die Sonde in Kontakt mit dem Unterarm.
- Bringen Sie die Sonde in Kontakt mit dem Unterarm, wobei die Sondenmitte auf der Markierung platziert wird, die zuvor in Schritt 2.2 durchgeführt wurde.
3. Auf der Suche nach einer stabilen Position
HINWEIS: Das HMI zeigt vier interessante Parameter an: zwei Geschwindigkeiten, vFAS und vA0, und zwei inverse Problemwerte, kortikale Dicke (Ct.Th) und kortikale Porosität (Ct.Po). Das HMI zeigt außerdem vier Qualitätsparameter an, die als alpha, lowk, max und diff bezeichnet werden. Diese Parameter werden in der Einleitung ausführlich beschrieben.
- Starten Sie die Echtzeit-Visualisierung .
- Starten Sie die Echtzeit-Visualisierung , indem Sie auf die Schaltfläche Start rechts unten auf der Softwareoberfläche klicken. Die Dauer zwischen zwei aufeinanderfolgenden Werteanzeigen beträgt ca. 0,5 s.
- Suchen Sie einen stabilen vFAS-Wert.
- Passen Sie die Sondenposition langsam an, während Sie den vFAS-Parameterwert beobachten, der in einem bestimmten Fall der Schnittstelle angezeigt wird. Die Normalwerte reichen von etwa 3800 m∙s-1 bis etwa 4200 m∙s-1.
- Wenn eine stabile Position gefunden wird, stellen Sie sicher, dass die vFAS-Variation zwischen zwei aufeinanderfolgenden Berechnungen weniger als etwa 40 m∙s-1 beträgt.
- Passen Sie den bidirektionalen Winkel an.
- Passen Sie die Sondenposition langsam an, während Sie den bidirektionalen Wert (Qualitätsparameter Alpha) beobachten, der in einem bestimmten Fall der Schnittstelle angezeigt wird.
- Passen Sie die Sondenposition an, indem Sie auf einer Sondenseite sanften Druck ausüben, bis der Absolutwert des Winkels weniger als 2° beträgt, um die Parallelität zwischen der Sonde und der Knochenoberfläche zu verbessern.
- Suchen Sie einen stabilen vA0-Wert.
- Passen Sie die Sondenposition langsam an, während Sie den vA0-Parameterwert beobachten, der in einem bestimmten Fall der Schnittstelle angezeigt wird. Die Normalwerte reichen von etwa 1500 m∙s-1 bis etwa 1900 m∙s-1.
- Wenn eine stabile Position gefunden wird, stellen Sie sicher, dass die vA0-Abweichung zwischen zwei aufeinanderfolgenden Berechnungen weniger als etwa 40 m∙s-1 beträgt.
- Beobachten Sie bei Schwierigkeiten die geführten Wellenbildspektren, die in der rechten Spalte der Benutzeroberfläche angezeigt werden. Stellen Sie sicher, dass der obere Teil des Spektrums als durchgehende Linie angezeigt wird, deren Steigung den vA0-Wert liefert.
- Beobachten Sie das inverse Problembild.
- Beobachten Sie das inverse Problembild, das automatisch angezeigt wird, sobald die beiden Geschwindigkeits- (vFAS und vA0) und Winkelwerte stabilisiert sind.
- Stellen Sie sicher, dass das Bild mindestens ein Maximum zeigt, das mit einem klaren Pixel angezeigt wird, und eventuell ein oder mehrere sekundäre Maxima, die mit einer anderen Farbe gekennzeichnet sind. Die drei fehlenden Qualitätsparameter (max. diff, lowk) werden automatisch in Echtzeit berechnet.
- Verbessern Sie das inverse Problembild.
- Passen Sie die Sondenposition langsam an, während Sie die inversen Problembildmaxima beobachten.
- Finden Sie das höchstmögliche erste Maximum und das niedrigstmögliche sekundäre Maximum, indem Sie sich die entsprechenden Fälle der Schnittstelle (Max- und Diff-Werte) ansehen.
- Beobachten Sie bei Schwierigkeiten das Bild des geführten Wellenspektrums, das in der rechten Spalte der Benutzeroberfläche angezeigt wird. Stellen Sie sicher, dass der untere Teil des Spektrums mit einigen durchgehenden Linien angezeigt wird, die so lang wie möglich sind, verbunden mit Modi mit hoher Phasengeschwindigkeit und der Parameterqualität lowk, so hoch wie möglich.
- Finde eine stabile Position.
- Sobald ein akzeptables inverses Problembild gefunden wurde, stabilisieren Sie die Sondenposition. Stellen Sie sicher, dass zwischen zwei aufeinanderfolgenden Berechnungen keine signifikanten Änderungen des inversen Problembildes zu sehen sind.
4. Datenerfassung
- Starten Sie eine Serie von 10 Akquisitionen.
- Sobald Sie eine stabile Position gefunden haben, starten Sie eine Reihe von 10 Erfassungen, indem Sie den Pedalschalter mit dem Fuß drücken.
- Bleiben Sie während der 10 Erfassungen, die etwa 5 s dauern, so stabil wie möglich.
- Kontrollieren Sie die Qualität der Serie.
- Sehen Sie sich die Mittelwerte und Standardabweichungen der relevanten Parameter an, die automatisch berechnet und in Popup-Fenstern angezeigt werden, die nach dem Ende der Reihe angezeigt werden.
- Wenn die Standardabweichungen niedriger als feste Schwellenwerte sind, wird die Reihe berücksichtigt. Im Gegenteil, lehnen Sie die Serie ab.
- Antwort auf die Frage, die in einem zweiten Pop-up-Fenster gestellt wird, ob der Bediener die Erfassungsserie desselben Teilnehmers stoppen oder fortsetzen möchte.
- Positionieren Sie den Taster neu.
- Beginnen Sie erneut mit den vorherigen Schritten (aus den Schritten 2.1 bis 3.2), um stabilere Positionen zu finden und mehr Serien von 10 Akquisitionen zu erwerben. Lassen Sie den Teilnehmer bei Bedarf zwischen zwei Neupositionierungen ruhen.
- Wie bisher werden Mittelwerte und Standardabweichungen der interessierenden Parameter automatisch für jede Reihe berechnet.
- Schauen Sie sich das Ergebnis-Popup-Fenster an, um zu überprüfen, ob die zuletzt erworbene Serie beibehalten oder abgelehnt wurde. Die Messung des Teilnehmers endet, wenn mindestens vier konsistente Reihen registriert sind. Außenseiter-Serien werden automatisch ausgeschleust.
- Ermitteln Sie die endgültigen Werte.
HINWEIS: Die Endwerte der interessierenden Parameter werden automatisch unter Berücksichtigung des Mittelwerts der Mittelwerte ermittelt, die mit der konsistenten Reihe erhalten wurden. - Überprüfen Sie die PDF-Datei für den automatischen Bericht.
- Stellen Sie sicher, dass die endgültigen Werte automatisch in der PDF-Datei des Berichts gemeldet und sofort generiert werden, sobald die Option Stopp im Popup-Fenster ausgewählt wird. Ein Beispiel ist in Abbildung 4 dargestellt.
HINWEIS: Die PDF-Datei befindet sich im selben Ordner wie die Rohdaten, die später offline erneut analysiert werden können.
- Stellen Sie sicher, dass die endgültigen Werte automatisch in der PDF-Datei des Berichts gemeldet und sofort generiert werden, sobald die Option Stopp im Popup-Fenster ausgewählt wird. Ein Beispiel ist in Abbildung 4 dargestellt.
- Überprüfen Sie den zweiten genauen Bericht.
- Überprüfen Sie den zweiten präzisen Bericht, der mit den exakten Werten des Wellenleitermodells für die Berechnung des inversen Problems erstellt wurde, anstatt mit angenäherten Werten wie im Fall des ersten automatischen Berichts. Die zweite Berichterstellung dauert weniger als 5 Minuten. Beispiele sind in Abbildung 5 und Abbildung 6 dargestellt.
- Stellen Sie sicher, dass der automatische Bericht mit dem genauen Bericht übereinstimmt. Entfernen Sie die Reihen, die nicht automatisch gelöscht wurden, um die konsistenten Reihen beizubehalten.
Ergebnisse
Es wurde eine Reproduzierbarkeitsstudie unter Einbeziehung von 3 Bedienern (ein Experte, zwei Anfänger) und 14 gesunden Teilnehmern (6 Frauen, 8 Männer, 21-53 Jahre) durchgeführt. Anfänger wurden ca. 3 Stunden lang geschult, um das Erfassungsprotokoll zu verstehen und zu üben. Dann wurden die Teilnehmer während 2 Wochen im August 2023 gemessen. Jede Messung wurde unabhängig voneinander durchgeführt. Alle Operatoren waren verblindet, d.h. ein Operator kannte die Ergebnisse der beiden anderen nicht.
Wiederholbarkeit innerhalb des Bedieners
Abbildung 5 veranschaulicht die Wiederholbarkeit innerhalb des Operators für einen konsistenten Fall: 4 Serien von 10 Erfassungen, die auf einem Teilnehmer und einem Operator erfasst wurden. Die erste Spalte entspricht den inversen Problemfunktionen, während die zweite Spalte die experimentelle Dispersion im geführten Modus im Vergleich zum am besten passenden Modell zeigt. Jede Figurenzeile entspricht einer gelungenen Serie. Die Anzahl der einbehaltenen Übernahmen ist im Titel angegeben: 7 von 10 für die erste Serie und 10 von 10 für die folgenden. Für jede Reihe werden Mittelwerte und Standardabweichungen sowie die vier Parameter (vFAS, vA0, Ct.Th und Ct.Po) angegeben. Darüber hinaus werden auch Qualitätsparameter angezeigt: der bidirektionale Winkel (alpha), das Maximum der inversen Problemfunktion (max), die absolute Differenz mit dem zweiten Maximum (diff) und der Mittelwert des untersten Teils des GWSI (lowk).
Die Standardabweichungen innerhalb der Serie sind gering, etwa 0,02 mm für die kortikale Dicke, weniger als 0,5 % für die kortikale Porosität und weniger als 20 m∙s-1 für die beiden Geschwindigkeiten, was darauf hindeutet, dass die Positionen der Reichweitensonde stabil waren. Dann kann man beobachten, dass die für jede Reihe erhaltenen Mittelwerte sehr nahe beieinander liegen, insbesondere für die Dickenwerte zwischen 3,4 mm und 3,5 mm und die vFAS-Werte zwischen 4040 m∙s-1 und 4070 m∙s-1. Beachten Sie, dass eine Differenz von 40 m∙s-1 einer Differenz von 1 % bei einem Mittelwert von 4000 m∙s-1 entspricht. Größere Schwankungen werden für die kortikale Porosität beobachtet, die von 8 % bis 12 % reicht, und die vA0-Geschwindigkeit von 1700 m∙s-1 bis 1740 m∙s-1. In diesem konsistenten Fall sind fast alle Akquisitionen konsistent, d.h. nahe beieinander. Es gibt fast keine Mehrdeutigkeit im Endergebnis der vier interessierenden Parameter.
Ein zweiter Fall ist in Abbildung 6 für einen weniger regelmäßigen Fall dargestellt. In diesem Fall sind drei Parameter, vFAS, vA0 und Ct.Po, mit Werten von etwa 4120 m∙s-1, 1700 m∙s-1 bzw. 10 % sehr stabil. Der Fall der kortikalen Dicke ist schwieriger, da zwei mehrdeutige Lösungen, 2,6 mm und 3,5 mm, in Übereinstimmung mit einem kleinen Differenzwert (Diff weniger als 0,5%) zwischen den beiden ersten Maxima der inversen Problemfunktion beobachtet werden. Im vorherigen regulären Fall lag diese Differenz zwischen 1 % und 3 %. Die Mehrdeutigkeit wird durch eine Expertenanalyse beseitigt, in diesem Fall durch die Betrachtung der Übereinstimmung zwischen experimentellen und theoretischen geführten Modi (rechte Spalte). Bei der geringsten Dicke ist die Übereinstimmung im untersten Teil des Spektrums (zwei erste Reihen) besser. Für die beiden letztgenannten Serien gibt es einen theoretischen Modus mit sehr wenigen experimentellen Punkten, etwa 0,5 MHz, was auf eine schlechtere Übereinstimmung im Vergleich zu den vorherigen Serien hindeutet. Darüber hinaus ist der Diff-Parameter (0,1 %) kleiner als die Werte der beiden ersten Reihen (0,4 % und 0,2 %). In diesem Fall ist die Wahl der aufbewahrten Lösung (2,6 mm) noch nicht automatisiert, und es wird immer noch ein Experte benötigt. Die drei Bediener standen jedoch vor ähnlichen Problemen und wählten ähnliche Lösungen in der Nähe von 2,6 mm.
Zusätzliche Zuverlässigkeit für den Bediener
Alle Ergebnisse für die 4 interessierenden Parameter, die von den 3 Operatoren mit den 14 Teilnehmern erhalten wurden, sind in Abbildung 7 dargestellt. Die Intraklassen-Korrelationskoeffizienten (ICC) wurden nach der Formel und dem zuvor veröffentlichten Matlab-Codeberechnet 37,38,39. ICC wird häufig zur Beurteilung der Zuverlässigkeit von Messgeräten verwendet, insbesondere für biomedizinische Anwendungen. ICC-Werte im Bereich von 0,75 bis 0,9 sind in der Regel mit einer guten Zuverlässigkeit verbunden, während ICC-Werte über 0,9 als sehr zuverlässig gelten. Der niedrigste Wert für ICC (0,76) wurde für den Parameter vA0 ermittelt. Die Standardabweichung betrug 17 m∙s-1, was etwa 7% des Messbereichs in der Größenordnung von 250 m∙s-1 entspricht. Ähnliche Werte wurden für Ct.Po mit einem ICC von 0,80 und einer Standardabweichung von 1,1 %, etwa 10 % des Bereichs, beobachtet. Für die beiden anderen Parameter, Ct.Th und Ct.Po, wurde eine ausgezeichnete Reliabilität (ICC ca. 0,9) mit einer Standardabweichung von weniger als 10 % des Bereichs erreicht.

Abbildung 1: verschiedene Teile des Ultraschallgeräts mit bidirektionaler axialer Übertragung (BDAT). Der Prototyp besteht aus einer elektronischen Isolierung (1), einem Pedalschalter (2), zwei Sonden (3.1 und 3.2), einem Elektronikmodul (4), einem Computer (5) und einem Lineal (6). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
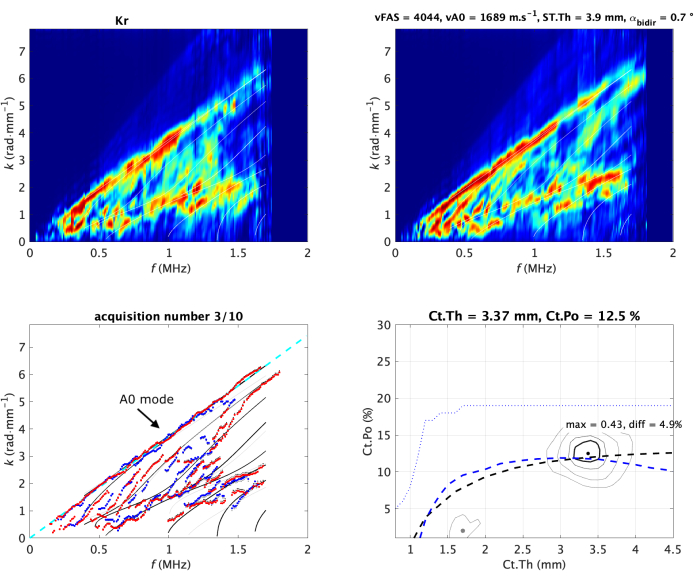
Abbildung 2: Typische Akquisition am in vivo Unterarm. Die beiden Norm-Funktionen (eine pro Ausbreitungsrichtung) sind in der oberen Zeile des Bildes dargestellt. Sie werden auch als Guided Wave Spectrum Image (GWSI) bezeichnet. Aus den Maxima dieser Bilder ist es möglich, die experimentellen geführten Modi (blaue und rote Punkte) im Vergleich zum am besten passenden Modell (unteres linkes Unterbild) zu extrahieren. Das am besten passende Modell wird durch zwei Werte, die kortikale Dicke (Ct.Th) und die Porosität (Ct.Po), parametrisiert, die der maximalen Position der inversen Problemfunktion entsprechen (unteres rechtes Teilbild). Ihre Werte werden im Titel jedes Panels angezeigt. Das vA0-Fitting ist als gestrichelte Linie dargestellt (links). Die Bilder des geführten Wellenspektrums und das inverse Problembild sind durch Konstruktion19,20 normalisiert (d. h. der Pixelwert reicht von 0 bis 1). Die Werte der beiden gemessenen Geschwindigkeiten, vFAS und vA0, sind im Titel des oberen rechten Unterbildes angegeben. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
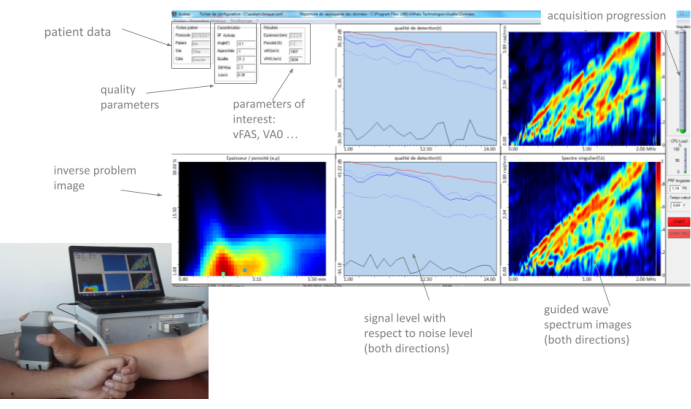
Abbildung 3: Mensch-Maschine-Schnittstelle (HMI). Das HMI zeigt real die beiden GWSIs (einen pro Ausbreitungsrichtung), das inverse Problembild, die interessierenden Parameter und die Qualitätsparameter. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
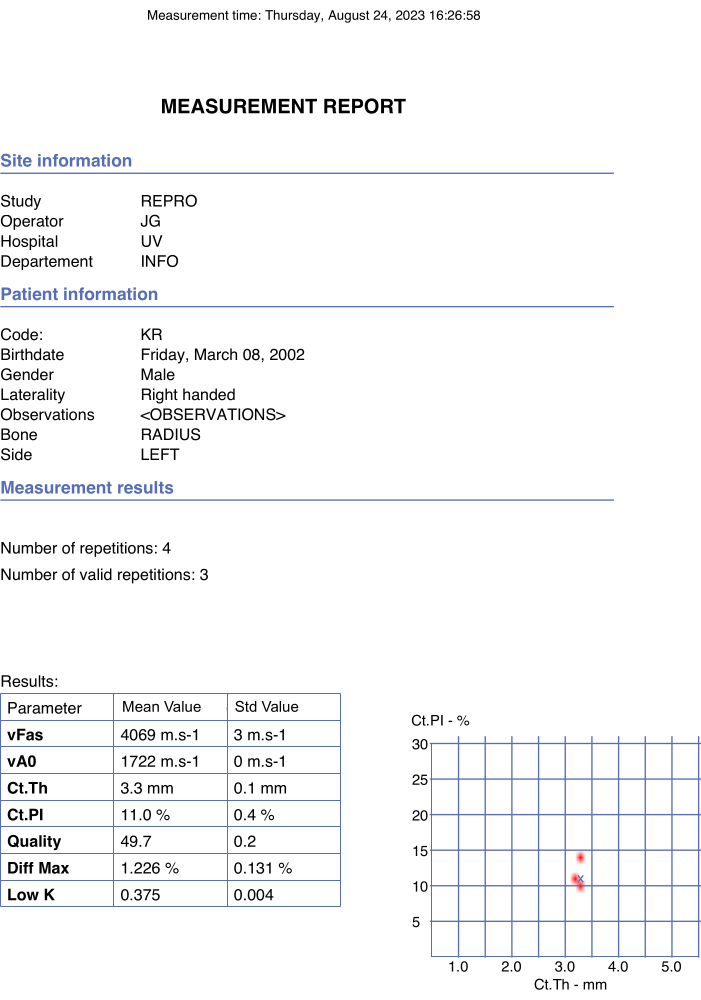
Abbildung 4: Beispiel für einen automatisierten Bericht. Der Bericht enthielt die Daten des Teilnehmers und des Betreibers sowie die Endwerte der interessierenden Parameter und Qualitätsparameter. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
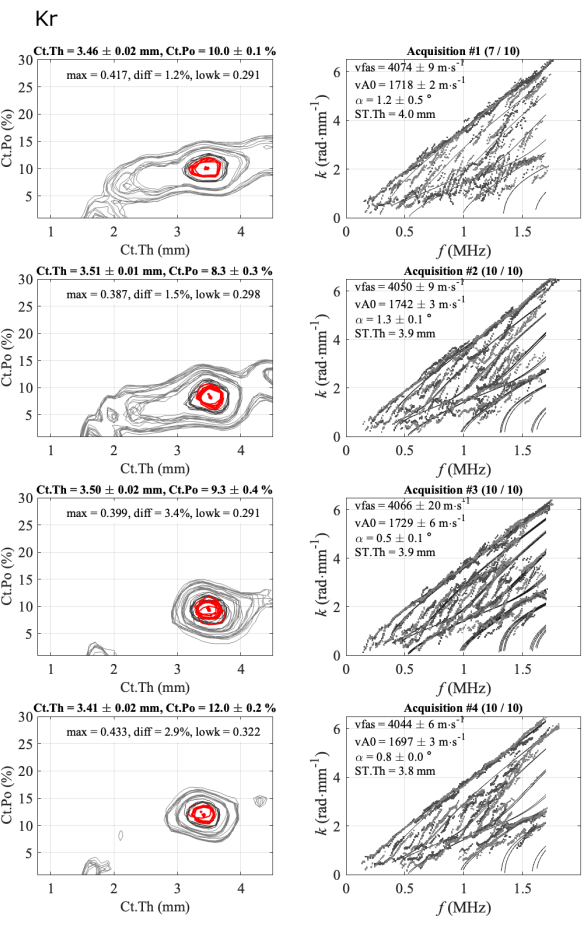
Abbildung 5: Beispiel für den zweiten Bericht für einen konsistenten Fall, identisch mit dem automatisierten Bericht in Abbildung 4. Die Abbildung zeigt 4 Serien mit 1 Teilnehmer und 1 Bediener: inverse Problembilder (linke Spalte) und experimentelle Wellenzahlen im Vergleich zum am besten passenden Modell (rechte Spalte). Die dargestellten Werte entsprechen dem Mittelwert und der Standardabweichung der gehaltenen Erfassungen über die 10er-Reihe. Die Anzahl der aufbewahrten Erwerbungen wird im Titel der rechten Spalte angegeben, z. B. (7/10) für die erste Serie. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
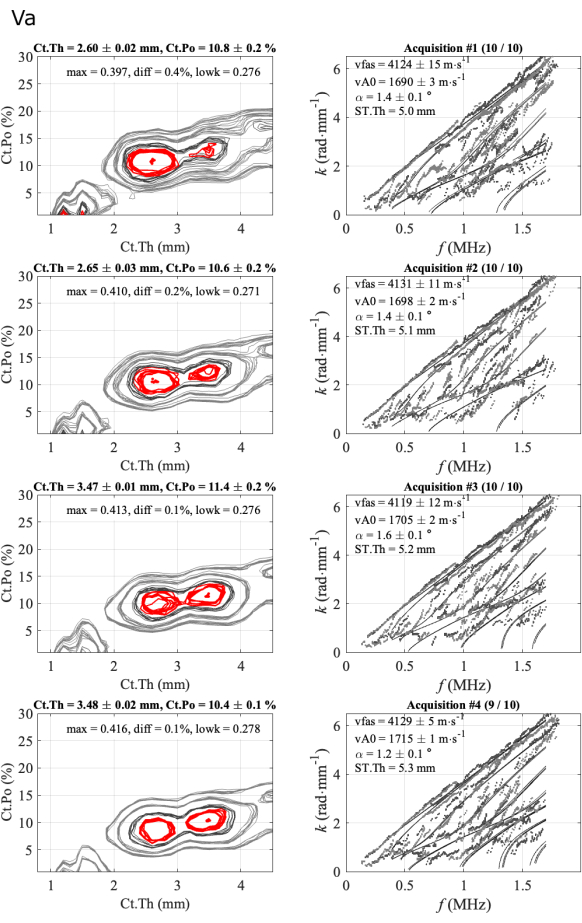
Abbildung 6: Beispiel des zweiten Berichts für einen mehrdeutigen Fall für die kortikale Dicke. Die Abbildung zeigt 4 Serien mit 1 Teilnehmer und 1 Bediener: inverse Problembilder (linke Spalte) und experimentelle Wellenzahlen im Vergleich zum am besten passenden Modell (rechte Spalte). Die dargestellten Werte entsprechen dem Mittelwert und der Standardabweichung über die beibehaltenen Erfassungen über die 10er-Reihe. Die Anzahl der aufbewahrten Erwerbungen wird im Titel der rechten Spalte angegeben, z. B. (10/10) für die erste Serie. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
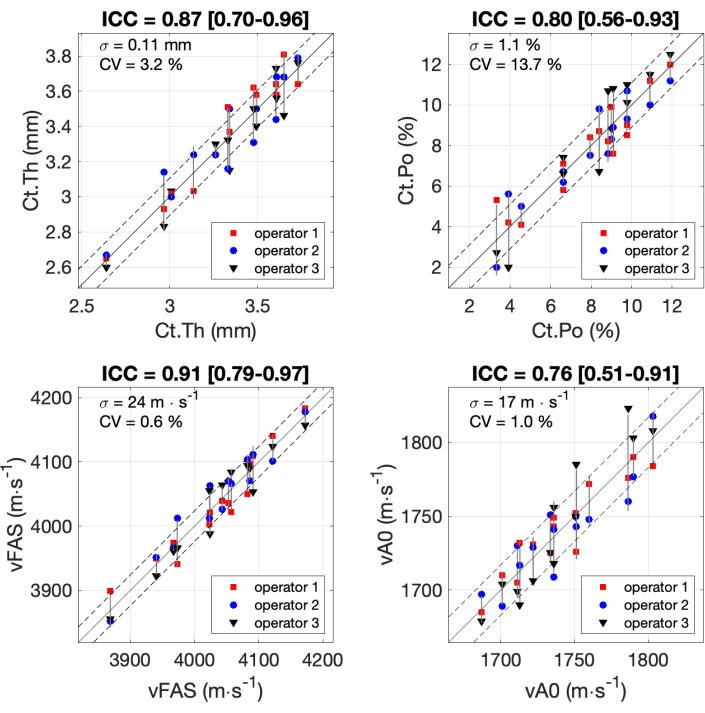
Abbildung 7: Zuverlässigkeit zwischen den Bedienern. Die Ergebnisse werden für die 4 interessierenden Parameter angezeigt, die von den 3 Betreibern mit 14 Teilnehmern erhalten wurden. Die von den 3 Operatoren (y-Achse) erhaltenen Werte werden mit dem Mittelwert der 3 Operatoren (x-Achse) verglichen. Die Intraklassen-Korrelationskoeffizienten (ICC) sind in den Titeln angegeben. Die Standardabweichung σ und der Variationskoeffizient CV werden ebenfalls angegeben. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Kritisch für den Messerfolg ist die korrekte Sondenpositionierung in Bezug auf den Knochen. Die Position in Bezug auf die Knochenoberfläche wurde erfolgreich gelöst, indem die bidirektionale Korrektur16,17 in die Führungsschnittstelle integriert wurde. Es zeigte sich, dass ohne diese Korrektur ein Fehler von wenigen Prozent für die vFAS-Parameter16 erreicht werden kann. Diese Korrektur erwies sich als entscheidend für die genaue Unterscheidung zwischen den Patienten, da der gesamte Messbereich (ca. 3800-4200 m∙s-1) etwa 10% des Mittelwerts17, etwa 4000 m∙s-1, beträgt. Die in dieser Studie gefundene Reproduzierbarkeit (Standardabweichung von 24 m∙s-1) war ähnlich wie in der vorherigen Studie17, was auf eine Standardabweichung von 20 m∙s-1 und einen Variationskoeffizienten (CV) von etwa 0,5 % hindeutet. Ein ähnlicher Variationskoeffizient (0,5 %) wurde bei einer niedrigeren Frequenz gefunden, d. h. bei 0,3 MHz40. Es ist zu beachten, dass die hervorragende Zuverlässigkeit des vFAS-Parameters (ICC = 0,91) höher ist als die Reliabilität, die kürzlich mit einem anderen AT-Gerät in einer älteren Population erreicht wurde (ICC = 0,77)41. Es ist zu beachten, dass die Population in diesem Fall nicht nur älter war, sondern auch ausschließlich weiblich und einige Probanden mit anderen klinischen Anzeichen einer erhöhten Knochenporosität41.
Die zweite Herausforderung besteht darin, die Sonde auch in Bezug auf die Knochenachse und die beiden Grenzflächen korrekt zu positionieren, um die geführten Moden zu erhalten, insbesondere die mit hoher Phasengeschwindigkeit oder niedriger Wellenzahl. Diese Moden sind nahe an der Resonanz und mit mehreren Reflexionspfaden verbunden. Wenn die Ausrichtung nicht korrekt ist, werden Wellen außerhalb des räumlichen Messbereichs der Sonde gestreut. Im Gegenteil, wenn die Sonde richtig positioniert ist, erscheinen diese Hochphasengeschwindigkeitsmoden als kontinuierliche Verzweigungen in der ROI3. Für die erste Version des aktuellen HMI wurde diese Ausrichtung durch einen Blick auf das Echtzeit-GWSI20 gelöst. Dieser Ansatz erwies sich jedoch als unzureichend, um eine robuste Messung zu erreichen: In derklinischen Pilotstudie lag die Misserfolgsrate bei etwa 20 %. Durch die Einbeziehung von Echtzeit-Qualitätsparametern kann das Scheitern in einer zweiten klinischen Studie auf etwa 10 % gesenktwerden 23. Die Einbeziehung des inversen Problembildes in das "Echtzeit"-HMI ermöglicht eine weitere Verbesserung, mit einer aktuellen Ausfallrate für die Radiusmessung von etwa 5%25. Beachten Sie, dass der anfängliche Fehler mit dem ersten Gerät, das nur vFAS misst, bei etwa 15 %17 lag.
Es wurde festgestellt, dass die Zuverlässigkeit der kortikalen Dicke ähnlich ist wie in einer früheren Studie22. Bei einer früheren Version desselben Prototyps wurde ebenfalls festgestellt, dass die ICC nahe 0,9 liegt, mit einer Standardabweichung von etwa 0,1 mm und einem CV von etwa 3 %. Eine deutliche Verbesserung der kortikalen Porosität ist jedoch zu beobachten: Die ICC stieg von 0,622 auf 0,8 und die Standardabweichung sank von 1,5 % auf 1 %. Der schwierigste Parameter ist vA0 aufgrund der Nähe seiner Geschwindigkeit zur Weichteilgeschwindigkeit, etwa 1500 m∙s-1. Wenn der Taster korrekt ausgerichtet ist, wird der A0-Modus eindeutig und kontinuierlich angezeigt. Im Gegenteil, es erscheint diskontinuierlich und/oder mehrfach, da es an das umgebende Weichgewebe gekoppelt ist. Dieser Effekt ist besonders stark bei Menschen mit kleiner (weniger als 4 mm) oder großer (mehr als 10 mm) Weichteildicke (bezeichnet ST.Th).
Wie bereits erwähnt, geht es vor allem darum, die richtige Sondenposition zu finden. Die Position sollte jedoch nicht nur korrekt, sondern auch stabil sein, um den Mittelwert und die Standardabweichung für eine Reihe von 10 Akquisitionen durchzuführen. In den meisten Fällen dauert die Suche nach einem stabilen Zustand weniger als 1 min, und die vollständige Messung eines Patienten würde etwa 5 min dauern. Auch wenn das in dieser Studie beschriebene Standardprotokoll für die Mehrheit der Patienten gut geeignet ist, sind einige Menschen schwieriger zu messen; Es ist schwierig, aber möglich, die richtigen Positionen zu finden, aber fast unmöglich, eine stabile Position zu finden. In diesem Fall kann der Bediener wählen, ob er längere Serien mit bis zu 200 Erfassungen aufzeichnen möchte. Die besten Akquisitionen werden später offline anhand von Qualitätsparametern ermittelt. Diese Filterung soll in Zukunft in Echtzeit angewendet werden. In der Praxis zeichnet der Bediener mehr Serien und/oder Erfassungen auf als die 4 Serien à 10 Erfassungen des idealen Zustandsprotokolls. Die übliche Messzeit bleibt jedoch bei ca. 5 min für eine Stelle, Unterarm oder Bein. Wenn das HMI nach einigen Minuten keine korrekte Position erkennt, stoppt die Messung und gilt als Fehler. Mit dem aktuellen Gerät und Protokoll wurde festgestellt, dass die Fehlerrate weniger als 5 %25 beträgt.
Für das aktuelle Gerät gelten unterschiedliche Einschränkungen:
i)Größe und Gewicht: Das aktuelle BDAT-Gerät ist tragbar: Es passt in Standardgepäck und wiegt ca. 25 kg. Dieses Gewicht ist jedoch im Vergleich zu den neuesten Ultraschallgeräten groß. Ein neues elektronisches Design kann in Betracht gezogen werden, wobei die Sonde und die Signalverarbeitung gleich bleiben. Es ist jedoch möglich, das aktuelle Gerät zu bewegen, insbesondere für Patienten im Bett oder zu Hause mit eingeschränkter Mobilität.
ii)Erfassungsgeschwindigkeit: Die aktuelle Bildrate beträgt etwa 2-4 Hz, was bedeutet, dass die Untersuchung der Messung im Vergleich zur tatsächlichen Echtzeiterfassung langsam ist, d. h. höher als 25 Hz. Dies könnte in Zukunft unter Berücksichtigung schnellerer Computer, schnellerer Datenanalyse und Übertragung zwischen der Elektronik und dem Computer verbessert werden. Eine Erhöhung der Erfassungsgeschwindigkeit würde die Benutzerfreundlichkeit der Messung verbessern, insbesondere die Suche nach der korrekten Sondenpositionierung.
iii)Weichgewebsdicke: Der derzeitige Ansatz ist durch eine große Weichgewebsschicht begrenzt, die in der Regel mehr als 10 mm beträgt. In diesem Fall ist das erste eintreffende Signal mit dem Weichteilpfad und nicht mit dem kortikalen Knochen verknüpft. Somit kann vFAS und der damit verbundene bidirektionale Winkel nicht verwendet werden. Ebenso ist vA0 für große Weichteilschichten sehr schwer zu messen. Ohne diese beiden Geschwindigkeiten kann das inverse Problem nicht ausgeführt werden. In Zukunft könnten andere Methoden der bidirektionalen Korrektur angewendet werden, zum Beispiel mit bildgebenden Verfahren. Patienten mit großen Weichteilschichten sind in der Regel mit Fettleibigkeit und einem Body-Mass-Index (BMI) von mehr als 30 kg.m-2 verbunden.
(iv)Regularität des Hohlleiters: Der Ansatz des inversen Problems setzt einen regulären Hohlleiter mit mehreren Ausbreitungspfaden voraus. Bei osteoporotischen Patienten kann die innere kortikale Schnittstelle unregelmäßig sein, was zu schlechten Bildern des geführten Wellenspektrums führt, insbesondere im unteren Teil. Diese Patienten sind in der Regel mit einer hohen Lösungsmehrdeutigkeit verbunden. Wenn das Weichgewebe oder die schlechte Positionierung nicht als Ursache für ein schlechtes Spektrumbild angesehen werden kann und wenn der Lowk-Parameterwert niedrig ist, ist der Wellenleiter angeblich unregelmäßig, und die Lösung mit der geringsten Dicke wird in Betracht gezogen. Auch Ansätze, die auf maschinellem Lernen basieren und keine physische Modellierung benötigen, können verwendet werden29.
Wie in der Einleitung erläutert, ist DXA der derzeitige Goldstandard für die Erkennung von Patienten mit einem Risiko für Fragilitätsfrakturen, die mit einigen Einschränkungen konfrontiert sind: ihre Größe, ihre geringe Verfügbarkeit in einigen Regionen, ihre relativ hohen Kosten und ihre relativ moderate Wirksamkeit. Die ersten Einschränkungen könnten mit Ultraschallgeräten gemildert werden, die für ihre attraktive Portabilität und Kosten bekannt sind. Die Fähigkeit, Risikopatienten effektiv zu erkennen, sollte jedoch mindestens gleichwertig mit DXA sein. In der Realität wird manchmal erwartet, dass sie höher ist als DXA, um die Anpassung der meisten Referenzen (medizinische Entscheidungen, Behandlung, Kosten, Zimmer usw.) zu rechtfertigen, die mit dem Goldstandard verbunden sind. Aus diesem Grund bieten einige Ultraschallgeräte aBMD-Surrogate 10,11,42 an. Ein Nachteil klinischer Parameter, wie z.B. aBMD und auch vFAS, ist jedoch die Integration unterschiedlicher kortikaler Knocheneigenschaften. Aus diesem Grund werden von anderen Ultraschallgeräten, einschließlich BDAT, komplementäre Standpunkte vorgeschlagen, die Parameter vorschlagen, die vom Arzt und vom Patienten leichter interpretiert werden können, wie z. B. kortikale Porosität, Dicke oder Porengrößenverteilung9. Diese Parameter spiegeln die geometrischen und materiellen Eigenschaften wider: Der kortikale Knochen kann möglicherweise in Bezug auf unabhängige Variationen der Quantität oder Qualität beurteilt werden. Diese Sichtweise könnte sehr hilfreich sein, um verschiedene mögliche Ursachen für Knochenbrüchigkeit zu erforschen. Zum Beispiel wird angenommen, dass intra- oder extrakapsuläre Hüftfrakturen, d. h. Schenkelhals- oder Trochanterfrakturen, unterschiedliche medizinische Ursachen haben43. Ebenso könnte es möglich sein, verschiedene Medikamente zu verfolgen, die auf unterschiedliche Wirkungen auf den kortikalen Knochen abzielen, sowie in Bezug auf Quantität oder Qualität3.
Beachten Sie, dass die Präzision, die mit BDAT für die kortikale Dicke (0,1 mm) erzielt wird, besser ist als bei anderen Ultraschallmethoden, normalerweise über 0,25 mm44. Dieser Unterschied ist zum Teil darauf zurückzuführen, dass das BDAT-Inversproblem kombinierte geometrische und materielle Variationen berücksichtigt. Einige andere Ansätze, wie z. B. das Pulsecho, berücksichtigen einzigartige Knochenmaterialeigenschaften für alle Patienten10,44. Dieser Genauigkeitswert von etwa 0,1 mm (CV ca. 3%) ist in der Tat entscheidend für die feine Unterscheidung zwischen den Patienten, da der Dickenbereich weniger als 2 mm beträgt. Die Genauigkeit bei der kortikalen Porosität (1%, CV ca. 14%) ist noch nicht so gut wie bei der Dicke. Im Vergleich zur vorangegangenen Reproduzierbarkeitsstudie wurden jedoch bereits signifikante Verbesserungen beobachtet22. Es ist zu erwarten, dass ähnliche Verbesserungen in naher Zukunft dank zukünftiger HMI-Verbesserungen erreicht werden könnten, insbesondere in Bezug auf die Bildrate, die näher an Echtzeit liegt.
Der BDAT könnte in großem Maßstab für das Populationsscreening in Regionen eingesetzt werden, in denen DXA nicht weit verbreitet ist. Darüber hinaus zeigten die jüngsten klinischen Ergebnisse das Potenzial, dass der BDAT sogar noch effizienter sein könnte als DXA. Diese Ergebnisse sollten jedoch durch die Einbeziehung von mehr Patienten bestätigt werden. Die nächste Herausforderung sollten multizentrische und/oder longitudinale Studien sein11,12. Das BDAT-Gerät ist jedoch immer noch ein Prototyp, der für die wissenschaftliche Zusammenarbeit zur Verfügung steht, wie dies bereits in Deutschland23 und UK24 geschehen ist. Es sind Anstrengungen erforderlich, um die nächste Generation von BDAT-Geräten zu industrialisieren, die sicherlich schneller und portabler wäre.
Offenlegungen
Die Autoren geben keine Interessenkonflikte an.
Danksagungen
Diese Studie wurde von den chilenischen Projekten ANID / Fondecyt / Regular 1201311 und 1241091 finanziert. Die Autoren bedanken sich bei der Firma BleuSolid für die Unterstützung bei den letzten HMI-Verbesserungen und bei Geropolis für den Drehraum.
Materialien
| Name | Company | Catalog Number | Comments |
| Computer | Notebook HP | mod Zbook (16 Go RAM, Inrel Core i7) | to receive the sampled signals and applying the signal processing steps. Results are displayed in quasi real time (up to 4 per second) through a dedicated Human Machine Interface (HMI, BleuSolid, Pomponne, France) allowing the measurement guidance; |
| Electric insulation transformer | REOMED, Solingen, Germany | IEC / EN 60601-1 | to protect the device, the patient and other devices from any electric hazard |
| Electronic module | Althaïs, Tours, France | in-house | send excitation signals (half a period of negative voltage of 170 V) and discretize received signals (1024 time points per receiver at 20 MHz sampling frequency and 12 bit dynamic) before sending them to the computer. Delays and amplification can be adapted using linear laws in order to optimize data sampling within the accessible ranges. |
| Human Machine Interface | BleuSolid, Pomponne, France | N/A | HMI |
| Pedal switch | Scythe, Germany | USB Foot Switch 2 | to start an acquisition series |
| Ruler | Westcott, USA | 10417 | to locate the measurement site |
| Ultrasonic probe radius | Vermon, Tours, France | in-house | 1 MHz central frequency, 24 receivers with 0.8 mm pitch and two blocks of 5 transmitters with 1 mm pitch. |
| Ultrasonic probe tibia | Vermon, Tours, France | in-house | 0.5 MHz central frequency, 24 receivers with 1.2 mm pitch and two block of 5 transmitters with 1.5 mm pitch |
| Ultrasonic probes | designed according to the bidirectional geometry: a single receiver array surrounded by two transmitter arrays. The three arrays are aligned, mechanically and electrically isolated in order to minimize coupling signals. The probes are adapted to two different sites, one third distal radius and mid tibia. |
Referenzen
- Curtis, E. M., Moon, R. J., Harvey, N. C., Cooper, C. Reprint of: the impact of fragility fracture and approaches to osteoporosis risk assessment worldwide. Int J Orthop Trauma Nurs. 26, 7-17 (2017).
- Sing, C. W., et al. Global epidemiology of hip fractures: secular trends in incidence rate, post-fracture treatment, and all-cause mortality. J Bone Miner Res. 38 (8), 1064-1075 (2023).
- Choksi, P., Jepsen, K. J., Clines, G. A. The challenges of diagnosing osteoporosis and the limitations of currently available tools. Clin Diabetes Endocrinol. 4, 1-13 (2018).
- El Maghraoui, A., Roux, C. DXA scanning in clinical practice. QJM. 101 (8), 605-617 (2008).
- Maeda, S. S., et al. Challenges and opportunities for quality densitometry in Latin America. Arch Osteoporos. 16, 1-11 (2021).
- Surowiec, R. K., Does, M. D., Nyman, J. S. In vivo assessment of bone quality without x-rays. Curr Osteoporos Rep. 22 (1), 56-68 (2024).
- Whittier, D. E., et al. A fracture risk assessment tool for high resolution peripheral quantitative computed tomography. J Bone Miner Res. 38 (9), 1234-1244 (2023).
- Nyman, J. S., et al. Toward the use of MRI measurements of bound and pore water in fracture risk assessment. Bone. 176, 116863(2023).
- Armbrecht, G., Nguyen Minh, H., Massmann, J., Raum, K. Pore size distribution and frequency-dependent attenuation in human cortical tibia bone discriminate fragility fractures in postmenopausal women with low bone mineral density. J Bone Miner Res Plus. 5 (11), e10536(2021).
- Behrens, M., et al. The Bindex® ultrasound device: reliability of cortical bone thickness measures and their relationship to regional bone mineral density. Physiol Meas. 37 (9), 1528-1540 (2016).
- Cortet, B., et al. Radiofrequency echographic multi-spectrometry (REMS) for the diagnosis of osteoporosis in a European multicenter clinical context. Bone. 143, 115786(2021).
- Olszynski, W. P., et al. Multisite quantitative ultrasound for the prediction of fractures over 5 years of follow-up the Canadian Multicentre Osteoporosis Study. J Bone Miner Res. 28 (9), 2027-2034 (2013).
- Hans, D., Métrailler, A., Gonzalez Rodriguez, E., Lamy, O., Shevroja, E. Quantitative ultrasound (QUS) in the management of osteoporosis and assessment of fracture risk: an update. Adv Exp Med Biol. 1364, 7-34 (2022).
- Weiss, M., Ben-Shlomo, A., Hagag, P., Ish-Shalom, S. Discrimination of proximal hip fracture by quantitative ultrasound measurement at the radius. Osteoporos Int. 11 (5), 411-416 (2000).
- Moilanen, P., et al. Discrimination of fractures by low-frequency axial transmission ultrasound in postmenopausal females. Osteoporos Int. 24, 723-730 (2013).
- Bossy, E., Talmant, M., Defontaine, M., Patat, F., Laugier, P. Bidirectional axial transmission can improve accuracy and precision of ultrasonic velocity measurement in cortical bone: a validation on test materials. IEEE Trans Ultrason Ferroelectr Freq Control. 51 (1), 71-79 (2004).
- Talmant, M., et al. In vivo performance evaluation of bi-directional ultrasonic axial transmission for cortical bone assessment. Ultrasound Med Biol. 35 (6), 912-919 (2009).
- Mitra, M., Gopalakrishnan, S. Guided wave based structural health monitoring: A review. Smart Mater Struct. 25, 053001(2016).
- Minonzio, J. G., Talmant, M., Laugier, P. Guided wave phase velocity measurement using multi-emitter and multi-receiver arrays in the axial transmission configuration. J Acoust Soc Am. 127 (5), 2913-2919 (2010).
- Minonzio, J. G., et al. cortical thickness and porosity assessment using ultrasound guided waves: An ex vivo validation. Bone. 116, 111-119 (2018).
- Vallet, Q., Bochud, N., Chappard, C., Laugier, P., Minonzio, J. G. In vivo characterization of cortical bone using guided waves measured by axial transmission. IEEE Trans Ultrason Ferroelectr Freq Control. 63 (9), 1361-1371 (2016).
- Minonzio, J. G., et al. Ultrasound-based estimates of cortical bone thickness and porosity are associated with nontraumatic fractures in postmenopausal women: a pilot study. J Bone Miner Res. 34 (9), 1585-1596 (2019).
- Minonzio, J. G., et al. Bi-directional axial transmission measurements applied in a clinical environment. PLoS One. 17 (12), e0277831(2022).
- Behforootan, S., et al. Can guided wave ultrasound predict bone mechanical properties at the femoral neck in patients undergoing hip arthroplasty. J Mech Behav Biomed Mater. 136, 105468(2022).
- Rojo, F., et al. Classification of hip fragility fractures in older adults using an ultrasonic device. , IEEE International Ultrasonics Symposium (IUS). Montreal, QC, Canada. (2023).
- Ishimoto, T., et al. Quantitative ultrasound (QUS) axial transmission method reflects anisotropy in micro-arrangement of apatite crystallites in human long bones: A study with 3-MHz-frequency ultrasound. Bone. 127, 82-90 (2019).
- Minonzio, J. G., Foiret, J., Talmant, M., Laugier, P. Impact of attenuation on guided mode wavenumber measurement in axial transmission on bone mimicking plates. J Acoust Soc Am. 130 (6), 3574-3582 (2011).
- Moreau, L., Minonzio, J. G., Talmant, M., Laugier, P. Measuring the wavenumber of guided modes in waveguides with linearly varying thickness. J Acoust Soc Am. 135 (5), 2614-2624 (2014).
- Miranda, D., Olivares, R., Munoz, R., Minonzio, J. G. Improvement of patient classification using feature selection applied to bidirectional axial transmission. IEEE Trans Ultrason Ferroelectr Freq Control. 69 (9), 2663-2671 (2022).
- Foiret, J., Minonzio, J. G., Chappard, C., Talmant, M., Laugier, P. Combined estimation of thickness and velocities using ultrasound guided waves: A pioneering study on in vitro cortical bone samples. IEEE Trans Ultrason Ferroelectr Freq Control. 61 (9), 1478-1488 (2014).
- Granke, M., et al. Change in porosity is the major determinant of the variation of cortical bone elasticity at the millimeter scale in aged women. Bone. 49 (5), 1020-1026 (2011).
- Bochud, N., Vallet, Q., Minonzio, J. G., Laugier, P. Predicting bone strength with ultrasonic guided waves. Sci Rep. 7 (1), 43628(2017).
- Schneider, J., et al. Ex vivo cortical porosity and thickness predictions at the tibia using full-spectrum ultrasonic guided-wave analysis. Arch Osteoporos. 14, 1-11 (2019).
- Ramiandrisoa, D., Fernandez, S., Chappard, C., Cohen-Solal, M., Minonzio, J. G. In vivo estimation of cortical thickness and porosity by axial transmission: Comparison with high resolution computed tomography. , 2018 IEEE International Ultrasonics Symposium (IUS). Kobe, Japan. (2018).
- Schneider, J., et al. In vivo measurements of cortical thickness and porosity at the proximal third of the tibia using guided waves: Comparison with site-matched peripheral quantitative computed tomography and distal high-resolution peripheral quantitative computed tomography. Ultrasound Med Biol. 45 (5), 1234-1242 (2019).
- Araya, C., et al. Real time waveguide parameter estimation using sparse multimode disperse radon transform. IEEE UFFC Latin America Ultrasonics Symposium (LAUS. , Gainesville, FL, USA. (2021).
- Bobak, C. A., Barr, P. J., O'Malley, A. J. Estimation of an inter-rater intra-class correlation coefficient that overcomes common assumption violations in the assessment of health measurement scales. BMC Med Res Methodol. 18 (1), 93(2018).
- Shrout, P. E., Fleiss, J. L. Intraclass correlations: uses in assessing rater reliability. Psychol Bull. 86 (2), 420(1979).
- Zoeller, T. Intraclass correlation coefficient with confidence intervals. , At https://www.mathworks.com/matlabcentral/fileexchange/26885-intraclass-correlation-coefficient-with-confidence-intervals (2010).
- Kilappa, V., et al. Low-frequency axial ultrasound velocity correlates with bone mineral density and cortical thickness in the radius and tibia in pre- and postmenopausal women. Osteoporos Int. 22, 1103-1113 (2011).
- Watson, C. J., de Ruig, M. J., Saunders, K. T. Intrarater and interrater reliability of quantitative ultrasound speed of sound by trained raters at the distal radius in postmenopausal women. J Geriatr Phys Ther. 47 (4), E159-E166 (2024).
- Stein, E. M., et al. Clinical assessment of the 1/3 radius using a new desktop ultrasonic bone densitometer. Ultrasound Med Biol. 39 (3), 388-395 (2013).
- Dinamarca-Montecinos, J. L., Prados-Olleta, N., Rubio-Herrera, R., Del Pino, A. C. S., Carrasco-Buvinic, A. Intra-and extracapsular hip fractures in the elderly: Two different pathologies. Rev Esp Cir Ortop Traumatol. 59 (4), 227-237 (2015).
- Karjalainen, J., Riekkinen, O., Toyras, J., Kroger, H., Jurvelin, J. Ultrasonic assessment of cortical bone thickness in vitro and in vivo. IEEE Trans Ultrason Ferroelectr Freq Control. 55 (10), 2191-2197 (2008).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten