Method Article
Avaliação óssea cortical usando ondas guiadas por ultrassom: um estudo de reprodutibilidade em uma população saudável
Neste Artigo
Resumo
Aqui, apresentamos detalhadamente o protocolo de medição do dispositivo ultrassônico de transmissão axial bidirecional (BDAT) e o testamos em um estudo de reprodutibilidade, considerando 14 participantes saudáveis e 3 operadores. A confiabilidade, medida com os coeficientes de correlação intraclasse (CCI), foi de boa a excelente para quatro parâmetros de interesse.
Resumo
As fraturas por fragilidade ainda são um fardo mundial para a saúde no contexto do envelhecimento populacional. Em particular, espera-se que o número global de fraturas de quadril dobre entre 2020 e 2050. Portanto, é essencial detectar pacientes com risco de fratura por fragilidade em escala populacional. O padrão ouro atual é a absorciometria de raios-X duplo (DXA), fornecendo a densidade mineral óssea de área (aBMD). Dispositivos ultrassônicos, geralmente mais portáteis e mais baratos que os dispositivos de raios-X, representam alternativas interessantes de DXA como ferramentas de triagem. No entanto, a dependência do operador é geralmente reconhecida como sua principal desvantagem. Neste estudo, o protocolo de medição do dispositivo ultrassônico de transmissão axial bidirecional (BDAT) é apresentado em detalhes. A sonda ultrassônica dedicada é colocada no raio distal de um terço do antebraço não dominante usando gel de acoplamento convencional. A interface guiada fornece em tempo quase real (cerca de 2 Hz) quatro parâmetros de interesse: velocidades do primeiro sinal que chega (vFAS) e do modo A0 (vA0), espessura cortical (Ct.Th) e porosidade (Ct.Po), bem como quatro parâmetros de qualidade. O operador move a sonda lentamente no local de medição, observando cuidadosamente o feedback fornecido pela interface até encontrar uma posição estável e iniciar uma série de 10 aquisições. Quando pelo menos quatro séries consistentes são obtidas, a medição termina e um relatório automático é gerado. A medição geralmente leva cerca de 5 minutos para ser concluída. Para determinar a robustez deste protocolo, foi realizado um estudo de reprodutibilidade entre 3 operadores (um especialista e dois novatos) e 14 participantes saudáveis (6 mulheres, 8 homens, 21-53 anos). Os coeficientes de correlação intraclasse (CCI) foram considerados bons para vA0 (0,76), Ct.Po (0,80) ou excelentes para Ct.Th (0,87) e vFAS (0,91). Os desvios-padrão foram inferiores a 10% dos intervalos totais na prática clínica.
Introdução
A osteoporose e as fraturas por fragilidade associadas ainda constituem um importante problema de saúde pública1. Em particular, espera-se que o número mundial de fraturas de quadril dobre até 20502. A fragilidade óssea é devida a um processo lento e silencioso de desmineralização e perda óssea, sem grandes sinais de alerta antes do evento de fratura por fragilidade. O padrão ouro atual para detectar pacientes em risco de fratura por fragilidade é a absorciometria de raios-X dupla (DXA), fornecendo uma imagem de raios-X 2D de baixa resolução com um pixel cinza calibrado3. A partir desta imagem, é possível extrair a densidade mineral óssea de área (DMO em g.cm-2) em diferentes regiões de interesse associadas aos principais locais de fratura por fragilidade: coluna, punho e quadril. O valor de aBMD diminui à medida que a taxa de fratura por fragilidade aumenta3. Além disso, a normalização do escore T, em relação a uma população normal saudável, permite a comparação de pacientes medidos com dispositivos propostos por diferentes fabricantes. O escore T da DXA foi proposto pela Organização Mundial da Saúde para definir o diagnóstico de osteoporose em três estágios: normal (escore T < -1), osteopênico (-1 < escore T < -2,5) e osteoporótico (escore T < -2,5)4.
A DXA apresenta várias limitações: seu tamanho, custo relativamente alto, necessidade de uma sala dedicada e sua capacidade de discriminar entre fraturados e não fraturados, bem como sua disponibilidade em vários países, como na América Latina, são moderados5. Assim, há necessidade de alternativas de DXA como ferramentas de triagem para estimativa de risco de fratura por fragilidade6. No entanto, algumas alternativas de DXA, como a tomografia computadorizada quantitativa e seusderivados7, a ressonância magnética (RM)8, também são volumosas e pouco disponíveis. O ultrassom quantitativo (QUS) apresenta o potencial para dispositivos de triagem portáteis, robustos e fáceis de usar. Diferentes dispositivos foram desenvolvidos para avaliação do osso cortical, associados a diferentes frequências variando de alguns kHz a alguns MHz e diferentes posicionamentos de transdutores na transmissão, retrodifusão9, eco de pulso10 e transmissão axial onde os transdutores são alinhados com o eixo de um osso longo, como rádio e tíbia. Alguns dispositivos fornecem substitutos de umBMD11, enquanto outros fornecem parâmetros ultrassônicos "clássicos", como velocidades12 ou coeficientes de atenuação9 e até mesmo parâmetros geométricos e de material, por exemplo, espessura cortical, porosidade ou distribuição de tamanho de poro9. No entanto, até hoje, o QUS ainda não conseguiu ser amplamente utilizado na prática clínica para avaliação óssea, em parte devido à falta de homogeneização entre os dispositivos e à dependência do operador13.
Dentre as tecnologias de QUS propostas como alternativas de DXA, a transmissão axial (TA) tem a vantagem de que a medição pode ser realizada no antebraço, um local (i) de fácil acesso e (ii) próximo a um dos principais locais de fraturas por fragilidade, ou seja, o punho. O primeiro parâmetro de TA proposto depende da velocidade de propagação ultrassônica na camada cortical, denotada velocidade do som (SOS) ou velocidade do primeiro sinal de chegada (vFAS), dependendo do processamento do sinal e dos dispositivos, sendo alguns comerciais12,14 e outros protótipos de laboratório15,16. Esse parâmetro tem sido capaz de discriminar entre grupos de pacientes com ou sem fraturas por fragilidade com desempenhos semelhantes à DMO em vários estudos clínicos desde o final da década de 199014,15. Também tem sido aplicado com sucesso para estudos longitudinais multicêntricos, demonstrando sua aplicação clínica e robustez12. A precisão da vFAS foi melhorada pela combinação das duas direções opostas de propagação, a fim de reduzir o viés devido ao ângulo entre a sonda e a superfície óssea16,17. Este ponto de vista foi denotado como AT bidirecional (BDAT).
Mesmo que a vFAS tenha mostrado interesse clínico, sua principal desvantagem, semelhante à DMO, é que ela combina diferentes características corticais ósseas importantes, como propriedades geométricas e materiais, tornando sua interpretação clínica não direta. É por isso que o ponto de vista da onda guiada foi proposto, considerando seu potencial devido à fina sensibilidade das ondas guiadas às propriedades do guia de ondas. Essa abordagem deve combinar processamento de sinais, modelagem de guias de ondas e problemas inversos e é amplamente utilizada em ensaios não destrutivos, considerando, por exemplo, guias de ondas metálicas, como placas ou tubos18. Assim, um dispositivo BDAT de segunda geração foi desenvolvido passo a passo desde 2010, desde os simuladores que imitam os ossos19 até a validação ex vivo 20 e medições in vivo 21. O dispositivo foi testado com sucesso em estudos clínicos na França22, Alemanha23, Reino Unido24 e Chile25, e mostrou resultados melhores em termos de taxa de sucesso e discriminação de pacientes.
Este estudo tem como objetivo explorar a reprodutibilidade do atual dispositivo ultrassônico BDAT. Primeiro, o dispositivo e o protocolo de medição serão detalhados. Os resultados obtidos com 14 participantes e 3 operadores serão apresentados e discutidos em termos de rastreio populacional para a deteção de doentes em risco de fraturas por fragilidade.
Princípio de medição: processamento de sinal, parâmetros de interesse e parâmetros de qualidade
O dispositivo de transmissão axial bidirecional (BDAT) é composto por diferentes partes, sendo a principal a sonda ultrassônica, o módulo eletrônico e o computador. A lista completa é detalhada na Tabela de Materiais e ilustrada na Figura 1. A seguir, são descritos os parâmetros de interesse, os parâmetros de qualidade de medição e o protocolo de medição.
vFAS
Uma vez que os sinais amostrados são recebidos pelo computador, eles são processados seguindo diferentes etapas. A primeira etapa consiste no processamento do sinal no domínio do tempo, detectando a SAF utilizando o protocolo descrito anteriormente16,17. Uma vez obtido o tempo de chegada de cada receptor, é possível determinar a velocidade do FAS, posteriormente denotada vFAS, que é a média harmônica das velocidades obtidas em ambas as direções de propagação. Combinando as informações de ambas as direções de propagação, é possível obter o ângulo de valor entre as direções da sonda e da superfície óssea e derivar um valor vFAS não enviesado16. Este ângulo bidirecional é posteriormente denotado alfa e é usado como parâmetro de qualidade de medição. Esse processamento temporal também permite estimar a espessura do tecido mole entre a superfície óssea e a sonda, denotada ST.Th26.
Imagem de espectro de onda guiada
A segunda etapa consiste no processamento do sinal no domínio de Fourier, considerando as frequências temporais e espaciais, denotadas f e k. A abordagem é um método baseado em SVD, permitindo a transformação dos sinais espaço-temporais na função Norm, também denotada imagem de espectro de onda guiada (GWSI), conforme ilustrado na Figura 2 para um antebraço in vivo 19. O método combina duas transformadas de Fourier (tempo e espaço) e uma decomposição de valor singular (SVD), permitindo visualizar a taxa de presença nos sinais recebidos (em uma escala de 0-1) dos modos guiados pela camada óssea cortical. O GWSI pode ser interpretado como um aprimoramento da Transformada de Fourier espaço-temporal, com cada pixel sendo associado a um plano independente de frequência f e número de onda k. Observe que a abordagem foi aprimorada para levar em consideração o impacto da atenuação do material27 e da variação linear da espessura28.
Atenção especial será dada à parte superior do espectro, associada ao modo A0, e também à parte mais baixa, associada aos maiores valores de velocidade de fase, ou seja, maior que 4 mm·μs-1. Esta parte corresponde à região de interesse 3 (ROI 3)29. O valor médio do ROI 3, posteriormente denotado como lowk, também é usado como parâmetro de qualidade. Um valor grande corresponde a um guia de ondas regular, permitindo reflexões de ondas claras nas interfaces ósseas. Se o valor diminuir, pode ser devido a um guia de ondas irregular ou a uma sonda mal colocada.
Modelo de guia de onda
A dispersão da onda guiada, ou a variação da velocidade de fase de cada modo guiado em relação à frequência, depende do material e das propriedades geométricas do guia de ondas. Assim, é potencialmente possível recuperar essas propriedades usando processamento de sinal dedicado, modelagem de guia de ondas e esquemas de problemas inversos. No caso do BDAT, o modelo de guia de onda corresponde a uma placa livre isotrópica transversal 2D, dependendo do material do guia de onda e de um parâmetro geométrico, a espessura30. O material ósseo cortical é homogeneizado considerando parâmetros fixos para a matriz óssea e porosidade variável31. Assim, o problema inverso depende de dois parâmetros, denotados espessura cortical (Ct.Th) e porosidade cortical (Ct.Po). Os efeitos da absorção de material, curvatura do guia de ondas e tecidos moles circundantes não são levados em consideração no modelo, mesmo que afetem a medição. No entanto, seu peso no resultado inverso do problema não foi determinante, o que significa que os modos nas duas principais regiões de interesse (A0 e parte inferior) não são significativamente alterados pela curvatura e pelos tecidos moles32.
Problema inverso
Inicialmente, o problema inverso foi dividido em duas etapas: primeiro, extrair a dispersão de onda guiada experimental e, segundo, comparar com o modelo de guia de onda. Esse ponto de vista foi limitado pelo ruído e pela rotulagem de modo30,32. Assim, uma abordagem dedicada foi proposta para superar essas limitações como uma extensão do ponto de vista da função Norma. Em vez de considerar cada onda plana de forma independente, apenas as possíveis ondas guiadas fornecidas pelo modelo de guia de ondas são levadas em consideração20. Isso leva à imagem inversa do problema, expressa no domínio do parâmetro do modelo, ou seja, o plano Ct.th - Ct.Po (Figura 2 no canto inferior direito). O modelo de melhor ajuste recebe a posição máxima, enquanto os eventuais picos secundários (indicados pelas imagens do problema inverso com um ponto cinza) correspondem a soluções ambíguas, indicadas na comparação f-k com modos experimentais com linhas cinza claro. Como antes, o valor do pixel é normalizado por construção e reflete, neste caso, a presença de um modelo de guia de onda específico nos sinais recebidos. O valor máximo (denotado máx.) e a diferença com o segundo máximo (denotado diff) também são usados como parâmetros de qualidade.
O problema inverso foi originalmente proposto para cálculo offline, ou seja, uma vez que os sinais são adquiridos, usando os valores exatos dos números de onda do modelo. Essa abordagem foi validada para os sítios do rádio e da tíbia considerando estudos ex vivo20,33 e in vivo 21,34,35. Para incluir esses cálculos na interface homem-máquina (IHM), foi proposta uma versão aproximada, compatível com a aplicação em tempo real, utilizando um ponto de vista matricial esparso36.
vA0
A partir do GWSI, também é possível extrair a velocidade do modo guiado mais lento, associado ao primeiro modo antissimétrico A0 da placa livre ou modelo Lamb33,35. A parte superior do espectro de ondas guiadas pode ser aproximada linearmente, com a inclinação fornecendo o valor da velocidade vA0 (Figura 2 no canto inferior esquerdo).
Resumo do parâmetro:
Finalmente, quatro parâmetros de interesse são medidos: (i) vFAS: velocidade do primeiro sinal de chegada (m·s-1); (ii) vA0: velocidade do modo guiado mais lento (m·s-1); (iii) Ct.Th: espessura cortical (mm); e (iv) Ct.Po: porosidade cortical (%).
Quatro parâmetros de qualidade são considerados: (i) alfa: ângulo bidirecional (°); (ii) lowk: valor médio da menor parte do GWSI (valor normalizado entre 0 e 1); (iii) max: máximo da função inversa do problema (valor normalizado entre 0 e 1); e (iv) diff: a diferença entre o primeiro e o segundo máximos da função inversa do problema (valor normalizado entre 0 e 100).
Todos esses parâmetros, bem como as duas imagens do espectro de ondas guiadas (uma direção par de propagação) e a imagem do problema inverso, são exibidos em "tempo real" pela IHM, com uma taxa de quadros de cerca de 2 Hz. Um exemplo típico é ilustrado na Figura 3. Na seção a seguir, o método de uso desses parâmetros é descrito em detalhes. A ideia principal é que o operador mova a sonda lentamente no local de medição, observando cuidadosamente o feedback fornecido pelas diferentes partes da interface até encontrar uma posição estável e iniciar uma série de 10 aquisições. Quando pelo menos quatro séries consistentes são obtidas, a medição termina e um relatório automático é gerado.
Protocolo
O estudo foi aprovado pelo Comitê de Ética da Universidad de Valparaiso, Chile, sob o número de protocolo CEC213-20. O consentimento informado por escrito foi fornecido aos participantes. Foi realizada entrevista telefônica para estabelecer a inclusão/exclusão dos participantes. O estudo foi registrado sob a seguinte referência: NCT05424536.
1. Configuração do dispositivo
- Coloque as partes principais do dispositivo em uma mesa grande.
- Coloque lado a lado as seguintes peças: transformador de isolamento elétrico, módulo eletrônico e laptop em uma mesa grande. Certifique-se de que haja espaço suficiente na frente dessas partes para colocar o antebraço do participante com facilidade posteriormente.
- Eventualmente, coloque o laptop diretamente no módulo eletrônico em caso de espaço limitado, tomando cuidado para não obstruir as janelas de ventilação do módulo, que estão claramente indicadas.
- Conecte o transformador de isolamento elétrico.
- Conecte o transformador de isolamento elétrico à energia doméstica da sala usando um cabo dedicado.
- Conecte o módulo eletrônico.
- Conecte o módulo eletrônico ao transformador de isolamento elétrico usando um cabo de alimentação dedicado.
- Pressione o botão ON-OFF no transformador para alimentar o módulo.
- Conecte o laptop.
- Conecte o laptop ao módulo usando o cabo USB (barramento serial universal) dedicado para enviar os sinais recebidos digitalizados ao computador para processamento posterior.
- Se o laptop precisar ser alimentado, conecte seu cabo de alimentação ao transformador de isolamento eletrônico.
- Conecte a sonda ultrassônica.
- Conecte a sonda ultrassônica ao módulo com o slot de cabo dedicado situado na parte frontal do módulo. Existem duas sondas diferentes para locais de medição de antebraço e perna. Neste estudo, apenas o rádio (sonda do antebraço) é considerado.
- Conecte o pedal.
- Coloque o pedal no chão próximo aos pés, considerando a posição do operador enquanto mede um participante. Conecte o pedal ao computador usando um cabo USB. Use o pedal para iniciar a série de aquisição.
2. Instalação do participante
- Posicione o participante.
- Convide o participante a sentar-se em frente ao operador com o antebraço nu apoiado na mesa em frente ao dispositivo previamente instalado (ver Figura 3).
NOTA: O lado contralateral é medido (ou seja, o lado esquerdo para um participante destro).
- Convide o participante a sentar-se em frente ao operador com o antebraço nu apoiado na mesa em frente ao dispositivo previamente instalado (ver Figura 3).
- Marque o local de medição (um terço do raio distal).
- Meça o comprimento do rádio usando a régua do estiloide radial (extremidade óssea próxima ao pulso) até o cotovelo.
- Divida esse comprimento por três.
- Marque o local de medição, ou seja, um terço do raio distal, usando a caneta medindo um terço do comprimento do raio a partir do pulso.
- Inicie o software HMI.
- Inicie o software HMI clicando no ícone correspondente na área de trabalho do laptop.
- Adicione os dados do participante.
- Adicione os dados do participante (ID anônimo, lateralidade, local medido, ID do operador, sexo, etc.) usando a janela pop-up, que se abre automaticamente quando o software é iniciado.
- Adicione gel ecográfico.
- Adicione gel ecológico na parte frontal da sonda e no local de medição, marcado no antebraço do participante, para garantir a propagação das ondas ultrassônicas.
- Coloque a sonda em contato com o antebraço.
- Coloque a sonda em contato com o antebraço, com o centro da sonda colocado na marca feita anteriormente na etapa 2.2.
3. Procurando uma posição estável
NOTA: A HMI exibe quatro parâmetros de interesse: duas velocidades, vFAS e vA0, e dois valores de problema inverso, espessura cortical (Ct.Th) e porosidade cortical (Ct.Po). A IHM também exibe quatro parâmetros de qualidade denotados alfa, lowk, max e diff. Esses parâmetros são descritos em detalhes na introdução.
- Inicie a visualização em tempo real .
- Inicie a visualização em tempo real clicando no botão Iniciar no lado inferior direito da interface do software. A duração entre duas exibições de valores sucessivas é de cerca de 0,5 s.
- Encontre um valor de vFAS estável.
- Ajuste lentamente a posição da sonda enquanto observa o valor do parâmetro vFAS exibido em um caso específico da interface. Os valores normais variam de cerca de 3800 m∙s-1 a cerca de 4200 m∙s-1.
- Se uma posição estável for encontrada, certifique-se de que a variação do vFAS seja inferior a cerca de 40 m∙s-1 entre dois cálculos sucessivos.
- Ajuste o ângulo bidirecional.
- Ajuste lentamente a posição da sonda enquanto observa o valor bidirecional (parâmetro de qualidade alfa) exibido em um caso específico da interface.
- Ajuste a posição da sonda adicionando suavemente pressão em um lado da sonda até que o valor absoluto do ângulo seja menor que 2° para melhorar o paralelismo entre a sonda e a superfície óssea.
- Encontre um valor vA0 estável.
- Ajuste lentamente a posição da sonda enquanto observa o valor do parâmetro vA0 exibido em um caso específico da interface. Os valores normais variam de cerca de 1500 m∙s-1 a cerca de 1900 m∙s-1.
- Se uma posição estável for encontrada, certifique-se de que a variação vA0 seja menor que cerca de 40 m∙s-1 entre dois cálculos sucessivos.
- Em caso de dificuldade, observe os espectros de imagem de onda guiada exibidos na coluna direita da interface. Certifique-se de que a parte superior do espectro apareça como uma linha contínua, cuja inclinação fornece o valor vA0.
- Observe a imagem do problema inverso.
- Observe a imagem do problema inverso, que aparece automaticamente quando as duas velocidades (vFAS e vA0) e os valores de ângulo são estabilizados.
- Certifique-se de que a imagem mostre pelo menos um máximo, indicado com um pixel claro e, eventualmente, um ou vários máximos secundários, indicados com uma cor diferente. Os três parâmetros de qualidade ausentes (máx. diff, lowk) são calculados automaticamente em tempo real.
- Melhore a imagem do problema inverso.
- Ajuste lentamente a posição da sonda enquanto observa os máximos inversos da imagem problemática.
- Encontre o primeiro máximo mais alto possível e o máximo secundário mais baixo possível enquanto observa os casos correspondentes da interface (valores máximo e diff).
- Em caso de dificuldade, observe a imagem do espectro de onda guiada exibida na coluna direita da interface. Certifique-se de que a parte inferior do espectro apareça com algumas linhas contínuas, o maior tempo possível, associadas a modos de alta velocidade de fase e a qualidade do parâmetro lowk, o mais alto possível.
- Encontre uma posição estável.
- Assim que uma imagem de problema inversa aceitável for encontrada, estabilize a posição da sonda. Certifique-se de que nenhuma alteração significativa da imagem inversa do problema seja vista entre dois cálculos sucessivos.
4. Aquisição de dados
- Inicie uma série de 10 aquisições.
- Assim que uma posição estável for encontrada, inicie uma série de 10 aquisições pressionando o pedal com o pé.
- Permaneça o mais estável possível durante as 10 aquisições, com duração de cerca de 5 s.
- Controle a qualidade da série.
- Observe as médias e desvios padrão dos parâmetros de interesse, que são calculados automaticamente e mostrados em janelas pop-up que aparecem quando a série termina.
- Se os desvios-padrão forem inferiores aos limiares fixos, tenha em conta a série. Pelo contrário, rejeite a série.
- Responda à pergunta feita em uma segunda janela pop-up, perguntando se o operador gostaria de interromper ou continuar com a série de aquisições do mesmo participante.
- Reposicione a sonda.
- Comece novamente as etapas anteriores (das etapas 2.1 a 3.2) para encontrar posições mais estáveis e adquirir mais séries de 10 aquisições. Eventualmente, se necessário, deixe o participante descansar entre dois reposicionamentos.
- Como antes, as médias e desvios padrão dos parâmetros de interesse são calculados automaticamente para cada série.
- Observe a janela pop-up de resultados para verificar se a última série adquirida foi mantida ou rejeitada. A medição do participante termina quando pelo menos quatro séries consistentes são registradas. As séries externas são rejeitadas automaticamente.
- Obtenha os valores finais.
NOTA: Os valores finais dos parâmetros de interesse são obtidos automaticamente, considerando a média das médias obtidas com as séries consistentes. - Verifique o pdf do relatório automático.
- Verifique se os valores finais são relatados no pdf do relatório gerado automaticamente e instantaneamente assim que a opção parar é escolhida na janela pop-up. Um exemplo é mostrado na Figura 4.
NOTA: O pdf está localizado na mesma pasta que os dados brutos, que podem ser reanalisados posteriormente offline.
- Verifique se os valores finais são relatados no pdf do relatório gerado automaticamente e instantaneamente assim que a opção parar é escolhida na janela pop-up. Um exemplo é mostrado na Figura 4.
- Verifique o segundo relatório preciso.
- Verifique o segundo relatório preciso gerado usando os valores exatos do modelo de guia de ondas para o cálculo do problema inverso em vez de valores aproximados como no caso do primeiro relatório automático. A segunda geração de relatório leva menos de 5 minutos. Os exemplos são mostrados na Figura 5 e na Figura 6.
- Verifique se o relatório automático está de acordo com o relatório preciso. Remova as séries que não foram eliminadas automaticamente para manter a série consistente.
Resultados
Um estudo de reprodutibilidade foi realizado considerando 3 operadores (um especialista, dois novatos) e 14 participantes saudáveis (6 mulheres, 8 homens, 21-53 anos). Operadores novatos foram treinados por aproximadamente 3 h para entender e praticar o protocolo de aquisição. Em seguida, os participantes foram medidos durante 2 semanas em agosto de 2023. Cada medida foi realizada de forma independente. Todos os operadores estavam cegos, ou seja, um operador não conhecia os resultados obtidos pelos outros dois.
Repetibilidade intra-operador
A Figura 5 ilustra a repetibilidade intra-operador para um caso consistente: 4 séries de 10 aquisições adquiridas em um participante e um operador. A primeira coluna corresponde às funções inversas do problema, enquanto a segunda coluna mostra a dispersão do modo guiado experimental em comparação com o modelo de melhor ajuste. Cada linha de figura corresponde a uma série de sucesso. O número de aquisições retidas é dado no título: 7 em 10 para a primeira série e 10 em 10 para as seguintes. Médias e desvios-padrão e os quatro parâmetros (vFAS, vA0, Ct.Th e Ct.Po) são fornecidos para cada série. Além disso, os parâmetros de qualidade também são mostrados: ângulo bidirecional (alfa), máximo da função inversa do problema (max), a diferença absoluta com o segundo máximo (diff) e o valor médio da parte mais baixa do GWSI (lowk).
Os desvios padrão intra-série são baixos, cerca de 0,02 mm para a espessura cortical, menos de 0,5% para porosidade cortical e menos de 20 m∙s-1 para as duas velocidades, indicando que as posições da sonda de alcance estavam estáveis. Observa-se, então, que os valores médios obtidos para cada série são muito próximos, principalmente para os valores de espessura variando entre 3,4 mm e 3,5 mm e os valores de vFAS variando de 4040 m∙s-1 a 4070 m∙s-1. Observe que uma diferença de 40 m∙s-1 corresponde a uma diferença de 1% para um valor médio de 4000 m∙s-1. Maiores variações são observadas para a porosidade cortical, variando de 8% a 12%, e a velocidade vA0, variando de 1700 m∙s-1 a 1740 m∙s-1. Nesse caso consistente, quase todas as aquisições são consistentes, ou seja, próximas umas das outras. Quase não há ambiguidade no resultado final dos quatro parâmetros de interesse.
Um segundo caso é ilustrado na Figura 6 para um caso menos regular. Nesse caso, três parâmetros, vFAS, vA0 e Ct.Po são muito estáveis, com valores respectivamente de cerca de 4120 m∙s-1, 1700 m∙s-1 e 10%. O caso da espessura cortical é mais difícil, pois duas soluções ambíguas, 2,6 mm e 3,5 mm, são observadas de acordo com um pequeno valor de diferença (diferença menor que 0,5%) entre os dois primeiros máximos da função problema inversa. No caso regular anterior, esta diferença variava entre 1% e 3%. A ambiguidade é removida pela análise de especialistas, neste caso, observando a concordância entre os modos experimental e teórico guiado (coluna da direita). No caso da espessura mais baixa, a concordância é melhor na parte mais baixa do espectro (duas primeiras séries). Para as duas últimas séries, existe um modo teórico com pouquíssimos pontos experimentais, em torno de 0,5 MHz, indicando uma concordância mais pobre em comparação com a série anterior. Além disso, o parâmetro diff (0,1%) é menor que os valores das duas primeiras séries (0,4% e 0,2%). Nesse caso, a escolha da solução mantida (2,6 mm) ainda não está automatizada e ainda é necessário um especialista. No entanto, os três operadores enfrentaram problemas semelhantes e escolheram soluções semelhantes, perto de 2,6 mm.
Confiabilidade extra-operador
Todos os resultados para os 4 parâmetros de interesse obtidos pelos 3 operadores com os 14 participantes são mostrados na Figura 7. Os coeficientes de correlação intraclasse (CCI) foram calculados seguindo a fórmula e o código Matlab publicados anteriormente 37,38,39. O ICC é comumente usado para avaliar a confiabilidade das escalas de medição, em particular para aplicações biomédicas. Valores de CCI variando de 0,75 a 0,9 geralmente estão associados a boa confiabilidade, enquanto valores de CCI acima de 0,9 são considerados excelente confiabilidade. O menor valor para CCI (0,76) foi obtido para o parâmetro vA0. O desvio padrão foi igual a 17 m∙s-1, que é cerca de 7% da faixa de medição da ordem de 250 m∙s-1. Valores semelhantes foram observados para Ct.Po com CCI igual a 0,80 e desvio padrão de 1,1%, cerca de 10% da faixa. Excelente confiabilidade (CCI em torno de 0,9) foi obtida para os outros dois parâmetros, Ct.Th e Ct.Po, com desvio padrão inferior a 10% da faixa.

Figura 1: diferentes partes do dispositivo ultrassônico de transmissão axial bidirecional (BDAT). O protótipo inclui isolamento eletrônico (1), um pedal (2), duas sondas (3.1 e 3.2), um módulo eletrônico (4), um computador (5) e uma régua (6). Clique aqui para ver uma versão maior desta figura.
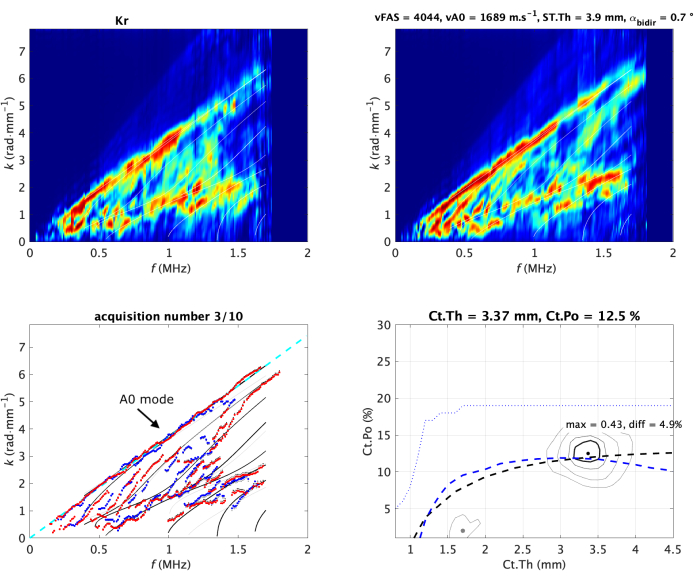
Figura 2: Aquisição típica no antebraço in vivo. As duas funções Norm (uma por direção de propagação) são mostradas na linha superior da imagem. Eles também são denotados imagem de espectro de onda guiada (GWSI). A partir dos máximos dessas imagens, é possível extrair os modos guiados experimentais (pontos azuis e vermelhos) em comparação com o modelo de melhor ajuste (subimagem inferior esquerda). O modelo de melhor ajuste é parametrizado por dois valores, espessura cortical (Ct.Th) e porosidade (Ct.Po), correspondendo à posição máxima da função inversa do problema (subimagem inferior direita). Seus valores são mostrados no título de cada painel. O ajuste vA0 é mostrado como uma linha tracejada (à esquerda). As imagens do espectro de ondas guiadas e a imagem do problema inverso são normalizadas (ou seja, o valor do pixel varia de 0 a 1) por construção19,20. Os valores das duas velocidades medidas, vFAS e vA0, são indicados no título da subimagem superior direita. Clique aqui para ver uma versão maior desta figura.
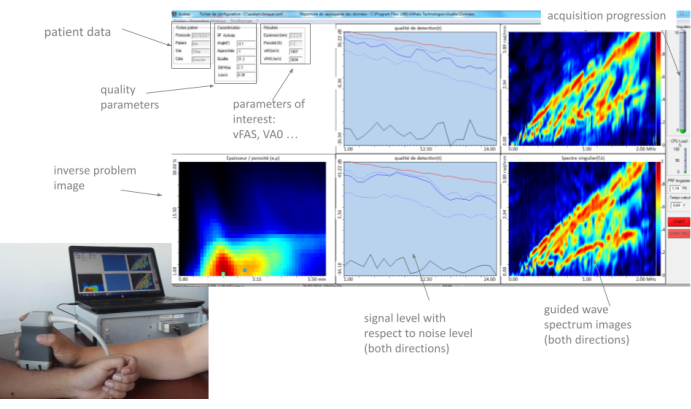
Figura 3: Interface homem-máquina (HMI). A IHM mostra em tempo real os dois GWSIs (um por direção de propagação), a imagem inversa do problema, os parâmetros de interesse e os parâmetros de qualidade. Clique aqui para ver uma versão maior desta figura.
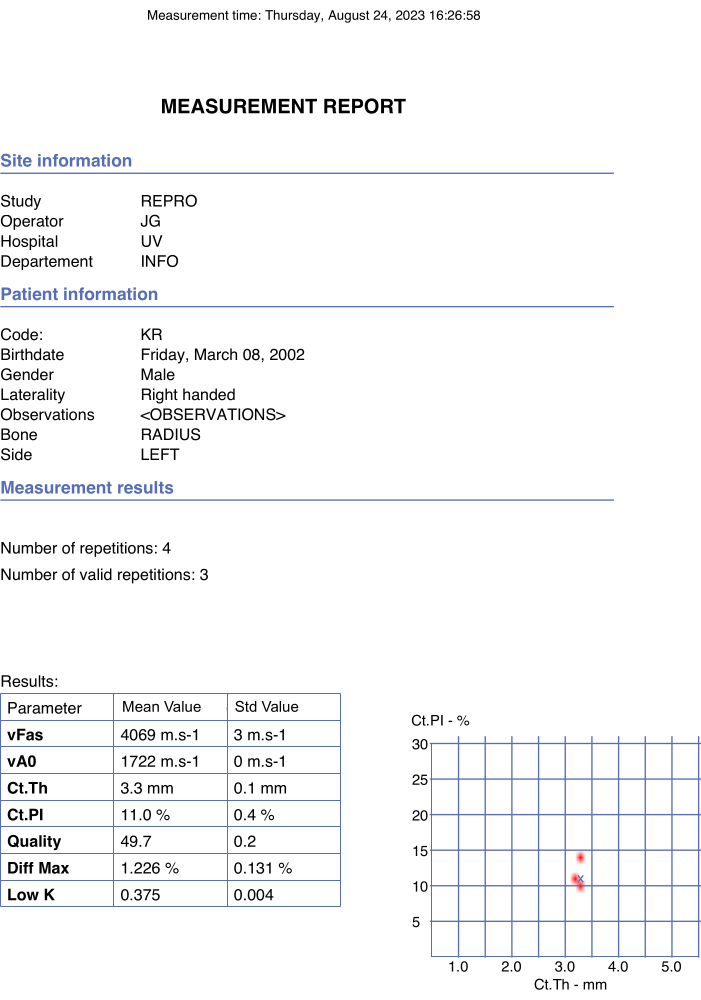
Figura 4: Exemplo de relatório automatizado. O relatório indicou os dados do participante e do operador, bem como os valores finais dos parâmetros de interesse e parâmetros de qualidade. Clique aqui para ver uma versão maior desta figura.
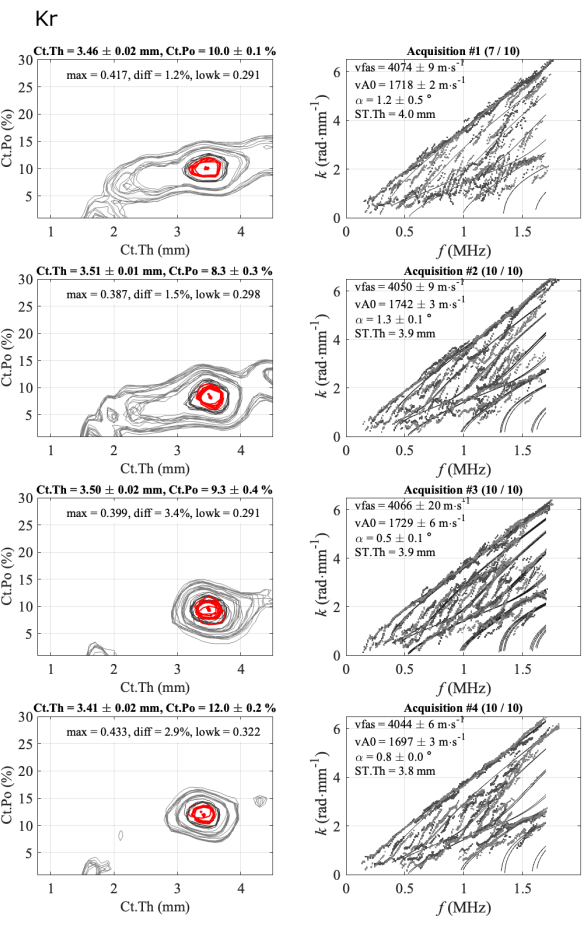
Figura 5: Exemplo do segundo relatório para um caso consistente, igual ao relatório automatizado mostrado na Figura 4. A figura mostra 4 séries de 1 participante e 1 operador: imagens de problemas inversos (coluna da esquerda) e números de onda experimentais em comparação com o modelo de melhor ajuste (coluna da direita). Os valores apresentados correspondem à média e desvio padrão das aquisições mantidas ao longo da série de 10 aquisições. O número de aquisições mantidas é indicado no título da coluna da direita, por exemplo, (7/10) para a primeira série. Clique aqui para ver uma versão maior desta figura.
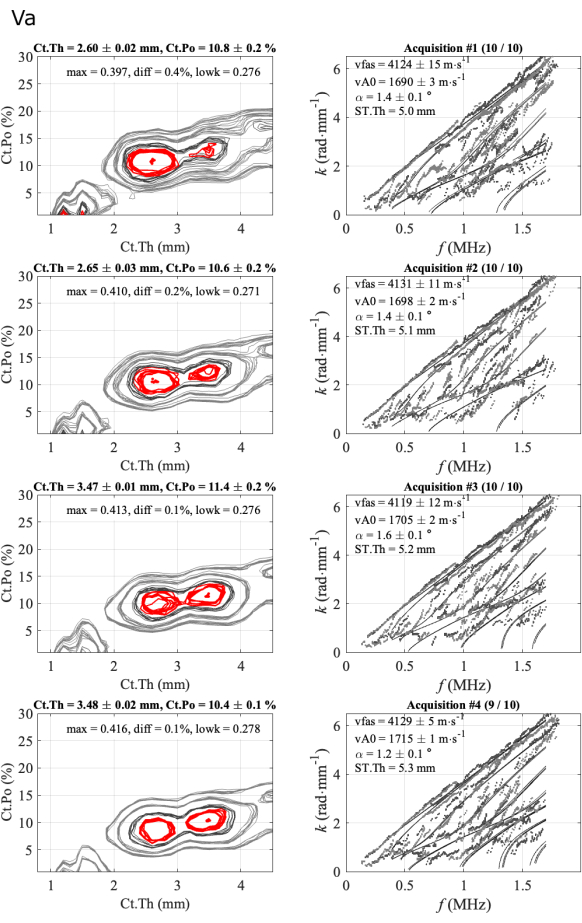
Figura 6: Exemplo do segundo relatório para um caso ambíguo de espessura cortical. A figura mostra 4 séries de 1 participante e 1 operador: imagens de problemas inversos (coluna da esquerda) e números de onda experimentais em comparação com o modelo de melhor ajuste (coluna da direita). Os valores apresentados correspondem à média e ao desvio padrão sobre as aquisições mantidas ao longo da série de 10 aquisições. O número de aquisições mantidas é indicado no título da coluna da direita, por exemplo, (10/10) para a primeira série. Clique aqui para ver uma versão maior desta figura.
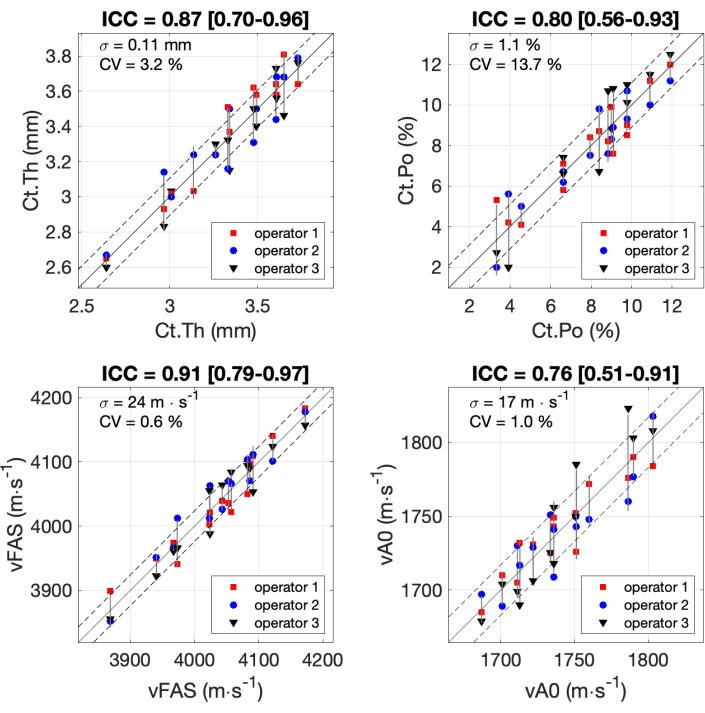
Figura 7: Confiabilidade entre operadores. Os resultados são mostrados para os 4 parâmetros de interesse obtidos pelos 3 operadores com 14 participantes. Os valores obtidos pelos 3 operadores (eixo y) são comparados com o valor médio dos 3 operadores (eixo x). Os coeficientes de correlação intraclasse (CCI) estão indicados nos títulos. O desvio padrão σ e o coeficiente de variação CV também são indicados. Clique aqui para ver uma versão maior desta figura.
Discussão
O ponto crítico para o sucesso da medição é o posicionamento correto da sonda em relação ao osso. A posição em relação à superfície óssea foi resolvida com sucesso integrando-se com a interface guia a correção bidirecional16,17. Foi demonstrado que, sem essa correção, alguns erros percentuais podem ser alcançados para os parâmetros vFAS16. Essa correção foi considerada crucial para discriminar com precisão entre os pacientes, pois toda a faixa de medição (cerca de 3800-4200 m∙s-1) é cerca de 10% do valor médio17, cerca de 4000 m∙s-1. A reprodutibilidade encontrada neste estudo (desvio-padrão de 24 m∙s-1) foi semelhante à do estudoanterior17, indicando um desvio-padrão de 20 m∙s-1 e um coeficiente de variação (CV) de cerca de 0,5%. Coeficiente de variação semelhante (0,5%) foi encontrado em uma frequência menor, ou seja, 0,3 MHz40. Ressalta-se que a excelente confiabilidade do parâmetro vFAS (CCI = 0,91) foi maior do que a obtida recentemente com outro dispositivo de TA em uma população idosa (CCI = 0,77)41. Deve-se notar que a população neste caso não era apenas mais velha, mas também toda do sexo feminino e alguns indivíduos com outros sinais clínicos de aumento da porosidade óssea41.
O segundo desafio é também posicionar a sonda corretamente em relação ao eixo ósseo e às duas interfaces para obter os modos guiados, em particular os de alta velocidade de fase ou baixo número de onda. Esses modos estão próximos da ressonância e associados a vários caminhos de reflexão. Se o alinhamento não estiver correto, as ondas serão espalhadas fora da faixa de medição espacial da sonda. Pelo contrário, se a sonda estiver posicionada corretamente, esses modos de velocidade de alta fase aparecerão como ramificações contínuas na ROI3. Para a primeira versão da IHM atual, esse alinhamento foi resolvido observando o GWSI20 em tempo real. No entanto, essa abordagem foi considerada insuficiente para alcançar uma medição robusta: a taxa de falha foi de cerca de 20% no estudo clínico piloto20. A inclusão de parâmetros de qualidade em tempo real permite que a falha diminua para cerca de 10% em um segundo estudo clínico23. Então, a inclusão da imagem inversa do problema na IHM "em tempo real" permite melhorias adicionais, com uma taxa de falha atual para medição de raio de cerca de 5%25. Deve-se notar que a falha inicial com o primeiro dispositivo medindo apenas a vFAS foi de cerca de 15%17.
A confiabilidade na espessura cortical foi semelhante a um estudo anterior22. Com uma versão anterior do mesmo protótipo, o ICC também estava próximo de 0,9, com um desvio padrão de cerca de 0,1 mm e um CV de cerca de 3%. No entanto, observa-se uma clara melhora na porosidade cortical: o CCI aumentou de 0,622 para 0,8 e o desvio padrão diminuiu de 1,5% para 1%. O parâmetro mais difícil é vA0 devido à proximidade de sua velocidade com a velocidade do tecido mole, cerca de 1500 m∙s-1. Se a sonda estiver alinhada corretamente, o modo A0 parece único e contínuo. Pelo contrário, parece descontínuo e/ou múltiplo devido ao acoplamento com os tecidos moles circundantes. Este efeito é particularmente forte para pessoas com espessura de tecido mole pequena (menos de 4 mm) ou grande (mais de 10 mm) (denotada ST.Th).
Como exposto anteriormente, o ponto chave é encontrar a posição correta da sonda. No entanto, a posição deve ser não apenas correta, mas também estável, a fim de realizar média e desvio padrão para uma série de 10 aquisições. Na maioria dos casos, encontrar um estábulo leva menos de 1 minuto, e a medição completa de um paciente duraria cerca de 5 minutos. Mesmo que o protocolo padrão descrito neste estudo seja adequado para a maioria dos pacientes, algumas pessoas são mais difíceis de medir; É difícil, mas possível encontrar posições corretas, mas quase impossível encontrar uma estável. Nesse caso, a operadora pode optar por registrar séries mais longas, até 200 aquisições. As melhores aquisições são posteriormente determinadas offline usando parâmetros de qualidade. Essa filtragem deve ser aplicada em tempo real no futuro. Na prática, o operador registra mais séries e/ou aquisições do que as 4 séries de 10 aquisições do protocolo de condição ideal. No entanto, o tempo de medição usual permanece em cerca de 5 minutos para um local, antebraço ou perna. Se, após alguns minutos, a IHM não detectar nenhuma posição correta, a medição é interrompida e é considerada uma falha. Com o dispositivo e protocolo atuais, a taxa de falha foi inferior a 5%25.
O dispositivo atual enfrenta diferentes limitações:
(i)Tamanho e peso: O dispositivo BDAT atual é portátil: cabe na bagagem padrão e pesa cerca de 25 kg. No entanto, esse peso é grande em relação aos mais novos dispositivos ultrassônicos. Um novo design eletrônico pode ser considerado, com a sonda e o processamento do sinal permanecendo os mesmos. No entanto, é possível mover o dispositivo atual, principalmente para pacientes na cama ou em casa com mobilidade limitada.
(ii)Velocidade de aquisição: A taxa de quadros atual é de cerca de 2-4 Hz, o que significa que a exploração da medição é lenta em comparação com a aquisição real em tempo real, ou seja, superior a 25 Hz. Isso pode ser melhorado no futuro, levando em consideração computadores mais rápidos, análise de dados mais rápida e transmissão entre a eletrônica e o computador. Um aumento na velocidade de aquisição melhoraria a facilidade de uso da medição, particularmente a busca pelo posicionamento correto da sonda.
(iii)Espessura do tecido mole: A abordagem atual é limitada por uma grande camada de tecido mole, normalmente superior a 10 mm. Nesse caso, o primeiro sinal que chega está ligado ao trajeto do tecido mole e não ao osso cortical. Assim, o vFAS e o ângulo bidirecional associado não podem ser usados. Da mesma forma, vA0 é muito difícil de medir para grandes camadas de tecidos moles. Sem essas duas velocidades, o problema inverso não pode ser executado. No futuro, outros métodos de correção bidirecional poderão ser aplicados usando técnicas de imagem, por exemplo. Pacientes com grandes camadas de tecidos moles geralmente estão associados à obesidade e ao Índice de Massa Corporal (IMC) maior que 30 kg.m-2.
(iv)Regularidade do guia de ondas: A abordagem do problema inverso supõe um guia de ondas regular com vários caminhos de propagação. Para pacientes osteoporóticos, a interface cortical interna pode ser irregular e, portanto, implica em imagens de espectro de onda mal guiadas, principalmente na parte inferior. Esses pacientes geralmente estão associados a alta ambiguidade da solução. Se o tecido mole ou o mau posicionamento não puderem ser considerados como a origem da imagem de espectro pobre, e se o valor do parâmetro lowk for baixo, o guia de ondas é supostamente irregular e a solução de menor espessura é considerada. Abordagens baseadas em aprendizado de máquina, que não necessita de modelagem física, também podem ser utilizadas29.
Como discutido na introdução, o padrão-ouro atual para a detecção de pacientes com risco de fratura por fragilidade é a DXA, que enfrenta algumas limitações: seu grande tamanho, baixa disponibilidade em algumas regiões, custo relativamente alto e eficácia relativamente moderada. As primeiras limitações podem ser mitigadas com dispositivos ultrassônicos, conhecidos por sua portabilidade e custos atraentes. No entanto, a capacidade de detectar efetivamente pacientes em risco deve ser pelo menos equivalente à DXA. Na realidade, às vezes espera-se que seja maior do que a DXA para justificar a adaptação da maioria das referências (decisões médicas, tratamento, custos, quartos, etc.) vinculadas ao padrão-ouro. É por isso que alguns dispositivos ultrassônicos propõem substitutos umBMD 10,11,42. No entanto, uma desvantagem dos parâmetros clínicos, como DMMOa e também vFAS, é a integração de diferentes propriedades ósseas corticais. É por isso que pontos de vista complementares são propostos por outros aparelhos ultrassônicos, incluindo o BDAT, propondo parâmetros que podem ser mais facilmente interpretados pelo médico e pelo paciente, como porosidade cortical, espessura ou distribuição porométrica9. Esses parâmetros refletem propriedades geométricas e materiais: o osso cortical pode ser potencialmente avaliado em termos de variações independentes de quantidade ou qualidade. Esse ponto de vista pode ser muito útil para explorar diferentes causas possíveis de fragilidade óssea. Por exemplo, as fraturas por fragilidade intra ou extracapsular do quadril, ou seja, locais de fratura do colo do fêmur ou do trocânter, devem ter diferentes origens médicas43. Da mesma forma, poderia ser possível seguir diferentes medicamentos visando diferentes efeitos no osso cortical, bem como em termos de quantidade ou qualidade3.
Ressalta-se que a precisão obtida com o BDAT para espessura cortical (0,1 mm) é melhor do que outros métodos ultrassônicos, geralmente acima de 0,25 mm44. Essa diferença se deve em parte ao fato de que o problema inverso do BDAT leva em consideração variações geométricas e materiais combinadas. Algumas outras abordagens, como na ecocardiografia de pulso, consideram propriedades únicas do material ósseo para todos os pacientes10,44. Este valor de precisão, cerca de 0,1 mm (CV cerca de 3%), é de fato crucial para discriminar com precisão entre os pacientes, pois a faixa de espessura é inferior a 2 mm. A precisão na porosidade cortical (1%, CV cerca de 14%) ainda não é tão boa quanto a espessura. No entanto, melhorias significativas já foram observadas em relação ao estudo de reprodutibilidade anterior22. Pode-se esperar que melhorias semelhantes possam ser alcançadas em um futuro próximo, graças a futuras melhorias na IHM, principalmente em termos de taxa de quadros mais próxima do tempo real.
O BDAT pode ser usado em larga escala para triagem populacional em regiões onde o DXA não está amplamente disponível. Além disso, os resultados clínicos mais recentes mostraram o potencial de que o BDAT poderia ser ainda mais eficiente do que o DXA. No entanto, esses resultados devem ser confirmados com a inclusão de mais pacientes. O próximo desafio deve ser estudos multicêntricos e/ou longitudinais11,12. No entanto, o dispositivo BDAT ainda é um protótipo disponível para colaboração científica, pois já foi feito na Alemanha23 e no Reino Unido24. São necessários esforços para a industrialização da próxima geração de dispositivos BDAT, que certamente seriam mais rápidos e portáteis.
Divulgações
Os autores não declaram conflitos de interesse.
Agradecimentos
Este estudo foi financiado pelos projetos chilenos ANID / Fondecyt / Regular 1201311 e 1241091. Os autores gostariam de agradecer à empresa BleuSolid por seu apoio durante as últimas melhorias da IHM e à Geropolis pela sala de filmagem.
Materiais
| Name | Company | Catalog Number | Comments |
| Computer | Notebook HP | mod Zbook (16 Go RAM, Inrel Core i7) | to receive the sampled signals and applying the signal processing steps. Results are displayed in quasi real time (up to 4 per second) through a dedicated Human Machine Interface (HMI, BleuSolid, Pomponne, France) allowing the measurement guidance; |
| Electric insulation transformer | REOMED, Solingen, Germany | IEC / EN 60601-1 | to protect the device, the patient and other devices from any electric hazard |
| Electronic module | Althaïs, Tours, France | in-house | send excitation signals (half a period of negative voltage of 170 V) and discretize received signals (1024 time points per receiver at 20 MHz sampling frequency and 12 bit dynamic) before sending them to the computer. Delays and amplification can be adapted using linear laws in order to optimize data sampling within the accessible ranges. |
| Human Machine Interface | BleuSolid, Pomponne, France | N/A | HMI |
| Pedal switch | Scythe, Germany | USB Foot Switch 2 | to start an acquisition series |
| Ruler | Westcott, USA | 10417 | to locate the measurement site |
| Ultrasonic probe radius | Vermon, Tours, France | in-house | 1 MHz central frequency, 24 receivers with 0.8 mm pitch and two blocks of 5 transmitters with 1 mm pitch. |
| Ultrasonic probe tibia | Vermon, Tours, France | in-house | 0.5 MHz central frequency, 24 receivers with 1.2 mm pitch and two block of 5 transmitters with 1.5 mm pitch |
| Ultrasonic probes | designed according to the bidirectional geometry: a single receiver array surrounded by two transmitter arrays. The three arrays are aligned, mechanically and electrically isolated in order to minimize coupling signals. The probes are adapted to two different sites, one third distal radius and mid tibia. |
Referências
- Curtis, E. M., Moon, R. J., Harvey, N. C., Cooper, C. Reprint of: the impact of fragility fracture and approaches to osteoporosis risk assessment worldwide. Int J Orthop Trauma Nurs. 26, 7-17 (2017).
- Sing, C. W., et al. Global epidemiology of hip fractures: secular trends in incidence rate, post-fracture treatment, and all-cause mortality. J Bone Miner Res. 38 (8), 1064-1075 (2023).
- Choksi, P., Jepsen, K. J., Clines, G. A. The challenges of diagnosing osteoporosis and the limitations of currently available tools. Clin Diabetes Endocrinol. 4, 1-13 (2018).
- El Maghraoui, A., Roux, C. DXA scanning in clinical practice. QJM. 101 (8), 605-617 (2008).
- Maeda, S. S., et al. Challenges and opportunities for quality densitometry in Latin America. Arch Osteoporos. 16, 1-11 (2021).
- Surowiec, R. K., Does, M. D., Nyman, J. S. In vivo assessment of bone quality without x-rays. Curr Osteoporos Rep. 22 (1), 56-68 (2024).
- Whittier, D. E., et al. A fracture risk assessment tool for high resolution peripheral quantitative computed tomography. J Bone Miner Res. 38 (9), 1234-1244 (2023).
- Nyman, J. S., et al. Toward the use of MRI measurements of bound and pore water in fracture risk assessment. Bone. 176, 116863(2023).
- Armbrecht, G., Nguyen Minh, H., Massmann, J., Raum, K. Pore size distribution and frequency-dependent attenuation in human cortical tibia bone discriminate fragility fractures in postmenopausal women with low bone mineral density. J Bone Miner Res Plus. 5 (11), e10536(2021).
- Behrens, M., et al. The Bindex® ultrasound device: reliability of cortical bone thickness measures and their relationship to regional bone mineral density. Physiol Meas. 37 (9), 1528-1540 (2016).
- Cortet, B., et al. Radiofrequency echographic multi-spectrometry (REMS) for the diagnosis of osteoporosis in a European multicenter clinical context. Bone. 143, 115786(2021).
- Olszynski, W. P., et al. Multisite quantitative ultrasound for the prediction of fractures over 5 years of follow-up the Canadian Multicentre Osteoporosis Study. J Bone Miner Res. 28 (9), 2027-2034 (2013).
- Hans, D., Métrailler, A., Gonzalez Rodriguez, E., Lamy, O., Shevroja, E. Quantitative ultrasound (QUS) in the management of osteoporosis and assessment of fracture risk: an update. Adv Exp Med Biol. 1364, 7-34 (2022).
- Weiss, M., Ben-Shlomo, A., Hagag, P., Ish-Shalom, S. Discrimination of proximal hip fracture by quantitative ultrasound measurement at the radius. Osteoporos Int. 11 (5), 411-416 (2000).
- Moilanen, P., et al. Discrimination of fractures by low-frequency axial transmission ultrasound in postmenopausal females. Osteoporos Int. 24, 723-730 (2013).
- Bossy, E., Talmant, M., Defontaine, M., Patat, F., Laugier, P. Bidirectional axial transmission can improve accuracy and precision of ultrasonic velocity measurement in cortical bone: a validation on test materials. IEEE Trans Ultrason Ferroelectr Freq Control. 51 (1), 71-79 (2004).
- Talmant, M., et al. In vivo performance evaluation of bi-directional ultrasonic axial transmission for cortical bone assessment. Ultrasound Med Biol. 35 (6), 912-919 (2009).
- Mitra, M., Gopalakrishnan, S. Guided wave based structural health monitoring: A review. Smart Mater Struct. 25, 053001(2016).
- Minonzio, J. G., Talmant, M., Laugier, P. Guided wave phase velocity measurement using multi-emitter and multi-receiver arrays in the axial transmission configuration. J Acoust Soc Am. 127 (5), 2913-2919 (2010).
- Minonzio, J. G., et al. cortical thickness and porosity assessment using ultrasound guided waves: An ex vivo validation. Bone. 116, 111-119 (2018).
- Vallet, Q., Bochud, N., Chappard, C., Laugier, P., Minonzio, J. G. In vivo characterization of cortical bone using guided waves measured by axial transmission. IEEE Trans Ultrason Ferroelectr Freq Control. 63 (9), 1361-1371 (2016).
- Minonzio, J. G., et al. Ultrasound-based estimates of cortical bone thickness and porosity are associated with nontraumatic fractures in postmenopausal women: a pilot study. J Bone Miner Res. 34 (9), 1585-1596 (2019).
- Minonzio, J. G., et al. Bi-directional axial transmission measurements applied in a clinical environment. PLoS One. 17 (12), e0277831(2022).
- Behforootan, S., et al. Can guided wave ultrasound predict bone mechanical properties at the femoral neck in patients undergoing hip arthroplasty. J Mech Behav Biomed Mater. 136, 105468(2022).
- Rojo, F., et al. Classification of hip fragility fractures in older adults using an ultrasonic device. , IEEE International Ultrasonics Symposium (IUS). Montreal, QC, Canada. (2023).
- Ishimoto, T., et al. Quantitative ultrasound (QUS) axial transmission method reflects anisotropy in micro-arrangement of apatite crystallites in human long bones: A study with 3-MHz-frequency ultrasound. Bone. 127, 82-90 (2019).
- Minonzio, J. G., Foiret, J., Talmant, M., Laugier, P. Impact of attenuation on guided mode wavenumber measurement in axial transmission on bone mimicking plates. J Acoust Soc Am. 130 (6), 3574-3582 (2011).
- Moreau, L., Minonzio, J. G., Talmant, M., Laugier, P. Measuring the wavenumber of guided modes in waveguides with linearly varying thickness. J Acoust Soc Am. 135 (5), 2614-2624 (2014).
- Miranda, D., Olivares, R., Munoz, R., Minonzio, J. G. Improvement of patient classification using feature selection applied to bidirectional axial transmission. IEEE Trans Ultrason Ferroelectr Freq Control. 69 (9), 2663-2671 (2022).
- Foiret, J., Minonzio, J. G., Chappard, C., Talmant, M., Laugier, P. Combined estimation of thickness and velocities using ultrasound guided waves: A pioneering study on in vitro cortical bone samples. IEEE Trans Ultrason Ferroelectr Freq Control. 61 (9), 1478-1488 (2014).
- Granke, M., et al. Change in porosity is the major determinant of the variation of cortical bone elasticity at the millimeter scale in aged women. Bone. 49 (5), 1020-1026 (2011).
- Bochud, N., Vallet, Q., Minonzio, J. G., Laugier, P. Predicting bone strength with ultrasonic guided waves. Sci Rep. 7 (1), 43628(2017).
- Schneider, J., et al. Ex vivo cortical porosity and thickness predictions at the tibia using full-spectrum ultrasonic guided-wave analysis. Arch Osteoporos. 14, 1-11 (2019).
- Ramiandrisoa, D., Fernandez, S., Chappard, C., Cohen-Solal, M., Minonzio, J. G. In vivo estimation of cortical thickness and porosity by axial transmission: Comparison with high resolution computed tomography. , 2018 IEEE International Ultrasonics Symposium (IUS). Kobe, Japan. (2018).
- Schneider, J., et al. In vivo measurements of cortical thickness and porosity at the proximal third of the tibia using guided waves: Comparison with site-matched peripheral quantitative computed tomography and distal high-resolution peripheral quantitative computed tomography. Ultrasound Med Biol. 45 (5), 1234-1242 (2019).
- Araya, C., et al. Real time waveguide parameter estimation using sparse multimode disperse radon transform. IEEE UFFC Latin America Ultrasonics Symposium (LAUS. , Gainesville, FL, USA. (2021).
- Bobak, C. A., Barr, P. J., O'Malley, A. J. Estimation of an inter-rater intra-class correlation coefficient that overcomes common assumption violations in the assessment of health measurement scales. BMC Med Res Methodol. 18 (1), 93(2018).
- Shrout, P. E., Fleiss, J. L. Intraclass correlations: uses in assessing rater reliability. Psychol Bull. 86 (2), 420(1979).
- Zoeller, T. Intraclass correlation coefficient with confidence intervals. , At https://www.mathworks.com/matlabcentral/fileexchange/26885-intraclass-correlation-coefficient-with-confidence-intervals (2010).
- Kilappa, V., et al. Low-frequency axial ultrasound velocity correlates with bone mineral density and cortical thickness in the radius and tibia in pre- and postmenopausal women. Osteoporos Int. 22, 1103-1113 (2011).
- Watson, C. J., de Ruig, M. J., Saunders, K. T. Intrarater and interrater reliability of quantitative ultrasound speed of sound by trained raters at the distal radius in postmenopausal women. J Geriatr Phys Ther. 47 (4), E159-E166 (2024).
- Stein, E. M., et al. Clinical assessment of the 1/3 radius using a new desktop ultrasonic bone densitometer. Ultrasound Med Biol. 39 (3), 388-395 (2013).
- Dinamarca-Montecinos, J. L., Prados-Olleta, N., Rubio-Herrera, R., Del Pino, A. C. S., Carrasco-Buvinic, A. Intra-and extracapsular hip fractures in the elderly: Two different pathologies. Rev Esp Cir Ortop Traumatol. 59 (4), 227-237 (2015).
- Karjalainen, J., Riekkinen, O., Toyras, J., Kroger, H., Jurvelin, J. Ultrasonic assessment of cortical bone thickness in vitro and in vivo. IEEE Trans Ultrason Ferroelectr Freq Control. 55 (10), 2191-2197 (2008).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados