Method Article
Macroscópica de globos no neoplásicos, incluidos los ojos fetales
En este artículo
Resumen
La macroscópica completa y el corte estandarizado de los globos no neoplásicos son importantes para obtener secciones histopatológicas reproducibles de alta calidad. En este documento se proporcionan pautas para una macrodosis estandarizada de globos no neoplásicos adultos y fetales. Se muestran y discuten diferentes opciones para la división del globo, incluidos los criterios para la toma de decisiones basada en casos.
Resumen
La macroscopía y el corte de los globos fetales y adultos son pasos críticos en la evaluación histopatológica de las enfermedades oculares. El manejo adecuado del globo terráqueo es esencial para el diagnóstico preciso de afecciones como tumores y cambios no neoplásicos, incluidos traumatismos, infecciones y procedimientos quirúrgicos previos. La orientación del globo terráqueo es seguida por un examen externo, documentando características que incluyen el tamaño, la forma y cualquier lesión o anormalidad visible. Se debe prestar especial atención a la presencia de tumores, cambios infecciosos o degenerativos, así como signos de traumatismo o cirugía previa. Se registran las mediciones del globo y las estructuras asociadas, incluyendo la córnea y el nervio óptico, y, en los ojos fetales, el desarrollo anatómico y oportuno. La transiluminación es esencial para detectar una sombra, que puede ser causada por una masa o hemorragia, así como por una mayor transmisión de luz en áreas de atrofia, como el coloboma.
La fijación del globo se realiza de forma rutinaria en paraformaldehído al 4% para preservar el tejido. Después de la fijación durante 24 h, el globo se secciona sistemáticamente para examinar las estructuras intraoculares, como la cámara anterior, el estado del cristalino, la úvea, la retina, el vítreo y el nervio óptico. El globo del adulto suele dividirse en trisecciones a lo largo del plano horizontal o, según las indicaciones clínicas, vertical/oblicuo para crear una sección del nervio óptico pupilar (PO). Se pueden tomar secciones adicionales de las calotas para evaluar áreas de interés, como masas sospechosas o áreas de atrofia. Para fines de investigación, se pueden considerar varios protocolos de fijación y seccionamiento.
Cada sección macroscópica se inspecciona, documenta y procesa cuidadosamente para su examen microscópico para garantizar que cualquier hallazgo patológico se muestree adecuadamente. La macroscopia y el seccionamiento precisos son fundamentales para correlacionar los hallazgos clínicos e histológicos, facilitar el diagnóstico, guiar las decisiones de tratamiento y, en última instancia, mejorar los resultados de los pacientes. La estandarización de la macroscopía y el seccionamiento garantiza una evaluación integral del globo ocular y contribuye al avance de la oftalmología.
Introducción
El examen macroscópico y la sección de los globos oculares son procedimientos esenciales en la patología oftálmica, ya que proporcionan información valiosa sobre diversas enfermedades oculares y la cicatrización de heridas despuésde la cirugía. El ojo, como órgano altamente especializado, es propenso a una amplia gama de cambios fisiopatológicos y/o patológicos, incluyendo tumores (p. ej., melanoma uveal, retinoblastoma), procesos inflamatorios (p. ej., uveítis, endoftalmitis) y enfermedades neurodegenerativas (p. ej., glaucoma, degeneración macular relacionada con la edad)2,3,4. La cicatrización de heridas después de procedimientos quirúrgicos también puede resultar en complicaciones que amenazan la visión.
Los ojos de adultos que se evalúan en un laboratorio de patología oftálmica generalmente se enuclean por razones clínicas, como un tumor o un ojo ciego y doloroso. En la mayoría de los países, la investigación de los ojos de los donantes a partir de autopsias se limita a los proyectos de investigación. Por el contrario, los ojos fetales y neonatales suelen ser muestras de autopsia (a excepción de los ojos con sospecha clínica de tumor intraocular)5,6. Así, los ojos fetales y neonatales se investigan en relación con los hallazgos de otras disciplinas, como la patología pediátrica o como parte de una autopsia forense7. Tanto para el ojo fetal como para el adulto, el conocimiento de la historia del paciente antes de la macroscopía es fundamental para comprender la indicación del análisis histopatológico, lo que tiene un impacto significativo en la forma en que el ojo sedocumenta y secciona (foto)1,3.
Sin embargo, el examen macroscópico, el seccionamiento y la documentación precisos no solo son críticos para la evaluación histopatológica, que contribuye al diagnóstico, pronóstico y manejo de las enfermedades oculares, sino también para los casos forenses (por ejemplo, traumatismo craneoencefálico abusivo o aspectos médico-legales)8,9. Durante la macroscopia, se realiza un examen externo exhaustivo del globo bajo un microscopio de disección o un microscopio de cirugía oftálmica desechado, centrándose en características como el tamaño, la forma y las características de la superficie (Figura suplementaria S1). Las mediciones de todo el globo (antero-posterior, horizontal y vertical), la córnea y el nervio óptico deben realizarse cuidadosamente con una regla de calibración y documentarse (Figura 1). Los músculos oblicuos y la arteria ciliar horizontal son útiles para orientar el globo. Las suturas restantes pueden ser indicativas de un procedimiento quirúrgico y no es necesario retirarlas durante la macroscopia. Sin embargo, algunos cirujanos colocan una sutura en uno de los músculos rectos durante la enucleación, lo que puede ser útil no solo para la extirpación del globo, sino también para la orientación (si se informa de la localización). La documentación precisa de cualquier lesión, decoloración u otra anomalía es crucial, ya que estos hallazgos pueden proporcionar pistas tempranas sobre la patología subyacente. La transiluminación es obligatoria para detectar tumores intraoculares o defectos del desarrollo, como los colobomas, e identificar el sitio de un procedimiento quirúrgico previo.
El corte del globo se realiza generalmente después de la fijación en paraformaldehído al 4% (PFA al 4%) o formalina al 10% para preservar la arquitectura del tejido. La fijación rutinaria con PFA al 4% se realiza durante 24 h. Para la microscopía electrónica, se pueden utilizar fijadores alternativos para muestras de investigación, por ejemplo, el fijador de Karnovsky (incluido el glutaraldehído) o el glutaraldehído al 2,5%. No se recomienda una incisión o inyección de fijador, ya que causa artefactos innecesarios. Sin embargo, para fines de investigación, el globo puede abrirse para tener una mejor penetración de PFA, en particular, para la fijación de la retina, pero esto no es aconsejable para muestras de rutina. En cuanto a los ojos de los donantes, pueden ser macroscópicos en su totalidad o tras la extracción de un botón esclerocorneal para un banco de ojos.
La elección del plano de corte (horizontal, vertical u oblicuo) depende de la sospecha clínica y de las estructuras anatómicas de interés, incluyendo sitios de cirugía previa (p. ej., trabeculectomía para glaucoma, generalmente en la posición de las 12 en punto)10. De forma rutinaria, se secciona un globo en el meridiano horizontal para obtener una sección del nervio óptico-pupilar (sección PO) con la córnea, la pupila, el cristalino, la mácula y el nervio óptico en una sección. También se puede lograr una sección PO si se realiza una sección vertical u oblicua. Sin embargo, en este escenario, la mácula no aparecerá en la misma sección que el nervio óptico. La sección PO es el estándar de oro para el examen histopatológico.
Después de la macroscopia y el seccionamiento, las estructuras intraoculares se inspeccionan, fotodocumentan y describen minuciosamente (Figura 1). Cada estructura ocular (córnea, estado del cristalino, iris, cuerpo ciliar, coroides, retina, cuerpo vítreo, nervio óptico) debe examinarse por separado. Siempre que sea posible, se debe obtener una sección transversal del nervio óptico y presentarla por separado. Todo este examen proporciona la base para al menos una correlación macroscópica-histológica, si no una correlación clínico-patológica.
Por lo tanto, un proceso preciso de macroscopía y seccionamiento es muy relevante en la práctica clínica, ya que los globos enucleados se someten a análisis histopatológico después de un traumatismo grave, sospechas de malignidades o infecciones resistentes al tratamiento. Un protocolo de examen macroscópico estandarizado permitirá a los patólogos oftálmicos rastrear la historia de un globo para proporcionar los diagnósticos histopatológicos más precisos con relevancia no solo para el ojo del paciente, sino también para futuros pacientes. El siguiente protocolo describe y documenta el manejo de ojos fetales y adultos (no neoplásicos) para el diagnóstico clínico de rutina, las investigaciones forenses y los enfoques de investigación.
Protocolo
Asegúrese de seguir las instrucciones de seguridad cuando manipule muestras fijadas en formol, ya que irrita la piel, es cancerígena y embriotóxica 11,12,13.
1. Orientación
- Identifique los cuatro músculos rectos (Figura 2A).
- Identificar el músculo oblicuo superior por su aspecto tendinoso (Figura 2B). Se inserta en la esclerótica en la superficie posterotemporal del globo muy cerca de la inserción del músculo recto superior.
- Identificar el músculo oblicuo inferior. Se inserta temporalmente inferiormente en la esclerótica entre el músculo recto lateral y el nervio óptico (Figura 2C).
- Identificar la arteria ciliar posterior larga (Figura 2B).
NOTA: En los ojos fetales, la arteria ciliar posterior larga es fundamental para identificar el meridiano horizontal, ya que los músculos no son tan prominentes como enlos ojos de los adultos. - Determine la lateralidad del globo terráqueo con precisión basándose en los pasos 1.1.1-1.1.3 (ojo derecho frente a ojo izquierdo).
2. Recaudación
- Mida el diámetro antero-posterior (diámetro AP), así como el diámetro horizontal y vertical en mm (Figura 3A,B).
NOTA: En el caso de los ojos fetales, el diámetro del PA debe compararse con un nomograma para evaluar la microftalmia7. - Describa cualquier anormalidad del aspecto externo del globo terráqueo, incluidas, entre otras, cicatrices, suturas, material médico extraño (por ejemplo, banda envolvente para el desprendimiento de retina o dispositivo de drenaje para glaucoma), cuerpos extraños, deformación (Figura 4A-D).
- Mida la córnea en su diámetro horizontal y vertical en mm (Figura 3A).
- Describa el aspecto de la córnea incluyendo, pero no limitado a, transparencia, cicatrices, signos de queratoplastia, suturas, vascularización (Figura 3A).
- Describa el iris (si es visible) con respecto al color, la configuración de la pupila y las posibles anomalías. Utilice la transiluminación para evaluar los defectos del iris (relacionados con traumatismos o anomalías congénitas).
- Mida la longitud del nervio óptico y las anomalías (p. ej., hemorragia en las vainas del nervio óptico) (Figura 3B).
- Si es posible, haga una sección transversal a través del nervio óptico y preséntela por separado.
- Transilumine el globo terráqueo utilizando un tubo LED con especial énfasis en los defectos del iris y una sombra escleral que podría ser el resultado de un tumor, una hemorragia o un material extraño (Figura 3C, D).
- Realizar documentación fotográfica del globo terráqueo.
3. Sección de muestras de rutina
- Coloque la córnea del globo hacia abajo (Figura 5A).
- Marque el meridiano horizontal o el plano de la sección con un bolígrafo (Figura 5A-C) de modo que la sección esté cerca del nervio óptico y atraviese la córnea periférica. Esto también se aplica si la sección es vertical o sagital.
NOTA: No corte a través de las áreas de interés, en su lugar corte cerca de ellas, de lo contrario, es posible que no se cubran en la sección histológica a medida que el tejido se encoge a través del procesamiento posterior. - Seccione cuidadosamente con una hoja de micrótomo a lo largo de la línea marcada, sosteniendo el globo con la otra mano.
NOTA: No es necesario eliminar el material iatrogénico, como una banda envolvente (Figura 4). - Retire la calota e inspeccione cuidadosamente para detectar anomalías (Figura 5D). Almacene en formol o envíelo para su posterior procesamiento histológico. Si el globo terráqueo se llena de aceite de silicona (utilizado como taponamiento) durante la cirugía de desprendimiento de retina, cuide el equipo, ya que es bastante pegajoso.
- Para el melanoma uveal, extirpe la vena del vórtice; En los ojos no tumorales, esto no se hace de forma rutinaria.
- Inspeccionar las estructuras oculares internas: cámara anterior; estado del cristalino (fáquico o pseudofáquico, afáquico, catarata, catarata secundaria); iris; cuerpo ciliar; coroides; retina central; retina periférica; nervio óptico (p. ej., atrofia); esclerótica (puede engrosarse en los ojos tisilos o adelgazarse en un traumatismo o estafiloma).
- Retire la otra calota para obtener una sección de PO adecuada (Figura 5E y Figura 6A); Coloque el globo abierto con cuidado con la abertura hacia abajo.
- Sostenga el globo terráqueo con una mano y sepárelo en una dirección paralela (pero por encima del nervio óptico y, nuevamente, idealmente a través de la córnea periférica). El globo es menos estable una vez abierto.
- Retire la calota e inspeccione cuidadosamente en busca de anomalías. Almacene en formol o envíelo para su posterior procesamiento histológico (Figura 6).
- Realizar la documentación fotográfica de la sección de PO y enviarla para su posterior procesamiento histológico.
4. Sección de muestras fetales
NOTA: Estos son solo ajustes al protocolo principal descrito en las secciones 1 (orientación), 2 (macroscópica) y 3 (sección de muestras de rutina).
- Coloque el globo terráqueo con la córnea hacia abajo.
- Identifique la arteria ciliar posterior larga comprimiendo suavemente el globo (Figura 7).
- Disecciona el globo horizontalmente cerca del nervio óptico, ejerciendo una ligera presión sobre la hoja del micrótomo. Asegúrese de que la periferia de la córnea también esté dentro de la sección.
NOTA: No se recomienda la trisección debido al pequeño tamaño del globo fetal. - Evalúe minuciosamente las estructuras intraoculares y documéntelas fotográficamente como se describe en el paso 3.6.
NOTA: Se debe prestar especial atención a las estructuras fetales (p. ej., vasculatura fetal) o a las anomalías del desarrollo (p. ej., coloboma). - Envíe la parte principal del globo para su posterior procesamiento.
- Archive el calotte restante en formol o envíelo para su posterior procesamiento.
5. Sección de muestras forenses
- Familiarícese con la pregunta forense antes de seccionar. En patología forense, prepárese para analizar toxicológicamente partes del globo terráqueo (vítreo) o utilícelas para estimar el tiempo transcurrido desde la muerte (córnea)2,14.
- En el caso de un traumatismo craneal abusivo (AHT, por sus siglas en inglés), realice una disección horizontal seguida de una inspección exhaustiva y una fotodocumentación de las hemorragias de la retina y las hemorragias de la vaina del nervio óptico. Realice una tinción de hierro (por ejemplo, la tinción azul de Prusia de Perl) para evaluar los signos de hemorragias ya degradadas.
NOTA: Un protocolo más detallado es proporcionado por Gilliland et al. quienes recomiendan la extracción y análisis de los ojos y su contenido orbital15.
Hay muchas otras condiciones que conducen a hemorragias de retina en un recién nacido, además de AHT 7,16,17,18,19,20. - Para preguntas relacionadas con la cirugía (p. ej., endoftalmitis4), realice la disección horizontal del globo y la evaluación como se describe en la sección 3. En el caso de los ojos con antecedentes de trabeculectomía, realice una sección vertical cerca del sitio de la ampolla (que puede ser una entrada para las bacterias).
- Cuerpos extraños: Mida y fotografíe el objeto y su ubicación in situ o en el espacio vacío donde se alojó el objeto (los cuerpos extraños metálicos deben eliminarse antes del corte ya que no se pueden seccionar). Describa el color, la forma y la consistencia. Mantenga el cuerpo extraño almacenado, ya que puede ser reinvestigado con fines legales.
6. Enfoques alternativos
NOTA: Se puede utilizar un enfoque alternativo si es necesario examinar la retina antes de seccionar 10,21,22. Este enfoque es similar a los globos de donantes en los que se ha extraído tejido esclerocorneal para un banco de ojos.
- Utilice un bisturí y corte circunferencialmente dentro de la pars plana (Figura 8A).
- Extraer el segmento anterior (córnea, reborde escleral, cristalino), bisectar y someter a evaluación histopatológica de rutina (Figura 8B).
- Visualizar la retina e imagenizarla multimodalmente (antes y/o después de la fijación) (Figura 8B).
- Retire ambas calotas para un procesamiento posterior de rutina. Como el segmento anterior ya ha sido extirpado, el globo restante es inestable; Por lo tanto, estabilícelo de forma segura con una mano mientras retira la calota como se describe en los pasos 3.1-3.4.
- Evalúe minuciosamente las estructuras intraoculares y fotografíelas como se describe en el paso 3.6.
- Retire la segunda calota como se describe en los pasos 3.7-3.10 (Figura 8D).
NOTA: En el caso de los especímenes de investigación únicamente, son posibles otros enfoques21.
7. Tratamiento posterior
- Después del procesamiento rutinario y la inclusión en parafina, prepare secciones escalonadas de 5 μm de espesor hasta que el nervio óptico y la mácula estén en la sección.
- Determine individualmente la distancia entre las secciones de escalón.
NOTA: Esta distancia entre las secciones escalonadas es rutinariamente de ~250 μm en nuestro laboratorio de patología oftálmica. - Preparar secciones en serie para globos de investigación. Si se necesitan tinciones inmunohistoquímicas, monte las secciones en portaobjetos recubiertos.
Resultados
Después de la orientación, debería ser factible determinar la lateralidad para los ojos de los adultos. Sin embargo, esto suele ser imposible para los ojos fetales. La lateralidad es importante para confirmar que se ha extirpado el ojo correcto y que coincide con el informe. Se documentan las mediciones antes del corte. En particular, para los ojos fetales, un nomograma es útil para descartar anomalías del tamaño ocular como la microftalmia.
Con base en la historia del paciente y la transiluminación, se planifica la sección . El globo generalmente se secciona horizontalmente, lo que requiere una identificación adecuada del plano horizontal como se describió anteriormente. Si hay áreas específicas de interés (p. ej., coloboma, lesiones insospechadas identificadas en la transiluminación o sitios quirúrgicos como la trabeculectomía), el corte se adapta respectivamente. El resultado objetivo del seccionamiento es una sección de PO adecuada (Figura 5 y Figura 6).
Un globo terráqueo mal seccionado dificulta una correlación clinicopatológica precisa y una interpretación de los hallazgos histológicos, con un impacto potencial en el seguimiento del paciente. Por ejemplo, uno de los diagnósticos más amenazantes a considerar es la oftalmía simpática23 , una inflamación granulomatosa crónica bilateral de la úvea que puede conducir a la ceguera del ojo restante (ojo simpático). Esta entidad debe ser descartada en todos los globos y, en particular, en los ojos ciegos y dolorosos. Dado que esto es fundamental para preservar el ojo restante, las secciones representativas del globo son obligatorias para la evaluación, preferiblemente como secciones PO.
En el caso de que se realice erróneamente un corte a través de toda la córnea en lugar de seccionar la periferia, presentar la calota con córnea y segmento anterior y la sección de PO fallida. La segunda calota debe retirarse como se describió anteriormente para que el globo quepa en el casete. En particular, los ojos ftísicos pueden exhibir metaplasia ósea del epitelio pigmentario de la retina, lo que hace casi imposible seccionar el globo. Descalcifique el globo en ácido nítrico al 5% durante 24 h seguido de una solución de litio o sulfato de sodio al 5% durante 24 h, almacene en agua del grifo durante 24-48 h y vuelva a intentar cortar el globo. Repita la descalcificación hasta que se pueda seccionar el globo. Por último, se debe realizar una fotodocumentación de cada globo terráqueo. Esto no es solo por razones forenses, sino que también es útil si ocurren hallazgos histológicos inesperados.
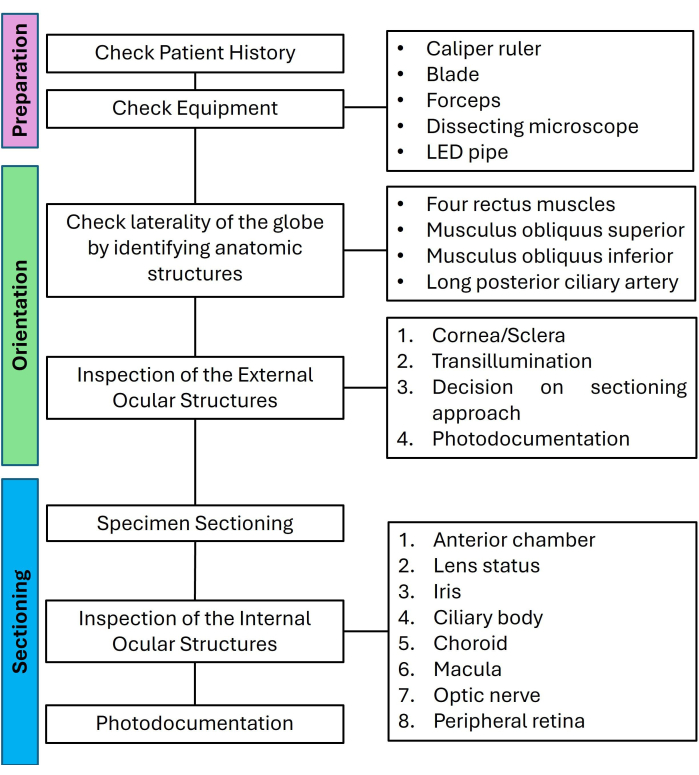
Figura 1: Diagrama de flujo para la preparación, orientación y seccionamiento de ojos no tumorales que enumera los pasos relevantes en un enfoque similar a una lista de verificación. Abreviatura: LED = diodo emisor de luz. Haga clic aquí para ver una versión más grande de esta figura.
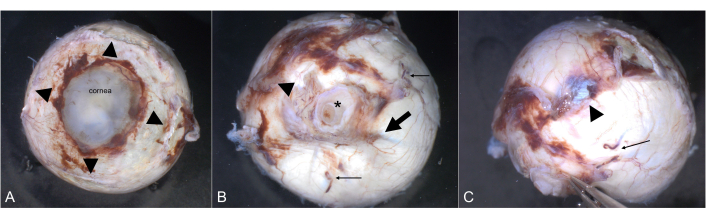
Figura 2: Orientación. La córnea es claramente visible desde una vista anterior. (A) Las inserciones de los cuatro músculos rectos están resaltadas por puntas de flecha. (B) El nervio óptico (asterisco) es visible desde una vista posterior. La arteria ciliar larga (flecha) marca el meridiano horizontal. La inserción típicamente carnosa del músculo oblicuo inferior (punta de flecha) es aproximadamente temporal. Dos de las venas del vórtice están resaltadas por flechas finas. (C) La inserción tendinosa del músculo oblicuo superior (punta de flecha) es superior entre el músculo recto superior y el nervio óptico. Una veta de vórtice está marcada por una flecha delgada. Haga clic aquí para ver una versión más grande de esta figura.
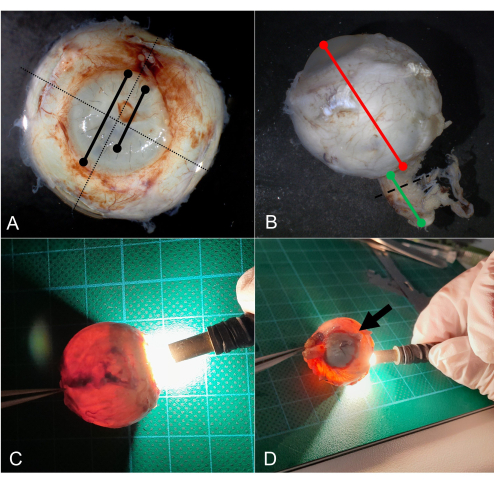
Figura 3: Grossing. (A) Medición del diámetro horizontal y vertical en mm (línea punteada). Medición del diámetro de la córnea, y por ejemplo, el diámetro de la queratoplastia. (B) Mida el diámetro antero-posterior en mm (línea roja) y la longitud del nervio óptico (línea verde). El nervio óptico se secciona transversalmente (línea punteada) y se presenta por separado para su posterior procesamiento. (C) Transiluminación regular de un globo por una luz LED. (D) En la transiluminación, se ve una sombra causada por un tumor coroideo (flecha). Abreviatura: LED = diodo emisor de luz. Haga clic aquí para ver una versión más grande de esta figura.
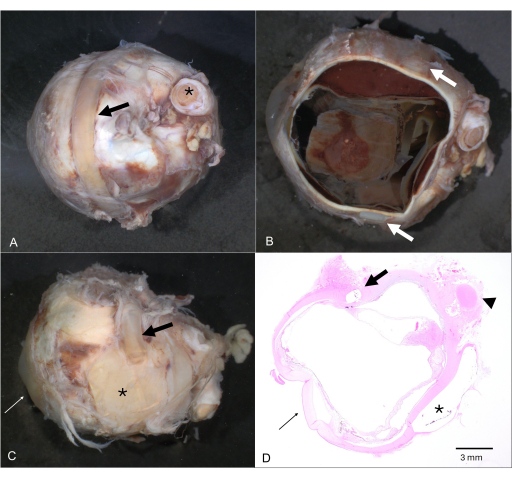
Figura 4: Material extraño extraocular. (A) Globo terráqueo con una banda/cerclaje circundante (flecha; el nervio óptico está marcado con un asterisco). (B) Después de la disección horizontal, la banda circundante todavía está unida al globo (flechas). (C) Múltiples aplicaciones de materiales extraños externos para la cirugía de desprendimiento de retina histórica que consisten en placas (asterisco) y varias hebillas esclerales (flecha). (D) La sección correspondiente de hematoxilina y eosina muestra la ubicación intraescleral de una hebilla (flecha), así como la imagen negativa de una placa extraescleral (asterisco). La córnea está marcada en C y D por una flecha delgada y el nervio óptico por una punta de flecha en D. Haga clic aquí para ver una versión más grande de esta figura.
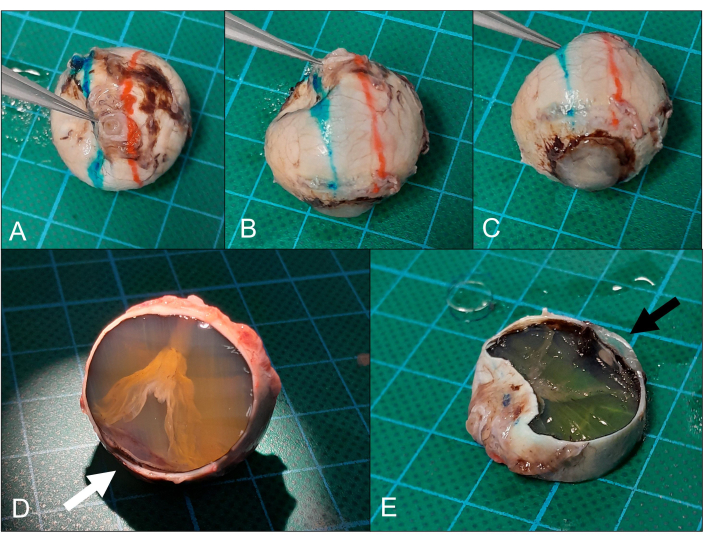
Figura 5: Seccionamiento. (A) El globo se coloca la córnea hacia abajo (el mismo ojo que en la Figura 2) y (B) se marcan los planos de sección superior (rojo) e inferior (azul). (C) El plano de la sección pasa idealmente a través de la córnea periférica/área limbal. (D) Después de la extirpación del calotte superior, se puede ver un desprendimiento de retina en forma de embudo. La sección solo está cerca de la córnea periférica (flecha), pero también es suficiente para el análisis. (E) La extirpación de la calota inferior (nótese la córnea periférica en la sección, flecha) produce la sección prevista del nervio óptico pupila. Haga clic aquí para ver una versión más grande de esta figura.
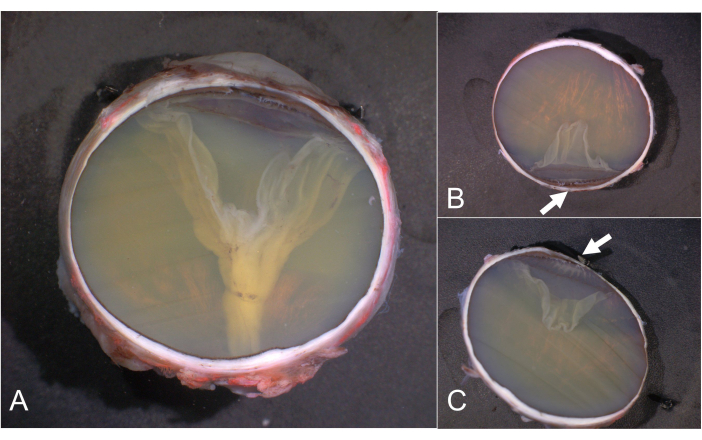
Figura 6: Secciones de PO y calotas. (A) sección de PO, (B) calotta superior y (C) inferior. La pars plicata del cuerpo ciliar está resaltada por flechas en B y C. Los calottes sin detalles clínicamente relevantes no tienen que ser procesados más y, en su lugar, se archivan. Abreviatura: PO = nervio óptico pupilal. Haga clic aquí para ver una versión más grande de esta figura.
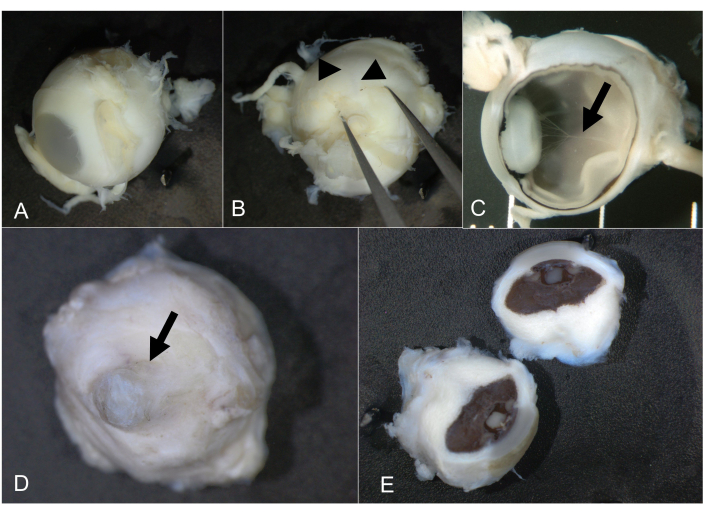
Figura 7: Ojos fetales y microftálmicos. (A) Ojo fetal normal, de 21 semanas de gestación y 10 mm de diámetro AP. (B) Empujar suavemente con fórceps revela la arteria ciliar posterior larga (puntas de flecha), que indica el meridiano horizontal. (C) Después de la bisección, se pueden inspeccionar las estructuras intraoculares, incluida la arteria hialoidea (flecha). (D) Ojo microftálmico de un adulto. La córnea está resaltada por una flecha. (E) Los globos fueron divididos en dos; No se pudo identificar la arteria ciliar posterior larga. Abreviatura: AP = anterioposterior. Haga clic aquí para ver una versión más grande de esta figura.
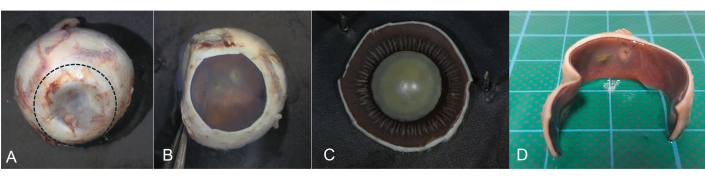
Figura 8: Incisión coronal. Una incisión coronal es útil si se pretende obtener imágenes postmortem del fondo de ojo. Durante la transiluminación, la pars plana del cuerpo ciliar se puede identificar como una estructura circular en forma de banda. (A) Con un bisturí, se realiza una incisión circular en el área de la pars plana (línea punteada) y se extirpa el segmento anterior. (B) La retina y el nervio óptico pueden ser documentados y fotografiados. (C) A continuación, se investiga el segmento anterior por separado. (D) Sección horizontal con el segmento anterior extirpado. Haga clic aquí para ver una versión más grande de esta figura.
Figura suplementaria S1:Unidad de microscopio de disección. Unidad de trabajo con un microscopio de cirugía oftálmica desechado. (A) Un tubo LED (flecha) y el equipo necesario para el tallado y seccionado. Los materiales necesarios son (B) regla, regla de calibre, pinzas y (C) micrótomo/cuchillas de afeitar. Para el corte de globos adultos, se recomiendan hojas de micrótomo (derecha); Para los ojos fetales u otros especímenes oculares, las hojas de afeitar (izquierda) son suficientes. (D) Microscopio de disección con una cámara conectada para documentar el espécimen. Haga clic aquí para descargar este archivo.
Discusión
Este protocolo tiene como objetivo estandarizar el examen macroscópico de los globos oculares no neoplásicos. Las guías macroscópicas en la literatura se centran principalmente en los ojos con tumor intraocular 24,25. Los respectivos protocolos de seccionamiento se encuentran en el sitio web de la Academia Americana de Oftalmología26, en varios sitios web universitarios, en el sitio web del Colegio Americano de Patólogos, así como en los libros de texto de patología oftálmica 7,10. También existen protocolos específicos para fines de investigación, por ejemplo, la fluorescencia de la lámina de luz para la vasculatura ocular 27,28,29.
Hasta donde sabemos, no existe una directiva publicada para la macrodosis sistemática de globos enucleados no tumorales. En particular, nuestra guía tiene como objetivo mejorar la evaluación de las muestras de enucleación, que difiere de los ojos tumorales en que el enfoque principal de la investigación puede no estar predeterminado. Además, los ojos no tumorales suelen tener una larga historia ocular, incluida la cirugía, con múltiples cambios intraoculares que dilucidan la fisiopatología de las enfermedades oculares y la cicatrización de heridas. La evisceración (las estructuras intraoculares se extirpan mientras la esclerótica y el nervio óptico permanecen en el paciente) no permite una ubicación precisa de los hallazgos oculares.
En los casos en los que se requiere la enucleación para indicaciones distintas a un tumor, todas las demás opciones de tratamiento disponibles han fracasado y los pacientes generalmente informan un ojo ciego y doloroso debido a un glaucoma secundario (por ejemplo, después de una retinopatía diabética proliferativa o una oclusión de la vena central de la retina), traumatismo ocular grave, enfermedades de la córnea perforante no controladas o cirugía frustrante de desprendimiento de retina (que se ha vuelto rara debido a las técnicas mejoradas de cirugía de retina). Como la oftalmología es una disciplina quirúrgica altamente especializada, existen muchas opciones para preservar la visión de los pacientes o al menos mantener el ojo en un estado indoloro y las razones mencionadas anteriormente para la enucleación son afortunadamente raras. Muchos pacientes que se someten a una enucleación tienen, por lo tanto, antecedentes de múltiples intervenciones quirúrgicas como queratoplastia, reducción de la presión o cirugía de retina. El rastreo de la historia clínica del paciente, que no siempre se menciona en detalle en el formulario de solicitud de patología, es fundamental para la decisión sobre cómo seccionar el ojo.
Un examen exhaustivo de las muestras de enucleación mejora la atención al paciente al comprender mejor las afecciones oculares graves que pueden conducir a este procedimiento quirúrgico definitivo. La macroscópica adecuada también mejora la correlación entre las imágenes multimodales y los hallazgos histológicos, como lo describe Eagle21. Además, el examen macroscópico de globos tiene un gran valor educativo, ya que ayuda a los estudiantes y residentes a comprender mejor la complejidad y el alcance de diversas enfermedades oculares y las implicaciones de las intervenciones quirúrgicas.
En el caso de los ojos fetales, el examen estandarizado ayuda a realizar un diagnóstico morfológico exacto de las malformaciones oculares. Junto con los otros hallazgos obtenidos durante la autopsia fetal, a menudo permite una clasificación exacta de un síndrome y, por lo tanto, un mejor asesoramiento genético para los padres sobre el riesgo de recurrencia en embarazos posteriores.
La colocación correcta de la muestra es un paso crítico en la aplicación de este protocolo. Un error en esta fase del examen puede comprometer la descripción y localización de los hallazgos, produciendo un informe incorrecto. Un factor clave limitante de este método es la preservación del globo. Un espécimen que se deja sin formalina durante muchas horas puede mostrar signos de autólisis, lo que puede comprometer la evaluación histopatológica, incluida la tinción inmunohistoquímica1. Además, las distorsiones arquitectónicas, que a menudo se encuentran en los ojos fantásticos, pueden dificultar la posición correcta del globo y hacer una incisión precisa y simétrica. Para superar esto, busque las estructuras anatómicas clave.
En conclusión, proponemos un protocolo sistemático para un examen integral de los ojos enucleados, con el objetivo de mejorar la atención al paciente a través de una mayor precisión diagnóstica y brindar oportunidades educativas. Nuestro enfoque se centra en la correcta identificación de las estructuras anatómicas y la orientación espacial del espécimen, asegurando una correcta valoración y documentación de las alteraciones patológicas. La estandarización del examen macroscópico de los globos no neoplásicos debe implementarse en los laboratorios de patología para mejorar la patología oftálmica descriptiva y diagnóstica con fines clínicos y educativos y apoyar futuros estudios sobre correlaciones clinicopatológicas.
Divulgaciones
Martina C. Herwig-Carl es coautora del libro "Fetal and Neonatal Eye Pathology", Springer 2020; Secretario de la Sociedad Internacional de Patología Oftálmica (ISOP); Miembro del comité de la sección "patología oftalmológica" de la Sociedad Alemana de Oftalmología (DOG); Miembro del "Comité del Programa de la Reunión Anual" de ARVO para la sección "Anatomía Patológica (AP)". Frank G. Holz: Acucela (C,F,R), Alcon (C,F,R), Alexion, Apellis (C,R), Allergan/AbbVie company (F,R), Bayer (C,F,R), Boehringer Ingelheim (C), CenterVue (F), Ellex (R), Genentech/Roche (C,F,R), Geuder (C), Grayburg Vision (C,R), Kanghong (C,F), Heidelberg Engineering (C,F,R), Lin BioScience (C,R), NightStarX (F), Novartis (C,F,R), Optos (F), Oxurion (C,R), Pixium Vision (C,F,R), Stealth Biotherapeutics (C,R), Zeiss (F,R). Los demás autores no tienen conflictos de intereses que declarar. [C: consultor; F: apoyo financiero; R: destinatario]
Agradecimientos
Este trabajo fue apoyado por el Fondo de Publicaciones de Acceso Abierto de la Universidad de Bonn.
Materiales
| Name | Company | Catalog Number | Comments |
| Caliper ruler | Mauser | out of market | INOX Messchieber 0- 200 mm |
| Dissecting microscope or discarded ophthalmic surgery microscope | Möller Wedel | out of market | |
| Forceps | Fine Science | 11203-23 | SS INOX |
| HistoBond | Marienfeld, Germany | DIN ISO 8037-1 | coated slides |
| LED pipe for transillumination in a dark room | Schott, Mainz | out of market | KL150 |
| Microtome blade | Feather microtome blades | N/A | A35 type |
Referencias
- Torczynski, E. Preparation of ocular specimens for histopathologic examination. Ophthalmology. 88 (12), 1367-1371 (1981).
- Atreya, A., Ateriya, N., Menezes, R. G. The eye in forensic practice: In the dead. Med Leg J. , (2024).
- Herwig-Carl, M. C., Holz, F. G., Löffler, K. U. Die Geschichte eines Auges – Untersuchung enukleierter Bulbi. Der Ophthalmologe. 117 (12), 1171-1179 (2020).
- Herwig-Carl, M. C., Holz, F., Löffler, K. U. Endophthalmitis aus ophthalmopathologischer Sicht. Klin Monbl Augenheilkd. 239 (7), 867-875 (2022).
- Herwig-Carl, M. C., Loeffler, K. U., Müller, A. M. Bedeutung der Untersuchung fetaler Augen : Ergänzung der Fetobduktion. Pathologe. 38 (4), 231-240 (2017).
- Herwig, M. C., Müller, A. M., Holz, F. G., Loeffler, K. U. Analyse eines ophthalmopathologischen Kollektivs humaner fetaler Augen unter besonderer Berücksichtigung außergewöhnlicher Befunde. Der Ophthalmologe. 107 (11), 1051-1058 (2010).
- Verdijk, R. M., Herwig-Carl, M. C. Fetal and Neonatal Eye Pathology. , Springer International Publishing. Cham. (2020).
- Breazzano, M. P., Unkrich, K. H., Barker-Griffith, A. E. Clinicopathological findings in abusive head trauma: analysis of 110 infant autopsy eyes. Am J Ophthalmol. 158 (6), 1146-1154.e2 (2014).
- Watts, P., et al. Abusive head trauma and the eye in infants and children - clinical guideline update by the royal college of ophthalmologists and the royal college of paediatrics and child health: executive summary. Eye (Lond). 38 (10), 1783-1786 (2024).
- Spencer, W. H. Ophthalmic pathology: An atlas and textbook. , Saunders. Philadelphia, PA. (1985).
- Khoshakhlagh, A. H., Mohammadzadeh, M., Sicard, P., Bamel, U. Human exposure to formaldehyde and health risk assessment: a 46-year systematic literature review. Environ Geochem Health. 46 (6), 206(2024).
- Protano, C., et al. The carcinogenic effects of formaldehyde occupational exposure: A systematic review. Cancers. 14 (1), 165(2021).
- Duong, A., Steinmaus, C., McHale, C. M., Vaughan, C. P., Zhang, L. Reproductive and developmental toxicity of formaldehyde: a systematic review. Mutat Res. 728 (3), 118-138 (2011).
- Ang, J. L., Collis, S., Dhillon, B., Cackett, P. The eye in forensic medicine: A narrative review. Asia Pac J Ophthalmol (Phila). 10 (5), 486-494 (2021).
- Gilliland, M. G. F., et al. Guidelines for postmortem protocol for ocular investigation of sudden unexplained infant death and suspected physical child abuse. Am J Forensic Med Pathol. 28 (4), 323-329 (2007).
- Bhardwaj, G., et al. A systematic review of the diagnostic accuracy of ocular signs in pediatric abusive head trauma. Ophthalmology. 117 (5), 983-992.e17 (2010).
- Herwig, M. C., Müller, A. M., Kuchelmeister, K., Loeffler, K. U. Pre- and intraretinal haemorrhages in a 22-week-old fetus of a mother suffering from HELLP syndrome and factor V Leiden mutation with deep vein thrombosis. Acta. 95 (1), e83-e84 (2017).
- Thau, A., et al. Retinal hemorrhage and bleeding disorders in children: A review. Child abuse Negl. 112, 104901(2021).
- Mattheij, M., et al. Retinal haemorrhages in a university hospital: not always abusive head injury. Acta Neurol Belg. 117 (2), 515-522 (2017).
- Maguire, S. A., et al. Retinal haemorrhages and related findings in abusive and non-abusive head trauma: a systematic review. Eye (London). 27 (1), 28-36 (2013).
- Eagle, R. C. Optical coherence tomography: Clinicopathologic correlations - The 2016 Gordon K. Klintworth lecture. Ocul Oncol Pathol. 4 (4), 203-212 (2018).
- Stockinger, P., et al. Vergleichende In-vivo-/Ex-vivo-Bildgebung des hinteren Augenabschnitts - Version. Der Ophthalmologe. 118 (Suppl 2), 153-159 (2021).
- Agarwal, M., et al. Sympathetic ophthalmia - An Overview. Ocul Immunol Inflamm. 31 (4), 793-809 (2023).
- Albert, D., Syed, N. Protocol for the examination of specimens from patients with uveal melanoma: a basis for checklists. Arch Pathol Lab Med. 125 (9), 1177-1182 (2001).
- Albert, D., Syed, N. Protocol for the examination of specimens from patients with retinoblastoma: a basis for checklists. Arch Pathol Lab Med. 125 (9), 1183-1188 (2001).
- American Academy of Ophthalmology (AAO). , https://www.aao.org/education/image/gross-dissection-of-globe (2025).
- Lu, W., et al. Corrigendum to 'Recent progress in optical clearing of eye tissues' Exp. Eye Res (Nov; 2021) 212 108796. Exp Eye Res. 214, 108896(2022).
- Lu, W., et al. Recent progress in optical clearing of eye tissues. Exp Eye Res. 212, 108796(2021).
- Darche, M., et al. Three-dimensional characterization of developing and adult ocular vasculature in mice using in toto clearing. Commun Biol. 5 (1), 1135(2022).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados