Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
El modelo de encefalopatía isquémica hipóxica de la isquemia perinatal
En este artículo
Resumen
El modelo de rata postnatal para la lesión cerebral hipóxico-isquémica es un modelo bien establecido de los derechos humanos neonatal encefalopatía hipóxica isquémica (EHI). En este artículo se describe el modelo de HIE en crías de ratas post-natal.
Resumen
Encefalopatía hipóxico-isquémica (EHI) es la consecuencia de asfixia sistémica que ocurre desde el nacimiento. Veinticinco por ciento de los recién nacidos con EHI desarrollan secuelas neuropsicológicas graves y permanentes, como retraso mental, parálisis cerebral y epilepsia. Los resultados de HIE son devastadores y permanentes, por lo que es fundamental para identificar y desarrollar estrategias terapéuticas para reducir el daño cerebral en los recién nacidos con EHI. A tal fin, el modelo de rata neonatal para la lesión cerebral hipóxico-isquémica se ha desarrollado el modelo de esta condición humana. El modelo de HIE fue validado por primera vez por Vannucci et al 1, y desde entonces ha sido ampliamente utilizada para identificar los mecanismos de lesión cerebral como consecuencia de la hipoxia-isquemia perinatal 2 y para probar posibles intervenciones terapéuticas 3,4. El modelo de HIE es un proceso de dos etapas y consiste en la ligadura de la arteria carótida común izquierda seguido por la exposición a un ambiente hipóxico. El flujo sanguíneo cerebral (FSC) en el hemisferio ipsilateral a la arteria carótida liga no disminuye por el flujo sanguíneo colateral a través del polígono de Willis, pero con la tensión de oxígeno baja, la CBF en el hemisferio ipsilateral y disminuye significativamente los resultados en la lesión isquémica unilateral . El uso de 2,3,5-trifenil tetrazolio cloruro (TTC) para teñir e identificar el tejido cerebral isquémico se desarrolló originalmente para los modelos adultos de la isquemia cerebral de roedores 5, y se utiliza para evaluar el grado de infarctin cerebral a los puntos de tiempo de hasta 72 horas después del evento isquémico 6. En este video, se demuestra el modelo de lesión hipóxico-isquémica en cerebro de rata postnatal y la evaluación del tamaño del infarto mediante la tinción de TTC.
Protocolo
Este protocolo fue aprobado por el Cuidado de Animales institucional y el empleo en la Universidad de Stanford y se rige por los Institutos Nacionales de Salud directrices para el uso de animales de experimentación.
Rata neonatal modelo HIE
- Días después del parto (PND) 7 Sprague-Dawley, crías de ratas (Charles River Laboratories, Inc., Wilmington, MA) son completamente anestesiados con isoflurano (Aerrane, Baxter, Deerfield, IL, un 3-4% para la inducción y 2.1% para de mantenimiento).
- Una pequeña incisión en el cuello (Extra Thin Tijeras Iris # 14088-10, Artes Ciencia Herramientas Inc, Foster City, CA) para exponer la arteria carótida común izquierda (CCA).
- La CCA se liga con una sutura de seda 5-0 (5-0 seda, Ethicon, Somer, NJ).
- La incisión se cierra con el pegamento de cianoacrilato (Elmers Products Inc, Columbus, OH). La incisión se cubre con cinta adhesiva y la anestesia se detiene. Los cachorros son devueltos a sus presas y les permite recuperar durante 1-2 horas.
- Los cachorros se colocan en una cámara hipóxica que contiene 8% de oxígeno equilibrada con un 92% de nitrógeno durante 100 minutos a 37 ° C. 8% de nitrógeno oxygen/92% de gas (Airgas, Sacramento, CA) el flujo a través de un tubo en la jaula del ratón equipado con una cubierta de plástico. La cubierta está hecha para adaptarse a la jaula y tiene dos agujeros de 2 cm de diámetro, una de ellas para recibir el tubo conectado al tanque de oxígeno del gas de 8% y el otro permite que el gas flowout. La cámara se coloca en un baño de agua y se calienta antes de su uso y un termómetro en el interior de la misma debe registrar 37 ° C antes del comienzo de la hipoxia.
- Al final de 100 minutos de hipoxia, los cachorros son devueltos de nuevo a su presa para la recuperación.
- 24 horas después del final de la hipoxia, las crías son sacrificados por la anestesia profunda con isoflurano. El tejido cerebral es perfundido con solución salina normal en frío, seguido por una solución de 1% de TTC frío en tampón fosfato salino pH 7,4 (Sigma Chemical Co, St Louis, MO). TTC debe mantenerse protegido de la luz.
- Los cerebros se retiran y se enfrían durante 1-2 minutos en hielo, y cuatro secciones coronales de 3 mm de distancia (niveles 1-4) se cortan, a partir de rostral a nivel de la opticchiasm e infundíbulo, que corresponde a la bregma 1,8 ~ 2,0 mm a nivel de el cerebro del ratón adulto.
- Cortes de cerebro se encuentran inmersos en una solución de TTC y se incuba a 37 ° C durante 8 minutos, seguido de la fijación en paraformaldehído al 4% / PBS durante la noche. Debido a TTC es sensible a la luz, mantener las rebanadas de la luz durante este tiempo.
- Las secciones teñidas TTC son escaneados y digitalizados. Con Image J (NIH, Bethesda, MD), los siguientes son medidos para cada nivel: área de infarto (área sin manchas), la zona del hemisferio ipsilateral, y la zona del hemisferio contralateral. El porcentaje de área infartada por rebanada se calcula como: (área de infarto / área del hemisferio ipsilateral) o A 1, A 2, A 3 y A 4. El porcentaje de volumen de infarto se calcula como la suma de (A 1 + A 2 + A 3 + A 4) * 3 mm. Las zonas de lesión cortical o estriado también puede ser cuantificado por separado de una manera similar.
Resultados representante
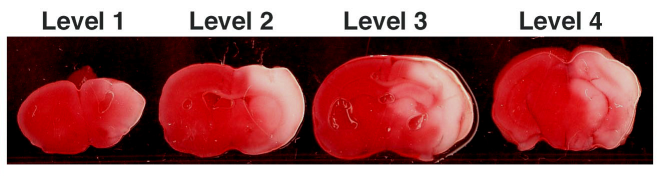
Figura 1. Representante HIE coronal niveles 1-4 teñidas con TTC.
TTC coronal secciones teñidas demostrar área de infarto (en blanco).
Discusión
El modelo de roedores postnatal HIE es un modelo establecido que la hipoxia cerebral recapitula que ocurren en el periodo perinatal en los recién nacidos. Amplia estudios de caracterización histológica y inmunocitoquímicos han demostrado que los roedores 7 días de edad tiene la madurez cerebral similar a un modelo de siete en el tercer trimestre el feto humano. El modelo de HIE roedores ha sido muy informativo para entender los mecanismos de la lesión cerebral de la hipoxia perinatal 2, donde las intervenciones, ...
Agradecimientos
Financiado por la American Heart Association y March of Dimes.
Materiales
| Name | Company | Catalog Number | Comments | |
| Sprague-Dawley Rat Pups | Animal | Charles River Laboratories | ||
| Isoflurane | Surgery | Baxter Internationl Inc. | ||
| 8% Oxygen/ 92% Nitrogen Gas | Surgery | Airgas | ||
| 2,3,5-triphenyl tetrazolium chloride | Reagent | Sigma-Aldrich | T8877 | |
| Phosphate buffered saline (PBS) pH 7.4 | Reagent | GIBCO, by Life Technologies | ||
| Paraformaldehyde | Reagent | Sigma-Aldrich | P6148 |
Referencias
- Rice, J. E., Vannucci, R. C., Brierley, J. B. The influence of immaturity on hypoxic-ischemic brain damage in the rat. Annals of neurology. 9 (2), 131-141 (1981).
- Vannucci, R. C., Vannucci, S. J. Perinatal Hypoxic-Ischemic Brain Damage: Evolution of an Animal Model. Dev Neurosci. 27 (2-4), 81-86 (2005).
- Bona, E., Hagberg, H., Loberg, E. M. Protective effects of moderate hypothermia after neonatal hypoxia-ischemia: short- and long-term outcome. Pediatric research. 43 (6), 738-738 (1998).
- Trescher, W. H., Ishiwa, S., Johnston, M. V. Effects of hypothermia and hyperthermia on attentional and spatial learning deficits following neonatal hypoxia-ischemic insult in rats. Behavioural brain research. 151 (1-2), 209-209 (2004).
- Mishima, K., Ikeda, T., Yoshikawa, T. Brief post-hypoxic-ischemic hypothermia markedly delays neonatal brain injury. Brain development. 19 (5), 326-326 (1997).
- Young, R. S., Olenginski, T. P., Yagel, S. K. The effect of graded hypothermia on hypoxic-ischemic brain damage: a neuropathologic study in the neonatal rat. Stroke; a journal of cerebral circulation. 14 (6), 929-929 (1983).
- Bederson, J. B., Pitts, L. H., Germano, S. M., et al. Evaluation of 2,3,5-triphenyltetrazolium chloride as a stain for detection and quantification of experimental cerebral infarction in rats. Stroke; a journal of cerebral circulation. 17 (6), 1304-1304 (1986).
- Cai, J., Kang, Z., Liu, W. W. Hydrogen therapy reduces apoptosis in neonatal hypoxia-ischemia rat model. Neuroscience letters. 441 (2), 167-167 (2008).
- Grow, J., Barks, J. D. Pathogenesis of hypoxic-ischemic cerebral injury in the term infant: current concepts. Clinics in perinatology. 29 (4), 585-585 (2002).
- Aden, U., Halldner, L., Lagercrantz , H., et al. Aggravated brain damage after hypoxic ischemia in immature adenosine A2A knockout mice. Stroke; a journal of cerebral circulation. 34 (3), 739-739 (2003).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados