Ley del Gas ideal
Visión general
Fuente: Laboratorio del Dr. Andreas Züttel - laboratorios federales suizos para la ciencia de los materiales y la tecnología
La ley de gas ideal describe el comportamiento de los gases más comunes en condiciones ambientales cerca y la tendencia de toda la materia de química en el límite diluído. Es una relación fundamental entre tres variables del sistema macroscópico mensurable (presión, temperatura y volumen) y el número de moléculas de gas en el sistema y es por tanto un eslabón esencial entre el microscopio y los universos macroscópicos.
La historia de la ley de gas ideal se remonta a mediados delsiglo 17 cuando la relación entre la presión y el volumen de aire resultó para ser inversamente proporcional, una expresión confirmada por Robert Boyle y que ahora llamamos como ley de Boyle (ecuación 1) .
P  V-1 (ecuación 1)
V-1 (ecuación 1)
Obra inédita por Jacques Charles en el 1780s, que fue ampliado a numerosos gases y vapores por Joseph Louis Gay-Lussac y registrados en el año 1802, estableció la relación directamente proporcional entre la temperatura absoluta y el volumen de un gas. Esta relación se denomina ley de Charles (ecuación 2).
V  T (ecuación 2)
T (ecuación 2)
Guillaume Amontons típicamente se acredita con primero descubrir la relación entre la temperatura y la presión del aire dentro de un volumen fijo a la vuelta delsiglo 18 . Esta ley también se extendió a numerosos otros gases por Joseph Louis Gay-Lussac a principios delsiglo 19 y es que bien conocido como ley de Amontons o ley de Gay-Lussac, como se muestra en la ecuación 3.
P  T (ecuación 3)
T (ecuación 3)
Juntos, estas tres relaciones se pueden combinar para dar la relación en la ecuación 4.
V  T (ecuación 4)
T (ecuación 4)
Finalmente, en 1811, se propuso por Amedeo Avogadro que cualquier dos gases, en el mismo volumen y a la misma temperatura y presión, contienen el mismo número de moléculas. Esto condujo a la conclusión de que todos los gases se pueden describir por una constante común, la constante de gas ideal R, que es independiente de la naturaleza del gas. Esto se conoce como la ley del gas ideal (ecuación 5). 1, 2
PV  T (ecuación 5)
T (ecuación 5)
Procedimiento
1. medición del volumen de la muestra
- Limpiar cuidadosamente la muestra y secar.
- Llenar una probeta graduada de alta resolución con suficiente agua para cubrir la muestra destilada. Nota el volumen inicial
- Colocar la muestra en el agua y observe el cambio de volumen. Este es el volumen de la muestra, V.
- Retire la muestra y secar. Nota: alternativamente, midió el lado dónde de la muestra y calcular su volumen utilizando la geometría.
2. cargar la m
Resultados
La ley del gas ideal es una descripción válida de las propiedades de gases reales de varios gases comunes en condiciones cerca de ambiente (recuadro de lafigura 1 ) y por lo tanto es útil en el contexto de muchas aplicaciones. Las limitaciones de la ley de gas ideal en la descripción de los sistemas bajo condiciones de altas presiones o bajas temperaturas pueden explicarse por la creciente importancia de las interacciones moleculares o el tamaño finito de las moléculas de gas que contribuyen a las ...
Aplicación y resumen
La ley de gas ideal es una ecuación de fundamental de las ciencias químicas que tiene una gran cantidad de usos en actividades del día a día del laboratorio, así como en los cálculos y modelación de sistemas incluso altamente complejos, por lo menos en primera aproximación. Su aplicabilidad está limitada sólo por las aproximaciones inherentes a la ley en el ambiente cerca de presiones y temperaturas, donde la ley del gas ideal es bien válida para muchos gases comunes, se emplea extensamente en la interpretaci?...
Referencias
- Zumdahl, S.S., Chemical Principles. Houghton Mifflin, New York, NY. (2002).
- Kotz, J., Treichel, P., Townsend, J. Chemistry and Chemical Reactivity. 8th ed. Brooks/Cole, Belmont, CA (2012).
- Rouquerol, F., Rouquerol, J., Sing, K.S.W., Llewellyn, P., Maurin, G. Adsorption by Powders and Porous Solids: Principles, Methodology and Applications.Academic Press, San Diego, CA. (2014).
Tags
Saltar a...
Vídeos de esta colección:

Now Playing
Ley del Gas ideal
General Chemistry
79.2K Vistas

Cristalería de laboratorio y usos comunes
General Chemistry
658.8K Vistas

Soluciones y concentraciones
General Chemistry
275.3K Vistas

Determinación de la densidad de un sólido y líquido
General Chemistry
556.8K Vistas

Determinación de la composición porcentual en masa de una solución acuosa
General Chemistry
383.8K Vistas

Determinación de la fórmula empírica
General Chemistry
183.7K Vistas

Determinación de las reglas de solubilidad de compuestos iónicos
General Chemistry
141.6K Vistas

Uso del medidor de pH
General Chemistry
346.9K Vistas

Introducción a la titulación
General Chemistry
425.6K Vistas

Determinación espectrofotométrica de la constante de un equilibrio
General Chemistry
158.8K Vistas

Principio de le Châtelier
General Chemistry
265.8K Vistas

Depresión del punto de congelación para determinar un compuesto desconocido
General Chemistry
160.8K Vistas

Determinación de las leyes de la velocidad y el orden de la reacción
General Chemistry
196.3K Vistas

Uso de la calorimetría diferencial para medir los cambios en la entalpía
General Chemistry
44.8K Vistas

Complejos de coordinación
General Chemistry
91.7K Vistas
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados
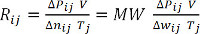 (Ecuación 9)
(Ecuación 9)