Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Mésoscopique fluorescence tomographie pour In vivo L'imagerie du développement Drosophile
Dans cet article
Résumé
Mésoscopique de fluorescence de tomographie opère au-delà des limites de la pénétration des tissus sectionnement microscopie à fluorescence. La technique est basée sur la multi-projection de l'illumination et une description de transport des photons. Nous démontrons in vivo du corps entier de visualisation 3D de la morphogenèse des ailes exprimant la GFP dans les disques imaginaux Drosophila melanogaster.
Résumé
Visualiser la formation des organes en développement ainsi que progession et le traitement de la maladie repose souvent lourdement sur la capacité à interroger optiquement les changements moléculaires et fonctionnelles dans les organismes vivants intacts. La plupart des méthodes existantes d'imagerie optique sont insuffisants pour l'imagerie à des dimensions qui se trouvent entre les limites de pénétration de la microscopie optique moderne (0,5-1mm) et les limites imposées par diffusion de la macroscopie optique (> 1 cm) [1]. Ainsi, de nombreux organismes modèles importants, par exemple insectes, des embryons animaux ou des extrémités du petit animal, restent inaccessibles pour l'imagerie in vivo optique.
Bien qu'il y ait un intérêt croissant envers le développement de nanomètre résolution méthodes d'imagerie optique, il n'ya pas eu beaucoup d'efforts réussi à améliorer la profondeur de pénétration d'imagerie. La capacité d'effectuer l'imagerie in vivo au delà des limites de microscopie est en fait rencontré des difficultés liées à la diffusion de photons présents dans les tissus. Les efforts récents pour embryons image entière par exemple [2,3] nécessitent un traitement chimique spécial de l'échantillon, pour les faire disparaître de la diffusion, une procédure qui permet de les utiliser uniquement pour l'imagerie post-mortem. Ces méthodes cependant des preuves de la nécessité pour les spécimens d'imagerie plus grandes que celles habituellement autorisés par microscopie à deux photons ou confocale, en particulier dans la biologie du développement et de découverte de médicaments.
Nous avons développé une nouvelle technique d'imagerie optique de fluorescence nommée mésoscopique tomographie [4], qui convient pour les non-invasives d'imagerie in vivo à des dimensions de 1mm à 5mm. La méthode de résolution des échanges pour la profondeur de pénétration, mais offre sans précédent de l'imagerie tomographique performance et il a été développé pour ajouter du temps comme une dimension nouvelle dans les observations de biologie du développement (et éventuellement d'autres domaines de la recherche biologique) en donnant la possibilité à l'image de l'évolution de la fluorescence taggés réponses au fil du temps. Comme telle, elle peut accélérer les études des dépendances morphologiques ou fonctionnelles sur les mutations des gènes ou des stimuli extérieurs, et peut surtout, capter l'image complète du développement ou de la fonction des tissus en permettant longitudinale time-lapse de visualisation de la même, l'organisme en développement.
La technique utilise un microscope de laboratoire modifié et multi-projection d'illumination pour recueillir des données à 360 degrés des projections. Elle s'applique à la simplification de Fermi à la solution de Fokker-Plank de l'équation de transport des photons, combinée avec les principes de l'optique géométrique afin de construire un système d'inversion réalistes adapté à une large échelle mésoscopique. Cela permet in vivo du corps entier de visualisation de la non-transparence des structures tridimensionnelles dans des échantillons de plusieurs millimètres dans la taille.
Nous avons démontré la performance in vivo de la technique par imagerie en trois dimensions des structures de développement de tissus in vivo chez la drosophile et en suivant la morphogenèse des ailes dans l'opaque pupes de drosophile en temps réel de plus de six heures consécutives.
Protocole
Les stocks de Drosophila melanogaster utilisés dans cette expérience sont les suivantes:
- elav-Gal4 (FBti0002575)
- AP-Gal4md544 (FBal0051787)
- SAMU-srcEGFP (FBti0013990)
- w1118 (FBal0018186)
Pour toutes les expériences, le système UAS-Gal4 a été utilisé pour surexprimer la GFP dans les tissus d'intérêt (c'est à dire des glandes salivaires ou les disques d'aile). Plus précisément, les mouches femelles transgéniques avec les Gal4 appropriés ont été croisés pour SAMU-EGFP compagnons transgéniques. Les croisements ont été élevés à 25 ° C dans un incubateur humidifié. Lorsque les nymphes commencent peupler les flacons (environ 5-6 jours après le début de la croix), ils ont été sélectionnés pour fluorescence de la GFP au stade blanche prépupal (0-1 h après la formation puparium) et collectées pour la tomographie par imagerie.
- Mettre en place des croisements appropriés et à l'arrière à 25 ° C
- 5-6 jours après l'initiation de la croix, sélectionnez la descendance fluorescentes pour l'imagerie. Utilisez un pinceau humide pour enlever en douceur de l'prénymphes blanches sur les côtés de la fiole.
- Mettez prénymphes dans une goutte d'eau ou du PBS placé dans une boîte de Pétri pour enlever les particules de nourriture et de la colle qui couvre le cas de nymphe et rend le spécimen autofluorescente. Nettoyez délicatement avec un pinceau. Si le vieillissement de la pupe est nécessaire, endroit choisi prénymphes blanc dans une boîte de Pétri avec une serviette en papier humide (une chambre humide) ou sur les côtés d'une cuvette propre avec de la nourriture volée. Cela permettra d'assurer qu'il ya suffisamment d'humidité, afin de permettre le bon développement de l'animal.
Drosophile montage
- Collez la partie inférieure de la coque de nymphose dans un tube capillaire en verre (800 microns de diamètre) de telle sorte que antérieure / postérieure de la mouche axe est orienté parallèlement au tube.
- Fixer le tube capillaire à la verticale sur une étape de rotation.
- Ajuster l'axe de basculement de la phase de rotation pour que l'axe de rotation parallèle à des colonnes de pixels de l'imagerie CCD.
Détermination Forward modèle
- Fixer une chrysalide dans un capillaire en verre et montez comme décrit précédemment
- Remplir un tube capillaire de silice (100 microns, DO) avec un colorant fluorescent (Cy5.5)
- Insérez le tube capillaire à l'intérieur de la pupe à 45 degrés par rapport à l'axe antérieur / postérieur
- Illuminer la nymphe avec un faisceau laser d'excitation avec un objectif d'ouverture numérique faible. Collecter des images de fluorescence transillumination plus de 360 degrés de rotation de la pupe long de son axe vertical.
- Ajuster les données expérimentales avec un modèle approprié avant
Glandes salivaires Imaging
- Monter une nymphe exprimer la GFP dans les glandes salivaires, comme décrit précédemment
- Éclairer avec un faisceau d'excitation et de recueillir en transillumination du signal de fluorescence GFP plus de 360 degrés de rotation de la pupe long de son axe vertical.
- Reconstruire les données acquises en utilisant le modèle de l'avant
Imagerie time-lapse
- Monter une GFP blanche prénymphe exprimer dans les disques imaginaux de l'aile
- Gardez à l'environnement d'imagerie et humide à température ambiante pour éviter la déshydratation de la nymphe.
- Placer un obturateur pour éviter un éclairage continu
- Éclairer avec un faisceau d'excitation et de recueillir en transillumination du signal de fluorescence GFP plus de 360 degrés de rotation de la pupe long de son axe vertical.
- Reconstruire les données acquises en utilisant le modèle de l'avant.
Histologie
- Disséquer les glandes salivaires du SNC / disques oeil dans du PBS 1X.
- Fixer les tissus dans le formol à 4%, 1x PEM (Pipes 100 mM, 1 mM EGTA, 1 mM MgCl 2) pendant 20min à température ambiante.
- Retirer de fixation et de montage dans Vectashield au DAPI (Vector)
- Image avec un microscope à fluorescence.
Time-Lapse Histologie
- Recueillir prénymphes blancs et les mettre en scène dans une chambre humide.
- Recueillir les pupes à différents stades de développement
- Piquer la coque de nymphose deux fois (0 h après la formation puparium) avec une aiguille fine (insecte broches 000, FST) avant la fixation.
- Fix pupes dans formaldéhyde à 8%, 1x PEM pour 6-8 heures à température ambiante avec agitation douce.
- Après le retrait de fixation et de rinçage avec du PBS 1x, couper la nymphe fixes avec une lame tranchante en deux morceaux perpendiculairement à l'axe A / P;
- Immerger les deux pièces en Vectashield au DAPI (Vector) et monter sur des lames couvre-objet (Lab-Tek) pour l'imagerie.
- Acquérir les images avec un microscope à fluorescence confocale.
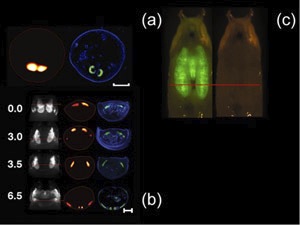
Figure 1. S'il vous plaît cliquez ici pour voir alVersion Arger de la figure 1.
Discussion
In vivo reconstructions de l'affaire de nymphe et les glandes salivaires exprimant la GFP d'un D. melanogaster prénymphe (barre d'échelle, 500 microns) avec l'histologie correspondante (en bleu, la coloration DAPI; vert, fluorescence de la GFP) est montré dans la figure 1 (a). Time-lapse série d'imagerie de D. melanogaster aile disques imaginaux est indiqué dans la Fig.1 (b). Les images sont acquises à partir d'un seul spécimen vivant, à quatre points de temps différent...
Déclarations de divulgation
The authors have nothing to disclose.
Remerciements
C. Vinegoni reconnaît le soutien de National Institutes of Health (NIH) accorder une-SR1-EB006432.
Références
- Ntziachristos, V. Looking and listening to light: the evolution of whole-body photonic imaging. Nat. Biotechnol. 23, 313-320 (2005).
- J, . Optical projection tomography as a tool for 3D microscopy and gene expression studies. Science. 296, 541-545 (2002).
- Dodt, H. U. Ultramicroscopy: three-dimensional visualization of neuronal networks in the whole mouse brain. Nat. Methods. 4, 331-336 (2007).
- Vinegoni, C. In vivo imaging of Drosophila melanogaster pupae with mesoscopic fluorescence tomography. Nat. Methods. 5, 45-47 (2008).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon