É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Mesoscópica de fluorescência para Tomografia In-vivo Imaging de desenvolvimento Drosophila
Neste Artigo
Resumo
Mesoscópica fluorescência tomografia opera além dos limites de penetração de tecido de corte de microscopia de fluorescência. A técnica é baseada na projeção multi-iluminação e uma descrição do transporte de fótons. Demonstramos in-vivo visualização de corpo inteiro em 3D da morfogênese da GFP-expressando asa em discos imaginais Drosophila melanogaster.
Resumo
Visualizando a formação de órgãos de desenvolvimento, bem como progession e tratamento da doença, muitas vezes depende fortemente da capacidade de interrogar opticamente alterações moleculares e funcionais em organismos vivos intactos. A maioria dos métodos existentes de imagens ópticas são inadequados para imagens em dimensões que se situam entre os limites de penetração de microscopia óptica moderna (0,5-1mm) e os limites de difusão-imposta de macroscopia óptica (> 1cm) [1]. Assim, muitos organismos modelo importante, insetos por exemplo, embriões de animais ou nas extremidades de pequenos animais, permanecem inacessíveis para a in-vivo de imagens ópticas.
Embora haja um interesse crescente para o desenvolvimento de métodos de resolução de nanômetros de imagem óptica, não tem havido muitos esforços bem sucedidos na melhoria da profundidade de penetração de imagem. A capacidade de executar in-vivo de imagens de microscopia para além dos limites é, de fato encontrou-se com as dificuldades associadas com o espalhamento de fótons presente nos tecidos. Esforços recentes para embriões imagem inteira, por exemplo, [2,3] necessitam de tratamento químico especial da amostra, para limpá-las de dispersão, um procedimento que os torna adequados apenas para pós-mortem de imagem. Estes métodos entanto evidência a necessidade de amostras maiores do que as imagens normalmente permitido por microscopia de dois fótons ou confocal, especialmente em biologia do desenvolvimento e na descoberta de medicamentos.
Nós desenvolvemos uma nova técnica de imageamento óptico chamado Mesoscópica Fluorescência Tomografia [4], que apropriado para não-invasivos de imagem in-vivo em dimensões de 1mm-5mm. O método de resolução de trocas de profundidade de penetração, mas oferece desempenho sem precedentes tomográfica de imagem e que foi desenvolvido para aumentar o tempo como uma nova dimensão em observações biologia do desenvolvimento (e possivelmente outras áreas da pesquisa biológica) por transmitir a capacidade de imagem da evolução da fluorescência tagged respostas ao longo do tempo. Como tal, pode acelerar os estudos de dependências morfológicas ou funcionais em mutações genéticas ou estímulos externos, e podem importante, capturar a imagem completa do desenvolvimento ou a função do tecido, permitindo a visualização de lapso de tempo longitudinal do organismo, mesmo em desenvolvimento.
A técnica utiliza um microscópio de laboratório modificados e multi-projecção de iluminação para coletar dados em 360 graus de projeções. Aplica-se a simplificação de Fermi Fokker-Plank solução da equação de transporte de fótons, combinados com princípios geométricos óptica, a fim de construir um esquema de inversão realista adequados para a faixa de mesoscópica. Isso permite que os in-vivo visualização de todo o corpo de não-transparente estruturas tridimensionais em amostras de até vários milímetros de tamanho.
Nós demonstramos o desempenho in vivo da técnica de imagem por estruturas tridimensionais de desenvolver tecidos Drosophila in-vivo e seguindo a morfogênese das asas na opaco Drosophila pupas em tempo real ao longo de seis horas consecutivas.
Protocolo
Os estoques de Drosophila melanogaster utilizadas neste experimento são as seguintes:
- elav-Gal4 (FBti0002575)
- ap-Gal4md544 (FBal0051787)
- UAS-srcEGFP (FBti0013990)
- w1118 (FBal0018186)
Para todos os experimentos, o sistema UAS-Gal4 foi usada para superexpressão GFP no tecido de interesse (ou seja, as glândulas salivares ou os discos de asa). Mais especificamente, as moscas fêmeas transgênicas com o Gal4 apropriadas foram cruzados com companheiros de UAS-EGFP transgênicos. As cruzes foram criados a 25 ° C em uma incubadora umidificada. Quando as pupas começar a preencher os frascos (cerca de 5-6 dias após o início da cruz), eles foram selecionados para GFP fluorescência em fase de pré-pupa branco (0-1 hr após a formação pupário) e cobradas por tomografia.
- Configurar cruza apropriado e traseiro a 25 ° C
- 5-6 dias após o início da cruz, selecione progênie fluorescentes para imagens. Use um pincel molhado para remoção suave das prepupas em branco dos lados do frasco.
- Coloque prepupas em uma gota de água ou PBS colocado numa placa de Petri para remover partículas de alimentos e a cola que cobre o caso pupal e faz o espécime autofluorescent. Limpe suavemente com um pincel. Se envelhecimento da pupa é necessário, local escolhido prepupas branco numa placa de Petri com papel toalha úmido (câmara úmida) ou para os lados de uma célula limpa com comida voar. Isso irá garantir que não há umidade suficiente, para permitir o desenvolvimento adequado do animal.
Drosophila Montagem
- Cole a parte inferior do caso pupal em um tubo capilar de vidro (800 mícrons de diâmetro), tais que o eixo da mosca anterior / posterior está orientado paralelo ao tubo.
- Fixar o tubo capilar verticalmente em um estágio de rotação.
- Ajustar a inclinação do eixo de rotação do palco para que o eixo de rotação a ser paralela às colunas de pixel da imagem CCD.
Modelo de determinação Encaminhar
- Corrigir uma pupa em um capilar de vidro e montar como descrito anteriormente
- Encha um tubo capilar de sílica (100 microns, OD) com um corante fluorescente (Cy5.5)
- Insira o tubo capilar no interior da pupa em 45 graus com relação ao eixo anterior / posterior
- Iluminar o pupa com um feixe de laser de excitação com uma lente de abertura numérica baixo. Coletar imagens de fluorescência transiluminação mais de 360 graus de rotação da pupa ao longo de seu eixo vertical.
- Ajustar os dados experimentais com um modelo apropriado para a frente
Glândulas Salivares imagem
- Montar uma pupa expressando GFP nas glândulas salivares como descrito anteriormente
- Iluminar com um feixe de excitação e recolher em transiluminação do sinal de fluorescência da GFP mais de 360 graus de rotação da pupa ao longo de seu eixo vertical.
- Reconstruir os dados adquiridos utilizando o modelo para a frente
Time Lapse-Imaging
- Montar uma GFP prepupa branco expressando nos discos asa imaginal
- Manter o ambiente úmido e de imagem em temperatura ambiente para evitar a desidratação da pupa.
- Coloque um obturador para evitar a iluminação contínua
- Iluminar com um feixe de excitação e recolher em transiluminação do sinal de fluorescência da GFP mais de 360 graus de rotação da pupa ao longo de seu eixo vertical.
- Reconstruir os dados adquiridos utilizando o modelo para a frente.
Histologia
- Dissecar CNS glândulas salivares / discos de olho em 1x PBS.
- Fix tecidos em formol 4%, 1x PEM (Pipes 100mM, EGTA 1 mM, 1mM MgCl 2) por 20min em temperatura ambiente.
- Remover fixação e montagem em Vectashield com DAPI (Vector)
- Imagem com um microscópio fluorescente.
Time-Lapse Histologia
- Coletar prepupas branco e estágio-los em uma câmara úmida.
- Coletar pupas em diferentes estágios de desenvolvimento
- Prick caso pupal duas vezes (0 hrs após a formação pupário) com uma agulha fina (pino inseto 000, FST) antes da fixação.
- Fix pupas em formol 8%, 1x PEM por 6-8 horas em temperatura ambiente com agitação suave.
- Após a remoção de fixação e lavagem com PBS 1x, corte a pupa fixa com uma lâmina afiada em duas partes perpendicular ao eixo A / P;
- Submergir as duas peças em Vectashield com DAPI (Vector) e montagem em lâminas de lamela (Lab-Tek) para geração de imagens.
- Aquisição de imagens com um microscópio de fluorescência confocal.
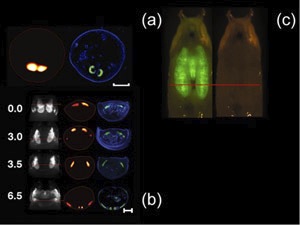
Figura 1. Por favor, clique aqui para ver alÄrger versão da figura 1.
Discussão
In vivo reconstruções do caso pupal e as glândulas salivares expressando GFP-de um D. melanogaster prepupa (Escala de bar, a 500 microns) com a histologia correspondente (azul, coloração DAPI; verde, GFP fluorescência) é mostrado na Figura 1 (a). Time-lapse série de imagem de D. discos melanogaster asa imaginal é mostrado na Fig.1 (b). As imagens são adquiridas a partir de um único espécime vivo, em quatro momentos diferentes (0,3.0, 3.5 e 6,5 horas). Na primeira projeção uma col...
Divulgações
The authors have nothing to disclose.
Agradecimentos
C. Vinegoni reconhece o apoio do National Institutes of Health (NIH) conceder 1-RO1-EB006432.
Referências
- Ntziachristos, V. Looking and listening to light: the evolution of whole-body photonic imaging. Nat. Biotechnol. 23, 313-320 (2005).
- J, . Optical projection tomography as a tool for 3D microscopy and gene expression studies. Science. 296, 541-545 (2002).
- Dodt, H. U. Ultramicroscopy: three-dimensional visualization of neuronal networks in the whole mouse brain. Nat. Methods. 4, 331-336 (2007).
- Vinegoni, C. In vivo imaging of Drosophila melanogaster pupae with mesoscopic fluorescence tomography. Nat. Methods. 5, 45-47 (2008).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados